Introducción
Los estudios de caracterización de proteasas en organismos acuáticos se han enfocado en identificar el tipo de enzimas digestivas presentes en el tracto digestivo de especies de interés acuícola aprovechando su naturaleza bioquímica y su función dentro de la digestión de los alimentos y asimilación de nutrientes. Por lo tanto, estudiar la caracte rización de las diversas enzimas digestivas es esencial si se pretende entender los tipos y modos de acción, así como el nivel de actividad que presentan (Alarcón et al., 1998). Para este fin se pueden evaluar factores como el efecto del pH y la temperatura sobre la actividad de las enzimas digestivas, la afinidad por sustratos específicos, los inhi bidores específicos y la caracterización por técnicas electroforéticas (Cohen et al., 1981). Es así como varias investigaciones han abordado aspectos que van desde la descripción de los parámetros funcionales de las principales enzimas digestivas o los tipos de enzimas presentes en el estómago (pepsina) e intestino (tripsina, quimotripsina, carboxi peptidasas, aminopeptidasas, entre otras), hasta la forma en que éstas pueden ser utilizadas para modelar la digestión de una especie, así como su función de indicadores de la condición nutricional durante sus diferentes etapas de desarrollo (Moyano, 2006). Bajo este precepto, aunque la mayoría de los peces sintetizan enzimas digestivas similares, la actividad proteolítica varía en cada uno, ya que presentan actividades óptimas a diferentes condiciones de pH y temperatura; por lo tanto, se necesita conocer cuáles grupos de enzimas participan en la degrada ción proteínica, lo cual se logra con el uso de inhibidores específicos para cada grupo o enzima en particular. Existen múltiples estudios que han caracterizado las proteasas ácidas y alcalinas en distintas especies como el pez disco (Symphysodon aequifasciata, Pellegrin 1904; Chong et al., 2002), lenguado (Solea senegalensis Kaup 1858; Sáenz et al., 2005), hurta (Pagrus auriga Valenciennes, 1843; Moyano et al., 2005), atún aleta azul del Atlántico (Thunnus thynnus Linnaeus, 1758; Essed et al., 2002), atún aleta azul del Pacífico (Thunnus thynnus orientalis Emminck & Schlegel, 1844; Matus de la Parra et al., 2007), así como la sardina (Sardinella aurita Valenciennes, 1847; Ben et al., 2011) y, re cientemente, el robalo blanco (Centropomus undecimalis Bloch, 1792; Concha-Frías et al., 2016); en ellos se observan valores entre 2 y 3 para la pepsina, y de 7 a 10 para las proteasas digestivas intestina les. En cuanto a la caracterización de las proteasas en relación con la temperatura, se ha detectado que son altamente termoresistentes, pues soportan temperaturas desde 45 ºC hasta 65 ºC para proteasas digestivas estomacales e intestinales (Essed et al., 2002; Moyano et al., 2005; Sáenz et al., 2005; Matus de la Parra et al., 2007; Ben et al., 2011; Concha-Frías et al., 2016). Debido a lo anterior, el objetivo en nuestro trabajo fue caracterizar las proteasas digestivas de C. paralle lus (Poey, 1860), con la intención de sentar las bases para los estudios de requerimientos nutricionales de la especie en estudio.
Materiales y métodos
Material biológico. Los juveniles de C. parallelus fueron capturados en la laguna Mecoacán, ubicada en el poblado El Bellote, Paraíso, Tabasco. Los ejemplares fueron clasificados e identificados taxonómicamente al momento de su captura, de acuerdo con lo que mencionan Miller et al. (2009), y transportados vivos al Laboratorio de Acuicultura Tropical de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco en un contenedor con capacidad de 1000 l de agua y oxigenación continua. Los organismos fueron depositados en estanques circulares con capacidad de 1000 l para su adaptación en cautiverio; ello con la finalidad de dejarlos sin aporte de alimento por un periodo de 48 horas, antes de ser sacrificados para su disección.
Caracterización de proteasas digestivas. Para los ensayos de caracterización enzimática se utilizaron 35 robalos juveniles (40 a 65 g), los cuales fueron sacrificados por inmersión en agua hielo (1-4 ºC). Los organismos fueron pesados en una balanza (OHAUS, CS2000, 2000 g x 1g), se disectaron a temperatura controlada (4 °C) y se extrajeron estómago e intestino por separado. Los tejidos fueron homogeneizados con un dispersor Ultra Turrax (modelo IKA T18 Basic) en búfer de glicina-HCl 0.1 M a pH 2 para estómagos, y búfer Tris-HCl 30 mM+CaCl2 12.5 mM pH 7.5 para intestinos, ambos homogenizados en relación 5:1 (peso/volumen). Las mezclas obtenidas se colocaron en tubos Eppendorf y centrifugaron a 16 000 g (Centrifuge 5810 R Eppendorf), a 4 ºC durante 15 minutos. El sobrenadante se separó y el pH se ajustó a pH 2 para estómago con ácido clorhídrico (0.1 M) y a pH de 7.5 para intestino con hidróxido de sodio (0.1 M). Las alícuotas se almacenaron en tubos Eppendorf a -20 ºC hasta su posterior análisis.
Cuantificación de proteína. La concentración de proteína soluble de los extractos crudos estomacales e intestinales se determinó mediante la técnica de Bradford (1976), usando albúmina bovina sérica como proteína estándar para la curva de calibración y la utilización microtécnica de acuerdo con lo descrito por el proveedor. Todos los ensayos se hicieron por triplicado.
Actividad proteolítica. La actividad de proteasa ácida de los extractos crudos (EC) estomacales se midió usando hemoglobina 1% como sus trato en búfer de glicina-HCl 100 mM a pH 2 por el método de Anson (1938), mientras que la actividad de proteasas alcalinas de los EC intestinales se evaluó usando caseína al 1% como sustrato en bufer Tris-HCl 100 mM + CaCl2 10 mM a pH 9 por el método de Kunitz (1947) modificado por Walter (1984). Se definió una unidad de actividad proteolítica como la cantidad de enzima necesaria para liberar un 1 µg de tirosina por minuto con un coeficiente de extinción molar (MEC) de 5000 cm-1M-1. Todos los ensayos se hicieron por triplicado.
La actividad de quimotripsina se determinó usando BTEE 5 mM (N-Benzoilo-L-Tirosina Etilo Ester) como sustrato de acuerdo con el método reportado por Ásgeirsson & Bjarnason (1991), donde una unidad de actividad enzimática se definió como la cantidad de enzima necesaria para hidrolizar 1 µmol de BTEE por minuto usando un MEC de 964 cm-1 M-1. Todos los ensayos se hicieron por triplicado.
La actividad de tripsina se analizó por el método propuesto por Erlanger et al. (1961), usando BAPNA 3.5 mM (N-a-Benzoilo-DL-argi nina-4-nitroanilida) como sustrato, donde una unidad de actividad en zimática se definió como la cantidad de enzima necesaria para liberar 1 µmol de p-nitroanilida liberada por minuto usando un MEC de 8800 cm-1 M-1. La actividad de las enzimas digestivas se ajustó con los mi ligramos de proteína soluble determinados son reportados como U mg de proteína-1. Todos los ensayos se hicieron por triplicado.
Efecto del pH y la temperatura de proteasas digestivas. El pH óp timo de las proteasas ácidas y alcalinas se evaluó usando un búfer universal (Stauffer, 1989) con un rango de 2 a 12, siguiendo el proce dimiento para determinación de actividad de proteasas descrito antes. Todos los ensayos se hicieron por triplicado.
La temperatura óptima de las proteasas ácidas y alcalinas se es tableció usando diferentes temperaturas (25, 35, 45, 55 y 65 ºC). El efecto del pH y la temperatura en la estabilidad de las proteasas ácidas y alcalinas se determinó preincubando los extractos crudos por 0, 30, 60 y 90 min con el búfer Stauffer (1989) y la temperatura y pH a probar. Todos los ensayos se hicieron por triplicado.
Efecto de inhibidores sobre las proteasas digestivas. La identi ficación del tipo de enzimas digestivas se realizó de acuerdo con lo mencionado por Dunn (1989). En el caso de las proteasas ácidas se utilizó el Pepstatin A (33.6 kDa) 1 mM como inhibidor. Para las protea sas alcalinas se usaron como inhibidores: fluoruro de fenilmetilsulfonilo 100 mM (PMSF), N-a-tosil-L-lisina-clorometilo cetona hidroclorada 10 mM (TLCK), inhibidor trípsico de soya 250 mM (SBT1), N-a-Tosil-L-fenilalanina clorometilo cetona 10 mM (TPCK), 1,10-fenantrolina10 mM (Fen), inhibidor trípsico tipo II-T ovoalbúmina de pavo 250 mM (Ovo) y ácido etilendiaminotetraacético 10 mM (EDTA).
Zimogramas de proteasas digestivas. Para las proteasas alcalinas, la electroforesis se realizó en condiciones desnaturalizantes utilizando dodecil sulfato sódico (SDS) y un sistema discontinuo (gel almacenador al 4% y un gel resolutivo al 10%), de acuerdo con la metodología des crita por Laemmli (1970) y adaptada por García-Carreño et al. (1993). Las electroforesis se realizaron en una cámara Mini PROTEAN® III Bio- Rad con 2 placas de geles verticales de 8 x 10 x 0.075 cm con capaci dad para 10 muestras cada uno. El corrimiento de la electroforesis se realizó con un búfer SDS 0.1%, Tris 25 mM y glicina 192 mM, pH 8.3 a 100 volts, 24 mA por 120 min. Para detectar la actividad de proteasa alcalina, los geles se sumergieron en caseína Hammersten al 2% en búfer Tris-HCl 100 mM + CaCl2 10 mM, pH 9, durante 1 h a 4 ºC; luego se transfirieron a otra solución de caseína a 37°C durante dos horas, posteriormente, se lavaron con agua destilada y se fijaron en una solu ción de ácido tricloroacético (TCA) al 12% durante 15 min.
Para la tinción se utilizó la metodología de Weber & Osborn (1969), con algunas modificaciones. Los geles permanecieron durante toda la noche a temperatura ambiente en la solución de tinción compuesta de 0.1% azul brillante de Coomassie (R- 250) en metanol-ácido acético-agua destilada (40:10:50). Para revelar los geles se utilizó una solución de metanol-ácido acético-agua (40:10:50). Las bandas de actividad proteolítica se observaron como bandas claras sobre un fondo azul intenso (caseína embebida en el gel). Para esta técnica se incluyó un marcador de bajo peso molecular Bio-Rad (LRMWM; Sigma, M-3913, fosforilasa B 97 kDa, albúmina bovina sérica 66 KDA, ovoalbúmina 45 kDa, anhidrasa carbónica 29 kDa, tripsinígeno 24 kDa e inhibidor tríp sico de soya 20 kDa). Para determinar los pesos moleculares de las bandas con actividad proteolítica se utilizó el programa Quality One V 4.6.5. de Bio-Rad.
Análisis estadísticos. Se comparó el control sin inhibir contra la activi dad residual con uso de inhibidores por medio de la prueba de Kruskal-Wallis. A fin de detectar diferencias significativas entre los tratamientos, se aplicó la prueba a posteriori de Nemenyi. Todos los análisis se reali zaron con un valor de significancia de 0.05. Para el análisis estadístico se utilizó el programa STATISTICA v. 7.
Resultados
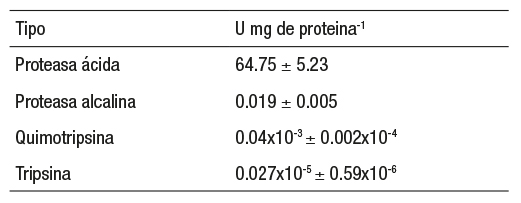
En la Tabla 1 se muestra que la actividad de la pepsina fue mayor a la actividad de las proteasas alcalinas, mientras que la quimotripsina presentó mayor actividad específica que la tripsina.
Tabla 1 Actividad proteolítica de las enzimas digestivas ácidas y alcali nas en juveniles de Centropomus parallelus.
Por otra parte, el pH óptimo para la actividad de proteasas ácidas fue pH 2.0 (Figura 1a), y la estabilidad de la actividad relativa se mantuvo alrededor del 100% en los pH 2 y 4 durante 90 min de preincubación, mientras que para los pH 6 y 8 la estabilidad tiende a disminuir alrede dor de un 20% desde los 60 min de preincubación. Por su parte, con pH de 10 y 12 la actividad residual cae abruptamente hasta llegar a 20% desde los 30 min de preincubación (Figura 1 b ). La temperatura óptima fue a 45 oC (Figura 1 c ), y su estabilidad mantuvo 100% de actividad residual a 25, 35 y 45 oC durante los 90 min de preincubación, mientras que para 55 y 65 oC se presenta una drástica caída a partir del minuto 30 de preincubación, al alcanzar solamente el 20% de actividad residual (Figura 1 d ).
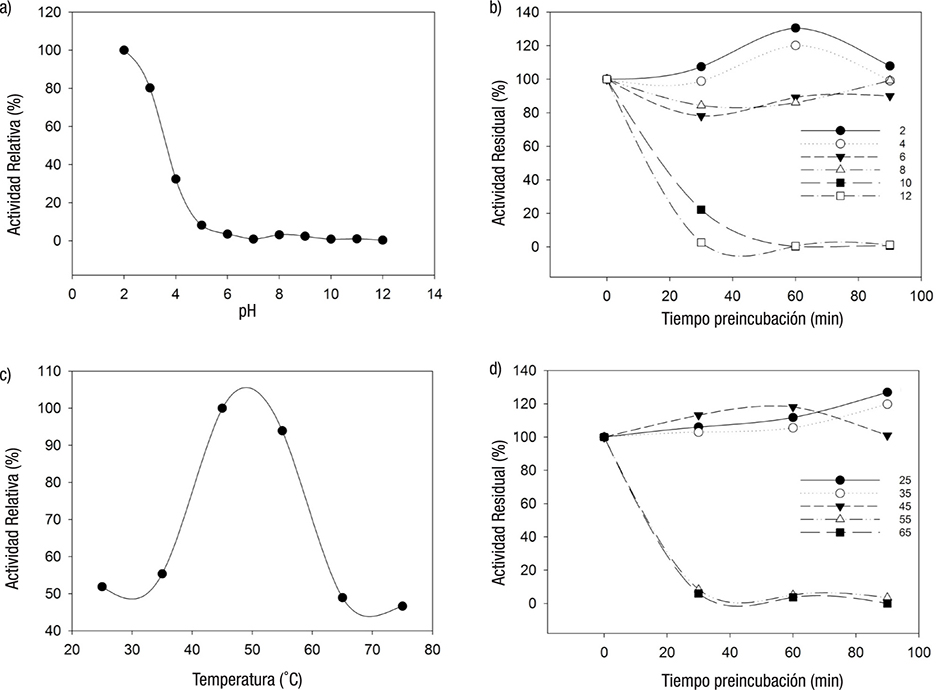
Figuras 1a-d Efecto del pH y la temperatura sobre las proteasas digestivas estomacales de Centropomus parallelus: a) pH óptimo. b) Estabilidad a pH. c) Temperatura óptima. d) Estabilidad a la temperatura.
En otro orden de ideas, las proteasas alcalinas mostraron dos picos de mayor actividad: uno máximo, con pH 10, y otro con menor actividad con pH 8 (Figura 2 a ). Mostraron una alta estabilidad con pH 6, 8,10 y 12 durante los 90 min de preincubación, mientras que la actividad residual con los pH 2 y 4 disminuye rápidamente a partir de los 30 min de preincubación (Figura 2 b ). La temperatura óptima para la actividad de proteasas alcalinas fue a 55 ºC (Figura 2 c ), y fue altamente estables entre los 25, 35 y 45 ºC (alrededor del 100% de actividad residual) durante los 90 min de preincubación, mientras que las temperaturas de 55 y 65 ºC afectan fuertemente la actividad de las enzimas, que disminuyen abruptamente para mantener solamente un 20% de actividad residual a partir de 30 min de preincubación (Figura 2 d ).
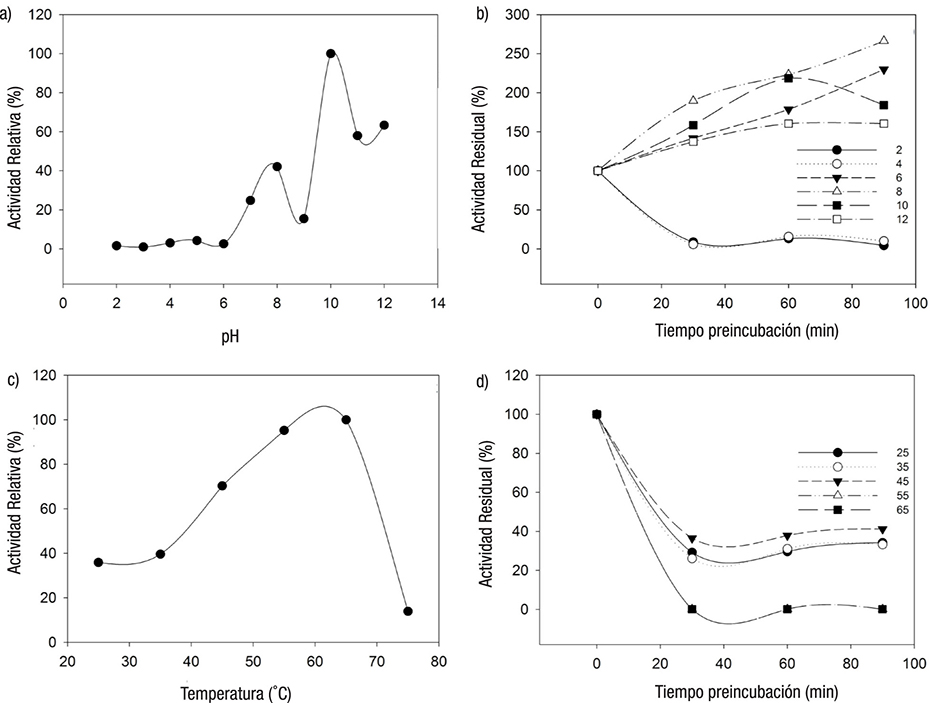
Figuras 2a-d Efecto del pH y la temperatura sobre las proteasas digestivas intestinales de juveniles de Centropomus parallelus: a) pH óptimo. b) Estabilidad a pH. c) Temperatura óptima. d) Estabilidad a la temperatura.
Para la caracterización de las proteasas presentes en los EC estomacales e intestinales de C. parallelus, se utilizaron inhibidores generales y específicos (Figura 3). La actividad de las proteasas ácidas fue inhibida en un 80% con pepstatin A. Por otro lado, la actividad de las proteasas alcalinas se redujo en 10 y 40%, con ovoalbúmina y PMSF, respectivamente; el TPCK redujo la actividad en un 50%, mientras que el TLCK y SBT1 redujeron la actividad para la tripsina en un 15 y 25%, respectivamente. Los inhibidores EDTA y fenantrolina lograron reducir la actividad en 5 y 85%, respectivamente.
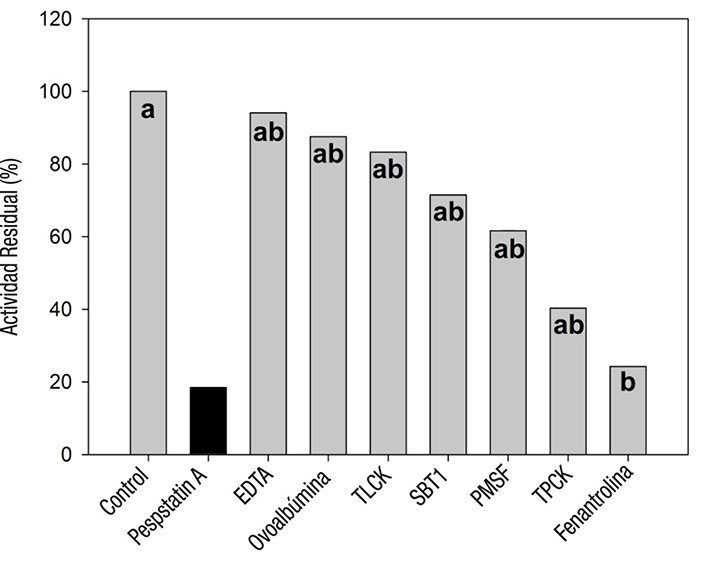
Figura 3 Actividad residual de las proteasas digestivas de los extractos multienzimáticos de juveniles de Centropomus parallelus resultante del uso de los inhibidores: Control (proteasas ácidas y alcalinas sin inhibidor), pepstatin A (Inhibidor de pepsina tipo A), EDTA (ácido etilendiaminotetraacético), ovoalbúmina, TLCK (tosil-lisina-clorometil cetona), SBT1 (inhibidor trípsico de soya), PMSF (fluoruro de fenilmetilsulfonilo), TPCK (tosil-fenilalanina-clorometil cetona), fenantrolina.
El zimograma de proteasas ácidas mostró una banda de actividad con un Rf de 0.35 kDa, inhibida totalmente por el pepstatin A (Figura 4 a ). Para las proteasas alcalinas se detectaron cinco bandas de actividad con un peso molecular de 79.5, 48.9, 37.0, 29.0 y 22.5 kDa respecti vamente. El PMSF inhibió tres bandas: 48.9, 37.0 y 29.0 kDa; el SBT1, dos bandas: 48.9 y 29.0 kDa; los inhibidores TPCK, TLCK y fenantrolina no inhibieron ninguna banda; la ovoalbúmina inhibió tres bandas: 48.9, 29.0 y 22.5 kDa, y el EDTA, dos bandas: 29.0 y 22.5 kDa (Figura 4 b ).
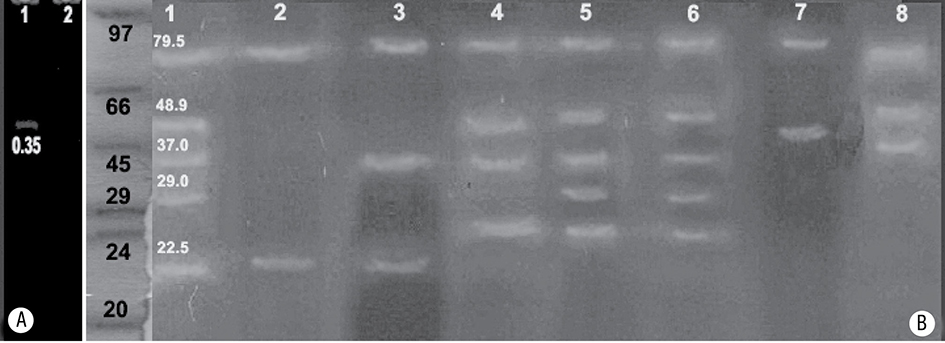
Figuras 4a-b Zimograma de actividad de las proteasas ácidas A) y alcalinas B) con diferentes inhibidores. a) pozo 1: Control ácido (proteasas ácidas sin inhibidor), pozo 2: pepstatin A (Inhibidor de pepsina tipo A 33.6 kDa). b) Marcador molecular: fosforilasa B 97 kDa, albúmina bovina sérica 66 KDA, ovoalbúmina 45 kDa, anhidrasa carbónica 29 kDa, tripsinógeno 24 kDa e inhibidor trípsico de soya 20 kDa; pozo 1: (Control de proteasas alcalinas sin inhibidor), pozo 2: PMSF (fluoruro de fenilmetilsulfonilo), pozo 3: SBT1 (inhibidor trípsico de soya), pozo 4: TPCK (N-a-Tosil-L-fenilalanina clorometilo cetona), pozo 5: TLCK (N-a-Tosil-L-lisina-clorometilo cetona hidroclorada), pozo 6: Fen (Fenantrolina), pozo 7: Ovo (Ovoalbúmina de pavo), pozo 8: EDTA (ácido etilendiaminotetraacético).
Discusión
Desde el punto de vista bioquímico, C. parallelus es considerado un carnívoro estricto al estar provisto de un estómago verdadero, esto es, que la actividad de las proteasas ácidas fue mayor a la de las proteasas intestinales, lo cual comprueba que el estómago es donde se realiza la mayor parte de la hidrólisis de proteínas. A su vez, en el intestino se termina la hidrólisis hasta la liberación de aminoácidos, que posterior mente son absorbidos a través de los enterocitos (Wang et al., 2006). Este aspecto concuerda con los estudios realizados en otras especies de peces carnívoros con estómago verdadero, como el atún aleta azul (Thunnus thynnus thynnus Linnaeus, 1758; Essed et al., 2002), el pez disco (Symphysodon aequifasciata Pellegrin, 1904; Chong et al., 2002), cabrilla arenera (Paralabrax maculatofasciatus Steindachner, 1868; Álvarez-González, 2003), pejelagarto (Atractosteus tropicus Gill, 1863; Guerrero-Zárate et al., 2013) y robalo blanco (Centropomus undecima lis; Concha-Frías et al., 2016). En ellos hallaron una clara diferencia entre la actividad de las enzimas digestivas del estómago y la del intes tino. El pH óptimo para las proteasas ácidas de C. parallelus fue de 2, que coincide con lo reportado para la mayoría de las especies carnívoras, como el rodaballo (Scophthalmus maximus Linnaeus, 1758; Wang et al., 2006), el lenguado senegalés (S. senegalensis; Sáenz et al., 2005), la cabrilla arenera (P. maculatofasciatus; Álvarez-González, 2003), el atún aleta azul (T. thynnus; Essed et al., 2002), el pez disco azul (S. aequifasciata; Chong et al., 2002), el pez lengüihueso (Scleropages for mosus Müller & Schlegel, 1844; Natalia et al., 2004) y el robalo blanco (Centropomus undecimalis) (Concha-Frías et al., 2016), que presentan un intervalo óptimo de pH entre 2 y 4. Complementariamente, las proteasas gástricas muestran ser muy estables con el pH de 2 a 8, desde los 30 minutos de preincubación, lo que demuestra que una vez que el esfínter pilórico se abre y el bolo alimenticio pasa al intestino, la pepsina mantiene su actividad a pesar del incremento gradual del pH; con ello se sostiene la hidrólisis de las proteínas hasta el momento de la acción de las proteasas alcalinas (tripsina y quimotripsina), cuando se ha alcanzado un pH neutro o alcalino (Álvarez-González, 2003). En otro aspecto, la disminución de la actividad enzimática digestiva en función de los cambios de pH ha sido descrita para otros peces, como P. maculatofasciatus (Álvarez-González, 2003), T. thynnus (Essed et al., 2002), A. tropicus (Guerrero-Zárate et al., 2013) y C. undecimalis (Concha-Frías et al., 2016), por lo que el intervalo de acción de las proteasas alcalinas de C. parallelus es bastante amplio en comparación con otras especies de peces carnívoros.
Por otra parte, las proteasas intestinales mostraron dos picos de mayor actividad proteolítica, con pH de 8 y 10. Datos similares se han reportado para la dorada (Sparus aurata Linnaeus, 1758; Munilla & Saborido, 1996), el dentón (Dentex dentex Linnaeus, 1758; Alarcón et al., 1998), P. maculatofasciatus (Álvarez-González, 2003), S. aequifasciata (Chong et al., 2002) y C. undecimalis (Concha-Frías et al., 2016), así como para peces agástricos, como la sardina Monterrey (Sardinops sagax caerulea Jenyns, 1842; Castillo-Yañez et al., 2005) y S. aurita (Ben et al., 2011). Esto sugiere la presencia de al menos dos grupos principales de proteasas alcalinas donde la actividad máxima general mente ha sido detectada con el pH de 8, lo que se debe principalmente a la alta actividad de la tripsina, y se ha demostrado que el pH óptimo para esta enzima se encuentra entre 7 y 9 (Das & Tripathi, 1991). En particular, la quimotripsina de C. parallelus parece ser la responsable del segundo pico de actividad cuando el pH es 10, similar a lo reportado por Guerrero-Zárate et al. (2013) en A. tropicus, y por Concha-Frías et al. (2016) en C. undecimalis. En esos casos consideran que inicialmente se libera la tripsina, que funciona como una enzima activadora de otras proteasas digestivas intestinales, como la quimotripsina. En este aspecto, la tripsina y la quimotripsina son de origen pancreático y pertenecen al grupo de las serinas proteasas, las cuales tienen su acción sobre los enlaces peptídicos internos (endopeptidasas), por lo que son las principales enzimas responsables de concluir la hidrólisis fina de los péptidos previamente hidrolizados en el estómago, en conjunto con la acción de las exopeptidasas (amino- y carboxipeptidasas), principalmente de origen intestinal (Moyano et al., 1996).
Es así que los resultados aquí presentados son similares a los reportados para diversas especies de peces marinos y dulceacuícolas de hábitos carnívoros estrictos, como el atún tongol (Thunnus tonggol Whitley, 1936; Prasertsan & Prachumratana, 2008a; 2008b), S. senegalensis (Sáenz et al., 2005), T. thynnus (Essed et al., 2002), Scleropages formosus (Natalia et al., 2004) y C. undecimalis (Concha-Frías et al., 2016), en cuanto a que presentan una baja cantidad de bandas con actividad proteólitica, generalmente una para pepsina (tipo A de aproximadamente 30 kDa), y no más de cinco bandas para la activi dad digestiva intestinal, la cual está fuertemente representada por la presencia de tripsina y quimotripsina (20 y 22 kDa, respectivamente). En este mismo sentido, existen grandes diferencias con peces de hábi tos omnívoros o herbívoros, como el piracanjuba (Brycon orbignyanus Valenciennes, 1850; García-Carreño et al., 2002), el híbrido de carpa plateada (Hypophthalmichthys molitrix Valenciennes, 1844) o la carpa cabeza grande (Aristichthys nobilis Richardson, 1845; Kumar et al., 2005), donde se ha detectado que las proteasas intestinales se pre sentan en un gran número de isoformas tipo tripsina y quimitripsina, generalmente en más de seis bandas, además de que muestran una mayor actividad digestiva en comparación con la estomacal, donde tanto la tripsina como la quimotripsina son las enzimas responsables de la hidrólisis total de las proteínas al ser afines a las cadenas polipeptídicas que contienen fenilalanina, triptófano y tirosina (Chong et al., 2002).
En otro orden de ideas, la respuesta de la actividad de proteasas digestivas en función de los cambios de la temperatura para C. parallelus permitió determinar que el óptimo de actividad de las proteasa estomacales e intestinales se dio con 45 y 55 oC respectivamente. En este sentido, se considera que ambos tipos de proteasas son termolábiles, ya que solamente se mantienen activas entre 25 y 45°C, y su actividad disminuye a partir de los 55°C, lo que difiere de lo reportado para C. undecimalis (Concha-Frías et al., 2016), donde se muestra una temperatura óptima a los 30 °C para proteasas estomacales, y de 75 °C para proteasas intestinales. Cabe mencionar que la determinación de la temperatura óptima y la estabilidad a los cambios térmicos no corresponden a parámetros fisiológicos de las especies, sino a la afinidad de la enzima con su sustrato a una determinada temperatura al alcanzar la máxima catálisis, por lo que la actividad enzimática digestiva, desde el punto de vista del organismo, se encuentra fuertemente disminuida a la temperatura ambiental donde habita el pez, lo que se compensa con el incremento en el tiempo de retención de los alimentos en el estómago e intestino, además de la acción conjunta de las hormonas digestivas (colecistoquinina y gastrina), que incrementan los movimientos peristálticos y el cierre de los esfínteres cardiaco, pilórico y del recto, con lo que favorecen la hidrólisis de las proteínas alimentarias (Navarro-Guillén et al., 2017).
En referencia a otro aspecto, nuestros resultados muestran que el pepstatin A inhibió las enzimas estomacales (pepsina tipo A) en más de un 80%, mientras que para las proteasas digestivas intestinales, el PMSF, SBT1 y la ovoalbúmina inhibieron fuertemente las serinas proteasas, mientras que el EDTA y la fenantrolina inactivaron a las enzimas de mayor peso molecular que generalmente pertenecen al grupo de las metalo-proteasas (carboxipeptidasas y aminopeptidasas); finalmente, los inhibidores específicos de TLCK y TPCK disminuyeron la actividad de tripsina y quimotripsina respectivamente. En este sentido, se ha identificado a la pepsina tipo A como la principal proteasa aspártica en el estómago de muchas especies de peces, la cual actúa como la primera enzima proteolítica encargada de la hidrólisis de los polipéptidos de cadena larga en el interior de las cadenas (Tengjaroenkul et al., 2000; Chong et al., 2002; Sáenz et al., 2005). Es así que se determinó que la principal proteasa digestiva en C. parallelus fue la pepsina A, al ser altamente inhibida por el pepstatin A y revelarse una sola banda en el zimograma, lo que concuerda con lo reportado para C. undecimalis, al detectarse un solo tipo de pepsina (Concha-Frías et al., 2016). Sin embargo, en otras especies de peces se ha reportado la presencia de dos isoformas de pepsina (pepsina I y pepsina II) (Castillo-Yañez et al., 2004; Cao et al., 2011).
Por otro lado, el hecho de que el estudio de inhibición enzimática de proteasas digestivas intestinales mostró altas inhibiciones, tanto de serina-proteasas como de metalo-proteasas, indica que C. parallelus es una especie altamente carnívora. Esto concuerda con lo encontrado por Essed et al. (2002), quienes señalan que la cantidad de tripsina es mayor al principio, por lo que funciona como la enzima clave activadora de otros zimógenos, como la quimotripsina en peces como la trucha o la dorada; mientras que Eshel et al. (1993) indican que la contribución de la tripsina a la hidrólisis de las proteasas en el intestino de peces carnívoros marinos es de 40 a 50%, como se ha reportado para S. aequifasciata, S. formosus y S. senegalensis (Chong et al., 2002; Natalia et al., 2004; Sáenz et al., 2005). De acuerdo con lo anterior, el extracto enzimático de juveniles de C. parallelus está compuesto principalmente por proteasas alcalinas del tipo tripsina y quimotripsina, las cuales fueron inhibidas 4 y 10% al usar los inhibidores de serina proteasas PMSF y ovoalbúmina respectivamente, lo anterior ha sido reportado para diversas especies de peces por autores como Jonas et al. (1983), Dimes et al. (1994), Munilla-Morán & Saborido-Rey (1996), García-Carreño et al. (2002), Chong et al. (2002), Chakrabarti et al. (2006), quienes indi can la presencia de serinas proteasas como las principales enzimas digestivas presentes en el intestino. En este mismo sentido, Concha-Frías et al. (2016) reportó en C. undecimalis una inhibición similar a la obtenida con C. parallelus, en ese caso el TPCK redujo en un 50% la actividad para quimotripsina. Asimismo, la inhibición de proteasas digestivas alcalinas usando SBT1 y TLCK (15 y 25%, respectivamente) en C. parallelus es similar a la de los estudios reportados por Alarcón et al. (1998) y Chakrabarti et al. (2006) en Sparus aurata (20%), Denter dentex (26%) y C. undecimalis (17%) (Concha-Frías et al., 2016). De esta forma, el resultado conjunto de la inhibición con SBT1 y TLCK en ensayos in vitro y el zimograma SDS-PAGE indican la importancia de la tripsina y la quimotripsina para llevar a cabo la última etapa de digestión en C. parallelus, aunque también se detectó la posible presencia de metaloproteasas relacionadas con enzimas tipo aminopeptidasas y carboxipeptidasa. De esta manera, los resultados de la actividad proteolítica digestiva en juveniles de C. parallelus demuestran que esta especie es estrictamente carnívora, aunque es necesario profundizar en las investigaciones sobre el desarrollo de alimentos balanceados, así como la posibilidad de sustituir la harina de pescado por otros ingredientes (vegetales y animales terrestres) seleccionados con base en la capacidad fisiológica digestiva de la especie.











 nova página do texto(beta)
nova página do texto(beta)


