Introducción
La Ciudad de México se encuentra en el Valle de México, donde existió un sistema lacustre con una superficie aproximada de 2,000 km2. La urbanización ha provocado una fuerte degradación ambiental en esta zona del país (Conagua, 2010), quedando en la actualidad 3.63 km2 de superficie de lagos, de la cual 92.3% pertenece a los lagos de Xochi milco y el resto a los de Chapultepec, Texcoco y San Juan de Aragón (Conagua, 2013). Esta situación resalta la importancia en la conserva ción de áreas lacustres en el ámbito urbano de la Ciudad de México, como la Cantera Oriente, un ambiente excepcional por su conservación que forma parte de la Reserva Ecológica del Pedregal de San Ángel (REPSA) (Lot, 2007); esta área ha cobrado gran importancia biológica para la ciudad por la diversidad que la caracteriza. En sitios con un alto grado de conservación, las condiciones ambientales tienden a man tenerse estables y el reto es evaluar las respuestas biológicas de las comunidades que los habitan, ya que permiten reconocer gradientes ambientales que ayudan a la evaluación de ecosistemas perturbados, especialmente los de tipo urbano.
Varios estudios de microalgas han mostrado que la Cantera Oriente alberga una gran diversidad, que es ejemplo del manejo adecuado de áreas lacustres inmersas en zonas densamente pobladas (Novelo et al., 2007, 2009; Rodríguez Terán et al., 2014). En estos estudios puede verse que los ecosistemas lénticos y la comunidad fitoplanctónica han sido los más estudiados, en parte porque los lagos representan 14% de la superficie total (0.075 km2) de la Cantera Oriente. En este trabajo nos hemos enfocado en la comunidad perifítica de cianoprocariontes de los sistemas lóticos de la zona, lo que ha aumentado sustancialmente el conocimiento de la diversidad y la ecología de esta área de la REPSA.
Las cianoprocariontes perifíticas contribuyen significativamente a definir el perfil ecológico de los ecosistemas lóticos. Biggs (1996) señaló que la interacción entre las algas perifíticas y el ambiente está regulada por dos tipos de factores: las variables que controlan directamente la pérdida o acumulación de biomasa, como nutrimentos, temperatura e irradianza, y las variables que influyen de manera indirecta, como el clima y el tipo de sustrato.
Cuando hay un suministro constante de nutrimentos y luz en el ambiente, predominan las especies filamentosas de clorofitas (Cladophora o Rhizoclonium) y las diatomeas pedunculadas (Danilov & Eke lund, 2001; Ensminger et al., 2005); si esto ocurre en ambientes lóticos de corrientes suaves con baja frecuencia de inundaciones, en donde la abrasión sobre el sustrato es mínima, la biomasa de algas perifíticas en general alcanza valores altos (Ensminger et al., 2005). Se ha consi derado que la herbivoría en estas condiciones sólo ejerce una presión baja o mediana; estas características, en su conjunto, sugieren que el ambiente está funcionando con un disturbio de nivel mediano a bajo (Biggs, 1996; Graba et al., 2014). Los autores citados, especialmente Biggs (1996), proponen que en estas condiciones suelen encontrarse cianoprocariontes Oscillatoriales o especies con talos de crecimiento erecto, como miembros de Nostocales, aunque también hay comunida des importantes de epífitas coloniales de cianoprocariontes que crecen sobre clorofitas filamentosas. Esto es lo que hemos observado en los sitios estudiados de la Cantera Oriente y también ha sido descrito en arroyos de la región central de México (Beltrán Magos et al., 2013; Mora Hernández et al., 2015; Novelo, 1998; Ramírez et al., 2003; Vala dez Cruz et al., 1996). Los principales objetivos de este estudio fueron comparar las comunidades de cianoprocariontes perifíticas de un am biente natural y uno artificial y evaluar el grado de disturbio o equilibrio ambiental a través de la composición de especies, su densidad rela tiva y su frecuencia relativa, enfocando la interpretación del grado de disturbio con elementos tomados de la bibliografía. Planteamos estos objetivos porque gran parte de la ecología actual de ambientes lóticos se ha basado en la comparación entre sustratos naturales y artificiales, empleando a la riqueza y composición de especies perifíticas y bentó nicas, así como sus densidades poblacionales (Schneck et al., 2011), biovolumen y biomasa (Murdock & Dodds, 2007; Potapova & Charles, 2005) y actividad metabólica (Fellows et al., 2006) como indicadores de la salud del ecosistema.
Los principales aportes de esta investigación son una caracteriza ción ecológica general de los ambientes lóticos de la Cantera Oriente, basada en la biología de las cianoprocariontes perifíticas, y una inter pretación sobre la posible existencia de selectividad de sustrato de las microalgas epífitas, con base en la descripción bibliográfica de sus pre ferencias de hábitat (Fattom & Shilo, 1984; Fellows et al., 2006; Michael et al., 2008; Potapova & Charles, 2005; Schneck et al., 2011).
Materiales y métodos
Área de estudio y sitios de recolección. La Cantera Oriente está ubicada al sur de la Ciudad de México y cuenta con 0.075 km2 de terreno (Lot, 2007). Se incorporó a la REPSA en diciembre de 1996. En ella existen cuatro unidades ambientales o de paisaje (Figura 1): A) paisaje lacustre y de humedales, B) paisaje de jardines, C) paisaje de bosques y arbustos y D) paisajes construidos. La unidad de paisaje lacustre y de humedales está subdividida en: cuerpos de agua (14.36% de la superficie), planicie palustre o de ciénaga (zonas que bordean a los cuerpos de agua), que representa 23.21% de la superficie, y zonas inundables que constituyen 4.85% de la superficie total de la Cantera (Lot, 2007; Ortiz Pérez et al., 2007).

Figura 1 Sitios de recolección en la Cantera Oriente (Ciudad de México, México). La flecha superior señala la ubicación del arroyo y la flecha inferior señala la ubicación del canal. En el sector Este se aprecia la zona de lagos. Fuente: Google Earth, 2013 (periodo de recolección).
Se eligieron dos sitios de recolección en donde se observó la presencia de cianoprocariontes perifíticas, los cuales se denominaron “arroyo” y “canal” (Figura 2a-b), de acuerdo con el estado natural o arti ficial del ambiente. El arroyo (sitio natural) es una desviación del agua que escurre por la pared noroeste de la Cantera. Se ubica en la unidad ambiental de paisajes de bosques y arbustos, en la subdivisión de plano ondulado de relleno con vegetación arbórea cerrada, que representa una comunidad forestal diversa, con un techo arbóreo denso (Ortiz Pérez et al., 2007). En las orillas del arroyo se encuentran principalmente cipreses (Cupressus sempervirens Linnaeus) y tepozanes (Buddleja cordata Kunth), mientras que dentro del arroyo se pueden encontrar plantas herbáceas, principalmente Stuckenia pectinata (Linnaeus) Bör ner, una macrófita sumergida. El otro sitio estudiado fue un canal de concreto (sitio artificial) poco profundo, de lecho plano y paredes ver ticales, que fue construido para nivelar el volumen de agua en época de lluvias y conecta el agua que proviene de la pared de la Cantera con el lago Vaso Regulador. Se encuentra dentro de la unidad ambiental de paisajes con jardines y se caracteriza por estar rodeado principalmente por fresnos (Fraxinus uhdei (Wenzig) Lingelsh) y liquidámbar (Liquidam bar styraciflua Linnaeus) (Ortiz Pérez et al., 2007).

Figura 2a-b Sitios de muestreo en la Cantera Oriente (Ciudad de México, México). a) Vista parcial del sitio natural denominado “arroyo”. b) Vista parcial del sitio artificial denominado “canal”.
Recolección en campo. Durante un año (septiembre 2012 - septiembre 2013) se recolectaron mensualmente muestras en el arroyo y el canal. En el arroyo, se recolectaron clorofitas filamentosas sumergi das (Rhizoclonium hieroglyphicum (C. Agardh) Kützing), macrófitas (S. pectinata) y raíces o madera sumergidas de B. cordata; en el canal se recolectaron talos del único sustrato vegetal, la clorofita filamentosa sumergida Cladophora glomerata (Linnaeus) Kützing. A partir de estas recolecciones se obtuvieron cianoprocariontes epífitas, mediante ras pado con una navaja o toma directa. Los raspados del material epífito se realizaron en el laboratorio.
En cada recolección se midieron la irradianza subsuperficial (Hobo®), el pH, la temperatura y la conductividad (potenciómetro Conductronic PC-18®) y el oxígeno disuelto (oxímetro Conductronic Ox-25®) del agua. En el laboratorio, empleando muestras de agua recolectadas en cada ocasión, se determinaron los nutrimentos por métodos espectrofotométricos (espectrofotómetro Hach DR 1900®), estandarizados (Rice et al., 2017). Todos los métodos están basados en los estándares aprobados para el análisis de agua dulce de la Agencia de Protección Ambiental de los Estados Unidos (USEPA, 2017). El fósfo ro total se obtuvo por el método de digestión ácida (EPA 365.1, 365.3, 8190), las determinaciones de nitrato se hicieron mediante el método de reducción de cadmio (EPA 353.2, 8171), las de nitrito por el método de diazotización (EPA 353.2, 8507) y las de amonio con el método del salicilato (EPA 350.1, 10023).
Las muestras para determinación de especies fueron preservadas con formol a 2.5%, material con el cual se realizaron preparaciones semipermanentes con gelatina glicerinada (González & Novelo, 1986). La documentación se realizó con un microscopio Nikon 80i® (con contraste de interferencia diferencial). El material (preparaciones y muestras líquidas) se incorporó al Herbario de la Facultad de Ciencias (FCME).
Análisis biológico de las especies. Debido a la diversidad de sustra tos que son colonizados por las cianoprocariontes perifíticas, se eva luó la presencia y la composición de las especies en las comunidades, considerando su densidad relativa y frecuencia relativa (Tabla 1), de acuerdo con el Índice de Valor de Importancia (IVI), modificado con base en el utilizado en estudios de ecología vegetal (Nguyen et al., 2014).
Tabla 1 Ecuaciones para calcular el Índice de Valor de Importancia (IVI) de especies con la suma de la densidad relativa y la frecuencia relativa. Modificado de Nguyen et al., 2014. La densidad relativa es la presencia de talos por preparación para cada especie; el área total muestreada es el número de preparaciones (cubreobjetos de 20 x 20 mm) en las que se registraron los tallos de cada especie.

Manejo estadístico de los datos. Las variables cuantitativas consideradas en el estudio se señalan en la Tabla 2. El nitrógeno inorgánico total disuelto (NID) se obtuvo sumando los valores de las tres formas inorgánicas determinadas y se utilizó para obtener la proporción de nitrógeno con respecto al fósforo (NP). El cálculo del coeficiente de variación (Microsoft Excel 2017) permitió establecer inicialmente la precisión de los datos (Tabla 2). Se utilizó el programa XLSTAT (Addinsoft, para Microsoft Excel 2017) y se analizó si los datos cumplieron con una distribución normal, aplicando una prueba de Kolmogorov-Smirnov. Se normalizaron los datos (transformación LN+1) y se aplicaron pruebas de contraste de medias paramétricas y no paramétricas (Levene, prueba T y Mann-Whitney). Para evaluar la posible asociación entre la presencia de especies y el tipo de ambiente (natural o artificial), se aplicó una prueba de asociación no paramétrica con el estadístico Chi cuadrada, mediante la creación de una tabla de contingencia. Las variables cualitativas consideradas para Chi cuadrada fueron el tipo de sustrato (alga, macrófita o arbusto), el tipo de ambiente (arroyo o canal) y la época (seca o de lluvias).
Tabla 2 Datos fisicoquímicos monitoreados en el arroyo y el canal en la Cantera Oriente (Ciudad de México, México). La relación nitrógeno-fósforo (N:P) se obtuvo sumando los valores del nitrógeno inorgánico disuelto y dividiéndolos entre los valores de fósforo total para cada fecha.

IVI = Índice de valor de importancia.
Resultados
Se encontraron 13 especies de cianoprocariontes (Tabla 3); de ellas sólo 31% es compartido por ambos sitios. La evaluación cuantitativa de su distribución y presencia se hizo con base en el IVI (Tabla 3), que se aplicó modificando la propuesta de Nguyen et al. (2014).
Tabla 3 Datos para la construcción de la tabla de contingencia, utilizada en la prueba de Chi cuadrada. Se muestran las especies organizadas por época climática en cada sitio de la Cantera Oriente (Ciudad de México, México). Los valores de IVI se corresponden con el sustrato sobre el que crecieron.

IVI = Índice de valor de importancia.
Una comparación proporcional de las especies de cada ambiente, de acuerdo con el IVI, mostró una representatividad diferente para cada especie, asociada con las variables cualitativas consideradas en el estudio: tipo de ambiente (arroyo (Figura 3) y canal (Figura 4)), la estación climática (época seca o de lluvias) y el tipo de sustrato (macrófita, alga o arbusto).
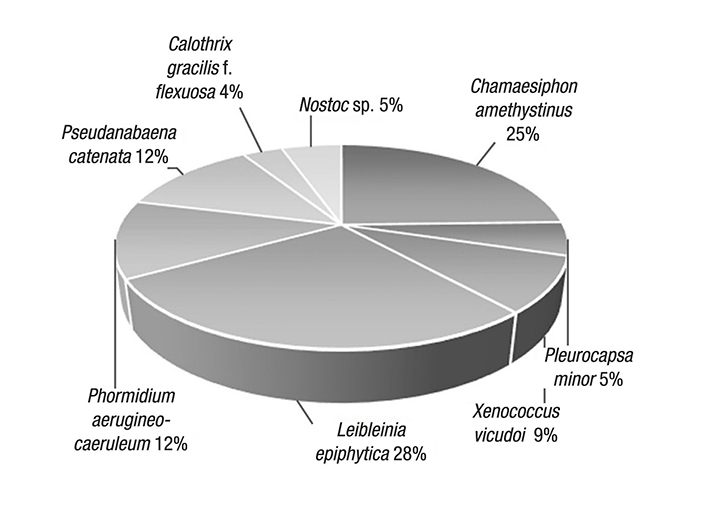
Figura 3 Expresión porcentual del IVI de cada especie en el sitio arroyo, Cantera Oriente (Ciudad de México, México). Leibleinia epiphytica y Chamaesiphon amethystinus destacaron por su densidad y frecuencia en todos los sustratos.
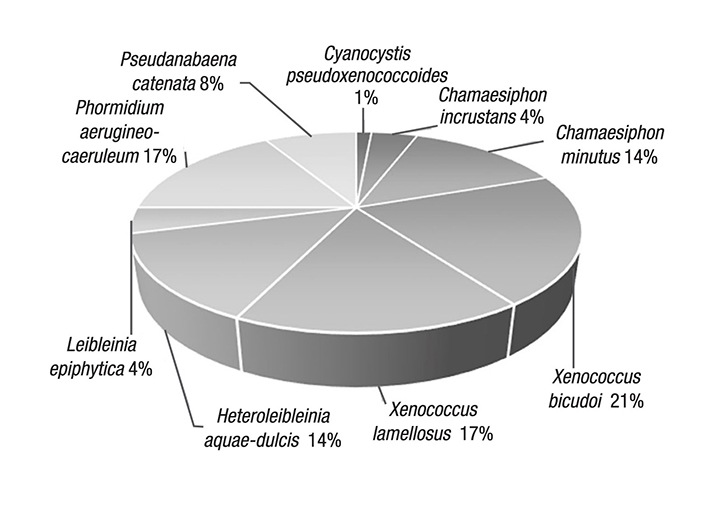
Figura 4 Expresión porcentual del IVI de cada especie en el sitio canal, Cantera Oriente (Ciudad de México, México). Xenococcus bicudoi, X. lamellosus y Phormidium aerugineocaeruleum destacaron por su dominancia y frecuencia sobre C. glomerata.
Análisis de los datos. Los datos de variables ambientales registrados en este estudio (Tabla 2) mostraron igualdad de varianzas; de acuerdo con el coeficiente de variación, solo la temperatura y la conductividad tuvieron precisión aceptable (<10%). La correlación de Pearson para estas variables no fue significativa para los valores de IVI (p >0.05; N = 19). El análisis exploratorio de los datos cuantitativos obtenidos para el conjunto de variables indicó que no tienen una distribución normal (prueba de Kolmogorov-Smirnov, p <0.05). Las pruebas de contraste de medias aplicadas a los datos normalizados indicaron que podemos asumir igualdad de varianza en cada variable (p >0.05 para la prueba de Levene y p >0.05 bilateral para la prueba T de igualdad de medias).
El análisis no paramétrico aplicado a los mismos datos normalizados también mostró que la diferencia de posición entre las muestras fue igual a cero (prueba de Mann-Whitney, p >0.05), excepto para el nitrógeno (p <0.05).
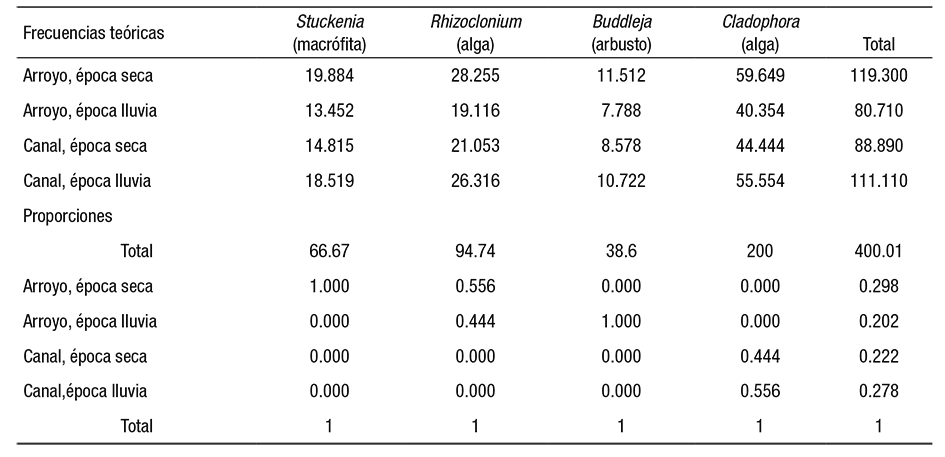
Una tabla de contingencia de los datos mostró la asociación entre las variables de naturaleza cualitativa (Tabla 4, Figura 5). El resultado de la prueba de Chi cuadrada, con p <0.05, estableció marcadas diferencias en el crecimiento de las cianoprocariontes en cada ambiente. Se aceptó por tanto la hipótesis alternativa de la prueba (Tabla 5), lo que indica que hay dependencia entre filas y columnas de la tabla de contingencia. Esto fue comprobado mediante las frecuencias teóricas y de proporciones y columnas (Tabla 6), que especificaron una magnitud de asociación de las especies con cada tipo de ambiente, dependiendo tanto del sustrato como de la estación climática.
Tabla 4 Tabla de contingencia de Chi cuadrada. Cada tipo de sustrato reunió el IVI de las especies para cada época climática y sitio en la Cantera Oriente (Ciudad de México, México).

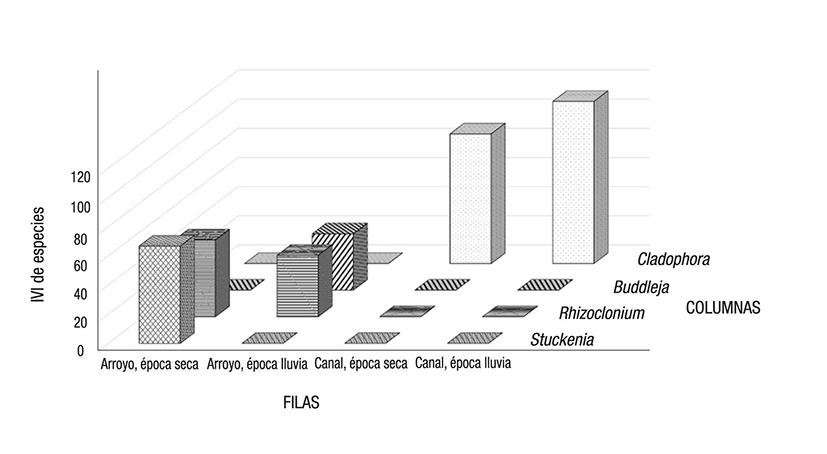
Figura 5 Presentación gráfica de la tabla de contingencia. La proporción de individuos en cada columna sugirió una asociación entre las variables cualitativas seleccionadas
Tabla 5 Resultado de la prueba de independencia entre las filas y co lumnas, producida por la prueba de Chi cuadrada. El valor de p cal culado fue menor a la significación de alfa. El riesgo de rechazo de la hipótesis nula (H0), en caso de ser vardadera, fue menor a 0.01%.

Discusión
Las pruebas estadísticas aplicadas tuvieron por objeto demostrar la existencia de asociaciones entre las especies de cianoprocariontes y las condiciones fisicoquímicas de los ambientes lóticos estudiados, el arroyo y el canal. Los análisis aplicados para explicar los resultados no mostraron ningún tipo de asociación entre las especies (variable dependiente) y las variables físicas o químicas. Como el seguimiento del muestreo fue amplio, continuo y estuvo basado en la evaluación de las especies mediante el índice de importancia calculado (valores de IVI), pensamos que existen suficientes datos para sustentar la propuesta de que las condiciones del medio son estables y no se relacionan directamente con las diferencias en presencia de las especies en ninguno de los sitios. Esto se reflejó particularmente en los resultados de las pruebas para explorar la normalidad y homogeneidad de varianzas, que al incumplir los supuestos estadísticos mínimos para las variables no sugirieron que fuera pertinente hacer una indagación mayor.
Es bastante notable que los factores fisicoquímicos medidos en ambos ambientes se hayan mantenido extremadamente constantes durante el periodo de muestreo (de ahí que no exista variabilidad suficiente de los datos), porque esto y la composición de especies, sumada a las densidades y frecuencias relativas de su crecimiento, se ajustan a la propuesta de Biggs (1996) y a lo sugerido por otros autores con base en esta propuesta (Danilov & Ekelund, 2001; Ensminger et al. 2005), que indican que en la Cantera Oriente los ambientes lóticos tienen un nivel de disturbio bajo y presentan un buen escenario para el desa rrollo de las especies de cianoprocariontes perifíticas observadas. Los resultados muestran que el suministro de nutrimentos es constante y que no hay limitación por la luz, puesto que las cianoprocariontes no modifican su valor de IVI en función de la variabilidad de la irradianza. Asimismo, la abrasión de la corriente no las afecta, ya que se fijan sobre dos sustratos algales (C. glomerata y R. hierogliphycum), que son indicadores de velocidades de corriente moderadas a bajas (Ensminger et al., 2005). De acuerdo con Biggs (1996) y Graba et al. (2014), en esta categoría de ambientes con bajo nivel de disturbio la herbivoría no influye en la pérdida de biomasa. Aunque no evaluamos la presión de herbivoría, pensamos que en el caso de los sitios estudiados también se cumple esta característica, así que las diferencias de crecimiento de las especies (IVI) no modificarán la biomasa del conjunto de perifiton a largo plazo. Esto significa que estas especies tenderán a mantenerse como habitantes epífitos en los sitios lóticos de la Cantera Oriente.
Aun considerando el bajo nivel de disturbio de estos ambientes, un aspecto importante fue averiguar si la presencia de las especies o su capacidad de crecimiento, representada por el IVI, dependían de la condición natural o artificial de cada ambiente, de la época del año o del tipo de sustrato colonizable (Tabla 4). Destaca el hecho de que sólo 31% de las especies son compartidas entre los sitios (Xenococcus bicudoi Montejano, Gold et Komárek), Leibleinia epiphytica (Hieronymus) Compère, Phormidium aerugineocaeruleum (Gomont) Anagnostidis et Komárek y Pseudanabaena catenata Lauterborn) (Tabla 2), pues aunque el ambiente sea homogéneo y estable, no todas las especies crecen en todos los sitios o sustratos y aun si fuera así, no crecen con la misma densidad poblacional ni con la misma frecuencia, de acuerdo con las diferencias observadas en el IVI.
Un análisis para variables cualitativas, asociando el tipo de susrato, el tipo de ambiente, la época del año y la forma como crecen las especies, realizado con la prueba Chi cuadrada, comprobó que los valores de IVI son muy diferentes dependiendo del sustrato en que cre cen las especies y, tal como fue construida la tabla de contingencia, muestra que se relacionan tanto con la época del año como con el tipo de ambiente (Tablas 3 y 4).
La dependencia de las especies con el tipo de sustrato sobre el que crecen podría ocurrir al azar, considerando que el canal cuenta con un único sustrato vegetal disponible (la clorofita filamentosa C. glomerata) y la presencia de concreto, pero no ocurrió así. En el arroyo existe una gama más amplia de sustratos posibles (R. hieroglyphicum, S. pectinata y B. cordata) y tanto la densidad poblacional como la frecuencia de las especies mostraron que la presencia de especies específicas no ocurre al azar. De las especies compartidas entre el arroyo y el canal, L. ephiphytica y X. bicudoi no están restringidas por el ambiente, sustrato o época del año, mientras que P. aeruginocaeruleum y P. catenata están restringidas por el tipo de sustrato y la época. Ninguna de es tas especies compartidas muestra una diferencia entre las clorofitas filamentosas y todas crecen indistintamente sobre C. glomerata o R. hieroglyphicium.
Las demás especies presentan otros gradientes de restricciones que las asocian de modo diferente con el tipo de ambiente, época o sustrato. En el arroyo las especies particulares fueron C. gracilis f. flexuosa Fritsch, con IVI 4% (restricción amplia: tipo de sustrato, época y tipo de ambiente), Nostoc sp., con IVI 5% (restricción media: época del año y tipo de ambiente) y Chamaesiphon amethystinus (Rostafinski) Lemmermann, con IVI 25% (restricción baja: únicamente tipo de am biente). El gradiente de restricción ambiental está bien reflejado por el valor del IVI, que se incrementó de forma inversamente proporcional al nivel de restricción; ésto sugiere que la densidad poblacional y la frecuencia de presencia que alcanza cada especie son resultado de las condiciones adecuadas para su fijación, aun cuando el ambiente se mantenga estable.
En el canal, todas las especies crecen sobre el único sustrato vegetal disponible (C. glomerata). En este sentido sobresale Xenococcus bicudoi, que aun pudiendo colonizar cualquiera de los sustratos y ambientes creció mucho mejor en el canal, con IVI 21% en la época seca y la de lluvias. Las demás especies del canal, no compartidas con el arroyo, se desarrollan bien (por sus valores de IVI) durante la época seca o lluviosa. Como excepciones destacan Cyanocystis pseudoxenococcoides (Bourrelly) Bourrelly y Chamaesiphon incrustans Grunow, descritas como epilíticas en latitudes tropicales (particularmente C. pseudoxenococcoides) y que no fueron observadas sobre el concreto, sino que únicamente crecieron en bajas densidades como epífitas de C. glomerata. Pensamos que esto se debe a la respuesta hidrofóbica particular del mucílago (Fattom & Shilo, 1984; Michael et al., 2008), pues el canal tiene paredes verticales, lo que se ha observado que es un factor que afecta de forma general el establecimiento de las cianoprocarion tes perifíticas (Michael et al., 2008). C. glomerata no representa enton ces el sustrato óptimo para estas especies y aunque crecen, lo hacen en forma limitada (Fig. 4). Nuestras observaciones de las especies de cianoprocariontes epífitas nos permiten concluir que los ambientes lóti cos de la Cantera Oriente se caracterizan por un bajo nivel de disturbio, ya que la presencia y la biomasa de las cianoprocariontes perifíticas no se modifican sensiblemente durante los periodos climáticos. Asimismo, de acuerdo con el objetivo principal de comparar las comunidades de cianoprocariontes perifíticas entre un ambiente natural y uno artificial, concluimos que las respuestas biológicas específicas ante la condición natural o artificial del ambiente, asociadas con el tipo de sustrato bio lógico como sitio de colonización, parecen explicar las preferencias de hábitat para algunas especies, pero puede haber gradientes ambien tales más sutiles relacionados con el perfil biológico de las especies y que es necesario estudiar en relación con los ciclos de vida en cultivos. Esta perspectiva tiene un respaldo firme, porque los estudios de fito plancton en los ambientes lénticos de la Cantera Oriente hasta ahora sugieren un escenario muy diferente al de los ambientes lóticos; es decir, un recambio muy rápido de especies que refleja una importante diversidad beta (Rodríguez Terán et al., 2014).











 nueva página del texto (beta)
nueva página del texto (beta)