INTRODUCCIÓN
Los caprélidos son crustáceos con tallas de entre 1 y 54 mm, exclu sivamente marinos y clasificados en dos grandes grupos: los bentóni cos de vida libre (familia Caprellidae) y los ectoparásitos de mamíferos marinos (familia Cyamidae) (McCain, 1968; Margolis et al., 2000). La familia Caprellidae incluye 423 especies dentro de 89 géneros (de Bro yer, 2015). El 40% de las especies corresponden al género Caprella Lamarck, 1801. Presentan una amplia distribución latitudinal y un gra diente batimétrico, habitan en diversos sustratos como algas, esponjas, hidrozoos, briozoos y octocorales (McCain, 1968; Laubitz, 1970; Laubitz & Mills, 1972), también en fondos blandos, arrecifes rocosos y coralinos (Guerra-García & Koonjul, 2005; Guerra-García et al., 2012; Galván-Villa & Ayón-Parente, 2015; Sánchez-Moyano et al., 2015).
El conocimiento sobre la sistemática de los anfípodos capréli dos inició con los trabajos de Mayer (1882, 1890, 1903), los cuales sintetizan lo que se conocía sobre la taxonomía hasta ese momento. Por lo que respecta a la zona del Pacífico occidental, se ha registra do una riqueza de 27 especies para el Indo-Pacífico central (Laubitz, 1991; Krapp-Schikel & Guerra-García, 2005), 18 especies en Australia (Guerra-García & Takeuchi, 2004), ocho para Hawái y la región media del Pacífico (McCain & Steinberg, 1970); y 115 especies para Japón y áreas adyacentes, región que presenta la mayor riqueza a nivel mundial (McCain & Steinberg, 1970; Arimoto, 1976; Takeuchi, 1999).
Para el pacífico oriental, la mayor parte de los registros correspon den a las costas del Pacífico norte oriental (Estados Unidos de América y Canadá) con 57 especies (Dougherty & Steinberg, 1953; Laubitz, 1970; McCain & Steinberg, 1970; Chess, 1989; Walting & Carlton, 2007; Gue rra-García & Hendrycks, 2013) y para las costas del Pacífico sudorien tal, cinco especies (Guerra-García & Thiel, 2001; Ros et al., 2014). La poca frecuencia de realización de este tipo de estudios puede asociarse a la escasez de especialistas en el grupo, además, las investigaciones sobre los anfípodos se han desarrollado en mayor proporción para los grupos de gammáridos e hipéridos (Escobar-Briones & Winfield, 2003).
Actualmente, los registros de caprélidos en el Pacífico oriental tro pical (POT) se limitan a las costas de unos cuantos países (McCain & Steinberg, 1970; Escobar-Briones & Winfield, 2003; Brusca & Hendric kx, 2005; García-Madrigal, 2007). Por lo anterior, este trabajo tiene la finalidad de contribuir al conocimiento de las especies de caprélidos descritas y registradas en el POT a partir de la revisión documental so bre el grupo; igualmente recopila información dispersa sobre su siste mática, generalidades morfológicas y aspectos ecológicos relacionados con su alimentación y hábitat.
Sistemática. Históricamente, el orden Amphipoda (Crustacea: Malacos traca: Peracarida) se clasificaba en cuatro subórdenes: Gammaridea Latrelle, 1802; Caprellidea Leach, 1814; Hyperriidea Milne-Edwards, 1830; e Ingolfiellidea Hansen, 1903. Sin embargo, recientemente se realizaron cambios sustanciales en la taxonomía del grupo con base en análisis filogenéticos y cladísticos de caracteres morfológicos (Myers & Lowry, 2003; Lowry & Myers, 2013). Se estableció al suborden Sen ticaudata Lowry & Myers, 2013, que agrupa al infraorden Coriophiida; asimismo al parvorden Caprellidira y a la superfamilia Caprelloidea Leach, 1814; ésta última incluye a las familias Caprellidae Leach, 1814; (con tres subfamilias Caprellinae, Paracercopinae, Phitisicinae) y Cya midae Rafinesque, 1817.
Morfología. Presentan dos variaciones morfológicas: los de cuerpo del gado y cilíndrico con hábitos de vida libre (Caprellidae) y los deprimidos dorsoventralmente que parasitan cetáceos (Cyamidae) (Margolis et al., 2000). Su cuerpo está constituido por siete pereonitos que en algunas especies presentan proyecciones dorsales (p. ej. Aciconula acanthoso ma Chess, 1989; Caprella verrucosa Boeck, 1871), laterales (p. ej. Pa racaprella pusilla Mayer, 1890) o ventrales (p. ej. Caprella equilibra Say, 1818; C. pilidigita Laubitz, 1970). Tienen dos pares de antenas, donde el primero es más largo que el segundo; dos pares de gnatópodos, con el segundo par más desarrollado y ornamentado en los machos que en las hembras (Arimoto, 1976).
En cuanto a las branquias, generalmente se localizan en el tercer y cuarto segmento, al igual que los oostegitos en el caso de las hembras. El número de pereiópodos es variable. En algunos géneros como Phiti sica y Hemiproto tiene cinco pares de pereiópodos (desde el pereonito tercero hasta el séptimo) o sólo tres (del quinto al séptimo) como en el género Caprella. Estas extremidades están provistas de garfios (gras ping spines en inglés) que les permiten aferrarse fuertemente al sustra to que habitan (Thiel et al., 2003) (Fig. 1). El abdomen es reducido; los pleópodos y urópodos se encuentran reducidos o ausentes, lo que les dificulta nadar. Esta última actividad la realizan mediante movimientos bruscos y rápidos que implican flexiones ventrales y enderezamien to del cuerpo, similares a los movimientos de una oruga (Keith, 1971; Aoki, 1999).
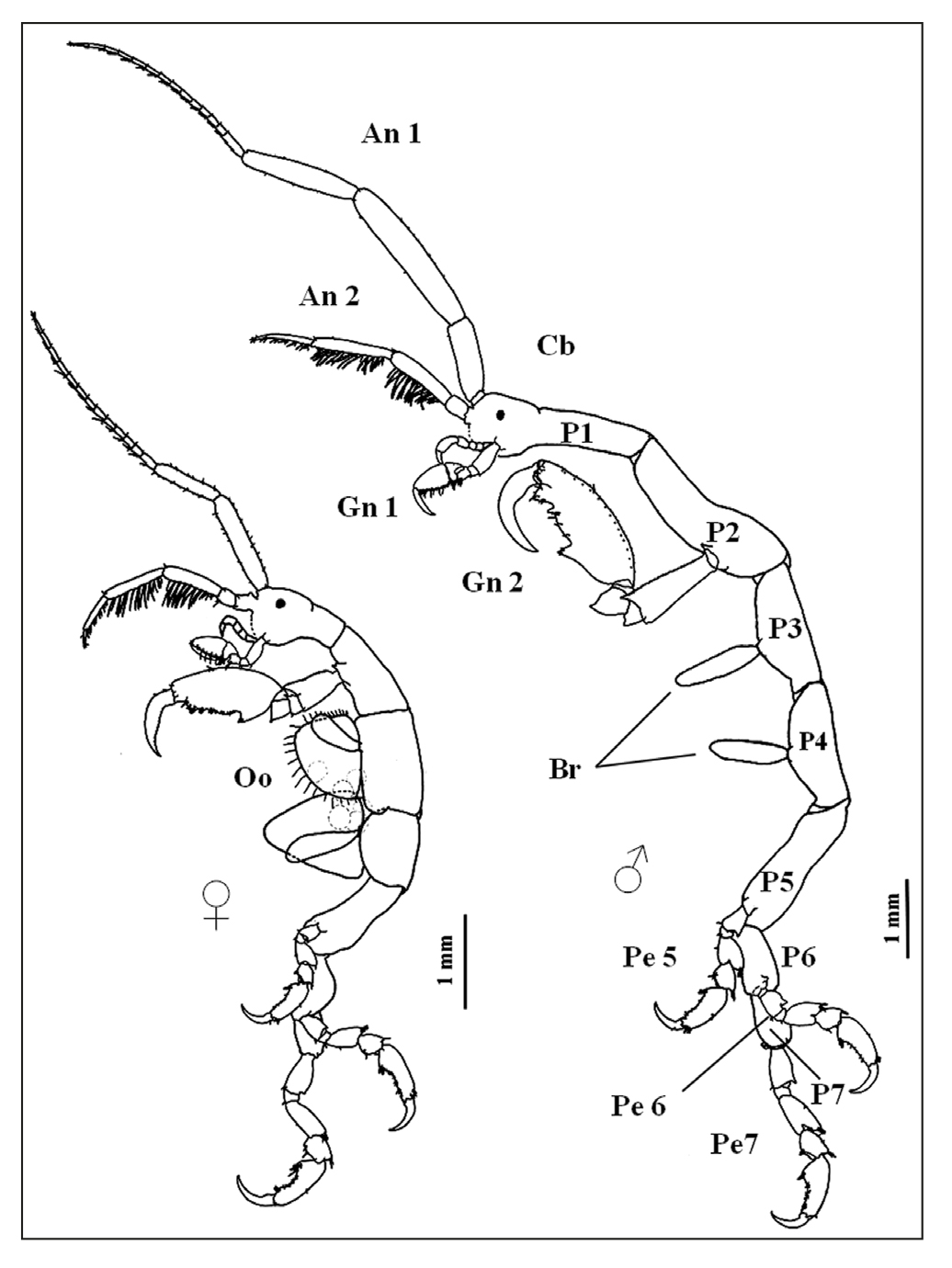
Figura 1 Morfología general de hembras y machos de caprélidos; vista lateral izquierda. An 1-2: Antena, Cb: Cabeza, Gn 1-2: Gnatópodo, P1-7: Pereonito, Pe 5-7: Pereiópodo, Oo: Oostegitos.
Importancia biológica. Son consumidores de diatomeas, detritus, pe queños crustáceos y microalgas, por lo que son considerados recicla dores de biomasa (Caine, 1979; Caine, 1991; Takeuchi & Hino, 1997; Woods, 2009; Alarcón-Ortega et al., 2012). Asimismo, son vectores en la transferencia de energía dentro de los ecosistemas al ser presas de crustáceos decápodos, cefalópodos y peces (Dauby et al., 2001; Guerra-García & Koonjul, 2005; Moreira et al., 2008; Woods, 2009).
Desde el punto de vista comercial son utilizados como alimento vivo para juveniles de peces y moluscos de cultivo, ya que alcanzan al tas densidades poblacionales, son de rápido crecimiento y de temprana maduración sexual, particularmente en ambientes con alto contenido orgánico (Pinczon du Sel et al., 2000; Guerra-García & Koonjul, 2005; Woods, 2009; Baeza-Rojano et al., 2010; Baeza-Rojano, 2012).
Adicionalmente, son considerados como bioindicadores de la ca lidad ambiental por su sensibilidad a contaminantes y tóxicos en el ambiente, incluso en condiciones abióticas extremas (Thomas, 1993; Guerra-García & Gómez, 2001; Woods, 2009). Además, son tolerantes a un amplio intervalo térmico (2-28ºC), tienen la capacidad de resistir condiciones de salinidad por debajo de los 19 ups, durante periodos cortos (Ashton et al., 2007) y pueden sobrevivir alrededor de 20 días sin alimento (Cook et al., 2007). Estas características les permiten dis tribuirse exitosamente en diferentes condiciones ambientales a lo largo de los océanos.
Hábitat. La morfológica de los caprélidos les ha permitido colonizar diferentes ecosistemas en un amplio gradiente de variables ambienta les (Caine, 1978) y en una extensa distribución latitudinal que incluye desde las zonas tropicales hasta los polos. En un gradiente batimétrico se les encuentra desde la zona intermareal hasta profundidades abi sales (4,970 m) (Laubitz & Mills, 1972; Moreira et al., 2008; Hendrickx & Ayón-Parente, 2014; Paz-Ríos et al., 2014). Los caprélidos estable cen asociaciones de protección, comensalismo, mutualismo y ecto parasitismo con la comunidad epibiótica (Vader, 1978; Caine, 1998). También se relacionan con anémonas (Vader, 1983), gorgonias (Lau bitz & Lewbel, 1974), equinodermos (Patton, 1968; Vader, 1978; Vol behr & Rachor, 1997) moluscos (Vader, 1972) y crustáceos decápodos (Griffiths, 1977; Martin & Pettit, 1998). Igualmente, se han encontrado en vertebrados como tortugas marinas (Aoki & Kikuchi, 1995), peces (Galván-Villa & Ayón-Parente, 2015) y cetáceos (familia Cyamidae) (Mc Cain, 1968; Margolis et al., 2000). Pueden ser encontrados aferrados a estructuras artificiales como boyas, cuerdas y cascos de barcos (Caine, 1987; Thiel et al., 2003; Astudillo et al., 2009; Ros et al., 2014; Alarcón-Ortega et al., 2015).
Alimentación. La mayoría de las especies son filtradoras, pues captan partículas en suspensión de la columna de agua al auxiliarse con las setas de sus antenas (Caine, 1974). Otras son carnívoras, que captu ran activamente crustáceos pequeños (p. ej. copépodos harpacticoides, gammáridos) o raspadoras, que ingieren principalmente detritus depo sitado sobre el sustrato (Caine, 1974; Guerra-García & Tierno de Figue roa, 2009; Alarcón-Ortega et al., 2012; Ros et al., 2014). De igual ma nera, en su dieta se encuentran hidroides, esponjas, algas y diatomeas (Keith, 1969; Caine, 1974; Guerra-García & Tierno de Figueroa, 2009; Alarcón-Ortega et al., 2012; Ros et al., 2014). No son consideradas especialistas, ya que algunas especies como C. grandimana (Mayer, 1882) y Paracaprella tenuis Mayer, 1903, modifican su dieta de acuer do con la disponibilidad de los recursos nutricionales (Guerra-García & Tierno de Figueroa, 2009).
La plasticidad de sus hábitos alimenticios, la asociación con sus tratos y sus estructuras corporales, como pereiópodos, gnatópodos y antenas, les permiten captar una mayor cantidad de alimento con el menor esfuerzo (Caine, 1974, 1978, 1979). Su presencia puede llegar a beneficiar al sustrato hospedero, como ejemplo, se tiene la asociación que existe con los hidroides, quienes proveen hábitat y alimento a cam bio de mantener alejados a los depredadores (Caine, 1998).
Ciclo de vida y reproducción. Su ciclo de vida es regularmente de un año y alcanzan la madurez sexual entre los 20 y 34 días de vida, con aproximadamente siete ciclos reproductivos en total (Baeza-Rojano & Guerra-García, 2013). Los machos poseen un par de penes en el séptimo pereonito y las hembras un par de poros genitales en el quinto. La cópula consiste en la introducción del par de penes y el depósito de esperma en los poros genitales. Posteriormente, la hembra transfiere los huevos (hasta 87) al interior de los oosteguitos y los incuba de tres a seis días (Heptner, 1963; Baeza-Rojano & Guerra-García, 2013). El desarrollo es de tipo directo, donde los caprélidos emergen del marsupio como juveniles con el mismo aspecto que un adulto, pero de menor tamaño y se aferran al sustrato que habitarán (Arimoto, 1976). Algunas especies presentan cuidado parental, donde los juveniles se aferran a la madre durante los primeros días de vida para recibir alimento y protección contra los de predadores (Thiel, 1997; Aoki, 1999). En otras especies el cuerpo de la madre es abandonado y los juveniles se sujetan rápidamente al sustrato (Aoki, 1999; Baeza-Rojano & Guerra-García, 2013).
MATERIALES Y MÉTODOS
El trabajo se centró en la búsqueda de información para el POT, región que comprende la costa del Pacífico de América, desde el sur de Baja California, México (~29ºN), hasta el norte de Perú (5ºS), con la inclusión de las islas Galápagos, Coco, Clipperton, Revillagigedo, Marietas, Ma rías e Isabel (Robertson et al., 2004). La búsqueda del material biblio gráfico se realizó con el buscador Google Scholar y en las bases de da tos Redalyc, Scielo, Science Direct e ISI Web, así como por referencias cruzadas. Sólo se incluyó material publicado entre 1903 y 2016. Con el objetivo de conocer la distribución de los estudios de caprélidos por subregiones en el POT, éste fue dividido en seis subregiones (García-Madrigal, 2007): A) Costa oeste de Baja California, B) Golfo de California, C) Pacífico central mexicano (de Nayarit a Michoacán), D) Pacífico sur mexicano (desde Guerrero hasta Chiapas), E) Centroamérica (Guate mala a Panamá) y F) Pacífico sureste tropical (de Colombia al norte de Perú) (Fig. 3).
RESULTADOS
Para el POT se documentaron 15 publicaciones sobre caprélidos, de las que siete citan nuevas especies y nuevos registros, cuatro presen tan listas de especies y cuatro mencionan aspectos ecológicos. Mayer (1903) fue quien realizó los primeros registros de especies de capré lidos para el POT: Caprella equilibra y C. ungulinaMayer, 1903. Casi cuatro décadas después, Shoemaker (1942) registró a C. scaura Tem pleton, 1836, en la costa este de Baja California Sur, México.
El primer registro de un caprélido abisal para el POT corresponde a Abyssicaprella galathaeMcCain, 1966, recolectado en Costa Rica (Mc Cain, 1966). Posteriormente, McCain (1967) describió a Paracaprella barnardi McCain, 1967, para Panamá. McCain & Steinberg (1970) rea lizaron una recopilación de los registros existentes anteriores al año de 1970, en la que señalan la presencia de C. californica Stimpson, 1856; C. equilibra, C. scaura y P. barnardi para el POT. En particular para el Pa cífico mexicano, Escobar-Briones & Winfield (2003) determinaron que su riqueza es de nueve especies, de las cuales tres corresponden a la familia Caprellidae (C. equilibra, C. scaura y C. californica) y seis a la fa milia Cyamidae. Para el Golfo de California, Brusca & Hendrickx (2005) realizaron una lista con la distribución de su macrofauna, e incluyeron a C. californica y C. equilibra. Posteriormente, García-Madrigal (2007) generó una relación de las especies del orden Amphipoda en el POT, en la cual incluyó seis especies de la familia Caprellidae: C. californica, C. equilibra, C. scaura, C. ungulina, P. barnardi y A. galathae.
Hasta el 2007 sólo se tenían seis registros de caprélidos para el POT. No obstante, en los últimos años algunos autores han contribuido al incremento del conocimiento del grupo en la región (Alarcón-Ortega et al., 2012; Hendrickx & Ayón-Parente, 2014; Ros et al., 2014; Alarcón-Ortega et al., 2015; Galván-Villa & Ayón-Parente, 2015; Sánchez-Moya no et al., 2015; Soler-Hurtado & Guerra-García, 2015).
En cuanto a su ecología, es poco lo que se ha generado. Alarcón-Ortega et al. (2012) registraron los hábitos alimenticios de C. equilibra, Aciconula acanthosoma, C. aff. penantis y Paracaprella sp., en la costa este de México. Por otro lado, para el Golfo de California, Hendrickx & Ayón-Parente (2014) determinaron dos nuevas especies de aguas profundas, Caprella calderoniHendrickx & Ayón-Parente, 2014, y C. mercedesae Hendrickx & Ayón-Parente, 2014. La primera asociada al erizo de mar Spatangus californicus H. L. Clark, 1917, y la segunda re colectada en hidroide. Asimismo, Sánchez-Moyano et al. (2015), en di ferentes zonas insulares del Pacífico central mexicano, registraron siete especies, donde cuatro fueron nuevas para la ciencia: A. acanthosoma; C. equilibra; C. mendaxMayer, 1903; Caprella pitu Sánchez-Moyano, García-Asencio & Guerra-García, 2014; Liropus isabelensis Sánchez-Moyano, García-Asencio & Guerra-García, 2014; Paracaprella carballoi Sánchez-Moyano, García-Asencio & Guerra-García, 2014 y P. isabelae Sánchez-Moyano, García-Asencio & Guerra-García, 2014.
Un aspecto importante sobre la distribución de los caprélidos son las especies consideradas como invasoras, como es el caso de la es pecie no-indígena Paracaprella pusilla, cuya localidad tipo es Río de Janeiro, Brasil, y ha sido registrada junto con C. equilibra en el Canal de Panamá (Ros et al., 2014). Actualmente, P. pusilla se ha encontrado asociada a muelles y estructuras marinas en la región del Pacífico cen tral mexicano (Alarcón-Ortega et al., 2015). Para las costas de Jalisco, México, Galván-Villa & Ayón-Parente (2015) describieron una nueva especie, Caprella suprapiscis Galván-Villa & Ayón-Parente, 2015, aso ciada al pez piedra Scorpaena mystes Jordan & Starks, 1895, siendo el segundo registro mundial que documenta este tipo de asociación. Recientemente para Ecuador, Soler-Hurtado y Guerra-García (2015) citaron la presencia de A. acanthosoma en asociación con gorgonias Leptogorgia obscura Bielshowsky, 1918 y Leptogorgia sp. (ver Tabla 1).
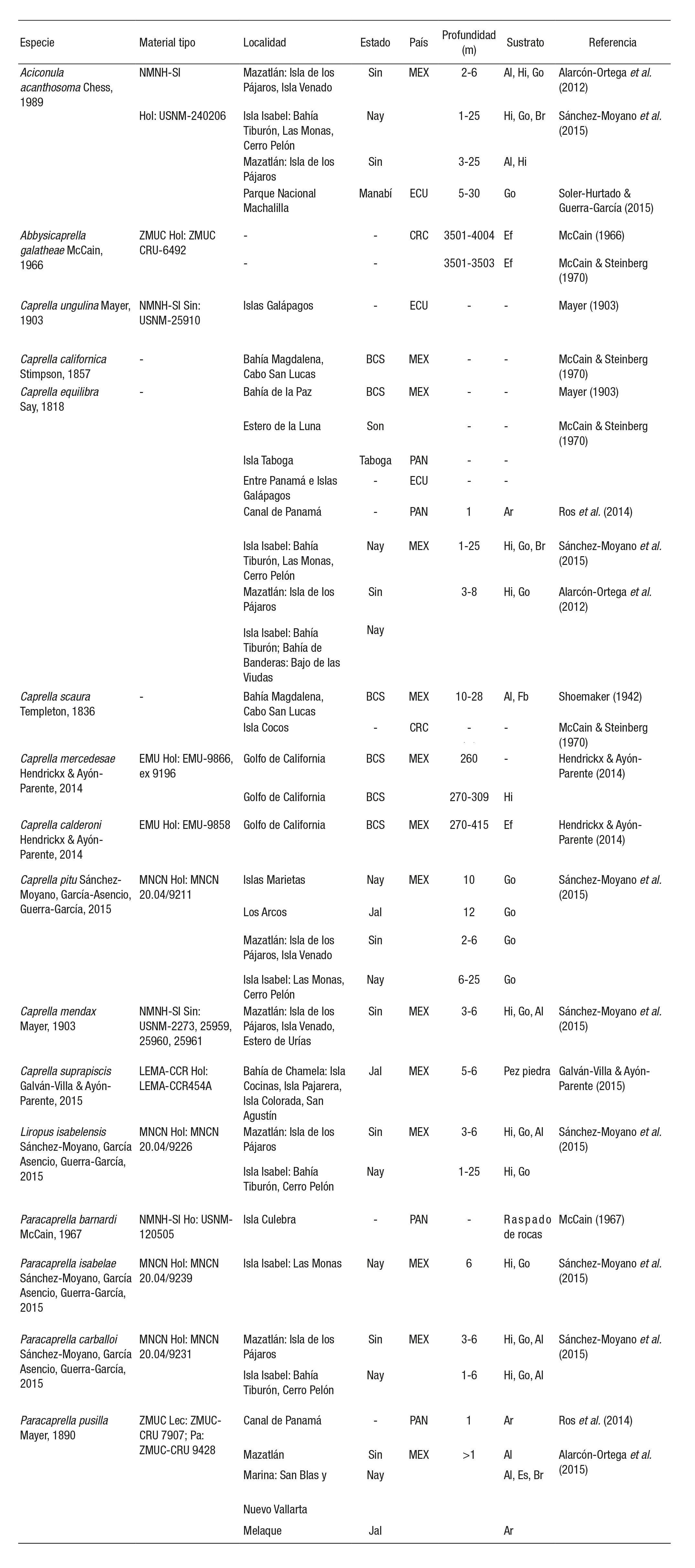
Tabla 1 Distribución de las especies de caprélidos registradas en el Pacífico oriental tropical; incluye la colección donde se encuentra el material tipo, localidades de recolecta, estado, país y tipo de sustrato en el que se recolectó. NMNH-SI: National Museum of Natural History, Smithsonian Institution, Whashington D.C.; ZMUC: Zoological Museum University of Copenhagen, Dinamarca; EMU: Colección Regional de Invertebrados Mari nos, Estación Marina Mazatlán, UNAM, Mazatlán, Sinaloa, México; MNCN: Museo Nacional de Ciencias Naturales de Madrid, España; LEMA-CCR: Laboratorio de Ecosistemas Marinos y Acuicultura, Universidad de Guadalajara, Zapopan, México. Hol: Holotipo; Sin: Sintipo; Lec: Lectotipo; Par: Paralectotipo. Sin: Sinaloa; Nay: Nayarit; Jal: Jalisco; BCS: Baja California Sur; Son: Sonora; MEX: México; ECU: Ecuador; PAN: Panamá; CRC: Costa Rica; Al: Alga; Hi: Hidrozoo; Go: Gorgonias; Es: Esponja; Ar: Arena, Br: Brozoo, Ef: Esqueletos de foraminíferos; Fb: Fondos blandos.
Consideraciones generales. En el POT se han registrado 16 especies dentro de cinco géneros. Caprella (nueve especies) y Paracaprella (cua tro especies) son los géneros más diversos. El POT contribuye con el 3.78% de las especies descritas en el mundo, las que principalmente se localizan en las subregiones del Golfo de California (nueve espe cies) y Pacífico central mexicano (ocho especies). Los estudios sobre el grupo son nulos en el Pacífico sur mexicano (Fig. 3); sin embargo, es importante reconocer que en la última década el esfuerzo de investiga ción se ha incrementado en un 50% (Fig. 2). No obstante, la información disponible sobre los caprélidos en esta región es limitada al compararla con otras regiones del mundo (Laubitz, 1970; Arimoto, 1976; Takeuchi, 1999; Winfield & Escobar-Briones, 2008; Guerra-García et al., 2012).
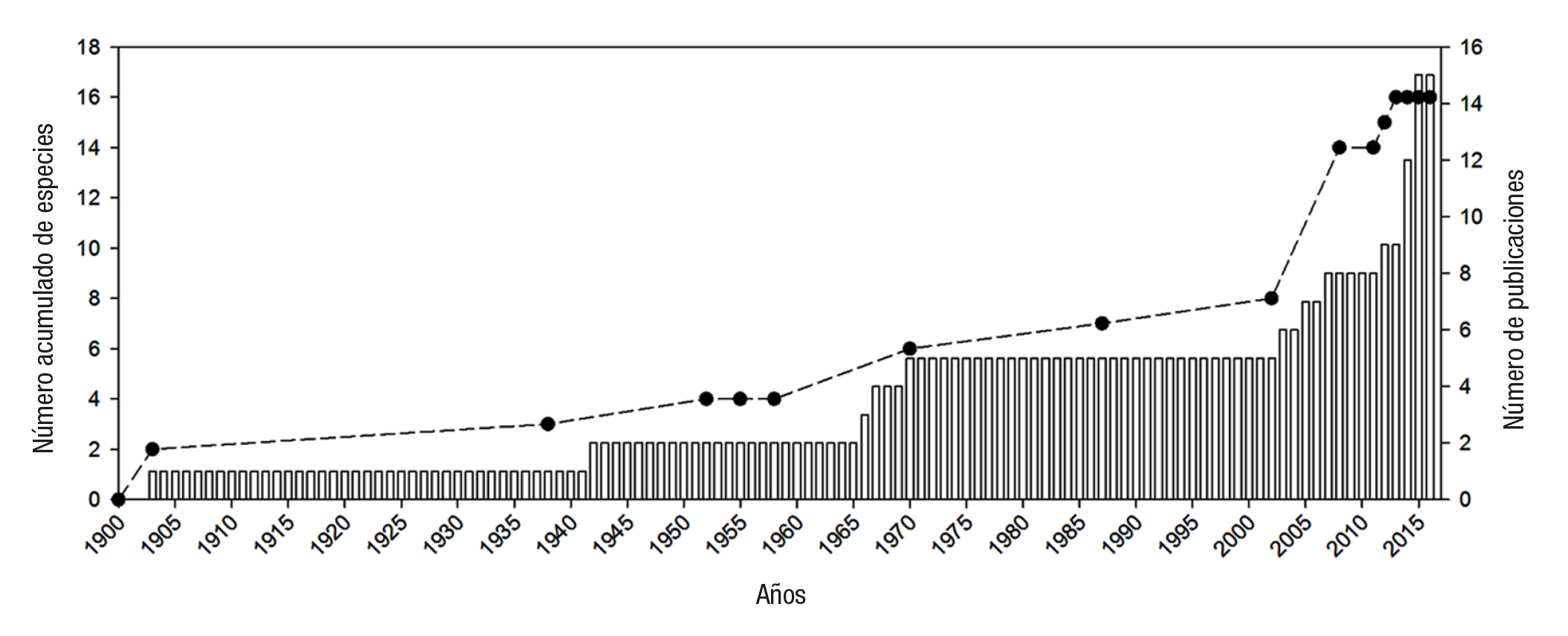
Figura 2 Número acumulativo de especies de caprélidos descritas (línea discontinua) y número de publicaciones (barras) para el Pacífico oriental tropical de 1903 a 2016.
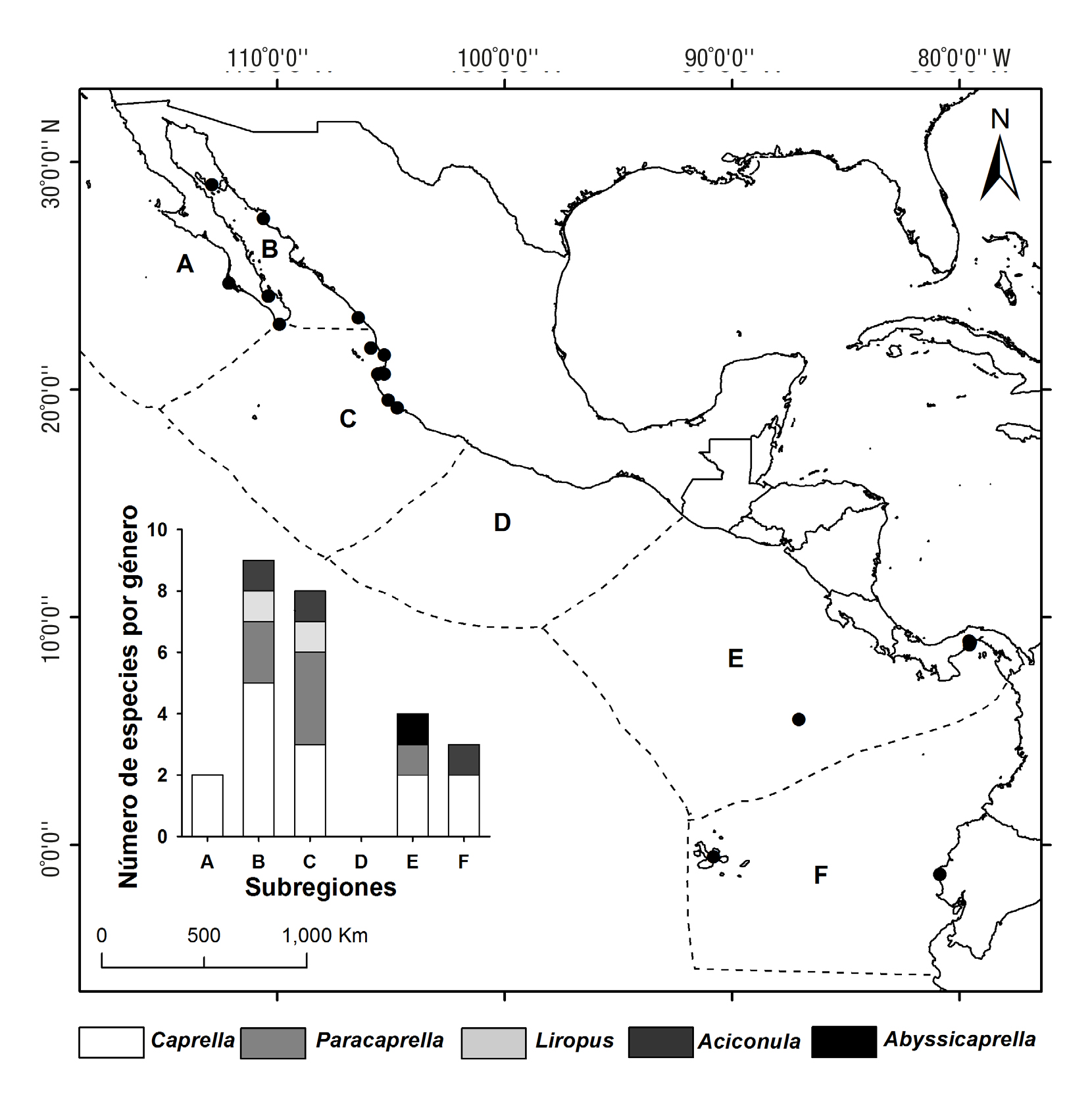
Figura 3 Distribución de la riqueza de especies de caprélidos a lo largo del Pacífico oriental tropical. Los círculos negros representan las localidades donde se han registrado caprélidos; la gráfica de barras representa el número de especies documentadas para cada género por subregión. A: Costa oeste de Baja California, B: Golfo de California, C: Pacífico central mexicano (de Nayarit a Michoacán), D: Pacífico sur mexicano (de Guerrero a Chiapas), E: Centroamérica (Guatemala a Panamá) y F: Pacífico sureste tropical (de Colombia al norte de Perú).
Por otro lado, las nuevas especies descritas fueron principalmen te para las subregiones Golfo de California (seis especies) (Hendrickx & Ayón-Parente, 2014; Sánchez-Moyano et al., 2015) y Pacífico Cen tral Mexicano (cinco especies) (Galván-Villa & Ayón-Parente, 2015; Sánchez-Moyano et al., 2015), pero escasas o con grandes vacíos de información en el resto de las subregiones (Fig. 3).
DISCUSIÓN
El POT pertenece a una de las provincias biogeográficas más diversas del mundo (Guzmán & Cortés, 1993). Presenta un alto nivel de conecti vidad ecológica y características oceanográficas complejas, derivadas de la convergencia de importantes corrientes marinas como la corrien te de California, Ecuatorial y la costera de Costa Rica (Kessler, 2006). La presencia de estas corrientes influye sobre las características am bientales como la temperatura, salinidad, disponibilidad de nutrientes y hábitat de la región (Hernández-Ayón, 2011); además, proporcionan las condiciones óptimas para el asentamiento y crecimiento de las poblaciones de caprélidos. Las condiciones oceanográficas influencia das por corrientes durante periodos largos (4-6 meses) de norte a sur y viceversa, ejercen un efecto en la dispersión de los caprélidos, los cuales pueden seguir el flujo superficial al utilizar medios físicos de dispersión como algas, hidroides y sustratos flotantes a la deriva (Thiel et al., 2003; Astudillo et al., 2009; Woods, 2009) que contribuye a la conectividad entre la región.
Otra condición importante en la distribución de los caprélidos es el evento “El Niño-Oscilación del Sur” (ENOS), tanto en su fase cálida (“El Niño”), como en su fase fría (“La Niña”). Estos fenómenos produ cen efectos, principalmente, en la productividad primaria de la cadena trófica de los ecosistemas marinos, afectando a los organismos depen dientes de su disponibilidad (Wang & Fiedler, 2006). Pocos estudios en caprélidos han correlacionado el efecto en sus abundancias durante eventos ENOS; no obstante, se ha observado que la abundancia dismi nuye durante “El Niño” e incrementa durante “La Niña”, principalmente debido a la respuesta de los grupos bentónicos a las fluctuaciones de la temperatura (Chess, 1989; Hosono, 2014). Debido a que estos even tos actualmente se presentan con una mayor frecuencia e intensidad (Wang & Fiedler, 2006; Lee & McPhaden, 2010), esta situación podría afectar el patrón de distribución y abundancia de algunas especies.
Además de su amplia línea de costa, el POT cuenta con islas oceá nicas de origen volcánico (Coco, Malpelo y Galápagos) que no presen tan conectividad con la plataforma continental. Esta característica au menta la importancia del estudio de los caprélidos, porque en las islas oceánicas es posible encontrar un alto número de especies endémicas (Whittaker & Fernández-Palacios, 2007). Por ejemplo, más del 80% de las especies de caprélidos se han documentado en zonas insulares co ralinas (Isabel, Marietas, Coco, Galápagos, entre otras) (McCain, 1967; McCain & Steinberg, 1970; Alarcón-Ortega et al., 2012; Galván-Villa & Ayón-Parente, 2015; Sánchez-Moyano et al., 2015) (Tabla 1).
Su morfología y la plasticidad en sus hábitos alimenticios les han permitido llegar a otros sitios distantes a su localidad de origen. Estas especies, llamadas invasoras, han logrado ampliar su distribución afe rrándose a estructuras artificiales marinas, muelles, cascos de barcos, agua de lastre y plásticos flotantes (botellas y boyas) (Thiel et al., 2003; Astudillo et al., 2009; Alarcón-Ortega et al., 2015). Tal es el caso de P. pusilla, especie originaria de Brasil (Mayer, 1890), que se ha encontra do en ecosistemas modificados como estructuras marinas y muelles, en tres subregiones del POT (Ros et al., 2014; Alarcón-Ortega et al., 2015). Es probable que estos sitios colonizados funcionen como puntos de distribución a otras localidades dentro del POT o más allá de éste (Alarcón-Ortega et al., 2015).
Por otro lado, la distribución batimétrica de este grupo está influen ciada por la interacción de la temperatura, profundidad, oxígeno disuel to, disponibilidad de hábitat y fuentes de alimento (Cook et al., 2007; Winfield & Escobar-Briones, 2008; Hendrickx & Ayón-Parente, 2013; Hosono, 2014). Los crustáceos peracáridos se distribuyen de manera estratificada con la profundidad y el tipo de sustrato (Sorbe, 1999), por lo que la composición específica y densidad de los caprélidos, dismi nuyen con el incremento de la profundidad y la distancia a la costa (Escobar-Briones et al., 1999; Winfield & Escobar-Briones, 2008; Paz-Ríos et al., 2014). Este patrón fue observado en el POT, donde las es pecies de caprélidos se encontraron principalmente en zonas someras (>1-30 m) asociadas a ecosistemas rocosos y coralinos, exceptuando a C. calderoni, C. mersedesae y A. galathae, que son caprélidos de aguas profunda y fondos blandos.
Podemos concluir que se requiere incrementar el esfuerzo de muestreo en la zona con la implementación de diferentes métodos de recolecta en los diferentes ecosistemas marinos, con el fin de determi nar cuáles son los hábitats donde potencialmente se pueden encontrar los caprélidos. Con esta información, se contará con elementos para plantear estudios específicos para conocer sobre la biología del grupo y su función ecológica en el POT. Asimismo, la experiencia en la de terminación taxonómica es fundamental para la identificación de los ejemplares, por lo que elaborar claves ilustradas, facilitará el trabajo de laboratorio y hará más eficiente la realización de estudios ecológicos. Por otro lado, promover la formación de redes de investigación espe cializadas en anfípodos caprélidos a lo largo del POT, permitirá generar bases de datos y la colaboración entre grupos de trabajo.
La mayor parte de la información disponible sobre caprélidos en el POT, corresponde a estudios taxonómicos o de distribución; por lo que su conocimiento en esta zona aún está en sus inicios, principalmente en subregiones como el Pacífico sur mexicano, Pacífico suroeste tro pical y Costa oeste de Baja California (Fig. 3). Por otro lado, el aumento en el conocimiento de los caprélidos en el POT durante los últimos años (Fig. 2), sugiere la posibilidad de que este número se incrementará en función de muestreos posteriores en la región. Esto, permitirá llenar los grandes vacíos de información y generará una línea base para futuras investigaciones que permitan mejorar las estrategias de manejo y con servación de los ecosistemas marinos.











 nueva página del texto (beta)
nueva página del texto (beta)


