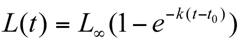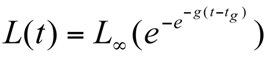INTRODUCCIÓN
La almeja chocolata (Megapitaria squalida, Sowerby 1835) se explota como un recurso pesquero en las costas del noroeste de México; se aprovecha principalmente como alimento al consumirse la pulpa (mús culos y vísceras), es comercializada entera-fresca y, en menor escala, sus valvas son utilizadas para la manufactura de artesanías (Castro-Ortiz et al., 1992; López-Rocha et al., 2010).
Su importancia para los pescadores radica en la gran demanda que tiene en el mercado regional, la capturan durante todo el año y funciona como un recurso alternativo cuando las especies de mayor valor comercial (e.g. camarón, langosta, abulón) no están disponibles debido a las regulaciones pesqueras como las vedas (Arellano-Martínez et al., 2006).
Su importancia fue reconocida por las autoridades pesqueras mexicanas en la Carta Nacional Pesquera (CNP), con una ficha especí fica (DOF, 2012); en las versiones anteriores de la CNP aparecía sola mente en el grupo de almejas en general. Los lineamientos de manejo establecidos en la CNP son: permisos de pesca, cuotas y talla mínima de captura (80 mm de longitud), pero la captura sólo está regulada en las costas de Baja California Sur y en la costa occidental del Golfo de California (aguas costeras de la península); en la costa oriental (aguas costeras del continente) no hay regulación explícita de la pesquería.
A pesar de su importancia social y comercial, se conoce poco sobre la edad y el crecimiento de esta almeja; el análisis de estos aspectos biológicos resulta necesario, ya que los métodos de evaluación de po blaciones requieren esencialmente de los parámetros de crecimiento individual y datos de composición por edades o tallas. El conocimiento de esta información es útil para analizar la respuesta poblacional que se puede esperar de la aplicación de diferentes estrategias de la admi nistración pesquera.
El método más común para estimar la edad en bivalvos consiste en examinar los anillos de crecimiento que se registran en algunas partes de las conchas, y pueden verse en la parte exterior (anillos externos) o ser analizados con el microscopio al hacer un corte a una valva, lo que se conoce como anillos internos (Arnold et al., 1998). El uso de las partes duras de moluscos bivalvos para determinar el crecimiento se conoce como esclerocronología y ha sido utilizada por muchos años (Davenport, 1938; Jones et al., 1989). Consiste en el análisis químico de los tejidos duros (conchas); se debe tomar en cuenta al ambiente como agente forzante para especificar una respuesta funcional como el crecimiento. De hecho, existe una gran variedad de bandas que se crean como respuesta a efectos del ambiente y que se forman en pe riodos que van desde horas hasta meses (Arnold et al., 1998), lo que las vuelve muy difíciles de interpretar. Las bandas anuales son relati vamente fáciles de identificar en almejas de concha dura (Arnold et al., 1998), como es el caso en la M. squalida. Lo que se percibe es una serie secuencial de bandas opacas alternadas con bandas traslúcidas que responden a épocas de crecimiento rápido y lento respectivamente. A cada par de estas bandas se le conoce como anillo de crecimiento y ha sido exitosamente analizado en una gran cantidad y variedad de estudios (para mayor detalle, consultar a Jones et al., 1989; Arnold et al., 1998). Estos anillos son anuales, sin embargo, lo que varía es la época en que se forma cada banda, es diferente entre especies, pero también para la misma especie en diferentes sitios geográficos, como es el caso de Mercenaria mercenaria (Linnaeus) en la costa Atlántica de los Estados Unidos (Jones et al., 1989; Arnold et al., 1998).
Tripp-Quezada (2008) analizó la edad y el crecimiento de M. squa lida en la Bahía de La Paz. A través del método de marcado-recaptura, validó que las bandas translúcidas corresponden a periodos invernales (cuando la temperatura es baja: 19 °C promedio en marzo) con un cre cimiento lento, y las bandas opacas se forman en verano y otoño. Por su parte Leyva-Vázquez (2015) encontró para esta misma especie, pero en la costa oriental del Golfo de California (Bahía de Navachiste, Sinaloa) que las bandas traslúcidas se forman de junio a octubre (verano-otoño). Lo anterior confirma que para M. squalida los anillos de crecimiento son anuales, no obstante, las épocas de lento crecimiento son diferentes en cada costa del Golfo de California, similar a lo encontrado en M. mercenaria (Jones et al., 1989; Arnold et al., 1998).
Las investigaciones más antiguas sobre el crecimiento de M. squa lida sólo mencionaron la ganancia en talla durante el periodo de estudio (Baqueiro-Cárdenas & Stuardo, 1977; Singh-Cabanillas et al., 1991). En los trabajos realizados por Castro-Ortiz et al. (1992) y Schweers et al. (2006), se estimaron los parámetros de crecimiento con el modelo de von Bertalanffy (MCVB).
A partir del trabajo de Katsanevakis (2006), el uso de la teoría de la información y modelos múltiples se ha consolidado como una op ción mucho más aceptada en los estudios de crecimiento individual. Al realizar una revisión de los artículos de crecimiento publicados des pués de esa fecha se observa un incremento en la implementación de este modelo, el cual también se ha utilizado en otros moluscos bivalvos (Aragón-Noriega, 2013; Aragón-Noriega et al., 2015; Chávez-Villalba & Aragón-Noriega, 2015). Las alternativas más comunes al MCVB son el modelo de crecimiento de Gompertz y el modelo logístico, entre mu chos otros.
Por lo anterior, el objetivo del presente trabajo fue obtener los pa rámetros de crecimiento individual de M. squalida para una población de la costa oriental del Golfo de California con un enfoque de múltiples modelos.
MATERIALES Y MÉTODOS
Recolecta de almejas. Los ejemplares de M. squalida fueron reco lectados en la costa oriental del Golfo de California, específicamente en el sitio conocido como Yavaros, Sonora (26º 36´-26º 48´ N y 109º 42´-109º 18´O). En la zona se practica la pesca de autoconsumo de esta especie, y en algunas épocas del año la captura es para proveer el mercado local, por lo que aún no existe una pesca comercial. Las alme jas fueron recolectadas mediante buceo autónomo a una profundidad de dos a cuatro metros, en los meses de marzo y abril de 2015, por un buzo técnico no comercial. Cada almeja fue medida y pesada entera, se limpiaron las valvas y se asignó un número de identificación para su posterior conteo de anillos de crecimiento para determinar su edad.
Determinación de la edad. Primeramente se midió la longitud de con cha (LC), esto es, la distancia entre el punto posterior y anterior de la almeja (Fig. 1). Además, se midió la altura de concha (AC): la distancia entre el umbo y la parte ventral de la concha. Se estimó la relación entre AC y LC, pero para el cálculo de los parámetros de crecimiento su usó el dato de LC. Posteriormente, se determinó la edad en el labora torio mediante el conteo de anillos de crecimiento, cada par de bandas (traslúcidas y opacas) se consideró como un año de edad. Las bandas fueron observadas al colocar cada valva a través de una fuente de luz intensa (Fig. 1), siguiendo el método descrito por Tripp-Quezada (2008) y Leyva-Vázquez (2015), ya que ellos validaron la formación anual de anillos de crecimiento. Por consistencia se tomó el primer anillo como representante de un año de edad en cada concha y la estructura de edad se construyó de acuerdo con ello.
Modelos de crecimiento. Se seleccionaron tres modelos que se ajus taron a los datos de longitud para la edad, el MCVB, el modelo de Gompertz y el modelo logístico, de acuerdo con las siguientes ecuaciones:
MCVB:
Modelo logístico:
Modelo de Gompertz:
Para todos estos modelos los parámetros evaluados se describen como:
L(t) |
longitud para la edad t (mm) |
t |
edad (años) |
L∞ |
longitud asintótica (mm) |
k |
coeficiente de crecimiento (unidades de año-1) |
t0 |
edad hipotética a la cual la longitud del organismo es cero (unidad año) |
k2 |
tasa relativa de crecimiento (unidades de año-1) |
t* |
punto de inflexión de la curva sigmoidea (unidad año) |
tg |
es λ/g |
λ |
es la tasa de crecimiento relativa inicial teórica a la edad cero (unidades de año-1) |
g |
es la tasa de decaimiento exponencial de la tasa de creci miento relativa (unidades de año-1) |
Los datos se ajustaron a cada uno de los diferentes modelos de crecimiento antes mencionados con la función de máxima verosimi litud:
Donde θ representa los parámetros de los modelos, y 𝜎 repre senta las desviaciones estándar de los errores calculados usando la siguiente ecuación:
Decisión del mejor modelo. La selección del mejor modelo se llevó a cabo con base en el criterio de información de Akaike (AIC), según Burnham & Anderson (2002). El modelo con el menor valor de AIC (AICmin) fue el seleccionado como el mejor. AIC=-2LL+2θ; donde: LL es la verosimilitud logarítmica, θ es el número de parámetros en el modelo. Posteriormente, se calcularon, para los tres modelos las diferencias entre los AICi de cada uno y el AICmin; Δi = AICi-AICmin. Y con esto se jerarquizaron los modelos (se aclara que el mejor modelo, que tiene el AICmin, tiene un Δi = 0). Luego a cada modelo se le calculó la ponderación o plausibilidad (el peso de la evidencia a favor del modelo i) a través de la “ponderación del AIC” como se describe a continuación:
Intervalos de confianza. Se determinaron los intervalos de confianza con base en los perfiles de verosimilitud y la distribución x 2 (Venzon & Moolgavkar, 1988). El intervalo de confianza se definió como todos los valores de θ que satisfacen la siguiente desigualdad:
Donde L(Y|(θbest) es la log verosimilitud del valor más probable de θ y x21,1-α es el valor de x 2 con un grado de libertad al nivel de confianza 1-α. Así, el intervalo de confianza al 95% de θ abarca todos los valores de θ que son dos veces la diferencia entre la log verosimilitud de un θ dado y la log verosimilitud de la mejor estimación de θ que sea menor que 3.84. Para obtener el intervalo de confianza de dos valores conjuntos (en este caso L∞ y k) y evitar el problema de la correlación del parámetro, se debe satisfacer la desigualdad asociada con la distribución con dos grados de libertad, donde el valor de referencia es menor de 5.99 para dos parámetros (Cerdenares-Ladrón de Guevara et al., 2011).
RESULTADOS
En total se analizaron 719 individuos de M. squalida. La talla mínima fue de 33 mm LC y la máxima de 104 mm LC, con un promedio de 68.9±10.2 mm LC, CV 14.8%. La figura 2 muestra que la mayor fre cuencia (24%) correspondió a la talla de 75-80 mm LC. El segundo intervalo más abundante es el de 70-75 mm LC (20%), el tercer grupo presentó una frecuencia del 16% y estuvo compuesto por los organis mos de 65-70 mm LC.
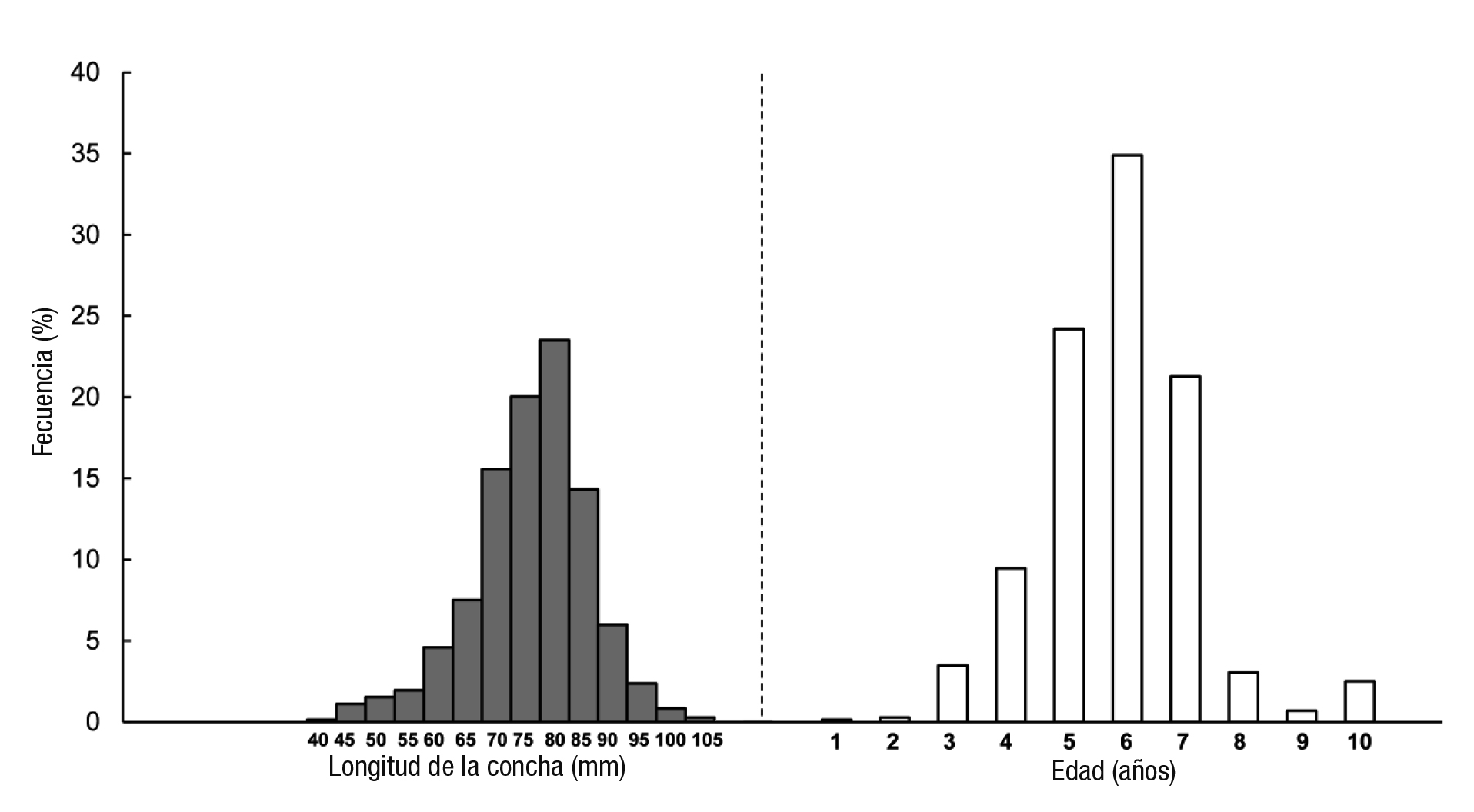
Figuras 2a-b Estructura de tallas (a) y edad (b) de Megapitaria squalida de las costas de Yavaros, Sonora.
Las marcas de crecimiento que se apreciaron en la parte exterior de la concha resaltaron al colocarlas sobre una fuente de luz intensa (Fig. 1). Las marcas opacas se observaron de un color café oscuro y las marcas traslúcidas adquirieron un color naranja. El primer par de bandas opacas y traslúcidas fueron tomadas como año 1 de edad y así se construyó la estructura de edad. Los tres lectores coincidieron al 100% en contar la misma cantidad de bandas en cada concha. Se en contraron organismos con una edad mínima de 1 año y máxima de 10 años, con un promedio de 6±1, CV 22.9%. Los organismos de 6 años representaron el 35%, los de 5 años, el 24% y los de 7 años, el 21% (Fig. 2). Estos datos representan el 80% de las edades encontradas, lo que da una apariencia de una estructura unimodal de la población.
Los parámetros estimados para generar cada una de las curvas de crecimiento con los valores de longitud para la edad de M. squalida de Yavaros, Sonora, de los tres modelos aplicados, se presentan en la Tabla 1. El modelo logístico resultó ser el mejor para describir el creci miento individual de los organismos de M. squalida de la costa oriental del Golfo de California (Tabla 1); incluso su valor de ponderación de Akaike (Wi) es muy alto (92.4%). La jerarquización de los otros dos mo delos ubicó a Gompertz en segundo lugar y al MCVB en último. El valor de Δi del modelo de Gompertz fue de 5 por lo que, siguiendo el criterio de inferencia multimodelo, puede ser empleado para describir el cre cimiento individual de la población en estudio, pero la Wi calculada fue de 7.6 %. El MCVB no se debe utilizar para describir el crecimiento M. squalida, ya que con el valor de Δi no tiene soporte y debe descartarse.
Tabla 1 Parámetros de crecimiento obtenidos por diferentes modelos para M. squalida de las costas de Yavaros, Sonora. También se muestran los valores de AIC, Δi, Wi.

AIC = criterio de información de Akaike. Δi = diferencia de los valores de AICi respecto del valor mínimo de AIC en los modelos puestos a prueba. Wi. = Ponderación de Akaike.
La curva generada con el MCVB se presenta en la figura 3a y el intervalo de confianza para el valor de L∞ se observa en la figura 3b con valores que van de 90.5 a 92 mm LC. El intervalo de confianza para k fue de 0.243-0.251 año-1 (Fig. 3c). Los contornos de verosimilitud para los parámetros L∞ y k se presentan en la figura 3d. La curva de crecimiento ajustada con el modelo Gompertz (Fig. 4a) con un intervalo de confianza para L∞ fue de 89.5-90.7 mm LC (Fig. 4b). El intervalo de confianza de k fue de 0.312-0.324 año-1 (Fig. 4c). Los contornos de verosimilitud para los parámetros L∞ y k se exponen en la figura 4d. La figura 5a presenta la curva ajustada del modelo Logístico con una longitud asintótica (L∞) menor de los tres modelos utilizados (85.5 mm LC) y el intervalo de confianza de 85-86.17 mm LC (Fig. 5b), mientras para el valor de k fue de 0.43-0.46 año-1 (Fig. 5c). Los contornos de verosimilitud para los parámetros L∞ (82-89 mm LC) y k (0.37-0.53 año-1) aparecen en la figura 5d. Se aprecia que cuando se obtienen contornos, el intervalo de cada valor es más amplio que cuando se calculan individualmente.
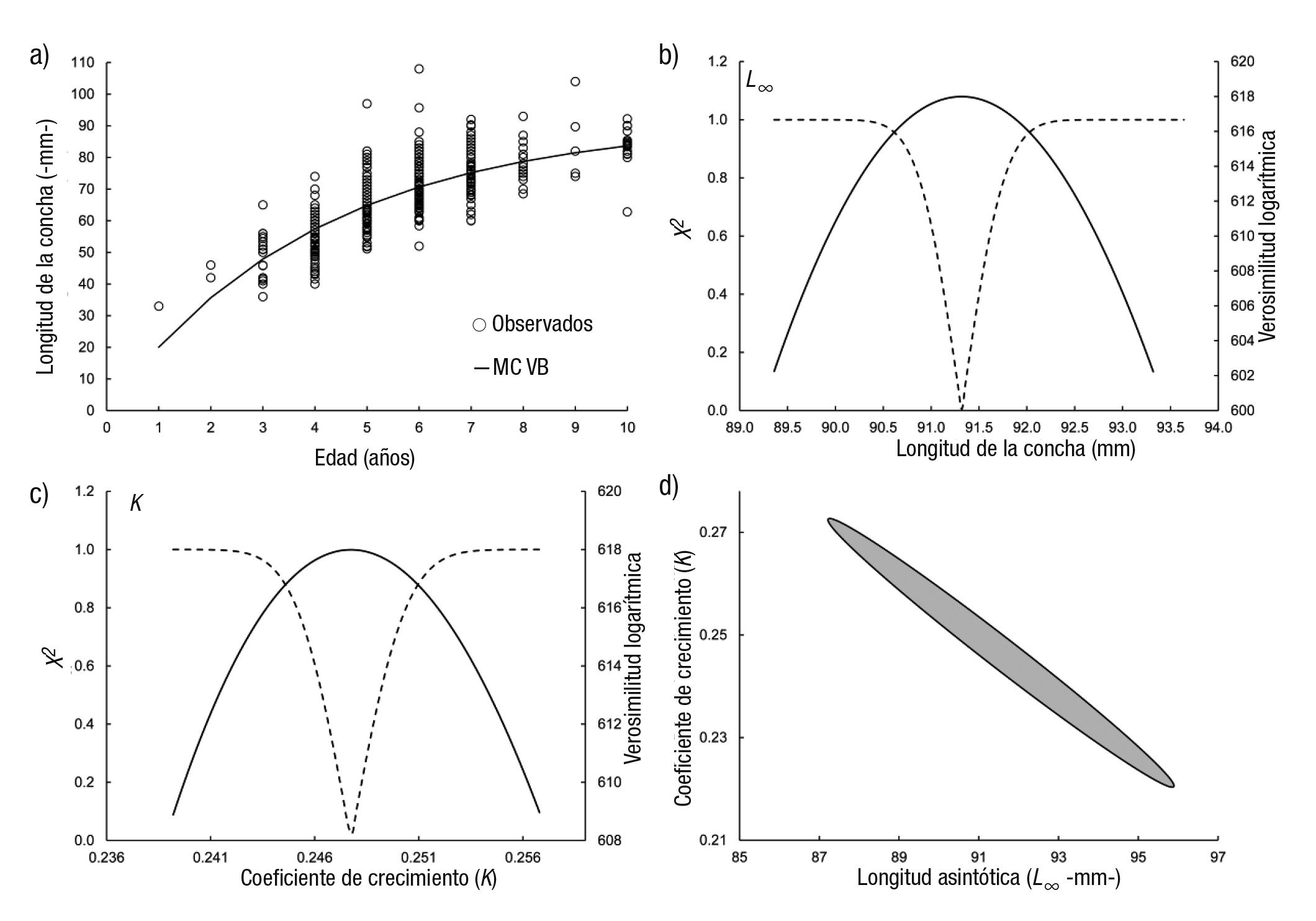
Figura 3a-d Curva de crecimiento del modelo de von Bertalanffy ajustado a los datos de longitud para la edad de Megapitaria squalida: a) modelo, b) perfil de verosimilitud del parámetro L∞, c) perfil de verosimilitud del parámetro k, d) contorno de verosimilitud para los parámetros L∞ y k. El área en negro representa los intervalos de confianza conjuntos.
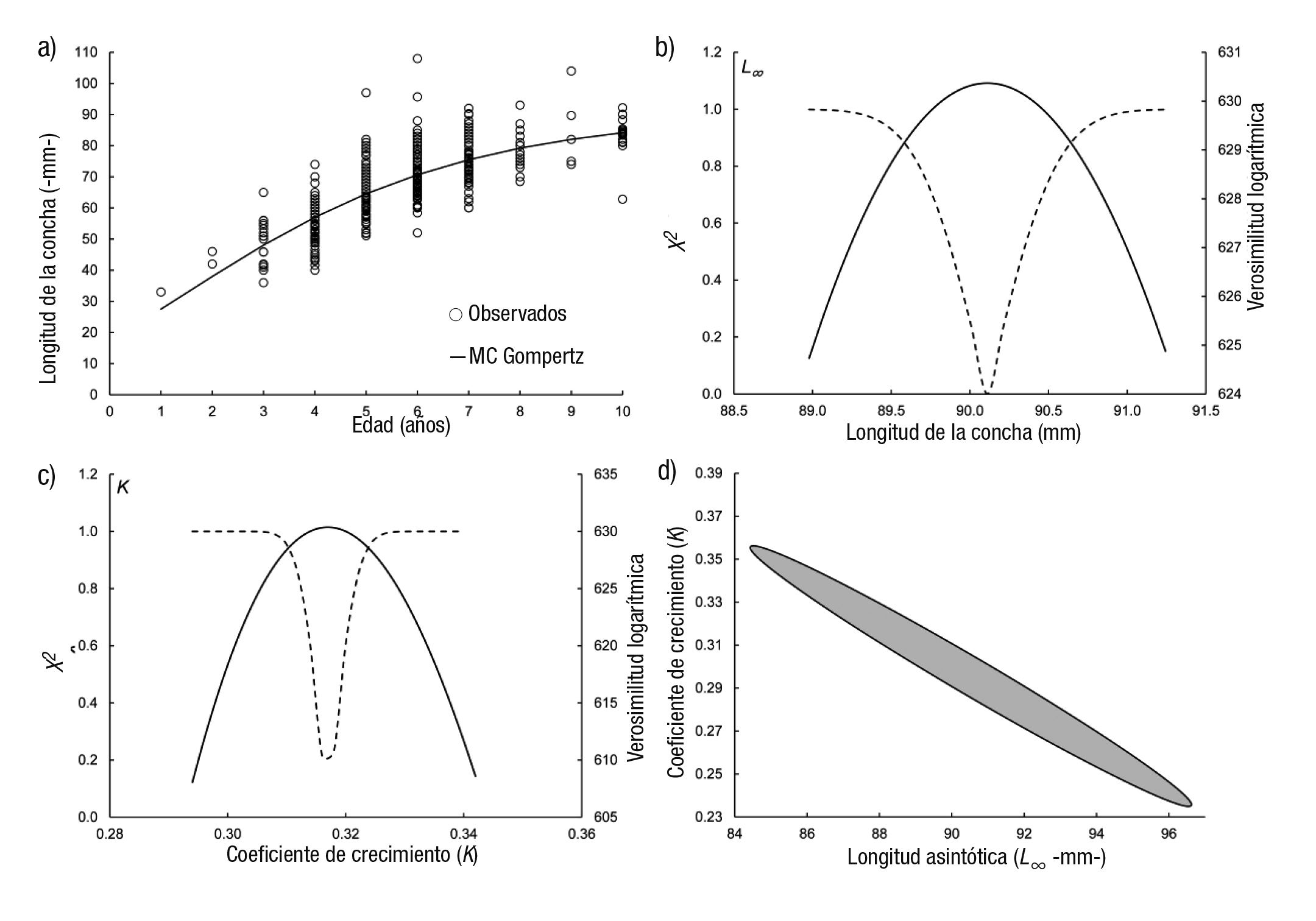
Figuras 4a-d Curva de crecimiento del modelo Gompertz ajustado a los datos de longitud de la edad de Megapitaria squalida: a) modelo, b) perfil de verosimilitud del parámetro L∞, c) perfil de verosimilitud del parámetro k, d) contorno de verosimilitud para los parámetros L∞ y k. El área en negro representa los intervalos de confianza conjuntos.
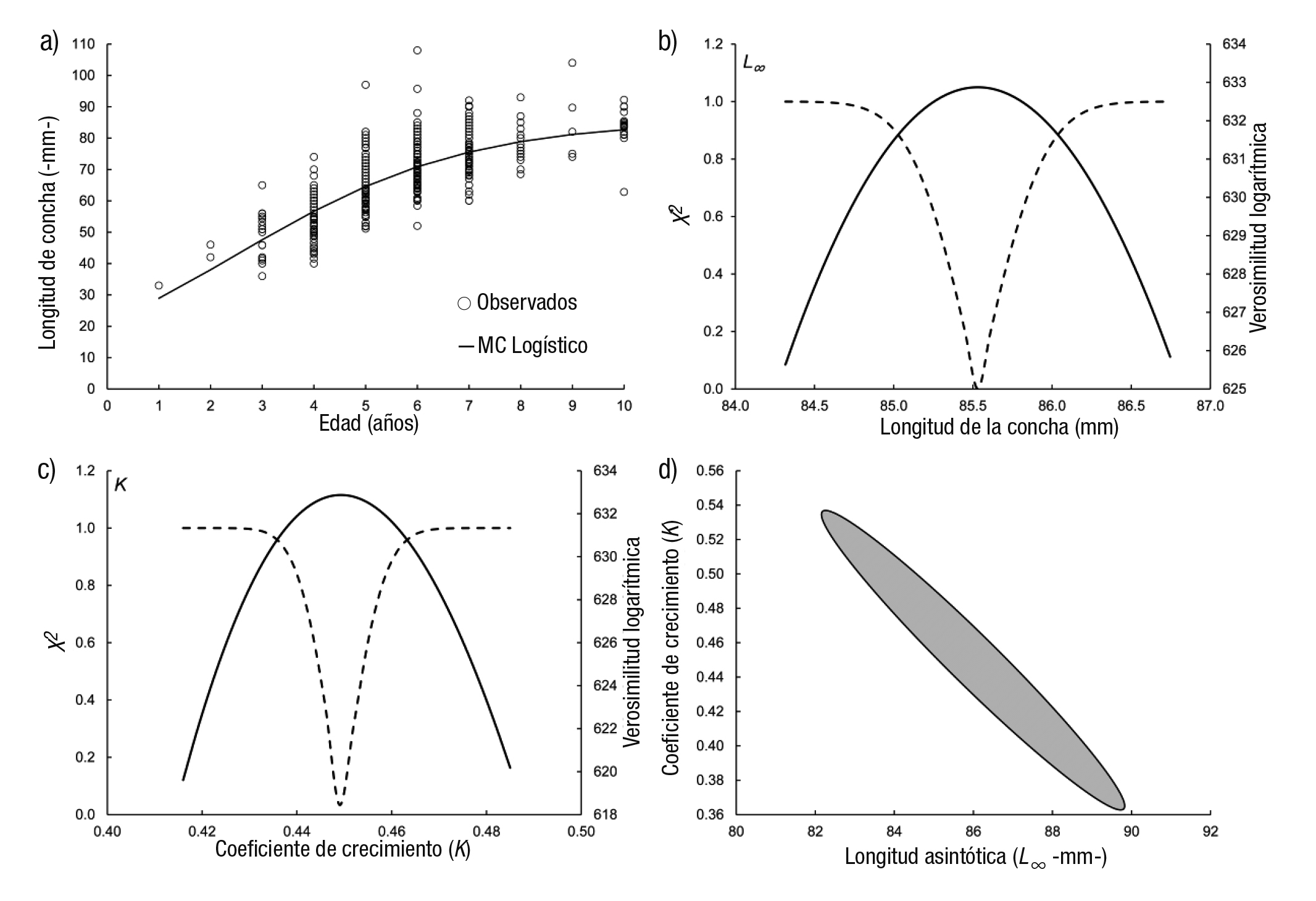
Figuras 5a-d Curva de crecimiento del modelo logístico ajustado a los datos de longitud para la edad de Megapitaria squalida: a) modelo, b) perfil de verosimilitud del parámetro L∞, c) perfil de verosimilitud del parámetro k, d) contorno de verosimilitud para los parámetros L∞ y k. El área en negro representa los intervalos de confianza conjuntos.
Finalmente se presenta la relación entre las variables LC y AC (Fig. 6), que resultó lineal y con un coeficiente de determinación superior al 0.8.
DISCUSIÓN
Aunque las poblaciones de M. squalida del Golfo de California son el objeto de una pesquería que crece rápidamente (López-Rocha et al., 2010), y la comprensión de los parámetros de crecimiento de la pobla ción se hace necesaria para desarrollar estrategias de aprovechamien to sostenibles, sólo hay tres documentos científicos que abordan este tema (Castro-Ortiz et al., 1992; Tripp-Quezada, 2008; Leyva-Vázquez 2015). Sin embargo, para deducir los parámetros de crecimiento se requiere de pares de datos de edad-longitud, por lo que el principal reto radica en la correcta interpretación de la edad. La validación de la edad, definida como la periodicidad con que se forman los anillos de crecimiento, se vuelve crucial. Anualmente la formación de anillos de crecimiento, ligada a la temperatura, se ha observado en otras almejas que habitan en aguas poco profundas como M. mercenaria (Jones et al., 1990, Arnold et al., 1991) o Macoma balthica (Linnaeus) (Beukema et al., 1985). La baja temperatura que causa inhibición del crecimien to en M. mercenaria fue aludido como patrón clásico por Jones et al. (1990), pero sostiene que las diferencias geográficas en este patrón bá sico parecen tener un componente latitudinal. Tanto para M. mercenaria como para M. balthica, la banda traslúcida se deposita en invierno en latitudes norteñas y en verano en latitudes sureñas (Arnold et al., 1998). Algo similar parece ocurrir con M. squalida del Golfo de California, el crecimiento lento sucede en invierno, en la costa peninsular y en la costa continental sobreviene en verano-otoño. Una posible explicación es la cantidad de alimento disponible, según Lluch-Cota et al. (2007) las surgencias, ricas en nutrientes, se presentan en verano-otoño en la costa peninsular y en invierno-primavera, en la costa continental, lo que coincide con los periodos de mayor crecimiento (banda opaca) en cada sitio. Arnold et al. (1998) destacan que aunque a la temperatura se le atribuye la influencia directa e indirecta sobre la depositación de las bandas traslúcidas, otro factor ambiental es la cantidad de alimento.
Con los estudios previos que validaron la formación de anillos anuales de crecimiento en M. squalida del Golfo de California (Tripp-Quezada, 2008; Leyva-Vázquez 2015) se da certeza de que los anillos de la misma especie, pero en la zona de Yavaros, son anuales, indepen dientemente de que la depositación de las bandas opacas o traslúci das sean en épocas distintas para cada costa del Golfo de California. El objetivo del trabajo no es captar información sobre los periodos en que se depositan las bandas traslúcidas u opacas, sino conocer los parámetros de crecimiento a partir de la interpretación de los anillos de crecimiento anuales, esto último usado en esta investigación para determinar pares de datos edad-longitud que pudieran utilizarse en el modelado de crecimiento individualLas edades encontradas superan a las previamente registradas debido a que en el sitio de muestreo se obtuvieron organismos de 1 a 10 años y los estudios previos habían reportado a un organismo de 7 años como el más longevo (Castro-Ortiz et al., 1992; Tripp-Quezada, 2008). Esta estructura de edades posible mente se relacione con la actividad pesquera, ya que en la costa orien tal del Golfo de California la pesca de almeja chocolata es incipiente y en la costa de la península de Baja California los volúmenes de captura superan anualmente las mil toneladas y tiene más de tres décadas de explotación (López-Rocha et al., 2010). Además, la regulación pesquera prohíbe la extracción de organismos menores a 80 mm, esto hace pen sar que la actividad pesquera ha capturado a organismos grandes y por tanto con edades mayores. Por otro lado la zona de captura (intermareal u submareal) también parece influir en las estructuras de edades que se han registrado en diferentes zonas. Tanto en las investigaciones de Castro-Ortiz et al. (1992), Tripp-Quezada (2008) como en este estudio, se hicieron las recolectas de almejas en el submareal con las eda des arriba comentadas, pero Schweers et al. (2006) y Leyva-Vázquez (2015) lo hicieron en el intermareal y los ejemplares más longevos no superaron los 5 años.
Cuando se analizan los parámetros de crecimiento de moluscos bivalvos la longitud asintótica es uno de los más citados, por lo que es importante destacar la parte de la concha en donde se ha realizado la medición para estimar dicho parámetro. En cinco estudios (Castro-Ortiz et al., 1992; Arellano-Martínez et al., 2006; Schweers et al., 2006; Tripp-Quezada, 2008; Leyva-Vázquez, 2015), donde se calculó la lon gitud asintótica para M. squallida, se usó la longitud de concha (LC) como se describe en la sección de material y métodos (Fig. 1). Salvo el de Arellano-Martínez et al. (2006), los otros cuatro resaltan de manera explícita que la medición es de la parte posterior a la anterior de la almeja, pero se entiende que usa LC no sólo porque así la menciona, sino porque aplica valores de Castro-Ortiz et al. (1992) para su propio análisis. Lo anterior se vuelve importante, puesto que autores como Sephton & Bryan (1990), quienes examinaron el crecimiento de Spisula solidissima (Dillwyn, 1817), utilizan el término LC, pero aclaran que la medición es la realizada desde el umbo a la parte ventral de la concha, lo que se conoce como altura de concha (AC) (Fig. 1). Hashiguchi et al. (2014), en su investigación de crecimiento de Meretrix lusoria (Roeding, 1798), usan el término LC, pero no hace referencia a la forma en que lo obtuvieron. En especies como M. mercenaria, M. campechiensis, M. balthica y M. arenaria, se ha usado la altura de concha (AC) para ave riguar los parámetros de crecimiento, y explícitamente se destaca que se midió desde el umbo a la parte ventral de la concha (Beukema et al., 1985; Jones et al., 1990; Arnold et al., 1991, 1998; Henry & Nixon, 2008; Ridgway et al., 2011). En otros estudios similares, se calcularon tanto AC como LC y aunque se destaca haber utilizado AC para conse guir los parámetros de crecimiento, se hace énfasis en la relación lineal entre estas dos variables. El resultado es similar al de este trabajo de investigación con M. squallida. Quizás lo más importante es resaltar que LC es tan válida como la AC para modelizar el crecimiento y no que una sea mejor que la otra.
En el presente trabajo la máxima longitud asintótica estimada fue 91.3 mm LC con el MCVB y en segundo lugar fue 90.1 mm, resultado alcanzado con el modelo de Gompertz. Estos valores estan fuera del intervalo encontrado para M. squalida en las costas de Baja California Sur, tanto del Golfo de California como del océano Pacífico, donde se encontró una longitud asintótica de 80.9 a 86.2 mm (Castro-Ortiz et al., 1992; Schweers et al., 2006; Tripp-Quezada, 2008). Sin embargo, con el modelo seleccionado como el mejor por el AIC (modelo Logístico) se obtuvo una L∞ dentro de los límites encontrados previamente. Este resultado realza la importancia del estudio con un enfoque de modelos multiples, de la misma forma que Schäffer & Zettler (2007) lo reporta ron para Mya arenaria Linnaeus, 1758, pues ellos emplearon Gompertz (L∞ = 62.6 mm) y MCVB (L∞ = 87.4 mm) y concluyeron que este mo delo fue el mejor para describir el crecimiento. La diferencia que ellos econtraron con cada modelo supera los 24 mm, y de allí la importancia de no aplicar solamente el MCVB como única alternativa.
Es importante apuntar que los parámetros de crecimiento de una especie en particular pueden tener diferentes valores de acuerdo con su distribución geográfica y también cohortes que pueden crecer de forma diferente según las condiciones ambientales (Sparre & Venema, 1995). En particular, con M. squalida, se tiene un resultado que re marca el efecto de los microhábitat, ya que Castro-Ortiz et al. (1992) estimaron valores de L∞ de 80.99 y 86.20 en Bahía Concepción, pero en dos sitios distintos. Otra posible explicación radica en lo encontrado por Anguas-Vélez y Castro-Ortiz (1990), quienes concluyen que para esta especie pudieran existir al menos dos ecotipos en la misma costa occidental del Golfo de California.
En el presente estudio los parámetros de crecimiento calculados con el MCVB tienen una marcada diferencia con los de Castro Ortiz et al. (1992), para la misma especie, en Bahía Concepción, donde: L∞= 80.99 mm LC, una k de 0.551 año-1 y la t0 de -0.023. Los resultados de Tripp-Quezada (2008), en Bahía La Paz, fueron: L∞ de 81.97 mm LC, k de 0.488 año-1 y t0 de -0.097; si se comparan esos valores con la presente investigación se tiene: L∞ de 91.31 mm LC, k de 0.247 año-1 y t0= 0, que expresa una diferencia entre los valores determinados, específicamente respecto al valor de k reportado por Castro-Ortiz et al. (1992), que significa una mayor rapidez de crecimiento que la observa da en este estudio. Schweers et al. (2006) obtuvieron como resultado L∞ de 83.00 mm LC y la k de 0.655 año-1 en Bahía Magadalena, pero con organismos menores a 60 mm LC. La posible explicación para un valor alto de k es que trata de organismos que están en su fase rápida de crecimiento en comparación con lo reportado aquí, donde se en contraron organismos de hasta 104 mm LC y 10 años de edad. Pero ahora es necesario mencionar que Castro-Ortiz et al. (1992) también evaluaron parámetros de L∞ (86.2 mm) y k (0.15 año-1) en organismos con una estructura de tallas de 7 a 89 mm LC y un intervalo de edad de 1-7 años.
Estudios anteriores estimaron los parámetros de crecimiento de la almeja chocolata en otras regiones utlizando un algoritmo basado en el método de cuadrados mínimos (Castro-Ortiz et al., 1992; Schweers et al., 2006; Tripp-Quezada, 2008). Aquí, en su lugar, se aplicó como cri terio la máxima verosimilitud, que representa una mejor solución para estimar adecuadamente los parámetros de los modelos de crecimiento individual (Katsanevakis, 2006), además de ser una prueba más ro busta. La selección de modelos basada en la teoría de la información ha sido recomendada como una alternativa mejor que los enfoques tradicionales (Katsanevakis, 2006; Cerdenares-Ladrón de Guevara et al., 2011; Aragón-Noriega et al., 2015). La ventaja de emplear el AIC es que los modelos pueden ordenarse jerárquicamente, según se ajuste a los datos, y pueden valorarse los parámetros promedio para un mo delo, en este caso de crecimiento individual. Sin embargo, el parámetro promedio deseado, como la longitud asintótica, se estima calculando la ponderación de Akaike (Burnham & Anderson, 2002), es decir, la contri bución de cada parámetro es ponderada antes de obtener la media del parámetro deseado. Según el AIC, se encontró que el mejor modelo fue el Logístico, mientras que el menos compatible fue el MCVB.
Castro-Ortiz et al. (1992), Schweers et al. (2006) y Tripp-Quezada (2008) sólo se basaron en el modelo MCVB y claramente se ajustó el modelo. El resultado de la presente investigación está en concordancia con otros estudios basados en el enfoque multimodelo y AIC para otras especies. Cruz-Vásquez et al. (2012) realizaron un análisis de Panopea globosa Dall, 1898, en Guaymas, Sonora, y consideraron este enfoque, cuyo resultado arrojó que el modelo logístico fue el que más se ajustó y que el MCVB no está bien soportado. Baer et al. (2011) concluyó que el MCVB no es el modelo óptimo para calcular el crecimiento de lenguado (Psetta máxima, Linnaeus); Flores et al. (2010), para el erizo de mar (Loxechinus albus, Molina 1872), obtuvo resultados similares.
El aporte del presente estudio es la descripción de los parámetros de crecimiento y el hallazgo de una estructura de tallas y edades de M. squalida en la costa oriental del Golfo de California; difiere de lo repor tado en la costa occidental y oriental de la península de Baja California. Se recomienda que para describir el crecimiento individual se utilicen herramientas o algoritmos con soporte estadístico robusto.
En conclusión, para M. squalida en la costa oriental del Golfo de Ca lifornia, el crecimiento individual fue descrito adecuadamente por una curva tipo sigmoidea (modelo logístico), mientras que el MCVB no fue soportado estadísticamente de acuerdo con la teoría de la información.











 nueva página del texto (beta)
nueva página del texto (beta)