INTRODUCCIÓN
Los peces estuarinos, principalmente en sus etapas juveniles, son ge neralistas tróficos que explotan los recursos alimenticios en una amplia gama de hábitats, por lo que sus relaciones tróficas se caracterizan por un amplio espectro en la dieta, omnivoría frecuente, deriva ontogénica, repartición de recursos entre especies y explotación de cadenas trófi cas basadas en el consumo de detritos y algas (Guevara et al., 2007; Giarrizzo & Saint-Paul, 2008; Abdurahiman et al., 2010; Cardoza-Mar tínez et al., 2011; Gimenes et al., 2013; Vitule et al., 2013). Además, muchos autores han registrado marcadas diferencias en la dieta de los peces de estos ecosistemas en diferentes escalas de espacio y de tiempo (Yañez-Arancibia et al., 1985; Yáñez-Arancibia & Sánchez-Gil, 1988; Medina et al., 2004; Ayala-Pérez et al., 2007; Guevara et al., 2007; Barreiros et al., 2009; Arceo-Carranza et al., 2010; Faye et al., 2011; Gimenes et al., 2013).
Las interacciones tróficas de la fauna estuarina están determina das o reguladas por las marcadas variaciones ambientales en escalas intra e interanuales, principalmente de la salinidad y la temperatura (Elliot et al., 2007; Giarrizzo & Saint-Paul, 2008; Lamontagne et al., 2016). En el mismo sentido, las fluctuaciones ambientales afectan las interacciones directas e indirectas de la relación depredador-presa, en particular, la competencia por la disponibilidad de presas y por refugios físicos (Michelsen et al., 1994; Jones & Able, 2015; Lee & Lin, 2015; Hendon & Rakocinski, 2016). Dicha disponibilidad, varía con la comple jidad cualitativa y cuantitativa que ofrecen los hábitats estructurados y no estructurados (Corona et al., 2000; Florido & Sánchez, 2010; Hendon & Rakocinski, 2016). En los ecosistemas estuarinos tropicales, los sus tratos suaves sin vegetación dominan entre los hábitats no estructura dos; mientras que la vegetación acuática sumergida, troncos hundidos, raíces de manglar, son hábitats estructurados frecuentes (Corona et al., 2000; Florido & Sánchez, 2010; Hendon & Rakocinski, 2016). La depredación y sus efectos sobre las demás interacciones están relacio nados con la actividad circadiana, el comportamiento agonístico y las estrategias de los depredadores (Michelsen et al., 1994; Kuhlmann & Hines, 2005; Nagelkerken et al., 2006; Nanjo et al., 2011).
Los registros de Cathorops melanopus (Gunther) o Arius melanopus Gunther en México corresponden a Cathorops aguadulce (Meek) sensu Miller et al. (2005) y Marceniuk y Betancur-R (2008). El árido, C. agua dulce es un pez frecuente y abundante en los ecosistemas estuarinos del sur del Golfo de México, el cual completa su ciclo de vida dentro de estos ecosistemas con una amplia distribución con respecto a los valores de salinidad (Lara-Domínguez et al., 1981; Yáñez-Arancibia & Lara-Domínguez, 1988; Vega-Cendejas, 1990; Kobelkowsky & Castillo-Rivera, 1995; Guevara et al., 2007; Mojica, 2007; Ayala-Pérez et al., 2008; Villéger et al., 2010). Por ejemplo, en laguna de Términos, las máximas abundancias de juveniles se reportaron en los sistemas flu vio-lagunares y zonas de la laguna con influencia de la descarga de los ríos en salinidades menores de 5‰; mientras que los adultos en toda la laguna, entre 25 y 35‰ (Yáñez-Arancibia & Lara-Domínguez, 1988). Durante su periodo juvenil, este bagre ha sido catalogado consumidor de detrito y fauna bentónica (Yáñez-Arancibia & Lara-Domínguez, 1988; Kobelkowsky & Castillo-Rivera, 1995; Mojica, 2007; Ayala-Pérez et al., 2008).
Las modificaciones ambientales evidenciadas en las lagunas costeras por actividades humanas y el cambio climático han afecta do la estructura y organización de las comunidades ícticas (Najjar et al., 2010; Villéger et al., 2010; Wetz & Yoskowitz, 2013; Baptista et al., 2015). En otras especies de áridos se ha documentado que su deriva en la dieta está relacionada con las variaciones estacionales, salinidad, profundidad y transparencia (Giarrizzo & Saint-Paul, 2008). En particu lar, para las especies de la familia Ariidae, la pérdida de hábitat y las modificaciones en el régimen halino han favorecido el incremento de C. aguadulce a consecuencia de la sobreposición espacial con Sciades felis (Linnaeus) [antes Ariopsis felis (Linnaeus)] en laguna de Términos (Villéger et al., 2010). En el sur del Golfo de México, esta dinámica es aún desconocida en otros ecosistemas estuarinos de menor extensión y descarga de ríos caudalosos con amplia variación intra-anual, como sucede en laguna de Términos y planicie costera de esta región del Golfo de México. Sin embargo, en las lagunas costeras con menor área y canales de comunicación al mar más estrechos, su variación tempo ral de la salinidad prácticamente abarca la mayoría del área estuarina, como se ha constatado para la laguna Mecoacán (Domínguez et al., 2003).
El análisis de la variación de la dieta e intensidad alimenticia de los componentes de la fauna íctica dominante, como C. aguadulce (Gue vara et al., 2007; Ayala-Pérez et al., 2008; Villéger et al., 2010), en una laguna costera afectada en su hidrodinámica por las modificaciones en la red fluvial superficial de los ríos Mezcalapa-Grijalva (Sánchez et al., 2015) y que por su reducida extensión las fluctuaciones espaciales de sus ambientes halinos posiblemente sean mayores a las mencio nadas en laguna de Términos por Villéger et al. (2010), sustenta este estudio en la laguna Mecoacán; ya que complementa la información y antecedentes expuestos en otros ecosistemas estuarinos en los dos párrafos anteriores. Adicionalmente, el incremento de la intensidad y frecuencia de los eventos hidrometeorológicos en el Golfo de México, sumados a las obras hidráulicas, pueden magnificar las amplias varia ciones espaciales de los ambientes halinos (Najjar et al., 2010; Medellín et al., 2013; Baptista et al., 2015) y a su vez afectar tanto la distribución y dieta de los peces, como la composición específica de sus presas. Entonces, para estudiar la intensidad y composición de la dieta en re lación con los efectos de las fluctuaciones ambientales y composición de tallas de C. aguadulce en la laguna Mecoacán, en donde se registran amplias variaciones espaciales de los ambientes halinos, se diseñó un muestreo que incluyó la variación diurna-nocturna y estacional en tres localidades ubicadas con respecto a un gradiente de salinidad espacial.
MATERIALES Y MÉTODOS
La laguna Mecoacán (18° 16' y 18° 28' N, 93° 04' y 93° 14' O) es un sistema estuarino somero que oscila entre 0.9 y 2.3 m de profundidad (Domínguez et al., 2003) y ocupa una extensión de 5,168 ha en el li toral del sur del Golfo de México. Al norte, la laguna se comunica de manera permanente con el Golfo de México a través del canal en barra de Dos Bocas, en donde el flujo está probablemente determinado por la marea (Medellín et al., 2013). Además, Mecoacán forma parte del sistema deltaico del río Mezcalapa, del cual recibe ininterrumpidamen te la descarga de los ríos Seco, Cuxcuchapa y Arroyo Hondo (Fig. 1), lo cual propicia que la mayor área de la laguna fluctúe de 1 a 18.5 UPS durante la temporada de lluvias y de 13 a 29 UPS durante la de sequía (Domínguez et al., 2003).
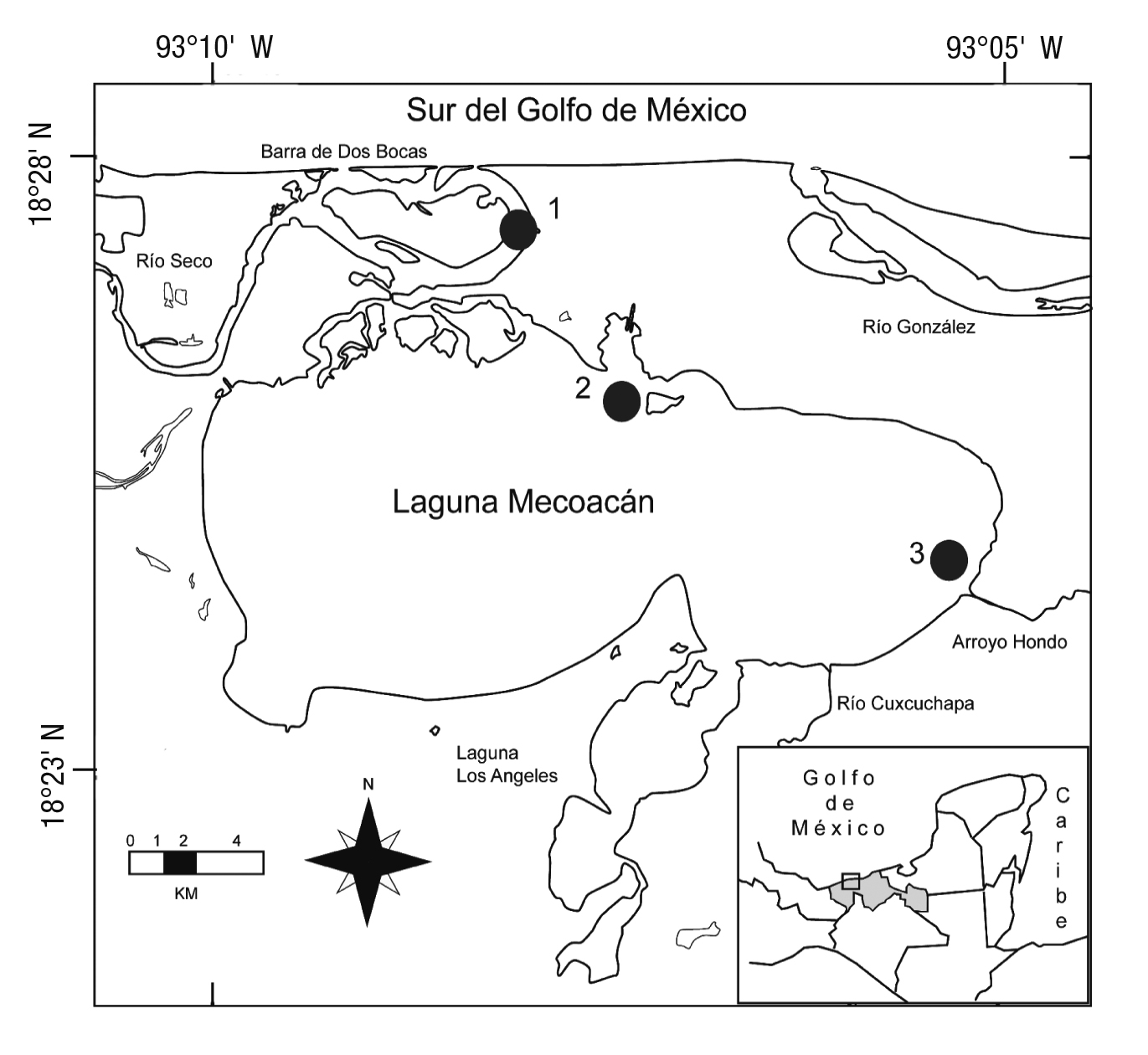
Figura 1 Laguna Mecoacán, sur del Golfo de México. Ubicación de los tres sitios de recolecta de Cathorops aguadulce durante el año 2012.
El diseño de muestreo incluyó la variación diaria (condiciones ilu minación y oscuridad) y temporal (estiaje en marzo, transición entre es tiaje y lluvias en julio y lluvias en septiembre) durante el 2012 en tres si tios (18°26'19.60'' N, 93°08'16.07'' O; 18°24'37.04'' N, 93°06'47.81'' O y 18°24'17.94'' N, 93°04'31.15'' O) ubicados a 0.24, 4.43 y 7.69 km (sitios 1, 2 y 3) de la barra de Dos Bocas (Fig. 1). El muestreo en dos condiciones de variación diaria, en tres temporadas, en tres sitios y tres repeticiones por sitio sumó un total de 54 arrastres. De este total, la mitad fue en horas de iluminación (9 a 15 horas) y el restante en obscuridad (21-24 horas). Los tres sitios de muestreo fueron seleccio nados en función al gradiente de salinidad; por lo mismo, el primero fue ubicado en la zona de la influencia directa de las corrientes de marea, el segundo en una zona intermedia, mientras que el tercero se localizó en las inmediaciones de las descargas de los ríos (Fig. 1). Los tres sitios se seleccionaron en sustratos suaves sin vegetación sumergida, que representa el sustrato dominante en el área de estudio. En cada localidad se midió la temperatura (°C) con un termómetro de cubeta y la salinidad (UPS) con un refractómetro.
Los peces fueron recolectados con una red tipo camaronera co mercial de 10 m de longitud, 8 m de abertura y 2.5 cm de luz de malla. El área de barrido por cada arrastre fue de 736 m2, el cual se cubrió en 3 minutos. Los especímenes capturados fueron inyectados y fijados en una solución de formaldehído al 10% para ser transportados al la boratorio, en donde se preservaron en una solución de alcohol al 70%. La identificación de los bagres se fundamentó en las claves taxonómi cas de Castro-Aguirre et al. (1999), Miller et al. (2005) y Marceniuk & Betancur-R (2008). La longitud total (LT en mm) y el peso húmedo (g) fueron medidos para cada ejemplar con la ayuda de un ictiómetro y una balanza digital.
Los cuatro intervalos de clase de tallas se definieron en función de las tallas de maduración (144 - 165 mm de LT) de A. melanopus en laguna de Términos (Lara-Domínguez et al., 1981; Yáñez-Arancibia & Lara-Domínguez, 1988) y la propia variabilidad de la composición por tallas del total de especímenes capturados, con la ayuda de la regla de Sturges (Daniel, 1982). Los cuatro intervalos de tallas se denominaron: juvenil 1 = 31-100 mm de LT, juvenil 2 = 101-150 mm de LT, adulto 1 = 151-200 mm de LT y adulto 2 ≥ 201 mm de LT. Para revisar el contenido estomacal de C. aguadulce se extrajo el tracto digestivo de 210 especímenes, de un total de 1,024 recolectados. El procedimiento de selección se basó en la separación de 70 ejemplares por cada una de las tres temporadas (estiaje, transición y lluvias), manteniendo la proporción de tallas del total capturado. Los componentes alimenticios del tracto digestivo fueron separados e identificados con un microsco pio estereoscópico hasta el nivel taxonómico posible según el grado de digestión, por lo mismo se agruparon a nivel de clase u orden. La identificación de las presas se basó en Abele & Kim (1986) y Carpen ter (2002) para gasterópodos, bivalvos y crustáceos; y para peces, en Castro-Aguirre et al. (1999) y Miller et al. (2005).
El porcentaje de tractos digestivos vacíos en referencia al total de especímenes capturados se calculó con el coeficiente de vacuidad (Win dell, 1971). Para evaluar la variación de la intensidad de la alimentación entre los intervalos de talla y las tres temporadas se aplicó el índice de repleción (Hyslop, 1980). Los componentes de la dieta se analizaron con la frecuencia de ocurrencia (FO = (Nt/(ΣN)(100)) en donde: Nt = número total de estómagos con cierto componente alimentario y (ΣN = número total de estómagos analizados (Chavance et al., 1984). Ade más, el índice de importancia relativa (IIR) modificado por Yáñez-Aran cibia et al. (1985) fue calculado a través de IIR = (FO)(%W)/100, en donde: FO = frecuencia de ocurrencia y %W = porcentaje gravimétrico (%W = (wj/ΣW)(100)), en donde: wj= peso del componente en la dieta y (ΣW = peso total de todos los componentes en la dieta.
La variación espacial y temporal de la salinidad y la temperatura se analizó mediante correlaciones lineales no paramétricas de Spearman (p <0.05) con el programa JMP vs 8.0.2 (SAS Institute Inc., 2009). Tam bién, la relación entre la composición por tallas con la variación espa cial y temporal de la salinidad y la temperatura fueron correlacionadas mediante el mismo coeficiente de Spearman. El índice de repleción fue vinculado con los cuatro intervalos de talla, variación temporal (sequía, transición y lluvias) y el efecto combinado de talla por variación tem poral por medio de la prueba no paramétrica de Kruskal-Wallis con el programa STATISTICA vs 8 (Stat Soft. Inc., 2007). El IIR fue analizado en los cuatro intervalos de clase de LT en relación con su variación anual (total), diaria (iluminación y obscuridad) y temporal (estiaje, transición y lluvias). Previo a la estimación del índice de similitud de Bray-Curtis (Legendre & Legendre, 2003), el promedio del IIR para cada factor se transformó con raíz cuadrada (Zar, 2010). Posteriormente, se aplicó un análisis de agrupamiento jerárquico, con el uso de la distancia prome dio como el criterio de enlace de pares no ponderados. Para determinar si la disimilitud entre los grupos formados en el análisis de agrupa miento era significativa estadísticamente se empleó la prueba SIM PROF (p <0.05). El análisis de agrupamiento y su nivel de significancia se realizaron con el programa PRIMER v6 (Clarke & Gorley, 2006).
RESULTADOS
La variación anual de la temperatura (22 a 30 °C) fue mínima (Spear man; (rs)0.05(2),210= 0.197; p = 0.5800) en los tres sitios de muestreo (Fig. 2). En cambio, la salinidad fluctuó de 0.5 a 31 UPS y mostró una disminución significativa (Spearman; (rs)0.05(2),210= 0.197; p = 0.0437) en relación con la cercanía a la cabecera del sistema estuarino (Fig. 2). Sin embargo, los juveniles y adultos de C. aguadulce se distribuyeron independientemente de la salinidad (Spearman; (rs)0.05(2),210= 0.197; p = 0.2319), pero estuvieron ausentes en valores mayores de 20 UPS (Fig. 2). Asimismo, tanto juveniles como adultos no mostraron una depen dencia (Spearman; (rs)0.05(2),210= 0.197; p = 0.196) con los valores de temperatura del agua (Fig. 2).
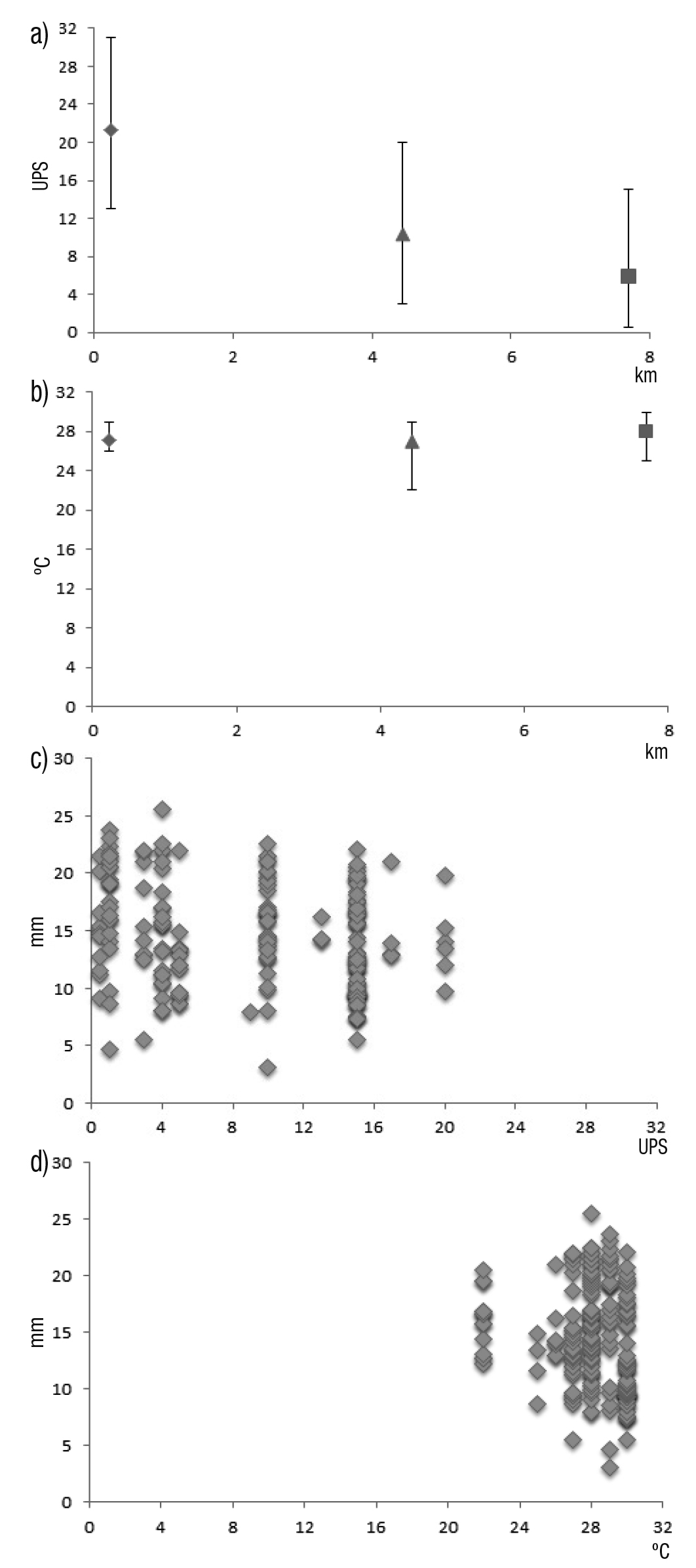
Figuras 2a-d Variación espacial y de tallas de Cathorops aguadulce. a) Variación espacial del promedio (± intervalo) de la salinidad (UPS), b)Variación espacial del promedio (± intervalo) de la temperatura (ºC) ambos en relación a la distancia (km) del canal de comunicación Dos Bocas de la laguna Mecoacán con la zona nerítica del sur del Golfo de México; c) Variación de la composición por tallas de Cathorops aguadulce en función de la salinidad (UPS), d) Variación de la compo sición por tallas de C. aguadulce en función de la temperatura (ºC).
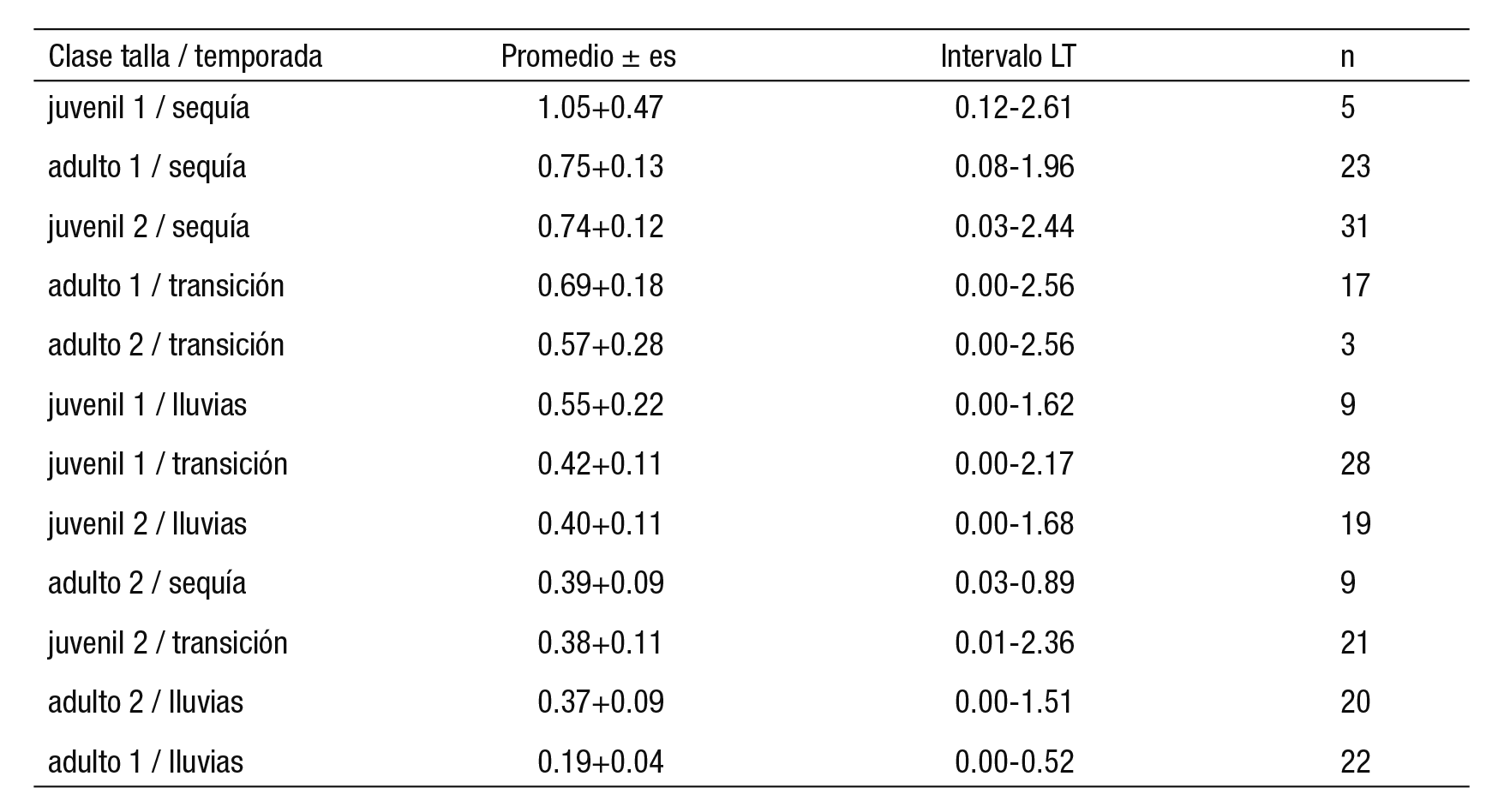
Los 1,024 especímenes recolectados de C. aguadulce fluctuaron de 31 a 255 mm de LT. En la temporada de estiaje se registró 100% de ocurrencia en los estómagos con algún ítem, seguido por lluvias con 83% y transición con 80%. La relación entre la intensidad de consumo y la composición por tallas fue estadísticamente similar (Kruskal-Wallis; p =0.649). Pero el índice de repleción promedio en la temporada de se quía (0.717±0.07) resultó significativamente mayor que el de transición (0.48±0.073) y lluvias (0.345±0.05) (Kruskal-Wallis; p =0.00001). Las combinaciones talla por temporada resultaron estadísticamente afines (Kruskal-Wallis; p =0.15), aunque los mayores valores del índice de re pleción se registraron en sequía para juveniles y adulto 1. Los menores valores se midieron en lluvias para los adultos (Tabla 1).
Tabla 1 Variación del índice de repleción en relación al efecto combinado de la composición de clases de tallas (juvenil 1= 31 a 100 mm de LT, juvenil 2 = 101 a 150 mm de LT, adulto 1 = 151 a 200 mm de LT y adulto 2 ≥ 201 mm de LT) de Cathorops aguadulce por temporada en la laguna Mecoacán (Kruskal-Wallis; p =0.15).
es = error estándar
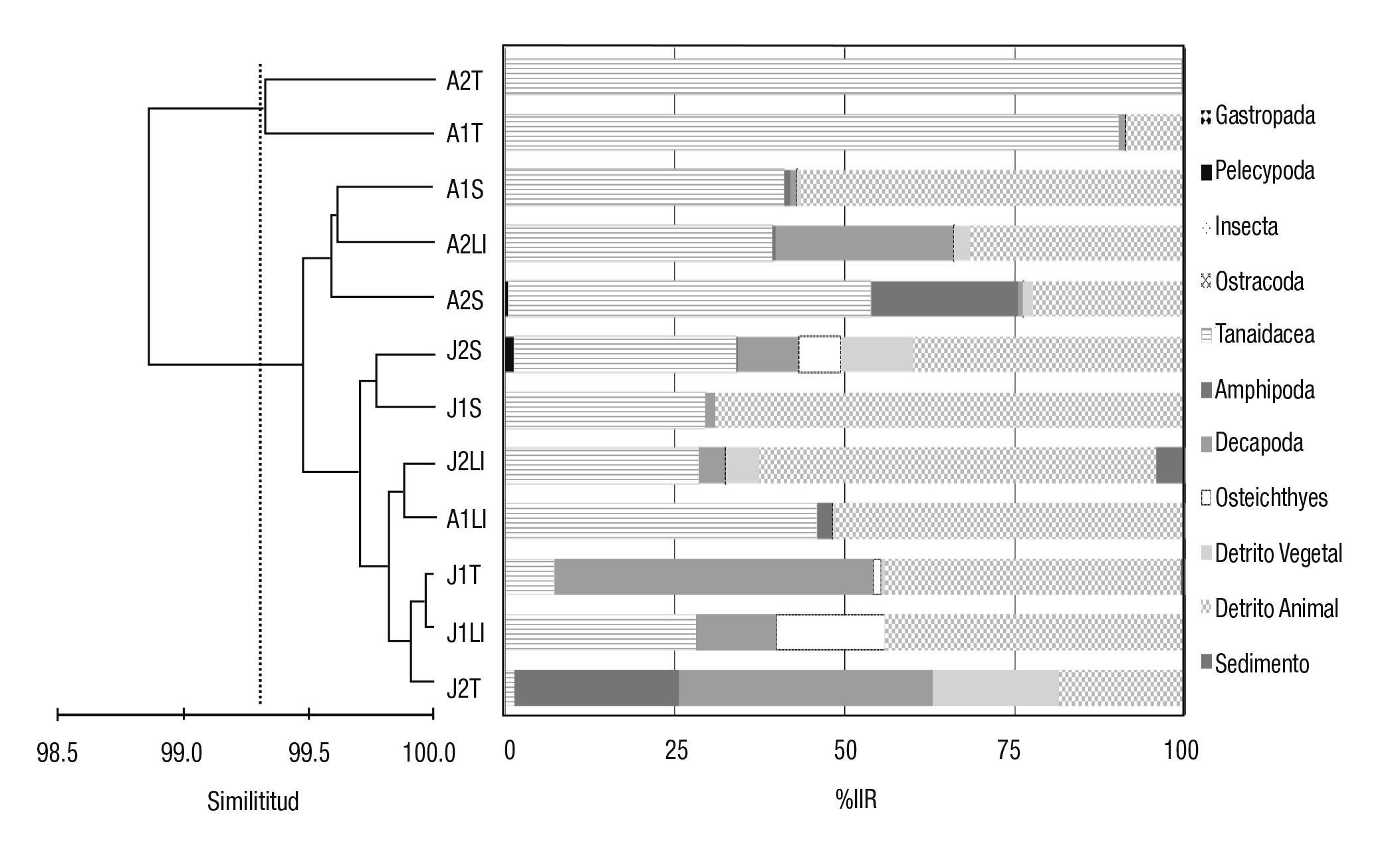
Los componentes alimenticios se dividieron en ocho grupos taxo nómicos de fauna acuática, más sedimento y detrito, tanto vegetal como animal. Los grupos taxonómicos incluyeron tres órdenes de crus táceos de la clase Malacostraca (Tanaidacea, Amphipoda y Decapo da) y las cinco clases (Gastropoda, Pelecypoda, Insecta, Ostracoda y Osteichthyes). En el caso de los decápodos se detectaron restos de camarones y braquiuros. En las tres temporadas muestreadas, ambos detritos y los tanaidáceos representaron la mayor frecuencia de ocu rrencia (81.6%). El resto de los componentes alimenticios presentaron ocurrencias menores a 5.01% (Tabla 2). Por último, el detrito animal y los tanaidáceos sumaron 94.7% del IIR; aunque la clase Malacostraca, que incluye los tanaidáceos, representó el 42.3% del IIR (Tabla 2). En los bagres juveniles 1 se registró el menor número (siete) de compo nentes alimenticios; mientras que en los juveniles 2 se reconocieron los 11 grupos y el porcentaje más alto fue de detrito animal (Fig. 3). Únicamente, en los adultos 1 hubo dos componentes alimenticios do minantes, ya que en los otros tres intervalos de talla se registraron al menos tres ítems dominantes al sumarse los decápodos con contribu ciones mayores al 12.26% del IIR (Fig. 3). Sin embargo, la disimilitud entre juveniles y adultos observada en el dendograma (Fig. 3), aunque no resultó significativa (Bray-Curtis similitud = 53%; p < 0.05), sí se sustentó tanto con la tendencia ascendente en el consumo de malacos tracos (de 39.13 a 74.94 %IIR) con respecto a las cuatro tallas, como la descendente en la ingesta de detrito (de 58.71 a 24.91 %IIR). Entre los malacostracos dominaron los tanaidáceos y los decápodos; mientras que en el detrito, fue el de origen animal (Fig. 3).
Tabla 2 Valores anuales de la frecuencia de ocurrencia (% FO) e Índice de Importancia Relativa (% IIR) de las categorías tróficas observadas en el contenido estomacal de Cathorops aguadulce en laguna Mecoacán, Tabasco, México.
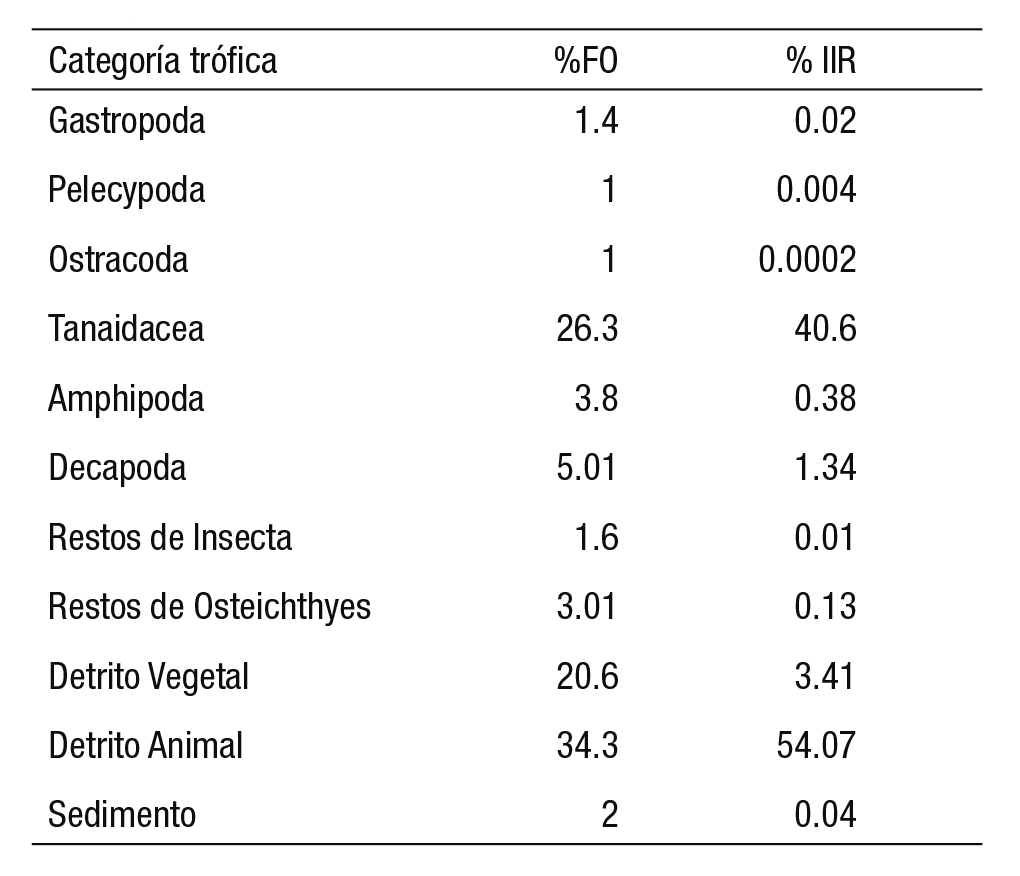
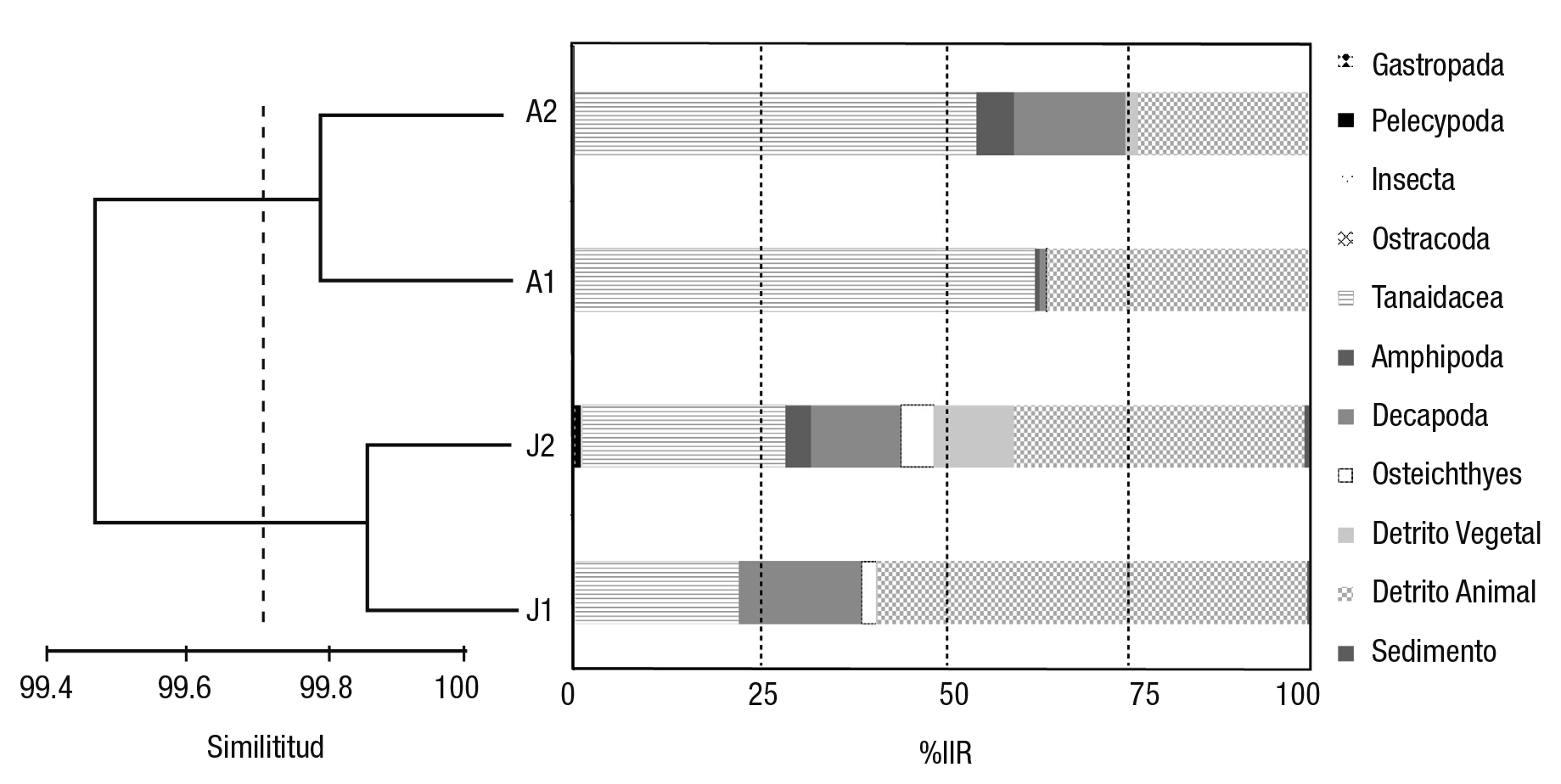
Figura 3 Índice de Importancia Relativa (%IIR), de las categorías tróficas en relación con las clases de talla de Cathorops aguadulce (J1 = 31-100 mm LT, n = 45; J2 = 101-150 mm LT, n = 71; A1 = 151-200 mm LT, n = 62; A2 ≥ 201 mm LT, n = 32) en laguna Mecoacán. n = número de estómagos por intervalo de clase de talla.
Las menores variedades de componentes alimenticios se obtuvie ron en el día y la noche para juveniles 1 y durante el día para adultos 2 (Fig. 4). La variación de los valores de IIR fue prácticamente indis tinta durante el día y la noche para la mayoría de los componentes alimenticios en las cuatro clases de tallas. Las excepciones fueron el mayor registro nocturno de decápodos en general y diurno de anfípodos para adultos 2 y peces en juveniles 2 (Fig. 4). Las agrupaciones en el dendograma fueron estadísticamente parecidas (Bray-Curtis similitud = 82.8%; p < 0.05), pero la diferencia entre juveniles y adultos fue de terminante en la agrupación por similitud en la variación diaria por talla del IIR, ya que esta agrupación coincidió con la tendencia de consumo ascendente para malacostracos y descendente para detrito en relación a las cuatro tallas, y fue independiente de la variación diurna-nocturna (Fig. 4). Además, esta tendencia ontogénica de la dieta coincidió con la observada solamente para las tallas (Fig. 3). Entre los malacostracos dominaron principalmente los tanaidáceos y los decápodos, aunque la contribución de los anfípodos fue notoria en el día para los adultos 1 (Fig. 4).
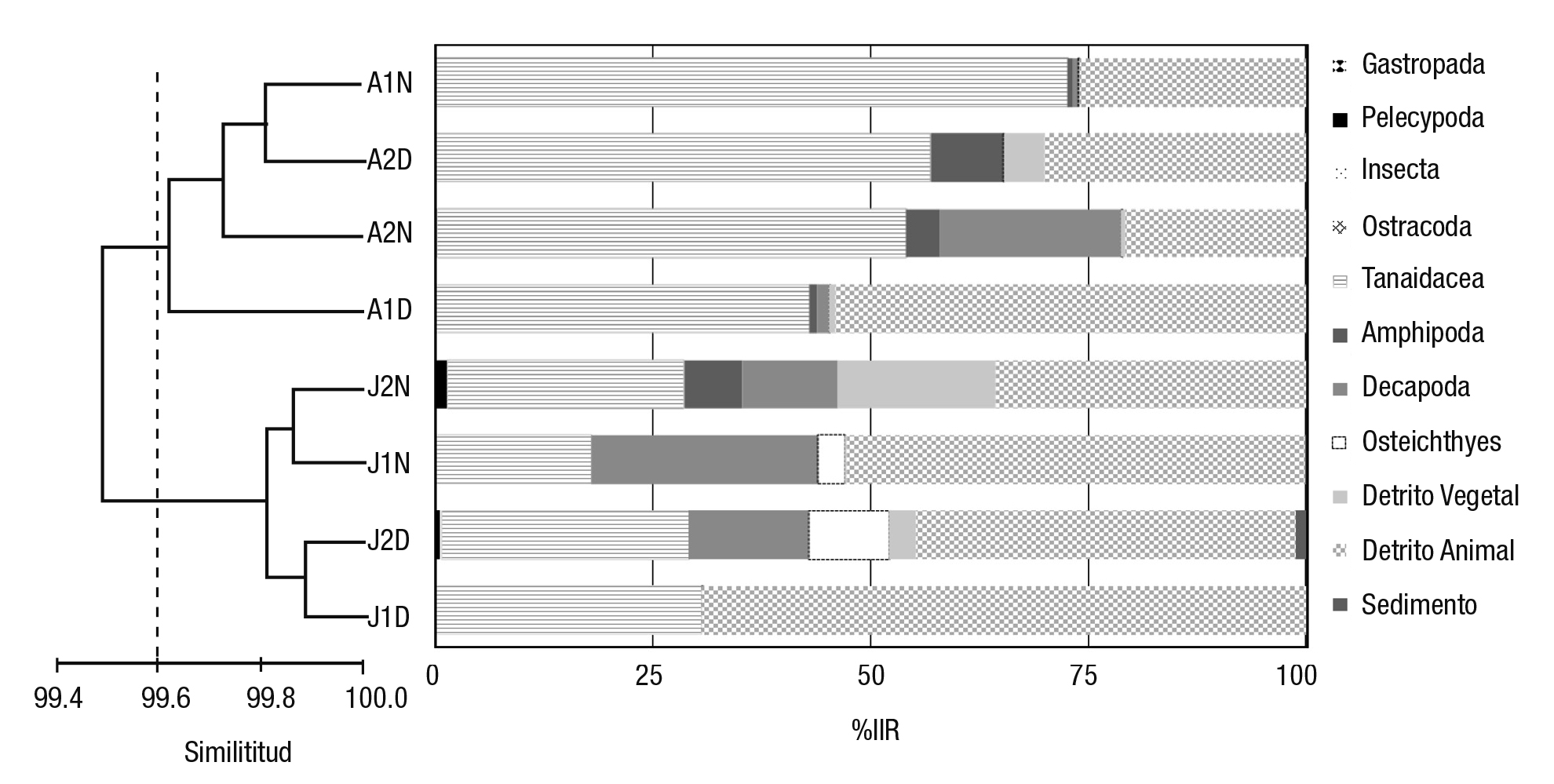
Figura 4 Índice de Importancia Relativa (%) de las categorías tróficas por variaciones en 24 hr (D = día, N = noche) y clases de talla (J1 = 31-100 mm LT; J2 = 101-150 mm LT; A1 = 151-200 mm LT; A2 ≥ 201 mm LT) de Cathorops aguadulce en la laguna Mecoacán, Tabasco, México.
En la temporada de transición se registraron los máximos del IIR de malacostracos (54.2 a 99.6%) y la menor diversidad de grupos alimen ticios (≤ 6 ítems) en las cuatro tallas. Este resultado ayuda a explicar la separación de los adultos en transición en el dendograma (Fig. 5), debido a que la ingesta de tanaidáceos fue casi exclusiva en los adultos (> 90% del IIR). En los bagres juveniles 1, en lluvias, se detectó el único porcentaje elevado de consumo de peces (16%). Asimismo, la ingesta de anfípodos sólo sobresalió (IIR ≥ 22%) en juveniles 2 en transición y en adultos 2 en estiaje (Fig. 5). Los tanaidáceos y el detrito animal fueron los componentes alimenticios dominantes en el IIR de todos los peces juveniles y adultos. El efecto de las tallas de los bagres no fue significativo estadísticamente (Bray-Curtis similitud= 15.7%; p < 0.05), pero sí resultó definitorio en la agrupación por similitud de las combina ciones talla-temporada de la variación ambiental estacional (Fig. 5), ya que persistió la tendencia de que el detrito fue más frecuente en los ju veniles y los tanaidáceos en los adultos en las tres temporadas (Fig. 5).
DISCUSIÓN
La distribución de Cathorops aguadulce en las cuencas de la vertien te sureste del Golfo de México fue delimitado desde la cuenca del río Pánuco hasta el río Polochic y el lago Izabal, Guatemala (Miller et al., 2005). Pero Marceniuk & Betancur-R (2008) restringieron su límite sur a la cuenca del río Coatzacoalcos y sugirieron como Cathorops kailolae Marceniuk & Betancur-R a las poblaciones del Grijalva-Usumacinta. Sin embargo, algunos autores mantuvieron la identificación de C. melano pus en las poblaciones capturadas en laguna de Términos (Ayala-Pérez et al., 2008; 2012; Villéger et al., 2010; Flores-Hernández et al., 2012). Para el presente trabajo, los caracteres anatómicos utilizados por Mar ceniuk & Betancur-R (2008) para validar a C. aguadulce y diferenciarlo de C. melanopus son contundentes. En cambio, las claves propuestas por los mismos autores para distinguir C. aguadulce de C. kailolae son insuficientes. En este sentido, los especímenes reportados en laguna Mecoacán corresponden a C. aguadulce.
El bagre Cathorops aguadulce es una especie dulceacuícola (Esch meyer et al., 2016) con amplia distribución limnética (Miller et al., 2005; Rodiles-Hernández et al., 2005; Macossay et al., 2011; Sánchez et al., 2012; Castillo-Domínguez et al., 2015); funcionalmente esta especie puede categorizarse como de agua dulce eurihalina, según la propues ta de McCormik et al. (2013), pues este bagre también completa su ciclo de vida y es numéricamente dominante en las comunidades de peces en Mecoacán y en otros sistemas estuarinos (Yañez-Arancibia & Lara-Domínguez, 1988; Guevara et al., 2007; Ayala-Pérez et al., 2008; Villéger et al., 2010). Su funcionalidad como especie de agua dulce eurihalina coincide con el aumento de su biomasa en detrimento de Sciades felis, ambos vinculados al decremento de la salinidad en la zona noroeste de mayor influencia de descarga de los ríos en la laguna de Términos (Villéger et al., 2010), ya que S. felis es un bagre marino eurihalino en el sentido de McCormik et al. (2013), debido a que desova en los sistemas estuarinos (Yáñez-Arancibia & Lara-Domínguez, 1988). Además, el registro de las máximas abundancias de juveniles en am bientes oligohalinos (Yañez-Arancibia & Lara-Domínguez, 1988; Ayala-Pérez et al., 2008), la falta de registros en otros sistemas estuarinos con salinidades mínimas anuales de 20 UPS (Chiappa-Carrara et al., 2012), y la distribución de los juveniles y adultos (independiente de la salinidad) en un intervalo de 0.5 a 20 UPS en este estudio, aportan mas argumentos acerca de la funcionalidad de C. aguadulce como una es pecie de agua dulce eurihalina en un ecosistema con amplias variacio nes espaciales de sus ambientes halinos, como es laguna Mecoacán.
Los intervalos de salinidad (5-28 ppm, 8-28 ‰ y 0.5-29 UPS) sus critos para laguna Mecoacán por Galaviz-Solís et al. (1987), Flores et al. (1996) y Domínguez et al. (2003) concordaron con los resultados de esta investigación (0.5-30 UPS). Según la zonación de la laguna basada en la variación espacial y temporal de los ambientes halinos cimentada en el sistema de Venecia (ASLO 1958) y propuesta por Do mínguez et al. (2003), los tres sitios de muestreo (Fig. 2) se ubicaron en zonas que fluctuaron de meso-polihalino a polihalino (0.24 km de Dos Bocas), mesohalino a meso-polihalino (4.43 km de Dos Bocas) y oli gohalino a oligo-mesohalino (7.69 km de Dos Bocas). Esta fluctuación ambiental ha ayudado a explicar la distribución espacial y temporal de moluscos, balanos epizoicos y decápodos en Mecoacán (García-Cubas et al., 1990; Flores et al., 1996; Domínguez et al., 2003; Tepetlan & Aldana-Aranda, 2008; González et al., 2016). En laguna de Términos, la distribución de los juveniles y adultos de A. melanopus y otros bagres estuvo influida por la fluctuación de la salinidad (Yáñez-Arancibia & Lara-Domínguez, 1988; Ayala-Pérez et al., 2008; Villéger et al., 2010). Del mismo modo, en los áridos A. melanopus en Celestún y Sciades herzbergii (Bloch), en el estuario de Curaçá en Brasil se detectó que la deriva temporal de la dieta fue más relevante que la ontogénica, debi do a la amplia variación ambiental (Vega-Cendejas, 1990; Giarrizzo & Saint-Paul, 2008). Pero en este estudio, la distribución de los juveniles y adultos de C. aguadulce resultó desvinculada de la variación de la salinidad. En las comparaciones de la poblaciones de C. aguadulce en las lagunas de Términos y Mecoacán, la composición por tallas careció de efecto en las diferencias mencionadas al resultar similares: 25 a 302 mm en la primera (Yáñez-Arancibia & Lara-Domínguez, 1988; Ayala-Pérez et al., 2008) y 31 a 255 mm en la segunda.
La dominancia del detrito y los tanaidáceos en la dieta C. aguadul ce concordaron en Pueblo Viejo, laguna de Términos, Celestún (Lara-Domínguez et al., 1981; Yáñez-Arancibia & Lara-Domínguez, 1988; Vega-Cendejas, 1990; Kobelkowsky & Castillo-Rivera, 1995; Guevara et al., 2007; Mojica, 2007; Ayala-Pérez et al., 2008) y en este estudio en Mecoacán. El consumo frecuente de detrito en los peces se atribuyó a las temporadas con disponibilidad de alimento limitada (Michelsen et al., 1994). Sin embargo, los elevados índices de detrito en el contenido estomacal de este bagre demersal se han relacionado con su frecuente distribución en sustratos suaves con alto contenido de detrito (Yáñez-Arancibia & Lara-Domínguez, 1988).
Los crustáceos bentónicos son frecuentes en la dieta de C. agua dulce en los ecosistemas estuarinos (Lara-Domínguez et al., 1981; Yáñez-Arancibia & Lara-Domínguez, 1988; Vega-Cendejas, 1990; Kobelkowsky & Castillo-Rivera, 1995; Guevara et al., 2007; Mojica, 2007; Ayala-Pérez et al., 2008). La dominancia de los tanaidáceos de juveniles y adultos, sobre todo en los segundos, se relaciona a que este orden de malacostracos presenta amplia distribución en los ecosiste mas estuarinos, pero son más abundantes en ambientes oligohalinos en sustratos suaves con alto contenido de materia orgánica (Winfield & Franco-López, 1992). Estos peracáridos han sido señalados como un componente trófico importante en los contenidos estomacales de áridos en varias lagunas costeras en el sur del Golfo de México, como Pueblo Viejo, Términos y Celestún (Lara-Domínguez et al., 1981; Vega-Cendejas, 1990; Mojica, 2007), lo cual concuerda con los resultados de este estudio, ya que fue un componente alimentario dominante en las cuatro clases de tallas. Además, los tanaidáceos son comunes en la dieta de otras especies de peces (Kneib, 1992; D´Aguillo et al., 2014; Compaire et al., 2016). Este elevado consumo de tanaidáceos en los cuatro intervalos de clase en la laguna Mecoacán representa la opor tunidad de comprobar la hipótesis sobre la función de C. aguadulce como regulador de los detritívoros distribuidos en sustratos suaves sin vegetación, en donde hay una elevada disponibilidad de materia orgá nica disuelta y particulada, aportada en parte por el manglar en laguna Mecoacán y en otros sistemas estuarinos en el sur del Golfo de México. Estas cadenas detritívoras también sostienen poblaciones abundantes de camarones peneidos y otros crustáceos (Flores et al., 1996; Raz-Guzman & Sánchez, 1996; Domínguez et al., 2003) que representan fuentes de alimento para este bagre zoobentívoro.
El consumo de los grupos dominantes fue en general indistinto du rante el día y la noche, aunque la ingesta de los anfípodos fue diurno y el de los restos de decápodos (principalmente de camarones peneidos) resultó más nocturno, lo que coincidió con la actividad diurna reportada para algunas especies de anfípodos y nocturna de los peneidos (Minello & Zimmerman, 1985; Matthews, 1991; Sánchez, 1997; Marion et al., 2008; Santos et al., 2016). También, las elevadas densidades de anfí podos y estadios inmaduros de camarones peneidos en sustratos sua ves u otros hábitats en laguna Mecoacán y otros sistemas estuarinos (Flores et al., 1996; Corona et al., 2000; Domínguez et al., 2003; Barba & Sánchez, 2005; Rocha-Ramírez et al., 2007; Baker et al., 2014) sus tentan que hayan sobresalido en la dieta de este silúrido zoobentívoro.
La menor diversidad de ítems alimenticios observada en la tem porada de transición contrastó con los valores promedio del índice de repleción, ya que sus mínimos valores se calcularon en la tempo rada de lluvias. Sin embargo, la deriva ontogenética de la dieta fue más determinante que los efectos de la variación temporal, en ambas escalas (24 horas y estacional) para las poblaciones de C. aguadulce en Mecoacán. Este resultado difirió parcialmente de lo registrado para la misma especie (A. melanopus) en laguna de Términos y Celestún, pues en ambas lagunas la alimentación se consideró similar durante su desarrollo (Yáñez-Arancibia & Lara-Domínguez, 1988; Vega-Cendejas, 1990), aunque hubo un incremento de consumo de restos de camaro nes en los bagres de mayor talla en la primera laguna (Yáñez-Arancibia & Lara-Domínguez, 1988). De forma semejante, para el bagre S. herz bergii en el estuario de Curaçá se propuso que la deriva temporal de la dieta fue más relevante que la ontogénica (Giarrizzo & Saint-Paul, 2008). En este estudio, los bagres de mayor talla aumentaron la inges ta de tanaidáceos, mientras la de decápodos se mantuvo durante las cuatro clases de tallas.
El silúrido C. aguadulce es una especie de agua dulce eurihalina zoobentívora, cuya deriva ontogénica de la dieta fue más relevante que la variación ambiental sobre sus hábitos alimenticios. Esta conclusión se sustenta en que los hábitos se agruparon para juveniles y adultos, pues el detrito dominó en los juveniles y los tanaidáceos en los adultos. La variación temporal significativa en la intensidad de dieta de este silúrido, aunada a la distribución de la composición por tallas de sus poblaciones independiente a la salinidad, disminuyen la probabilidad de atribuir las diferencias ontogénicas de su dieta a la disponibilidad de las presas en relación a la distribución del depredador. En cambio, abre la posibilidad de comprobar si la variación ontogenética de sus rasgos morfométricos funcionales está asociada con la adquisición de alimen to y movimiento. Los resultados de esta investigación ayudan a explicar la dominancia numérica de este bagre en ecosistemas estuarinos, en donde las extensas y frecuentes áreas con sedimentos suaves sin ve getación sumergida y con alto contenido de detrito representan sitios de alimentación para los juveniles y adultos de esta especie.











 nueva página del texto (beta)
nueva página del texto (beta)