INTRODUCCIÓN
El sistema lacustre de Xochimilco localizado en la Ciudad de México es una región de gran tradición en México, no obstante, la mayoría de los canales de este sistema presentan una reducción drástica en sus niveles de agua debido a que se recargan con aguas tratadas (Mazari-Hiriart et al., 2000) o a que se usa el agua para el riego agrícola (An, 2004). Dada la abundancia de diferentes plantas acuáticas flotantes que se distribuyen en los canales, se han considerado como herramien ta para tratar aguas contaminadas, ya que muestran una alta tasa de propagación y absorción de contaminantes, por lo que son una alterna tiva viable para la salud de los canales (Abbisy & Mandi, 1999). Entre estas plantas destacan las pertenecientes a la familia Lemnaceae, las cuales crecen sobre superficies de aguas tranquilas (Landolt, 1987). En ésta familia se ubica Lemna gibba Linnaeus, que ha resultado un excelente modelo experimental debido a que su manejo es fácil, se encuentra ampliamente distribuida en México, es de alta productivi dad, tolerante a condiciones naturales adversas y tiene un ciclo de vida corto. Por ello, es una especie que se utiliza frecuentemente para pruebas de toxicidad en el monitoreo de ecosistemas acuáticos y se ha considerado como un bioindicador (Wang, 1990). En la actualidad, los estudios se han enfocado en los microorganismos endófitos de plantas asociadas a la restauración de ecosistemas, que habitan en espacios intracelulares, intercelulares o en el tejido vascular de las plantas, sin causarles daño, promoviendo su crecimiento y desarrollo (Hallmann, 1997; Reiter & Sessitsch, 2006; Dibut et al., 2009; Dimkpa et al., 2009). El análisis de la diversidad funcional de las fitobacterias con relación a sus atributos promotores del crecimiento vegetal, ha permitido ca racterizar a estos microorganismos gracias al papel que desempeñan no solamente en la interacción con las plantas, sino también por su relación con el ecosistema. Uno de sus atributos más estudiados por su importancia es el que se refiere de manera directa a la promoción del crecimiento vegetal, mediado por la producción de fitohormonas, en particular la principal auxina el ácido indolacético (AIA), que controla una variedad de procesos importantes que incluyen el alargamiento, la división celular y la diferenciación tisular. Existen pocos estudios sobre el conjunto de interacciones entre las bacterias endófitas y las plantas acuáticas (Overbeek & Elsas, 2008), en particular destacan, los relacio nados con la rizósfera de estas últimas y están orientados a su uso po tencial para la remediación a través de la interacción planta acuática-microorganismos (Stout & Nusslein 2005, 2010; Yamaga et al., 2010).
El objetivo de este estudio fue aislar y describir a las fitobacterias endófitas productoras de ácido indolacético aisladas de plantas de L. gibba, colectadas en la zona chinampera de los canales de Xochimilco y determinar su potencial como productoras de esta fitohormona.
MATERIALES Y MÉTODOS
Ubicación del sitio de estudio. El área de estudio se localiza dentro del sistema lacustre de Xochimilco, entre las coordenadas 19° 15’ 11” y 19° 19’ 15” N y 99° 00’ 58” y 99°07’ 08” O, con una altitud promedio de 2,240 msnm y una superficie de 2,657 ha. Los canales selecciona dos para el estudio se ubican dentro de la zona agrícola o chinampera caracterizada particularmente por el desarrollo agrícola, el cultivo de hortalizas, plantas de ornato y flores.
Aislamiento de fitobacterias endófitas de Lemna gibba. La colecta de plantas de L. gibba se realizó en dos épocas: temporada de sequía, en el mes de mayo, y de lluvias, en el mes de agosto, en el año 2013. Se marcaron tres puntos a lo largo del canal seleccionado en la zona agrícola, donde se tomaron muestras superficiales de agua en reci pientes de plástico de 500 mL preparados conforme al método están dar APHA (2005), que se transportaron al laboratorio en obscuridad y refrigeración a 4 ˚C, para la determinación de los parámetros químicos siguientes: contenido de nitrógeno total (NT mg/L), nitritos (NO2 mg/L), nitratos (NO3 mg/L), nitrógeno amoniacal (NH3 mg/L), ortofosfatos (PO4 mg/L) y fósforo total (PT mg/L). Estos análisis se hicieron por duplicado, empleando las técnicas respectivas del equipo HACH DRL/2500.
También se colectaron en cada sitio tres muestras de 100 g de bio masa de plantas de L. gibba, con ayuda de una red de 60 cm de largo x 25 micras de diámetro de malla, que se colocaron en bolsas herméticas y trasladaron en frío al laboratorio para el aislamiento de sus fitobacte rias endófitas. Se tomaron 10 g de la biomasa total de plantas, la cual se desinfectó con hipoclorito de sodio al 10% durante varios segundos y con varios enjuagues consecutivos con agua destilada estéril; después se sometió a un molido en mortero aséptico al que se le agregaron 10 mL de agua destilada estéril, para conseguir una suspensión del mate rial biológico, la cual se vertió en botellas con 90 mL de agua destilada estéril. Las suspensiones resultantes se evaluaron de acuerdo con el método de dilución en placa, considerando diluciones de 10-1y 10-2 en medio de agar nutritivo (AN); se inocularon 0.2 mL de cada dilución por extensión en placa por triplicado. Las placas se incubaron por 24 ho ras a 28 ºC. Se seleccionaron aquellas colonias con morfología colonial diferente de las que se resembraron por estría cruzada en placas con medio AN para su aislamiento, conservación y posterior caracterización microscópica. Su identificación se realizó a través de la determinación de sus secuencias del gen 16S rDNA, empleando la reacción en ca dena de la polimerasa (PCR: Polimerase Chain Reaction), para ello se efectuaron resiembras de las fitobacterias aisladas de forma masiva en medio AN, se incubaron de 24 a 48 horas a 28 ºC hasta obtener el crecimiento adecuado de biomasa microbiana, se recuperó la biomasa con ayuda de una asa microbiológica, se depositó en un mortero estéril al que se le adicionó N2 líquido, se maceró hasta lograr un polvo fino y se extrajo su DNA con el método de Allers & Lichen (2000), se agre garon 1 o 2 mL de CTAB (CTAB al 2%, EDTA, Trizma base 200 mM pH 8.0, NaCl 2M y polivinilpirrolidona 0.5%) y se mezcló hasta conseguir una suspensión homogénea. Se separó la suspensión en tubos Eppen dorf de 1.5 mL (0.5 mL en cada uno) y se incubaron a 65 ºC por una hora, después 30 minutos a temperatura ambiente y posteriormente se les adicionó 500 µL de la mezcla de cloroformo: alcohol isoamílico (24:1); se agitaron en vórtex hasta formar una emulsión y centrifugaron a 13,000 rpm durante 10 minutos a temperatura ambiente.
Se transfirió la fase acuosa a tubos Eppendorf nuevos y se les aña dió 500 µL de isopropanol concentrado para favorecer la precipitación del DNA; se mezclaron por inversión y se incubaron a -20 ºC toda la noche para recuperar el DNA por centrifugación a 13,000 rpm durante 10 minutos a 4 ºC.
Finalmente, se lavó la pastilla de DNA con 1000 μL de etanol al 70% dos veces, se centrifugó en frío, se decantó el sobrenadante y se dejó secar la pastilla. El DNA obtenido se resuspendió en 50 μL de agua desionizada estéril y se incubó a -20 ºC para realizar la amplificación del gen 16S rDNAr por PCR. Del DNA genómico purificado, se amplificó el gen ribosomal 16S rDNA, utilizando los cebadores universales fD1 y rD1 diseñados por Weisburg et al. (1991). La mezcla de PCR contuvo 1.23 µL del iniciador Fw (fD1), 1.05 µL del iniciador (rD1), 1.5 µL de MgCl2 50mM, 0.5 µL de dNTP’s 200 µM, 0.5 µL de 5 unidades de Taq DNA polimerasa, 2.5 µL de regulador 1X, 16.72 µL de agua estéril y finalmente 1 µL de DNA diluido 1:10. La PCR se llevó a cabo según el método de Allers & Lichten (2000) utilizando un termociclador. La temperatura inicial fue de 94 °C por 5 min, seguido de 30 ciclos de 94 °C durante 1 min, 55 °C por 1 min, 72 °C por 3 min y por último a 72°C durante 10 min. La purificación de los amplificados del gen ribosomal 16S rDNA se hizo con el empleo del Kit Comercial de la marca Zymo Re search, agregando en un tubo Eppendorf de 1.5 mL, 50 µL del producto de PCR y 100 µL del DNA Binding Buffer; la mezcla se agitó suavemente en vórtex y se transfirió a la columna de purificación colocada previa mente en el tubo colector, se centrifugó a 13,000 rpm por un minuto; se decantó el sobrenadante y al precipitado se le adicionaron 200 µL de Wash Buffer. Se centrifugó a 10,000 rpm por un minuto y el paso anterior se ejecutó 2 veces más para finalmente adicionar 10 µL de H2O desionizada directamente a la matriz de la columna.
El eluído se colocó en un tubo Eppendorf nuevo para colectar las muestras finales y por último se centrifugaron durante un minuto a 10,000 rpm. Los productos de la PCR se verificaron por medio de una electroforesis en gel de agarosa al 1% (w/v) teñido con bromuro de etidio. Los productos de la amplificación del gen 16S rDNA de las fito bacterias aisladas se purificaron y secuenciaron en la Unidad de Bio tecnología y Prototipos de la FES-Iztacala (UNAM) y las secuencias se compararon para elaborar su homología molecular con secuencias de la base de datos genómicos utilizando el análisis BLAST (Basic Logical Alignment Search Tool, BLAST at NCBI).
Evaluación de producción de fitohormonas. Para la evaluación de la producción de fitohormonas por las fitobacterias endófitas aisladas de las plantas de L. gibba, se empleó la técnica de la producción in vitro de ácido indolacético (AIA), a través de la detección fotocolorimétrica de éste con la adición del reactivo de Salkowski, como sigue: se emplea ron tubos de ensaye con tapón de algodón de 20 mL de capacidad con 4.9 mL de caldo nutritivo con la adición de L-triptófano en las concen traciones de 1, 2 y 5 mg/L y se utilizó como testigo una serie de tubos con caldo nutritivo sin L-triptófano. Todos los tubos se inocularon con 0.2 mL de un inóculo de cada fitobacteria aislada con concentración de 5 x 107células/mL, determinado por turbidez con el empleo de un foto colorímetro Klett Summerson con filtro azul 42. Los tubos se incubaron por 4 días a 28 °C y después se cuantificó el contenido de auxinas como equivalentes de AIA por análisis espectral, mezclando 1 mL del medio de los cultivos fitobacterianos con 1 mL de reactivo de Salkowski (2% (w/v) de FeCl3 0.5M disuelto en ácido perclórico al 35%. Se incubó a temperatura ambiente por 30 minutos para el desarrollo de una colo ración rosada, la cual indica la producción de AIA, se cuantificó leyendo su absorbancia a 535 nm e interpolando en una curva tipo de AIA. La caracterización de las bacterias productoras de AIA in vitro se estable ció, según lo descrito por Khalid et al. (2004), en tres grupos principales: las bajas productoras (de 1 a 10 µg/mL), las medianas productoras (de 11 a 20 µg/mL) y las altas productoras (de 21 a 30 µg/mL de AIA).
Análisis de datos. Para los datos químicos del agua y la comparación de la producción de AIA se realizó un análisis de varianza de una vía (ANOVA) y pruebas de Tukey usando el paquete estadístico Sigma Plot 11.0. El estudio de los datos, de acuerdo con la categorización de la producción de AIA de las fitobacterias endófitas, se llevó a cabo por me dio de un análisis numérico comparativo con el programa NTS y S-PC versión 2.11T (Numerical Taxonomy and Multivariate Analysis Sys tem) para la aplicación de un índice de distancia. Una vez obtenidos los valores de distancia del coeficiente aplicado, se construyó el fenograma respectivo utilizando el método de agrupamiento UPGMA (Unweighted Pair Group Method of Arithmetic Averages) y se estableció la veracidad y confianza del fenograma construido a través del coeficiente de co rrelación producto-momento de Pearson. Finalmente, para evaluar la asociación entre las variables químicas y biológicas resultantes, se rea lizó un análisis de componentes principales (ACP) que incluyó ambas temporadas con base en la correlación de Pearson (Kebede & Kebedee, 2012), para lo cual se empleó el paquete estadístico XLSTAT-Pro 2009.
RESULTADOS
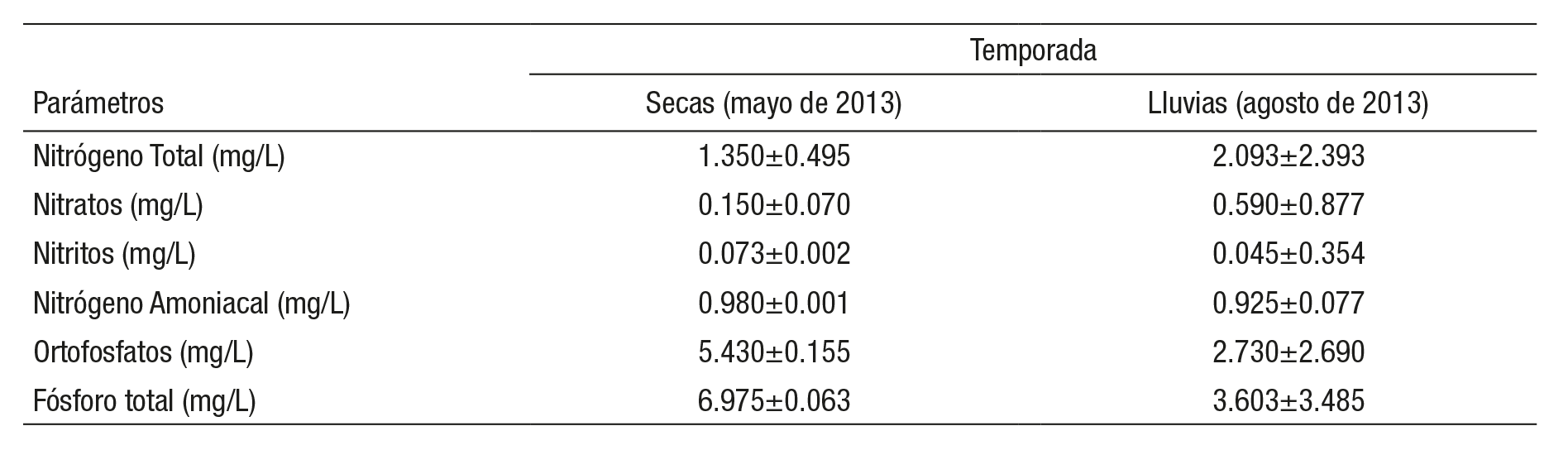
Los valores promedio de cada uno de los seis parámetros químicos analizados, que reflejaron las características del agua en el canal ubi cado en la zona chinampera en las temporadas de sequía y lluvias, se presentan en la Tabla 1. Los valores del contenido de nitrógeno total medido y la concentración de nitratos fueron mayores en las muestras de agua del mes de agosto (temporada de lluvias), mientras que los contenidos de nitritos y nitrógeno amoniacal no mostraron diferencias significativas en ambas temporadas (p <0.05). La concentración de fósforo total fue contrastante con los resultados de la del nitrógeno durante las temporadas de estudio, donde los valores totales de este elemento, así como la concentración de ortofosfatos medidos en las muestras de agua, resultaron mayores en la temporada de sequía.
Tabla 1 Contenido de nitrógeno y fósforo en las muestras de agua colectadas del canal seleccionado de la zona chinampera en el lago de Xochi milco, México. No se presentaron diferencias estadísticas significativas (n=3, p <0.05).
Se aislaron un total de 12 fitobacterias endófitas de las plantas de L. gibba (Tabla 2); 8 de ellas se aislaron de las plantas colectadas en la temporada de sequía y 4 de ellas de las plantas colectadas en la temporada de lluvias.
Tabla 2 Fitobacterias endófitas aisladas de plantas de Lemna gibba y su producción de (ácido indolacético) AIA. Las diferentes letras muestras las diferencias estadísticas significativas entre ambas temporadas (n = 3, p <0.001).
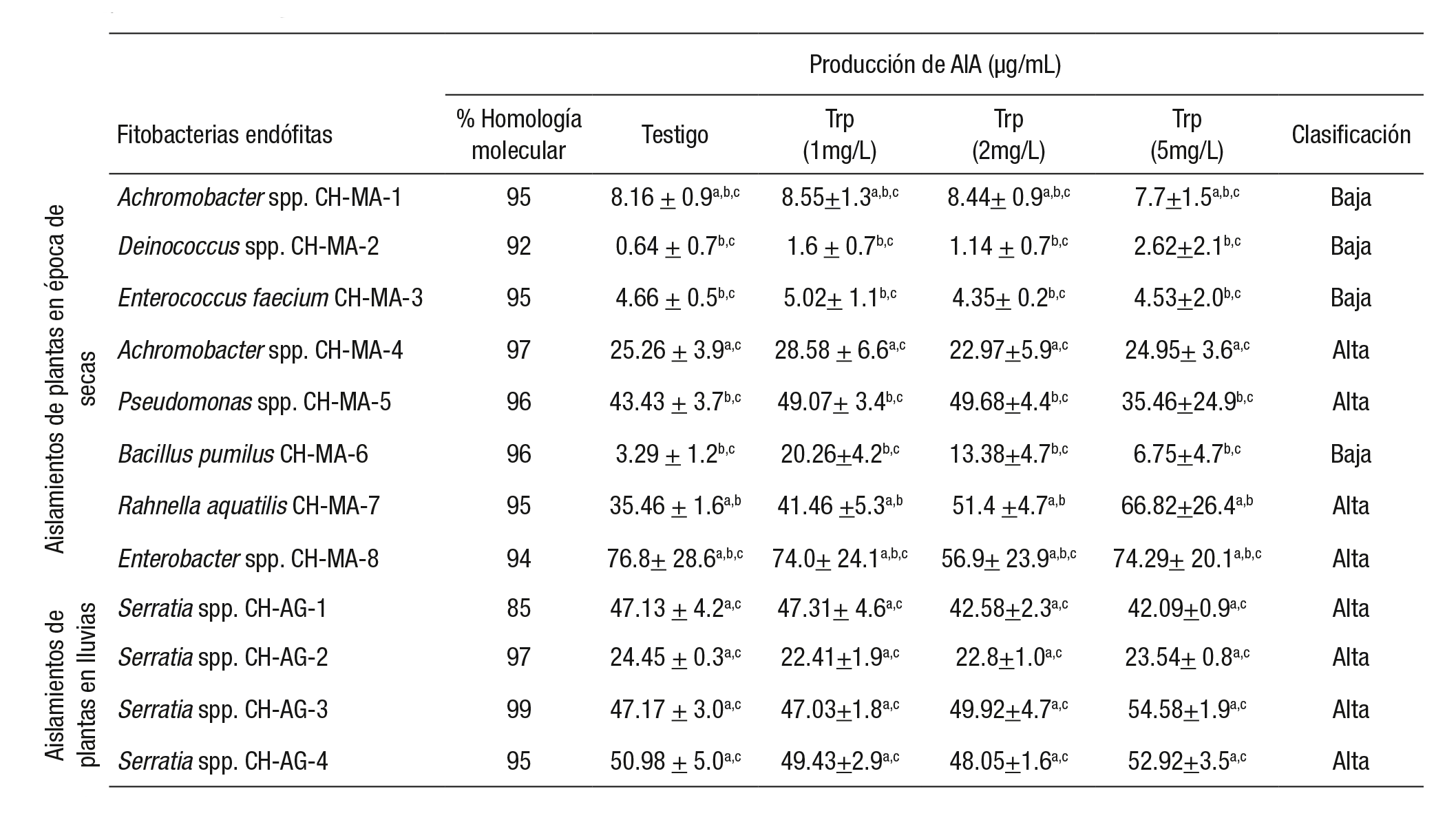
Trp = triptófano
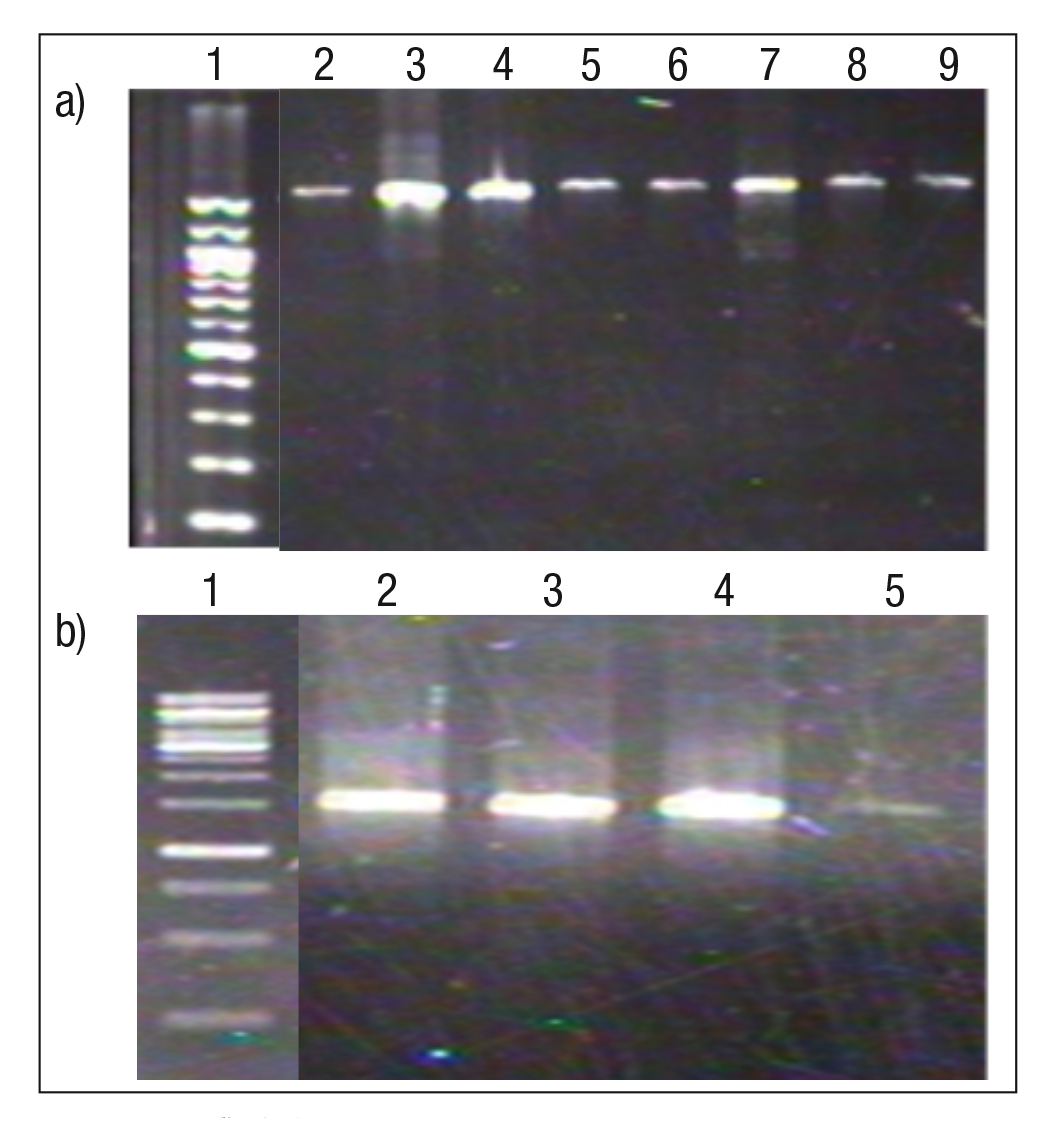
El electroferograma del DNA genómico muestra que se obtuvie ron altas concentraciones de DNA (3,500 ng/µL) de las fitobacterias aisladas de las plantas colectadas en la temporada de secas, contra riamente a lo encontrado de las fitobacterias aisladas de las plantas colectadas en la temporada de lluvias, donde las concentraciones de DNA fueron más bajas (Figs.1a-1b).

Figuras 1a-b Electroferogramas del DNA genómico obtenido de los diferentes aislamientos provenientes de plantas de Lemna gibba: a) Aislamientos de plantas recolectadas en la temporada de secas: 1 = CH-MA-1; 2 = CH-MA-2; 3 = CH-MA-3; 4 = CH-MA-4; 5 = CH-MA-5; 6 = CH-MA-6; 7 =CH-MA-7; 8 = CH-MA-8, b) Aislamientos de plantas recolectadas en la temporada de lluvias: 1 = CH-AG-1; 2 = CH-AG-2; 3 = CH-AG-3; 4 = CH-AG-4.
La amplificación del gen 16S rDNA generó una banda única de aproximadamente 1.5 Kb, lo que muestra que los iniciadores fueron es pecíficos para la región del gen 16S rDNA (Figs. 2a-2b). De los aislados de las plantas de L. gibba colectadas en ambas temporadas, las bandas se extrajeron de los geles y se procedió a elaborar su secuenciación y posterior análisis bioinformático. Para la selección de los posibles gén eros o especies se revisó literatura para cotejar la morfología colonial y microscópica de los aislados. Las secuencias elegidas fueron aquellas que tuvieron un mayor porcentaje de similitud, comparadas con las se cuencias del Gen Bank, para así tener una mejor exactitud posible para la identificación de las fitobacterias aisladas: Achromobacter spp. CH-MA-1, Deinococcus spp. CH-MA-2, Enterococcus faecium CH-MA-3, Achromobacter spp. CH-MA-4, Pseudomonas spp. CH-MA-5, Bacillus pumilus CH-MA-6, Rahnella aquatilis CH-MA-7, Enterobacter spp. CH-MA-8, de las plantas colectadas en la temporada de sequía y Serratia spp. CH-AG-1, Serratia spp. CH-AG-2, Serratia spp. CH-AG-3 y Serratia spp. CH-AG-4, de las plantas colectadas en la temporada de lluvia.
Figuras 2a-b Electroferogramas de los productos de amplificación del gen 16S rDNA de los diferentes aislamientos de fitobacterias de plantas de Lemna gibba. a) Aislamientos de pantas recolectados en la temporada de secas: 1 =Marcador de Peso Molecular (1Kb); 2 = CH-MA-1; 3 = CH-MA-2; 4 = CH-MA-3; 5 = CH-MA-4; 6 = CH-MA-5; 7 = CH-MA-6; 8= CH-MA-7; 9 = CH-MA-8. b) Aislamientos de plantas recolectadas en la temporada de lluvias: 1 =Marcador de Peso Molecular (1Kb); 2 = CH-AG-1; 3 = CH-AG-2; 4 = CH-AG-3; 5 = CH-AG-4.
La producción de AIA in vitro, obtenida de las fitobacterias en dófitas aisladas, permitió caracterizarlas según la clasificación de Khalid et al. (2004), como altas productoras de AIA (25 a 76μg/mL) a las fitobacterias: Achromobacter spp. CH-MA-4, Pseudomonas spp. CH-MA-5, Rahnella aquatilis CH-MA-7 y Enterobacter spp. CH-MA-8; y como bajas productoras de AIA (0.6 a 8μg/mL) a las fitobacterias: Achromobacter spp. CH-MA-1, Deinococcus spp. CH-MA-2, Enterococ cus faecium Orla-Jensen 1919 Schleifer & Kilpper-Bälz 1984 CH-MA-3 y Bacillus pumilus CH-MA-6, provenientes de las plantas colectadas en la temporada de sequía. Todas las fitobacterias endófitas aisladas en la temporada de lluvias fueron clasificadas como altas productoras de AIA (24 a 51 μg/mL) (Tabla 2).
En cuanto a la comparación en la producción de AIA, considerando las distintas concentraciones de triptófano y el testigo para cada una de las fitobacterias aisladas resultó que de las 4 fitobacterias que se clasi ficaron como altas productoras de AIA, sólo la fitobacteria Enterobacter spp. CH-MA-8 presentó mayor producción sin la adición de triptófano; la concentración de 1 mg/L de triptófano potenció la producción de AIA en la fitobacteria Achromobacter spp. CH-MA-4; la concentración de 2 mg/L de triptófano incrementó la producción de AIA en la fitobacteria Pseudomonas spp. CH-MA-5 y solamente la fitobacteria aislada Rahne lla aquatilis CH-MA-7 mostró una alta producción de AIA con la adición de 5 mg/L de triptófano. Para la temporada de lluvias, no se encontra ron diferencias significativas de producción de AIA bajo las distintas concentraciones de triptófano para cada aislado.
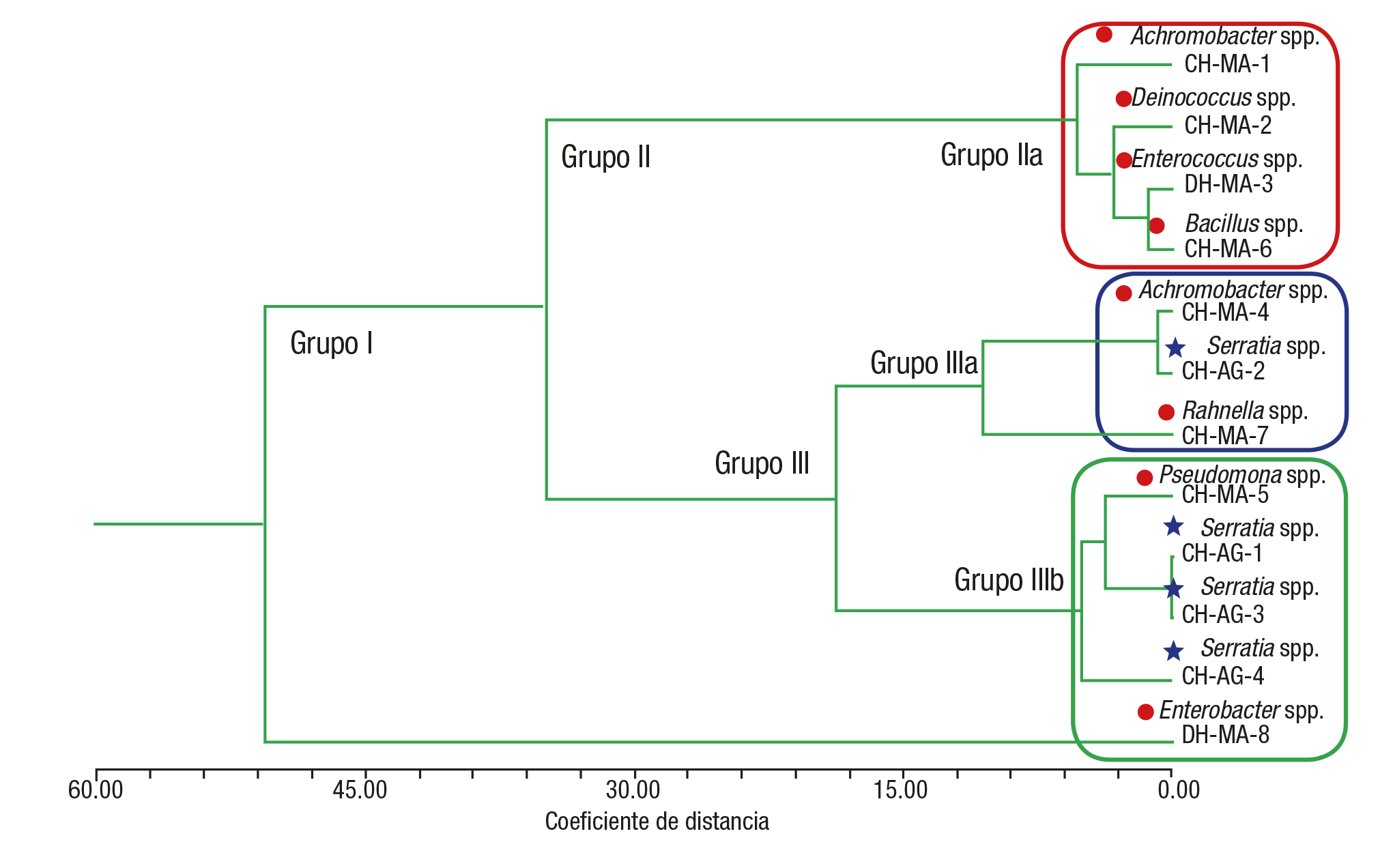
La Fig.3 expone la agrupación de las fitobacterias endófitas a tra vés de un fenograma que muestra tres grupos bien definidos de ma nera inicial; el grupo I incluye a Enterobacter spp. CH-MA-8, aislada de las plantas colectadas en la temporada de sequía, que fue clasificada como la más alta productora de AIA con 76.84 µg/mL. El grupo II, subdi vidido por un grupo IIa representado por Achromobacter spp. CH-MA-1, Deinococcus spp. CH-MA-2, Enterococcus faecium CH-MA-3 y Bacillus pumilus CH-MA-6, incluye las fitobacterias aisladas de las plantas de la temporada de sequía y fueron clasificadas como las productoras de AIA más bajas. Finalmente, el grupo III, que está subdividido en dos grupos: el grupo IIIa, que agrupó a las medianas productoras de AIA cuya pro ducción fue entre 24.45 y 35.46 µg/mL, estuvo conformado por Achro mobacter spp. CH-MA-4 y Rahnella aquatilis CH-MA-7 aisladas de las plantas colectadas en la temporada de sequía y Serratia spp. CH-AG-2 de plantas colectadas en la temporada de lluvia. El grupo IIIb, consti tuido por las fitobacterias clasificadas como las más altas productoras de AIA, incluyó a Pseudomonas spp. CH-MA-5 y Enterobacter spp.CH-MA-8 de las plantas colectadas en la temporada de sequía y las cepas Serratia spp. CH-AG-1, Serratia spp. CH-AG-3 y Serratia spp. CH-AG-4 aisladas de plantas colectadas en la temporada de lluvia; en éste grupo se determinaron concentraciones entre 43.43 a 76.84 µg/mL.
DISCUSIÓN
El interés por emplear estas especies de Lemna para la fitoremediación acuática ha aumentado, pero en particular, se han realizado estudios sobre las comunidades microbianas asociadas con estas plantas, que abordan la absorción o inmovilización de metales pesados (Stout & Nüsslen 2005; Vogel et al., 2006; Stout & Nüsslen, 2010), ejemplo de ello es la caracterización de la microflora arsénico resistente asociada a la superficie de plantas de Lemna gibba y Lemna minor L. Griff. 1851, en las cuales Mkandawire et al. (2004) determinaron seis grupos fisio lógicos: oligótrofos, fijadores de nitrógeno, solubilizadores de fósforo, bacterias amonificantes, nitrificantes y desnitrificantes; encontraron también que la mayoría de las bacterias resistentes al arsénico fue ron Gram negativas y del género Pseudomonas. En especial, y vincu lado como antecedente a este trabajo, se tiene el reporte de Idris et al. (2007), quienes aislaron de Lemna minor a la fitobacteria Bacillus amyloliquefasciens Priest et al. F2B42, que produce y secreta cantida des significativas de AIA (29.3 ng/mL). En este estudio, la caracteriza ción de las fitobacterias endófitas aisladas de las plantas de L. gibba como productoras de AIA mostró que se obtuvo un alto porcentaje de altas productoras (67%), considerando los aislamientos de las plantas colectadas en ambas temporadas; pero los aislamientos de las plan tas colectadas en la temporada de lluvias representaron el 100% de bacterias altas productoras. La fitobacteria endófita Enterobacter spp. CH-MA-8 manifestó una producción total de 77 µg/mL de AIA, mayor a lo reportado por Vivas et al. (2006) y Zaidi et al. (2006) para Bacillus ssp. y Enterobacter ssp., géneros reportados como altos productores con 55 µg/mL de AIA producido. Las fitobacterias endófitas aisladas del género Serratia alcanzaron valores superiores a los mencionados por Rojas et al. (2010), cuyos aislamientos reportan una producción de 35 µg/mL. Esta diversidad y productividad de AIA pudiera responder también a la interacción particular que se establece entre estas fito bacterias y su planta “hospedero”, como lo reportan Idris et al. (2007). Estos autores indican que la fitobacteria B. amyloliquefasciens F2B42, que posee la habilidad para colonizar las raíces de plantas de Lemna minor ST, sugiere que ésta depende en cierto grado de la capacidad de la fitobacteria para sintetizar AIA. Lebuhn et al. (1977) han propuesto que la síntesis bacteriana de AIA contribuye a potenciar la competencia en la rizósfera al eliminar los compuestos análogos presentes en la superficie de las plantas hospedero. Lambrecht et al. (2000) mencionan que esta competencia puede darse por la estimulación generada por la liberación de exudados por parte de la planta; mientras que Yamada (1993) lo asoció a la regulación en las defensas de la planta y Robinette y Matthys (1990) a la inhibición en la respuesta de hipersensibilidad en plantas infectadas.
Algunos autores mencionan que la diversidad funcional se puede expresar a través de un análisis fenético basado en las similitudes entre los atributos funcionales evaluados (Petchey & Gaston, 2009; Ciancia ruso et al., 2009). La comparación fenética de los aislados, de acuerdo con la producción de AIA en ambas temporadas, mostró que hay dife rencias entre las fitobacterias aisladas.
El ACP de la figura 4, que asoció los seis parámetros químicos me didos en las muestras de agua con la producción de AIA medida en las fitobacterias endófitas aisladas de las plantas de L. gibba, muestra que los valores de los dos primeros componentes representaron el 100% de la varianza total (F1 = 89.08%; F2 =10.92%); en este caso se observó que existe una asociación entre los valores de nitrógeno amoniacal, ortofosfatos, nitritos y fósforo total en las muestras de la temporada de sequía consistente con el aislamiento de fitobacterias en la misma colecta, caracterizadas por su alta producción de AIA. Las muestras de la temporada de lluvia se caracterizaron por una particular asociación entre el nitrógeno total, nitratos y la presencia del género Serratia. En el primer componente se asociaron todos los aislados con mayor producción de AIA de las plantas colectadas en la temporada de lluvias, con una relación positiva. Para el segundo componente, se asociaron todos los aislados de las plantas colectadas en la temporada de sequía, con una relación positiva, aquellos que fueron más productores de AIA y de forma negativa, los de menor producción.
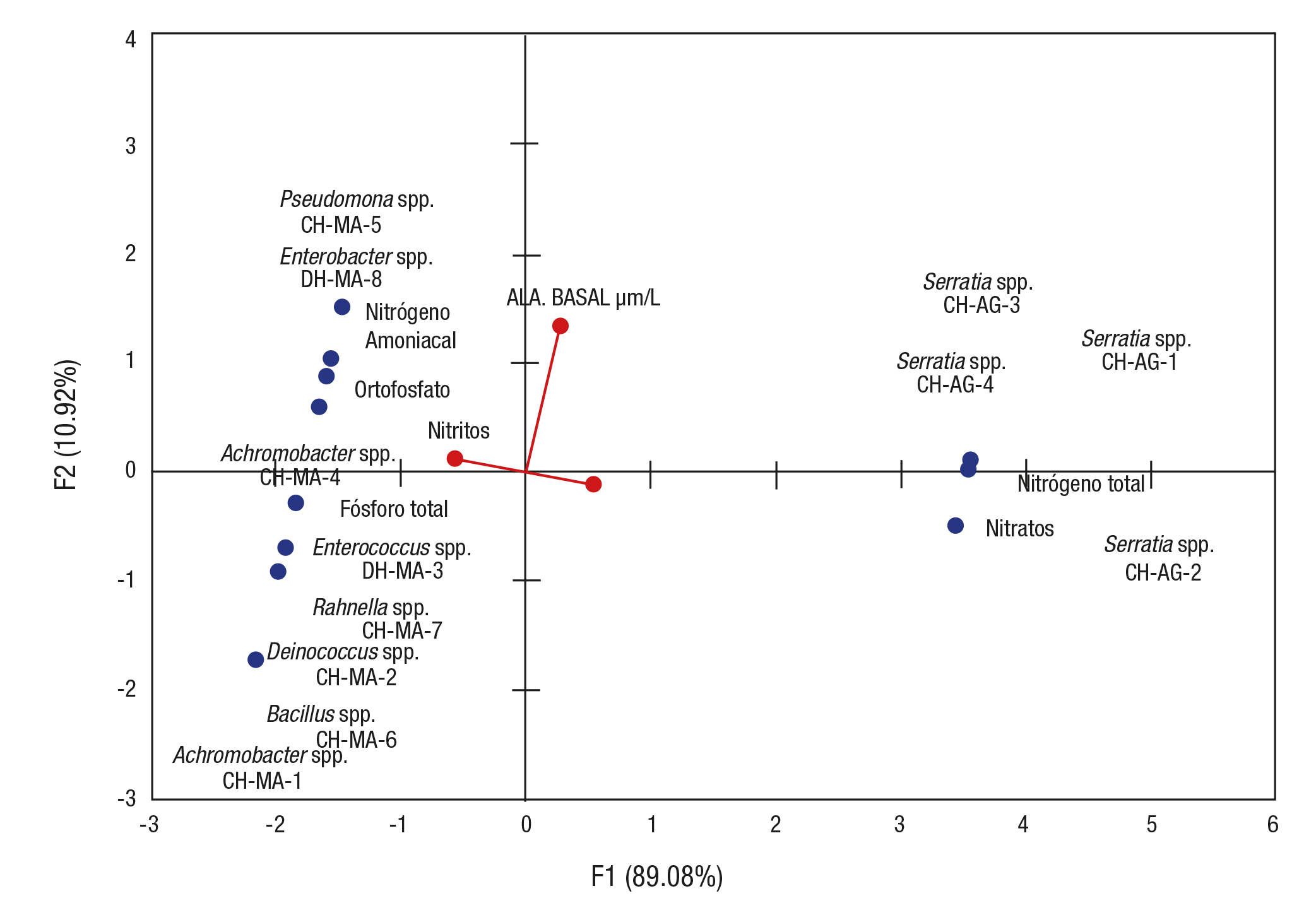
Figura 4 Análisis de componentes principales (ACP) que muestra la relación entre los parámetros químicos medidos de la calidad del agua del canal de Xochimilco, México, seleccionado de la zona agrícola, con relación al atributo funcional de la producción de AIA (ácido indolacético) de las fitobacterias endófitas aisladas de plantas de Lemna gibba colectadas en dos temporadas (secas y lluvias).
La evaluación de los parámetros químicos evidenció que las mues tras de agua del canal lo definen como un sitio con un cierto grado de eutrofización, repartido en el contenido de nitrógeno total alto en la temporada de lluvias y de fósforo total alto en la temporada de sequía. Aunque estos valores son datos puntuales, se puede notar que éstos se han incrementado con el tiempo, al compararse con los datos reco lectados por López-López et al. (2006) para esta zona, que reportan un contenido de nitrógeno total de 1 mg/L, de nitratos de 0.016 mg/L, de nitrógeno amoniacal de 0.06 mg/L y de fósforo total de 4.7 mg/L. Estos datos sugieren que los valores altos podrían originarse por el uso de fertilizantes nitrogenados y fosforados por las actividades agrícolas de sarrolladas en el área, lo que contribuiría al incremento en la concentra ción de estos nutrientes en Xochimilco; un proceso observado en otros sistemas acuáticos como lo mencionan Chapman y Kimstach (1992).
Esta asociación entre los altos productores de AIA y las altas con centraciones de N y P cuantificadas tiene su relación en lo establecido por algunos autores de acuerdo con su comportamiento en ecosiste mas con este grado de eutrofización, donde las especies de Lemna prefieren el nitrógeno en forma amoniacal y preferentemente remueven el amonio, aun en concentraciones altas de nitrógeno; Lüönd (1980) demostró tasas elevadas de crecimiento de Lemna obtenidas cuando el nitrógeno está presente en forma de amonio más que de nitrato. En el caso del fósforo, este elemento es esencial para el crecimiento rápido de estas plantas y las aguas ricas en nutrientes se consideran como un buen reservorio, tanto de fósforo como de potasio. Se ha reportado también que la contribución indirecta de L. gibba a la remoción total de nutrientes, se da por medio de las biopelículas que integran algas y bacterias sobre la superficie de estas plantas, que contribuyen a la pérdida del 35 y 32% del nitrógeno y fósforo totales, respectivamente. Existen varios estudios realizados sobre la asociación entre Lemna y su microflora, los cuales se han enfocado principalmente en observa ciones microscópicas y a la cuenta bacteriana sobre las superficies de estas plantas, así como estudios dependientes de cultivo (Mkandawide & Dudel, 2007). Otras áreas ampliamente estudiadas son las que se re portan sobre la remoción del exceso de nutrientes, particularmente de nitrógeno y fósforo empleando la asociación Lemna-microorganismos, para el tratamiento de aguas residuales. La zona Chinampera se con sidera como irregular por los valores contrastantes en los parámetros evaluados en ambas temporadas, asimismo, el ACP asoció ésta zona con el mayor número de fitobacterias aisladas con mayor producción de AIA.
Finalmente, los estudios relacionados con el análisis de la diversi dad funcional en un ecosistema dan información sobre el papel que los organismos desempeñan. Esta investigación contribuye no solamente al conocimiento de la diversidad de las fitobacterias endófitas de las plantas acuáticas, como fue el caso de los aislados identificados en las plantas de Lemna gibba colectadas en un canal de la zona agrícola del sistema lacustre de Xochimilco; sino también a la caracterización de uno de sus atributos funcionales de la promoción del crecimiento vegetal (la producción de fitohormonas); la existencia de fitobacterias endófitas clasificadas como altas productoras de ácido indolacético en las plantas de Lemna gibba, sugiere que en cierta medida podrían ser consideradas como bioinoculantes potenciales.











 nueva página del texto (beta)
nueva página del texto (beta)