INTRODUCCIÓN
Los moluscos dulceacuícolas (bivalvos y gasterópodos) se encuentran diversificados en cuerpos de agua muy variados, algunas de las especies se distribuyen ampliamente e invaden nuevos hábitats de forma relativamente rápida, mientras que otras se encuentran en sitios res tringidos (Naranjo-García & Olivera-Carrasco, 2014). Los factores que controlan la distribución de los grupos tróficos en ambientes acuáticos determinan la estructura de las poblaciones que componen la comuni dad de moluscos, a la vez que la distribución y abundancia de los gru pos funcionales se correlacionan con los factores físicos del ambiente (Olabarría et al., 2001).
En los ecosistemas acuáticos la temperatura y salinidad se consi deran de suma importancia por estar entre las principales propiedades ambientales que limitan la distribución de invertebrados (Kinne, 1971). El aumento de la salinidad en los ecosistemas continentales es uno de los factores que influye en la distribución, la abundancia y el desarrollo de los organismos; distintas especies del mismo género tienen diferen tes rangos de tolerancia a la salinidad (Eckert et al., 1989).
El rango de tolerancia aguda es aquel en el que los organismos son capaces de compensar los cambios modificando sus tasas fisiológicas para permanecer relativamente “independientes” del medio (Bayne, 1976). Fuera de estos límites, existe un rango de resistencia donde los organismos son incapaces de adaptarse a variaciones extremas, ya que se destruye la integridad de éstos y en poco tiempo sobreviene la muerte (Fry, 1947). El método para determinar el rango de tolerancia consiste en someter, por medio de bioensayos, ejemplares aclimatados a un cierto nivel a cambios agudos de diferentes magnitudes del factor durante un tiempo de exposición previamente establecido.
Entender cómo varía la tolerancia al estrés ambiental entre pobla ciones sirve para predecir los efectos del cambio climático en especies localmente adaptadas a su ambiente abiótico (Kuo & Sanford, 2009).
El objetivo principal de este trabajo fue evaluar el efecto de la salinidad en cuatro especies de gasterópodos nativos (Mexinauta im pluviata (Morelet, 1849), Pomacea flagellata (Say, 1827), Pyrgophorus coronatus (Pfeiffer, 1849) y Aroapyrgus clenchi (Goodrich & Van der Schalie, 1937)) y dos introducidos (Tarebia granifera (Lamarck, 1822) y Melanoides tuberculata (O. F. Müller, 1774)) de Tabasco (Contreras-Arquieta, 1995; Rangel-Ruiz & Gamboa-Aguilar, 2001; Cruz-Ascencio et al., 2003; Albarran-Melze, et al., 2009) en condiciones de laboratorio, con el fin de determinar su CL50 y CL90, y TL50 y TL90 para conocer la capacidad de adaptación en un ambiente salino, producido por el incre mento del nivel del mar y la intrusión de agua salina a cuerpos de agua dulce por efecto del cambio climático.
MATERIALES Y MÉTODOS
Las muestras de Aroapyrgus clenchi, Pyrgophorus coronatus y Mexi nauta impluviata fueron tomadas del lavado y tamizado de las raíces de lirio acuático (Eichchornia crassipes [Mart.] Solms); para Tarebia granifera y Melanoides tuberculata se utilizó una draga tipo Van Ven (Mellado-Hernández et al., 2015) y la colecta de Pomacea flagellata se hizo manual. Las seis especies de gasterópodos se recolectaron en las lagunas Guanal, San Isidro, Viento, Larga y Tintal en el municipio de Centla, en la Reserva de la Biosfera Pantanos de Centla (RBPC), Tabasco (Tabla 1). La salinidad media anual en estos cuerpos de agua fue: Gua nal: 0.9 g/L, San Isidro: 0.4 g/L, Viento: 0.2 g/L, Larga: 0.2 g/L y Tintal: 0.4 g/L (Macossay-Cortez et al., 2011).
Tabla 1 Situación geográfica de las estaciones de colecta de gasterópodos dulceacuícolas en la Reserva de la Biosfera Pantanos de Centla (RBPC), Tabasco, México.

Con el objetivo de disponer de suficientes caracoles para los bioen sayos, se desarrollaron cultivos en tinas de 1 m3 al aire libre, con agua declorinada y 50 caracoles en promedio de cada especie. Durante este periodo no se cambió el agua, sólo se recuperaron los niveles en las tinas y se mantuvieron las temperaturas del medio. La aireación fue continua, se conservaron refugios, como troncos y lirio acuático, y ade más se utilizaron sustratos artificiales de vermiculita. La alimentación se suministró cada tres días con raíces de lirio acuático y lechuguilla.
Todos los gasterópodos fueron medidos con base en el largo de la concha (LC), se presenta el mínimo y máximo entre paréntesis y en seguida el promedio con su desviación estándar: (MIN-MAX) PROM ± DE. Todas las medidas se dan en milímetros (mm).
Para determinar la concentración letal media de CL50 y CL90 (en las que se producen el 50 y 90% de mortalidad de la población expuesta), a un nivel de confiabilidad del 95%, y establecer los rangos de tolerancia aguda a la salinidad, primero se realizó una prueba exploratoria (cuya finalidad fue conocer un rango preliminar aproximado) de amplio inter valo donde se aplicaron concentraciones de salinidad de 0 a 15 g/L. Con fundamento en los resultados de la prueba preliminar, el diseño experimental consistió para Pyrgophorus coronatus de cinco concen traciones (0.5, 1, 2, 3 y 4 g/L); para Aroapyrgus clenchi de seis (0.2, 0.3, 0.4, 0.5, 1 y 2 g/L); para Pomacea flagellata y Mexinauta impluviata de cinco (5, 6, 7, 8, 9 g/L); para Tarebia granifera y Melanoides tuberculata de ocho (1, 2, 3, 4, 5, 6, 7 y 8 g/L) y un testigo por cada concentración, todas ellas con tres réplicas. Los bioensayos se realizaron en recipien tes de plástico circulares y trasparentes de un litro de capacidad. Los parámetros fisicoquímicos promedio considerados en todos los bioen sayos fueron: temperatura 25.0 oC, pH 6.9 y oxígeno disuelto 4.2 mg/L. En cada réplica se colocaron 20 gasterópodos, la mortalidad se conta bilizó cada hora hasta las 12 horas. La mortalidad de los gasterópodos se consideró cuando perdieron movilidad, se contrajeron dentro de la concha y no respondieron a estímulos mecánicos. Se utilizó el número de moluscos activos como un índice de tolerancia a la salinidad.
Las soluciones salinas se prepararon con sal marina profesional marca Oceanic, debido a que presenta proporciones iónicas similares al agua de mar. Los recipientes de plástico, probetas y vasos de preci pitado utilizados en la preparación de las soluciones y pruebas fueron lavados siguiendo la técnica propuesta por Sobrino y Pica (2008).
Con el propósito de establecer las diferencias significativas entre las concentraciones y las repeticiones se aplicó la prueba no paramé trica de Kruskal-Wallis y la prueba de rangos múltiples, utilizando el programa estadístico de Statgraphics Centurión XV. La determinación de la CL50 y CL90 se realizó por medio de una regresión Probit-Log, con el programa SPSS Statistics V. 20 (Segnini & Chung, 1989; Azuaje & Chung, 1993; Chung, 1994). El tiempo letal TL50 y TL90 de cada concen tración se consideró como el tiempo que tarda en morir el 50 y 90% de los caracoles expuestos.
RESULTADOS
En los bioensayos se utilizaron en total 2,340 organismos: Pyrgophorus coronatus 320 org con un LC de (2.0 - 5.3) 3.3 ± 0.9 mm; Aroapyr gus clenchi 380 org con un LC de (1.5 - 3.1) 2.3 ± 0.4 mm; Pomacea flagellata 320 con un LC de (23.6 - 49.9) 38.1 ± 6.9 mm; Melanoides tuberculata 500 org con un LC de (17.4 - 21.8) 19.6 ± 1.2 mm; Tarebia granifera 500 org con un LC de (16.2 - 24.0) 20.2 ± 1.9 mm; y Mexin auta impluviata 320 con un LC de (10.2 - 22.0) 13.9 ± 2.2 mm.
Pyrgophorus coronatus. De las cinco concentraciones salinas utiliza das para P. coronatus (0.5, 1.0, 2.0, 3.0, 4.0 g/L), las de 0.5 y 1.0 g/L no presentaron mortalidad; tres superaron el 50% de mortalidad (2.0, 3.0 y 4.0 g/L), en un TL50 de cinco, tres y dos horas respectivamente; el 90% de mortalidad se manifestó en las concentraciones de 3 y 4 g/L en un TL90 a las tres y dos horas; y el 100% de mortalidad se al canzó sólo en las concentraciones de 3 y 4 g/L a las tres y cinco horas respectivamente. No se presentaron diferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), ni entre las que supera ron el 50% de mortalidad (p = 0.19). La CL50 de esta especie obtenida por el análisis Probit-Log fue de 2.52 g/L y la CL90 de 4.63 g/L (Fig. 1a).
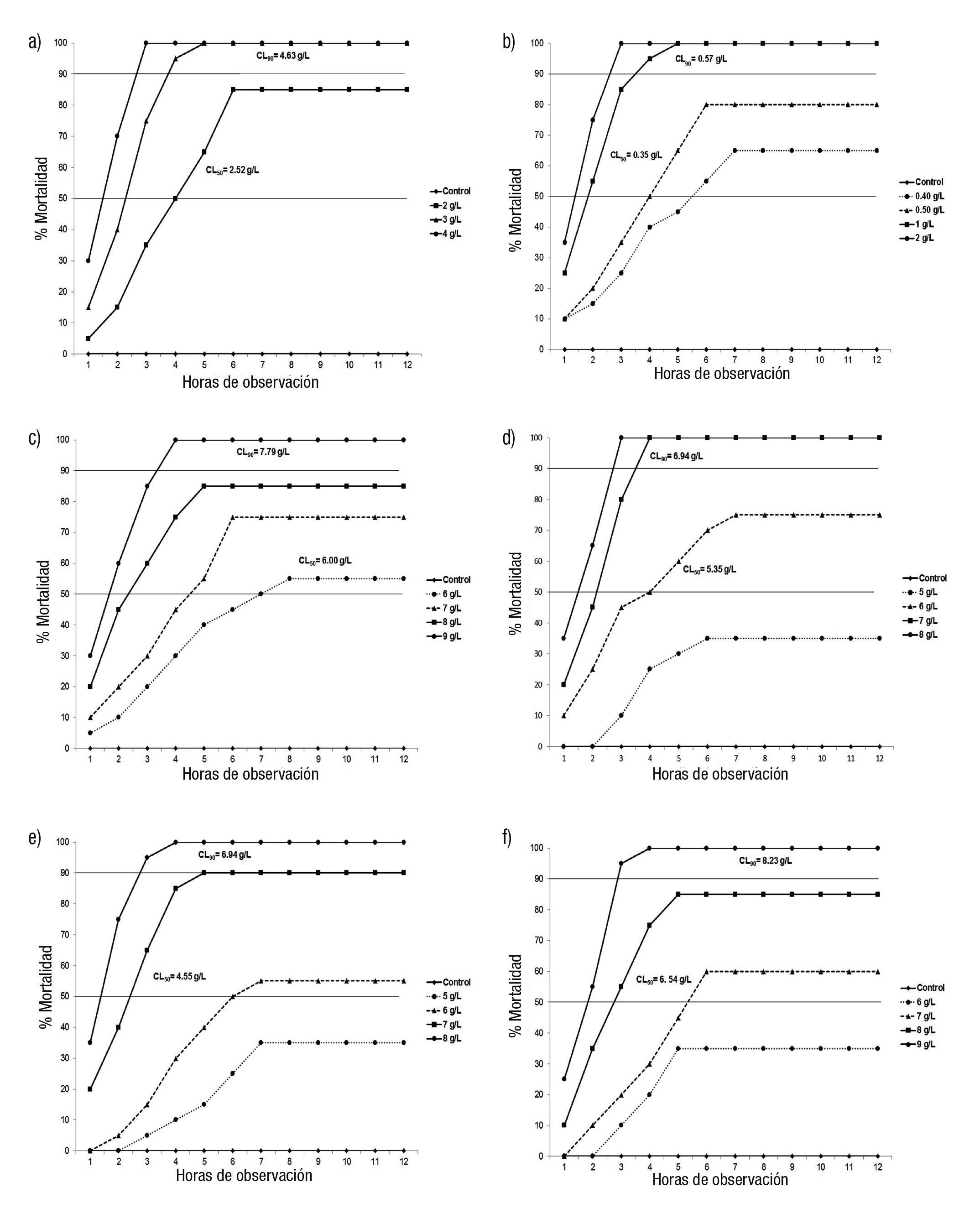
Figuras 1a-f Tolerancia a la salinidad en condiciones de laboratorio de gasterópodos dulceacuícolas de Tabasco, México: a) Pyrgophorus coronatus, b) Aroapyrgus clenchi, c) Pomacea flagellata, d) Tarebia granifera, e) Melanoides tuberculata, f) Mexinauta impluviata.
Aroapyrgus clenchi. De las seis concentraciones salinas (0.2, 0.3, 0.4, 0.5, 1.0 y 2.0 g/L) utilizadas para A. clenchi, sólo las de 0.20 y 0.30 g/L no presentaron mortalidad; cuatro superaron el 50% (0.4, 0.5, 1.0 y 2.0 g/L) con un TL50 de seis, cinco, tres y dos horas respectivamente; el 90% de mortalidad se presentó en las concentraciones de 1.0 y 2.0 g/L en un TL90 de cuatro y tres horas; el 100% de mortalidad se alcanzó en estas mismas concentraciones a las cinco y tres horas respectivamen te. No se presentaron diferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), ni entre las que superaron el 50% de mortalidad (p = 0.82). Para esta especie la CL50 obtenida por el análisis Probit-Log fue de 0.35 g/L y la CL90 de 0.57 g/L (Fig. 1b).
Pomacea flagellata. Se probaron cinco concentraciones salinas (5.0, 6.0, 7.0, 8.0 y 9.0 g/L) para P. flagellata, la de 5.0 g/L no presentó mor talidad; cuatro superaron el 50% de mortalidad (6.0, 7.0, 8.0 y 9.0 g/L) en un TL50 de siete, cinco, tres y dos horas respectivamente; el 90% de mortalidad se presentó sólo en la concentración de 9.0 g/L en un TL90 de cuatro horas; el 100% de mortalidad se alcanzó únicamente en esta última concentración a las cuatro horas. No se presentaron diferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), ni entre las que superaron el 50% de mortalidad (p = 1.00). Para esta especie la CL50 obtenida por el análisis Probit-Log fue de 6.00 g/L y la CL90 de 7.79 g/L (Fig. 1c).
Tarebia granifera. Se desarrollaron ocho concentraciones salinas (1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0 y 8.0 g/L) para T. granifera, las que no pre sentaron mortalidad fueron 1.0, 2.0, 3.0, 4.0 g/L; tres superaron el 50% de mortalidad (6.0, 7.0 y 8.0 g/L) en un TL50 de cinco, tres y dos horas respectivamente; el 90% de mortalidad se mostró en las concentracio nes de 7.0 y 8.0 g/L en un TL90 de cuatro y tres horas; y el 100% de mortalidad lo alcanzaron en estas mismas concentraciones a las cuatro y tres horas. No hubo diferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), pero sí entre las que superaron el 50% de mortalidad (p = 0.01), exponiéndose las diferencias entre la concentración de 5 g/L con las de 7 y 8 g/L y entre la de 6 y 7 g/L con la de 8 g/L. Para esta especie la CL50 obtenida por el análisis Probit-Log fue de 5.35 g/L y la CL90 de 6.94 g/L (Fig. 1d).
Melanoides tuberculata. Se probaron ocho concentraciones salinas (1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0 y 8.0 g/L) para M. tuberculata, cinco no presentaron mortalidad (1.0, 2.0, 3.0, 4.0, 5.0); tres superaron el 50% de mortalidad (6.0, 7.0 y 8.0 g/L) en un TL50 de seis, tres y dos horas respectivamente; el 90% de mortalidad se presentó sólo en la concen tración de 8 g/L en un TL90 de tres horas; el 100% de mortalidad se alcanzó en la misma concentración a las tres horas. No se manifestaron diferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), pero sí entre las que superaron el 50% de mortalidad (p = 0.01), lo que reveló las diferencias entre la concentración de 5 g/L con las de 7 y 8 g/L y entre la de 6 y 8 g/L. Para esta especie la CL50 obtenida por el análisis Probit-Log fue de 4.55 g/L y la CL90 de 6.94 g/L (Fig. 1e).
Mexinauta impluviata. De las cinco concentraciones salinas (5.0, 6.0, 7.0, 8.0 y 9.0 g/L) utilizadas para M. impluviata, la concentración de 5.0 g/L no presentó mortalidad; una no superó el 50% de mortalidad (6.0 g/L); tres superaron el 50% de mortalidad (7.0, 8.0 y 9.0 g/L) en un TL50 de seis, tres y dos horas respectivamente; el 90% de mortalidad se presentó a 9.0 g/L en un TL90 de tres horas; el 100% de mortalidad se alcanzó en la misma concentración a las cuatro horas. No hubo di ferencias significativas entre las repeticiones de cada concentración (p ≤ 0.05), sólo en las que superaron el 50% de mortalidad (p = 0.01), mostrantándose las diferencias entre la concentración de 9 g/L con las de 6 y 7 g/L. Para esta especie la CL50 obtenida por el análisis Probit-Log fue de 6.54 g/L y la CL90 de 8.23 g/L (Fig. 1f).
DISCUSIÓN
La salinidad, la temperatura y el pH son considerados universalmente como factores limitantes en los ecosistemas acuáticos; por lo cual, to dos los organismos tienen límites de tolerancia (mínimos y máximos) y fuera de estos se considera que los organismos no pueden sobrevivir, crecer o reproducirse de forma óptima (Thaman, 2007). Por lo anterior, y considerando el incremento de muchas zonas áridas y semiáridas del mundo (Williams, 1987), así como el aumento del nivel del mar y por consiguiente de la salinidad en ríos y humedales (Verbrugge et al., 2012), es necesario conocer la tolerancia a la salinidad de diversas especies, con el propósito de predecir los cambios en la distribución y estructura de sus poblaciones o comunidades.
Para las seis especies de gasterópodos se probó una tolerancia a la salinidad de 0 a 9 g/L. Las especies con el menor rango de tolerancia (< 50% de mortalidad) fueron Aroapyrgus clenchi ≤ 0.30 g/L y Pyrgo phorus coronatus ≤ 1.00 g/L y las de mayor concentración, Pomacea flagellata, Tarebia granifera y Melanoides tuberculata ≤ 5 y Mexinauta impluviata ≤ 6 g/L. Por lo anterior, podemos decir que estas especies no soportan cambios agudos de salinidad mayores a estas concentracio nes sin sufrir un importante incremento en la mortalidad. Las especies de mayor a menor tolerancia se enumeran de la siguiente forma: Mexi nauta impluviata > Pomacea flagellata > Tarebia granifera > Melanoi des tuberculata > Pyrgophorus coronatus > Aroapyrgus clenchi.
Los efectos subletales en el crecimiento y reproducción no fueron investigados, por lo que será necesario realizar nuevos bioensayos, ya que se ha visto como en Physa acuta y Potamopyrgus antipodarum un pequeño aumento en la salinidad da lugar a un aumento en el ren dimiento biológico hasta una concentración donde es maximizada, y nuevos aumentos en la salinidad entonces resultan en una disminución del rendimiento biológico hasta la muerte (Duncan, 1966; Jacobsen & Forbes, 1997; Kefford et al. 2005). Además, se tendrán que realizar pruebas sobre la adaptabilidad a cambios de salinidad, ya que Chung (1990, 2001) señala que la aclimatación de los organismos acuáticos es más conveniente en el descenso que en el aumento de salinidad.
Si bien la comparación de la tolerancia aguda entre estas seis es pecies de gasterópodos es válida, resulta difícil contrastarla con otros trabajos en los que se hayan usado otros tipos de sales, como el NaCl o sales de mar artificial como Ocean Nature (Radke et al., 2002; Zalizniak et al., 2006; Kefford et al., 2007); otros sistemas de prueba diferentes, como sistemas de flujo constante, u otras especies de moluscos o ma croinvertebrados (Mount et al., 1997; Kefford et al., 2004).
Para todas las especies se encontró una correlación inversa y sig nificativa (p ≤ 0.05) entre la concentración y el tiempo letal, es decir, que a mayor concentración el tiempo letal es menor, a partir de la CL50 (T. granifera 5.35 g/L; M. tuberculata 4.55 g/L; P. coronatus 2.52 g/L; A. clenchi 0.35 g/L; P. flagellata 6.00 g/L; M. impluviata 6.54 g/L) se incre menta rápidamente la mortalidad, comportamiento similar reportado en otros trabajos (Hart et al., 1991).
La mortalidad de los caracoles fue producida por efecto de osmo sis por la deshidratación y salida de fluidos celulares provocada por salinidad. Se observó que los límites fisiológicos fueron más bajos en los hidróbidos que en el resto de los gasterópodos, debido a su menor capacidad osmoreguladora y a la deshidratación celular (Heart et al., 1991).
La tolerancia aguda a la salinidad entre las especies introducidas Tarebia granifera y Melanoides tuberculata no mostró diferencias sig nificativas con Mexinauta impluviata y Pomacea flagellata, pero sí lo hicieron todas estas con las dos especies de hidróbidos Pyrgophorus coronatus y Aroapyrgus clenchi, que presentaron una tolerancia menor a la salinidad. Los resultados anteriores confirman la inexistencia de diferencias significativas entre especies nativas y no nativas, compor tamiento similar al registrado para moluscos colectados en el río Rin: en las especies nativas, la tolerancia máxima varió de 0.5 a 19.0‰ y para las no nativas de 1.0 a 28.0‰. La tolerancia media máxima entre las especies nativas y no nativas no presentó diferencias significativas (Verbrugge et al., 2012). Bolaji et al. (2011) mencionan que en la expo sición a la salinidad de Melanoides tuberculatus a una CL50 (24,42 ‰) en 96 h era 1.7 veces más tóxico que a 24, 48 y 72 horas de exposición, además señalan que M. tuberculatus podría no ser capaz de sobrevivir en aguas marinas debido al nivel de tolerancia que no es más de 25 ‰., valor muy superior al registrado en este trabajo.
A los tiáridos Melanoides tuberculata y Tarebia granifera se les ha encontrado en zonas estuarinas, manglares, ríos, lagunas dulceacuíco las, hasta desagües contaminados, lo que demuestra su amplia capaci dad adaptativa. El comportamiento que éstas presentan ante el cambio climático es crucial para su sobrevivencia. Se ha observado que Tarebia granifera tiene una adaptación ambiental de dispersión más favorable que Melanoides tuberculata. Adicionalmente, pueden afectar a las es pecies nativas por medio de diferentes mecanismos adaptativos, entre los cuales destacan: la hibridación, éxito reproductivo, competencia por alimento y espacio, depredación, transferencia de patógenos, altera ción del hábitat, desplazamiento de especies nativas, alteración de la estructura de los niveles tróficos, introducción de parásitos y enferme dades (Goldberg & Triplett, 1997; Bhaskar & Pederson, 2003).
Las seis especies de gasterópodos estudiados, al igual que muchos invertebrados acuáticos, son consideradas osmoconformistas y pueden dividirse en dos grupos: osmoconformistas eurihalinos con amplia pre ferencia dulceacuícola como Melanoides tuberculata, Tarebia granifera, Pomacea flagellata y Mexinauta impluviata, que logran habitar en algu nas áreas de estuarios cercanas a la desembocadura de ríos y arroyos dulceacuícolas donde la salinidad es baja y rara vez y por tiempo limi tado se encuentran en áreas de mediana a alta salinidad; por otro lado los estenohalinos como Pyrgophorus coronatus y Aroapyrgus clenchi, que habitan cuerpos de agua dulce y sólo por periodos de tiempo muy cortos, logran penetrar a lagunas salobres en áreas de muy baja salini dad (Hill & Wyse, 2006; Wingard et al., 2008; Carvalho & Barros, 2015).
Tarebia granifera puede causar perturbaciones ecológicas y po tencialmente reducir la biodiversidad mediante el desplazamiento de invertebrados endémicos. Esta especie es capaz de sobrevivir en con diciones con altos índices de salinidad por largos periodos de tiempo (30 g/L durante 65-75 días). Sin embargo, los caracoles aclimatados en agua dulce y expuestos rápidamente a soluciones de 30 y 40 g/L mueren en un 100% en 48 horas (Miranda et al., 2010). Este compor tamiento es similar al registrado en este trabajo pero en sólo 9.0 g/L y a las 3 horas.
Se observó que los caracoles pueden adaptarse a cambios de sa linidad cuando se da con incrementos paulatinos y hasta cierta con centración (Miranda et al., 2010). Sin embargo, son muy susceptibles a cambios bruscos de salinidad.
Los estudios acerca del efecto del cambio climático en los ma croinvertebrados, entre ellos los moluscos que habitan en humedales como ríos y lagos de agua dulce, han mostrado cambios en la composi ción de especies y diversidad (Mouthon & Daufresne, 2006; Burgmer et al., 2007), aunque las respuestas de estos grupos al cambio climático en los humedales son difíciles de predecir por la falta de conocimiento sobre las funciones fisiológicas y tolerancia de cada especie (Heino et al., 2009).
En las costas de Tabasco, desde el punto de vista morfodinámico costero, los cambios morfológicos de su línea de costa son una de las evidencias más claras en el retroceso de la misma hacia el interior de la porción continental (Ortiz, 1992). Indican además un gradiente acele rado de retroceso en diversas localidades del estado.
Las interpretaciones de estos resultados por cartografía compa rativa, entre los años 1943-1958 y 1972-1984 (Ortiz-Pérez & Benítez, 1996), muestran que el retroceso de la costa es un evento común en todo el frente deltaico de los estados de Tabasco y Campeche, con una tasa media anual de -8 m, años extremos de hasta -15 m/año, en la desembocadura del río San Pedro-San Pablo.
Los cálculos de las tendencias entre 1984 y 1995, presentados en el trabajo de Hernández et al. (2008) para el estado de Tabasco, también reflejan la tendencia sostenida desde 1943, con valores entre -9 y -10 m/año, estos retrocesos se reflejarán cada vez más en la sa linización de los cuerpos de agua cercanos a la costa por la intrusión salina que se genera.
Por el incremento de la salinidad en los cuerpos de agua costeros en el estado de Tabasco, se espera que los patrones de distribución de la mayoría de las especies de gasterópodos se modifiquen, así como la estructura de sus poblaciones y comunidades a las que pertenecen, por lo que es necesario realizar un monitoreo permanente que permita tomar decisiones oportunas a fin de evitar daños a este grupo de mo luscos.











 nova página do texto(beta)
nova página do texto(beta)


