Introducción
Los arroyos son ecosistemas lóticos que forman parte importante de las redes fluviales (Clarke et al., 2008), transportan sustancias disueltas y material particulado en la columna de agua a través de redes de drenaje y presentan una gran variedad de hábitats en gradientes ambientales con una alta complejidad espacial (Allan, 2004).
Actualmente los arroyos se han visto degradados por la introducción de actividades ganaderas y agrícolas, lo que ha provocado un efecto negativo directo en el hábitat físico, la hidrología y las comunidades de macroinvertebrados bentónicos (De Long & Brusven, 1994; Pozo et al., 1997; Nessimian et al., 2008).
Estas actividades pueden afectar la biota en diferentes escalas espaciales y temporales. Las comunidades biológicas, al acumular los efectos de diferentes tipos de estresores, reflejan las condiciones generales del ecosistema, actuando como buenos indicadores de impacto al mostrar una medida ecológica del cambio en las condiciones ambientales (Barbour et al., 1999).
El conocimiento de la estructura y composición de los grupos bentónicos en un sistema acuático es fundamental para relacionarlos con su medio (Alba-Tercedor, 1996). Al considerar cualquier patrón ecológico es importante conocer el estudio de la diversidad regional en cuanto al número de especies dentro de la misma y por otro lado, la diversidad local, es decir, el número de especies dentro de un sitio o de una localidad (Levin, 1992). En otras palabras, es importante conocer la composición y estructura de la entomofauna acuática local y regional para poder entender el efecto de los diversos procesos naturales y antropogénicos, en los sistemas acuáticos. El presente estudio pretende determinar la composición y diversidad de la entomofauna acuática en distintos municipios del estado de Tabasco en relación con las variables ambientales, ya que los sistemas ribereños están muy bien representados.
Materiales y métodos
Área de estudio. El estado de Tabasco representa el 1.3% del territorio nacional. Su clima es cálido-húmedo, con una temperatura de 27°C y una precipitación media anual de 2550 mm. La superficie está constituida en un 27.76% por humedales ribereños, lacustres, costeros y palustres (Barba et al., 2006).
Actividades de campo. Se realizaron muestreos diurnos en 38 localidades durante los años de 2010 a 2013 (Tabla 1; Fig. 1). Los parámetros fisicoquímicos de la columna de agua se determinaron mediante una sonda multiparamétrica marca HANNA, modelo HI 9828. Además, se determinó la profundidad y la transparencia con el disco de Secchi. Se utilizaron diversas artes de colecta en cada localidad: nucleador con un área de 0.0033 m2; draga Petite Ponar con área de 0.024 m2 (AENOR, 1995); red de cuchara con un arrastre de 10 m; luz de malla 500 µm y área de 0.087 m2 y red tipo Surber con luz de malla de 500 µm y área de 0.14 m2. La colecta de los organismos fue por triplicado para cada arte y localidad con un total de 36 muestras por localidad. Los organismos se colocaron en bolsas y se etiquetaron y fijaron en alcohol al 96% para su posterior análisis en laboratorio.
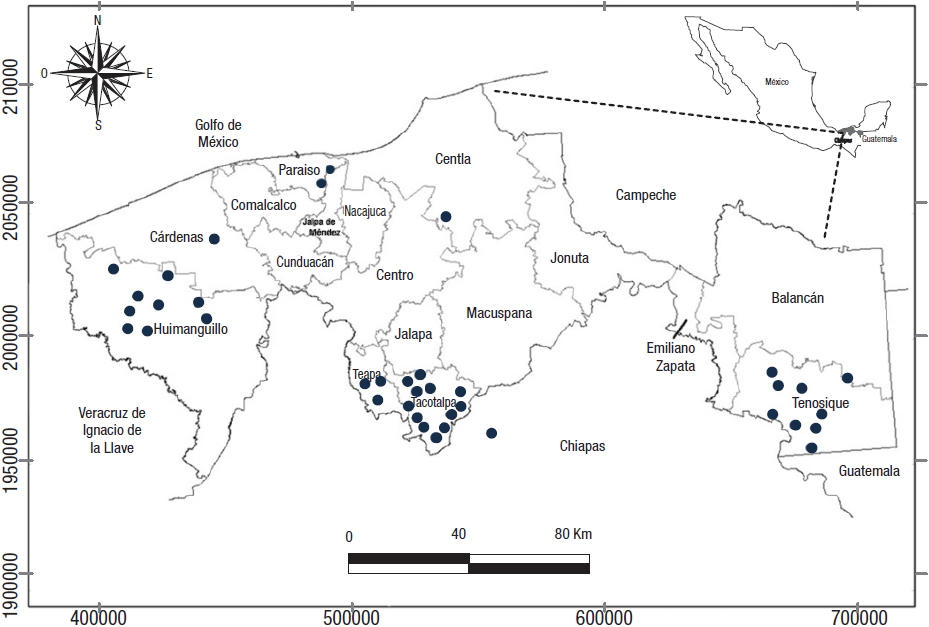
Figura 1 Localidades de muestreo por municipio, de la entomofauna acuática, en arroyos de Tabasco, México.
Actividades de laboratorio. Los organismos colectados fueron identificados a nivel de familia gracias a claves taxonómicas especializadas (Wiggins, 2000; Merritt et al., 2008) y se preservaron en alcohol al 96%. Posteriormente, se depositaron en la colección de referencia de fauna acuática de ECOSUR Unidad Villahermosa.
Análisis de datos. Los organismos, una vez contabilizados, se pesaron con una balanza analítica con precisión de ±0.001 g para obtener su abundancia relativa en términos de densidad (ind/m2) y biomasa (g/m2). La riqueza y diversidad de la entomofauna acuática de cada municipio se calcularon con diferentes índices: el Índice de riqueza de Margalef (D) (Margalef, 1969), Índice de diversidad Shannon-Wiener (H’) (Shannon & Weaver, 1963) e Índice de equidad de Pielou (J’) (Pielou, 1966). Para comparar la abundancia de los organismos entre las artes y localidades, se estandarizaron los datos a densidad (ind/m2). Se aplicó también un Análisis de Componentes Principales (ACP) con las variables fisicoquímicas, cuya finalidad fue conocer su ordenación o agrupación en función de éstas, y a su vez, determinar las variables con mayor influencia en dicha ordenación de los municipios. Además, se analizaron las asociaciones entre la estructura de la comunidad de insectos y las variables ambientales, mediante el Análisis de Correspondencia Canónica (ACC) (Ter Braak & Verdonshot, 1995). Los análisis de ordenamientos se realizaron con el software STATISTICA 7. El criterio utilizado para determinar la significancia de los coeficientes resultantes fue de 0.50, categorizado como bueno de acuerdo con McGarigal et al. (2000).
Resultados
Parámetros fisicoquímicos. Las variaciones espaciales de los parámetros fisicoquímicos se resumen en la Tabla 2. La profundidad presentó un valor mínimo de 0.3 m en Huimanguillo y un máximo de 1 m en Tacotalpa, Paraíso y Cárdenas. El pH arrojó valores de neutros a básicos en los municipios. La temperatura alcanzó un mínimo de 25.03°C en Teapa y un máximo de 32.2 en Paraíso. El oxígeno disuelto registró un valor mínimo de 0.37 mg L-1 en Centla y un máximo de 7.05 mg L-1 en Tacotalpa. La conductividad mostró un valor mínimo de 0.46 mS cm-1 en Cárdenas y un máximo de 850.5 mS cm-1 en Paraíso. La salinidad obtuvo un valor mínimo de 0.05 0/00 en Teapa y un máximo de 0.5 0/00 en Paraíso. Las variables fisicoquímicas que presentaron diferencias significativas entre los diversos municipios fueron: temperatura con F= 4.1 y una p≤0.006; el oxígeno disuelto con F= 5.4 y una p≤0.001; la conductividad con F= 7.9 y una p≤0.001 y la salinidad con F= 5.5 y una p≤0.001 (Fig. 2a-d). Con base en los datos ambientales, el análisis de componentes principales (ACP) explicó el 60.26% de la variación total con los dos primeros ejes: el eje 1 con 38% de la variación y el eje 2 con 21.78% de la variación. Las variables ambientales con mayor influencia en el eje 1 fueron la conductividad y la salinidad, para el eje 2 fueron la profundidad y el pH, los cuales presentaron valores positivos y negativos mayores a 0.5. La ordenación de los municipios mediante el ACP deja ver que Tacotalpa presenta una correlación positiva con el oxígeno disuelto, mientras que Teapa y Tenosique presentan una correlación con la salinidad y la conductividad; Centla y Huimanguillo están correlacionados con la profundidad y el pH (Fig. 3a-b).
Tabla 2 Valores promedio de los parámetros fisicoquímicos de la columna de agua de arroyos de Tabasco, México, por municipio.
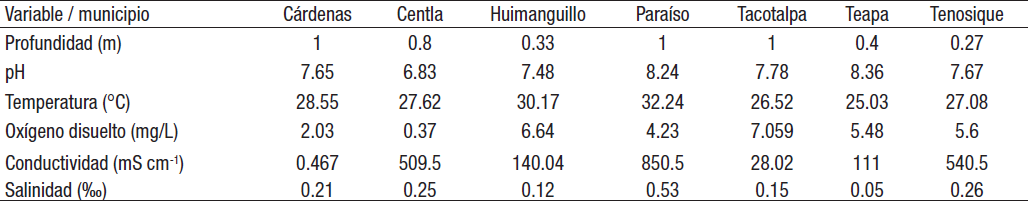

Figuras 2a-d Diagramas de caja y bigotes de las variables ambientales que presentaron diferencia significativa entre arroyos de los municipios de Tabasco, México (p≤0.05). (a) = temperatura. (b) = oxígeno disuelto. (c) = conductivida. (d) = salinidad.

a) Comportamiento de las variables fisicoquímicas. b) Ordenación de los municipios en función de las variables fisicoquímicas. Clave de localidad: (1) Cárdenas, (2) Centla, (3) Huimanguillo, (4) Paraíso, (5) Tacotalpa, (6) Teapa y (7) Tenosique. Clave de valores fisicoquímicos: Cond = conductividad; Temp= temperatura; OD = oxígeno disuelto Sal= salinidad; Z= profundidad.
Figuras 3a-b Análisis de componentes principales de arroyos por municipio de Tabasco, México.
Composición biológica. Se registró un total de 5,315 organismos correspondientes a 56 familias y 11 órdenes. En Cárdenas se registraron 145 organismos correspondientes a seis familias, en Centla se registraron 415 organismos correspondientes a 11 familias, en Huimanguillo se registraron 369 organismos y 25 familias, en Paraíso 21 organismos correspondientes a ocho familias, en Tacotalpa 3,044 organismos de 42 familias, en Teapa fueron 175 organismos y 1 familia, mientras que en Tenosique se registraron 1,146 organismos y 29 familias.
Estructura faunística. De la densidad total de organismos, diez familias presentaron densidades mayores a 2000 ind/m2 con una representación de 76% de la densidad total. No obstante, las familias Chironomidae, Phylopotamidae, Caenidae, Heptagenidae e Hydropsychidae fueron las dominantes, ya que en conjunto representaron el 54% de la densidad total (Tabla 3). Las familias dominantes por municipio fueron, en Cárdenas, Notonectidae y Baetidae; en Centla, Hydrophilidae y Belostomatidae; en Huimanguillo, Polymetarcyidae y Vellidae; en Paraíso, Libellulidae y Stratiomyidae; en Tacotalpa, Phylopotamidae, Chironomidae y Caenidae; en Teapa, Baetidae, mientras en Tenosique dominaron Caenidae, Chironomidae y Coenagrionidae.
Tabla 3 Distribución espacial de la densidad total (ind/m2) de la entomofauna acuática por municipio, en arroyos de Tabasco, México.
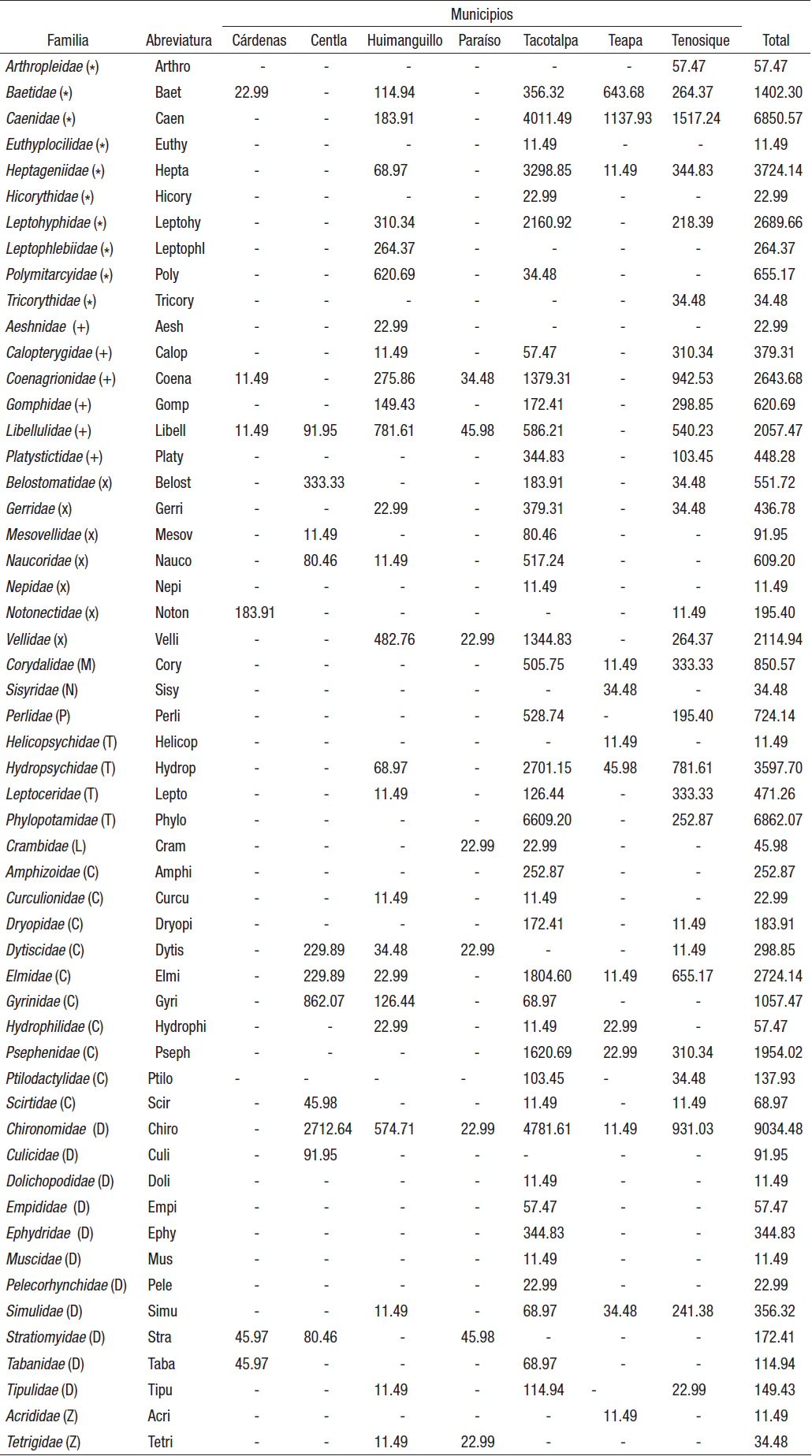
Órdenes de entomofauna acuática: (*) = Ephemeroptera, (+) = Odonata, (x) = Hemiptera, (M) = Megaloptera, (N) = Neuróptera, (P) = Plecoptera, (T) = Trichoptera, (C) = Coleoptera, (D) = Diptera. (Z) = Orthoptera.
Diversidad. Comparando la diversidad entre municipios, el valor más alto de diversidad (H’) se presentó en Tacotalpa (2.87), seguido por Tenosique (1.09) y el mínimo en Cárdenas (0.05). La riqueza (D) fue mayor en Cárdenas (0.979) y Teapa (0.936) y la mínima se presentó en Tacotalpa (0.468). La equidad (J’) tuvo el máximo valor en Tacotalpa (0.532), seguido por Tenosique (0.226) y Cárdenas con el mínimo (0.021) (Fig. 4).
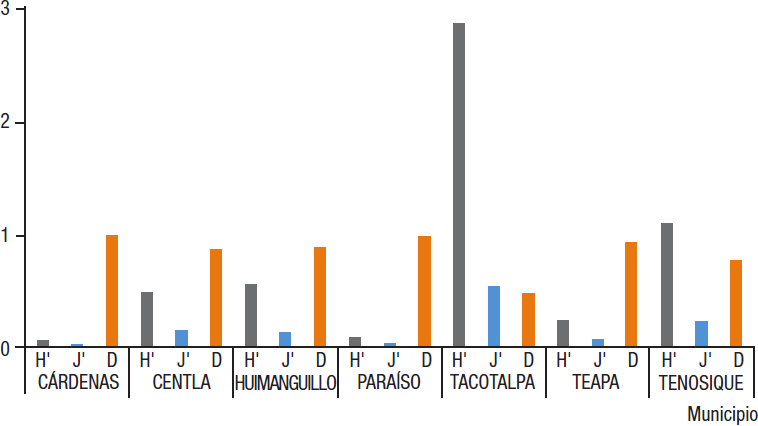
Figura 4 Diversidad de la entomofauna acuática por municipio. H'= Diversidad (bits/ind). D= Riqueza de especies (sp/ind). J'= Equidad (bits).
Análisis multivariado de correspondencia canónica (ACP). El resultado del ACP realizado determinó que el pH y el oxígeno disuelto son las variables que tienen más peso en la ordenación de las familias de insectos para el primer eje, el cual explica el 43% de la variación total, mientras que para el segundo eje (con 17%) la variación total se explica por el oxígeno disuelto y la transparencia (Fig. 5). Las familias correspondientes al orden Ephemeroptera se relacionaron principalmente con el oxígeno disuelto, mientras que los órdenes Coleoptera y Hemiptera se relacionaron con la transparencia y pH.
Discusión
Con respecto a los resultados obtenidos en este estudio se registró un mayor número de familias en el municipio de Tacotalpa y Tenosique; esto se atribuye a la variación de diversos parámetros ambientales como la temperatura y el oxígeno disuelto, entre otros, los cuales presentaron diferencias significativas con una p≤0.006, que coincide con otros autores quienes mencionan que los factores ambientales más importantes que regulan la distribución de insectos acuáticos en ecosistemas lóticos son: la concentración de oxígeno disuelto, la temperatura del agua (Bass, 1995; Castella et al., 2001; Li et al., 2001; Sullivan et al., 2004), y la química del agua, incluyendo pH, salinidad y concentraciones de iones o elementos, así como la presencia de vegetación riparia (Subramanian et al., 2005); aunque esta última no se cuantificó, durante las campañas de muestreo se apreció la presencia de una mayor cobertura en los arroyos correspondientes a los municipios de Tacotalpa y Tenosique, en donde se registró el mayor número de familias. Por el contrario, en los municipios de Paraíso Cárdenas y Huimanguillo, las zonas aledañas a los puntos de colecta, están fuertemente perjudicadas debido a las actividades agrícolas de la región (Barba, 2012). Lo anterior ha sido mencionado por diversos autores con estudios en regiones templadas y tropicales que han encontrado que la diversidad y riqueza de las especies decrece en áreas impactadas por las actividades humanas (Stone & Wallace, 1998; Ometo et al., 2000; Benstead et al., 2003), además de presentar cauces con carencia de cantos rodados y presencia de sedimento terrígeno, lo que disminuye drásticamente la disponibilidad de nichos y como consecuencia, la disminución de la diversidad (Allan et al., 1997). También existen otros factores que en menor medida explican la estructura y composición de la entomofauna acuática, como los patrones estacionales (Miserendino & Pizzolon, 2003; Waite et al., 2004; Sporka et al., 2006; Joshi et al., 2007). Es importante destacar que el presente estudio es un acercamiento para entender la problemática existente en los sistemas acuáticos del estado de Tabasco, sin embargo, nos queda claro que hace falta mucho más esfuerzo de muestreo en diversas zonas para poder realizar una evaluación más real de la biota de los sistemas acuáticos.











 nova página do texto(beta)
nova página do texto(beta)




