Introducción
Los ecosistemas dulceacuícolas, en particular los ríos, se encuentran entre los hábitats más amenazados del mundo (Hering et al., 2006). Una de las razones de su alta vulnerabilidad es que han sido considerados como ecosistemas que presentan un alto grado de conectividad con su entorno, conectividad que contribuye a delinear las características bióticas y abióticas de su curso (Vannote et al., 1980; Robinson et al., 2014). De acuerdo con Wohl (2014), los ríos presentan diversos grados de conectividad: a) conexión longitudinal, que contribuye a que el agua, los sedimentos y los solutos sean transportados río abajo desde las partes altas; en este eje algunos organismos pueden transportarse a lo largo del río; b) conexión lateral entre el río y su planicie de inundación, que también permite el transporte de agua, sedimentos, solutos y organismos hacia las planicies de inundación; c) conexión lateral con tierras altas, que se manifiesta durante las tormentas o por procesos de erosión que incorporan materiales (materia orgánica, sedimentos y solutos) de la cuenca de captación al curso del río; d) conexión vertical, que vincula los flujos superficiales con los sedimentos; e) conexión vertical profunda, que conecta el curso del río con la zona de agua subterránea y da lugar al intercambio en ambos sentidos, y f) la conexión del río con la atmósfera. Debido a estos niveles de conectividad y los consecuentes flujos de materia y energía, se reconoce que los ríos son sistemas integradores, ya que su forma y dinámica son el resultado de los procesos físicos, químicos y biológicos (contemporáneos e históricos) de su cuenca de captación (Wohl, 2014).
A la fecha, es muy conocido que la intervención humana en los paisajes es la principal amenaza de la integridad ecológica de los ecosistemas ribereños, pues impacta en el hábitat, la calidad del agua y la biota por medio de diferentes y complejas rutas (Allan, 2004). El cambio en el uso del suelo con sustitución de la vegetación natural es otra de las razones locales por la cual los sistemas fluviales se ven afectados (Kasangaki et al., 2006). Conforme el disturbio en el uso del suelo se incrementa por las actividades antrópicas, se hace indispensable determinar la forma en que éstas influyen en la estructura y función de los ecosistemas acuáticos, particularmente en los ríos, así como el potencial de restauración que puede tener el ecosistema impactado dado su alto nivel de susceptibilidad a los disturbios. Por lo anterior, un aspecto clave para evaluar la calidad de los sistemas acuáticos es comprender los vínculos entre el uso del suelo con los cambios en las condiciones fisicoquímicas y con los ensambles bióticos de los ríos (Kasangaki et al., 2006).
Diversas investigaciones han demostrado que la sustitución de la vegetación natural por otros usos del suelo (pastizales, uso agrícola o urbano) puede influir en el hábitat y en las comunidades acuáticas de distintas formas. La pérdida de vegetación terrestre puede desencadenar diversas modificaciones, como alteraciones en la evapotranspiración, infiltración y el régimen del flujo de agua; aumento en el ingreso de sedimentos, alteración en el sustrato del río y modificación en la diversidad de organismos acuáticos (Quinn & Strout, 2002); así como el incremento en el régimen de radiación solar y en la temperatura (Rutherford et al., 1997). El uso agrícola puede, además, degradar la calidad del agua por la adición de contaminantes provenientes de fuentes no puntuales, lo que aumenta la tasa de ingreso de nutrientes y, como consecuencia, afecta la estructura del hábitat y del flujo de la corriente (Johnson et al., 1997; Allan, 2004); en el caso de lagos y reservorios receptores, acrecienta la producción primaria, lo cual modifica la estructura trófica de la comunidad acuática (Gurtz & Wallace, 1984). En general, cualquier modificación en el uso del suelo puede favorecer la incorporación de sustancias tóxicas, por ejemplo en zonas agrícolas, por el uso de pesticidas; en zonas industriales, por las descargas de diversos compuestos, y en zonas urbanas, por descargas que pueden contener agentes potencialmente tóxicos, como productos de limpieza y fármacos, entre otros (Stewart et al., 2001). Por otra parte, la magnitud de los efectos en las características fisicoquímicas y en las comunidades acuáticas dependerá, a su vez, de la magnitud de los efectos en los cambios de uso del suelo.
Particularmente, los invertebrados acuáticos son un grupo de organismos que han sido empleados para la evaluación de la calidad del agua desde los años sesenta (Binghui & Liu, 2010) debido a que poseen una amplia gama de respuestas al estrés ambiental en diferentes niveles de organización, y cuyos efectos se manifiestan desde cambios en el metabolismo de los organismos hasta alteraciones en la estructura y los atributos propios de la comunidad (Alonso & Camargo, 2005; Springer, 2010). En ese sentido, cuando los cuerpos de agua sufren algún tipo de impacto, la estructura de la comunidad de macroinvertebrados acuáticos se ve modificada, ocasionando la muerte de los organismos más sensibles (intolerantes) a los eventos de estrés y favoreciendo el desarrollo de aquellos organismos menos sensibles (tolerantes) a las condiciones adversas (Alba, 1996; Reece & Richardson, 1999; Lytle, 2002; Feld & Hering, 2007; Muralidharan et al., 2010). Esto se debe a que los macroinvertebrados acuáticos han adquirido una serie de adaptaciones (morfológicas y fisiológicas) que les permiten sobrevivir y desarrollarse dependiendo de la naturaleza y magnitud del estrés (Alonso & Camargo, 2005). Estas adaptaciones incluyen cierto grado de tolerancia hacia diversos factores, como temperatura, pH, salinidad, concentración de oxígeno disuelto, nutrientes, cantidad de materia orgánica, entre otros (Sandin & Johnson, 2000; Brosse et al., 2003; Soldner et al., 2004; Archaimbault et al., 2005; Czerniawzka-Kusza, 2005; Feld & Hering, 2007; Bonada et al., 2007; Smith & Smith, 2007; Dhembare, 2011).
En México, la alta tasa de urbanización, lo cambios en el uso del suelo, la deforestación y las diversas actividades económicas han impactado severamente la salud de los cuerpos de agua (Sedeño-Díaz & López-López, 2007). Las subcuencas de los ríos Apatlaco y Chalma-Tembembe, ubicados en la cuenca del Balsas, poseen un alto grado de impacto antropogénico. Especialmente, el río Apatlaco recibe descargas domésticas, industriales y agrícolas, además de que a lo largo de su cauce hay asentamientos humanos irregulares. Por otra parte, la subcuenca del río Chalma-Tembembe sufre los efectos ocasionados por la presencia de algunos asentamientos humanos y zonas agrícolas (CONAGUA, 2010, 2012a). En México, la información sobre bioindicación, como una herramienta de evaluación, es escasa (Weigel et al., 2002, Hurtado et al., 2005) y el biomonitoreo no está contemplado aún dentro de la normativa; por lo cual, es necesario identificar aquellos bioindicadores que nos permitan asociar el impacto de diferentes usos del suelo con la calidad del agua, por ejemplo, los ensambles de invertebrados acuáticos (IA). El objetivo de la presente investigación es analizar las relaciones que guardan las características fisicoquímicas del agua y los ensambles de macroinvertebrados acuáticos con los distintos usos del suelo adyacentes a los ríos Apatlaco y Chalma-Tembembe, considerando que ambos ríos se ven influenciados por un mosaico de diferentes usos del suelo, principalmente, vegetación natural, uso agrícola y uso urbano.
Materiales y métodos
Área de estudio. Los ríos Apatlaco y Chalma-Tembembe se localizan en la cuenca del río Balsas (Fig. 1), una de las más grandes en México, que cuenta con un área de 117 405 km2 (CONAGUA, 2012b). La subcuenca del río Chalma-Tembembe está formada por el río Chalma, cuya longitud es de 70 km, y el río Tembembe, de 50.72 km, que escurre del Eje Neovolcánico. El tributario Chalma confluye con el río Tembembe en su porción más baja. La subcuenca Chalma-Tembembe presenta un clima templado durante todo el año, con una precipitación anual de 600 mm y conserva algunas áreas de bosque caducifolio (aproximadamente 47%); mientras que el territorio restante comprende principalmente zonas de uso agrícola (CONAGUA, 2012b). Se eligieron seis sitios de estudio en esta subcuenca a lo largo de ambos ríos: El Arco (CT1), La Loma (CT2), El Platanar (CT3), Casa de la Escuela (CT4), Coatlán (CT5) y Hacienda de Cuautlita (CT6). El río Apatlaco posee una longitud de 63 km. La precipitación anual varía de los 850 mm a los 1 500 mm; la vegetación natural ha sido altamente fragmentada y transformada, ya que sólo 27% del área total corresponde al bosque caducifolio, bosque de coníferas y bosque de encino. Además, existe un corredor urbano e industrial importante a lo largo del cauce del río y diversas áreas de uso agrícola (CONAGUA, 2012a). Se seleccionaron nueve sitios de estudio en el cauce principal del río: Las Truchas (AP1), El Pollo (AP2), El Rayo (AP3), El Encanto (AP4), Salida Panocheras (AP5), Xochitepec (AP6), Alpuyeca (AP7), Xoxocotla (AP8) y Zacatepec (AP9); dos en el tributario occidental: Buenavista 1 (AP10) y Buenavista 2 (AP11), que son dos puntos ubicados antes y después del efluente de una planta de tratamiento de aguas residuales, y tres en el tributario oriental: El Texcal (AP12), La Gachupina (AP13) y Las Juntas (AP14), lo que da un total de 14 sitios (Fig. 1). Se llevaron a cabo cuatro campañas de muestreo que comprenden la temporada de estiaje (en otoño: diciembre 2012, y en invierno: febrero-marzo 2013) y de lluvias (en verano: agosto-septiembre 2012 y primavera: junio 2013).

Figura 1 Localización de la cuenca del río Balsas y ubicación geográfica de los sitios de estudio en las subcuencas del Río Balsas: Apatlaco y Chalma-Tembembe, México.
Uso del suelo. Los datos de uso del suelo fueron generados empleando las capas de uso del suelo para las subcuencas de los ríos Apatlaco y Chalma-Tembembe, información del Marco Geoestadístico Nacional 2010, facilitada por el INEGI. Los usos del suelo se agruparon en tres categorías: vegetación natural, zonas agrícolas (incluyendo actividad pecuaria) y zonas urbanas. Posteriormente, se determinó el área de impacto del uso del suelo para cada sitio de estudio trazando una línea imaginaria de 2 kilómetros de longitud a partir de cada sitio, siguiendo el cauce del río contracorriente; después se trazó una zona de influencia con un radio de 500 m alrededor de dicha línea, formando un polígono de alrededor de 2 kilómetros cuadrados; finalmente, la extensión correspondiente a cada uso del suelo dentro de la zona de influencia fue delimitada para calcular su área en km2 y, a su vez, fue convertida a porcentaje. Lo anterior se realizó empleando el software Mapa Digital versión 5.1.1, descargado desde la página oficial del INEGI.
Análisis fisicoquímico. En cada sitio de estudio se registraron in situ temperatura del agua (°C), conductividad (mS/cm), pH y concentración de oxígeno disuelto (mg/L O2 ), empleando una sonda multiparamétrica Quanta. Adicionalmente, se tomaron muestras de agua para cuantificar la demanda bioquímica de oxígeno (DBO5 mg/L O2 ), concentración de cloruros (mg/L Cl-), alcalinidad (mg/L CaCO3 ) y coliformes totales y fecales (NMP/100mL), de acuerdo con los métodos estándar de la APHA (Eaton et al., 2005). Además, se determinó la concentración de nitritos (mg/L NO2 ), nitratos (mg/L NO3 ), nitrógeno amoniacal (mg/L NH3), nitrógeno total (NT), ortofosfatos (mg/L PO4 ), fósforo total (PT), dureza (mg/L CaCO3 ), sulfatos (mg/L SO4 ) y color (U Pt-Co), según las técnicas del espectrofotómetro Hach DR 2500. Los valores obtenidos por temporada de colecta para cada parámetro fueron promediados para su posterior procesamiento.
Invertebrados acuáticos. Se tomaron muestras de invertebrados acuáticos (IA) provenientes de un monitoreo multihábitat, el cual incluyó zonas de rápidos, rocas, pozas, vegetación sumergida y vegetación ribereña, empleando una red de pateo y redes de cuchara tipo D (dependiendo del microhábitat), ambas con una luz de malla de 500 mm; y se estandarizó el esfuerzo de recolecta a 30 minutos de tiempo efectivo. Los organismos fueron separados en campo y conservados en frascos con alcohol a 70%. Posteriormente, en el laboratorio se llevó a cabo la identificación taxonómica de los organismos a nivel de familia mediante las claves de Thorp & Covich (2001) y de Merritt et al. (2008); además, los organismos fueron contabilizados para obtener la abundancia (número de individuos de cada familia) y calcular el índice de diversidad de Shannon-Wiener (H’); en ambos casos, los valores obtenidos por temporada de estudio fueron promediados. Para el caso de la riqueza de familias y la H’ se realizó una ANOVA con el paquete estadístico SigmaPlot versión 11.0, para detectar diferencias estadísticas entre sitios de estudio.
Análisis de resultados. La caracterización fisicoquímica de los sitios de estudio y los usos del suelo se realizó con un análisis de componentes principales (ACP). Para este análisis, la matriz incluyó los sitios de estudio y, como atributos de cada sitio, los valores promedio de los parámetros fisicoquímicos y los porcentajes de uso de suelo; el ACP se realizó con la correlación de Pearson. Con el fin de evaluar el nivel de similitud de los sitios de estudio por sus características de uso del suelo, parámetros fisicoquímicos y sus comunidades biológicas, se elaboraron dos análisis de agrupación jerárquica por correlación de Pearson (AJCP). El dendrograma se construyó con el método de unión por promedios no ponderados y corte automático por entropía. El primero de los análisis (AJCP-I) comprendió los datos de uso de suelo, la H’ promedio y las abundancias promedio de las familias de invertebrados acuáticos por sitio de estudio, y el segundo (AJCP-II) se llevó a cabo con los resultados de uso del suelo, el promedio de los parámetros fisicoquímicos, la H’ y la abundancia de las familias de IA.
Adicionalmente, se realizó un análisis de correlación de Pearson (CP) para determinar si existe correlación significativa (p < 0.05) entre las familias de IA, las condiciones fisicoquímicas de los sitios de estudio y los usos del suelo, y así identificar a los taxa que pudieran ser empleados como potenciales indicadores de alteración por determinado uso de suelo; para ello se empleó una matriz que incluyó los sitios de estudio, y como atributos, los diferentes usos del suelo y los parámetros fisicoquímicos de los sitios de estudio, los valores promedio de abundancia y la H’.
Los datos empleados para los ACP, los AJCP y la correlación de Pearson fueron previamente estandarizados con la ecuación Ln(x+1), y en el caso de los porcentajes, se empleó la fórmula arcsin√x, donde x corresponde al valor por estandarizar. El procesamiento de los datos se llevó a cabo con el paquete estadístico XLSTAT versión 2015.
Resultados
Uso del suelo. El mapa de uso de suelo obtenido para las subcuencas de los ríos Apatlaco y Chalma-Tembembe se muestra en la Figura 2, mientras que los porcentajes correspondientes al área de impacto para cada sitio de estudio por los diferentes usos del suelo se resumen en la Tabla 1. Para el río Chalma-Tembembe, los porcentajes predominantes correspondieron a la categoría vegetación natural, de 75 a 85% en la parte media del río (El Platanar y Casa de la Escuela), y al uso agrícola, de 80 a 86% en la parte alta y baja del río; mientras que el uso urbano obtuvo porcentajes menores a 12% a lo largo de su cauce. Por su parte, en el río Apatlaco se observa que sólo la localidad de Las Truchas cuenta con un porcentaje importante de vegetación natural circundante (≈98%); posteriormente, el curso del río atraviesa por una zona donde el uso del suelo fue sustituido por uso urbano y agrícola, principalmente en las localidades de El Pollo, El Rayo y El Encanto, con porcentajes de 86, 34 y 14% para uso urbano, y de 13, 66 y 86% para uso agrícola, respectivamente; después, algunas localidades correspondientes a la parte baja del cauce principal, como Salida Panocheras, Xochitepec y Xoxocotla, presentaron una combinación de los tres usos de suelo, con porcentajes de 36, 2 y 13% de vegetación natural, y 15, 54 y 78% de uso agrícola, respectivamente; el porcentaje restante correspondió a zonas urbanas. Los sitios de Alpuyeca y Zacatepec presentaron una proporción casi igual entre el uso de suelo agrícola y urbano (»50%). Por último, en el ramal occidental se observa una fuerte influencia agrícola (92%), con una aportación de la vegetación natural menor a 8%, y el ramal oriental muestra mayor porcentaje de uso de suelo urbano en su parte alta (72%), correspondiente a El Texcal, con algunos parches de vegetación natural menores a 28%, y gran extensión agrícola en los sitios de La Gachupina y Las Juntas (75 y 84%, respectivamente).

Figura 2 Mapa de uso de suelo para los sitios de estudio de las subcuencas del Río Balsas, México. Apatlaco y Chalma-Tembembe. Las áreas sombreadas represen tan el área de influencia para cada sitio. Verde: vegetación natural; Amarillo: Zona agrícola y Naranja: Zona urbana.
Tabla 1 Porcentaje de usos de suelos en el área de influencia de los sitios de estudio, en ríos de la cuenca del Río Balsas, México.

Caracterización fisicoquímica de los sitios de estudio y su relación con usos del suelo. El ACP de usos del suelo y parámetros fisicoquímicos ordenó los sitios de estudio en gradientes ambientales y de uso del suelo. En el primer componente (que incorpora 41.60% de la varianza explicada), muestra un gradiente en el uso del suelo, con los sitios de la mayor cobertura con vegetación natural hacia el margen izquierdo y en donde el cauce del río presenta las aguas con mayor contenido de oxígeno; mientras que en el extremo derecho se observa una combinación de usos del suelo agrícola y urbano y se presentan altos valores de nutrientes, alto grado de mineralización de los cuerpos de agua y valores altos de conductividad. El segundo componente aportó 18.54% de la varianza explicada y mostró un gradiente de los sitios más mineralizados por sus valores altos de dureza, sulfatos y conductividad en los cuadrantes superiores, mientras que en los inferiores se presenta la mayor concentración de compuestos nitrogenados, en combinación con ortofosfatos, fósforo total y DBO5. De esta forma, el diagrama del ACP (Fig. 3) muestra la asociación de los sitios de estudio en dos grandes grupos: los sitios ubicados en los cuadrantes del margen izquierdo con la mayor cobertura de vegetación natural, entre ellos destaca Las Truchas (en el extremo izquierdo del diagrama), por tener el mayor porcentaje de cobertura vegetal natural (≈98%), además de mostrar la menor concentración de nutrientes, otros iones, coliformes fecales y totales, y la mayor concentración de oxígeno disuelto; otro conjunto de sitios asociados a un alto porcentaje de cobertura vegetal natural lo conforman los seis puntos de estudio del río Chalma-Tembembe, además de Buenavista 1 y El Texcal; los siete primeros sitios, además de su cubierta de vegetación natural, tienen una moderada concentración de nutrientes, mientras que El Texcal se caracteriza por su baja concentración de nutrientes y altos valores de oxígeno disuelto (a pesar de encontrarse en una zona urbana). Por otro lado, en el extremo derecho del diagrama se ubicaron aquellos sitios en los que el uso del suelo está dominado por una combinación de uso urbano y actividad agrícola. En este grupo se pueden diferenciar dos subgrupos: los sitios Alpuyeca, Las Juntas, Xoxocotla, Zacatepec y Xochitepec, que no sólo presenta esta combinación, sino que la calidad del agua denota altos valores de dureza, sulfatos, alcalinidad, conductividad y presentan aguas cálidas. El segundo subgrupo está compuesto por El Pollo, El Rayo, El Encanto, Salida Panocheras, La Gachupina y Buenavista 2, en los que la calidad de agua se caracteriza por presentar valores altos de coliformes fecales y totales, nitritos, nitratos, nitrógeno amoniacal, nitrógeno total, fósforo total, color y cloruros, factores que ponen de manifiesto que estos sitios presentan gran influencia de las aguas residuales de las zonas urbanas.

Figura 3 Diagrama del análisis de componentes principales donde se distribuyen los sitios de estudido, de la subcuenca del río Balsas, México, de acuerdo a los usos de suelo y parámetros fisicoquímicos.
Invertebrados acuáticos. Se registraron en total 66 taxa, distribuidos en cinco phyla, siete clases, 21 órdenes y 63 familias; algunos de ellos se identificaron hasta clase, como fue el caso de los Oligochaeta, Hirudinea y Turbellaria (Tabla 2). Las variaciones de las abundancias y la riqueza promedio del elenco de invertebrados acuáticos por sitio de estudio se resumen en la Tabla 3, en la que se aprecia que en los sitios correspondientes al río Chalma-Tembembe existe una mayor riqueza de taxa presentes a lo largo de su cauce (24 a 32 familias), con respecto a algunos sitios del río Apatlaco, donde se observaron sitios con una mínima riqueza de familias, principalmente en la región media del cauce principal; por ejemplo: El Pollo presentó 13; El Rayo, 20; El Encanto, 5; Salida Panocheras, 11; Xochitepec, 12; La Gachupina, 19; Las Juntas, 21, y Alpuyeca, 13 familias. Cabe mencionar que algunos taxa están presentes en todos los sitios de estudio, aunque con abundancias muy diferentes, por ejemplo, los quironómidos y oligoquetos; mientras que otros únicamente se presentaron en un sitio, como en el caso de las familias Blaberidae, Ephydridae e Hydroptilidae. Por otra parte, el sitio de Las Truchas fue el que presentó la mayor cantidad de taxa (35), incluyendo la familia Perlidae, que fue exclusiva de este lugar, así como los valores más altos de diversidad (>3). Por su parte, las localidades en la parte más baja del río Apatlaco en las que predominó el uso del suelo agrícola, la riqueza de familias se recuperó y alcanzó valores de 21 a 26 familias, en Xoxocotla, Zacatepec y Las Juntas. Con respecto a la diversidad, los valores de H’ mostraron variaciones entre sitios de estudio (Fig. 4); el río Chalma-Tembembe obtuvo puntajes de 2.0 a 3.55 en los sitios correspondientes a la parte alta del cauce (El Arco y La Loma); de 1.72 a 3.11 en la parte media (El Platanar y Casa de la Escuela), y de 1.84 a 3.02 en la parte baja (Coatlán y Hacienda de Cuautlita). En el cauce principal del río Apatlaco, Las Truchas obtuvo valores de H’ superiores a los 3 puntos, lo que lo hace el sitio más diverso; en los siguientes tres sitios (El Pollo, El Rayo y El Encanto), ubicados en la parte media, se obtuvieron valores promedio inferiores a los 2 puntos, mientras que en la parte baja la diversidad vuelve a incrementarse alrededor de los 2.3. El ramal occidental (Buenavista 1 y 2) se mantuvo con valores alrededor de 1.74 y 2.02 puntos, mientras que el ramal oriental presentó una tendencia similar al cauce principal del río, aunque los valores promedio oscilaron entre 0.7 y 1.36 puntos.
Tabla 2 Elenco sistemático de las familias de macroinvertebrados acuáticos de los ríos Apatlaco y Chalma-Tembembe, México.

* Nombres empleados en el presente estudio.
Tabla 3 Valores de las abundancias promedio de macroinvertebrados acuáticos, la riqueza total y riqueza promedio por sitio de estudio en los ríos Apatlaco y Chalma-Tembembe, México.

Clave de localidades: El Arco (CT1), La Loma (CT2), El Platanar (CT3), Casa de la Escuela (CT4), Coatlán (CT5), Hacienda de Cuautlita (CT6), Las Truchas (AP1), El Pollo (AP2), El Rayo (AP3), El Encanto (AP4), Salida Panocheras (AP5), Xochitepec (AP6), Alpuyeca (AP7), Xoxocotla (AP8), Zacatepec (AP9), Buenavista 1 (AP10), Buenavista 2 (AP11), El Texcal (AP12), La Gachupina (AP13) y Las Juntas (AP14).

Figuras 4a-b Valores del Índice de diversidad de Shannon-Wiener (a) y riqueza de familias (b) por sitio de estudio en subcuencas del Río Balsas, México. Los aste riscos representan diferencia significativa (p < 0.05). El Arco (CT1), La Loma (CT2), El Platanar (CT3), Casa de la Escuela (CT4), Coatlán (CT5), Hacienda de Cuautlita (CT6), Las Truchas (AP1), El Pollo (AP2), El Rayo (AP3), El Encanto (AP4), Salida Panocheras (AP5), Xochitepec (AP6), Alpuyeca (AP7), Xoxocotla (AP8), Zacatepec (AP9), Buenavista 1 (AP10), Buenavista 2 (AP11), El Texcal (AP12), La Gachupina (AP13) y Las Juntas (AP14).
El AJCP-I elaborado con los datos de uso del suelo y las abundancias promedio de IA (Fig. 5) muestra cuatro grupos a un nivel de corte de 0.605: el grupo I, formado por una unidad aislada, el sitio de Las Truchas, el cual presentó los valores más altos de H’ y una abundancia moderada de diferentes familias (Tabla 3); el grupo II (≈87% de similitud), formado por El Platanar y la Casa de la Escuela, que estuvieron asociados principalmente por sus altos valores de vegetación natural, y con valores de H’ entre 2 y 3 puntos y una menor riqueza de familias de IA con respecto a Las Truchas, aunque algunas de ellas presentaron mayor abundancia de individuos, como las familias Hydropsychidae y Leptohyphidae; el grupo III, en el que se reunieron 12 sitios con 64% de similitud divididos en tres subgrupos; el subgrupo a (86% de similitud), que comprende los sitios de Buenavista 1 y 2, caracterizados por una fuerte influencia agrícola, puntajes de H’ menores a 2.5 y una mayor variedad de dípteros y coleópteros; el subgrupo b (78% de similitud), donde se encuentran Coatlán, Hacienda de Cuautlita, Xoxocotla, Zacatepec, El Arco y La Loma, donde predomina el uso de suelo agrícola combinado con una escasa vegetación natural, valores de H’ ≈2.5 puntos y una mayor abundancia principalmente de tricópteros, odonatos y algunos dípteros, y el subgrupo c (≈78% de similitud), que contempla a Alpuyeca, Las Juntas, La Gachupina y El Encanto, donde predomina el uso del suelo agrícola seguido de zonas urbanas, valores bajos de H’ y comunidades dominadas por diversos dípteros (principalmente quironómidos) y bajas abundancias de tricópteros y efemerópteros; y, finalmente, el grupo IV, que comprende dos subgrupos: el subgrupo d (≈62% de similitud), correspondiente a El Texcal, que posee un alto porcentaje de uso de suelo urbano, valores de H’ menores a 1.5 puntos y una mayor abundancia de la familia Hyalellidae, con presencia de algunos tricópteros, moluscos, efemerópteros y odonatos; y el subgrupo e (76% de similitud), con El Pollo, El Rayo, Salida Panocheras y Xochitepec, que se caracterizaron por la influencia del uso del suelo urbano y valores de H’ inferiores a 2.5 puntos, y por la presencia de dípteros, isópodos y moluscos principalmente.
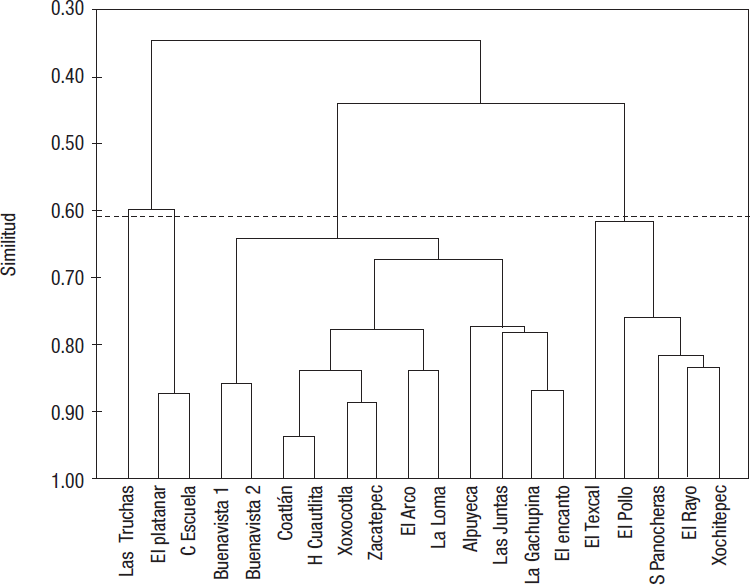
Figura 5 Análisis de agrupamiento para los sitios de estudio de los ríos Apatlaco y Chalma-Tembembe, México, empleando datos de los usos de suelo, abundancias de invertebrados acuáticos y valores del índice de diversidad (H’).
Por último, el AJCP-II, que contempla las características fisicoquímicas, los usos del suelo, la abundancia y la diversidad H’ (Fig. 6), separó seis grupos: el grupo I aisló a Las Truchas del resto por presentar los valores más altos de H’, mayor cobertura vegetal y menor concentración de nutrientes y otros iones en el agua; en el grupo II se encuentra únicamente El Texcal, principalmente por la baja concentración de nutrientes, y sus valores de H’ fueron moderados (≈2 puntos); en el grupo III se asociaron El Platanar y la Casa de la Escuela, con ≈97% de similitud debido a su cobertura vegetal y por compartir algunas familias de odonatos, coleópteros, tricópteros, efemerópteros, entre otros; el grupo IV incluye Xochitepec, El Pollo, El Rayo y Salida Panocheras, con 94% de similitud, sitios que están asociados a un uso del suelo urbano en combinación con uso agrícola y bajos valores de H’; el grupo V comprende La Gachupina, El Encanto, Buenavista 1 y 2, con 93% de similitud, todos fuertemente influenciados por un uso del suelo agrícola, y el grupo VI, en el que se encuentran El Arco, La Loma, Coatlán, Hacienda de Cuautlita, Xoxocotla, Alpuyeca, Zacatepec y Las Juntas; todos con una alta proporción de uso de suelo agrícola, además de presentar valores de H’ moderados y estar ubicados en la parte baja del cauce principal y en la parte media y baja del ramal oriental.
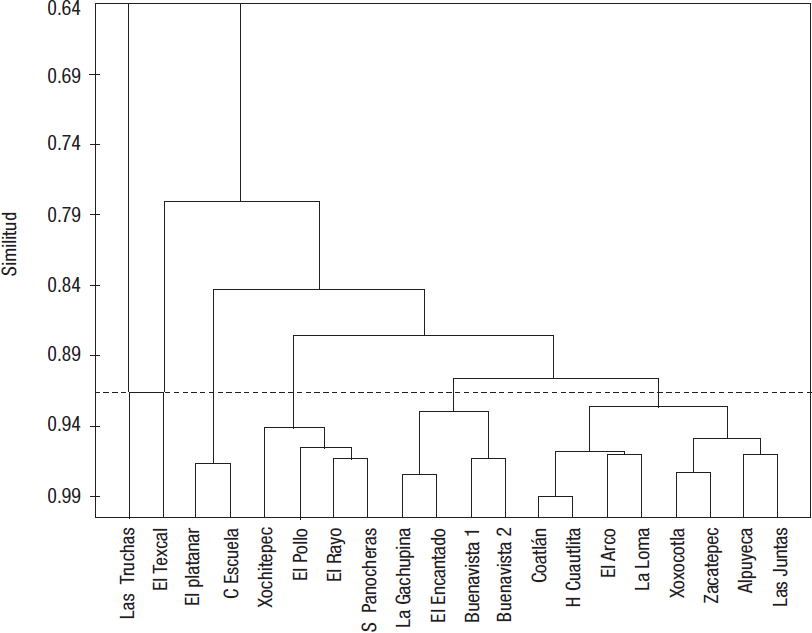
Figura 6 Análisis de agrupamiento para los sitios de estudio de los ríos Apatlaco y Chalma-Tembembe, empleando datos de los usos de suelo, parámetros fisicoquí micos, abundancias de invertebrados acuáticos y valores de H’.
Los resultados del análisis de correlación de Pearson, derivados de la matriz de datos que incluyó los porcentajes de uso de suelo, el promedio de los parámetros fisicoquímicos, abundancia de IA y valores de H’, se resumen en la Tabla 4, en la que se observa que las familias Belostomatidae, Cordulegastridae, Corixidae, Corydalidae, Dryopidae, Elmidae, Hebridae, Helicopsychidae, Heptageniidae, Hydrobiosidae, Lepidostomatidae, Libellulidae, Perlidae, Philopotamidae, Polycentropodidae, Scirtidae, Staphylinidae y Tabanidae presentaron una correlación positiva estadísticamente significativa (p < 0.05) con la cobertura natural de vegetación; por otro lado, las familias Ancylidae, Asellidae, Chironomidae, Hyalellidae, Psychodidae y la clase Hirudinea mostraron una correlación positiva y significativa (p < 0.05) con el uso de suelo correspondiente a zonas urbanas. Ninguna familia se correlacionó positivamente con el uso de suelo agrícola; sin embargo, se detectaron correlaciones negativas (p < 0.05) con las familias Baetidae, Cordulegastridae, Helicopsychidae, Heptageniidae, Lepidostomatidae y Perlidae.
Tabla 4 Análisis de correlación de Pearson de las familias de macroinvertebrados acuáticos y los parámetros fisicoquímicos con los usos de suelo para los Ríos Apatlaco y Chalma-Tembembe, México. Los números en negrita representan significancia estadística (p < 0.05). El sombreado repre senta la correlación positiva con el uso de suelo.

Discusión
Análisis fisicoquímico. El ACP evidenció un gradiente de las condiciones fisicoquímicas de los sitios de estudio en asociación con los usos del suelo y los parámetros de calidad del agua. Este análisis mostró que el único sitio con el mayor porcentaje de vegetación natural (Las Truchas) se asocia con el buen grado de conservación de la calidad del agua, que posee mayor concentración de oxígeno disuelto y menor concentración de nutrientes (compuestos nitrogenados y fósforo); a diferencia de El Texcal que, aunque es un manantial, se asoció con los sitios del río Chalma-Tembembe en los cuadrantes 3 y 4 del ACP, donde se denota una mayor carga de nutrientes. El ACP revela que los sitios influenciados por suelos agrícolas tienen una mayor carga de materia orgánica, al presentar los valores más altos de DBO5, color y coliformes, y la mayor concentración de nitratos, nitritos, nitrógeno amoniacal, nitrógeno total, ortofosfatos y fósforo total. Las zonas agrícolas suelen permitir una mayor erosión de suelos, lo que puede favorecer el ingreso de materia orgánica de la cuenca de captación y, como consecuencia, incrementar la DBO5 y los nutrientes en el curso de los ríos, como lo han detectado Egler et al., (2012) y Ribeiro et al. (2014); además, en este estudio, debido a que se incorporó a las zonas pecuarias dentro de la zonas agrícolas, el aumento de coliformes en éstas puede atribuirse a la actividad pecuaria. Por otra parte, los sitios con influencia urbana presentaron mayor conductividad, alcalinidad, dureza y concentración de cloruros. Los valores altos de H’ en ríos poco perturbados, la alta concentración de nutrientes por el efecto de zonas agrícolas y la presencia de valores altos de conductividad y otros iones en ríos urbanos han sido reportados por otros autores para ríos de países como Corea (Yung-Chul et al., 2011), Uganda (Kasangaki et al., 2008), Etiopía (Mereta et al., 2012), Italia (Ravera, 2001), La India (Singh et al., 2005), entre otros.
Invertebrados acuáticos. Los valores obtenidos para el índice de diversidad de Shannon-Wienner mostraron variaciones significativas (p < 0.05) entre los sitios de estudio (particularmente en Las Truchas y El Encanto, que, a su vez, presentaron el máximo y el mínimo de riqueza de familias, respectivamente); estas diferencias pueden atribuirse al grado de impacto antropogénico (Latha & Thanga, 2010) ocasionado por el tipo de descargas que se vierten a los cuerpos de agua, así como por el tipo de uso de suelo predominante en sus áreas de impacto, lo cual influye en la calidad del agua y, por lo tanto, en la calidad del entorno para el desarrollo de los invertebrados acuáticos, favoreciendo a los organismos capaces de habitar en ambientes hostiles (Luna et al., 2002; Azrina et al., 2005; Kasangaki, et al., 2008; Guevara, 2011).
Si comparamos los grupos obtenidos en el AJCP-I (usos de suelo + H’ + abundancia de IA) con los del AJCP-II (usos de suelo + H’ + abundancia de IA+ factores fisicoquímicos), encontramos que el segundo fue más eficiente al agrupar los sitios, ya que los grupos formados reflejaron de una manera más fiel las condiciones prevalecientes en ambas subcuencas. De esta manera, en el río Apatlaco, el sitio de Las Truchas (grupo I) se aisló de todos los demás sitios por poseer los valores más altos de H’ y una mayor riqueza de familias de invertebrados acuáticos, incluyendo principalmente efemerópteros, plecópteros, tricópteros y coleópteros, lo cual refiere a una comunidad diversa y compleja, condición que se puede atribuir a la abundante cobertura vegetal en el sitio y que coincide con lo encontrado por Azrina et al. (2005) en un río de Malasia, por Guevara-Cardona et al. (2006) en Chile, y por Mereta et al. (2012) en un río de Etiopía, donde reportan valores altos de diversidad en zonas poco perturbadas. Posteriormente, El Texcal (grupo II) es un sitio muy particular del río Apatlaco, ya que presentó organismos característicos de aguas tranquilas, como los de las familias Baetidae, Hyalellidae y Pseudothelphusidae; su baja diversidad puede ser consecuencia de la canalización del agua para consumo humano, lo cual dificulta el desarrollo de una buena cobertura vegetal y la diversificación del hábitat (Aura et al., 2010). En la parte media el río Chalma-Tembembe encontramos al grupo III, donde existe un porcentaje considerable de cobertura vegetal (≈80%); sin embargo, no hubo mucha variación en cuanto a la composición del elenco taxonómico a lo largo de este río, y se observó, de manera general, una dominancia (> 50%) de la familia Hydropsychidae, seguida en menor medida de la familia Leptohyphidae (≈15%), pertenecientes a los órdenes Trichoptera y Ephemeróptera, respectivamente, ambos indicadores de buena calidad del agua (Gamboa et al., 2008), además de algunos odonatos y coleópteros, que son organismos capaces de habitar ambientes moderadamente perturbados (Kasangaki et al., 2008).
Por otra parte, en el grupo IV predominaron organismos de las familias Asellidae y Chironomidae; además, tuvo presencia de los grupos Hirudinea (sanguijuelas), Oligochaeta (lombrices) y Turbellaria (planarias), característicos de ríos urbanos con un alto impacto ocasionado por los efluentes industriales y municipales, donde el agua presenta bajos niveles de oxígeno disuelto y altas concentraciones de materia orgánica (Alonso & Camargo, 2005; Naranjo & González, 2007), al igual que lo reportado por Vivas et al. (2002) para ríos mediterráneos. El grupo V estuvo casi exclusivamente dominado por la familia Chironomidae (>90%) en los sitios de El Encanto y La Gachupina, mientras que en Buenavista 1 y 2 se presentaron abundancias importantes de dípteros (principalmente quironómidos), hemípteros y algunos coleópteros. El grupo VI fue el más grande de todos, ya que asoció a los sitios por su actividad agrícola, contemplando cuatro sitios del río Chalma-Tembembe y cuatro del río Apatlaco: Xoxocotla, Zacatepec, Alpuyeca y Las Juntas, que son sitios de la parte baja del cauce principal del río; este grupo estuvo dominado por la familia Hydropsychidae (> 50%), con la presencia de la familia Leptohyphidae, de algunos moluscos y dípteros; el subgrupo b también presentó una gran abundancia para la familia Hydropsychidae, aunque aquí estuvieron mejor representados los efemerópteros y quironómidos y se encontró una mayor variedad y abundancia de odonatos. Las variaciones encontradas en los ensambles de IA y los valores de H’ de los grupos V y VI parecen estar relacionadas con el grado de impacto del cuerpo de agua, como lo mencionan Miserendino et al., (2008) y Guevara (2011), ya que cada taxa presenta una tolerancia diferente a la contaminación (Dang et al., 2009). Lo anterior también se justifica con el análisis de correlación de Pearson, donde se observa una correlación positiva de las familias indicadoras de mala calidad del agua con la zona urbana y algunas de las familias ya reportadas como indicadores de buena calidad acuática, como es el caso de los efemerópteros, plecópteros y tricópteros.
De manera general, se puede apreciar que el río Apatlaco presenta un mayor grado de impacto debido a la combinación de usos de suelo que se encuentran a lo largo de su cauce y por el efecto de la conectividad de la cuenca de captación con el cuerpo de agua, de acuerdo con lo que señala Wohl (2014), ya sea longitudinal (con el arrastre de diversas sustancias río abajo, principalmente en la parte media del río) o lateral (por la escorrentía, que permite el acceso de diversos agentes provenientes de la cuenca de captación), lo cual genera un mosaico importante de características fisicoquímicas en el que, dependiendo de la porción del río, los invertebrados acuáticos pueden asentarse y desarrollarse. Sin embargo, a pesar del alto impacto que sufre en su parte media (El Pollo, El Rayo, El Encanto y La Gachupina, principalmente), se puede apreciar la capacidad de autodepuración que posee este cuerpo de agua cuando la presión ejercida por el tipo de uso de suelo disminuye su intensidad; por ejemplo, el cambio en el predominio de zonas urbanas a agrícolas en la parte media y baja del río, respectivamente, que se manifiesta con un incremento tanto en la riqueza como en la abundancia de las algunas familias de invertebrados acuáticos en los sitios de Xochitepec, Alpuyeca, Xoxocotla y Zacatepec. Mientras que en el río Chalma-Tembembe las condiciones tanto fisicoquímicas como de uso de suelo son más estables, por lo cual la riqueza y abundancia de su elenco de invertebrados acuáticos son poco variables a lo largo de su cauce. Estos resultados sugieren el potencial de recuperación que posee el río Apatlaco.
Los resultados obtenidos muestran que el uso de suelo circundante al curso de los ríos estudiados ejerce un efecto considerable en las características de calidad del agua y en la composición de las comunidades de invertebrados. En el presente estudio, el ensamble de las familias que se correlacionaron con ecosistemas sanos, como es el caso de Las Truchas, fueron Belostomatidae, Cordulegastridae, Corixidae, Corydalidae, Dryopidae, Elmidae, Hebridae, Helicopsychidae, Heptageniidae, Hydrobiosidae, Lepidostomatidae, Libellulidae, Perlidae, Philopotamidae, Polycentropodidae, Scirtidae, Staphylinidae y Tabanidae; por otro lado, el ensamble compuesto por las familias Ancylidae, Asellidae, Chironomidae, Hyalellidae, Psychodidae y la clase Hirudinea se correlacionó con ambientes altamente perturbados, como las zonas urbanas; mientras que los sitios con abundancias moderadas, pero con poca diversidad de organismos, pueden manifestar el impacto por actividades agrícolas. Por lo anterior, los ensambles de IA reflejan el grado de perturbación de los ecosistemas acuáticos.











 nueva página del texto (beta)
nueva página del texto (beta)


