Introducción
Es bien conocido el problema de la eutrofización en las aguas superficiales en el mundo. Pero éstas no sólo obtienen nutrientes de la escorrentía, lo que genera la eutrofización, sino que también reciben otros impactos agropecuarios, como el del ganado, que altera físicamente la zona ribereña, las orillas y el fondo de los cauces, además de que les aporta nutrientes y materia orgánica por sus excrementos (Gillingham & Thorrold, 2000; Scrimgeour & Kendall, 2003; Monaghan & Smith, 2004; Monaghan et al., 2007), o desechos de agroindustrias, como de las bodegas vitivinícolas. Desde la introducción de la ganadería, en el siglo XVII, el territorio uruguayo ha sufrido grandes alteraciones ambientales debido a la actividad productiva y los asentamientos humanos. Este fenómeno ha sido propiciado por la aptitud agropecuaria de casi todo su territorio, que ha provocado el deterioro de las aguas superficiales (OPP-OEA-BID, 1992; Conde et al., 2002; Chalar et al., 2011).
La calidad ambiental tiene un sentido más integral que la calidad del agua por sí sola, ya que incorpora otros aspectos del sistema acuático que son de interés para evaluar el estado de éste; éstos incluyen el canal, el fondo, las orillas y la zona ribereña, generalmente denominados factores locales o del hábitat. La integridad ecológica puede definirse como la estructura y función de un ecosistema dentro de su rango de variación natural (Washington State Department of Natural Resources, 2014), o su capacidad de evolución y recuperación natural de una perturbación (Westra et al., 2000). La integridad ecológica se refiere a la totalidad del sistema, incluyendo sus comunidades, procesos ecológicos y condiciones ambientales (Dale & Beyeler, 2001).
Durante el siglo pasado, se realizó una vasta investigación de la integridad ecológica de los ecosistemas fluviales basada en sus comunidades biológicas (Stainbrook et al., 2006). Los organismos que viven en los arroyos son utilizados como bioindicadores de la calidad del agua debido a que los métodos biológicos dan una idea del estado integral de la misma, a diferencia de los métodos físicos y químicos, que registran el estado durante su medición (Alba Tercedor, 1996; Nijboer et al. 2005; Testi et al., 2009). Los macroinvertebrados son usados como indicadores de la calidad ambiental por su capacidad para detectar la alteración de los ecosistemas (Bass & Harrel, 1981; Nijboer et al., 2005, Moreno et al., 2009; Testi et al., 2009; Prat et al., 2009). Su uso ha recibido múltiples enfoques, desde las especies indicadoras y los parámetros de la comunidad hasta los métodos multivariados y predictivos (Baptista et al., 2007; Poquet et al., 2009). Así, los métodos rápidos son generalmente semicuantitativos y la identificación es a menor resolución taxonómica, gracias a lo cual se logran detectar los impactos fuertes a mucho menor costo (Metzeling et al., 2003).
La contaminación de los ríos y arroyos de Uruguay es principalmente orgánica y por nutrientes de origen urbano, agropecuario e industrial (Conde et al., 2002). Estos sistemas tienen cierta capacidad de autodepuración mediante procesos como la dilución, sedimentación, asimilación y descomposición de los aportes, entre otros. Sin embargo, el ingreso de otro tipo de contaminantes, como los tóxicos, puede interferir en estos procesos, bloqueándolos o retrasándolos. Es importante una evaluación permanente de la calidad de los cursos de agua, que contribuya a armonizar los objetivos de preservación con los de desarrollo económico.
La contaminación de origen agrícola deriva principalmente del uso de plaguicidas y fertilizantes, los cuales son arrastrados por las aguas superficiales, especialmente en las zonas más pobladas y con un uso del suelo más intenso. Es el caso de los arroyos localizados en las zonas vecinas a Montevideo, como el arroyo Colorado, afluente del Sauce que desemboca en el Pando, y éste, en el Río de la Plata. Se trata de un arroyo pequeño, representativo de los cursos de cabecera, cuya alteración puede reducir la integridad ecológica de los sistemas mayores que los reciben (Freeman et al., 2007).
En el marco de un proyecto que busca mejorar este ecosistema hídrico por medio de acciones comunitarias regenerativas, el objetivo del presente trabajo es evaluar la calidad ambiental del arroyo Colorado mediante métodos químicos, el hábitat y el uso de macroinvertebrados como bioindicadores.
La cuenca del arroyo Colorado (34° 38’-45’ S, 56° 02’-06’ W) mide 21 km2, extendidos sobre una zona muy transitada y poblada. Su superficie está dedicada principalmente a la actividad agropecuaria intensiva, en una zona frutivinícola que abastece a la cercana ciudad de Montevideo. El arroyo Colorado (3.4 km de largo) está formado por la confluencia de las cañadas Benítez (9.6 km, 11 km2) y Rocha (6.0 km, 3 km2).
Luego de un muestreo piloto en los diez sitios del arroyo accesibles por caminos, se seleccionaron seis: uno cerca de las nacientes y otro cerca de la desembocadura de cada una de las dos cañadas y del arroyo (Fig. 1). Los cursos son de orden hidrológico 2 y 3.
Materiales y métodos
En imágenes obtenidas por medio de Google Earth de noviembre de 2012, se determinó, mediante herramientas de dicho sistema, para cada microcuenca la extensión de los usos del suelo: bosque, viñedo, urbano y otros (cultivos y pasturas), que ocurren alteraciones en los cursos y que existen desagües de bodegas vinícolas y de salas de ordeñe.
En cuatro ocasiones del verano de 2013 (29 de enero, 28 de febrero, 15 y 22 de marzo), se midió ancho húmedo (resolución 0.1 m) con un medidor láser Bosch DLE 40, profundidad máxima (0.1 m) con una regla de aluminio, temperatura (T, 0.1 °C), oxígeno disuelto (OD, 0.1 mgl), pH (0.1) y conductividad (K, 10 μS.cm-1) con sensores de campo Oakton. En dos muestreos (28 de febrero y 22 de marzo) también se midió la velocidad del agua (0.01 m/s) en varios puntos de una sección transversal con un correntómetro para calcular los caudales por el método de área y velocidad, y, además, se caracterizó cualitativamente el hábitat. El 29 de enero, 28 de febrero y 22 de marzo, se tomaron muestras de agua con botellas plásticas de 1 L para su análisis químico en laboratorio. El 28 de febrero también se muestrearon los macroinvertebrados pasando una red de mano tipo D (AENOR, 1995), de ca. 1 mm de tamaño de malla, por el fondo del curso durante tres minutos, los que se fijaron en 70% de etanol.
Los aspectos cualitativos del hábitat registrados in situ fueron adaptados de los índices RCE (Petersen, 1992) y QBR (Munné et al., 2003), los cuales consideran las siguientes variables: uso de suelo de la zona lindera a la ribera, ancho y vegetación de ésta, morfología de la orilla, cobertura y tipo de macrófitas, tipo de sedimento según la escala de Wentworth, porcentaje de sombra sobre el cauce, velocidad de la corriente y turbidez del agua. Estas observaciones se realizaron visual y cualitativamente en el centro de un tramo de 50 m (Villamarín et al., 2013) y fueron cuantificados mediante una escala arbitraria y simple decalidad del hábitat con 0= muy malo, 1=malo, 2=regulary 3= bueno. Se determinó en cada muestra de agua: sólidos en suspensión (SST) y su contenido en materia orgánica (MO), fósforo total (PT) y nitrógeno total (NT), ortofosfato (PO4 3-), nitrato (NO3 -) y amonio (NH4 +), según APHA (1995) y Conde et al. (1999). Los resultados fueron comparados entre sitios mediante la prueba no paramétrica de Kruskal-Wallis.
Con los datos obtenidos se estimó el valor del índice de calidad de agua ICA-Santa Lucía (Arocena et al., 2008). Los parámetros del ICA fueron seleccionados con base en los criterios de la EPA (Hallock, 1990; Cude, 2001), normalizados (Tabla 1) y ponderados a partir de métodos multivariados (Arocena et al., 2008):
Tabla 1 Normalización de los parámetros del Índice de Calidad del Agua ICA-Santa Lucía, de parámetros fisicoquímicos obtenidos en el arroyo Colorado, Uruguay.

Para normalizar las variables se distribuyeron sus rangos en cinco grupos, correspondientes a los factores de normalización 1, 25, 50, 75 y 100. Las variables y sus factores de ponderación surgieron de la mejor concordancia entre la clasificación según el ICA, y su agrupamiento, según los tres primeros componentes de un ACP, de los arroyos de la cuenca del río Santa Lucía empleados en su elaboración (Arocena et al., 2008). El índice clasifica en una escala de 0 a 100 la calidad del agua según los parámetros evaluados y esto, a su vez, posibilita la calificación del agua conforme a su estado como bueno, regular, malo y muy malo. En el laboratorio se separaron, contaron y determinaron taxonómicamente los macroinvertebrados en grandes grupos (orden de artrópodos y familia de moluscos y anélidos) mediante el uso de claves regionales (Lopretto & Tell, 1995; Domínguez & Fernández, 2009) a efectos de probar un método rápido de biomonitoreo. Las seis localidades fueron comparadas primero mediante la distancia euclidiana de su composición taxonómica (presencia y ausencia) en un dendrograma basado en el método de asociación UPGMA con el programa Statistica. Luego se compararon de la misma manera las composiciones porcentuales de las comunidades.
Con el objeto de integrar los diferentes aspectos contemplados en la evaluación de la calidad ambiental del arroyo, se realizó un Análisis de Componentes Principales (ACP) con los parámetros físico-químicos principales sintetizados con el puntaje del ICA, los usos principales del suelo (%), la calidad del hábitat (puntaje) y la abundancia de la comunidad bentónica y de sus grupos principales (log x + 1).
Resultados
Uso de la cuenca. La cuenca está cultivada (Fig. 2), principalmente, con praderas artificiales y cultivos (“otros”, 63% en promedio), excepto en la microcuenca 2, donde dominan los viñedos. En los sitios 7, 8 y 10 lo segundo son viñedos, y en los sitios 5 y 6, los bosques. En las inmediaciones de los sitios 6 y 2 hay bodegas productoras de vino.

Figura 2 Uso del suelo en las seis subcuencas del arroyo Colorado, Uruguay estudiadas. Para conocer la ubicación de los sitios de muestreo, ver Fig. 1.
Las imágenes satelitales muestran canalizaciones del curso fluvial antes de los sitios 5, 2 y 7, y represas en todos los sitios, excepto en el 10. Se observó un efluente proveniente de una bodega antes del sitio 6, el que fue luego verificado en el campo. La sinuosidad de la cañada de Rocha en sus dos subcuencas fue 15% menor (1.27 y 1.23) que en los otros cuatro tramos (1.40-1.56).
Aspectos cualitativos del hábitat (Tabla 2). En todos los sitios se observó un uso intensivo del suelo y una fuerte modificación antrópica de la zona lindera. Sólo los sitios 6 y 8 conservan algo de monte ribereño, aunque reducido a una pequeña franja de mimbres (Salix spp.), cañas (Saccharum spp.), fresnos (Fraxinus spp.) y sauces (Salix spp.). Además, el sitio 8 presenta los invasores ligustros (Ligustrum spp.). La vegetación de ribera en los sitios 5 y 7 tienen sólo algunas chircas (Eupatorium spp.), al igual que el sitio 10, que también tiene algunos árboles aislados. Ambas cañadas estaban canalizadas y represadas. En los sitios 8 y 10 las orillas estaban fuertemente erosionadas por la acción del ganado.
Tabla 2 Aspectos cualitativos del hábitat evaluados en los seis sitios durante cuatro muestreos en el arroyo Colorado, Uruguay.
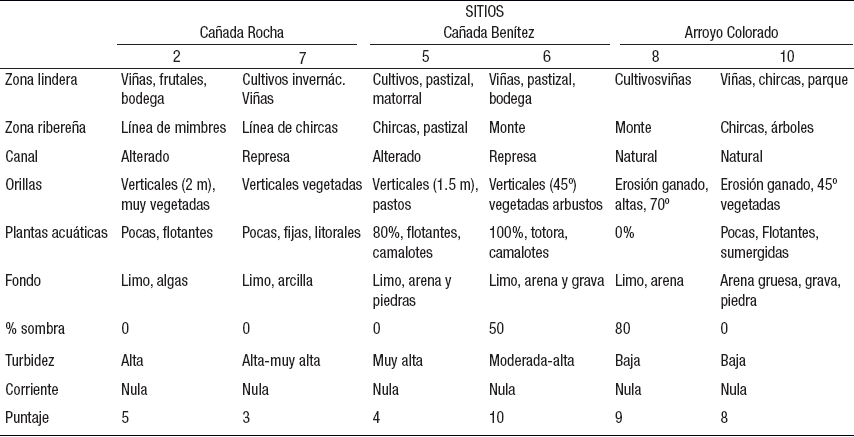
La vegetación acuática en la cañada Rocha fue escasa (10%), principalmente reducida al litoral. En cambio, en la cañada Benítez el sitio 5 presentó 80% de macrófitas, principalmente camalotes (Eichhornia sp.), y el sitio 6 también presentó una gran cobertura de camalotes y totora (Typha sp.). En el sitio 8 no hubo macrófitas, y en el 10 se encontraron algunas flotantes litorales y sumergidas (Eichhornia sp., Myriophyllum sp.). La sombra del dosel vegetal sólo fue importante en los sitios 8 y 6 (Tabla 2), y nula en el resto.
Todos los sitios presentaron limo como principal componente del sedimento, salvo el 10, donde predominaron arena gruesa y grava. En todos los casos se detectó un alto contenido de materia orgánica. El sistema presentó una turbidez en general alta, excepto en los sitios 8 y 10, a pesar de que la corriente fue nula.
Cuando le atribuimos un puntaje a los aspectos de cada ítem de la Tabla 2 y los sumamos, obtuvimos un valor estimativo de calidad del hábitat que varió entre 3 puntos (sitio 7) y 10 puntos (sitio 6) sobre un máximo posible de 18. Los sitios 8 y 10 del arroyo Colorado y el 6 tienen una alta puntuación (8-10), mientras que las nacientes 2 y 5, y el 7, una baja puntuación (3-5, Tabla 2). Para este puntaje no utilizamos la zona lindera, el fondo ni la corriente por ser muy similares en los distintos sitios.
Parámetros físico-químicos. El ancho húmedo del curso varió entre 3 y 6 m en enero y aumentó en general 1 m en febrero, sin mostrar un gradiente longitudinal. La profundidad máxima varió entre 30 y 60 cm en enero y aumentó hasta 30 cm más en febrero. Estos parámetros volvieron a adquirir en marzo los valores de enero.
La temperatura varió entre 15.7 y 35.0 °C en marzo y enero, respectivamente. Los valores menores siempre se registraron en los sitios 8 y 6, aunque las diferencias no fueron significativas (Tabla 3). Las variaciones del oxígeno fueron significativas entre sitios, y llegaron ocasionalmente a condiciones anóxicas, en particular en el sitio 6, donde siempre ocurrieron los mínimos y fue menor al resto (Tabla 3, Wilcoxon, p <0.001). Los otros sitios, en cambio, presentaron ocasionalmente valores de sobresaturación.
Tabla 3 Media y desviación estándar (DS) de los parámetros abióticos medidos in situ, (n=4) en el arroyo Colorado, Uruguay.

T = temperatura, OD = oxígeno disuelto, COND. = Conductividad eléctrica. Kruskal-Wallis p = probabilidad de diferencias no significativas entre sitios.
La conductividad eléctrica (122-1038 μS/cm) también mostró variaciones significativas entre sitios. La mayor concentración de sales ocurrió en los sitios 6 y 8, seguidos del sitio 10 (Wilcoxon p <0.001), y la menor, en los sitios 2 y 7 (Tabla 3). Los valores del pH (6.9-8.2) también difirieron entre sitios, pues mostraron un incremento aguas debajo del sitio 2 (Wilcoxon p <0.001, Tabla 3). La velocidad de corriente fue generalmente indetectable, por lo que el caudal sólo pudo estimarse en febrero y marzo en los sitios 8 y 10. En febrero fue de 9 y 22l/s, y en marzo, de 16 y 42 l/s, respectivamente.
Los SST y su porcentaje de materia orgánica no presentaron diferencias entre sitios (Kruskal-Wallis p = 0.277 y 0.091, respectivamente). Éste fue siempre en promedio ca. 30% (Fig. 3). El fosfato (89-674 μg/l), nitrato (58-121 μg/l) y PT (330-933 μg/l) difirieron entre sitios (Kruskal-Wallis p = 0.016, 0,027 y 0.069, respectivamente), con valores mayores en 2, 7 y 10, y menores en 5 y 6, pero no así el NT (456977 μg/l, Kruskal-Wallis p = 0.286, Fig. 3). Los valores del índice de calidad de agua ICA-Santa Lucía corresponden a una calidad regular en los sitios 7 y 5, y mala en los otros cuatro (Fig. 4).

Figuras 3a-c Valores promedio y desviación estándar de diferentes parámetros fisicoquímicos en los seis sitios de muestreo en la cuenca del arroyo Colorado, Uruguay. a) Sólidos suspendidos totales (SST) y materia orgánica suspendida (MO). b) Fósforo total y fosfato. c) Nitrógeno total y nitrato.

Figura 4 Valores del Índice de Calidad de Agua ICA-Santa Lucía en los seis sitios muestreados en la cuenca del arroyo Colorado, Uruguay. Las barras vacías corresponden a calidad ̈mala ̈ y las sombreadas a calidad “regular”.
Invertebrados. Se identificaron 787 individuos de 19 taxones que incluyeron 3 órdenes de crustáceos y 6 de insectos, 2 familias de dípteros, 6 de moluscos y 2 de anélidos (Tabla 4, Fig. 5). La riqueza promedio fue de 9 taxones por sitio. Estuvo por debajo de este valor en los sitios 2, 7 y 5 (Tabla 4). El sitio 8 reunió más de la mitad de los individuos colectados, y el sitio 5, el 26%. Los otros sitios tuvieron entre 3% y 7% del total de individuos. Cada sitio estuvo dominado por un taxón diferente.
Tabla 4 Invertebrados Colectados en el Arroyo Colorado, Uruguay y sus afluentes.

C. = Cañada. A. = Arroyo. NI = No identificado.
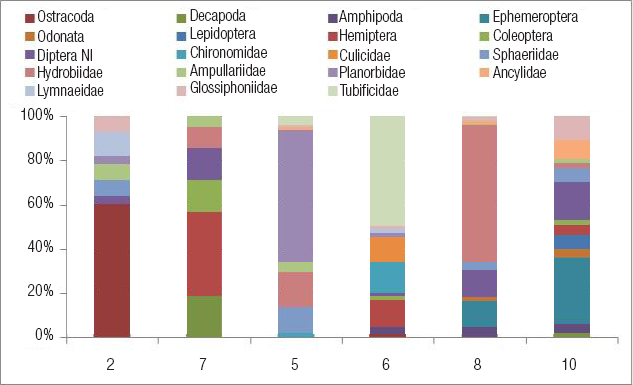
Figura 5 Composición Porcentual De Los Macroinvertebrados Acuáticos En Los Distintos Sitios De Muestreo En El Arroyo Colorado, Uruguay.
En la cañada Rocha, el sitio 2 registró una comunidad compuesta en su mayoría por ostrácodos (59%) y gasterópodos (21%). En el sitio 7 se observó una comunidad representada por pocos hemípteros, decápodos, coleópteros y dípteros, pero en proporciones similares (Fig. 5). La composición taxonómica de los sitios 2 y 7 fue muy diferente a pesar de ser sitios contiguos (Fig. 6). El sitio 2 se parece más al 5 y 6 de la otra cañada, y el sitio 7, al 8 y 10 que se suceden aguas abajo. Al elaborar el dendrograma con la abundancia de los invertebrados (Fig. 6), se observa que los sitios 7 y 10 son los más similares entre sí, pero no se generan otros grupos, lo cual evidencia la variedad de fauna examinada.

Figuras 6a-b Dendrogramas de la distancia euclidiana entre sitios según la presencia / ausencia (a) y la abundancia relativa (b) de los macroinvertebrados acuáticos en el arroyo Colorado, Uruguay.
En la cañada Benítez, el sitio 5 mostró una comunidad dominada por gasterópodos Planorbidae (Biomphalaria peregrina, d'Orbigny, 1835, 60%) e Hydrobiidae (Heleobia sp., 16%). En el contiguo sitio 6, la comunidad estuvo dominada por oligoquetos tubifícidos (49%), acompañados por quironómidos, culícidos y hemípteros. En el arroyo Colorado, el sitio 8 tuvo una comunidad dominada por Heleobia sp. (62%) y con menor cantidad de efemerópteros y dípteros, entre otros. El sitio 10 presentó una comunidad más rica y equitativa, con muchos grupos de insectos, principalmente efemerópteros (30%) y dípteros (17%). La composición taxonómica de estos dos sitios es la que más se parece. La cañada Rocha, en los sitios 2 y 7, está canalizada y represada, es menos sinuosa, con pocas macrófitas y fondo de limo. Además de su baja calidad del hábitat (5 y 3 puntos), estos sitios presentaron la menor riqueza de invertebrados. En la microcuenca 2 dominan los viñedos y hay bodegas. En el sitio 7 los viñedos son el segundo uso, la calidad del agua es regular y dominan los hemípteros.
Por otra parte, la cañada Benítez, también con represas en los sitios de estudio 5 y 6, presenta más macrófitas (camalotes), fondo de limo y arena, y menos PO4, NO3 y PT. En el sitio 5 hay canalización, y la calidad del hábitat es igualmente mala (4 puntos); aunque la calidad del agua es regular, y la riqueza, menor, se detectó alta abundancia de invertebrados dominada por planórbidos. En el sitio 6 hay bodegas, pero un monte ribereño mejora la calidad del hábitat (10 puntos). Sin embargo, la calidad del agua es mala, con anoxia, mayor conductividad y poca abundancia de invertebrados, dominados por tubifícidos.
En ambas estaciones del arroyo Colorado, aunque con mejor calidad del hábitat (9 y 8 puntos), las orillas están desmoronadas y escasean o faltan las macrófitas en un fondo arenoso. Pese a que la turbidez es menor, la calidad del agua es mala. En el sitio 8 hay monte ribereño que, como en el sitio 6, mantiene una menor temperatura, y una alta abundancia de invertebrados dominados por hidróbidos. En el sitio 10 hay más PO4, NO3 y PT, y una baja abundancia de invertebrados, entre los cuales dominan los efemerópteros.
Análisis multivariado. Los dos primeros ejes del ACP explican el 60% de la varianza (Fig. 7). El primero se correlaciona positivamente con la riqueza taxonómica y la calidad del hábitat, condiciones propias de los sitios 8, 10 (arroyo Colorado) y 6 (cañada Benítez). Este eje se correlaciona negativamente con la calidad del agua (ICA) y las superficies porcentuales de viñedo y de bosque, que se presentaron con valores altos en los sitios 7 y 2 (cañada Rocha), y en menor medida en el 5. El segundo eje se correlaciona positivamente con tres taxones de insectos, dominantes en el sitio 7, y negativamente con dos taxones de moluscos, dominantes en el sitio 5.
Discusión
Las bodegas presentan un alto consumo de agua y el vertido de materia orgánica, sólidos en suspensión, pocos nutrientes, polifenoles, aceites y desinfectantes (Molina Ubeda & Díaz Barcos, 2002). Aunque la mayor parte de los tóxicos sería eliminada en los procesos enotécnicos (Navarro et al., 1997 y 1999; Oliva et al., 2000; Fernández et al., 2004), es válido presumir que aun una escasa cantidad es suficiente para afectar sistemas pequeños como los aquí estudiados.
Otra fuente de alteración del sistema es el ganado que acude a beber a los arroyos, pues afecta la vegetación ribereña, las orillas y los sedimentos y aporta materia orgánica y nutrientes con sus heces. Asimismo, la canalización y las represas alteran la dinámica del sistema acuático, interrumpiendo el intercambio de agua y nutrientes entre el arroyo y su valle de inundación (Greet et al., 2011).
Los efectos de la contaminación se agudizan cuando se alteran los cursos y se elimina la vegetación ribereña (Moreno et al., 2009). En particular estos cursos de cabecera, por sus reducidas dimensiones, dependen mucho de su área ribereña para procesos como la regulación térmica, la estabilidad de sus orillas y el ingreso de materia orgánica (Osborne & Kovacic, 1993; Imholt et al., 2010; Studinski et al., 2012). El monte ribereño puede ser muy importante para mejorar la conductividad, el oxígeno, amonio y fósforo (Fernandes et al., 2014) y para los invertebrados (Wahl et al., 2013).
No se encontraron diferencias en la luz, la corriente y el sedimento que expliquen la abundancia de macrófitas acuáticas en la cañada Benítez y su escasez en la cañada Rocha. Sin embargo, el curso de la cañada Rocha se encuentra rectificado, lo que facilitaría una mayor velocidad de corriente e impediría el establecimiento de las macrófitas. La alta turbidez del agua, excepto en los sitios 6 y 8, no se explicaría por una resuspensión de sedimentos, ya que no había suficiente corriente de agua para ello. Probablemente, se trate de coloides (1 μm, no filtrable) que se mantienen suspendidos en la columna de agua aun sin corriente. Los sitios con mejor calidad del hábitat tienen monte, macrófitas y menor turbidez del agua. El mayor contenido de materia orgánica en el sedimento del sitio 2 es debido a la presencia de limo, y es menor en el 6 por la arena y la grava.
Debido a su corta extensión a lo largo de un terreno homogéneo, el curso no presenta gradientes morfométricos longitudinales. Son cursos en general encajonados, capaces de cambiar rápidamente su velocidad de corriente y caudal. En estos cursos pequeños el caudal está sumamente alterado por la extracción de agua, la canalización y el embalsado. El régimen natural de caudal con sus variaciones es un factor de suma importancia en el mantenimiento del ecosistema fluvial (Greet et al., 2011).
La temperatura no mostró diferencias significativas entre sitios porque es más importante la variación temporal; sin embargo, el mínimo siempre se registró en el sitio 8, seguido del sitio 6, seguramente debido a la sombra del dosel y a la poca circulación del agua.
La alta conductividad y baja cantidad de oxígeno disuelto en el sitio 6 podría explicarse por el vertido encontrado antes del mismo. Pero también el sitio 8, sin aportes próximos, presentó bajos valores de oxígeno y alta conductividad, lo que prolonga aguas abajo los efectos de lo ocurrido aguas arriba. Los promedios y casi todos los valores de oxígeno de los sitios 2, 6 y 8 estuvieron por debajo del mínimo admitido (5 mg/l) nacional (Decreto 253/79) e internacionalmente (Unión Europea -UE- y Canadá: Chapman, 1996). El nitrato está por debajo de los estándares establecidos tanto a nivel nacional (10 mg/l N, Decreto 253/79) como por los que marca la Organización Mundial de la Salud (OMS) y la UE (50 mg/l N: Chapman, 1996), mientras que todas las concentraciones de PT superan el umbral nacional (0.025 mg/l Decreto 253/79), pero no el de la UE (5 mg/l: Chapman, 1996).
Mientras la cañada Rocha muestra una recuperación en el ICA aguas abajo, de mala a regular, la cañada Benítez se deteriora de regular a mala, y así se mantiene en el arroyo Colorado, que nunca llega a recuperarse.
El muestreo del zoobentos se realizó sólo en verano, cuando los caudales reducidos facilitan el acceso a los arroyos, se concentran los contaminantes y estabilizan las comunidades (Villamarín et al. 2013). Además, Suren y Jowett (2006) encontraron en un clima similar que la abundancia de los Ostracoda, Coleoptera, Chironomidae, Oligochaeta y Gastropoda, que son 64% de los individuos aquí colectados, mostraba poca variación estacional. El muestreo semicuantitativo es un método rápido que permite colectar más grupos al cubrir una mayor área (Metzeling et al., 2003). Por otra parte, la riqueza de taxones superiores (órdenes y familias) tiene la ventaja de incluir una mayor distancia filogenética (Marchant, 2007).
La ausencia de filtradores entre los organismos colectados puede estar relacionada con la reducción del caudal, una de las principales alteraciones de los ríos que reduce su capacidad de autodepuración (Graeber et al., 2013). Varios de los grupos encontrados son indicadores de contaminación orgánica.
La menor riqueza de los invertebrados en la cañada Rocha obedecería a la contaminación, que reduce el número de taxones presentes (Margalef, 1983). Los sitios 7 y 10 presentaron comunidades más equilibradas y de composición similar, lo que significa que podrían ser posibles sitios de recuperación, la cual ha sido interrumpida por el encuentro con la cañada Benítez (sitio 8). Todos los otros sitios presentaron alta abundancia de grupos tolerantes. El sitio 2 se parece más a los de la cañada Benítez que a los ubicados aguas abajo, lo cual coincide con lo anterior.
A pesar de que los sitios 6 y 8 fueron los únicos con remanentes de monte ribereño, no presentaron mayor riqueza de invertebrados y también estuvieron dominados por grupos tolerantes a la contaminación. La literatura es contradictoria al respecto. Johnson et al. (2013) encontraron que las diferencias en la estructura de la comunidad estaban correlacionadas con la conductividad y el fósforo inorgánico disuelto. Para Coe et al. (2013) era la cuenca y no el bosque inmediato lo que mejor explicaba la estructura bentónica. En cambio, Rios y Bailey (2006) encontraron un incremento de la diversidad conforme aumenta la cobertura arbórea a escala de tramo de arroyo (largo muestreado). Dicho estudio fue hecho en 33 microcuencas y 3500 km2, el cual es un resultado estadístico y no puntual, como el del presente trabajo. Che Salmah et al. (2013) encontraron que la fragmentación del bosque tuvo un efecto negativo en la diversidad de insectos acuáticos, pero no en sus abundancias.
Los primeros sitios de cada curso presentaron cierto dominio de moluscos, los que en general se asocian a moderados niveles de contaminación orgánica, pero son sensibles a una reducción del oxígeno disuelto. La eutrofización puede favorecer a los moluscos al ofrecerles más recursos (Ciparis et al., 2013). Fernández y Schnack (1977) consideran al hidróbido Heleobia piscium sensible a la contaminación, y al planórbido Biomphalaria peregrina, tolerante. La familia Planorbidae puede ser considerada como muy tolerante (Harman, 1974; Branco, 1986).
Los oligoquetos tubifícidos se adaptan a un extenso rango de condiciones ambientales, por lo que suelen ser dominantes donde hay mucha materia orgánica y el sedimento es pobre en oxígeno (Brinkhurst & Jamieson, 1971; Timm, 1980; Grimm, 1987; Brinkhurst & Marchese, 1992). Los tubifícidos son indicadores útiles en el diagnóstico de la calidad ecológica de los sistemas acuáticos (Learner, 1979; Lang, 1990; Milbrink, 1994). En el sistema del arroyo Colorado es precisamente en el sitio 6, y sólo allí, donde son dominantes.
Los ostrácodos se hallan en una amplia diversidad de ambientes, por lo que se les ha considerado indicadores útiles de calidad del agua (Liberto, 2010). Muchas especies pueden tolerar bajas concentraciones de oxígeno gracias a su corto ciclo de vida y la producción de huevos de resistencia (Thorp & Covich, 2001). Los anfípodos y los decápodos ocupan una gran variedad de aguas no contaminadas, más o menos confinados al sustrato somero con abundante oxígeno (Arocena, 1999). En este caso no fueron abundantes ni frecuentes, a diferencia de otros sistemas similares de la región.
Los efemerópteros, en general sensibles a la contaminación y de importancia en el sitio 10, pueden indicar cierta recuperación del curso. Los hemípteros, dominantes en el sitio 7, son un grupo heterogéneo con diferentes grados de adaptación al medio, por lo que es necesaria una mayor resolución taxonómica para interpretar su presencia. La mayoría de las larvas de dípteros se alimenta de materia orgánica y son frecuentes en ambientes en descomposición (Scatoni et al., 2009). La familia Chironomidae contiene grupos tolerantes, aunque también hay algunos sensibles (Medina & Paggi 2004), y suele ser la familia de dípteros más frecuente y abundante, que domina junto con los tubifícidos en sedimentos orgánicos pobres en oxígeno (Arocena, 1999; Marchese & Paggi, 2004; Khan & Colbo, 2008) como sucede en el sitio 6. La presencia de estos organismos indican aguas con contaminación orgánica y baja capacidad de autodepuración (Chalar, 1994).
El ACP muestra que los sitios del arroyo Colorado tienen una comunidad bentónica más rica y un mejor hábitat. Sin embargo, la calidad del agua es peor allí que en las nacientes. Aparentemente, la comunidad bentónica depende más en nuestro caso del estado del tramo que de la calidad del agua, la que respondería al uso del suelo en toda la cuenca. Las nacientes se proyectan en la parte inferior del plano del ACP debido al predominio en las mismas de los moluscos, que son en parte reemplazados aguas abajo por los insectos.
En síntesis, la cañada Rocha está canalizada y tiene escasas macrófitas, mayor concentración de nutrientes y menor riqueza y abundancia de invertebrados. El ICA muestra una recuperación aguas abajo, con la comunidad bentónica más equilibrada. Junto con el sitio 5, tiene la peor calidad del hábitat. En la cañada Benítez hay abundantes macrófitas acuáticas, y el ICA se deteriora aguas abajo y así se mantiene en el arroyo Colorado. Los sitios 6, 8 y 10 tienen los mayores puntajes de calidad del hábitat, aunque los dos últimos muestran las orillas desmoronadas por acción del ganado. La cañada Rocha sufre eutrofización en sus nacientes, para la cual presenta aún cierta capacidad de autodepuración. Por el contrario, la cañada Benítez sufriría un impacto por sustancias tóxicas de las bodegas e interrumpiría la recuperación de la cañada Rocha. Aguas abajo de su confluencia se retomaría el proceso de autodepuración, al menos en algunas de las variables analizadas.











 nueva página del texto (beta)
nueva página del texto (beta)




