Introducción
Los arrecifes de coral y los pastos marinos se encuentran entre los ecosistemas marinos tropicales amenazados a escala global por diversos factores de origen antrópico y natural, de los cuales las acciones humanas en la zona costera y el cambio climático son las principales causas de su degradación (Hoegh-Guldberg, et al., 2008; Wilkinson & Souter, 2008). Esta degradación se ha visto reflejada en la disminución de la diversidad o los cambios en la estructura de algunos grupos zoológicos en estos ecosistemas a lo largo del tiempo, con implicaciones negativas para los arrecifes coralinos. Ejemplo de ello son las investigaciones que se han realizado en Cuba, dedicadas al estudio de los corales pétreos (Hernández-Fernández et al., 2008; Alcolado, et al., 2010; Caballero & Alcolado, 2011), octocorales (Hernández-Muñozet al., 2008), esponjas (Alcolado, 1990b, 1999, 2007; Alcolado & Herrera-Moreno, 1987) y peces (González-Sansón et al., 2009).
El macrofitobentos (macroalgas y angiospermas marinas) tiene varias funciones de suma importancia para el funcionamiento de los ecosistemas neríticos, tales como: la productividad primaria, el reciclaje de nutrientes en el agua y los sedimentos (los cuales retienen carbono), que aportan material biogénico, proporcionan un hábitat que funciona como refugio o zonas de cría para muchas especies y contribuyen a la acreción de los arrecifes coralinos, entre otras funciones (Wanders, 1976; Littler & Littler, 1988; Suárez, 1989; Graham & Wilcox, 2000; Larkum et al., 2006).
Los principales factores fisico-químicos que suelen incidir en el desarrollo de las macroalgas y angiospermas marinas son la luz, la temperatura, los nutrientes y la presencia de un sustrato adecuado (Lüning, 1990; Graham & Wilcox, 2000; Larkum,et al., 2006). Estos factores están relacionados, a escala local, con las características geomorfológicas, la profundidad, la dinámica y la calidad de las aguas (Graham & Wilcox, 2000).
La abundancia y el tipo de macroalgas predominantes en los ecosistemas marino-costeros tropicales, cuando no existe otro factor que sea limitante, suele encontrarse modulada por dos vías diferentes y antagónicas de regulación del sistema (regulación “bottom-up” y “top-down”)(Cardoso et al., 2004; Bellwood et al., 2006; Littler & Littler, 2006; Littler et al., 2006; Collado-Vides et al., 2007), así como por disturbios que controlan su desarrollo. Durante cierto tiempo se ha suscitado una controversia sobre cuál de estos dos controles son los determinantes para la conservación de los arrecifes coralinos (Hughes et al., 1999; Lapointe, 1999). Algunos autores mantienen la propuesta de un modelo de dominancia relativa que es aplicable tanto para los arrecifes coralinos como para los pastos marinos (Littler & Littler, 2005a, b), en el cual los bajos niveles de herbivoría, relacionados con niveles más altos de nutrientes, favorecen el desarrollo excesivo de las macroalgas oportunistas (foliosas, filamentosas y carnosas) que causan el deterioro del ecosistema, principalmente en la competencia por el espacio y la luz con los organismos dominantes, como los corales, en los arrecifes y las angiospermas marinas, en los pastos marinos. Otro problema que pudo haber facilitado una explosión de macroalgas en los arrecifes coralinos del Caribe fue la mortandad masiva del erizo herbívoro Diadema antillarum (Phillipi, 1845) en la década de 1980 (Hughes et al., 1987).
La mayor parte de los trabajos encontrados sobre las macroalgas en los arrecifes coralinos estiman la abundancia de las especies (o morfotipos) en cuadrados o transectos, visualmente o con un software mediante fotografía o video (Littler & Littler, 1985; Valdivia & de la Guardia, 2004; Kraufvelin et al., 2010; Caballero & Alcolado, 2011). Ha sido menos frecuente el estudio de la composición por especies de las macroalgas como indicadoras de la condición de los arrecifes coralinos, dadas las dificultades que entraña la cuantificación y la identificación in situ de las especies. Pocos estudios utilizan la biomasa de las algas como forma de evaluar su abundancia (Martínez-Daranas et al., 1996; Zúñiga-Ríos et al., 2012). La determinación de las especies presentes por medio de la recolecta de todo el material del fondo puede dar una mayor información acerca de la estructura de las comunidades de macroalgas que la cobertura, ya que se puede lograr la separación e identificación en el laboratorio de todos los especímenes que sean recolectados.
Generalmente no se cuenta con datos de la abundancia de macroalgas en los arrecifes de coral en épocas anteriores, para poder realizar comparaciones con la situación actual. Debido a esta situación, se propuso como objetivo del presente trabajo, explorar las diferencias entre la abundancia y la composición específica de las macroalgas en tres arrecifes coralinos de la costa sur de Cuba durante dos épocas climáticas de recolecta (lluvias y secas). Para ello se utilizaron datos no publicados de la biomasa seca por especie y biomasa total de macroalgas de la década de 1980. Además, se analizó la influencia de algunas características de los sitios (época climática, profundidad, tipo de sustrato, hidrodinamismo, relieve del fondo). Los datos de este trabajo brindaron información que en un futuro permitirá realizar comparaciones entre las macroalgas de estos arrecifes en la actualidad y los resultados anteriores, ante los posibles cambios de origen antrópico o natural.
Materiales y métodos
Área de estudio. Los tres sitios de estudio están ubicados en los cayos Juan García, Cantiles y Diego Pérez (Fig. 1) en el borde de la plataforma insular cubana, al sur del golfo de Batabanó (zona suroccidental de Cuba). Los tres se encuentran alejados de áreas con desarrollo costero, pero muestran algunas diferencias en sus características topográficas, influencia terrígena y resguardo de los vientos procedentes del Este y del Sur.
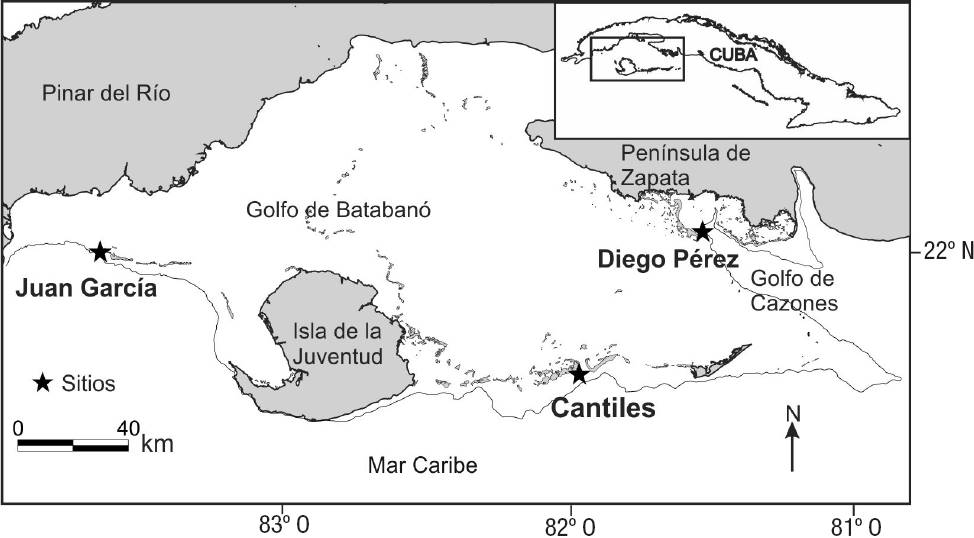
Figura 1: Localización de los tres arrecifes coralinos de la plataforma sudoccidental de Cuba estudiados.
En cada sitio se consideraron cuatro zonas: L (laguna del arrecife entre 2 y 4 m de profundidad), 5 (terraza rocosa del arrecife frontal a 5 m de profundidad), 10 (arrecife frontal a 10 m de profundidad), 15 (arrecife frontal 15 m de profundidad (Tabla 1), para un total de 12 estaciones. En 1987 en cada estación se realizaron dos muestreos, uno en la época climática de lluvias (julio) y otro en la de secas (febrero-marzo). La denominación de cada muestra estuvo formada por las siglas del sitio, la zona y la época del año. Por ejemplo, JGLs significa el muestreo realizado en el sitio Juan García, en la laguna arrecifal, en la época de secas.
Tabla 1: Características de las estaciones estudiadas en cada sitio de los tres arrecifes coralinos de la plataforma sudoccidental de Cuba, por zonas, y valores de las variables abióticas.

Zonas: lagunas arrecifales=(L), terrazas rocosas a 5 m de profundidad=(5), pendiente a 10 m=(10), pendiente a 15 m=(15). BF=Biomasa foliar seca de angiospermas en secas=(s) y en lluvias= (ll). ITH = Índice de tensión hidrodinámica. Prof.=Profundidad. Sustrato: 1=capa de sedimento mayor de 10 cm; 2=capa de sedimento menor de 10 cm, con roca aflorando en algunas partes; 3 (fondo rocoso). Relieve: 0=plano con pastos marinos, 1=poco irregular, 2=irregularidad intermedia, 3=muy irregular.
Método de muestreo. El método de muestreo consistió en recolectar, con una draga de succión modificada (Ibarzábal, 1987), todas las macroalgas y las angiospermas que se ubicaron dentro de un aro de 33 cm de diámetro lanzado al azar sobre el fondo. Cada aro lanzado constituyó una unidad de muestreo, por lo que se obtuvieron un total de 24 muestras, cada una con entre 9 y 13 unidades de muestreo, excepto en JG15s, donde se lograron solo 5. Seobviaron los casos en que los aros coincidieron con invertebrados sésiles en el fondo. Con este método no se incluyeron las macroalgas costrosas, como las del orden Corallinales.
El material recolectado fue conservado en formol al 5% diluido en agua de mar, previamente neutralizado con tetraborato de sodio, y guardado en bolsas de plástico etiquetadas. En el laboratorio, el material fue se separado manualmente por decantación y debajo de un microscopio estereoscópico. Se identificaron las macroalgas y angiospermas marinas mayores de 1 cm de talla hasta el nivel de especie cuando fue posible, con base en la literatura especializada (Taylor, 1957, 1960; Chapman, 1961, 1963) y se actualizó su nomenclatura con la base de datos online de Guiry y Guiry (2016).
Como indicador de la abundancia de cada especie, se estimó su biomasa seca en cada unidad de muestreo. Para lo cual, se estimó la biomasa húmeda inicial de cada especie, después de dejarla reposar 10 min sobre papel secante, y posteriormente se procedió al secado en una estufa a 70º C hasta alcanzar peso constante, con una balanza analítica de 0.0001 g de precisión. Cada valor de biomasa seca se extrapoló a la unidad de área (m2) y se promediaron los valores de cada muestra, para calcular la biomasa seca de cada especie (BS). Se sumaron las biomasas promedio de todas las especies por muestra para obtener la biomasa seca total de macroalgas (BT).
Análisis de datos. Se calculó la curva de acumulación de riqueza de taxones de los sitios y de las zonas con el estimador Bootstrap (Efron & Tibshirani, 1986). Este método se basa en el remuestreo al azar de los datos reales, recalcula la riqueza N veces y permite estimar la desviación estándar (Crowley, 1992). Para ello, se utilizó el software libre en línea EstimateS (Versión 8.2.0, © R. K. Colwell) con 100 permutaciones (Colwell, 2009).
Con los datos de biomasa seca por especie (BS) se probaron las diferencias en la composición específica de macroalgas entre épocas (lluvias y secas), los tres sitios y las cuatro zonas del arrecife, con la rutina a priori ANOSIM. Para explorar las diferencias en la composición específica de las macroalgas entre los muestreos, se realizó una matriz de similitud con el coeficiente de similitud de Bray Curtis, a partir de los valores de BS previamente transformados con logaritmo. Para evitar la distorsión que provocan las especies raras (Clarke & Warwick, 2001) y no desechar especies frecuentes pero de baja biomasa, se incluyeron en la matriz las que contribuyeron con más del 5% de la biomasa total de al menos una muestra, así como aquellas que se presentaron en el 5% o más de las muestras. A partir de esta matriz, se realizó un análisis de agrupamiento (CLUSTER) empleando la técnica de aglomeración de promedio de grupos, con la prueba de similitud a posteriori SIMPROF con un 5% de significación. Mediante la rutina SIMPER, se determinó la contribución de las especies de cada grupo formado. Con la misma matriz de similitud se realizó un escalamiento multidimensional no métrico (MDS).
Para determinar cuáles son las variables que influyen en la estructura de las macroalgas con las variables abióticas, se empleó la rutina BEST con 99 permutaciones y los datos abióticos previamente normalizados. Todos estos análisis multivariados se realizaron con el programa PRIMER v.6 (Clarke & Gorley, 2006). Como variables abióticas se consideraron: la época en que se realizaron los muestreos (lluvias y secas), la profundidad, el índice de tensión hidrodinámico (ITH) calculado a partir de las especies dominantes de octocorales (Alcolado, 1984), y el grado de irregularidad del relieve del fondo, estimado visualmente con una escala del cero (para los fondos horizontales con pastos marinos) al tres. Al tipo de sustrato también se le asignó una escala de valores: capa profunda de arena (1), capa delgada de arena mezclada con rocas (2) y roca desnuda (3). Como posible competidor de las macroalgas, se incluyó la biomasa seca de angiospermas marinas en las lagunas. Los valores asignados a estos factores abióticos aparecen en la Tabla 1.
La normalidad y homogeneidad de varianza de los datos de biomasa total de macroalgas (BT) fueron probadas mediante las pruebas de Lilliefors y de Levene, respectivamente. Esta variable fue comparada entre sitios y épocas, así como entre zonas y épocas, mediante un análisis de varianza bifactorial, con los datos transformados con logaritmo natural. Posteriormente se aplicó la prueba de comparación de medias a posteriori de Tukey HSD para tamaños de muestra desiguales.
Se aplicó un análisis de correlación por rangos de Spearman para detectar las relaciones entre la biomasa total de macroalgas y las variables abióticas (profundidad, relieve, ITH, tipo de sustrato y biomasa seca de angiospermas marinas en las lagunas). Estos análisis se realizaron con el programa Statistica 7.0 (© Statsoft, Inc. 1984-2004) con un nivel de significación de 0.05.
Resultados
Composición específica. Se encontró un total de 70 especies del macrofitobentos: 22 Rhodophyta, 10 Phaeophyceae (Heterokontophyta), 35 Chlorophyta y tres Magnoliophyta. La lista de especies de macroalgas y angiospermas marinas con las autoridades de los taxones se encuentra en la Tabla 2.
Tabla 2: Lista de especies y biomasa seca promedio de macroalgas y angiospermas marinas halladas en tres arrecifes coralinos de la plataforma sudoccidental de Cuba por zonas, frecuencia en porcentaje (Frec) y época climática en que aparecieron.
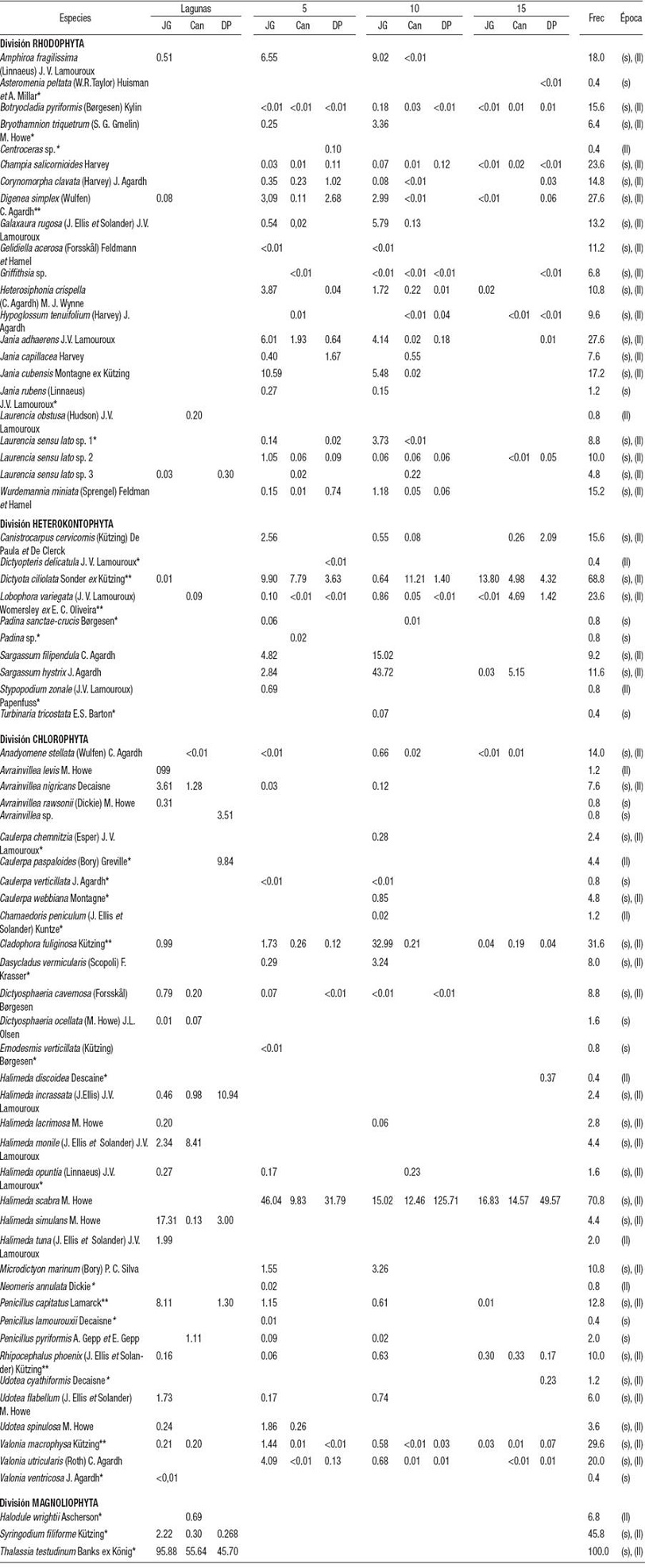
*Taxones que no se incluyeron en los análisis multivariados. ** Taxones que aparecieron en las cuatro zonas de los arrecifes estudiados: Lagunas, arrecife frontal a 5 m (5), 10 m (10) y 15 m de profundidad (15). Sitios: Juan García (JG), Cantiles (Can) y Diego Pérez (DP). Épocas climáticas: secas (s) y lluvias (ll).
La biomasa seca por especie de macroalga por zona (promediando lluvia y seca) estuvo entre 0.0001 y 125.7 gPS.m-2, con el valor más alto para Halimeda scabra (DP10), seguida por la angiosperma Thalassia testudinum en JGL. En la zona frontal del arrecife se destacaron por valores altos de biomasa en algunas muestras Hesterosiphonia crispella (JG5), Sargassum hystrix y Cladophora fuliginosa (JG10) (Tabla 2).
La especie del macrofitobentos más importante por su biomasa seca y por la frecuencia de aparición en las lagunas arrecifales de los tres sitios fue la angiosperma T. testudinum, aunque también se encontraron parches de la angiosperma Syringodium filiforme en los tres (Tabla 2). Halodule wrightii se encontró solamente en CanLll. Las macroalgas que se presentaron en las tres lagunas fueron Halimeda incrassata y H. simulans, que no se encontraron en las zonas frontales de los arrecifes (Tabla 2). Las especies de mayor frecuencia de aparición y biomasa seca en la zona frontal (5, 10 y 15 m) de los tres arrecifes fueron H. scabra y Dictyota ciliolata (Tabla 2). En JG5 y JG10 m, Sargassum filipendula y S. hystrix también presentaron valores de biomasa comparativamente altos. Botryocladia pyriformis, Champia salicornioides y Valonia macrophysa aparecieron en los tres sitios y en las tres profundidades del arrecife frontal, aunque con menores valores de biomasa que las anteriores. En las cuatro zonas del arrecife coincidieron ocho especies: Digenea simplex, D. ciliolata, Lobophora variegata, Anadyomene stellata, C. fuliginosa, Penicillus capitatus, Rhipocephalus phoenix y V. macrophysa. La mayoría de las especies se encontraron tanto en secas como en lluvias (Tabla 2).
Según la profundidad máxima a la que se encontraron las especies del macrofitobentos, 11 macroalgas y las tres angiospermas estuvieron solo en las lagunas hasta 2.5-3.5 m. En las zonas frontales, ocho especies aparecieron sólo hasta en 5 m, 29 llegaron hasta 10 m y 19 llegaron hasta 15 m de profundidad (Tablas 1 y 2).
Riqueza de especies. El número acumulado de especies de macroalgas por muestra estuvo entre 3y 38, con los mayores valores en JG5 y JG10, tanto en secas como en lluvias, y los menores enDPLs, DPLll y CanLll (Tabla 3). La riqueza de especies por el estimador Bootstrap fue superior en Juan García (JG) y menor en Diego Pérez (DP) en todas las zonas, salvo a 15 m de profundidad, donde fue a la inversa (Fig. 2). De modo general, el número de especies mostró una tendencia a ser superior en el arrecife frontal entre los 5 y 10 m de profundidad y menor en la laguna y a 15 m de profundidad (Fig. 2).
Tabla 3: Riqueza de especies (S) por muestra colectada en tres arrecifes coralinos de la plataforma sudoccidental de Cuba.

Sitios: Juan García (JG), Cantiles (Can) y Diego Pérez (DP). Zonas: Lagunas, arre cife frontal a 5 m de profundidad=5, 10 m de profundidad=10 y 15 m de profun didad=15. Épocas: secas (s) y lluvias (ll).
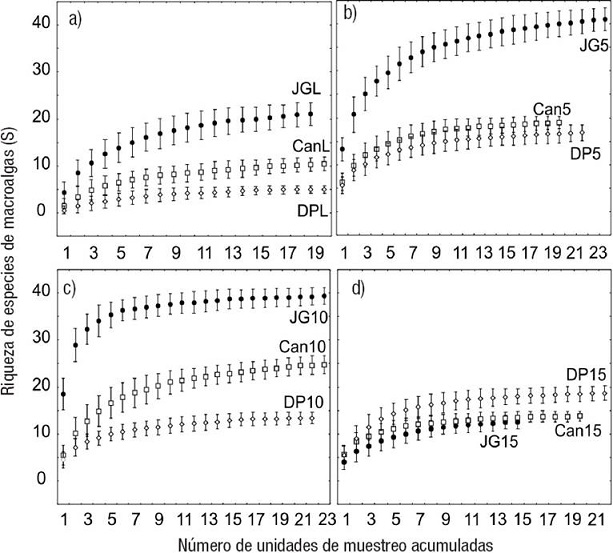
Figuras 2a-d: Riqueza de especies (S) acumulada de macroalgas en las cuatro zonas de los tres tres arrecifes coralinos de la plataforma SO de Cuba estudiados. Sitios de estudio. a: Lagunas arrecifales; b: Arrecifes frontales a 5 m de profundidad; c: Arrecifes frontales a 10 m de profundidad; d: Arrecifes frontales a 15 m de profundidad. Las barras denotan la desviación estándar con 100 permutaciones. Sitios: Juan García (JG), Cantiles (Can), Diego Pérez (DP).
Patrones en la distribución y biomasa de las especies. El análisis de similitudes a priori ANOSIM no mostró diferencias en la composiciónespecífica de macroalgas y sus biomasas entre las épocas (R Global = -0.473, p = 1.0) y entre los sitios (R Global = 0.057, p = 0.135). Si hubo diferencias entre las cuatro zonas del arrecife (R Global = 0.435, p = 0.01), con un resultado diferente en las lagunas de las tres zonas del arrecife frontal (R ≥ 0.874, p = 0,002), así comoel arrecife frontal a 5 m de los 15 m de profundidad (R = 0.337, p = 0,002).
El análisis de agrupamiento (CLUSTER) mostró diferencias en la composición por especies y sus biomasas secas (BS) en las 24 muestras recolectadas, de modo que se ordenaron en tres grupos (prueba a posteriori SIMPROF). Los muestreos del arrecife frontal formaron dos grupos (a y b) (Fig. 3), donde la mayoría de las muestras quedaron en el grupo b, mientras que a incluyó sólo a JG5s, JG10s y JG10ll. Las lagunas integraron el tercer grupo (c) (Fig. 3). El escalamiento multidimensional no métrico (MDS) corroboró la estructura que planteó el análisis de agrupamiento (CLUSTER) con tres grupos bien definidos (Fig. 4).
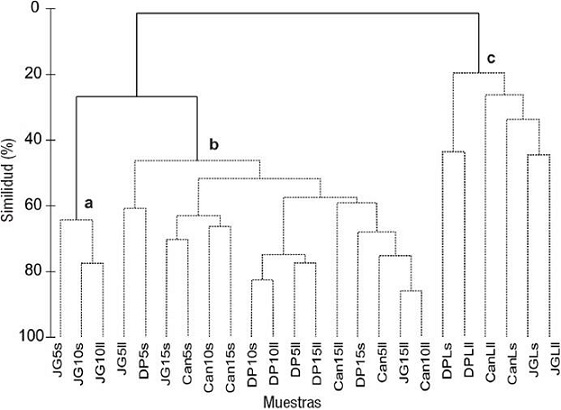
Figura 3: Grupos formados a partir del análisis de agrupamiento (CLUSTER) con la biomasa seca de las especies de macroalgas en todos los muestreos de los tres arrecifes coralinos de la plataforma SO de Cuba estudiados. Las líneas continuas separan los grupos (a, b, c) que son significativamente diferentes, según la prueba a posteriori SIMPROF. Sitios: Juan García (JG), Cantiles (Can) y Diego Pérez (DP). Zonas: lagunas arrecifales (L), arrecifes frontales a 5 m de profundidad (5), arrecifes frontales a 10 m de profundidad (10) y arrecifes frontales a 15 m de profundidad (15). Épocas: seca (s) y lluvia (ll).
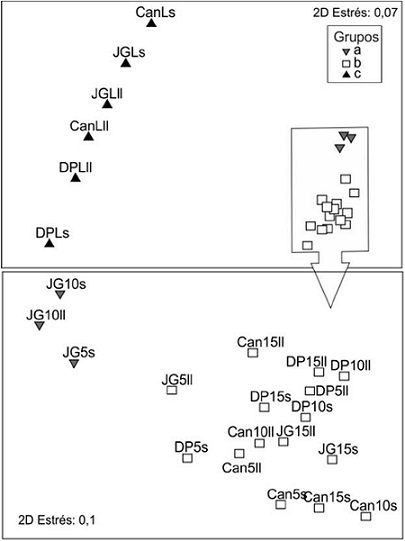
Figura 4: Escalamiento multidimensional no métrico (MDS) de los muestreos de macroalgas realizados en tres arrecifes coralinos de Cuba con la biomasa por especie. Los tres grupos fueron definidos en base al análisis CLUSTER (ver Fig. 4 y texto para más detalles). Sitios: Juan García (JG), Cantiles (Can) y Diego Pérez (DP). Zonas: lagunas arrecifales (L), arrecifes frontales a 5 m de profundidad (5), arrecifes frontales a 10 m de profundidad (10) y arrecifes frontales a 15 m de profundidad (15). Épocas: seca (s) y lluvia (ll). El recuadro inferiores un MDS realizado con los grupos a y b.
El análisis de similitudes (SIMPER) entre los tres grupos formados por el análisis de agrupamiento (CLUSTER) brinda la información de las especies que más aportan a la similitud entre las muestras que los integran (Tabla 4), así como las que contribuyen a la disimilitud entre éstos (Tabla 5). El grupo a presentó una mayor cantidad de especies que contribuyen a la similitud de las muestras y una mayor similitud promedio que los otros dos (Tabla 4). En el grupo b, donde quedaron la mayor parte de los muestreos realizados en la zona frontal del arrecife, se distingue a H. scabra y D. ciliolata como las especies que caracterizan a todas estas muestras (Tabla 4). Las lagunas arrecifales, que integraron el grupo c, estuvieron caracterizadas por Halimeda incrassata, H. monile y H. simulans, aunque en la similitud promedio de entre todas las muestras fue la menor de todas (Tabla 4). La disimilitud por pares de grupos fue menor entre a y b que entre a y c y entre b y c (Tabla 5). Se aprecia que aunque hay especies compartidas entre los grupos, hay diferencias en sus biomasas. Otras especies aparecieron en un grupo pero en los otros no. Por ejemplo, Sargassum filipendula aparece en el grupo a, pero no en b (Tabla 5).
Tabla 4: Contribución de las especies de macroalgas en tres arrecifes coralinos de la plataforma sudoccidental de Cuba, en orden decreciente hasta el 50% de similitud acumulada (a partir de la rutina SIMPER) en los tres grupos derivados del análisis de agrupamiento (CLUSTER), muestras que los integran y similitud promedio de cada uno.
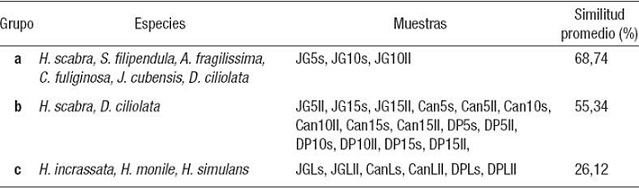
Tabla 5: Descomposición de la disimilitud promedio y la contribución de cada especie de macroalagas en orden descendente (%), obtenidas a partir de la rutina SIMPER, en las comparaciones entre pares de grupos formados del análisis de agrupamiento (CLUSTER) con los datos de biomasa seca (BS) transformados. Se presentan solamente las especies que contribuyeron al menos al 50% de la disimilitud promedio (DM) acumulada.
Variabilidad de la biomasa total de macroalgas. La biomasa total de macroalgas por muestra (BT) mostró diferencias significativas entre los sitios, mas no entre las épocas climáticas ni en las interacciones entre ambos factores: sitio y época (Tabla 6). La biomasa total de macroalgas fue menor en Cantiles, al compararla con la de los otros dos arrecifes (Fig. 5). Además, la biomasa seca total fue similar entre las zonas y entre las épocas y no hubo interacción entre ambos factores (Tabla 7).
Tabla 6: Prueba de significación del análisis de varianza bifactorial para la biomasa total de macroalgas (BT) entre los sitios y las épocas en que se realizaron los muestreos en tres arrecifes coralinos de la plataforma sudoccidental de Cuba. Se presenta la suma de cuadrados (SC), los grados de libertad (gl), cuadrado medio (CM), el valor crítico de la distribución F y la probabilidad (p).
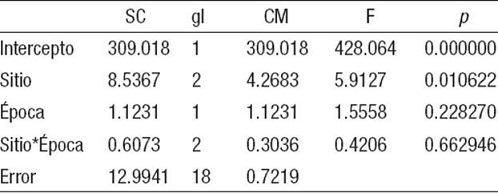
Sitio*Época = a la interacción entre sitios y épocas

Figura 5: Promedio y desviación estándar (DE) de la biomasa total de macroalgas en los sitios de estudio de tres arrecifes de Cuba. Juan García (JG), Cantiles (Can) y Diego Pérez (DP). Letras diferentes señalan las diferencias significativas.
Tabla 7: Prueba de significación del análisis de varianza bifactorial para la biomasa total de macroalgas (BT) entre las zonas y las épocas en que se realizaron los muestreos en tres arrecifes coralinos de la plataforma sudoccidental de Cuba. Se presenta la suma de cuadrados (SC), los grados de libertad (gl), cuadrado medio (CM), el valor crítico de la distri bución F y la probabilidad (p).
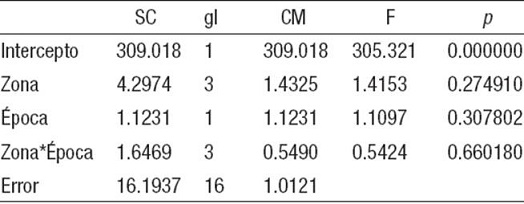
Zona*Época = a la interacción entre zonas y épocas
Relaciones con las variables abióticas. Al relacionar la composición específica y la biomasa de las especies de macroalgas con el tipo de sustrato, la profundidad, la complejidad del relieve, el ITH y la época en que se realizaron los muestreos (rutina BEST), se obtuvo que el tipo de sustrato es la variable que más incide en la composición específica de macroalgas (Rho=0.838, nivel de significación=0.01). Si se incluyen varios de estos factores en el análisis, el tipo de sustrato más la complejidad del relieve es la combinación que mejor explica dicha composición, pero la correlación no fue mayor que la anterior (Rho=0.739, nivel de significación=0.01). El mismo análisis realizado sólo para las lagunas, incluyendo la biomasa de angiospermas marinas como variable independiente, no dio una correlación significativa (nivel de significación=0.62).
Se encontraron correlaciones positivas, de acuerdo con la prueba de Spearman, entre la biomasa total de macroalgas con el relieve (Rs=0.4499, p=0.027) y con la biomasa total de angiospermas marinas en las lagunas (Rs=0.828, p=0.041). No se encontró correlación entre la biomasa total con el tipo de sustrato, ni con la profundidad y ni con el ITH (p>0.05).
Discusión
La estimación de la riqueza a nivel de especie por el método no paramétrico Bootstrap, mediante la acumulación de muestras escogidas de modo aleatorio con reemplazo, se aproximó rápidamente a la asíntota. Por ello, se pudo estimar la desviación estándar para realizar comparaciones de la riqueza de especies entre los sitios. Estas comparaciones parecen válidas con el tamaño de muestra alcanzado, incluso para la estación JG15, con menos unidades de muestreo, aunque esto puede haber incidido en los resultados.
La biomasa seca de las especies de macroalgas y en su conjunto fue una variable útil para diferenciar su abundancia y la variabilidad de la composición específica de estas comunidades en los tres arrecifes coralinos, a través de análisis multivariados y univariados. Las diferencias en la estructura específica(composición y biomasa) de las macroalgas en los tres arrecifes estuvieron relacionadas fundamentalmente con el tipo de sustrato, lo que se comprobó con los análisis multivariados. En este caso se pueden inferir no solo las diferencias del efecto del fondo rocoso como favorecedor de la implantación de macroalgas, puesto que muchas de estas especies necesitan un sustrato duro para su fijación mediante un disco basal (Graham & Wilcox, 2000), sino también del biotopo de pastos marinos en la laguna del arrecife, donde predominan las angiospermas marinas. En los fondos blandos con pastos marinos suelen predominar algas verdes con rizoides de los géneros Penicillum, Avrainvillea, Udotea y Halimeda (van Tussenbroek et al., 2006; Martínez-Daranas et al., 2008), tal como resultó en este estudio. Por ello, aunque se compartieron especies entre las cuatro zonas del arrecife, se evidenciaron diferencias marcadas en la estructura (composición + biomasa) entre la laguna y el arrecife frontal en las tres profundidades.La composición por especies y su abundancia no presentó diferencias para estas tres zonas, de acuerdo con los análisis CLUSTER. No obstante, el análisis de similitudes a priori ANOSIM dio como resultado diferencias entre los 5 y los 15 m de profundidad. Esta aparente contradicción se debe a que para el primer análisis se eliminaron las especies raras, según el criterio de Clarke y Warwick (2001); sin embargo, el segundo análisis incluyó a todas las especies. El número de especies disminuyó con la profundidad en este intervalo, lo cual pudiera estar relacionado con los cambios en la cantidad de luz y sus longitudes de onda a medida (Graham & Wilcox, 2000). Esto explica las diferencias entre los resultados de ambas pruebas.
Muchas algas producen metabolitos secundarios y/o defensas estructurales (Graham & Wilcox, 2000), aspecto que no fue analizado en el presente trabajo. Una herbivoría selectiva sobre otras especies explicaría el predominio en biomasa del género Halimeda sp., que posee un alto contenido de carbonato de calcio y metabolitos secundarios (Hay et al.,1994), y del género Dictyota, que produce metabolitos secundarios (Paul & Hay, 1986). El predominio de ambos géneros y de otras especies del orden Dictyotales coincide con lo encontrado por varios autores más recientemente en arrecifes de la zona suroccidental de Cuba (de la Guardia et al., 2004a, b; Alcolado et al., 2013), en otras zonas de Cuba (González-Díaz et al., 2003; Valdivia & de la Guardia, 2004; Caballero et al., 2009; Zúñiga-Ríoset al., 2012),así como en el mar Caribe o en los cayos de la Florida (Lirman & Biber, 2000; Márquez & Díaz, 2005; Burkepile et al., 2013). No obstante, en arrecifes con un cierto grado de deterioro, otras especies, por ejemplo Microdyction marinum, C. fuliginosa y Codium isthmocladum Vickers, pueden tener altos valores de abundancia (Alcolado et al., 2001; Lapointe et al., 2005; Zúñiga-Ríos et al., 2012).
Al analizar las diferencias entre los sitios se destacó el arrecife de Juan García, con valores más altos de biomasa total y riqueza de especies de macroalgas. También se observaron diferencias en la composición estructural (especies y su abundancia), donde JG5s, JG10ll y JG10s se diferenciaron de los otros muestreos de los arrecifes frontales. En la zona frontal del arrecife de Cantiles se hallaron valores comparativamente más bajos de la biomasa total en la época de secas, principalmente a 5 y 10 m de profundidad. El arrecife frontal de Diego Pérez exhibió una menor riqueza de especies de macroalgas en casi todos los muestreos. Estas diferencias son el resultado de la interacción de factores que actúan en forma combinada (en ocasiones sinérgicamente), sobre los organismos vivos. Uno de los factores que influyen sobre el desarrollo de las macroalgas es la concentración de nutrientes (Graham & Wilcox, 2000). No existen registros de la concentración de nutrientes de los sitios estudiados en la fecha de recolecta (década de los 80). Sin embargo, Lluis-Riera (1972) reportó concentraciones de nitratos (0.20-1.29 µM) y de fosfatos (0.10-0.31 µM) en aguas cercanas a estos tres arrecifes entre 1967 y 1970. Estos niveles de fosfatos fueron más altos, en la mayoría de los casos, al valor encontrado por otros autores (~0.10 µM de fósforo reactivo soluble; Lapointe, 1999; Littler et al., 2009) como valor límite, a partir del cual los corales comienzan a ser desplazados por las macroalgas en los arrecifes. Lluis-Riera (1972) también encontró mayores concentraciones de nutrientes en el periodo lluvioso que en secas, pero en los años en que se realizó este estudio, las precipitaciones fueron pobres en la zona (López Deulofeu et al., 2005). Es probable que esta sea la causa de que no se observaran diferencias en la biomasa total ni en la composición específica de macroalgas entre las épocas del año en que se realizaron los muestreos. La lluvia provoca variaciones de salinidad, pero además arrastra nutrientes por escorrentía desde tierra. Algunos géneros de macroalgas encontrados en este trabajo, como Halimeda y Dictyota, han sido hallados en diferentes épocas climáticas en arrecifes de coral del área geográfica (Lirman & Biber, 2000).
Otro aspecto que puede estar influyendo en estas diferencias entre los sitios es la circulación de las aguas, lo cual puede propiciar diferencias en la composición de especies de macroalgas a pesar de estar alejados de acciones antrópicas importantes. La circulación general de las aguas del golfo de Batabanó tiene una resultante general de Este a Oeste (Arriaza et al., 2008) lo que ocasiona una asimetría en la distribución de la materia orgánica en el golfo de Batabanó, con una mayor concentración en su zona suroccidental, por donde se hunden las masas de aguas hasta el fondo (Plante et al., 1989; Fernández de la Llera et al., 1990), hasta la zona donde se encuentra el arrecife de Juan García. Este arrecife también puede recibir la influencia de aguas con cierta carga terrígena proveniente de la costa más próxima al sur de la provincia de Pinar del Río (alrededor de 19 km), relativamente ricas en plancton (Plante et al., 1989; Alcolado, 1990a). Este mismo patrón de circulación puede contribuir con propágulos de algas procedentes de otras zonas del golfo de Batabanó hasta Juan García. Por otra parte, en la laguna arrecifal de este arrecife quedan zonas rocosas expuestas, lo que resulta en una combinación de sustratos rocoso, cabezos coralinos y zonas arenosas con pastos marinos (pradera de T. testudinum). De esta forma, en esta laguna arrecifal se encontraron especies con rizoides del orden Bryopsidales y otras con disco basal que se encontraron también en la zona frontal, como Amphiroa fragilissima, D. simplex, D. ciliolata, C. fuliginosa y Halimeda opuntia. Todos estos factores combinados aparentemente favorecen el desarrollo de las macroalgas, dando lugar a una mayor cantidad de especies y mayor biomasa total de macroalgas en Juan García.
Los arrecifes de Juan García y Cantiles reciben fuerte incidencia de los vientos del Sur durante los meses finales de la etapa seca (marzo - abril) y del Este, durante el resto del año (Alcolado, 1990a), lo que se refleja en los mayores valores del ITH a 5 y 10 m de profundidad. Este nivel de hidrodinamismo, dentro de ciertos límites, puede favorecer la distribución y el desarrollo de las macroalgas (por mayor oxigenación, reducción del sombreado de las frondas de las plantas, reabastecimiento y difusión de los nutrientes; Graham & Wilcox, 2000). La combinación de este factor con una adecuada disponibilidad de nutrientes en Juan García puede constituir un estímulo para el desarrollo de las algas y parecen determinar una mayor biomasa de macroalgas. A diferencia de Juan García y Cantiles, el arrecife de Diego Pérez se encuentra más protegido de los vientos por su ubicación geográfica, lo que se comprueba por los valores menores de ITH. Esto podría implicar un menor arribo de propágulos de especies de macroalgas. Este arrecife recibe cierta influencia terrígena de la península de Zapata (cuyo punto más próximo se encuentra a más o menos 13 km), en la cual existen extensas áreas de ciénagas y manglares bien conservados que pertenecen al Parque Nacional Ciénaga de Zapata (Alcolado, 1990a), lo que pudiera ser la causa de valores de biomasa algalen el mismo orden que en Juan García. Por otra parte, aunque en Cantiles hay altos valores de hidrodinamismo, sus aguas son relativamente más pobres en nutrientes por estar más expuestas a la influencia de las aguas oceánicas y menos a la terrígena (Plante et al., 1989). Esto explicaría que la biomasa algal sea la más pobre.
Pocas investigaciones han empleado la biomasa seca de macroalgas como indicador de abundancia. Lirman y Biber (2000) hallaron valores de biomasa seca de Dictyota spp., Halimeda spp. en el mismo orden que los del presente trabajo e incluso, algunos superiores, en el Parque Nacional Biscayne, Florida.
La biomasa húmeda total de macroalgas (antes de ser secadas) por muestra del presente estudio (que varió entre 2.3 y 1527 gPH.m-2) fue mucho menor que la registrada en los arrecifes del archipiélago Sabana-Camagüey entre 5 y 20 m de profundidad, en 1994 (entre 267 y 3110 gPH.m-2; Zúñiga-Ríos et al., 2012). Este resultado coincidió con una concentración promedio de nitrógeno inorgánico de 3.68 µM (Penié & García, 1998; Montalvo et al., 2007), casi tres veces superior al máximo encontrado en el sur del golfo de Batabanó por Lluis-Riera (1972). El promedio para los fosfatos en Sabana-Camagüey fue de 0.28 µM, con algunos valores puntuales superiores a 0.6 µ M (Penié & García, 1998; Montalvo-Estévez et al., 2007), casi el doble de los registrados en el sur del golfo de Batabanó por Lluis-Riera (1972). Como diferencia fundamental entre ambas zonas, se subraya que, a diferencia de los sitios del presente estudio, los arrecifes de Sabana-Camagüey se encuentran cerca de varias bahías con poca circulación donde se acumulan contaminantes, materia orgánica y nutrientes, provenientes de tierra firme (Montalvo-Estévez et al., 2007). Por esta razón, estos resultados apuntan a que los nutrientes juegan un papel primordial en el desarrollo de las macroalgas en estos arrecifes coralinos, independientemente de la herbivoría, que no fue evaluada en ninguno de los dos casos.
Los resultados del presente trabajo sirven como línea base para evaluar los posibles cambios que se hayan producido en las comunidades del macrofitobentos en estos arrecifes de coral, los cuales integran tres áreas marinas protegidas cubanas en la actualidad (SNAP, 2013). Resultaría interesante, repetir la evaluación en estas comunidades del macrofitobentos y su abundancia en estos arrecifes.











 nueva página del texto (beta)
nueva página del texto (beta)


