Introducción
La flora de algas marinas bénticas del Pacífico colombiano pertenece a las áreas menos conocidas del Pacífico Tropical Oriental. En comparación con el litoral Caribe colombiano, la flora de algas del Pacífico es menos rica en especies. Díaz y Díaz (2003) registraron un total de 549 especies para la región Caribe. En contraste, Peña y Palacios (1988) reconocieron en total 133 especies para la zona continental del litoral Pacífico. La baja diversidad de algas está relacionada con factores como la pluviosidad, la salinidad, la turbidez en la columna de agua y las condiciones desfavorables del sustrato (Schnetter & Bula, 1982; Marín & Peña, 2014).
Varios autores aseguran que la baja diversidad de flora marina en el Pacífico está vinculada con: los talos relativamente poco desarrollados, el difícil acceso a las localidades costeras y clima desfavorable, lo que explica que en tiempos pasados se recolectaran pocas algas en la costa del Pacífico de Colombia (Schnetter & Bula, 1982; Peña, 1998). Particularmente se ha estudiado con mayor énfasis las algas asociadas a manglar, y se ha demostrado que representan un valor ecológico significativo, especialmente por su aporte de carbono y materia orgánica en la columna de agua y su contribución a la remoción de nitrógeno, fósforo, metano y metales pesados que afectan la calidad de las aguas costeras (Robledo, 1996; Susarla et al., 2002; Peña et al., 2005; Kim et al., 2006; Peña et al., 2011).
Los bosques de manglar conforman uno de los ecosistemas más importantes del Pacífico colombiano, y dominan en las zonas costeras (Cantera, 1991; Peña, 1998; Cantera y Blanco, 2001; Peña, 1998), además, constituyen uno de los principales sustratos para la fijación de talos de la flora algal, especialmente en las áreas fangosas de la línea costera (Peña, 2008; Marín & Peña, 2014). La comunidad de algas epífitas está dominada principalmente por algas rojas, de los géneros Bostrychia (Rhodomelaceae, Ceramiales), Caloglossa (Delesseriaceae, Ceramiales) y Catenella (Caulacanthaceae, Gigartinales) (Schnetter & Bula 1982; Peña et al., 1987; Peña & Palacios 1988; Peña, 1998; Karsten et al., 2000). Esta asociación de algas conocida como el complejo “Bostrichetum”, se refiere principalmente a la relación característica global de estos géneros (Cantera, 1991; Peña, 1998; Cantera y Blanco, 2001; Peña, 2008).
La bahía de Tumaco se comporta como un sistema estuarino pues existe un intercambio continúo de aguas oceánicas con aguas continentales provenientes de la cuenca de los ríos Rosario, Mejicano y Curay, entre otros. El régimen mareal semidiurno de la bahía determina las condiciones de calidad del agua y provoca la dilución o concentración de los nutrientes, la variación de otros parámetros fisicoquímicos y la determinación de los procesos propios del ecosistema (Garay-Tinoco et al., 2006). Las condiciones oceanográficas del cuerpo costero están relacionadas con la composición florística de algas en la bahía, por cuanto la presencia de ciertas especies está influenciada por la salinidad y el tipo de sustrato. De igual manera, el resultado de la confluencia entre aportes naturales y antrópicos (estos últimos representados por contribuciones provenientes de poblaciones ribereñas, aguas residuales domésticas e industriales, actividades marítimas y portuarias), pueden influenciar el registro de ciertas especies de algas con importancia bioindicadora (Peña et al., 2005; Celis, 2008).
El presente trabajo evaluó el recurso algal de la bahía de Tumaco, mediante la descripción y actualización de los registros y del inventario de especies en esta región costera de la costa Pacífica colombiana.
Materiales y métodos
Área de estudio. El área de estudio se encuentra ubicada en el sur de la costa Pacífica de Colombia, en el departamento de Nariño, en la bahía de Tumaco y algunos esteros que actúan como brazos del río Mira (Fig. 1). La bahía de Tumaco se encuentra entre las latitudes 1°45’ y 2°00’ N y las longitudes 78°30’ y 78°45’ O; comprende un área de aproximadamente 350 km2 con profundidades que varían entre 0 y 50 m (Garay-Tinoco et al., 2006), y está conformada por una red hidrográfica de importantes tributarios de la cuenca del Pacífico, además de una extensa zona de esteros, de los cuales los más reconocidos son: Guandarajo, Chontal, Natal, Aguaclara, Pajal, Palmichal, Curay y Llanaje.
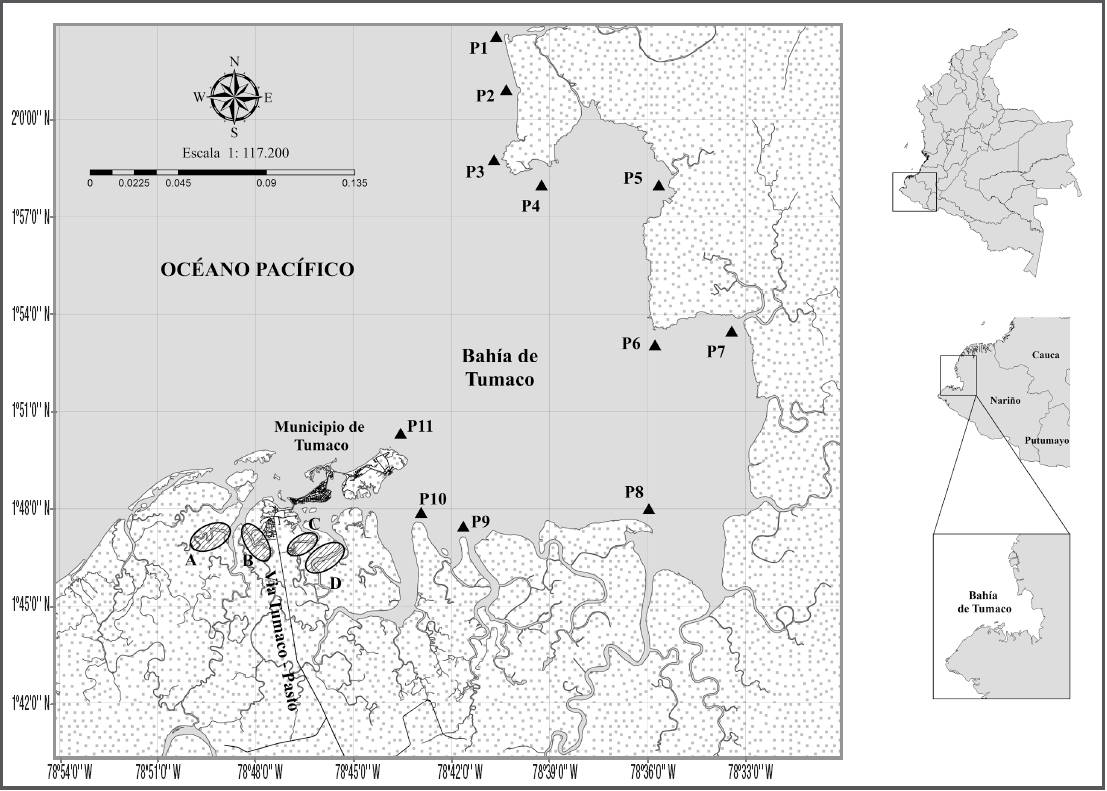
Figura 1: Bahía de Tumaco, Nariño, Colombia, indicando los puntos de muestreo en la bahía. P1- P2 = Salahonda. P3 = Pta. Cascajal. P4 = Pta. Isla del Gallo. P5 = Llanaje. P6 = Pta. Laura. P7 = Bocas de Curay. P8 = Trujillo. P9 = Resurrección. P10 = Playa El Bajo. P11= Isla del Morro y zona estuarina (A: Estero Chontal, B: Estero Palmichal, C: Estero Pajal, D: Estero Natal).
La zona de muestreo está influenciada por el aporte de agua del río Mira, principal colector de los tributarios de la región, que aporta gran cantidad de sedimentos en la zona costera aledaña (234.000 t. año-1), con una menor penetración de la luz en la columna de agua, especialmente en la época lluviosa a causa del lavado de suelos (Garay-Tinoco et al., 2006).
Las zonas de muestreo se dividen en dos grupos: el primero está conformado por zonas estuarinas caracterizadas por su alta productividad biológica y representadas en bosques de manglar dominados por Rhizophora mangle Linnaeo, Avicennia germinans Linnaeo y Laguncularia racemosa Karl Friedrich von Gärtner, con pocos sustratos duros y dominancia de planos lodosos; el segundo grupo corresponde a la ensenada, dominada principalmente por zonas rocosas y fondos arenosos.
Listado taxonómico. Para el desarrollo del listado se revisaron publicaciones, reportes bibliográficos y recolectas recientes, en los que se incluyen registros de algas del Pacífico colombiano, así como datos ecológicos y hábitat de las diferentes especies. El material se recolectó en los esteros referenciados y en la bahía entre mayo y diciembre de 2009 y entre marzo y octubre de 2010, (Fig. 1). Las macroalgas se recolectaron a nivel submareal, por medio de buceo autónomo y a nivel intermareal, y fueron removidas del sustrato manualmente y puestas en bolsas de plástico. La ubicación específica de la muestra dentro del hábitat fue tomada en el momento del muestreo. El material recolectado fue preservado en una solución de formalina al 4% en agua de mar, y se realizaron réplicas secas, las cuales fueron depositadas en el herbario CUVC de la Universidad del Valle, en Cali, Colombia. La identificación del material se llevó a cabo con base en la literatura existente para el Pacífico y el Atlántico Tropical (Schnetter & Bula, 1982; Díaz & Díaz, 2003; Wysor, 2004; Fernández, 2008; Fernández & Alvarado, 2008; Guiry & Guiry, 2014). Para comparar la flora marina de la zona de estudio con otras áreas, se revisaron los trabajos de Kamiya et al. (1997), West et al. (2001), Zuccarello et al. (2006), (Zuccarello y West, 2002, 2003, 2006) y Zuccarello et al. (2011). Se presenta la descripción de las especies registradas en la ensenada y la zona estuarina, con datos ecológicos, hábito, distribución geográfica y datos morfológicos en algunas especies. A su vez, la información taxonómica, y los datos de la distribución en el Pacífico colombiano y otras regiones del mundo se obtuvieron de la base de datos AlgaeBase (Guiry & Guiry, 2014).
Resultados
En total se registraron 26 especies de algas, de las cuales ocho pertenecen al filo Chlorophyta; dos a Ochrophyta, clase Phaeophyceae y 16 a Rhodophyta, distribuidas en nueve órdenes, 14 familias y 18 géneros (Tabla 1). Los números de inclusión en el herbario CUVC de la Universidad del Valle se presentan en la Tabla 2. De la flora algal asociada al manglar, las especies del género Bostrychia son las más abundantes a lo largo de la línea costera.
Tabla 1: Lista comparativa del número de especies de a nivel genérico, de las algas bentónicas marinas del Pacífico colombiano y de la Bahía de Tumaco. El arreglo orden taxonómico se basa principalmente en Guiry y Guiry (2014).
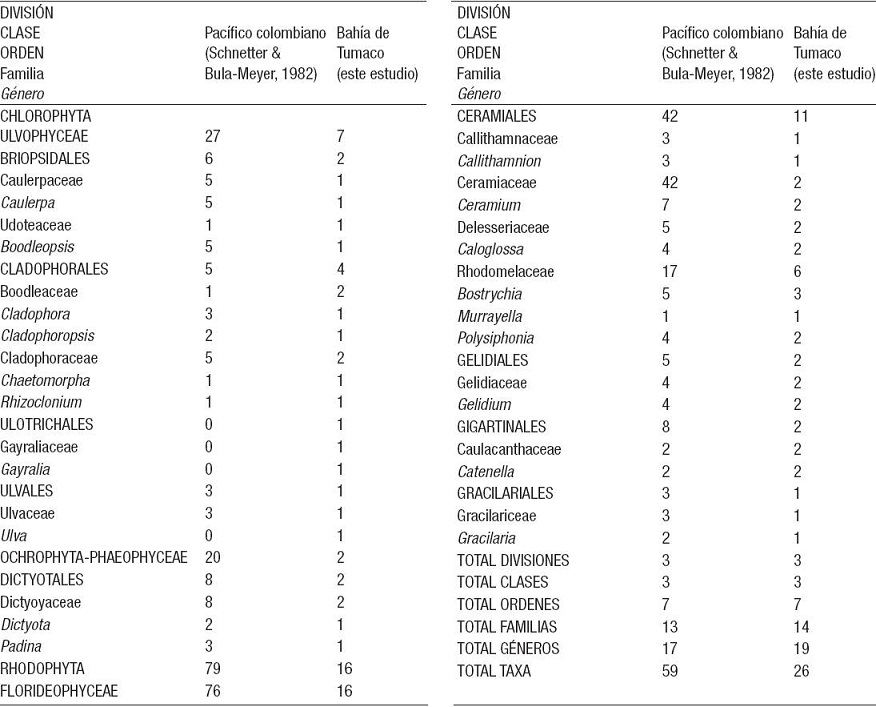
Tabla 2: Listado de algas bénticas marinas por División algal y orden alfabético, de la Ensenada de Tumaco, incluyendo distribución mundial y local.
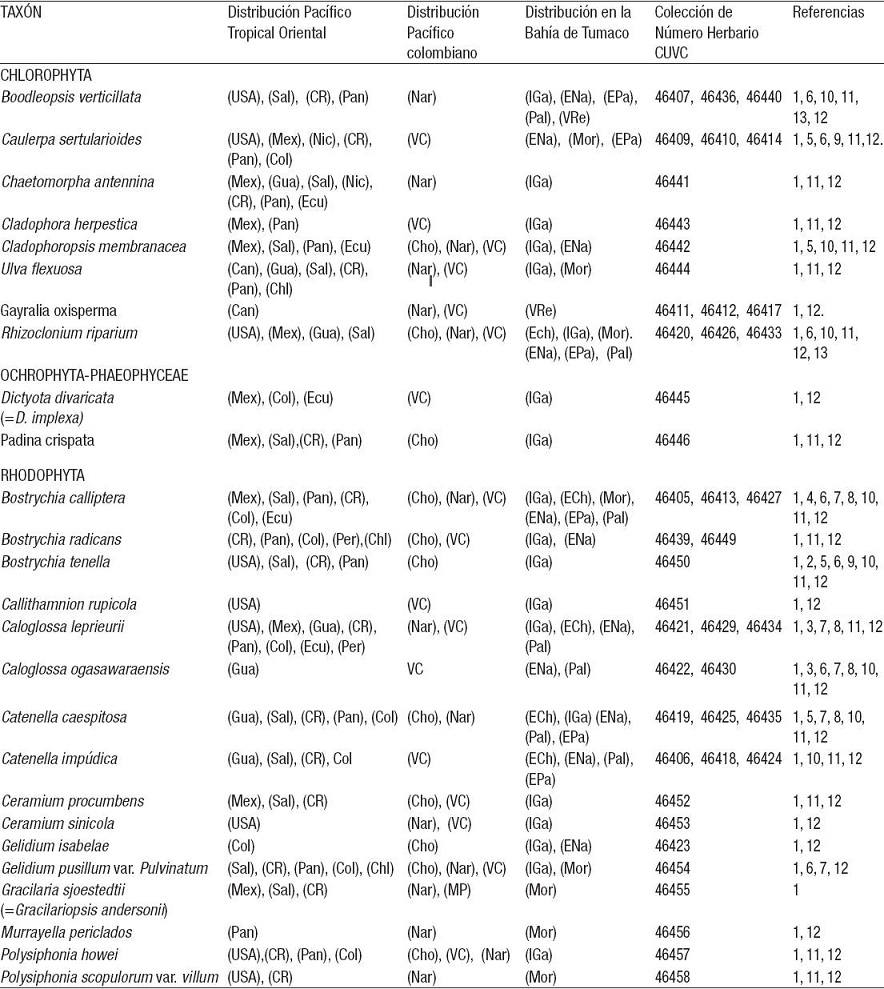
Los números frente a cada sector geográfico corresponden a las siguientes referencias: 1=Schnetter y Bula-Meyer (1982). 2=Kamiya et al. (1997). 3=West et al. (2001). 4=Zuccarelo y West (2002); 5=Díaz y Díaz (2003); 6=Wysor (2004); 7=Serviere et al (2007); 8=Tejada-Rivas (2002); 9=Fernández y Alvarado (2008); 10=Peña (2008); 11=Fernández et al. (2011); 12=Guiry y Guiry (2014). Distribución Pacífico Tropical Oriental: (Can)=Canadá. (USA)=Estados Unidos. (Mex)=México. (Gua)=Guatemala. (Sal)=El Salvador. (Nic)=Nicaragua. (CR)=Costa Rica. (Pan)=Panamá. (Col)=Colombia. (Ecu)=Ecuador. (Per)=Perú. (Chl)=Chile. Distribución Pacífico colombiano: (Cho)=Choco. (MP)=Mal Pelo. (Nar)=Nariño. (VC)=Valle del Cauca. Distribución Bahía de Tumaco: (IGa)=Isla del Gallo. (ECh)=Estero Chontal. (ENa)=Estero Natal. (Mor)=El Morro. (EPa)=Estero Pajal. (Pal)=Estero Palmichal. (VRe)=Vda. Resurrección.
Caulerpa sertularioides (S.G. Gmelin) M. Howe
Localidad tipo: “in coralliis americanis”
Descripción: frondas rastreras, adheridas por medio de rizoides. Eje principal rastrero, entre 5-19 cm de longitud y 1.5-2 mm de diámetro. Ramificaciones de 8-15 cm de longitud y 1.0 mm de diámetro; con la porción proximal de los ejes libre de pínnulas; ápices agudos. Pínnulas opuestas, bilaterales, de 5-10 mm de longitud y 0.5 mm de diámetro.
Hábitat: creciendo sobre sustrato arenoso, en la zona intermareal, desde 2 m por debajo de línea de pleamar hasta 4 m de profundidad.
Boodleopsis verticillata E.Y. Dawson
Localidad tipo: Interior de bahía San Telmo en Isla del Rey, Panamá.
Descripción: talos con estructura sifonal, formando cojines esponjosos, fijos al sustrato por medio de rizoides. Ramas erectas ramificadas de entre 100-50 µm de diámetro, que nacen generalmente en verticilos de 3 a 5 en las partes terminales de los segmentos.
Hábitat: sobre sustratos fangosos, en áreas de pleamar
Cladophora herpestica (Montagne) Kützing
Localidad tipo: bahía de islas Bay, Nueva Zelanda.
Descripción: talos erectos de hasta 2 cm de alto. Filamentos cilíndricos de 130-160 µm de diámetro, ápices redondeados. Rizoides en la base, con mayor presencia en zona proximal del talo.
Hábitat: sobre sustrato rocoso.
Cladophoropsis membranacea (Hofman Bang ex C. Agardh) Børgesen
Localidad tipo: Santa Cruz, Islas Vírgenes.
Descripción: talo filamentoso con ramificación lateral, formando cojinetes de gran extensión. Filamentos de 170-270 µm de diámetro.
Hábitat: crecimiento epífito, sobre hojas de mangle de arribazón.
Chaetomorpha antennina (Bory de Saint-Vincent) Kützing
Localidad tipo: Isla Reunión (océano Índico).
Descripción: talos gregarios, formando grupos de filamentos rígidos, uniseriados, de 2-10 cm de altura, de crecimiento difuso, adheridos por medio de rizoides ramificados. Células basales aproximadamente 10 veces más largas que anchas, de hasta 9 mm de longitud y más de 500 µm de diámetro en la parte distal; paredes celulares gruesas y estratificadas, con constricciones en las áreas basales del talo.
Hábitat: epífita sobre Bostrychia.
Rhizoclonium riparium (Roth) Harvey
Localidad tipo: Norderney, islas Frisias orientales, Alemania.
Descripción: talo filamentoso, formando mechones de 7-15 cm de longitud. Filamentos simples, cilíndricos o con ligeras constricciones, de 20-55 µm de diámetro. La presencia de pequeñas ramas rizoidales simples es poco frecuente, y cuando las presentan, éstas están constituidas por más de una célula.
Hábitat: epifita del complejo Bostrychetum, ubicada en las raíces de mangle rojo (R. mangle), desde el suelo hasta aproximadamente 1.20 m de altura.
Gayralia oxysperma f. wittrockii (Bornet) P.C.Silva
Localidad tipo: Cherbourg, Manche, Francia.
Descripción: talo sacciforme en la base, después foliáceo; lámina monostromática de hasta 2.5 cm de largo y 1 mm de ancho. Células en vista superficial agrupadas de forma irregular, de 1.3-1.7 y de 2-4 µm de diámetro. Cloroplasto parietal con un pirenoide.
Hábitat: sobre sustratos lodosos y neumatóforos de Avicennia germinans.
Ulva flexuosa Wulfen
Localidad tipo: Duino, Trieste, mar Adriático.
Descripción: talo con ramificaciones basales de hasta 5 cm de longitud, eje y ramas más anchas en la zona apical, entre 1-3 mm de ancho. Organización celular en hileras longitudinales en la zona basal y media del talo y de forma irregular en la zona apical.
Hábitat: Sobre sustrato areno-fangoso.
Dictyota implexa (Desfontaines) J.V. Lamouroux
Localidad tipo: mar Mediterráneo.
Descripción: talo de entre 5-7 cm de alto, ejes hasta 3 mm de ancho, regiones apicales con división dicotómica; bifurcación entre 90 y 120°.
Hábitat: creciendo en zonas rocosas.
Padina crispata Thivy
Localidad tipo: golfo Dulce, Costa Rica.
Descripción: talo postrado, aproximadamente de 10 cm de alto, con múltiples ramificaciones y estípites cubiertos por rizoides. Lámina de 2-4 cm de ancho, haz calcificado. Tetrasporangios de 80-100 µm de diámetro, formando soros en ambas caras del talo, algunos dispersos en la zona apical de la lámina.
Hábitat: creciendo en sitios expuestos al oleaje directo.
Callithamnion rupicola C.L. Anderson
Localidad tipo: bahía de Monterrey, EE.UU.
Descripción: talos pulviniformes de aproximadamente 2 cm de alto. Ramificaciones alternas o unilaterales, pinnadas o bipinnadas. Tetrasporangios sésiles, sobre la cara superior de las pínnulas. Espermatangióforos en soros longitudinales, adaxiales, sobre pínnulas de segundo orden.
Hábitat: creciendo sobre sustrato rocoso.
Ceramium procumbens Setchell et N. L. Gardner
Localidad tipo: Isla Partida, Baja California, México.
Descripción: talo de 1 cm, incompletamente corticado, eje principal rastrero, epífito, adherido por medio de rizoides, de aproximadamente 1-3 mm de longitud. Ramificación lateral, ápices rectos y agudos, ramas laterales erectas, simples. Tetrasporangios verticilados, irregularmente cruciados, de 40 µm de ancho por 50 µm de alto, inmersos en estiquídios. Espermatangios en partes abultadas de las ramas erectas.
Hábitat: epìfita, sobre hojas de manglar de arribazón.
Ceramium sinicola Setchell et N. L. Gardner
Localidad tipo: Bahía de Ensenada, Baja California, México.
Descripción: talo de 1-3 cm de alto, con ejes rastreros y erectos; rizoides numerosos, simples y ramificados. Ramificación desde alterna hasta dicótoma, bifurcaciones obtusas. Ápices rectos o acuminados. Tetrasporangios inmersos, dispuestos en verticilos o de manera irregular, de 50 µm de diámetro y 75 µm de largo aproximadamente.
Hábitat: epífita sobre hojas de mangle de arribazón.
Caloglossa leprieurii (Montagne) G. Martens
Localidad tipo: Sinnamary, NO de Cayena, Guayana Francesa
Descripción: talo rastrero, de hasta 5 mm de diámetro, bifurcado y atenuado en los nudos y en otras partes, pero también alado en las ramificaciones. Rizoides en nudos ventrales, adheridos a raíces de R. mangle, asociado a Catenella impudica, C. caespitosa y Bostrychia sp.
Hábitat: creciendo en raíces de R. mangle, asociado a Catenella impudica, C. caespitosa y Bostrychia sp.
Caloglossa ogasawaraensis Okamura
Localidad tipo: islas Ogasawara (Islas Bonin), Japón.
Descripción: talo rastrero de entre 1-2 mm de diámetro, con ejes principales conspicuos; ramas laterales en los nudos, a ambos lados; rizoides en el costado ventral y ramas adventicias dispersas. Segmentos lineales, lanceolados, de 250-600 µm aproximadamente y entre 2-5 cm de largo.
Hábitat: adherida a raíces de R. mangle. Crecimiento asociados a Catenella impudica, C. caespitosa y Bostrychia sp.
Gelidium isabelae W.R Taylor
Localidad tipo: Punta Albemarle (Isla Isabela), Isla Galápagos, Ecuador.
Descripción: talos de 0.2-1 cm de alto, formando ejes rastreros, cilíndricos o comprimidos, con hápteros. Ramas erectas pediceladas, liguladas o lanceoladas, con ápices obtusos; simples, algunas veces pinnadas.
Hábitat: sobre sustrato rocoso.
Gelidium pusillum var. pulvinatum (C. Agardh) J. Feldmann
Localidad tipo: Cádiz, España.
Descripción: Talos de 0.5-2 (-10) cm de altura, pulviniformes o cespitosos, formados por ejes cilíndricos, rastreros, fijos al sustrato por medio de hápteros. Ramas erectas, cilíndricas entre 0.3 y 1 mm de diámetro, hasta complanadas; Hábitat: creciendo sobre rocas en zona intermareal, o en el sublitoral superior, entre 0.5 y 1 m por debajo de la línea de pleamar.
Bostrychia calliptera (Montagne) Montagne
Localidad tipo: Cayena, Guayana Francesa.
Descripción: talo muy ramificado, formando cojinetes de 5-7 cm de longitud, diámetro del talo principal entre 690-700 µm, 698 µm en promedio. Ejes principales, ramificados de forma dicotómica o policótoma, presentando hápteros en la cara inferior de las ramificaciones en los ejes rastreros. Ramitas simples, de crecimiento limitado, de inserción dística, corticadas en las partes basales y medias, polisifónicas hasta los ápices. Células pericentrales entre 200-315 µm de diámetro. Cistocarpos de 800-834 µm y estiquídios entre 900- 988 µm de longitud y 980 µm de promedio.
Hábitat: en raíces de mangle rojo (R. mangle) y mangle negro (Avicennia sp.) asociada a Catenella impudica (Montagne) J. Agardh, C. caespitosa (Witherin) L. M. Irvine y Caloglossa spp.
Bostrychia radicans (Montagne) Montagne
Localidad tipo: Cayena, Guyana Francesa.
Descripción: talo sin corteza, pulviniforme, de hasta 1.5 cm de alto; ejes rastreros de 150-200 µm de diámetro, fijos al sustrato por medio de hápteros; ramas erectas de 45-125 µm de diámetro, ramificación dística y ápices incurvados.
Hábitat: en raíces de mangle rojo (R. mangle) y mangle negro (Avicennia sp.) asociada a Catenella impudica (Montagne) J. Agardh, C. caespitosa (Witherin) L. M. Irvine y Caloglossa spp.
Bostrychia tenella (J.V. Lamouroux) J. Agardh
Localidad tipo: Santa Cruz, Islas Vírgenes.
Descripción: talo formando cojinetes de 2-5 cm de alto. Ejes rastreros de alrededor de 280 µm de diámetro, fijos al sustrato por medio de hápteros parecidos a procesos, que nacen en la cara inferior de las ramificaciones y ápices incurvados. Células corticales en vista superficial, más o menos isodiamétricas, de 20 µm de ancho. Ramitas laterales insertadas disticamente, pinnadas, frecuentemente incurvadas y parcialmente corticadas; las pínulas de último orden monosifónicas.
Hábitat: en raíces de mangle rojo (R. mangle) y mangle negro (Avicennia sp.) asociada a Catenella impudica (Montagne) J. Agardh, C. caespitosa (Witherin) L. M. Irvine y Caloglossa spp.
Murrayella periclados (C. Agardh) F. Schmitz
Localidad tipo: Santa Cruz, Virgin Islands.
Descripción: talos rastreros fijos por medio de rizoides. Ejes erectos de hasta 4.5 cm de alto, ramificaciones dicotómicas en la zona proximal y alternas en la apical. Ejes con ramitas helicoidales, pigmentadas y monosifónicas, simples o con ramificación alterna. Estiquídios de tetrasporangios con pedicelo polisifónico y cuatro esporangios por segmento. Cistocarpos esféricos, de aproximadamente 350 µm de diámetro, en posición terminal sobre ramas laterales.
Hábitat: epífita de raíces de mangle.
Polysiphonia howei Hollenberg
Localidad tipo: Cayo Whale, Isla Berry, Bahamas.
Descripción: ejes rastreros, adheridos por medio de rizoides. Ramas erectas, generalmente ramificadas, de aproximadamente 1.5 cm de alto. Talos juveniles curvados. Segmentos de 100- 170 µm de diámetro, más cortos que anchos. Tetrasporangios de 45-55 µm de diámetro, unidos en hileras helicoidales en zonas distales de ramas erectas. Cistocarpos ovoides, aproximadamente de 175-200 µm de ancho. Espermatangióforos de 120-170 µm de largo y 35-59 µm de diámetro.
Hábitat: epífita, sobre hojas de mangle de arribazón.
Polysiphonia scopulorum var. villum (J. Agardh) Hollenberg
Localidad tipo: “ad littus Americae tropicae” (México).
Descripción: ejes rastreros, fijos al sustrato mediante rizoides unicelulares con hápteros lobados. Ejes erectos de 5-8 mm de alto, ramificaciones no continuas. Tetrasporangios de aproximadamente 50-60 µm de diámetro, dispuestos en hileras erectas. Cistocarpos ovoides, de 150-180 µm de ancho. Espermatangióforos cilíndricos.
Hábitat: creciendo en la zona intermareal rocosa.
Catenella caespitosa (Withering) L.M. Irvine
Localidad Tipo: Anglesey, Gales.
Descripción: Hábito: frondas fijas al sustrato por medio de hápteros cortos, predominantemente en los sitios donde el talo se ramifica. Talo de color pardo claro, 5 a 10 mm de longitud, ramificación dicotómica, formando segmentos fusiformes, teretes, comprimidos, de 2 a 3 mm de longitud por 0.8-1 mm de ancho. Hápteros delgados, de 1-1.5 mm de largo. Esporangios ovalados, en zonas apicales, de 1 mm de longitud por 0.5 mm de ancho.
Hábitat: creciendo sobre raíces de R. mangle, en la zona intermareal, entre 2 y 3 m por debajo de línea de pleamar.
Catenella impudica (Montagne) J. Agardh
Localidad tipo: Cayena, Guayana Francesa.
Descripción: Hábito: frondas rastreras y/o erectas, fijándose al sustrato por medio de hápteros cortos, predominantemente en los sitos de ramificación del talo. Talo de color pardo claro hasta púrpura, (2)-3 - 5-(7) cm de longitud. Fronda con ramificación dicotómica formando segmentos fusiformes, teretes, comprimidos, de 6-10 mm de longitud por 3-5 mm de ancho. Hápteros delgados, de 1-3 mm de largo. Cistocarpos sub-esféricos, entre las bifurcaciones, de 8-10 mm de longitud por 4 mm de ancho. Esporangios ovalados, en zonas apicales, de 3-5 mm de longitud por 1-2 mm de ancho.
Hábitat: creciendo sobre raíces de R. mangle, en la zona intermareal entre 0.5 y 1 m por debajo de línea de pleamar.
Gracilariopsis andersonii (Grunow) E. Y. Dawson
Localidad tipo: Santa Cruz, California. EE. UU.
Descripción: talos de hasta 18 cm de alto, con bifurcaciones irregulares; ramas de 2-4 cm de ancho, disminuyendo hacia los ápices. Células medulares de 100 µm de diámetro, células de la corteza, entre 25-80 µm de ancho. Cistocarpos dispersos, esféricos, de aproximadamente 800 µm de diámetro. Espermatangios en soros superficiales, redondeados; tetrasporangios esféricos, dispersos, de alrededor de 30 µm de ancho.
Hábitat: sobre sustratos arenosos.
Discusión
La costa del Pacífico Tropical del continente americano cuenta con limitados estudios sobre diversidad algal, además existe una falta de consenso taxonómico de algunas especies. En la región, Fernández et al. (2011) registraron en total 576 especies, mientras que en el Pacífico colombiano, Peña y Palacios (1988) listaron sólo 133 especies.
Las hipótesis relacionadas con la baja diversidad de algas en el Pacífico colombiano mencionan que esto se podrían atribuir a la alta pluviosidad, que ocasiona una disminución de la salinidad de las aguas superficiales; este factor tiene mayor relevancia dado el número de desembocaduras de los ríos, la turbidez del agua y las condiciones desfavorables del sustrato (Schnetter & Bula, 1982; Marín & Peña, 2014).
El litoral Caribe colombiano cuenta con aproximadamente con 472 (120 Chlorophyta, 62 Ochrophyta y 290 Rhodophyta). En contraste, el número de especies de algas en la zona continental del litoral Pacífico colombiano, que como se dijo anteriormente asciende a 133 especies (27 Chlorophyta, 22 Ochrophyta y 84 Rhodophyta) (Peña et al., 1987; Peña & Palacios, 1988; Peña, 1998; Díaz & Díaz, 2003; Álvarez et al., 2007), de las cuales 42 especies se encuentran en la isla Gorgona (Murillo & Peña, 2014). Comparativamente, la alta diversidad de especies de la isla está asociada a la poca influencia de los aportes de agua dulce continental (Bula, 1988; Peña et al., 2005), siendo este un factor a destacar al comparar el reducido número de especies en la bahía de Tumaco, teniendo en cuanta la influencia del río Mira y otros tributarios de la región que aporta gran cantidad de sedimentos en la zona costera (Garay-Tinoco et al., 2006).
En cuanto al litoral del departamento de Nariño, dominado por trechos muy extensos de manglares y las pocas zonas rocosas presentes en la costa, el substrato es demasiado blando para la fijación de talos mayores (Schnetter & Bula, 1982; Peña, 2008; Marín & Peña, 2014). Adicionalmente, las comunidades intermareales en su conjunto están afectadas por el fenómeno de las mareas; la alternancia de la inmersión y emersión influyen en otros factores ecológicos, como la temperatura, salinidad, iluminación y pH (Marín & Peña, 2014). Para la ensenada de Tumaco, se cuenta sólo con los registros de Schnetter y Bula (1982) en los sectores de El Morro y la Isla del Gallo, donde se registran 14 especies de Rhodophyta y seis de Chlorophyta, correspondientes al 14% de las especies del litoral Pacífico encontradas.
De acuerdo con este estudio, se mencionan nuevas localidades para las especies encontradas en la zona estuarina (Tabla 3), lo que permite comparar la flora marina que se presenta en la zona rocosa de la bahía, considerado uno de los ambientes poco estudiados y más representativos de la zona costera de la región de estudio.
Tabla 3: Distribución de macroalgas bénticas en las localidades estudiadas de bahía Tumaco, Colombia, de acuerdo a diferentes hábitats reconocidos.
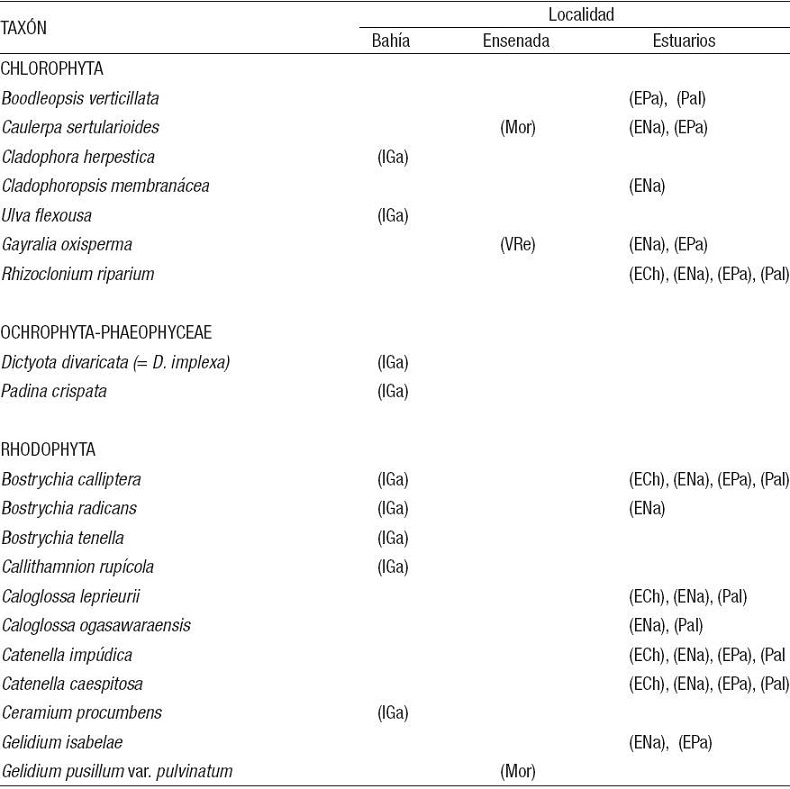
Distribución Bahía de Tumaco: (IGa) = Isla del Gallo. (ECh) = Estero Chontal. (ENa) = Estero Natal. (Mor) = El Morro. (EPa) = Estero Pajal. (Pal) = Estero Palmichal. (VRe) = Vda. Resurrección. (Para conocer la localización geográfica de las localidades, consultar la Figura 1).
Rhodophyta constituye el grupo más diverso de macroalgas en la zona de estudio, y destaca la presencia del género Bostrychia, tanto en la zona estuarina como en la ensenada. Zuccarello et al. (2011) encontraron una divergencia genética entre B. radicans y B. moritziana, que tuvo lugar después del cierre del istmo de Panamá. Peña (2008)) encontró especies de Bostrychia representativas del grupo citado por Zuccarello et al. (2011) en el Pacífico colombiano.
Las especies registradas en este estudio presentan distribución pantropical y coinciden con las descripciones presentadas por otros autores (Schnetter & Bula, 1982; Ospina-Álvarez et al. 2006; Peña, 1998; Peña, 2008; Zuccarello et al., 2006; Zuccarello & West, 2002, 2006; Zuccarello & West, 2011; Zuccarello et al., 2011). El hábitat de preferencia de las especies recolectadas se encuentra asociado a bosque de manglar. Esto fue mencionado por otros investigadores en varios sitios del Pacífico Oriental Tropical, como Nicaragua (Dawson, 1962), Colombia (Schnetter & Bula, 1982; Marín & Peña, 2014), Panamá (Wysor, 2004) y Costa Rica (Tejada-Rivas, 2002; Fernández, 2008).
Las especies registradas en estos ambientes presentan una serie de adaptaciones fisiológicas relacionadas con limitaciones ambientales de luz y nutrientes (Peña et al., 1999; Karsten et al., 2000; Delgadillo & Newmark, 2008; Peña et al., 2011). En general, las especies de este trabajo presentan una distribución batimétrica amplia y adaptabilidad morfológica y fisiológica que son determinantes para favorecer su distribución en diferentes ambientes (Collado & Robledo, 1999; Marín & Peña, 2014).
De acuerdo con los resultados, se concluye que la bahía de Tumaco presenta una baja diversidad de algas (26 especies), al ser comparada con los estudios en la isla Gorgona (Colombia) con 42 especies (Murillo & Peña, 2011) y en la isla de Coco (Costa Rica) con 170 (Fernández, 2008). Los datos aquí obtenidos también contrastan con los de Fernández et al. (2011), quienes registraron 216 especies en las costas del Pacífico de Costa Rica, 174 en las de Panamá y 146 en las de El Salvador. Aunque coinciden con los reportes para Nicaragua (24 especies) y Guatemala (16 especies) (Fernández et al., 2011). A la fecha, debido a los pocos estudios ficológicos para el Pacífico colombiano, no hay consenso en el número total de especies para la zona, especialmente aquellas presentes en la zona submareal somera o de profundidad, por lo que es necesario continuar con exploraciones en estas localidades poco estudiadas y, de esta manera, realizar comparaciones con los registros de otras localidades.











 nueva página del texto (beta)
nueva página del texto (beta)
















