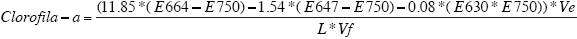Introducción
La biomasa fitoplanctónica es un parámetro esencial en los ecosistemas acuáticos, ya que constituye la base de las redes tróficas al ser el producto final del proceso de la fotosíntesis que transforma el dióxido de carbono en carbono orgánico (Álvarez-Borrego, 2007). Es por ello que su estimación ha sido calculada con diferentes indicadores y métodos, cada uno con diferentes niveles de precisión.
Uno de los indicadores indirectos más utilizados para estimar la biomasa fitoplanctónica es la determinación de la clorofila-a (Cl-a), debido a que está presente en todos los grupos algales y es el único parámetro biológico que puede ser evaluado mediante percepción remota en ambientes oceánicos pelágicos (Platt et al., 2008). Sin embargo, en los litorales costeros, los cuales son considerados como uno de los ecosistemas marinos más productivos a nivel global (Muller-Karger et al., 2005), dichas evaluaciones se deben hacer aún in situ debido a que los satélites no pueden calcular la biomasa fitoplanctónica en aguas someras. En cuanto a los métodos más utilizados para evaluar la biomasa de la comunidad fitoplanctónica destaca el método tricromático (Aminot & Rey, 2000) por encima de otras técnicas como el HPLC (cromatografía líquida de alta resolución), debido principalmente a los altos costos de operación que conlleva su uso (Steinman et al., 2007).
Otro método utilizado para calcular la biomasa fitoplanctónica a nivel específico o por grupos algales es el biovolumen (BV), en donde la información morfométrica de las células se convierte a unidades de volumen geométrico y posteriormente a unidades de carbono (Menden-Deuer & Lessard, 2000; López-Fuerte et al., 2007). Por lo general, las muestras destinadas a la evaluación de BV son preservadas con diferentes soluciones, siendo el Lugol ácido (Throndsen, 1978) el más utilizado para muestras de fitoplancton, no obstante que se ha comprobado que este fijador modifica las dimensiones celulares (Menden-Deuer et al., 2001).
Con el objetivo de mostrar el margen de diferencia que existe respecto al cálculo de la biomasa fitoplanctónica con los métodos de biovolumen y espectrofotometría, se realizaron cálculos sobre cuatro taxones de diatomeas en cultivo. Adicionalmente, bajo la hipótesis de que la medición de células vivas para la obtención del BV disminuye el error en las estimaciones de la biomasa, se realizaron comparaciones entre el BV obtenido en células vivas y fijadas con Lugol ácido.
Materiales y métodos
Diseño experimental. Se usaron cuatro cultivos de diatomeas y el diseño experimental constó de dos partes: 1) El cálculo de biomasa por medición de la concentración de clorofila-a. En cuatro cultivos de diatomeas se calculó la biomasa de una alícuota y se realizaron conteos celulares para estimar el contenido de carbono por célula. 2) El cálculo de biomasa a partir de la medición de biovolumen. Se establecieron dos tratamientos: uno en células vivas y otro en células fijadas con Lugol ácido para cada cultivo. En cada tratamiento se midieron 40-45 células.
Aislamiento y cultivos celulares. Se aislaron cuatro taxones de diatomeas marinas: Thalassiosira hispida Syvertsen, Skeletonema costatum (Greville) Cleve, Cylindrotheca closterium (Ehrenberg) Reimann et J. C. Lewin (=Ceratoneis closterium Ehrenberg) y Pseudo-nitzschia H. Peragallo sp.; todas provenientes del Parque Nacional Sistema Arrecifal Veracruzano (PNSAV) para su posterior cultivo. El aislamiento se realizó con micropipetas adelgazadas y cámaras de pozos empleando varias células iniciales como inóculo (Andersen & Kawachi, 2005). Se utilizó el medio de cultivo f/2 (Guillard & Ryther, 1962) con adición de 1mL/L de una solución stock de metasilicato de sodio (4 g/100mL). Previo a la adición de nutrientes, el agua de mar fue filtrada con membranas Millipore tipo HA de 0.45 µm de apertura de poro y se le añadió una solución de HCl al 10% hasta que el medio de cultivo tuviera un pH de 7.5. Con una autoclave se esterilizó a 15 lb/pulgada2 de presión durante 10 min y después de que el medio se encontró a temperatura ambiente, se le incluyó 1mL/L de una solución stock de vitaminas (B1,100mg/L; B6, 100mg/L y B12, 10.447mg/L).
Las condiciones de los cultivos no axénicos fueron los siguientes: fotoperiodo luz: oscuridad de 14:10 h, aireación constante (en Pseudo-nitzschia sp. se sustituyó por una agitación manual diaria), 25°C, e irradiancia de 9.9 µmol/m2/s. Los cultivos se colocaron dentro de una cámara ambiental Scorpion scientific y fueron resembrados cada diez días para mantener el crecimiento exponencial en matraces de 125 mL con 75 mL de medio de cultivo y 1 mL de inóculo.
Cálculo de la biomasa mediante espectrofotometría. Para la extracción y determinación de Cl-a se obtuvieron dos alícuotas de 50 mL de cada uno de los cultivos, previa homogeneización de la muestra según Contreras-Espinosa (1994) y Aminot y Rey (2000). Las alícuotas fueron filtradas con membranas Millipore de 0.45 µm de abertura de poro, las cuales se introdujeron en un tubo de ensayo con 10 mL de acetona al 90% y posteriormente fueron homogeneizadas con un Vortex Mixer tipo 16700 para desintegrar la membrana. Estas muestras se guardaron en refrigeración a 4°C durante 24 h y después fueron incluidas en una centrífuga SOLBAT durante 15 min a 4000 rpm. El sobrenadante se colocó en una celda de cuarzo para ser analizada en un espectrofotómetro Genesys 10 UV. Las lecturas fueron realizadas a 750 nm de longitud de onda para correcciones por errores de turbidez y a 664, 647 y 630 nm que son las máximas absorbancias de las clorofilas a, b y c, respectivamente. Adicionalmente se realizó la lectura a 430 nm para cuantificar los carotenoides y poder calcular el índice de pigmentos de Margalef (430 nm / 664 nm).
Para obtener el valor de Cl-a, se utilizó la fórmula descrita por Aminot y Rey (2000), basada en el trabajo de Jeffrey y Humphrey (1975) como parte del método tricromático. La fórmula es la siguiente:
Donde E es la absorbancia a la longitud de onda indicada (750, 664, 647 y 630 nm), Ve es el volumen de extracción, expresado en mL; L es el grosor de la celda de cuarzo en centímetros y Vf es el volumen filtrado expresado en litros. El valor resultante de Cl-a se expresó en mg/m3.
La transformación de Cl-a a carbono se realizó mediante la ecuación:
C:Cl - a = 43.4-1.14T+1.85e^(-0.126T) (Thompson, 2006) generalizada para todos los grupos de fitoplancton, donde C es carbono, Cl-a es clorofila-a, T es temperatura en grados centígrados, I es la irradiancia en fotones µmol/m2/s y e es la base del logaritmo natural, igual a 2.718. La irradiancia dentro de la cámara ambiental fue medida con un sensor LI-COR, que fue igual a 9.923 µmol/m2/s a una temperatura de 25°C, de modo tal que la razón C:Cl-a fue igual a 15.686.
Para los conteos celulares, se obtuvo una muestra de 50 mL de cada uno de los cultivos y se fijó con Lugol ácido (Throndsen, 1978), posteriormente se contaron las células siguiendo el método descrito por la A.P.H.A. (1998), usando una cámara Sedgwick-Rafter con 1 mL de muestra. Las observaciones se hicieron con un microscopio invertido Carl-Zeiss-AXIO utilizando el objetivo de 40X. Con base en estos conteos y el valor obtenido del cálculo de biomasa, se estimó el valor correspondiente de biomasa por cada célula.
Cálculo de la biomasa mediante biovolumen. Para estimar la biomasa mediante biovolumen, se tomaron dos muestras de 50 mL de cada cultivo, previa homogenización por agitación. Estas muestras se tomaron del mismo recipiente y al mismo tiempo que las muestras destinadas al cálculo de Cl-a mediante espectrofotometría.
La primera muestra se analizó in vivo, mientras que a la segunda muestra se le agregó una solución fijadora de Lugol ácido. Las mediciones de las células se hicieron con un microscopio óptico Motic BA-300 con contraste de fases, con una reglilla graduada en uno de los oculares y una cámara fotográfica digital Leica D-Lux 3 para capturar las imágenes de las células analizadas.
Para calcular el biovolumen de las células vivas, se midieron al menos 40 células, independientemente de que 25 células se consideran una muestra representativa (Smayda, 1978). Según la morfología de cada taxón se utilizaron ecuaciones para cuerpos geométricos conocidos (Fig. 1); en el caso de Thalassiosira hispida y Skeletonema costatum, la fórmula utilizada fue la de un cilindro, mientras que a Pseudo-nitzschia sp. le correspondió la de un prisma sobre un paralelogramo (Hillebrand et al., 1999). En el caso de Cylindrotheca closterium se ocupó la forma geométrica combinada de un esferoide y dos cilindros (Vadrucci et al., 2007).

Figuras 1a-g: Organismos cultivados y formas geométricas asociadas. a) Thalassiosira hispida. b) Skeletonema costatum. c) Cilindro. d) Pseudo-nitzschia sp. e) Prisma sobre paralelogramo. f) Cylindrotheca closterium. g) Esferoide más dos cilindros.
La transformación de los valores de biovolumen a carbono por célula (pgC/cel) se realizó con la fórmula pgC/cel.= 0.288 [BV (µm3)] 0.811 propuesta por Menden-Deuer y Lessard (2000), donde el BV utilizado fue el promedio de todas las mediciones para cada uno de los tratamientos, es decir, las células vivas o fijadas. La ecuación de Menden-Deuer y Lessard (2000) fue elegida de entre otras fórmulas disponibles debido a que es el producto de la compilación de la literatura de biovolumen en diatomeas. Para obtener el biovolumen de las muestras fijadas se utilizaron las mismas figuras y ecuaciones que las muestras analizadas in vivo.
Análisis de datos. La comparación entre los valores de biomasa obtenidos por espectrofotometría y biovolumen se hizo en términos de porcentajes, tomando como base el valor obtenido en unidades de carbono y el promedio obtenido mediante BV. Para buscar diferencias significativas entre los tratamientos de los cálculos de BV se realizaron pruebas de t. La homogeneidad de varianzas en los datos de BV se probó mediante la prueba de Levene (Zar, 2010) y se estimó el coeficiente de variación (C.V.) para cada una de los tratamientos en cada cultivo. Con el fin de obtener una serie de ecuaciones para estimar la biomasa a partir de mediciones de biovolumen, se realizó una correlación y regresión lineal simple entre el promedio de BV de cada uno de los tratamientos (células vivas y fijadas) y el valor de pgC/cel obtenido por espectrofotometría, utilizando el contenido de carbono como variable independiente. La significancia de las regresiones se comprobó utilizando el estadístico F; dichas ecuaciones presentan la corrección para las especies de la zona de estudio. Todos los análisis estadísticos se realizaron con el software Statistica 7.1 (StatSoft, 2005).
Resultados
La Figura 2 muestra que, tanto Thalassiosira hispida como Skeletonema costatum presentan valores marcadamente diferentes entre la biomasa obtenida por los métodos espectrofotométrico y de BV; sin embargo, en Pseudo-nitzschia sp. y Cylindrotheca closterium sucede lo contrario, ya que aquí los valores entre métodos resultan con poca diferencia. Con T. hispida y S. costatum el BV de células vivas arroja valores menores con respecto al valor de la biomasa estimada mediante espectrofotometría (subestiman ≈41% en ambos casos), mientras que en C. closterium y Pseudo-nitzschia sp. este comportamiento es a la inversa, ya que en este caso, el BV estima la biomasa con valores apenas mayores que con la espectrofotometría (sobreestiman 4% y 25%, respectivamente).

Figura 2: Comparación entre los métodos para cálculo de biomasa. El Biovolumen (BV) se obtuvo midiendo células vivas y transformando a unidades de carbono de acuerdo con Menden-Deuer y Lessard (2000), la clorofila-a se cuantificó de acuerdo con el método tricromático. Las líneas sobre las barras del BV, indican el error estándar.
De acuerdo al contenido celular de Cl-a en los distintos taxones se encontró que la estimación celular de carbono osciló entre 10.096 y 109.5 pgC/cel (Tabla 1). La especie con mayor biomasa calculada fue Thalassiosira hispida, seguida de Skeletonema costatum, Cylindrotheca closterium y Pseudo-nitzschia sp. Con respecto al índice de pigmentos (430/664), los valores estimados oscilaron entre 2.065 y 2.79 (Tabla 1).
Tabla 1: Biomasa calculada mediante el método espectrofotométrico. Clorofila-a, carbono e índice de pigmentos (430/664) de los taxones cultivados.

Los valores de BV variaron entre 24.24 µm3 y 1551.11 µm3 para todos los organismos analizados. Los promedios de BV por taxón, se ubicaron entre 83.73 y 775.81 µm3 para S. costatum y Thalassiosira hispida, respectivamente. En T. hispida y C. closterium las células vivas resultaron ser más grandes que las fijadas con Lugol ácido, no así con Pseudo-nitzschia sp. y S. costatum, en donde el promedio de BV fue mayor en las células fijadas. Los coeficientes de variación (C.V.) del BV entre los cultivos fueron considerables, desde 16.8 hasta 46.96, sin embargo, dentro de cada taxón en las células vivas y fijadas, la diferencia no fue evidente, con un máximo entre los tratamientos de 5.37. El taxón con menor C.V. fue C. closterium, seguida de Pseudo-nitzschia sp., T. hispida y S. costatum (Tabla 2).
Tabla 2: Biomasa calculada mediante el método de Biovolumen (BV). Valores de BV (μm3) y biomasa (pgC/cel) de las especies aisladas.

Trat. = Tratamiento. V= células vivas, F= células fijadas.
La prueba de t entre el BV de las células fijadas y vivas no mostró diferencia significativa en T. hispida (t = 1.298, p>0.05, g.l. = 88) y S. costatum (t = -0.113, p> 0.05, g.l. = 78). A pesar de esto, en T. hispida se observó que de acuerdo con los promedios de BV, el uso de Lugol ácido en las células vivas disminuye un 11% su volumen celular. Con S. costatum ocurrió lo contrario, ya que la fijación provocó un aumento de 2.56%. En C. closterium (t = 7.288, p<0.05, g.l. = 88) y Pseudo-nitzschia sp. (t = -9.721, p<0.05, g.l. = 79) la diferencia encontrada entre las células vivas y fijadas sí fue significativa; en el primer caso, la fijación celular disminuye su BV un 25.49%, y en el segundo caso el BV aumenta 60.79%. Las transformaciones de BV a carbono, al depender de la misma fórmula, presentan la misma proporción de cambio que los cálculos de BV.
Al realizar una correlación simple entre el promedio de BV de células vivas y el valor de pgC/cel obtenido por Cl-a, se obtuvo un coeficiente de correlación de R=0.9913 (p<0.05) y con las células fijadas, un valor de R = 0.9884 (p<0.05). En ambos casos, se observa una buena correlación entre estas dos variables.
Una regresión lineal simple utilizando al BV como variable dependiente arrojó la ecuación pgC/cel = -1.5567 + 0.1428 (BV) para células vivas, y pgC/cel = -5.0126 + 0.1644 (BV) para células fijadas. Ambas regresiones fueron significativas con un valor de R = 0.9913 (F0.05 (1,2) = 112.8073, p<0.05) y R = 0.98849 (F0.05 (1,2) = 85.39162, p<0.05), respectivamente.
Discusión
A nivel mundial se considera que muchas de las aplicaciones de la técnica del BV presentan inconvenientes, por ejemplo, Lee y Fuhrman (1987) concluyen que el tamaño del bacterioplancton marino, no refleja las variaciones en su biomasa estimada mediante peso seco. Bratbak (1985) menciona que la biomasa calculada mediante BV para bacterias acuáticas ha sido seriamente subestimada y ha influenciado las inferencias sobre los ecosistemas. En lo que se refiere a las diatomeas, el biovolumen mediante métodos de reconocimiento de imágenes parece sobreestimar la biomasa debido principalmente a que las mediciones son lineares y no tridimensionales (Álvarez et al., 2012; Roselli et al., 2013). No obstante que se ha reportado que el biovolumen está relacionado positivamente con la biomasa (Nazet al., 2013). Los resultados de esta investigación apoyan la idea de que al seguir únicamente la metodología tradicional para estimar el biovolumen, se puede incrementar el error al intentar cuantificar la biomasa de una especie y, por lo tanto, en explicar la producción primaria en el inicio de las redes tróficas marinas.
La biomasa (en unidades de carbono) calculada mediante la concentración de Cl-a y mediante el BV de células vivas, permite establecer que solamente en el caso de Pseudo-nitzschia sp. y de Cylindrotheca closterium el BV resulta confiable, ya que la biomasa es similar. Sin embargo, la biomasa mediante BV resulta marcadamente diferente en Skeletonema costatum y Thalassiosira hispida ya que ésta se subestima con respecto a los valores calculados por espectrofotometría. En el caso particular de esta última especie la biomasa es subestimada casi en la mitad del valor real.
En este trabajo se utilizó la espectrofotometría para la estimación de la Cl-a, en particular el método tricromático descrito originalmente por Jeffrey y Humprey (1975), el cual excluye la cuantificación de los feopigmentos, que son producto de la degradación de la Cl-a. El máximo de absorción de luz de este tipo de pigmentos se ubica en los mismos intervalos de longitud de onda que la Cl-a, cercano a los 664 nm por lo que su cuantificación es importante ya que puede sobreestimar los valores de Cl-a. Los feopigmentos en los cultivos analizados son tácitamente escasos con base en el índice de pigmentos también llamado Índice de Margalef, que es una relación entre pigmentos amarillos y verdes que se ubica entre valores de 2 y 7; mientras mayor sea su valor implicará una mayor madurez de una asociación algal (Margalef, 2005), es decir, que nos permite conocer la fase en que se encuentra un cultivo celular. En el caso de los cultivos utilizados para la cuantificación de Cl-a, los resultados de este índice nunca rebasaron un valor máximo de 2.79, lo que indica que en el momento en que se tomaron las muestras de los cultivos para el análisis de conteo y biomasa, éstos se encontraban como asociaciones jóvenes con una alta tasa de regeneración, característicos de la fase exponencial de crecimiento y, por lo tanto, con una dominancia pigmentaria de Cl-a. Esto permitió disminuir el error, ya que si se hubiera tomado de una asociación madura, los feopigmentos hubieran sido los más abundantes y la estimación de la Cl-a hubiera presentado un error significativo.
En las mediciones de BV, llama la atención el cultivo de Pseudo-nitzschia sp., en el cuál la adición de Lugol ácido a las células incrementa su BV un 60%. Este aumento se confirma con los valores del C.V. de las estimaciones de BV, que no son diferentes (de 20 a 23) entre las células vivas y fijadas. Este comportamiento del C.V. fue similar para todas las especies estudiadas.
De acuerdo con Hawkins et al. (2005), la adición de Lugol sobre las cianobacterias disminuye entre un 30 y 40% su volumen celular. En muestras de fitoplancton colectadas en campo, el Lugol en distintas concentraciones ejerce un cambio en el BV, tanto en el nano como en el microfitoplancton (Zarauz & Irigoien, 2008). Con respecto a las diatomeas, la preservación con Lugol según Menden-Deuer y Lessard (2001), puede variar hasta en un 30%. Los resultados presentados en este trabajo también muestran variación entre el BV real y el estimado en células fijadas (hasta 60%), por lo menos en dos de los cultivos de diatomeas. Esto reafirma la incógnita sobre los mecanismos que hacen que las diatomeas modifiquen su dimensión celular en presencia de Lugol, confrontándose con la suposición generalizada de que su cubierta de sílice no lo permite. Esta interrogante hoy en día no ha sido abordada, por lo que se considera un campo potencial de investigación.
Las estimaciones de BV de tres de las cuatro especies referidas en este estudio han sido cuantificadas en distintas partes del mundo con resultados muy variables. Para estas evaluaciones las fórmulas han sido elegidas de acuerdo con el criterio de cada investigador, lo que hace aún más complicado realizar una comparación de la biomasa con un mismo método pero con diversos enfoques. En fechas recientes se estableció una base de datos global de diatomeas en la que se resumen ciertas variables, entre las que se encuentran el BV y el contenido de carbono obtenidos a partir de mediciones morfométricas y una fórmula generalizada para la transformación a carbono (Leblanc et al., 2012). De acuerdo con dicho trabajo, y con base en 64 observaciones de diferentes especies del género Pseudo-nitzschia, el intervalo de la biomasa varía entre 11 y 485 pgC/cel, aunque dentro de este intervalo se incluyen valores de auxosporas, que tienen una mayor biomasa que las células vegetativas. En el caso de Cylindrotheca closterium y cuatro de sus cepas se ubicaron en el intervalo de 57 a 303 pgC/cel, mientras que tres cepas de Skeletonema costatum están entre los 2 y 193 pgC/cel. Thalassiosira hispida está ausente en dicho estudio y, de acuerdo con la revisión bibliográfica realizada, la presente investigación constituye la primera estimación de BV de dicha especie. De estos intervalos se puede determinar que las especies aisladas en el PNSAV tienen una menor biomasa que el intervalo para las mismas especies en otras partes del mundo (Rodríguez-Gómez, 2013). Cabe destacar que en los cálculos aquí presentados, la conversión de BV a carbono es más precisa, ya que la ecuación utilizada incluye dos variables importantes en el metabolismo de la fijación de carbono, que son la irradiancia y la temperatura.
De manera general se ha aceptado que el tamaño de los organismos decrece cuando aumenta la temperatura; que el contenido de carbono relacionado al BV disminuye con el aumento de tamaño y que la razón de C:Cl-a es igual entre los diferentes grupos que integran el fitoplancton (Atkinson, 1994; Margalef, 2005; Thompson, 2006), sin embargo, investigaciones recientes han contradicho estas posturas si nos referimos a los organismos fitoplanctónicos (Menden-Deuer & Lessard, 2000; Montagnes & Franklin, 2001). Aunque estos paradigmas han sido desarrollados para zonas templadas, los resultados aquí expuestos parecen concordar con estas ideas.
Concluimos que la medición del biovolumen es un método que, aunque es útil para estimar la biomasa de especies fitoplanctónicas, puede presentar algunos inconvenientes, ya que produce valores por arriba y por debajo de los valores del contenido de carbono estimado mediante espectrofotometría; este intervalo se ubica entre 2% y 60% en las diatomeas estudiadas. Aun así, para estudios donde se requiera conocer las dimensiones celulares, es preferible trabajar con las células vivas, ya que el Lugol ácido modifica significativamente el tamaño de las diatomeas, por lo menos en el caso de Cylindrotheca closterium (disminuye 25%) y Pseudo-nitzschia sp. (aumenta 60%). En futuros estudios, en donde se requiera conocer la biomasa de una especie, antes de elegir como método de estimación al BV, es recomendable considerar la información disponible sobre valores reales de su biomasa obtenida a partir de su concentración de Cl-a o carbono.
En este estudio se ofrecen dos ecuaciones con las correcciones para las especies de una zona tropical, por lo que si se cuenta con valores de biovolumen de células vivas, se sugiere utilizar las fórmulas mencionadas.











 nueva página del texto (beta)
nueva página del texto (beta)