Introducción
El enriquecimiento de nutrientes, nitrógeno (N) y fósforo (P), en ecosistemas acuáticos costeros representa una crisis ambiental en crecimiento. En muchos casos la intensidad de la carga de nutrientes en el ecosistema ha culminado en la eutrofización o hiper-eutrofización, pero tiende a diferenciarse entre regiones subdesarrolladas y desarrolladas (Selman & Greenhalgh, 2009; Marion & Orth, 2010; Dokulil & Teubner, 2011). Los ecosistemas limnéticos someros han sido más vulnerados debido a que pequeñas modificaciones en el aporte de nutrientes ha ocasionado cambios relativos en la composición de la comunidad y su funcionamiento (Kennish & Paerl, 2010).
En el dilema de la eutrofización en las lagunas costeras adquiere relevancia la vegetación de angiospermas sumergidas y enraizadas por sus funciones ecológicas, así como los servicios ambientales asociados (Wang et al., 2008a; Sánchez et al., 2012; Chen et al., 2013). En esencia, eleva la concentración del oxígeno que purifica el agua, participa en los ciclos biogeoquímicos de carbono (C), N y P, recicla los nutrientes en diferentes escalas tróficas y alberga altas densidades de biodiversidad planctónica y béntica. En contraste, el incremento de los nutrientes modifica la concentración natural de N y P, la disponibilidad de luz, el oxígeno disuelto y el crecimiento de fitoplancton, a lo que se ha atribuido la declinación masiva o pérdida drástica de angiospermas sumergidas en diferentes áreas biogeográficas (Burkholder et al., 2007; Li et al., 2008; Cao et al., 2011; Cai et al., 2012; Ruiz-Carrera & Sánchez, 2012; Zhu et al., 2014).
En las poblaciones del género Vallisneria la declinación por enriquecimiento de nutrientes se ha explicado más por el efecto negativo del N reducido que por el N oxidado (Cao et al., 2007; Li et al., 2008; Cao et al., 2009; Cao et al., 2011; Zhu et al., 2014). Varias respuestas fisiológicas y anatómicas en V. natans (João de Loureiro) han presentado correlaciones negativas con el incremento de nutrientes, en relaciones 20:1 de N: P en concentración total e iónica 1:2 de N-NH4:N-NO3 (Wang et al., 2012). En la misma especie se han ensayado relaciones 1:1 y 1:7 de N-NH4:N-NO3 (Wang et al., 2012; Dou et al., 2013). Sin embargo la relación N:P ha sido registrada en aguas eutrofizadas en magnitud más elevada (Quan & Falkowski, 2009).
En el ámbito de los ecosistemas acuáticos eutroficados la estrategia ha sido integrar en las evaluaciones la relación N:P y C:P (Leoni et al., 2008; Dodds & Whiles, 2010), y en las predicciones reduccionistas de estrés es factible usar el cultivo in vitro (Pérez-Clemente & Gómez-Cadenas, 2012). El modelo de cultivo in vitro de plantas que fue desarrollado para V. americana (André Michaux) ofrece una herramienta básica de acercamiento al estrés abiótico en tiempo real (Ruiz-Carrera & Sánchez, 2008).
El enfoque experimental con el balance estequiométrico de elementos que ciclan, en particular del C, N y P, en las propiedades biológicas y ecológicas de la biota ha formado parte de varias estrategias que han explicado el flujo de energía y materiales en diferentes niveles de organización, desde genes hasta ecosistemas (Elser et al., 2010; Sistla & Schimel, 2012; Wang et al., 2012; Minden & Kleyer, 2014). La estequiometría N:P ha sido utilizada en el análisis de correlaciones simples y múltiples de causas y efectos del estrés, sus evaluaciones en diferentes escalas espacio-temporales y como indicador de la calidad del agua para orientar la estrategia dual de manejo de N y P en los ecosistemas costeros (de la Lanza-Espino, 2011; Chen et al., 2013).
La modificación en la relación de N:P y C:P por incrementos de la concentración de nutrientes han impactado procesos metabólicos de especies sumergidas como la eficiencia en captura de luz y la asimilación de nutrientes (Burkholder et al., 2007; Leoni et al., 2008; Dodds & Whiles, 2010; Wang et al., 2012). Diversos estudios en lagos someros señalaron que la carga de N ha sido determinante en la pérdida de plantas sumergidas, aún en concentración de P suficientemente alta (Li et al., 2008). Las respuestas registradas en angiospermas acuáticas sumergidas por el enriquecimiento de N han sido de estimulación o inhibición directa en sus procesos fisiológicos e indirecta como la atenuación de luz, anoxia o hipoxia en el ambiente acuático debido al sobrecimiento de algas (Leoni et al., 2008), y estas respuestas han variado de acuerdo al genotipo, el protocolo implementado, la fuente de nutrientes (columna de agua o sedimento) y por las interacciones con factores tales como la temperatura, el forrajeo y la luz.
En el contexto de la vulnerabilidad de angiospermas sumergidas por el enriquecimiento de nutrientes en la columna de agua con N oxidado, la hipótesis plantea que el mecanismo de estrés en hojas y raíces está diferenciado a partir del incremento de la relación N:P y la carga de nutrientes.
El presente estudio analizó en condición de cultivo in vitro la resistencia al estrés de Vallisneria americana a las modificaciones en la estequiometría N:P (N-NO3 y P-H2PO4) y el nivel de enriquecimiento de nutrientes. La disminución en viabilidad y regenerantes de hojas y raíces fueron marcadores útiles para distinguir el mecanismo de estrés de esta angiosperma sumergida y para mejorar futuras aplicaciones de restauración en las lagunas costeras eutrofizadas del Continente Americano.
Materiales y Métodos
Ecosistema y recolección de frutos. En el humedal Reserva de la Biosfera Pantanos de Centla, localizado en la cuenca baja de los ríos Grijalva-Usumacinta, se ubica la laguna de Santa Anita (051° 39' 43" N - 20° 29' 756" O). En esta laguna tropical limnética (26.0 - 32.0 oC y 372 - 513 µS cm-1) fueron recolectados los frutos maduros de V. americana, en la temporada de transición al flujo alto de 2012. La laguna registró en esta temporada profundidad promedio de 2.4 ± 0.2 m con una transparencia de 0.3- 0.5 m, pH de 6.6 - 8.2 y oxígeno disuelto de 6.6 - 8.2 mg L-1. Según el Índice de Estado Trófico (Carlson, 1977), con valores de 0.62 ± 0.6 mg L-1 y 37.4 ± 16.9 µg L-1 para NT y Cla, la laguna presentó condiciones hipereutróficas.
Los frutos se transportaron al laboratorio en agua de la misma localidad. Las semillas fueron extraídas manualmente del fruto. El almacén de semillas permaneció en agua purificada dentro del refrigerador (5 oC) antes de iniciar los experimentos.
Cultivo in vitro de plantas. En la preparación de las semillas y unidades de cultivo para la regeneración de las plantas y los experimentos se usó la técnica de cultivo in vitro bifásico de Ruiz-Carrera & Sánchez (2008). La relación de altura entre fase gelificada (soporte de 4% agar-agar) y fase acuosa (columna de agua) fue 1:5 cm. Cada fase se preparó en recipientes de vidrio (6.5 cm altura x 5.5 cm ancho) con tapas de policarbonato (Magenta (r)). Las fases se esterilizaron en autoclave a 121 ºC por 17 min. Las fases fueron preparadas de agua dura a pH 7.5, compuesta de carbonatos, sulfatos y cloruros (Eaton et al., 2000).
Las semillas fueron desinfectadas con solución de NaClO (10% de Cloralex®) por 10 min en agitación constante (125 rpm) y enjuagadas tres veces con agua estéril. Antes de cultivar las semillas la fase acuosa fue agregada suavemente al soporte en la campana de flujo laminar. Las plántulas se desarrollaron en cuartos de cultivo en temperatura de 30± 5 °C, luz difusa y fotoperiodo de 16:8 h luz-obscuridad.
En los experimentos se sustituyó la fase acuosa de agua dura con medio nutritivo MS (Murashige & Skoog, 1962) modificado en la composición de sales de N con la exclusión de N-NH4. El nivel de luz de 20 µmol fotones m-2 s-1 (Photosynthetic Photon Flux-BQM) se estableció bajo para evitar el estrés por fotoinhibición (Murata et al., 2007). La renovación de la fase acuosa se realizó cuando las plantas fueron autótrofas, es decir presentaron coleóptilo seco, 2 o 3 hojas y 2 o 3 raíces.
Preparación de medio nutritivo. Los nutrientes del medio MS fueron preparados de: 1) soluciones de macronutrientes (CaCl2.2H2O, MgSO4.7H2O, KH2PO4), micronutrientes (H3BO3, MnSO4.4H2O, ZnSO4.7H2O, KI, Na2MoO4.2H2O, CuSO4.5H2O y CoCl2.6H2O), complejo Fe-EDTA (Na2EDTA y FeSO4.7H2O) y orgánicos (glicina, ácido nicotínico, piridoxina-HCl, tiamina-HCl y mio-inositol) y 2) diferentes pesos de KNO3 y NaHCO3, que fueron sumados en la concentración total de nutrientes. Las soluciones se concentraron 10 o 100 veces respecto a la concentración de nutrientes del MS modificado y permanecieron refrigeradas a 5°C en frascos de vidrio con tapa de policarbonato. El complejo Fe-EDTA fue protegido de la luz en frasco ámbar. Las diferentes fuentes de nutrientes se mezclaron y el pH fue ajustado a 7.5 antes de aforar. La mezcla de nutrientes fue renovada cada 15 días. A partir de las concentraciones de N-NO3, P-H2PO4 y C-HCO3 de la fase acuosa fueron calculadas las relaciones molares de N:P y C:P.
Diseños experimentales. Los experimentos se desarrollaron en régimen nutricional (RN) a través de dos experimentos factoriales aleatorizados usando las plantas in vitro de 20 días de edad. El primer experimento (RN1) cruzó relaciones N:P de 24, 20 y 16 (régimen N:P bajo) y concentración de nutrientes de 100%, 50% y 25% (régimen de nutrientes alto, moderado y bajo). El segundo experimento (RN2) cruzó relaciones N:P de 48, 60 y 72 de N:P (régimen N:P alto) y las concentraciones de 50%, 25%, 12.5%, 6.25% y 3.125% (régimen de nutrientes moderado, bajo y el resto muy bajos). Ambos experimentos incluyeron cinco réplicas por tratamiento más una repetición al centro en el segundo. El volumen de medio fresco se incrementó en 10 ml para evitar que las hojas rebasaran la interfase agua/aire. La relación de C:P aumentó en proporción con la concentración de nutrientes de 1.22 a 4.9 en RN1 y de 0.15 a 2.45 en RN2. El RN completo incluyó estequiometrías N:P que aplican a ecuaciones de crecimiento del fitoplancton (N16:P) y de macrófitas marinas enraizadas (N20:P) (Romero et al., 2006), así como a otras citadas en áreas naturales (Romero et al., 2006; Benson et al., 2008; Sardans et al., 2012).
La resistencia al estrés fue registrada con la declinación de la regeneración y la viabilidad foliar y radicular (10-15 plantas/unidad de cultivo), expresados en unidad o porcentaje. Por la edad juvenil de las plantas la predicción en el crecimiento de rametos fue opcional. En la unidad experimental se registró el número de plantas y el número de hojas iniciales. La presencia de algas asociadas fue indicada en categorías de ausencia y presencia.
Los predictores del experimento fueron los marcadores de regeneración y viabilidad. La regeneración fue medida con el número de hojas y raíces nuevas en un individuo seleccionado al azar. La viabilidad foliar fue analizado por el color (verde -2, parcialmente verdes-1 y cloróticas-0). La categoría cero también se aplicó a la desintegración foliar. La viabilidad de raíces fue indicada combinando la turgencia y los crecimientos longitudinales (no turgentes-0, turgentes sin cambio-1, turgentes -2 cortas y turgentes largas-3). La turgencia se ligó a la superficie brillante translúcida. La raíz larga rebasó la base del recipiente y presentó entorchamiento o circumnutación. En el segundo experimento las categorías 2 y 3 de la raíz se unieron en la categoría turgentes con crecimiento-2. Ambos marcadores fueron analizados cada 15 días en un periodo máximo de 10 semanas (Wang et al., 2012).
Análisis estadístico. El análisis de los datos fue desarrollado con el programa Statistica (release 8.0). En la determinación del supuesto de homogeneidad de varianza se usó la prueba de Cochran y de la normalidad fue Shapiro-Wilk (Zar, 1999). El MANCOVA fue usado en las variables de concentración de nutrientes, relación N:P y tiempos de cultivo. Las covariables fueron las algas (experimento 1) y el número de plantas iniciales (experimento 2). En el primer experimento se excluyó el tiempo de cultivo de 45 días y la concentración de 100%, porque las plantas se desintegraron en todas las unidades de cultivo. En las comparaciones múltiples se usó la prueba de Tukey a p<0.05. La correlación entre la regeneración unitaria de hojas y raíces, y la primera con la viabilidad foliar, así como entre las de regeneración y viabilidad porcentual de hojas y raíces viables (n= 459) fue establecida con el coeficiente de Pearson.
Resultados
Las plantas de Vallisneria americana no presentaron crecimiento de rametos en ningún régimen nutricional. En el primero (RN1), el crecimiento de algas en el 52% de los cultivos impidió observar la regeneración foliar y radical. Sin embargo, las algas oportunistas no presentaron covarianza (p>0.05). En relaciones N:P de 16 a 24 y concentración de nutrientes de 100% las plantas murieron. La concentración de nutrientes mostró variación significativa en la viabilidad de hojas (Fn=2= 12.95, p<0.0001), significativa en raíces (Fn=2= 8.08 p<0.001) y en las hojas la interacción presentó significancia menor (Fn=4= 3.51, p<0.01). El tiempo de cultivo no causó variación alguna (p>0.05). La viabilidad foliar disminuyó con el incremento de la concentración de nutrientes y en la raíz fueron iguales las de 50% y 25% (p<0.05). La viabilidad foliar fue máximo en la interacción 24 N:P y 25% de concentración de nutrientes (Fig. 1).

Figura 1 Viabilidad de hojas y raíces en las plantas de Vallisneria americana cultivadas en relación de N:P de 16 a 24 y enriquecimiento de nutrientes de 25 y 50%. Líneas verticales = intervalo de confianza. Literales diferentes = diferencias significativas (p< 0.05). n = 10 - 15
En el RN2, la covarianza afectó la regeneración de raíces y la viabilidad unitaria de hojas (Fn=1 =19.92, p<0.0001). En la regeneración de hojas y raíces fue significativo el efecto de la relación de N:P (Fn=2= 8.19, p<0.0005 y Fn=2 = 9.5, p<0.0001), la concentración de nutrientes (Fn=4 = 316.74 y 277.93, p<0.0001) y el tiempo de cultivo (Fn=4= 59.48 y 63.04, p<0.0001). La relación de N:P interactuó con la concentración de nutrientes y reportó diferencias de mayor significancia en la regeneración de hojas (Fn=8= 4.89, p<0.0001) que en la viabilidad unitaria de hojas (Fn=8= 2.68, p<0.007) y la regeneración de raíces (Fn=8= 2.126; p<0.03).
La declinación en regeneración de hojas y raíces y en la viabilidad de hojas fue gradual con el incremento de la relación de N:P (Fig. 2). Solo en hojas regeneradas fueron iguales las de 72 y 60 (p<0.05). En las relaciones N:P de 48, 60 y 72 de los tres marcadores no incrementaron en el tiempo (Fn=8 = 0.6089 y 1.0833, p>0.05). En cambio, la concentración de nutrientes interactuó con el tiempo de manera significativa (Fn=8= 40.76 y 27.72; p<0.0001). La declinación en regeneración de hojas fue constante en la concentración de nutrientes de 50%, y después de 45 días de cultivo murieron (Fig. 3). La regeneración foliar permaneció estática en 25% después de 45 días y en 12.5% a los 60 días. La viabilidad fue más notoria en las hojas (Fig. 4). La correlación fue significativa (r=0.9, r2=0.75 p< 0.01) entre la regeneración de hojas y raíces y entre la de regeneración de hojas y la viabilidad de hojas (r=0.53, r2=0.28 p<0.01) (Fig. 5). El perfil cinético fue similar entre la viabilidad unitaria de hojas y regeneración de raíces, en correspondencia con las correlaciones registradas (Fig. 5).
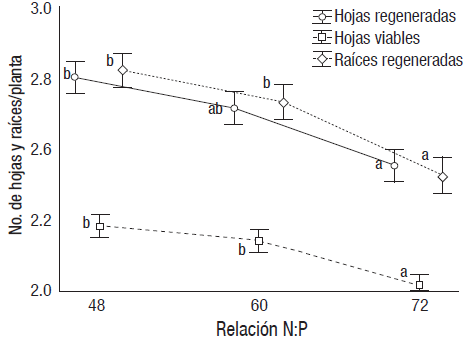
Figura 2 Declinación en la regeneración de hojas y raíces y viabilidad de hojas en plantas de Vallisneria americana con incremento en la relación N:P (48 a 72). Efecto covariado en el número de plantas. Líneas verticales = intervalo de confianza. Literales diferentes = diferencias significativas (p< 0.05). n = 10 - 15

Figura 3 Cambios en la regeneración de hojas de Vallisneria americana en orden creciente de concentración de nutrientes durante 75 días en cultivo bifásico. Promedios acumulados en la relación N:P de 48 a 72. Líneas verticales = intervalo de confianza. Literales diferentes = diferencias significativas (p<0.05). n = 5 - 10.

Figuras 4a-o Viabilidad de hojas y raíz de Vallisneria americana a los 60 días de cultivo con incremento en la relación N:P en función de la concentración de nutrientes (CN).
Discusión
Los estudios que han analizado el efecto del enriquecimiento de nutrientes, en particular de N, sobre las angiospermas sumergidas no han sugerido un patrón general de estrés a escala geográfica (Leoni et al., 2008). Para discernir el estrés de V. americana por el incremento de la relación N:P (N-NO3 y P-H2PO4) del enriquecimiento de nutrientes se evaluaron, en experimentos no destructivos a microescala, sus efectos directos e interactivos en la regeneración y la senescencia foliar y radical de plantas juveniles. En contraste a muchos experimentos realizados en el género Vallisneria se descartaron efectos puntuales de N-NH4 y el dual con N-NO3 (Wang et al., 2008b; Dou et al., 2013; Wang et al., 2012). También se excluyó el efecto de la variación N:P con limitación de N. Lo anterior con base en los registros de limitación de P en el hábitat limnético (Sterner, 2008; Raven, 2012) y a estudios que han indicado que la mineralización de N es más rápida que la mineralización de P en zonas tropicales (Sardans & Peñuelas, 2012). La influencia de epífitas quedó descartada incluso en condiciones que presentaron relaciones de N:P cercanas a la de Redfield (N16P). Vallisneria americana fue muy sensible a los cambios en la relación de N:P en ciertos umbrales críticos de concentración de nutrientes en la columna de agua, mantenida la relación C:P equilibrada con la de N:P. Además, presentó mecanismos de estrés diferenciados entre el incremento de la relación N:P y la concentración total de nutrientes, por lo que la hipótesis sometida a contrastación fue válida a microescala in vitro en las condiciones del presente estudio. La resistencia al estrés fue explícita en el segundo régimen nutricional con el incremento de la relación de N:P; en específico, el coeficiente de 72 mostró efecto negativo y potencializado.
Esta resistencia puede ser interpretada con base en la estequiometría del metabolismo C:N:P. En las etapas de crecimiento y desarrollo, las plantas son muy dependientes de la interacción C:N. La fotosíntesis proporciona la energía y los esqueletos de C para la síntesis de aminoácidos (Jiang et al., 2013); sin embargo el suministro de N en exceso afecta la capacidad de fijar carbono, y en consecuencia disminuye la provisión de fuerza reductora y ATP para culminar el proceso de asimilación de N. Adicionalmente, el P en condición de nutriente limitante restringe las síntesis del ARN ribosomal y de las proteínas (Raven, 2013). Es decir, en la síntesis de ARN ribosomal hay mayor demanda de moléculas de P que de N. De acuerdo a Raven (2012) y Veneklaas et al. (2012), una demanda metabólica de ARN ribosomal de tal magnitud es inadmisible, excepto en los productores primarios que cuentan con suficiente número de ribosomas para mantener una velocidad de síntesis de proteínas y más de la mitad de P libre para sintetizar ARN (hipótesis de la velocidad de crecimiento). También se ha señalado que la posibilidad de disminuir la asignación de ARN sin disminuir la tasa de crecimiento, es un proceso metabólico muy exigente (Raven, 2012), a menos que los organismos que crecen con limitación de P manifiesten sobrerregulación de ARN, o que en la etapa de crecimiento el reparto espacial y temporal de P sea muy eficiente para satisfacer los requerimientos de ARN y mantener constante la velocidad síntesis de proteínas (Raven, 2012).
Comparativamente, los resultados mostraron que la declinación en capacidad regenerativa y viabilidad de las plantas de V. americana fue menos drástica en función de la relación N:P que por la concentración de nutrientes. Resultó excluida la concentración de 3 % (0.33 a 0.26 g L-1) que mostró un ritmo en regeneración y viabilidad de hojas y raíces en constante aumento durante el periodo experimental. Con base en el marcador unitario de regeneración de hojas y sus correlaciones con regeneración de raíces y viabilidad foliar, se determinó que V. americana presentó más resistencia al estrés salino en concentración de nutrientes de 0.66 a 0.51 g L-1, que fue la segunda en el gradiente (6.25%). En contraste, la resistencia fue mínima en concentración de nutrientes moderada y baja (2.65 a 1.03 g L-1). En las concentraciones elevadas la planta completa presentó en breve tiempo (30 días) estrés letal. Estos resultados con la relación N:P del segundo régimen nutricional concuerdan con la vulnerabilidad del ecosistema limnético con pequeños cambios en la carga de nutrientes (Kennish & Paerl, 2010) y con estudios que han indicado la limitada tolerancia de V. americana al estrés salino (Benson et al., 2008). También explica la causa por la cual muchas macrófitas de aguas limnéticas no se ajustan a esquemas convencionales de cultivo in vitro (García-Jiménez et al., 2006; Ruiz-Carrera & Sánchez, 2008; Ruiz-Carrera & Sánchez, 2012).
En conclusión, el mecanismo de estrés por la relación N:P con N-NO3 fue interpretado por el desbalance metabólico de proteínas: ARN, sin haber presentado variación en tiempo. Por el contrario, el mecanismo de estrés con exceso de nutrientes fue osmótico y rápido. El mecanismo osmótico presentó similitud en la senescencia foliar y la elongación de las raíces provocada por la salinidad en diferentes plantas terrestres (Munns & Tester, 2008). Sin embargo, la identificación de circumnutación de raíces y las correlaciones efectivas entre regeneración de hojas y raíces y entre regeneración y viabilidad de hojas, mostraron valor agregado para mejorar la compresión del estrés abiótico por eutrofización, tanto in vitro como de campo en el ecotipo focal. La circumnutación de raíces en las angiospermas sumergidas no ha sido destacada en otros estudios (Kosuge et al., 2013).
Una perspectiva experimental de mayor nivel para la interpretación fina de ambos mecanismos de estrés, requiere técnicas modernas de proteómica, metabolómica y fenómica en asociación con las técnicas in vitro. El enriquecimiento de N analizado con estequiometría N:P a microescala in vitro, indicó que en la angiosperma sumergida, V. americana la resistencia al estrés estuvo vinculada a cargas bajas de nutrientes, con la fuente N oxidada en la columna de agua. La comprensión de estos conocimientos en V. americana requieren ser acoplados a las estrategias de rehabilitación de los ecosistemas que tienden a la eutrofización para mantener los beneficios de soporte, provisión y regulación de las lagunas limnéticas, como es el agua para beber, la cosecha de peces, varios bienes de mercado y los servicios recreacionales asociados.











 nueva página del texto (beta)
nueva página del texto (beta)



