Introducción
En la costa sur del Pacífico Tropical mexicano, entre Punta Chipehua, próxima a la ciudad de Salina Cruz, Oaxaca, México (16º01´31.39´´ N y 95º22´24.56´´ O) y Puerto Chiapas, Chiapas, México (14º40´55.81´´ N y 92º23´44.13´´ O), se localiza el Golfo de Tehuantepec (Cervantes-Hernández, 2008), donde se sitúa la zona marina 90 de pesca (subdividida en cinco sub-zonas de la S-91 a la S-95) (Fig. 1). En todas las sub-zonas, así como en los sistemas lagunares: (a) Huave, (b) Mar Muerto, (c) Cabeza de Toro-La Joya Buenavista, (d) Los Patos-Sólo Dios (e) Carretas-Pereyra y (f) Chantuto-Panza Cola (Fig. 1), se registra una alta actividad pesquera de altamar y ribereña, orientada a la explotación del recurso camarón (Cervantes-Hernández et al., 2006; 2008a; 2010; 2012). Las especies de camarón que principalmente son explotadas son: (a) el "café" o Farfantepenaeus californiensis (Holmes, 1900) y (b) el "blanco" o Litopenaeus vannamei (Boone, 1931) ( Cervantes-Hernández et al., 2008a).

Figura 1 Localización geográfica del Sistema Lagunar Mar Muerto (SL-MM), Oaxaca-Chiapas, México. Los puntos negros corresponden a las estaciones de muestreos para la captura ribereña de camarón; mientras que, los puntos grises designan a las estaciones de recolección para los sedimentos. Cuadro superior derecho, localización geográfica de la zona marina 90 de pesca en el Golfo de Tehuantepec. Los sistemas lagunares son: (a) Huave, (b) Mar Muerto, (c) Cabeza de Toro-La Joya Buenavista, (d) Los Patos-Sólo Dios, (e) Carretas-Pereyra, (f) Chantuto-Panza Cola.
El Sistema Lagunar Mar Muerto, Oaxaca-Chiapas, México (SL-MM), se localiza en la sub-zona S-92, entre los 15° 57´ 47.2´´-16° 18´ 36.02´ N y 93° 48´ 12.05´´-94° 27´ 05.95´´ O (Fig. 1). En la región oaxaqueña, que incluye también al Sistema Lagunar Huave, Oaxaca, México (SL-H), la pesca ribereña del recurso camarón y escama se rige mediante el sistema de "Usos y Costumbres", caracterizado por un alto sentido de lapertenencia étnica (Toledo, 1994; Millán, 2003) y una reacia resistencia a intromisiones externas (Espinoza-Tenorio et al., 2011). Lo anterior ha retrasado por décadas la presencia y el desempeño del Gobierno Oaxaqueño, así como también la intervención académica. Por esta razón, a la fecha, no se ha podido consolidar un ordenamiento que permita mejorar la disponibilidad de los recursos ribereños (camarón y peces) aún disponibles en los SL-MM y SL-H.
En los sistemas lagunares antes mencionados, el ordenamiento de la pesca ribereña de camarón se ha planificado históricamente considerado aspectos socioeconómicos y culturales (Anónimo, 1998); porque nunca antes para los SL-MM y SL-H, se habían estimado indicadores poblacionales para la captura ribereña, ni analizado la disposición geográfica de los sedimentos internos. El objetivo de este trabajo fue localizar y delimitar geográficamente, las zonas lagunares que persistentemente, al interior del SL-MM, presentan los mayores y menores niveles de captura ribereña de "juveniles" de F. californiensis y L. vannamei. Para realizar lo anterior, inicialmente se corroboró el tipo de distribución ecológica que estas poblaciones tienen al interior del SL-MM (aleatoria o agregada). Los resultados del análisis anterior, sefueron explicados haciendo énfasis en la disposición geográfica de los sedimentos internos; pero adicionalmente, se tomó en cuenta la variación hidrológica documentada para el SL-MM (Tapia-García et al. 2011; Castrejón-Rodríguez, 2014), referente a la temperatura superficial del agua (TSA en °C) y la salinidad (S en UPS). Las conclusiones obtenidas, estuvieron encaminadas a explicar el potencial y las oportunidades actuales del SL-MM, respecto al desarrollo de proyectos productivos en pesca, acuícolas y de conservación.
Material y Métodos
En 16 estaciones georreferidas a lo largo del SL-MM (Fig. 1), el Centro Regional de Investigación Pesquera de Salina Cruz, Oaxaca, México (CRIP-SC), realizó mensualmente, en un rango aproximado de profundidad entre 1 y 6 m, muestreos para la captura ribereña de camarón (Kg), entre el 12 de mayo 2005 y el 16 de febrero 2006 (excepto, noviembre 2005) (Tabla 1). La captura se obtuvo mediante tres lances, utilizando atarrayas de monofilamento con un grosor de hilo de 0.1 mm, 1.5 m de diámetro y con luz de malla de 20.0 mm. Para realizar el trabajo de campo, que fue entre las 8:00 y 14:30 horas, se utilizó una lancha de fibra de vidrio modelo W-25 con 7.61 m de eslora, capacidad de carga de 1,200 kg y motor YAMAHA de 60 Hp (14.1 kw). Posterior a las faenas de captura, los ejemplares capturados se identificaron a nivel de especie con las claves taxonómicas de Hendrickx (1995).
Tabla 1 Registros mensuales para la captura ribereña de camarón (Kg) en distintas zonas del Sistema Lagunar Mar Muerto (SL-MM), Oaxaca-Chiapas, México, del 12 de mayo 2005 al 16 de febrero 2006 (excepto, noviembre 2005). Norte (N), oeste (O), especie (sp.), F. californiensis (F), L. vannamei (L), captura ribereña total para F (CF), captura ribereña total para L (CL). Los j meses para los que no se obtuvieron registros de captura en las i estaciones, están indicados con el símbolo (*)

Para el mismo rango de profundidad antes mencionado, el 12 de noviembre 2004 el CRIP-SC realizó en 22 estaciones georreferidas a lo largo del SL-MM (Fig. 1), la recolección de 5 Kg de sedimento. Todas las muestras se enviaron al Laboratorio de Sedimentología CRIP-SL y éstas fueron procesadas, utilizando tamices de malla cuadrada de la serie ASTM (del No 8 al No 230). Con base en la clasificación granulométrica de Folk (1969), los responsables analistas del CRIP-SL reportaron a lo largo del SL-MM, según el diámetro del grano: arenas (de 0.06 a 2 mm), lodos (de 0.002 a 0.06 mm) y mayormente, la mezcla de arenas y lodos (Tabla 2). Debido a procesos burocráticos de confidencialidad, resultó imposible adquirir los registros numéricos del peso para los sedimentos clasificados en las 22 estaciones de recolección (Fig. 1); y en su lugar, el CRIP-SC únicamente proporcionó una base de datos georreferida, con 22 registros cualitativos para la presencia observada de arenas (Ar), lodos (Lo) y arenas-lodos (ArLo) (Tabla 2).
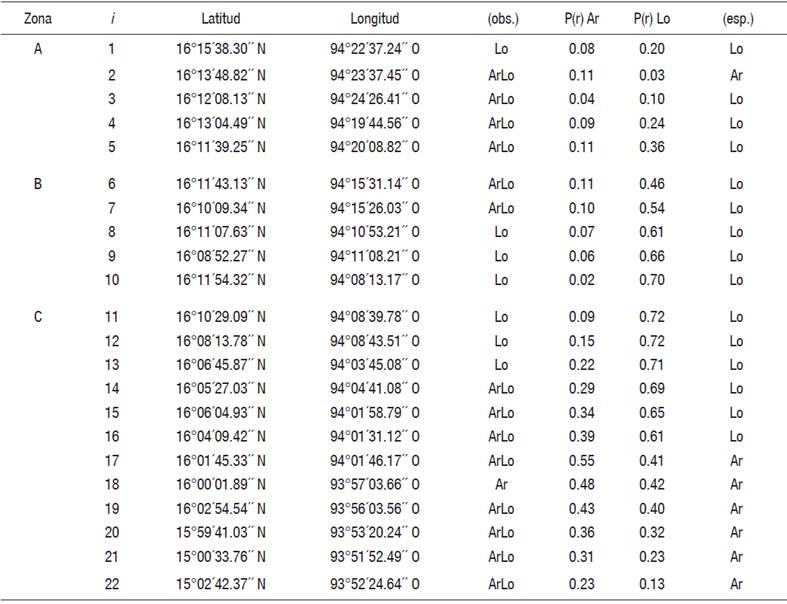
Tabla 2 Registros cualitativos observados (obs.) del tipo de sedimento en el SL-MM, con fecha del 12 de noviembre 2004. Norte (N), oeste (O), arenas (Ar), lodos (Lo) y arenas-lodos (ArLo). Para validar en la i estaciones la presencia esperada (esp.) de Ar y Lo, comparar la magnitud de los registros numéricos estimados para las probabilidades P (Ar) y P (Lo).
Tanto la captura ribereña de camarón, como los registros cualitativos del tipo de sedimento se analizaron en el Laboratorio de Sistemas de Información Geográfica de la Universidad del Mar, Puerto Ángel, Oaxaca, México. El análisis se realizó de la siguiente manera:
Análisis de la captura. La Tabla 1 corresponde a un arreglo matricial en donde para 16 estaciones georreferidas (i) y nueve fechas de muestreo (j ), se muestran en cada interacción (i, j ), los registros de la captura ribereña para F. californiensis (F) y L. vannamei (L). Para cada i, la información contenida en j se adicionó para estimar la captura total ribereña por especie (C) y con ello, se estructuraron las correspondientes matrices (CF ) y (CL) (Tabla 1). Para cada una de estas matrices, se estimaron la media ( ) y la varianza (S2); y posteriormente, ambos estimadores estadísticos se incluyeron por separado en la función probabilística Binomial Negativa (Ludwig & Reynolds, 1988). Con base en lo anterior y para cada población de camarón, se evaluó la pertinencia de la distribución ecológica agregada. Para validar lo anterior, se utilizó la función probabilística de ji-cuadrada (, grados de libertad N-3, N es el número total de registros de la captura ribereña, separada por especie de camarón) (Zar, 1999) y se infirió acerca de las siguientes hipótesis estadísticas:
Ho: S2 = Ȳ . Al interior del SL-MM, F. californiensis y/o L. vannamei evidenciaron una distribución ecológica aleatoria.
Ha: S2 > Ȳ. Al interior del SL-MM, F. californiensis y/o L. vannamei evidenciaron una distribución ecológica agregada.
Para los casos en los que la hipótesis Ha fuese rechazada, la validez estadística de la hipótesis Ho se corroboró con la función probabilística Poisson (Krebs, 1999), incluyendo por separado, los correspondientes valores de Ȳ y S2 de las matrices CF y CL.
Todos los registros mensuales de la captura ribereña para F. californiensis y L. vannamei (excepto los inscritos en las matrices CF y CL) (Tabla 1), se transformaron a valores probabilísticos de captura o P(c), cuyo rango de variación fue entre cero y uno. Para realizar la trasformación, se utilizó la función probabilística ligada a la hipótesis aceptada (Binomial Negativa o Poisson). La transformación fue necesaria para reducir el amplio rango de variación en los registros de la captura ribereña original (de uno a 233 kg para F. californiensis y de uno a 61 kg para L. vannamei) (Tabla 1); y para facilitar con ello, su posterior interpolación geográfica. Todo lo anterior, se realizó con el programa computacional, Microsoft Office Excel ® versión 2007.
Análisis del sedimento. La Tabla 2 corresponde a un arreglo matricial en donde para 22 estaciones georreferidas (i) y una fecha de muestreo (j), se muestran en cada interacción (i, j), los registros cualitativos del tipo de sedimento (Ar, Lo y ArLo). Debido a que no se pudo disponer de los registros numéricos del peso para los sedimentos clasificados en cada i, fue imposible validar la fracción dominante, especialmente en los casos para los que ArLo se reportó. Para resolver esto último y adicionalmente, para validar en cada i la presencia separada de Ar y Lo, se estructuró un modelo de clasificación cualitativa neuronal (MCN) (Haykin, 1999). Con base en lo anterior, fueron simulados registros numéricos de probabilidad esperada para la presencia de Ar y Lo; definidos aquí respectivamente, como P(Ar) y P(Lo) (Tabla 2). Finalmente, estos valores se utilizaron para subsanar a los registros numéricos del peso no proporcionados.
Para estructurar el MCN, se utilizaron como señales de entrada, todos los registros cualitativos del tipo de sedimento (Tabla 2) y mediante la implementación de tres capas de aprendizaje, fueron simulados para cada i dos resultados, estos fueron P(Ar) y P(Lo). Mediante la comparación de ambas magnitudes probabilísticas, se validó en cada i la presencia separada de Ar y Lo, seleccionando de entre éstas a la que resultó con mayor magnitud (Tabla 2); lo mismo se aplicó, en los casos para los que ArLo se reportó (Tabla 2).
Análisis geoestadístico. Para continuar con el análisis poblacional, se crearon dos raster de tipo valor-punto, el primero se asignó a F. californiensis (raster A) y el segundo, correspondió a L. vannamei (raster B). Cada uno de los raster fue dividido en nueve capas temáticas (las j fechas de muestreo) (Tabla1); y en cada una de éstas, se incluyó y asignó para cada i, el correspondiente valor estimado de P(c).
Para el caso específico de los sedimentos, se crearon dos raster de tipo valor-punto, el primero se definió como la capa temática Ar (raster C) y el segundo, como la capa temática Lo (raster D). En cada uno de éstos, se incluyó y asignó para cada i, las respectivas probabilidades esperadas de P(Ar) o P(Lo) (Tabla 2). Todo lo anterior se realizó con el programa computacional Integrated Land and Water Information System ® versión 3.3. (ILWIS por sus siglas en inglés).
Se utilizó la técnica de "Promedio Móvil" para simular y completar en los raster A, B, C y D, la información espacial no incluida entre las i estaciones georreferidas. De acuerdo con Uriel (1995), el promedio móvil aplicado a cada capa temática (entradas), generó para cada una de éstas, un raster interpolado de medias ponderadas (salidas). En ILWIS, la media ponderada fue estimada con:
Donde:
R es el raster de salida de medias ponderadas para la capa temática j,
C son los n registros temáticos j que fueron inscritos en cada i estación,
W es el peso estimado de los n registros temáticos j en cada i estación,
D es la distancia inversa Euclidiana entre los n registros temáticos j en cada i, estación, para realizar el interpolado por el vecino ponderado.
Las nueve capas temáticas interpoladas incluidas en los raster A y B, se introdujeron separadamente al ILWIS, para aplicar la técnica de análisis de componentes principales (ACP) (Hair et al., 1999). Con el ACP, se obtuvieron nueve imágenes regionalizadas de P(c) para F. californiensis y L. vanname (componentes principales), pero sólo una de éstas fue seleccionada para representar en cada caso, la regionalización final de P(c). La selección de los componentes principales más significativos, estuvo en función del eigen-valor que cada uno de éstos generó. Hair et al. (1999) indicó que los eigen-valores más significativos deben ser ≥ 1.0.
Los dos componentes principales así seleccionados, se utilizaron para representar cartográficamente, al interior del SL-MM, la distribución ecológica de F. californiensis y L. vannamei. Con los resultados de la regionalización, se localizaron y delimitaron geográficamente, las zonas lagunares que persistentemente, entre el 12 de mayo 2005 y el 16 de febrero 2006, presentaron mayores y menores valores de P(c). Lo anterior se utilizó como una guía, para explicar la variación espacial en los niveles de la captura ribereña de F. californiensis y L. vannamei.
Las capas temáticas interpoladas correspondientes a los raster C y D, se utilizaron directamente para representar cartográficamente (sin aplicar el ACP), al interior del SL-MM, la disposición geográfica del tipo de sedimento durante el 12 de noviembre 2004. El ACP no se aplicó, porque la información del tipo de sedimento fue obtenida para una única fecha de recolección.
Para describir la distribución ecológica de F. californiensis y L. vannamei, con relación a la disposición geográfica de los sedimentos en el SL-MM; se tomó en cuenta en apego a Tapia-García et al. (2011), dividir el SL-MM en tres zonas (zona A, zona B y zona C) (Fig. 1). La zona "A" fue delimitada desde la franja costera interna (frente a las Pampas Rincón de Juárez y Culito de Mar) hasta la Isla Palizada (longitud aproximada 23.98 Km) (Fig. 1). La zona "B" fue delimitada entre el final de la Isla Palizada y el Arroyo La Línea (longitud aproximada 23.98 Km) (Fig. 1). La zona "C" fue delimitada desde El Arroyo La Línea hasta la Boca de Tonalá en Pampa Paredón (longitud aproximada14.01 Km) (Fig. 1).
Finalmente y a nivel del SL-MM (sin considerar zonas), se realizó un análisis de correlación múltiple entre los valores de CF, CL, P(Ar) y P(Lo) (Tablas 1 -2).
Resultados
Análisis de la captura. Para ambas poblaciones de camarón, la hipótesis Ha se aceptó; por lo que al interior del SL-MM, F. californiensis (Ȳ =5.12, S2 = 18.83, S2 > Ȳ, X2 =154.63, X2 0.05 = 23.68, P<0.05) y L. vannamei (Ȳ =3.95, S2 =10.70, S2 > Ȳ, X2 =24.00, X2 0.05 =23.68, P<0.05), evidenciaron tener una distribución ecológica agregada. Para ambos casos, la P(c) se estimó con la función probabilística Binomial Negativa.
Análisis del sedimento. Para los casos en los que ArLo se reportó, el MCN validó fracciones dominantes de P(Lo) en las estaciones 3, 4, 5, 6, 7, 14, 15, 16 (Tabla 2). Fracciones dominantes de P(Ar) se validaron en las estaciones 2, 17, 19, 20, 21, 22 (Tabla 2). Por separado, P(Ar) se validó en la estación 18 y P(Lo), en las estaciones 1, 8, 9, 10, 11, 12 y 13 (Tabla 2).
Análisis geoestadístico (primera parte). Del ACP, fueron seleccionados los dos primeros componentes principales, cuyos eigen-valores fueron de 7.45 para F. californiensis (82.77% de varianza explicada) y de 7.33 para L. vannamei (81.44% de varianza explicada).
Al este de la zona B, F. californiensis evidenció un núcleo de agregación con variaciones de P(c) entre 0.4 y 0.9, que descendió gradualmente dentro de la misma zona, hacia los lados este y oeste (Fig. 2). Al centro de la zona B, L. vannamei evidenció un núcleo de agregación con variaciones de P(c) entre 0.3 y 0.6, que descendió gradualmente dentro de la misma zona, hacia los lados este y oeste (Fig. 3). Al interior de la zona B, las poblaciones de F. californiensis y L. vannamei, se evidenciaron geográficamente segregadas (Figs. 2 -3), con un traslape sutil a nivel de la Isla Puntachal (Figs. 1, 2, 3).
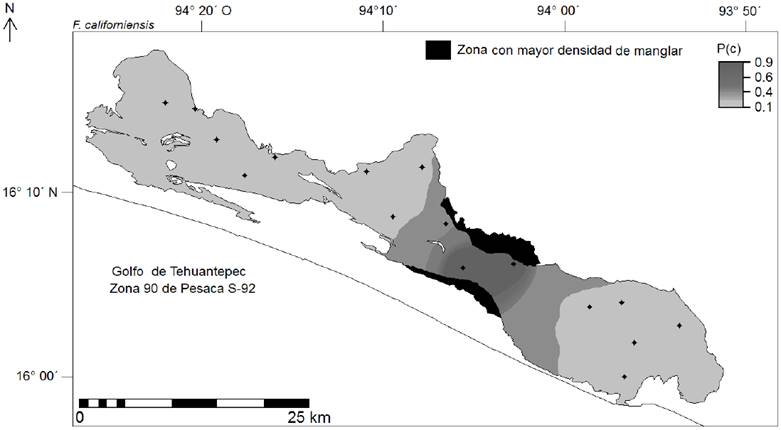
Figura 2 Cartográfica regionalizada para la probabilidad de captura P(c) de F. californiensis en el Sistema Lagunar Mar Muerto (SL-MM). Los puntos negros corresponden a las estaciones de muestreos para la captura ribereña de camarón.

Figura 3 Cartográfica regionalizada para la probabilidad de captura P(c) de L. vannamei en el (SL-MM). Los puntos negros corresponden a las estaciones de muestreos para la captura ribereña de camarón.
Análisis geoestadístico (segunda parte). La mezcla de arenas y lodos estuvo presente a lo largo de todo del SL-MM, pero con el MCN se evidenciaron variaciones en sus fracciones componentes (Figs. 4-5). Las arenas fueron dominantes en la mayor parte de la zona C (Fig. 4), reduciendo gradualmente su dominancia con dirección hacia la zona A y mostrando valores intermedios de P(Ar), hacia la mitad de la zona B (Fig. 4). Los lodos fueron dominantes en toda la zona B (Fig. 5), reduciendo su dominancia gradualmente con dirección hacia la zona C y mostrando valores intermedios de P(Lo) en toda la zona A (Fig. 5).
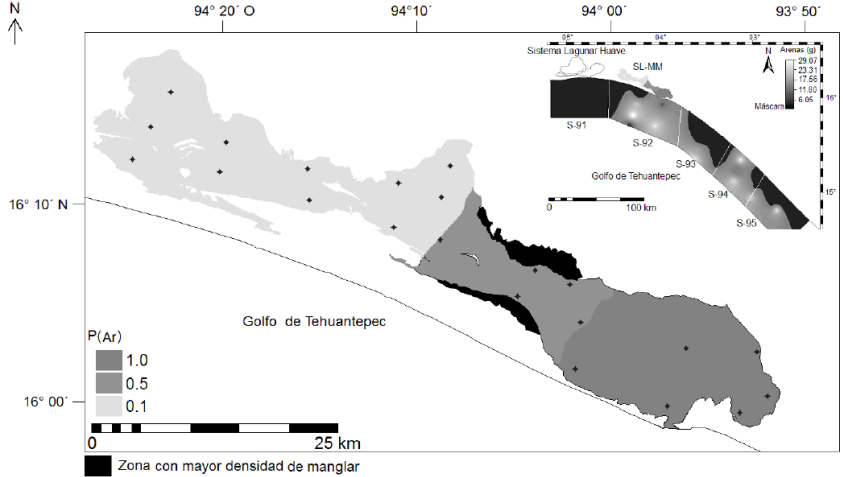
Figura 4 Cartografía para la disposición geográfica de la probabilidad esperada de arenas o P(Ar) en el (SL-MM). Los puntos negros corresponden a las estaciones de recolección para los sedimentos. Cuadro superior derecho, cartográfica regionalizada para la disposición geográfica de las arena en la zona marina 90 de pesca, Golfo de Tehuantepec (Cervantes-Hernández & Egremy-Valdez, 2013). Para este caso, la máscara negra representa a las secciones marino/costeros sin presencia de arenas.

Figura 5 Cartografía para la disposición geográfica de la probabilidad esperada de lodos o P(Lo) en el (SL-MM). Los puntos negros corresponden a las estaciones de recolección para los sedimentos.
Los mayores niveles de la captura ribereña de camarón están localizados en la zona B (e.g.: 113 kg para F. californiensis y 36 Kg para L. vannamei), donde los lodos fueron dominantes (Figs. 2, 3, 4, 5). Estos niveles fueron de menor magnitud en la sección limítrofe entre las zonas B y C (e.g: 80 kg para F. californiensis y 42 Kg para L. vannamei), donde se localizó la transición de arenas y lodos, pero con dominancia de las primeras (Figs. 2- 5). Para el resto de la zona C y toda la zona A, se registraron los menores niveles de la captura ribereña de camarón (Figs. 2-5). Como en la zona B, en la zona A se registró que P(Lo) > P(Ar), pero en ésta última, no se registraron altos niveles de la captura ribereña de camarón.
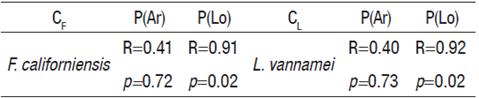
Se estimaron correlaciones directas pero no significativas entre CF, CL y P(Ar) (Tabla 3); pero en presencia de P(Lo), las correlaciones fueron directas y significativa con respecto a CF y CL (Tabla 3).
Discusión
En la zona B del SL-MM, las poblaciones de F. californiensis y L. vannamei evidenciaron tener una distribución ecológica agregada bien definida (Figs. 2-3), pero geográficamente segregadas, con un traslape sutil a nivel de la Isla Puntachal (Fig. 1). Reportes similares para la segregación poblacional están documentados en la Laguna de Términos, Campeche, México (Gracia & Soto, 1990); donde F. duorarum (Burkenroad, 1939) es dominante al noreste, con proximidad a la Boca de Puerto Real, en la que la influencia marina del Golfo de México es mayor. Bajo una mayor influencia de descarga fluvial de los ríos Palizada y Chumpán, L. setiferus (Linnaeus, 1767) es dominante al suroeste de esta laguna.
Otro caso similar fue registrado en la Laguna Mecoacán-Paraíso, Tabasco, México (Valencia et. al., 2003), donde F. aztecus (Ives, 1891) es dominante al centro lagunar, con proximidad a la Barra de Dos Bocas, en la que la influencia marina del Golfo de México es mayor. Bajo una mayor influencia de descarga fluvial del Río Arrastrero (en El Pajal), L. setiferus exhibió la mayor abundancia.
Para explicar la segregación geográfica en las poblaciones de F. californiensis y L. vannamei (Figs. 2-3), en primera instancia e independientemente de los resultados obtenidos con relación a la disposición de los sedimentos (Figs. 2-5), se consideró la capacidad de resistencia a la S por parte de ambas especies de camarón.
F. californiensis es una especie estenohalina (Arreola-Lizárraga et al., 2004); por esta razón y en apego al ACP (Fig. 2), esta población al este de la zona B, se mantuvo persistentemente agregada, próxima a la Boca de Tonalá, en la que la influencia marina del Golfo de Tehuantepec es mayor. L. vannamei es una especie eurihalina (Gracia, 1992); por esta razón y en apego al ACP (Fig. 3), esta población al centro de la zona B, se mantuvo persistentemente agregada, próxima a la influencia de los ríos San Miguel, Novillero, Berejonal y Guadalupe (Fig. 1).
Mediante una serie de muestreos realizados entre 1991 y 1993, Tapia-García et al. (2011) reportaron tres sistemas hidrológicos persistentes al interior del SL-MM (las denominadas zonas A, B y C) (Fig. 1). Con base en el análisis estacional de la TSA y la S, tales autores identificaron, describieron y delimitaron a cada de estas zonas. En la zona A, fueron registradas variaciones extremas en la TSA y la S (aunque sin valores reportados). Por otra parte y debido a su proximidad con la Boca de Tonalá (Fig. 1), la zona C recibe directamente la influencia marina del Golfo de Tehuantepec y en ésta, se documentaros menores variaciones en la TSA y la S (aunque sin valores reportados). La red fluvial de mayor importancia, se localiza e incide directamente en la sección media de la zona B, en donde fueron descritas variaciones estacionales para la TSA y la S (aunque sin valores reportados).
Un segundo análisis hidrológico para el SL-MM fue documentado por Castrejón-Rodríguez (2014), para el que la TSA y la S fueron regionalizadas vía ACP, entre septiembre 2001 y marzo 2002. Este autor documentó consistentemente con Tapia-García et al. (2011), la presencia de los tres sistemas hidrológicos antes mencionados. En la zona A, se registraron variaciones extremas en la TSA (de 23 a 34°C) y en la S (entre 12 y 44 UPS). Serrano-Guzmán et al. (2004) indicó que durante la mayor parte del año, la zona A permanece frecuentemente con bajos niveles de agua, porque ahí persistentemente, se registran altas tasas de evaporación y poca entrada de descarga fluvial. Por otra parte, en la zona C se registraron valores persistentemente estables de TSA (33°C) y S de (38 UPS). Registros intermedios para éstas últimas, se documentaron en la zona B (32°C y entre 34 y 35 UPS).
Para el ambiente marino, está bien documentado que los camarones pertenecientes a los géneros Farfantepenaeus y Litopenaeus (Kensley, 1997), presentan hábitos conductuales preferenciales para habitar sobre (Boddeke, 1983) y dentro (Williams, 1958) de sedimentos limo-lodo-arcilloso y lodoso (Burkenroad, 1939; Gunter, 1950; Springer & Bullis, 1954; Fuss & Ogren, 1966; Grady, 1971; Fotheringham & Weissberg, 1979; Regnault, 1979; Dall & Smith, 1986; Arreola-Lizárraga et al., 2004; Cervantes-Hernández & Egremy-Valdez, 2013). Tal y como en el ambiente marino, en sistemas lagunares, ambos géneros de camarón han sido registrados con los mismos hábitos conductuales preferenciales para habitar en sedimentos limo-lodo-arcilloso y lodoso (Zimmerman & Minello, 1984; Gracia & Soto, 1990; Valencia et. al., 2003).
Los hábitos conductuales antes señalados en sistemas lagunares, se evidenciaron con las mismas tendencias en la zona B del SL-MM, en donde los mayores niveles de la captura ribereña de camarón, se evidenciaron en sedimentos cuya fracción dominante fueron los lodos (Figs. 2-5). Esta zona se identificó como la más idónea en la que las poblaciones de F. californiensis y L. vannamei pudieran habitar, porque ahí coinciden la mayor red fluvial, los sedimentos lodosos y las variaciones hidrológicas estacionales en la TSA y la S (Tapia-García et al., 2011; Castrejón-Rodríguez, 2014).
Aunque en la zona C son persistentemente estables las variaciones hidrológicas en la TSA y la S (Tapia-García et al. 2011; Castrejón-Rodríguez, 2014), la captura ribereña de camarón tuvo los menores niveles; y esto fue explicado exclusivamente, por la presencia de sedimentos, cuya fracción dominante fueron las arenas (Figs. 2-5). Con los resultados de correlación obtenidos entre CF, CL y P(Ar) (Tabla 3), se demostró preliminarmente, que ambas especies de camarón, no presentan hábitos conductuales preferenciales para habitar en sedimentos cuya fracción dominante fueron las arenas.
Para la zona marina 90 de pesca del GT, particularmente en las sub-zonas S-92 y S-94 (Fig. 4), los sedimentos marino/costeros poseen una fracción dominante de arenas; y en el caso de la S-92, donde el SL-MM se localiza (Fig. 1), las arenas tienen un alto nivel de penetración costera (Cervantes-Hernández & Egremy-Valdez, 2013). Ésto es una de las causas por las que en la zona C del SL-MM, las arenas ingresan persistentemente a través de la Boca de Tonalá (Fig. 1) y mediante la acción mareal; se configura según Tapia-García et al. (2011), un delta arenoso con movimientos estacionales.
A pesar de que en la zona A se registraron sedimentos lodosos dominantes (Fig. 5), no se visualizaron niveles importantes de P(c) para ambas especies de camarón (Figs. 2-5); porque ahí, ocurren variaciones extremas hidrológicas en la TSA y la S (Tapia-García et al. 2011; Castrejón-Rodríguez, 2014).
Un caso similar al documentado en la zona A del SL-MM, se registró en el Mar Tileme del SL-H, donde se registró la escasez del recurso camarón entre 1999 y 2007 (Cervantes-Hernández et al., 2012a). En esta sección lagunar, son persistentes valores altos en la TSA (entre 29.2 y 30ºC), la S (de 44 a 54.7 UPS) y el oxígeno disuelto (entre 5.0 y 6.7 mg/l). Bajo estas condiciones hidrológicas, la hipoxia se prolonga por largos periodos de tiempo, reduciendo la capacidad de supervivencia de F. californiensis y L. vannamei. Esto se confirmó indirectamente con la estimación de una tasa de mortalidad natural de 0.82 mensual, exclusiva para el Mar Tileme.
Aunque para el SL-MM no están documentadas las variaciones del oxigeno disuelto en las tres zonas, se tiene conocimiento, mediante experimentos de laboratorio, que la muerte L. setiferus ocurre en exposiciones prolongadas de hipoxia entre 15 y 35 UPS (Rosas et al., 1999). Sánchez et al. (1991) demostraron que a bajos niveles de hipoxia, L. setiferus culminó en la muerte, siempre que la S se incrementó > 35 UPS. Para que la hipoxia ocurra en el SL-MM, se necesita una combinación hidrológica extrema de alta TSA y S; lo que según Castrejón-Rodríguez (2014) y Serrano-Guzmán et al. (2004), ocurre con frecuencia en la zona A.
La especie de camarón con la que comúnmente se trabaja en proyectos acuícolas es L. vannamei (Anónimo, 2009) y para su cultivo, se reportan óptimos para la temperatura del agua entre 25 a 30°C (Talavera et al., 1997; Zweig et al., 1999) y para la S entre 25 y 30 UPS (Páez-Osuna & Ruiz-Fernández, 2001; Van Wyk et al., 1999). Para el SL-MM, las características hidrológicas más cercanas a los óptimos de cultivo señalados, se localizan en la zona B (Castrejón-Rodríguez, 2014), pero que debido a la dinámica geológica del sistema lagunar y a la variación hidrológica estacional en la TSA y la S, el cultivo de L. vannamei parece ser viable únicamente de manera artesanal, desarrollado en jaulas rústicas y por periodos breves de tiempo. Adicionalmente, la infraestructura que hasta ahora está documentada para el SL-MM, es apenas la mínima necesaria (e.g.: líneas de transmisión eléctrica, vías de transporte entre otras), por lo que el desarrollo extenso de la acuicultura es incierto y seguramente se agudiza aún más, por el problema social de "Usos y Costumbres".
La dinámica geológica del SL-MM, consiste en un sistema de barreras naturales que estrechan y obstruyen la comunicación entre las zonas, manteniendo estacionalmente las características sedimentologías (Figs. 4-5) e hidrológicas antes descritas. Durante la estación de secas, en la zona C se forma y modifica gradualmente un delta arenoso (Tapia-García et al., 2011), que labra canales con diferentes magnitudes de profundidad, los centrales son profundos (> 5 m) y los periféricos, no exceden el metro de profundidad. Debido a la constante entrada de las arenas desde la sub-zona S-92 hacia la zona C (Fig. 4), la Boca de Tonalá se mantiene permanentemente abierta (con profundidad estable > 5 m), permitiendo la constante influencia marina del GT: pero sin alcanzar a influir hasta la zona B, debido al taponeo progresivo de arenas que se forma a nivel de la Isla Puntachal (Fig. 1). Ésta última y la Isla Palizada (Fig. 1), funcionan como tapones que gradualmente al cúmulo de sedimentos, impiden el libre flujo de agua marina entre las zonas. Un cambio total de todo lo anterior ocurre durante la estación de lluvias, permitiendo el tránsito de camarones entre las distintas zonas del SL-MM (Castrejón-Rodríguez, 2014), debido al flujo de agua marina (Tapia-García et al., 2011). Por otra parte, estacionalmente la zona A se registra como la más somera, teniendo en promedio máximo 1 m de profundidad, seguida de la B con un máximo de 5 m (Tapia-García et al., 2011).
Otros aspectos a considerar para explicar la segregación geográfica en las poblaciones de F. californiensis y L. vannamei (Figs. 2-3) dentro del SL-MM, tienen relación con el desarrollo de sus temporadas de reproducción y reclutamiento. En la zona marina 90 del GT, ambas especies de camarón se reproducen y reclutan todo el año, pero los máximos de abundancia para reproductores y reclutas no ocurren al mismo tiempo en ambas poblaciones. La reproducción y el reclutamiento de L. vannamei es en agosto/septiembre y junio/julio, respectivamente (Cervantes-Hernández et al., 2008a; 2012b). Para F. californiensis, éstas ocurren en octubre/noviembre y agosto/septiembre, respectivamente (Cervantes-Hernández, 2008). En el Golfo de Tehuantepec, el reclutamiento es del tipo lagunar (RL) o marino (RM). Durante las temporadas de reproducción ocurre el RL, que es el movimiento natural de postlarvas de camarón desde la zona marina 90 de pesca, hacia el interior de los sistemas lagunares. Durante las temporadas de reclutamiento ocurre el RM, que es el movimiento natural de camarones juveniles desde el interior de los sistemas lagunares, hacia la zona marina 90 de pesca (Cervantes-Hernández et al., 2012b).
Para el periodo analizado, que fue del 12 de mayo 2005 al 16 de febrero 2006, se encontró que el RM de L. vannamei finalizaba (Cervantes-Hernández et al., 2008a; 2012b); mientras que, el RL de F. californiensis comenzaba (Cervantes-Hernández, 2008). Por esta razón al interior del SL-MM, se observó que la P(c) estimada para L. vannamei resultó de menor magnitud (entre 0.1 y 0.6), con respecto a la estimada para F. californiensis (entre 0.1 y 0.9) (Figs. 2-5). Al conjuntar y analizar ambos tipos de reclutamiento, se concluye que año con año las postlarvas de L. vannamei ingresarán primero y progresivamente al SL-MM, hasta alcanzar su máxima agregación ecológica y que esto último se reducirá gradualmente mientras transcurren los meses (RM), al tiempo que F. californiensis avanzará progresivamente hacia su máxima agregación ecológica (RL). Durante el desarrollo de ambos tipos de reclutamiento, estas poblaciones de camarón se mantienen temporal y espacialmente segregadas en la misma área geográfica preferencial (la zona B) (Figs. 2-3), al tiempo que optimizan las condiciones hidrológicas imperantes. Con base en lo anterior, se sugiere que al interior del SL-MM, la disposición geográfica de los sedimentos, no es la única variable ambiental que influye sobre de la distribución ecológica de los camarones F. californiensis y L. vannamei; sino que otros factores hidrológicos (Ruello, 1973; Penn & Caputi, 1986; Gillanders et al., 2003; Cervantes-Hernández et al., 2010; 2012), condicionan el resultado la distribución ecológica, al trascurrir el RM y el RL.











 nueva página del texto (beta)
nueva página del texto (beta)