Introducción
Debido a que los sistemas acuáticos epicontinentales (principalmente lagos, ríos y presas) cubren una pequeña fracción de la superficie de la Tierra, no se habían considerado como componentes potencialmente importantes en el ciclo del carbono tanto a escala regional como global; sin embargo, recientemente Cole et al. (2007) mostraron que estos ecosistemas acuáticos constituyen un componente importante tanto en el ciclo global como regional del carbono. Dentro de este contexto, la fracción fitoplanctónica es la que más contribuye con la tasa de fijación del carbono, al realizar el proceso fotosintético dentro de los sistemas acuáticos (Reynolds, 2006).
Se han utilizado muchos conceptos en la literatura para describir los índices de producción primaria (PP) y respiración (R) a nivel ecosistema. La producción primaria bruta (PPB) se define como la transformación autotrófica total del carbono inorgánico a formas de carbono orgánico, sin importar cual sea su destino. La respiración en el ecosistema (R) es la oxidación total de carbono orgánico a carbono inorgánico tanto por organismos heterótrofos como autotróficos (Cole et al., 2000; Lovett et al., 2006).
Los sistemas acuáticos donde la fotosíntesis supera la respiración total del plancton (P > R) son completamente autotróficos y actúan como productores de oxígeno y materia orgánica considerándose sumideros de CO2. Por el contrario, los ecosistemas acuáticos donde la respiración excede a la fotosíntesis (P < R) son heterótrofos netos y como resultado de ser consumidores de carbono orgánico, emiten CO2 a la atmósfera (Carignan et al., 2000).
En una escala global la relación PPB:R y la producción primaria neta (PPN) ayudan a comprender mejor el ciclo del carbono a nivel mundial y explicar el papel de estos ecosistemas como fuentes o sumideros de CO2 atmosférico (Del Giorgio & Duarte, 2002).
La variación de la PP y la R depende de diversos factores a diferentes escalas. Existe una variación en la PPB y la PPN en respuesta a ciclos diurnos de luz, ya que la mayoría del fitoplancton no vive más de un día; sin embargo, las variaciones mensuales, estacionales y anuales pueden mostrar cambios en la estructura del sistema y la actividad de diferentes grupos del fitoplancton (Smith & Hollibaugh, 1997). Por otro lado, el enriquecimiento en nutrientes puede provocar que un lago pase de ser netamente heterótrofo a ser autotrófico favoreciendo más la PPB que la R; no obstante, si lo que ingresa es materia orgánica disuelta la R aumenta y la PPB puede reducirse por la atenuación de la luz en el agua (Del Giorgio & Duarte, 2002; Ask et al., 2009).
La mayor parte de las investigaciones sobre la PP y R en sistemas acuáticos se han hecho en latitudes templadas (79%), con mucho menos estudios en subtropicales (10%), tropicales (8%) y árticos (3%) (Staehr et al., 2012a). Dentro de los trabajos realizados en ambientes tropicales son aún menos los realizados en lagos profundos y oligotróficos (p.ej., Carignan et al., 2000; Staehr et al., 2012b). Por lo anterior, el objetivo del presente trabajo fue evaluar la variación de la PPB, PPN y R en el lago Alchichica para establecer el papel que juegan los lagos oligotróficos y profundos de regiones tropicales, como fuentes o sumideros de CO2. Lo anterior permitirá entender mejor las dinámicas regionales para lagos equivalentes en latitudes tropicales.
Materiales y métodos
Área de Estudio. El lago Alchichica es un lago tropical que se encuentra a los 19° 24' N, 97° 24' 0 y 2,350 m s.n.m. en la Cuenca Oriental (Alcocer et al., 2000). Presenta una forma semicircular con una profundidad máxima de 62 m y media de 40.9 m y el volumen de agua que almacena es de 94,214,080 m3 (Filonov et al., 2006). El abastecimiento principal de la cuenca lacustre es subterránea. Es un lago básico (pH 8.7-9.2) e hiposalino (8.5 g L-1), siendo los iones dominantes el sodio y el cloruro, aunque también son importantes los bicarbonatos y los carbonatos (Vilaclara et al., 1993; Alcocer et al., 2000).
El lago Alchichica es monomíctico cálido, con un periodo de circulación invernal y uno de estratificación el resto del año. La época de mezcla se presenta a fines de diciembre o inicios de enero y culmina a finales de marzo o principios de abril (Alcocer et al., 2000). El periodo de estratificación se caracteriza por el desarrollo de un hipolimnion anóxico (Alcocer et al., 2008). La zona eufótica varía entre 13 y 38 m, profundizándose a medida que avanza la época de estratificación (Oliva et al., 2001). Es oligotrófico (clorofila a ≤ 5 μg L-1) y a diferencia de la mayoría de los cuerpos acuáticos con el mismo estado trófico, la talla dominante de fitoplancton es la grande (> 2 μm) (Adame et al., 2008). Se presentan dos florecimientos de fitoplancton: uno de diatomeas durante la época de mezcla y otro de cianobacterias a principios de la estratificación (Oliva et al., 2001).
Trabajo de Campo. Se realizaron muestreos mensuales de enero a diciembre de 2011 en la parte central y más profunda del lago. Se midieron perfiles in situ metro a metro de temperatura y oxígeno disuelto con una sonda multiparamétrica de calidad del agua marca Hydrolab modelo DS5 y SVR4. Asimismo se obtuvieron perfiles de radiación fotosintética activa (PAR, por sus siglas en inglés) y fluorescencia natural de la clorofila "a" con un perfilador de fluorescencia natural marca Biospherical modelo PNF-300. Con la ayuda de una estación meteorológica marca Davis modelo Vantage Pro2 ubicada en la orilla del lago se cuantificó la cantidad de luz recibida (400-1100 nm) durante todo el periodo que duró cada incubación.
Con base en las variables medidas in situ (i.e., temperatura, oxígeno disuelto, radiación fotosintética activa (PAR) y fluorescencia natural de la clorofila "a") justo previo a cada experimento, se seleccionaron mes con mes entre 6 y 9 profundidades para medir las tasas de PP y R siguiendo el método de las botellas claras y oscuras que miden las tasas de cambio en la concentración del oxígeno disuelto (Vollenweider et al., 1974; Wetzel & Likens, 2000).
Se montó un anclaje con las profundidades (Fig. 2) previamente elegidas dependiendo de la heterogeneidad fisicoquímica y biológica de la columna de agua (i.e., termoclina, oxiclina, PAR y fluorescencia natural de la clorofila "a"). Se tomó una muestra de agua correspondientes a cada una de las profundidades y se llenaron dos botellas claras y dos oscuras teniendo cuidado de no generar burbujas y evitar el contacto con la atmósfera. A cada una de la botellas se les midió la concentración de oxígeno disuelto inicial con una oxímetro marca HACH modelo HQ40d portátil con una sonda de oxígeno luminiscente LBOD10101. Las incubaciones se realizaron por ocho horas después de lo cual se recuperaron las botellas e inmediatamente se midió la concentración de oxígeno disuelto en éstas.
Tratamiento de datos. Las tasas de PPB, PPN y R fueron calculadas usando la variación en la concentración de oxígeno disuelto en las botellas claras y oscuras siguiendo la propuesta de Wetzel y Likens (2000). Para el cálculo de los valores de carbono se utilizaron los factores de conversión de 0.375 para la equivalencia entre los pesos moleculares de oxígeno y carbono y el de 1.2 para el coeficiente fotosintético según lo sugiere Wetzel (2001). Para calcular la tasa de PP por día se multiplicó la tasa de PP por hora por el cociente de las horas de luz entre las horas de incubación.
Con base en los valores de PPB, PPN y la R en cada una de las profundidades muestreadas, se hicieron las integraciones verticales respectivas para obtener los distintos procesos expresados por unidad de área. Las integraciones se realizaron hasta la base de la zona eufótica (ZEU, profundidad hasta la cual el PAR es suficiente para realizar la fotosíntesis) y que, para el caso particular del lago Alchichica, se determinó en el 0.1% del PAR superficial (González, 2013). Las integraciones se realizaron con el método de área baja la curva con la ayuda del paquete SigmaPlot v12. Para establecer si el lago Alchichica funciona como fuente o sumidero de CO2, se calculó la relación PPB:R de la integración de la zona eufótica como lo sugiere Cole et al. (2000).
Resultados
Caracterización ambiental. Tanto la radiación solar promedio como la integrada que incidió sobre la superficie del lago durante las incubaciones varió a lo largo del año. Durante enero es cuando se presentó la menor incidencia de luz (promedio = 293 W m-2, integrada = 2,346 Wh m-2) mientras que la cantidad mayor de luz promedio se registró en mayo (692 W m-2) e integrada en junio (6,739 Wh m-2). La cantidad de luz promedio fue mayor a la media (518 ± 115 W m-2) en los meses de febrero a junio. La luz integrada fue mayor a su promedio (4,666 ± 1,207 Wh m-2) de marzo a julio. Para ambos casos septiembre registró un valor mayor a la de la media (Fig. 1).
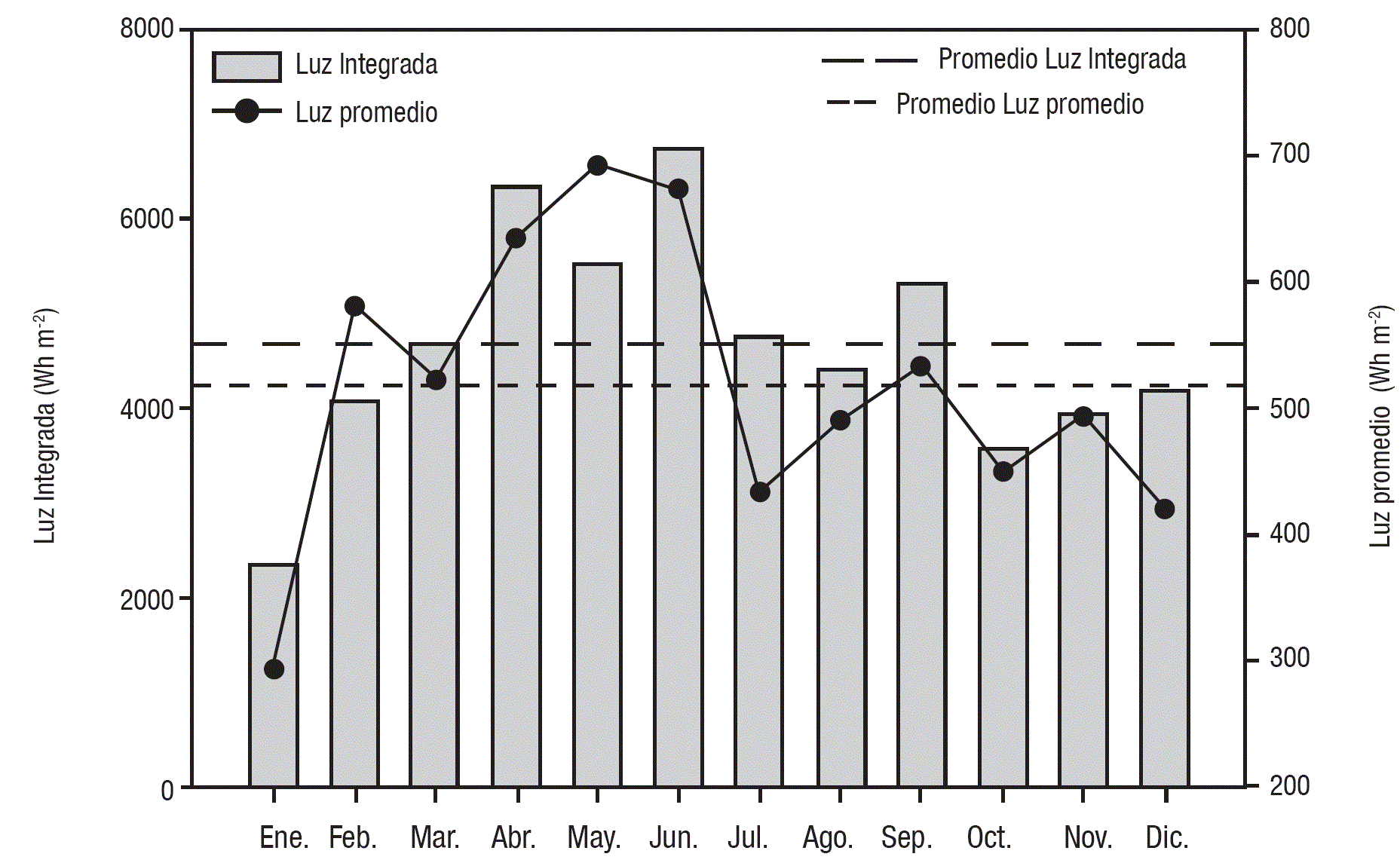
Figura 1 Variación temporal de la cantidad de luz (W m-2) y la luz integrada (Wh m-2) que incidió sobre la superficie del lago del lago Alchichica, Puebla, México, durante los periodos de incubación. Las líneas representan el promedio de la luz integrada (- -) y de la luz promedio (---).
El lago Alchichica mostró un comportamiento térmico correspondiente a la monomixis cálida con un periodo de circulación de enero a marzo y el de estratificación el resto del año (Fig. 2). Dentro del periodo de estratificación se reconocen tres etapas; a) estratificación temprana (abril a junio) cuando el perfil de temperatura muestra una termoclina incipiente, b) estratificación bien establecida (julio a septiembre), cuando la termoclina se encuentra bien desarrollada y c) estratificación tardía (octubre a diciembre) cuando la termoclina se angosta y profundiza. Este comportamiento en la hidrodinámica del lago es regular y predecible como ha sido reportado en otros trabajos (p.ej., Alcocer et al., 2000). La ZEU varió de los 22 m (enero) a los 39 m (septiembre) observándose dos épocas, la de aguas turbias, que corresponden al periodo de mezcla y la de aguas claras, que se presentan durante la estratificación (Fig. 2). Durante el periodo de aguas claras, se presenta una reducción de la ZEU en los meses de abril y mayo correspondiente al florecimiento de cianobacterias.
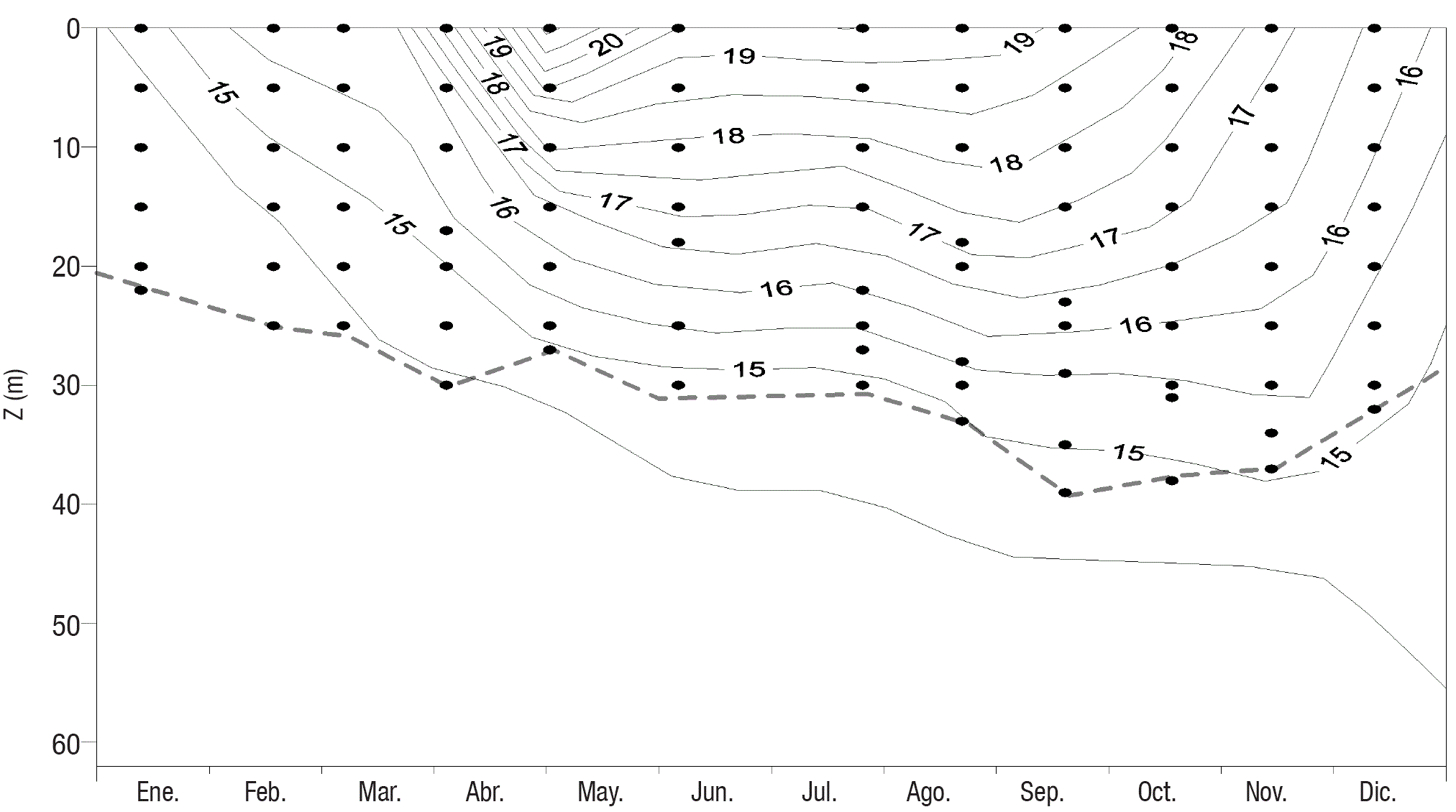
Figura 2 Diagrama pro fundidad-tiempo de isotermas (°C) en el Lago Alchichica, Puebla, México,. El límite de la Zona Eufótica se representa con la línea punteada y las profundidades de incubación con puntos.
PPB, PPN y R en el perfil vertical. La distribución vertical de PPB y PPN varió a lo largo del año, lo cual estuvo asociado a la hidrodinámica del lago. El promedio para la PPB y PPN fuede 110±86y15±143mg C m-3 d-1, respectivamente. Se encontraron cuatro meses (enero, mayo, octubre y diciembre) en los que tanto la PPB y la PPN tuvieron valores máximos en la columna de agua (Figs. 3 y 4).
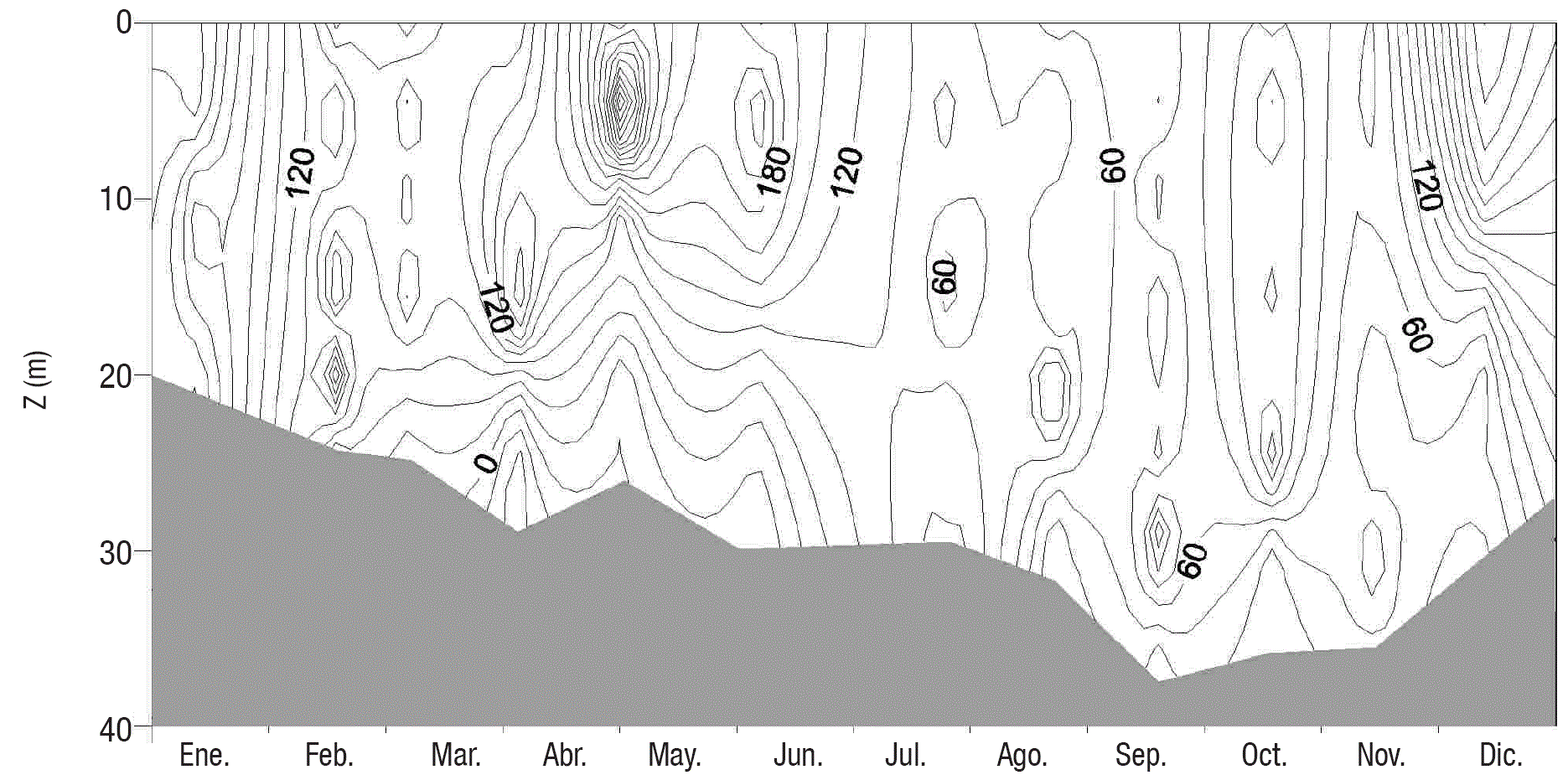
Figura 3 Diagrama profundidad-tiempo de la PPB (mg C m-3 d-1) en el Lago Alchichica, Puebla, México. La zona gris representa la zona afótica (< 0.1 % PAR).

Figura 4 Diagrama profundidad-tiempo de la PPN (mg C m-3 d-1) en el Lago Alchichica, Puebla, México. La zona gris representa la zona afótica (< 0.1 % PAR).
La mayor PPB en toda la ZEU se observó durante el periodo de circulación con valores por arriba del promedio global (160 - 277 mg C m-3 d-1) (Figs. 3 y 4). Durante la estratificación temprana la producción mayor se presentó en la capa de mezcla (ZMIX), presentándose a los 5 m las máximas PPB (488 mg C m-3 d-1) y PPN (304 mg C m-3 d-1) de todo el año. Sin embargo, no hubo PP en toda la ZEU, ya que por debajo de la ZMIX, a pesar de todavía haber luz, la PPB medida fue de 0 mg C m-3 d-1 (Figs. 3 y 4). En la estratificación bien establecida se encontró un tercer pico de PPB (160 mg C m-3 d-1), pero en esta ocasión se ubicó en el metalimnion (25 m), justo por debajo de la ZMIX, pero aún dentro del límite inferior de la ZEU (Figs. 3 y 4). El último pico de PPB (238 - 301 mg C m-3 d-1) se presentó en diciembre, en los primeros 20 m de la ZMIX y por arriba de la ZEU (Figs. 3 y 4).
Al igual que la PP, la R varió en la vertical a lo largo del año con un promedio general de 78 ± 75 mg C m-3 d-1. Durante la circulación se encontraron valores de 60 a 225 mg C m-3 d-1 en toda la ZEU (Fig. 5). Los máximos se encontraron a inicios y a finales de la estratificación con valores por arriba de los 200 mg C m-3 d-1 (Fig. 5). Durante los dos primeros meses de la época de circulación, la R ta mbién presentó valores por arriba de la media general a lo largo de la ZEU (Fig. 5).

Figura 5 Diagrama profundidad-tiempo de la R (mg C m-3 d-1) en el Lago Alchichica Puebla, México. La zona gris representa la zona afótica (< 0.1 % PAR).
PPB, PPN y R integradas. El promedio de la PPB y la PPN integradas por unidad de área fue de 2,915 ± 796 mg C m-2 d-1 y 842± 2,296 mg C m-2 d-1, respectivamente. La variación temporal de la PPB y la PPN presentaron cuatro picos bien definidos a lo largo del año (Fig. 6). El primer pico tanto para la PPB (3,496 mg C m-2 d-1) como para PPN (2,322 mg C m-2 d-1) se encontró a inicios de la época de circulación en el mes de enero (Fig. 6). En la estratificación temprana se observó el segundo pico para la PPB, en el mes de mayo (3,782 mg C m-2 d-1) y para la PPN en junio (2,758 mg C m-2 d-1). El tercer pico se presentó durante la estratificación bien establecida (octubre) con valores de 3,433 y 3,163 mg C m-2 d-1 para la PPB y PPN respectivamente. A finales de la época de estratificación e inicios de la circulación (diciembre), se registraron los valores máximos para la PPB (4,195 mg C m-2 d-1) y la PPN (2,592 mg C m-2 d-1) (Fig. 6). La PPN presentó valores negativos en los meses de febrero (-579 mg C m-2 d-1), abril (-2,914 mg C m-2 d-1) y noviembre (-4,100 mg C m-2 d-1) (Fig. 6).
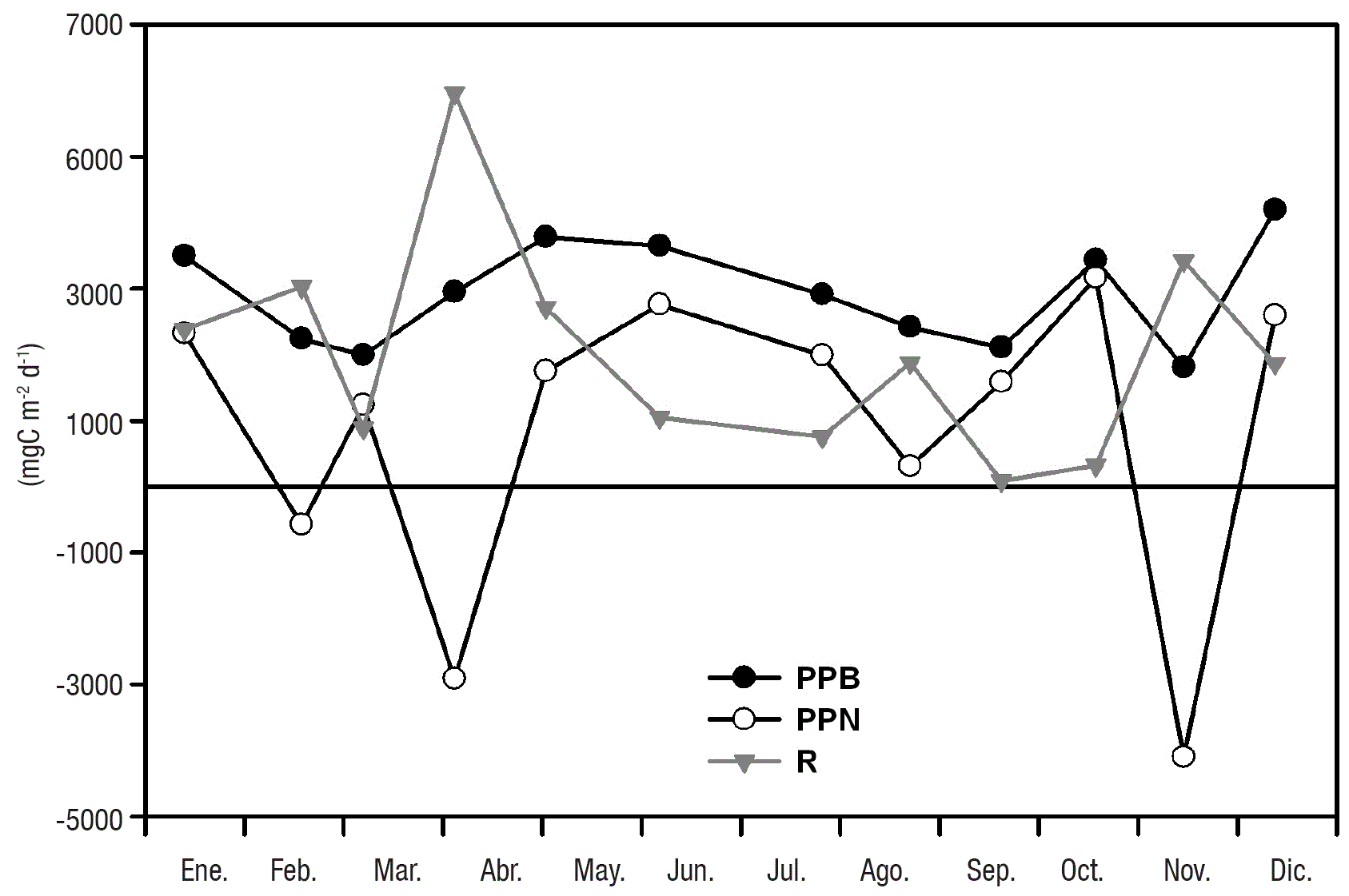
Figura 6 Variación temporal de la PPB, PPN y R integradas por unidad de área (mg C m-2 d-1) del lago Alchichica, Puebla, México. a lo largo del ciclo anual (2011).
El promedio de la R fue de 2,029 ± 1,642 mg C m-2 d-1 observándose tres picos a lo largo del periodo de muestreo, cuando la PPN presentó valores negativos (Fig. 6). El primero se presentó a mediados del periodo de circulación (febrero = 3,028 mg C m-2 d-1), mientras que en la transición de la mezcla y la estratificación se observó el segundo pico (abril = 5,996 mg C m-2 d-1) que duplicó el valor del registrado en la circulación y fue el mayor de todo el año. El tercer pico y segundo en magnitud (noviembre = 3,421 mg C m-2 d-1), se registró a finales de la época de estratificación (Fig. 6).
En cuanto a la relación PPB:R se obtuvo un promedio anual de 4.39 ± 6.84 sin observase un patrón temporal definido. Solo durante tres meses (febrero, abril y noviembre), el lago Alchichica se comportó como una fuente de CO2, el resto del año funcionó como sumidero (Tabla 1).
Discusión
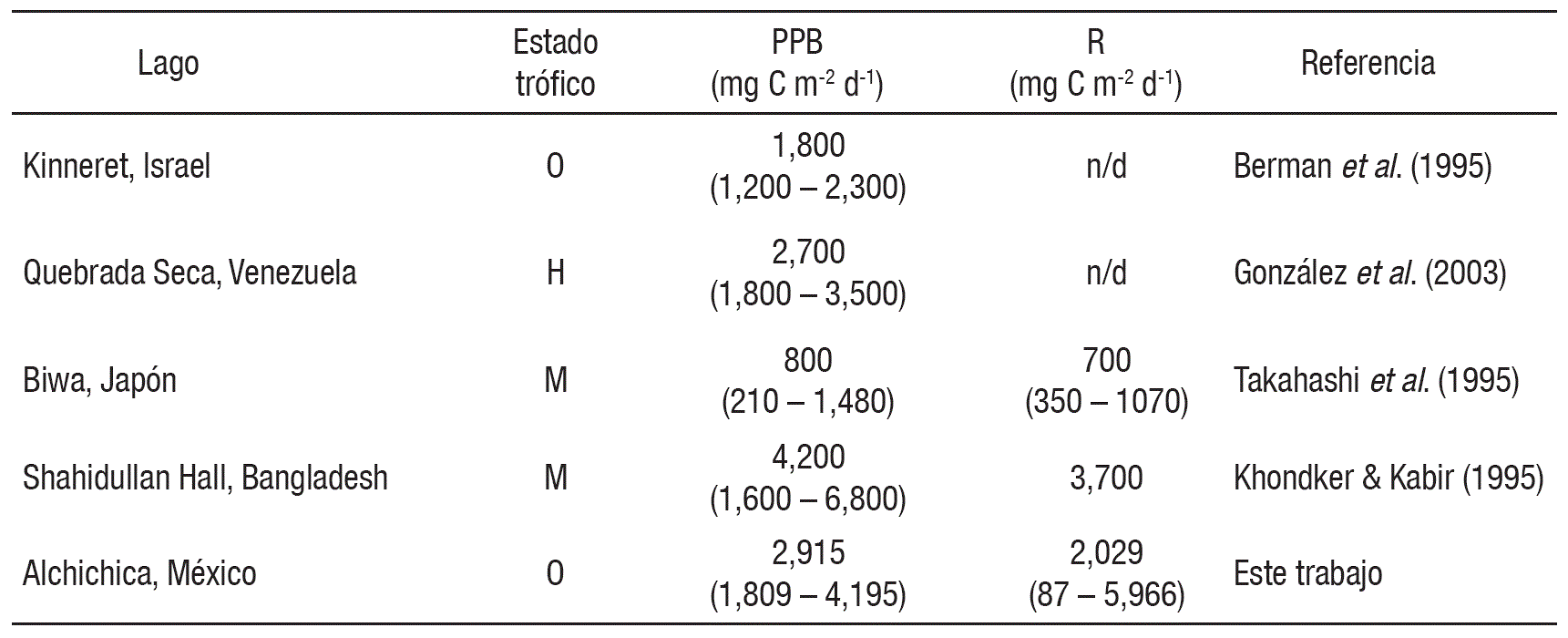
La tasa anual de la PP encontrada en el lago Alchichica fue de 1,049 g C m-2 año-1 la cual está en el primer quinto del rango (4 5,700 g C m-2 año-1) que menciona Kalff (2002) para los lagos en general. En la Tabla 2 se presentan los valores de PPB de algunos lagos tropicales y subtropicales con relación a los observados en el lago Alchichica. La PPB observada en el lago Alchichica es casi del doble a la encontrada para el lago Kinneret, Israel, con el cual comparte el mismo estado trófico y el mismo comportamiento de monomixis. Sin embargo, es muy similar a la PPB registrada en la Quebrada Seca, Venezuela, que se considera hipertrófico y que tiene un gran aporte de nutrientes alóctonos. El lago Alchichica no presenta una fuente de nutrientes alóctonos por lo que la PPB es de origen principalmente autóctono (Tabla 2). Por otro lado, Wetzel (2001) clasifica el estado trófico de los lagos con base a la PPN en la cual se consideraría al lago Alchichica (842 ± 2,296 mg C m-2 d-1) como mesotrófico (250 - 1,000 mg C m-2 d-1). A pesar que el lago Alchichica es un lago oligotrófico sus valores de R fueron mayores a los encontrados en el lago oligotrófico Biwa, Japón, pero menores a los encontrados en el lago mesotrófico Shahidullan Hall, Bangladesh.
Tabla 2 Producción primaria bruta (PPB) y respiración (R) en lagos tropicales y subtropicales con diferentes estados tróficos. O = Oligotrófico, M = Mesotrófico y H = Hipertrófico.
La variación temporal de la PP y la R en los lagos profundos, en general está influenciada por el patrón térmico, esto es, por los periodos de estratificación y circulación (Schallenberg & Burns, 2010), dado que estos periodos están relacionados con la disponibilidad de nutrientes y los florecimientos fitoplanctónicos.
En el lago Alchichica se observaron valores de PP integrados por unidad de área elevados a inicios de la época de mezcla y finales del periodo de estratificación cuando se ensancha la ZMIX, para dar paso al nuevo periodo de circulación (Figs. 3 y 6). Estos valores elevados están relacionados con la liberación de nutrientes remineralizados en el hipolimnion que inducen el desarrollo del florecimiento invernal de diatomeas. Durante esta época ni el nitrógeno ni el fósforo son limitantes de la PP (Ramos-Higuera et al., 2008), lo que favorece el florecimiento de diatomeas, siendo Cyclotella alchichicana Oliva, Lugo, Alcocer et Cantoral-Uriza (~ 50 μm) la especie que domina la biomasa fitoplanctónica (Oliva et al., 2001).
A inicios de la estratificación se observó un incremento en la PPB integrada por unidad de área. Éste se debe principalmente al desarrolló del florecimiento de Nodularia cf. spumigena Mertens ex Bornet et Flahault (Oliva et al., 2001, 2009). El florecimiento de una cianobacteria fijadora de nitrógeno se presenta comúnmente en los lagos tropicales oligotróficos profundos, cuando el nitrógeno en la zona de mezcla ya no está disponible y aún persiste algo de fósforo (Lewis, 2002). A diferencia del periodo de circulación donde la PPB se lleva a cabo de forma más o menos homogénea a lo largo de la columna de agua, la PPB asociadas al florecimiento de cianobacterias se ubica en los primeros metros de la columna de agua debido a que esta cianobacteria necesita fijar el nitrógeno atmosférico para su crecimiento y por eso genera aerotopos y mucílago que garantizan su presencia en la porción superior de la columna de agua.
El aumento de PPB integrada por unidad de área durante la estratificación bien establecida fue asociado con la presencia de un máximo profundo de clorofila (DCM por sus siglas en inglés), el cual se desarrolla en el metalimnion, justo en la base de la ZEU. El DCM está compuesto una vez más y principalmente por diatomeas grandes (C. alchichicana y Cyclotella choctawhatcheeana Prasad) las cuales aprovechan los nutrientes que se difunden del hipolimnion hacia el metalimnion inducido por la turbulencia generada por ondas internas. En el lago Alchichica las ondas internas alcanzan los 1.4 m de amplitud y un periodo de 3.1 horas (Filonov & Alcocer, 2002) y, como lo menciona Wetzel (2001), en los lagos profundos y estratificados las ondas internas son comúnmente el único mecanismo que puede aumentar el intercambio de nutrientes, los cuales quedan disponibles para el fitoplancton.
El pico de R encontrado en la época de mezcla se atribuye principalmente a la presencia de zooplancton. En el lago Alchichica existe un incremento de la abundancia del copépodo Leptodiaptomus garciai Osorio-Tafall, asociado al florecimiento de diatomeas durante el periodo de circulación (Lugo et al., 1999; Ortega-Mayagoitia et al., 2011). El pico observado a finales del periodo de estratificación se debe por una parte a la presencia de zooplancton (Del Giorgio & Peters, 1993; Del Giorgio & Williams, 2005) y por otra a la oxidación de materia orgánica procedente del hipolimnion. Se ha observado a L. garciai en la base del epilimnion y al rotífero Brachionus grupo plicatilis dentro del metalimnion (Ortega et al., 2011), justo donde se está desarrollando el DCM. Adicionalmente, una parte de la materia orgánica generada por el fitoplancton del DCM es oxidada en está capa antes de ser exportada hacia el fondo del lago.
Varios trabajos mencionan (p.ej., Cole et al., 1994; Duarte & Agusti, 1998) que muchos sistemas epicontinentales funcionan como fuentes de CO2. No obstante, el lago Alchichica funciona principalmente como sumidero de CO2 ya que tiene un comportamiento predominantemente autotrófico debido a que la PPB anual excede a la R (PPB:R = 4.39 ± 6.84) y, por lo tanto, la PPN anual es positiva. A diferencia de otros lagos, el lago Alchichica no recibe materia orgánica de la cuenca de drenaje y de acuerdo a Oseguera et al. (2011) el aporte aéreo de material alóctono es muy reducido.
De los tres meses que dura el periodo de circulación en el lago Alchichica, solo febrero se comportó como fuente de CO2 ya que la R fue mayor que la PPB, fenómeno derivado de la ocurrencia de una gran abundancia de los consumidores primarios (i.e., zooplancton) asociados con el florecimiento de diatomeas. Los copépodos pueden consumir a estas diatomeas solo cuando ellas están en pleno periodo reproductivo asexual y por ello su talla disminuye.
Asimismo, durante la transición entre la época de circulación y la estratificación (inicios de abril), la R fue mayor a la PPB. Ha sido mencionado que justo en este lapso la biomasa fitoplanctónica disminuye y está dominada por especies de talla pequeña (Adame et al., 2008) por lo que la ruta principal que sigue el carbono es más bien la remineralización en la columna de agua a través del circuito microbiano (Legendre, 1999). Por lo anterior, el sistema se torna heterótrofo y por lo tanto funciona como fuente de CO2.
A finales de la estratificación, la R vuelve a ser mayor que la PPB lo cual se debe, una vez más, a la elevada respiración de los heterótrofos que están aprovechando la disponibilidad de alimento (p.ej., diatomeas) en el metalimnion que conforman el DCM. El zooplancton se alimenta del fitoplancton asociado al DCM y las bacterias de la materia orgánica liberada del metalimnion.
En el resto del tiempo, la PPB supera a la respiración. La biomasa fitoplanctónica en el lago Alchichica está dominada por individuos de talla grande (Adame et al., 2008), que al no poder ser consumida por los herbívoros (ya sea por su gran tamaño y/o su gran abundancia), se agrega y hunde junto con el fitodetrito, exportándose hacia el fondo en gran número (Ardiles et al., 2012).
En conclusión, las tasas de PPB y R están íntimamente ligadas con el florecimiento invernal de diatomeas, el florecimiento primaveral de cianobacterias y el máximo profundo de clorofila durante la estratificación bien establecida y tardía, los cuales a su vez, están controlados por la hidrodinámica regular del lago Alchichica (monomixis cálida). Este lago tiene un comportamiento predominantemente autotrófico debido a que la PPB anual excede a la R, con una PPN anual positiva y por lo tanto funciona como sumidero de CO2 el 75% del tiempo del ciclo anual.











 nueva página del texto (beta)
nueva página del texto (beta)



