En la acuicultura marina existen grandes retos para lograr un crecimiento sostenido, como son: mejorar las dietas de acuerdo a sus requerimientos; disminuir el uso de harinas elaboradas con pelágicos menores; producir una menor cantidad de desechos nitrogenados al medio ambiente, entre otros. Los estudios para evaluar la digestibilidad in vitro se basan en la técnica del pH-Stat (Pedersen & Eggum, 1983), que si bien han sido útiles para predecir el potencial digestivo de un alimento formulado o de un organismo determinado (Ezquerra et al., 1997; Cheng & Hardy, 2002), o para describir la calidad, no dejan de ser una predicción. Un método recientemente incorporado dentro del área de nutrición acuícola es la técnica de isótopos estables (Preston et al., 1996; Gamboa-Delgado & Le Vay, 2009; Felip et al., 2012). Se basa en que muchos elementos poseen dos o más isótopos en donde los estables son aquellos que no sufren una desintegración nuclear. Los isótopos estables dentro de las cadenas tróficas favorecen la retención de los pesados sobre los ligeros, ya que energéticamente estos últimos son más fáciles de metabolizar (Martínez del Río et al., 2009). De tal manera que con los valores isotópicos del nitrógeno (relación del isótopo ligero y pesado) presente en el alimento y el que fue incorporado en el tejido, se calculó la retención de N (Carleton & Martínez del Río, 2010). Si todo organismo tiende a equilibrar los valores isotópicos del alimento ingerido, la diferencia entre el alimento y lo acumulado, representa los valores de discriminación isotópica o factor de discriminación, de tal manera que las desviaciones entre el equilibrio reflejará que tanto nitrógeno del alimento o ingrediente es integrado y de que manera lo hace (Phillips & Eldridge, 2006). A la fecha esta técnica no ha sido reportada para evaluar la calidad de alimentos comerciales para peces marinos expuestos a condiciones no controladas en un ambiente marino. Por tanto, el objetivo de este trabajo fue probar esta técnica en el estudio de retención de N con dos fuentes de alimento comercial de distinto origen (o marca comercial) para ser evaluados in situ (jaulas marinas).
Dos alimentos comerciales, con 47% de proteína y 12% de grasa se utilizaron para alimentar a veinticinco mil juveniles de lobina rayada Morone sexatilis (Walbaum, 1792), que fueron cultivados en jaulas marinas de 22.0 m de diámetro y 10.0 m de profundidad. Se recurrió a un diseño experimental cruzado en el que peces alimentados durante 9 meses (270 días) con el alimento comercial "A", posteriormente fueron alimentados con el alimento comercial "B". El ensayo experimental se llevó a cabo en la empresa Pacífico Aquaculture S. de R.L. de C.V., localizada en Ensenada Baja California, México. Muestras de los alimentos y tejidos (hígado y músculo) fueron tomadas y procesadas de forma individual (por triplicado) antes y durante el cambio del alimento, las cuales fueron congeladas a -30 °C para su análisis.
El análisis proximal de los alimentos y tejidos fue evaluado por triplicado y expresado en materia seca de acuerdo a los estándares propuestos por la AOAC (1995).
Los valores isotópicos (δ15N) se determinaron a partir de muestras desengrasadas de alimento y tejido (músculo e hígado) para determinar la composición relativa de 15N / 14N. En resumen, 1.5 mg de muestras pesadas en una ultra balanza (±0.1µg), y guardadas en cápsulas de estaño se analizaron en la Universidad de California Davis (USA), en donde se utilizó un analizador elemental de interfase con un espectrómetro de flujo continuo de masas de relación isotópica (IRMS) con una precisión de 0.3‰. El valor isotópico de la muestra (δ) es reportado en partes por mil (‰) relativo al nitrógeno atmosférico siguiendo la siguiente fórmula:
δ15N(‰)= [(R muestra - R estándar) / R estándar] X 1000
donde R de la muestra y R del estándar representan la relación del isótopo pesado al ligero (15N/ 14N). El factor de discriminación isotópico del tejido del músculo e hígado (∆) relativo a cada una de las dietas experimentales se calculó con la siguiente ecuación: ∆= (δ tejido - δ dieta)
Se utilizó un análisis de varianza de una vía (ANOVA) (n=3) con las muestras obtenidas a partir de un diseño experimental cruzado (Quinn & Keough, 2010). Se utilizó la prueba a posteriori de Tukey en aquellos valores en donde se observaron diferencias utilizando SigmaStat para Windows 3.5.
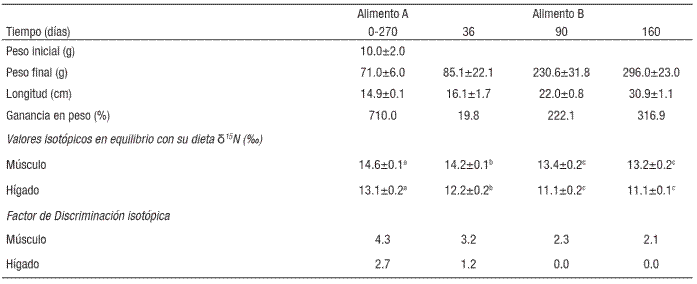
Los peces alimentados con el alimento "A" durante 270 días alcanzaron un peso de 71.0±6.0 g y una longitud de 14.9±0.1 cm, tiempo en que se cambió al alimento "B". Posteriormente se realizaron tres biometrías y recolecta de muestras en un lapso de 160 días. Fecha en que los peces alcanzaron un peso promedio de 296.0±23 g y una longitud de 30.9±1.1 cm y aumentaron un 316% en peso (Tabla 1).
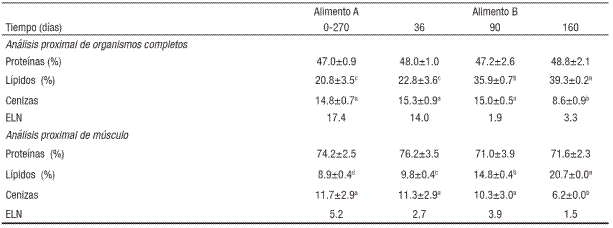
Tabla 1 Análisis proximal y valores isotópicos de δ15N (‰) de los ali mentos comerciales de lobina rayada (Morone saxatilis) en jaulas ma rinas.
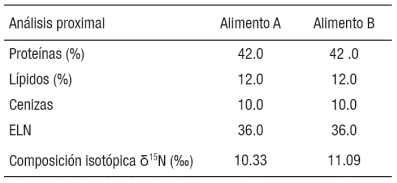
El valor isotópico de las muestras iniciales de músculo e hígado fueron mayores al valor isotópico del alimento "A" (10.3‰) con 14.6±0.1‰ y 13.1±0.2‰ obteniendo un factor de discriminación de 4.3 y 2.7 respectivamente. Al día 160 los peces alimentados con el alimento "B" (11.09‰) presentaron valores en el músculo e hígado de 13.2±0.2‰, y 11.1±0.1‰, con un factor de discriminación de 2.1 y 0.0‰ respectivamente.
Los organismos alimentados con el alimento "A" se consideraron en equilibrio isotópico con su dieta, ya que habían sido alimentados durante 270 días. De acuerdo al productor, el peso inicial de los juveniles estaba entre 5 y 10 g dando un valor estimado de crecimiento total del 846%. Si bien se puede afirmar que los peces deberían estar en equilibrio isotópico con su dieta (10.3‰), los valores de δ15N para el músculo e hígado alcanzaron valores de 14.6 y 13.1‰ respectivamente, lo que implica un mayor enriquecimiento que el observado en esos mismos peces con el alimento "B". El enriquecimiento de isótopos pesados puede ser un indicador de una deficiencia en aminoácidos limitantes, dando lugar a un proceso catabólico con el consecuente enriquecimiento de δ15N en músculo e hígado, o bien, podría reflejar una calidad deficiente de la proteína por baja digestibilidad (Martínez del Río et al., 2009). Al cambiar al alimento "B", bajo las mismas condiciones de cultivo y con los mismos peces, se mostró una rápida incorporación de tejido y se obtuvo en 160 días el 316% de incremento en peso. Para el día 36 con un δ15N de 19.8‰ el hígado presentó una discriminación de 1.2 (del 2.7 para el día cero). Al comparar con la composición proximal del pez entero se aprecia una disminución continua del contenido de cenizas, indicando una menor proporción relativa con el resto de los nutrientes (proteína y lípidos) y que desde el día 90 con tan sólo un 222.1% de ganancia total en peso, el hígado ya presentó valores isotópicos muy similares a los del alimento. La respuesta de enriquecimiento isotópico por tejido es variable de especie a especie e incluso de tejido a tejido, considerando que el factor de discriminación isotópica para N en sistemas acuáticos se ha calculado en el orden de 3.2‰ (Peterson & Fry, 1987) El factor de discriminación isotópica con el alimento "A" fue de 4.3 y 2.7‰ para músculo e hígado, por lo que puede decirse que el alimento es aceptable. Sin embargo al comparar los valores del alimento "A" con el alimento "B" se observa que este último presentó un mejor desempeño en la retención. De acuerdo con Carleton y Martínez del Río (2010) el hígado es uno de los órganos más sensibles por su elevada tasa de recambio. Aquí se ve que el hígado alcanza valores de cero lo que demuestra poco enriquecimiento y una clara diferencia entre ambos alimentos. Los alimentos comerciales utilizados eran de empresas distintas con un valor isotópico diferente, seguramente por estar formulados con ingredientes de origen distinto, lo cual podría explicar la diferencia en la retención de N.
En conclusión, se demuestra que la técnica de isótopos estables es una herramienta útil para evaluar la calidad del alimento en condiciones comerciales. (Tabla 2 y 3)
Tabla 2 Índices biológicos, valores isotópicos de δ15N (‰) y Factor de discriminación isotópica de músculo e hígado de lobina rayada (Morone saxatilis) en jaulas marinas.











 nueva página del texto (beta)
nueva página del texto (beta)