Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.24 no.3 Ciudad de México sep./dic. 2014
Artículos
Fecundidad y consumo de oxígeno del cangrejo dulceacuícola Trichodactylus borellianus (Decapoda: Trichodactylidae) en el valle aluvial del Paraná Medio (Argentina)
Fecundity and oxygen consumption of the freshwater crab Trichodactylus borellianus (Decapoda: Trichodactylidae) in the alluvial valley of Middle Paraná (Argentina)
Eloisa Senkman,1,2 Verónica Williner,1,3 Leandro Negro,1,4 Natalia König3 y Pablo Collins1,4
1 INAU-CONICET-UNL. Ciudad Universitaria-Paraje EL Pozo-Santa Fe. Argentina.
2 FCYT UADER. Corrientes y Andrés Pazos-Paraná. Argentina.
3 FHUC-UNL. Ciudad Universitaria-Paraje El Pozo-Santa Fe. Argentina.
4 Escuela Superior de Sanidad-FBCB-UNL. Ciudad Universitaria-Paraje EL Pozo-Santa Fe. Argentina. e-mail: esenkman@inali.unl.edu.ar.
Recibido: 29 de enero de 2013.
Aceptado: 24 de abril de 2014.
RESUMEN
En el presente trabajo se analiza la fecundidad de Trichodactylus borellianus en el área del Paraná Medio (Argentina) y el consumo de oxígeno de hembras ovígeras en condiciones experimentales. Se obtuvieron los valores promedio y desviación estándar de la fecundidad (96 ± 36 huevos), masa húmeda de huevos (0.11 ± 0.08 g), volumen del huevo (0.40 ± 0.08 mm3) y el esfuerzo reproductivo (0.22 ± 0.1). El consumo de oxígeno no difirió entre hembras ovígeras, hembras no ovígeras y machos, pero sin emargo sí varió entre hembras ovígeras con los huevos en diferentes estadios de desarrollo. El consumo de oxígeno en hembras ovígeras de T. borellianus mostró una tendencia a invertir energía simultáneamente en el cuidado parental de incubación de los huevos y en el desarrollo de gónadas para optimizar su reproducción.
Palabras clave: Ambientes continentales, América del Sur, decápodos, fisiología, hembras ovígeras.
ABSTRACT
This paper analyzes the fecundity of Trichodactylus borellianus during a water cycle in the area of the Middle Paraná (Argentina) and the oxygen consumption of ovigerous females in experimental conditions. Mean and standard deviation values of fecundity (96 ± 36 eggs), egg wet mass (0.11 ± 0.08 g), egg volume (0.40 ± 0.08 mm3) and reproductive effort (0.22 ± 0.1) were obtained. Oxygen consumption no differed between ovigerous females, non-ovigerous females and males, but different however if between ovigerous females with eggs in different stages of development. Oxygen consumption in ovigerous females of T. borellianus shows a tendency to simultaneously invest energy in parental care (egg incubation) and in the development of gonads to optimize reproduction.
Key words: Decapods, island water, ovigerous female, physiology, South America.
INTRODUCCIÓN
Trichodactylus borellianus (Nobili, 1896) es un cangrejo perteneciente a la familia Trichodactylidae (Magalhaes & Turkay, 1996) que se distribuye en Brasil, Bolivia, Paraguay y Argentina (Magalhaes, 2003). Se encuentra en ambientes acuáticos continentales, en zonas de refugio, como la en vegetación, o bien enterrado o debajo de rocas en las márgenes poco profundas de lagunas, arroyos y ríos (Poi de Neiff & Carignan, 1997; Collins et al., 2006). Estos cangrejos se registran de manera abundante en las comunidades litorales de los ambientes acuáticos asociados al Río Paraná, encontrándose en raíces y pecíolos de hojas del camalote o Jacinto de agua (Eicchornia crassipes (Mart.) Solms). Estas macrófitas flotantes forman un ambiente heterogéneo que sostiene gran parte de la relaciones tróficas de los ambientes leníticos (Sabattini & Lallana, 2007).
Los ambientes donde los decápodos habitan pertenecen a ríos con llanuras de inundación, hábitats altamente dinámicos donde la estabilidad y la diversidad son principalmente condicionadas por la hidrología y el flujo de sedimentos y nutrientes (Junk, 1989). Los organismos que conquistaron estos sistemas dulciacuícolas, realizaron ajustes en su historia evolutiva para acoplar sus ciclos vitales a estos ambientes. Algunas de las principales modificaciones fueron las relativas a aspectos reproductivos. Por ejemplo, aunque el volumen de los huevos producidos por las especies de crustáceos es, en parte, controlado genéticamente (Raven, 1961), se observa un patrón de variación de acuerdo al grado de salinidad de los ambientes y de la independencia del medio marino (Omori, 1974; Sastry, 1983). De esta manera, una de las adaptaciones de los crustáceos decápodos que conquistaron ambientes dulciacuícolas fue la disminución en el número de huevos y el aumento en el volumen de éstos (Jalihal et al., 1993; Odinetz Collart & Rabelo, 1996). Esta característica propia de los cangrejos dulceacuícolas se debe a una estrategia reproductiva, en la cual el embrión se desarrolla en su totalidad dentro del huevo, sin tener estadios larvales fuera de él (Mansur, 2002; Souza, 2010). De esta manera, el tiempo de desarrollo larval se reduce y emergen del huevo organismos similares a los adultos, con las características de sus progenitores. También algunos aspectos conductuales fueron modificados, incorporándose el cuidado parental prolongado, entendiéndose este, como el cuidado de la progenie después de la eclosión. Desde un punto de vista ecológico y evolutivo, la caracterización de aspectos reproductivos y poblacionales como la fecundidad y el éxito reproductivo es una herramienta importante para la comprensión de estos cambios (Anger, 1995). En este contexto de ambientes inestables, como los existentes en los valles aluviales de ríos de llanura de inundación, las poblaciones animales presentan sincronización con los factores ambientales que influyen sobre la densidad, la proporción de sexos y el reclutamiento (Ranta, 1998; Ruetz et al., 2005). En el área del Paraná Medio (Provincia de Santa Fe, Argentina), las hembras de T. borellianus son más abundantes que los machos, salvo a finales del invierno y en primavera, observándose hembras ovígeras en épocas de aguas altas, que coinciden con la máxima extensión del valle de inundación (Collins et al., 2006).
Existen diferentes herramientas para caracterizar los procesos reproductivos en los decápodos, en este estudio la fecundidad fue evaluada a través del número de huevos producidos por hembra. En estudios anteriores, estos valores se correlacionaron con el tamaño corporal o peso de las hembras (Hines, 1982; Somers, 1991; Haddon, 1994; Pinheiro & Terceiro, 2000; Brante et al., 2003; De Lestang et al., 2003; Nakata & Goshima, 2004).
Las hembras de T. borellianus llevan sus huevos en desarrollo pegados a los pleópodos, a diferencia de Dilocarcinus pagei Stimpson y Sylviocarcinus australis Magalhaes & Turkay (especies de la misma familia) quienes los llevan sueltos entre los pleópodos (Mansur, 2002; Souza, 2010). Así, además del consumo de oxígeno asociado a los costos asociados a los cuidados parentales y de apareamiento, hay una inversión por parte de las hembras en la provisión de vitelo en los huevos (Taylor & Leelapiyanart, 2001). En T. borellianus, después de la eclosión de los juveniles, se han registrado conductas relativas al cuidado parental (Senkman, 2014). Este comportamiento incluye el aseo de la prole y la ventilación mediante el batido abdominal, pudiendo implicar un aumento de la tasa metabólica materna (Bauer, 1989; Baeza & Fernández, 2002, Taylor & Leeapiyanart, 2001), por otra parte, en cangrejos tricodactílidos, las hembras cargan con sus crías durante un tiempo después de la eclosión (Tadeei, 1999; Mansur & Hebling, 2002; Souza da Silva, 2010; Senkman, 2014). La ventilación de los huevos y el transporte de la progenie tienen un costo energético que generalmente puede ser evaluado a nivel de tasa de consumo de oxígeno. Un análisis del consumo de oxígeno de las hembras durante el desarrollo del huevo, podría ayudar a dilucidar en qué momento de su período de incubación aumenta su tasa de consumo de oxígeno (Taylor & Leeapiyanart, 2001). En este contexto teórico, el presente trabajo analiza la fecundidad de T. borellianus en el área del Paraná Medio (Argentina) y el consumo de oxígeno de hembras ovígeras en condiciones experimentales.
MATERIALES Y MÉTODOS
Muestreo y recolección de organismos. Para analizar la fecundidad se realizó un muestreo mensual durante 15 meses (desde agosto de 2001 a octubre de 2002) en 3 sitios del valle de inundación del Paraná Medio. Este tiempo se corresponde con un ciclo hídrico completo, con épocas de aguas altas y de aguas bajas. Como se registró en estudios anteriores, T. borellianus ajusta sus eventos reproductivos a este ciclo (Collins et al., 2006). Los sitios muestreados fueron el Río Santa Fe (S31°38'35"W60°40'05,5" a 18AMSL), A° Aliviador (S31°40'17,9"W60°34'45,9" a 20AMSL) y A° Las Sandias (S31°41'15,3"W60°31'31,6" a 18AMSL). En cada sitio se colectaron 3 muestras de vegetación acuática flotante y litoral utilizando un copo de mano de abertura de malla de 1 mm y 0.9 m2 de superficie. El mismo esfuerzo de muestreo fue aplicado en todos los casos. Cada una de las repeticiones fue colocada en bolsas plásticas para su posterior traslado al laboratorio. Los muestreos de mayo y junio no registraron ejemplares. En todos los puntos de muestreo se registraron valores de recolección dentro un rango amplio (entre 5 a 68 organismos).
Para realizar los ensayos de consumo de oxígeno se utilizó a los individuos de T. borellianus de ambos sexos obtenidos en el mes de enero, los cuales fueron trasladados en recipientes plásticos al laboratorio de Bioensayos del INALI. Ahí, los cangrejos se mantuvieron en peceras grupales de 100 litros con aireación constante y temperatura de 26 ± 2 °C (desviación estándar). En los acuarios se los alimentó ad libitum con músculo de pescado hasta 24 hrs. antes del ensayo.
Fecundidad y parámetros reproductivos. La vegetación acuática recolectada en campo fue lavada en el laboratorio y los cangrejos separados de las raíces para su posterior medición. Se les registraron las siguientes variables: ancho de cefalotórax (AC), largo de cefalotórax (LCF) y ancho de abdomen (AAD) utilizando un calibre digital (0.01 mm de precisión). Luego fueron pesados (PHe) utilizándose una balanza (Digital Ohaus, modelo CS 200, precisión 0.1 g). Para retirar la masa de huevos, las hembras ovígeras fueron examinadas bajo el microscopio estereoscópico. En cada caso los huevos fueron contados y se determinó el estadio de desarrollo de los mismos, de acuerdo con una adaptación de la clasificación propuesta por Taylor y Leeapiyanart (2001) y Tuset et al. (2011) (Tabla 3). La clasificación utilizada abarca 5 estadios, de menor a mayor desarrollo: E0 = huevo con vitelo uniforme; E1 = huevo con más del 50% de vitelo uniforme y zona libre de vitelo; E2 = Huevo con menos del 50% de vitelo, esbozo de pleópodos, corazón bombeando y presencia de mancha ocular semilunar; E3 = huevo con presencia de ojos, abdomen y pleópodos segmentados. El embrión ocupa la mayor parte del huevo; E4 = cangrejos recién eclosionados. La totalidad de la masa de huevos fue pesada (PHu) utilizando una balanza digital (Ohaus, microscale, precisión 0. 001 g). Se seleccionaron 10 huevos al azar en cada hembra que fueron fotografiados. En cada fotografía se midió el largo (L) de los huevos utilizando el software TPS Dig2 (Rolfh, 2004). Los valores medios del diámetro (L) fueron usados para estimar el volumen de los huevos (volumen de la esfera). El esfuerzo reproductivo (RO) fue evaluado mediante la siguiente ecuación (Clarke et al., 1991):
RO = (peso total de huevos /peso de la hembra) * 100
Ensayo de consumo de oxígeno. Los animales utilizados fueron aclimatados en acuarios de 5 litros de capacidad, acondicionados con vegetación acuática y rocas propias del sitio de recolección durante una semana. Los cangrejos fueron agrupados por sexo en acuarios separados y alimentados con músculo de pescado fresco.
Las tasas de consumo de oxígeno fueron utilizadas como indicadoras del gasto energético. Se determinó el consumo de O2 con un sistema de cámaras metabólicas cerradas consistente en una botella hermética de vidrio de 640 cm3 de capacidad (Fig. 1). Todas las medidas se realizaron durante el día, cuando la actividad de los cangrejos es menor, para que pudieran ser utilizadas como estándar de las tasas de metabolismo (Lardies et al., 2004). El registro del consumo de oxígeno fue realizado en tres grupos con distintas características reproductivas: hembras ovígeras con huevos en 5 estadios de desarrollo, hembras reproductivas no ovígeras y machos reproductivos. Los cangrejos fueron pesados y colocados individualmente en cada cámara. El nivel de oxígeno fue registrado con un oxímetro digital (HANNA model HI9143) antes de colocar los organismos y luego de 4 hs. de permanencia en la cámara (tiempo estimado en ensayos preliminares). En todos los casos se calculó el consumo de oxígeno por unidad de tiempo.

La determinación de juveniles y de machos reproductivos se realizó a partir de la talla de madurez sexual morfológica (Williner et al., inédito).
Análisis de datos. Se establecieron relaciones de regresión entre las medidas biométricas (ancho de cefalotórax, ancho de abdomen), las medidas de peso (peso de las hembras, peso de los huevos), la fecundidad y el valor de RO utilizando el paquete estadístico PAST (Hammer et al., 2008). Las regresiones se realizaron sobre los datos originales. Se utilizó la prueba t de Student para determinar si las pendientes de las ecuaciones eran iguales a cero. Los valores de RO fueron comparados entre hembras con huevos en diferentes estadios de desarrollo utilizándose ANOVA. Los valores de RO fueron transformados utilizando logaritmo en base 10. La fecundidad fue comparada entre hembras con huevos en las distintos estadios de desarrollo mediante ANCOVA de una vía, estableciendo el ancho del caparazón como covariable (Lardies et al., 2004). Para discriminar entre las medias se utilizó el procedimiento de diferencia mínima significativa (LSD) de Fisher con un nivel de significancia del 0.05. Para evaluar diferencias en la tasa de consumo de oxígeno de las hembras con huevos en distintos estadios de desarrollo, de hembras reproductivas no ovígeras y de machos reproductivos, se utilizó ANOVA. Para establecer los grupos que mostraron diferencias entre sí, se utilizó la prueba de Tukey de comparaciones múltiples (Zar, 1999). Para todos los valores mencionados se utilizó la desviación estándar como medida de variabilidad.
RESULTADOS
Parámetros reproductivos y fecundidad. Se recolectaron un total de 482 cangrejos, de los cuales 121 fueron juveniles, 162 machos y 199 hembras. Del total de hembras, 70 estaban ovígeras y comenzaron a registrarse hacia fines del invierno austral (agosto), estando presentes hasta finales de verano (marzo) con una alta ocurrencia entre noviembre y enero. La hembra ovígera más pequeña registrada, presentó un ancho de caparazón (AC) de 7.3 mm y portaba 66 huevos, mientras que la de mayor talla portaba 249 huevos (Tabla 1).

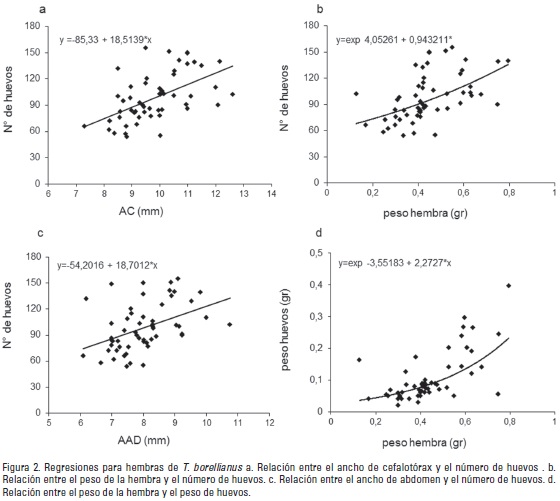
Los análisis de regresión mostraron una relación significativa entre la fecundidad y las medidas biométricas AC y AAD, al igual que con el peso de las hembras (PHe). En el mismo sentido, los valores de peso de los huevos (PHu) y el peso de las hembras (PHe) mostraron una relación significativa (Tabla 2). Sin embargo, los valores R2 resultaron bajos en todas las regresiones (Fig. 2).
El esfuerzo reproductivo (RO) de las hembras varió significativamente en función de los estadios de desarrollo de huevos (ANOVA, F4 37: 4.9, p = 0.0028). El post test de Tukey de múltiples comparaciones mostró que el estadio E0 presentó diferencias estadísticamente significativas con respecto a estadios avanzados (E3 y E4). Además los valores de RO mostraron una tendencia lineal (y = 0,0709x-0.8788 R2 = 0.3132) significativa (ANOVA, F4 37: 17.73, p = 0.0002) (Fig. 3).

Al comparar los valores de fecundidad en cada estadio de desarrollo de los huevos de acuerdo con la talla de las hembras como covariable, se encontró que la talla de la hembra tiene un efecto significativo sobre la cantidad de huevos (ANCOVA, F 1,36: 16.79, p = 0.0003). Una vez controlado dicho efecto, los valores de fecundidad mostraron diferencias significativas entre los estadios E3 y E4 (ANCOVA, F5 36: 1.97, p = 0.004) (Fig. 4).

Consumo de oxígeno. La tasa de consumo de oxígeno (ppm/g.) no mostró diferencias significativas entre machos, hembras sin huevos, y hembras ovígeras (ANOVA, F 2,99: 1.75, p=0.17) (Fig. 5). Por otro lado, las tasas de consumo (ppm/g.) mostraron diferencias significativas entre las hembras ovígeras con huevos en distintos estadios de desarrollo (ANOVA, F4,57: 4.35, p=0.00414). El post test de Tukey de múltiples repeticiones evidenció que la tasa de consumo de las hembras con huevos del estadio E3 presentó diferencias con E1, E2 y E4. (Fig. 6).


DISCUSIÓN
Variables reproductivas. El número de huevos de T. borellianus (96 ± 36) es similar al de T. Kensleyi Rodríguez, 1992 (entre 75 y 119 huevos) (Konig & Williner, comunicación personal). Sin embargo el número de la puesta es menor al registrado en Dilocarcinus pagel (Stimpson, 1861) especie de la misma familia. Mansur y Hebling (2002) registraron valores de fecundidad mayores a 200, pudiendo este valor estar relacionado con las estrategias reproductivas propias de cada especie. El tamaño mayor en los huevos de los cangrejos tricodactílidos comparados con algunas especies marinas (Bliss, 1968; Liu & Li, 2000), está relacionada con el desarrollo directo que evolutivamente acompañó, en algunas especies, la conquista del ambiente dulceacuícola (Mansur & Hebling, 2002). Este aspecto tiene importantes consecuencias en el tamaño de los juveniles al momento de la eclosión (Negreiros-Fransozo et al., 1992), lo que a su vez influye en la sobrevivencia (Sastry, 1983; Rabalais & Gore, 1985). También el tamaño del huevo sería un buen estimador de la energía destinada al huevo (Jaeckle, 1995), como demostraron Giménez y Anger (2001; 2003) en Chasmagnathus granulata Dana 1851, donde la biomasa inicial del huevo, afecta el desempeño de la larva. Estos resultados concuerdan con lo planteado por Bliss (1968), que considera la reducción del número de huevos como una característica de la familia Trichodactylidae. Otra variable registrada de la masa de huevos fue el volumen, que junto con la cantidad y peso de los huevos muestran las diferencias marcadas con los valores registrados para organismos marinos como Hyus coaxtutus e Inachus dorsettensis (Pennant, 1777) (Bryant & Hartnoll, 1995). En este sentido es preciso mencionar, que si bien este patrón de aumento del tamaño de los huevos y reducción de etapas larvarias está representado en numerosas especies de cangrejos, no sería adecuado plantearlo como una única estrategia evolutiva en respuesta a la conquista de las aguas continentales (Anger, 2013).
Al analizar los resultados de los modelos de regresión, se observa que la fecundidad aumenta conforme lo hacen las dimensiones corporales de las hembras (Hines, 1982; Faria de Oliveira & Arruda Leme, 2004). Esta condición, podría atribuírseles a los cangrejos dulceacuícolas, los cuales invierten en crecimiento somático, aspecto que repercute directamente en su fecundidad (Pinheiro & Taddei, 2005). Los valores de R2 indican que la variable independiente explica un bajo porcentaje de la variabilidad del tamaño y el peso de la puesta. Estos resultados, están de acuerdo con el patrón general planteado por Hartnoll (1985) y Hines (1982). Estos valores podrían verse encubiertos por utilizar hembras con huevos en distintos estadios de desarrollo en un mismo análisis, aspecto que se evidencia al analizar la fecundidad con la talla de los ejemplares como covariable. Los valores de RO muestran que a medida que avanzan los estadios de desarrollo de los huevos, la inversión en relación al peso de la hembra es mayor. En el último estadio de desarrollo (E4) el peso de la masa de huevos representa cerca del 35% del peso de la hembra, mostrando un promedio de 22%. Este es un rasgo regular entre los crustáceos (García-Guerrero & Hendrickx, 2006) y podría atribuirse a la necesidad del embrión de obtener mayor fuerza para romper el corion al finalizar el desarrollo embrionario (Pandian, 1970; Nagao et al., 1999; Pinheiro & Hattori, 2003; García-Guerrero & Hendrickx, 2006). Los valores de RO obtenidos para T. borellianus fueron mayores que los registrados para el isópodo terrestre Porcellio laevis Latreille, 1804, que fueron del 12% en promedio (Lardies et al., 2004). Estos resultados podrían analizarse en relación a la pérdida o reabsorción de huevos, como propone Faria de Oliveira y Arruda Leme (2004). Las diferencias en los valores de RO entre los distintos estadios de desarrollo de los huevos podrían mostrar que para T. borellianus, el análisis de este parámetro es un buen descriptor del estado de las hembras ovígeras.
Consumo de oxígeno. En T. borellianus se observó que el consumo de oxígeno es similar en machos, hembras ovígeras y en hembras no ovígeras. Estos resultados podrían deberse a que los machos consumen mayor cantidad energía durante el proceso reproductivo (cortejo, cópula y formación de gametos) y las hembras ovígeras consumen casi la misma cantidad de energía que los machos, porque al mismo momento que tienen cuidados parentales de sus huevos, sus gónadas se encuentran desarrollándose, y poco tiempo después de liberar sus crías (entre 7 y 10 días) vuelven a estar ovígeras, teniéndose varias puestas al año (Senkman, 2014). Sin embargo, las hembras ovígeras de cangrejos marinos consumen sustancialmente más cantidad de oxígeno que las hembras no ovígeras (Fernández et al., 2000; Baeza & Fernández, 2002; Brante et al. 2003), lo que indicaría un costo de suministro de oxígeno para los embriones (Fernández & Brante, 2003).
Las diferencias de consumo de oxígeno entre hembras con huevos en estadios final de desarrollo, pueden deberse a que el E3 es el último estadio de desarrollo embrionario y este podría requerir mayor energía para la eclosión (Taylor & Leeapiyanart, 2001) En este sentido, el costo energético aumenta al concluir el desarrollo embrionario (Pandian, 1970; Nagao et al., 1999; Pinheiro & Hattori, 2003; García-Guerrero & Hendrickx, 2006) y esto podría observarse en un aumento de la tasa de consumo de oxígeno, dado por el aumento del batido abdominal de la hembra.
El costo de la reproducción es tradicionalmente interpretado como una consecuencia del conflicto entre la demanda de recursos para la reproducción, el crecimiento y el metabolismo basal (Barnes & Partridge, 2003). En los crustáceos existen profundas diferencias en las estrategias reproductivas al analizar el número, el tamaño y el tiempo de incubación de huevos entre especies marinas y de ambientes dulceacuícolas.
En general, el cuidado parental se ha asociado con la protección de las crías frente a los depredadores o las condiciones adversas del ambiente (Thiel, 1999). Además de estas conductas, las hembras ovígeras de decápodos presentan cuidados asociados específicamente a la provisión de oxígeno a los huevos (Fernández et al., 2000; Baeza & Fernández, 2002; Thatje et al., 2003) ya que el oxígeno se considera un factor limitante en el desarrollo de los huevos (Baeza & Fernandez, 2002). Sin embargo, el consumo de oxígeno en hembras ovígeras de T. borellianus, no mostró diferencias respecto a los demás por lo cual esta especie optimiza la energía teniendo varias puestas anuales.
El conocimiento de aspectos reproductivos en cangrejos de la familia Trichodactylidae es aún escaso, este trabajo muestra los primeros aportes para T. borellianus en el Valle aluvial del tramo medio del río Paraná. Sin embargo, aún quedan numerosos aspectos morfológicos, fisiológicos y ecológicos por dilucidar sobre la dinámica de la reproducción de estos decápodos.
REFERENCIAS
Anger, K. 1995. The conquest of freshwater and land by marine crabs: adaptations in life-history patterns and larval bioenergetics. Journal of Experimental Marine Biology and Ecology 193: 119-145. [ Links ]
Anger, K. 2013. Neotropical Macrobrachium (Caridea: Palaemonidae): on the biology, origin, and radiation of freshwater-invading shrimp. Journal of Crustacean Biology 33 (2):151-183. [ Links ]
Baeza, J. A. & M. Fernández. 2002. Active brood care in Cancer setosus (Crustacea: Decapoda: Cancridae): the relationship between female behaviour, embryo oxygen consumption, and the cost of brooding. Functional Ecology 16 (2): 241-251. [ Links ]
Barnes A. I. & L. Partridge. 2003. Costing reproduction. Animal Behaviour 66: 199-204. [ Links ]
Bauer, R. T. 1989. Functional morphology, adaptive value, and phylogenetic significance of grooming in Decapod Crustacea. In Felgenhauer, B. & L. Watling (Eds.). Functional Morphology of Grooming and Feeding Appendages. Balkema press, pp. 49-73. [ Links ]
Bliss, D. E. 1968. Transition from water to land in decapod crustaceans. American Zoologist 8: 355-392. [ Links ]
Brante, A., M. Fernández, L. Eckerle, F. Mark, H.O. Portner & W. Arntz. 2003. Reproductive investment in the crab, Cancer setosus, along a latitudinal cline: egg production, egg losses and egg ventilation. Marine Ecology Progress Series 251: 221-232. [ Links ]
Bryant A. D. & R. G. Hartnoll. 1995. Reproductive investment in two spider breeding strategies crabs with different. Journal of Experimental Marine Biology and Ecology 188: 261-275. [ Links ]
Clarke, A., C. C. Hopkins & E. M. Nilssen. 1991. Egg size and reproductive output in the freeswater prawn Pandalus borealis Kroyer, 1838. Functional Ecology 5: 724-730. [ Links ]
Collins, P., F. Giri & V. Williner. 2006. Population dynamics of Trichodactylus borellianus (Crustacea Decapoda Brachyura) and interactions with the aquatic vegetation of the Paraná River (South America, Argentina). Annales de Limnologie-International Journal of Limnology 42:19-25. [ Links ]
De Lestang, S., N. G. Hall & I. C. Potter. 2003. Reproductive biology of the blue swimmer crab (Portunus pelagicus, Decapoda: Portunidae) in five bodies of water on the west coast of Australia. Fish B-Natl. Oceanic Atmos. Administration 101: 745-757. [ Links ]
Faria de Oliveira, C. C. & M. H. Arruda-Leme. 2004. Desenvolvimiento embrionario e fecundidade do caranguejo Armases rubripes (Crustacea, Brachyura, Grapsidae) de uma regiao esturina de Ubatuba-SP. Revista Biociéncias (Taubaté 10 (3): 129-137. [ Links ]
Fernández, M., C. Bock & H. Portner. 2000. The cost of being a caring mother: the ignored factor in the reproduction of marine invertebrates. Ecology Letters 3: 487-494. [ Links ]
Fernández M. & A. Brante. 2003. Brood care in Brachyuran crabs: the effect of oxygen provision on reproductive costs. Revista Chilena de Historia Natural 76: 157-168. [ Links ]
García-Guerrero, M. & M. E. Hendrickx. 2006. Embryology of decapod crustaceans III: Embryonic development of Europanopeus canalensis Abele & Kim, 1989, and Panopeus chilensis H. Milne Edwards & Lucas, 1844 (Decapoda, Brachyura, Panopeidae). Belgian Journal of Zoology 136 (2): 249-253 [ Links ]
Giménez, L. & K. Anger. 2001. Relationships among salinity, egg size, embryonic development, and larval biomass in the estuarine crab Chasmagnathus granulata Dana, (1851). Journal of Experimental Marine Biology and Ecology 260: 241-257. [ Links ]
Giménez, L. & K. Anger. 2003 Larval performance in an estuarine crab, Chasmagnathus granulata, is a consequence of both larval and embryonic experience. Marine Ecology Progress Series 249: 251-264. [ Links ]
Haddon, M. 1994. Size-fecundity relationships, mating behaviour and larval release in the New Zealand paddle crab Ovalipes catharus (White, 1843) (Brachyura: Portunidae). New Zealand Journal of Marine and Freshwater Research 28: 329-334. [ Links ]
Hammer, O., Harper D. A. T. & P. D. Ryan. 2008. PAST - Palaeontological statistics, ver. 1.81. [ Links ]
Hartnoll, R. G. 1985. Growth, sexual maturity and reproductive output. In Wenner, A. M. (Ed.). Crustacean Issues. 3. Factors in Adult Growth. A.A. Balkema, Rotterdam: 101-128. [ Links ]
Hines, A. H. 1982. Allometric Constraints and Variables of Reproductive Effort in Brachyuran Crabs. Marine Biology69: 309-320. [ Links ]
Jaeckle, W. B. 1995. Variation in size, energy content and biochemical composition of invertebrate eggs: correlates to the mode of larval development. In: McEdward, L.R. (Ed.). Ecology of Marine Invertebrate Larvae. Powell's, Boca Ratón, Florida, EEUU, pp. 49-78 [ Links ]
Jalihal, D. R., K. N. Sankolli & S. Shenoy. 1993. Evolution of larval development patterns and the process of freshwaterization in the prawn genus Macrobrachium Bate, 1868 (Decapoda, Palaemonidae). Crustaceana 65: 365-376. [ Links ]
Junk, W. J., P. B. Bailey & R. E. Sparks. 1989. The Flood Pulse concept in river-floodplain systems. In: Dodge, D. (Eds.). Proceeding of the International Larger River Symposiums, Canadian Special Publication of Fisheries and Aquatic Sciences, pp. 106. [ Links ] Lardies, M. A., I. S. Cotoras & F. Bozinovic. 2004. The energetics of reproduction and parental care in the terrestrial isopod Porcellio laevis. Journal of Insect Physiology 50: 1127-1135. [ Links ]
Liu, H. C. & C. W. Li. 2000. Reproduction in the fresh-water crab Candidiopotamon rathbunae (Brachyura: Potamidae) in Taiwan. Journal of Crustacean Biology 20: 89-99. [ Links ]
Magalhães, C. 2003. The occurrence of freshwater crabs (Crustacea: Decapoda: Pseudothelphusidae, Trichodactylidae) in the Río Xingu, Amazon Region, Brazil, with description of a new species of Pseudothelphusidae. Amazoniana 17 (3/4): 377-386. [ Links ]
Magalhães, C. & M. Turkay. 1996. Taxonomy of the Neotropical freshwater crab family Trichodactylidae I. The generic system with description of some new genera (Crustacea: Decapoda: Brachyura). Senckenbergiana biologica 75 (1/2): 63-95. [ Links ]
Mansur, C. B. & N. J. Hebling. 2002. Análise comparativa entre a fecundidade de Dilocarcinus pagei Stimpson e Sylviocarcinus australis Magalhaes & Turkay (Crustacea, Decapoda, Trichodactylidae) no Pantanal do Rio Paraguai, Porto Murtinho, Mato Grosso do Sul. Revista Brasileira de Zoologia 19 (3): 797-805. [ Links ]
Nagao, J., H. Munehara & K. Shimazaki. 1999. Embryonic development of the hair crab Erimacrus isenbeckii. Journal of Crustacean Biology 19 (1): 77-83. [ Links ]
Nakata, K., Goshima, S. 2004. Fecundity of the Japanese crayfish, Cambaroides japonicus: ovary formation, egg number and egg size. Aquaculture 242. 335-343. [ Links ]
Negreiros-Fransozo. M. L., A. Fransozo, F. L. M. Mantelatto, J. M. Nakagaki & M. C. F. Spilborghs. 1992. Fecundity of Paguristes tortugae Schmitt, 1933 (Crustacca, Decapoda, Anomura) in Ubatuba (SP), Brazil. Revista Brasileira de Biologia 52 (4): 547-553. [ Links ]
Odinetz-Collart, O. & H. Rabelo. 1996. Variation in egg size of the freshwater prawn Macrobrachium amazonicum (Decapoda: Palaemonidae). Journal of Crustacean Biology 16 (4): 684-688. [ Links ]
Omori, M. 1974. The biology of pelagic shrimps in the oceans. Advances in Marine Biology 12: 233-324. [ Links ]
Pandian, T. J. 1970. Ecophysiological studies on the developing eggs and embryos of the european lobster Homarus gammarus. Marine Biology 5: 154-167. [ Links ]
Pinheiro, M. A. A. & O. S. L. Terceiro. 2000. Fecundity and reproductive output of the speckled swimming crab, Arenaeus cribrarius (Lamarck, 1818) (Brachyura, Portunidae). Crustaceana 73 (9):1121-1137. [ Links ]
Pinheiro, M. & Hattori, G. 2003. Embryology of the mangrove crab Ucides cordatus (Brachyura: Ocypodidae). Journal Crustacean Biology 23:729-737 [ Links ]
Pinheiro, M. A. A. & F. G. Taddei. 2005. Crescimento do caranguejo de água doce Dilocarcinus pagei Stimpson, 1861 (Crustacea, Brachyura, Trichodactylidae). Revista Brasileira de Zoologia 22 (3): 522528. [ Links ]
Poi de Neiff, A. & R. Carignan. 1997. Macroinvertebrates on Eichhornia crassipes roots in two lakes of the Paraná River floodplain. Hydrobiologia 345: 185-196. [ Links ]
Rabalais, N. N. 1991. Egg production in crabs with abbreviated development. In Wenner, A. & A. Kuris (Eds.). Crustacean Egg Production. Rotterdam A. A. Balkema Publishers. pp. 217-234. [ Links ]
Rabalais, N. N. & Gore, R. H. (1985). Abbreviated development in decapods. In: Crustacean Issues. Vo!. 2. Larval growth. Ed. A. M. Wenner. (A. A. Balkema, Rotterdam). pp. 67-126. [ Links ]
Ranta, E., V. Kaitala & P. Lundberg. 1998. Population variability in space and time: dynamics of synchronous population fluctuations. Oikos 83: 376-382. [ Links ]
Raven, C. P. 1961 Oogenesis: the storage of developmental information. Oxford, Pergamon Press, 274 p. [ Links ]
Rohlf, F. J. 2004. TPSDig2, version 1.40. Department of Ecology and Evolution, State University New York. Stony Brook. [ Links ]
Ruetz, C. R., J. C. Trexler, F. Jordan, W. F. Loftus & S. A. Perry. 2005. Population dynamics of wetland fishes: spatio-temporal patterns synchronized by hydrological disturbance? Journal of Animal Ecology 74: 322-332. [ Links ]
Sabattini R. & V. Lallana. 2007. Aquatic macrophytes. In: Iriondo M. H., Paggi J. C. & M. J. Parma (Eds.) "The middle Parana River: Limnology of a subtropical wetland". Springer-Verlag, Berlín, Heidelberg. Pp. 205-244. [ Links ]
Sastry, A. N. 1983. Ecological aspects of reproduction. In. Vernberg, W. B. (Ed.). The Biology of Crustacea: Environmental adaptations. New York, Academic Press, Vol. 8. pp. 179-270. [ Links ]
Senkman, L. E. 2014. Biología reproductiva de cangrejos tricodactílidos en el río Paraná Medio. Tesis de Doctorado en Ciencias Naturales. Facultad de Ciencias Naturales y Museo UNLP. La Plata, Argentina. 189 p. [ Links ]
Somers, K. M. 1991 Characterizing size-specific fecundity in crustaceans. In. Wenner A. & A. Kuris (Eds.). Crustacean Egg Production, pp. 357-78. Balkema, Rotterdam. [ Links ]
Souza da Silva, L. 2010. Estrutura populacional e maturidade sexual de Sylviocarcinuspictus (H. Milne-Edwards, 1853) e S. devillei H. Milne-Edwards, 1853 (Brachyura, Trichodactylidae) das ilhas do estuàrio amazónico no entorno de Belém, Pará, Brasil. Dissertammo (Mestrado) Universidade Federal do Pará, Instituto de Ciencias Biológicas, Belém. Programa de Pós-Graduação em Ecologia Aquàtica e Pesca. 95 p. [ Links ]
Taddei, F. G. 1999. Biologia populacional e crescimento do caranguejo de água doce Dilocarcinus pagei Stimpson, 1861 (Crustacea, Brachyura, Trichodactylidae) da Represa Municipal de Sao José do Rio Preto, SP. Dissertagao de Mestrado, Universidade Estadual Paulista, Botucatu, Brasil. 107 p. [ Links ]
Thatje, S., S. Schnack-Schiel, W. E. Arntz. 2003. Developmental trade-offs in Subantartic meroplankton communities and the enigma of low decapod diversity in high southern latitudes. Marine Ecology Progress Series 260. 195-207. [ Links ]
Taylor, H. H. & N. Leelapiyanart. 2001. Oxygen uptake by embryos and ovigerous females of two intertidal crabs, Heterozius rotundifrons (Belliidae) and Cyclograpsus lavauxi (Grapsidae). scaling and the metabolic costs of reproduction. Journal of Experimental Biology 204 (6). 1083-1097. [ Links ]
Thiel, M. 1999. Duration of extended parental care in marine Amphipods Journal of Crustacean Biology 19 (1). 60-71. [ Links ]
Tuset, V. M., D. Espinosa, A. García-Mederosa, J. I. Santana & J. A. González. 2011. Egg development and fecundity estimation in deep-sea red crab, Chaceon affinis (Geryonidae), off the Canary Islands (NE Atlantic). Fisheries Research 109 (2). 373-378. [ Links ]
Williner, V., M. V. Torres, D. Azevedo Carvalho & N. Konig. Relative growth and morphological sexual maturity size of the freshwater crab Trichodactylus borellianus (Crustacea, Decapoda, Trichodactylidae) in The Middle Paraná River. Inedito. [ Links ]
Zar, J. H. 1996. Biostatistical Analysis. Prentice Hall, New York. 663 p. [ Links ]














