Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.23 no.2 Ciudad de México Mai./Ago. 2013
Paralarvas y juveniles de cefalópodos en el Pacífico sur de México
Paralarvae and juvenile of cephalopods in the Mexican South Pacific
Ma. del Carmen Alejo-Plata,1 Rubén García-Guillén2 y Jorge Herrera-Galindo1
1 Instituto de Recursos. Universidad del Mar Campus Puerto Ángel Ciudad Universitaria, Puerto Ángel, Apartado postal 47, 70902 Oaxaca, México.
2 Programa de Biología Marina, Universidad del Mar Campus Puerto Ángel. e-mail: plata@angel.umar.mx.
Recibido: 28 de agosto de 2012.
Aceptado: 4 de enero de 2013.
RESUMEN
Los primeros estadios de vida de la mayoría de las especies de cefalópodos se encuentran pobremente estudiados e inadecuadamente descritos. En este trabajo se presenta por primera vez la composición de especies, patrones de distribución y abundancia de paralarvas y juveniles de cefalópodos en el Golfo de Tehuantepec, en el Pacífico sur de México. Esta es una región altamente productiva y de gran complejidad ecológica. Los especímenes examinados provinieron de muestras de zooplancton recolectadas con redes Bongo (10-15 °N, 96-100 °O) a bordo del B/O "El Puma" durante junio y septiembre de 2001 y de un tercer muestreo a bordo del B/P "UMAR", noviembre 2001 (14-16 °N, 93-97 °O) con red tipo 2al2OFI. La abundancia promedio fue de 16.2 individuos x 1000 m-3. Se identificaron seis familias, que comprenden ocho géneros y por lo menos 13 especies. En orden de abundancia las familias fueron Octopodidae (48.5% de los especímenes analizados), Enoploteuthidae (15.9%), Argonautidae (13.3%), Ommastrephidae (11.5%), Onychoteuthidae (6.7%) y 2ranchiidae (4.1%). Los resultados mostraron un ensamble de cefalópodos típico de aguas tropicales y oceánicas. La talla osciló entre 0.2 y 37.8 mm de longitud de manto (LM); el 90% de los organismos presentó tallas menores a 3 mm LM. Se presentan ilustraciones de los principales géneros y especies y se discuten sus patrones de distribución a meso-escala. Los resultados ofrecen nueva información sobre la presencia y abundancia relativa de especies tropicales en esta región del Pacífico Oriental.
Palabras clave: Abundancia, distribución calamares, Golfo Tehuantepec, taxonomía, zooplancton.
ABSTRACT
Early life cephalopod stages are poorly studied and inadequately described. This study presents for the first time the composition of species, patterns of distribution, and abundance of parlarvae and juveniles of cephalopods in the Gulf of Tehuantepec, a highly productive and ecologically complex region. Paralarvae and juvenile were recovered from zooplancton samples collected with bongo tows (10-15 °N, 96-100 °O) on board of the O/V "El Puma" during June and September 2001. A third set of samples were obtained on board the B/P "UMAR" in November 2001 (14-16 °N, 93-97 °O) with a 2al2OFI net. Average density of cephalopods was 16.2 organisms x 1000 m-3. Six families representing eight genera and at least 13 species were identified. The most abundant families were: Octopodidae (48.5% of specimens examined), Enoploteuthidae (15.9%), Argonautidae (13.3%), Ommastrephidae (11.5%), Onychoteuthidae (6.7%), and 2ranchiidae (4.1%). The results revealed a typical tropical and oceanic cephalopod assemblage. The mantle length (ML) ranged between 0.2 and 37.8 mm; most specimens (90%) were small-sized, measuring less than 3 mm ML. The main genera and species are illustrated and their meso-scale distribution patterns are discussed. Results provide new information on the presence and relative abundance of tropical species in this region of the Eastern Pacific.
Key words: Abundance, Gulf of Tehuantepec, squid distribution, taxonomy, zooplankton.
INTRODUCCIÓN
El Golfo de Tehuantepec es una de las áreas más productivas de los mares mexicanos. Es un sitio netamente tropical, influenciado por corrientes oceánicas cálidas, la temperatura superficial del mar mensual promedio se encuentra por arriba de los 26 °2 a lo largo del año (Lara-Lara et. al., 1998). Un aspecto relevante en la oceanografía del Golfo es la surgencia inducida por los fuertes vientos, los denominados localmente "tehuanos". Estas características favorecen el desove de diferentes especies marinas y lo convierten también en un lugar de crianza y alimentación de especies con importancia comercial y lugar de importantes pesquerías (Trasviña & Barton, 1997).
El Golfo de Papagayo, el Domo de 2osta Rica y el Golfo de Tehuantepec representan en conjunto las únicas fuentes de enriquecimiento de nutrientes por procesos de surgencia en la región del Pacífico de 2entroamérica; sin embargo, el Golfo de Tehuantepec es la zona con la menor información respecto a sus comunidades marinas y variabilidad ambiental (Ortega-García et al., 2000). Esta carencia aunque se refleja prácticamente en todos los grupos de especies marinas, de manera especial en los cefalópodos.
A diferencia del resto de los moluscos, en los cefalópodos no existe la típica larva velíger que caracteriza a los demás miembros del grupo. Debido a la gran cantidad de vitelo en el huevo, los cefalópodos eclosionan en un estado muy avanzado de desarrollo, sin una metamorfosis radical y son una morfología semejante al adulto, lo que indujo a la utilización del término "paralarva" para referirse a la etapa posterior a la eclosión (Vecchione, 1987; Young & Harman, 1988).
En esta primera etapa los pequeños cefalópodos parecen adultos en miniatura; sin embargo, su modo de vida difiere respecto al de los adultos (Boletzki, 2003). Al eclosionar, las para-larvas son nadadoras activas que utilizan un hábitat diferente al de los adultos, frecuentemente se incorporan al plancton. Se desconoce su tiempo de permanencia en la columna de agua, aunque dependiendo de la especie puede ser de varias semanas (Bower, 1996). Estos estadios se encuentran pobremente estudiados e inadecuadamente descritos para la mayoría de las especies (Sweeney et al., 1992). En la última década se ha incrementado el interés por estudiar los estadios tempranos de vida de los cefalópodos. A nivel mundial los estudios se han enfocado a la identificación taxonómica de las paralarvas (Harman & Young, 1985; Young & Hirota, 1990; Sweeney et al., 1992) así como sus patrones de distribución y abundancia (Bower et al., 1999; Vecchione, 1999; Yatsu et al., 1999; Sakurai et al., 2000; Anderson & Rodhouse, 2001; Waluda et al., 2001; Goto, 2002; Yamamoto et al., 2007; Ichii et al., 2009).
En el Pacífico mexicano la mayoría de los estudios previos sobre cefalópodos se refiere a los adultos (p. ej. Markaida & So-sa-Nishizaki, 2001; Díaz-Uribe et al., 2006; Alejo-Plata et al., 2009; Nigmatullin & Markaida, 2009). Respecto a los estadios tempranos se cuentan con los trabajos de Granados-Amores (2008) y 2amarillo-2oop et al. (2011) sobre abundancia y distribución; el de Ramos-2astillejos et al. (2010) sobre identificación taxonómica en el Golfo de 2alifornia y el de Alejo-Plata et al. (2012), sobre la distribución de Octopus bimaculatus Verrill, 1883 en la porción sur del Pacífico mexicano.
Es indispensable poder conocer los estadios planctónicos de los cefalópodos de importancia comercial, lo cual permitirá identificar la especie a la cual pertenece, completar el conocimiento de su ciclo de vida y determinar los factores que afectan al reclutamiento en la pesquería (Rocha et al., 1999); información necesaria para el manejo sustentable de los stocks pesqueros (Rodhouse et al., 1992).
El presente estudio tuvo como objetivo proporcionar información sobre la composición taxonómica, abundancia y distribución de los estados tempranos de vida de los cefalópodos, recolectados en el Pacífico sur de México.
MATERIALES Y MÉTODOS
El material biológico analizado provino de tres cruceros oceanográficos realizados durante el 2001 con un total de 50 estaciones de muestreo, las cuales cubrieron la zona costera y oceánica del Pacífico sur de México. Se realizaron dos cruceros oceanográficos a bordo del B/O "El Puma" de la Universidad Nacional Autónoma de México: E2A2-II (10 al 22 de julio, Fig. 1 estaciones A-L) y E2A2-III (30 de agosto al 5 de septiembre, Fig. 1 estaciones A, B, 2, 2D, D) (10-15 °N, 96-100 °O). Para la obtención de las muestras de zooplancton se realizaron arrastres oblicuos desde los 200 m a la superficie, cuando la profundidad de la zona lo permitió. Los arrastres se realizaron con una red Bongo de 60 cm de diámetro de boca, con redes de 303 y 505 μm de luz de malla, equipadas con un flujómetro. La velocidad de los arrastres fue mantenida aproximadamente a 2 nudos (Smith & Richardson, 1979).

El tercer muestreo se realizó a bordo del B/P "UMAR" de la Universidad del Mar, entre el 27 y 30 de noviembre, estaciones 132 (14-16 °N, 93-97 °O). Las muestras se obtuvieron con una red tipo 2al2OFI, con un diámetro de apertura de boca de 1 m equipada con red de luz de malla de 300 μm y con flujómetro. Los arrastres fueron oblicuos a una velocidad de aproximadamente 2 nudos desde superficie y hasta 50 m de profundidad. En cada estación de muestreo se registraron datos de temperatura y salinidad (ups) utilizando un 2TD SEA BIRD. Después del arrastre el material fue fijado con formol al 4% neutralizado con borato de sodio.
Las paralarvas y juveniles de cefalópodos fueron separados de las muestras de zooplancton originales. A cada espécimen se le midió la longitud del manto dorsal (LM) con una precisión de 0.1 mm con un micrómetro ocular usando un microscopio estereoscópico Olympus® SZX-TR30. De acuerdo a Sweeney et al. (1992), Yatsu et al. (1999) y Staaf et al. (2008), se consideró que las paralarvas obtenidas <3 mm LM correspondieron a un evento de desove reciente.
El análisis morfológico-taxonómico se basó en las descripciones de Voss (1980), Sweeney et al. (1992), Roper et al. (1995), Yatsu et al. (1999) y Diekmann et al. (2002). Se evaluaron distintos caracteres, como la presencia de fotóforos oculares y viscerales, el arreglo de cromatóforos en sifón, brazos, cabeza y manto, la posición, número y acomodo de las ventosas, tanto en brazos como en tentáculos, las características de los tentáculos, la forma del manto, las líneas de los tubérculos cartilaginosos en el manto, la presencia de una sutura, la forma del cartílago de cierre del sifón, y las costillas en la membrana bucal. Se utilizó una cámara lúcida para elaborar ilustraciones de los organismos.
Se catalogaron como "organismo no identificado" aquellas paralarvas que por su tamaño y estado de preservación no fue posible identificar a nivel especie. También se separaron los especímenes incompletos (sólo cabezas o mantos) que no fue posible identificar y por ello no fueron considerados en los distintos análisis.
Se estimó la dominancia, frecuencia, abundancia, distribución despacial de las paralarvas encontradas y frecuencia de tallas de las especies más numerosas. La dominancia de cefalópodos en la comunidad zooplanctónica se calculó como el porcentaje entre el número de muestras en que se encontraron y el total de muestras realizadas durante el crucero para cada etapa, valorándose según el consumo de Bodenheimer (en Mujica y Rojas, 1985) en accidental (0.0% - 2.5%), accesorio (2.6% - 5.0%) o dominante (5.1% - 100%). La frecuencia de ocurrencia o constancia numérica de cada taxa, se calculó por el número de estaciones en que se encontró la especie y el número total de estaciones con paralarvas, clasificándose de acuerdo a la escala de Bodenheimer en accidental (0.0% - 25%), accesorio (25.1% - 50%) o constante (50.1%-100%). La biomasa zooplanctónica se determinó mediante el método del volumen desplazado. Los datos de biomasa se estandarizaron a 1000 m-3 de agua de mar filtrada (Smith & Richardson, 1979), y su distribución se analizó en categorías expresadas sobre el área de muestreo.
RESULTADOS
Distribución y abundancia. Se recolectaron un total de 42 muestras de zooplancton en los tres cruceros realizados. De éstas, 26 resultaron positivas para cefalópodos. En los cruceros de julio y septiembre se encontraron paralarvas y juveniles en todas las estaciones muestreadas; por el contrario durante el crucero de noviembre las paralarvas estuvieron presentes en pocas estaciones, principalmente las estaciones costeras localizadas frente a los sistemas lagunares (Fig. 2). Durante el periodo de muestreo se registró una temperatura superficial del mar (TSM) mínima de 20 °2, media de 30.1 °2 y máxima de 31.4 °2; la salinidad superficial mínima fue de 33.4 ups, la media de 33.9 ups y la máxima de 34.3 ups. En la tabla 1 se muestran los detalles de la distribución de las especies de cefalópodos y estaciones de muestreo.
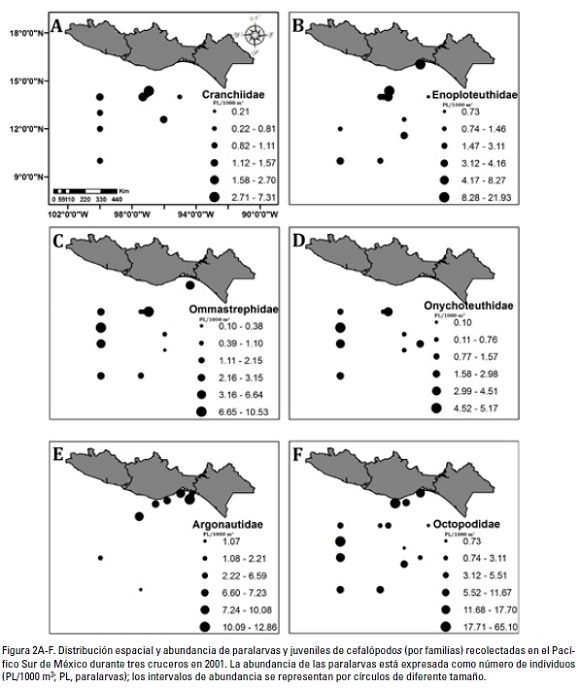
En total se capturaron 303 paralarvas entre los 200 m de profundidad y la superficie de la columna de agua. La abundancia promedio fue de 16.2 individuos x 1000 m-3 (Fig. 2). Se identificaron seis familias que comprenden ocho géneros y por lo menos 18 especies. En orden de abundancia las familias presentes en el área de estudio fueron: Octopodidae (48.5%), Enoploteuthidae (15.9%), Argonautidae (13.3%), Ommastrephidae (11.5%), Onychoteuthidae (6.7%) y 2ranchiidae (4.1%). Las familias Onychoteuthidae (Fig. 2 D) y Argonautidae (Fig. 2 E) mostraron una mayor abundancia en las estaciones costeras; mientras que la familia Octopodidae fue tanto abundante en estaciones costeras como oceánicas (Fig. 2F).
Se recolectaron paralarvas y juveniles de cefalópodos en 12, 4 y 10 estaciones de muestreo de cada uno de los cruceros analizados. La frecuencia de los 2ephalopoda dentro de la comunidad zooplanctónica fue en todos los casos amplia, con 100% y 75% para los cruceros de la región oceánica, y de 31% para el crucero de la región costera. De acuerdo a frecuencia de ocurrencia o constancia numérica, las familias Enoploteuthidae, Ommastrephidae y Octopodidae fueron dominantes, el resto de las familias presentes fueron accesorias.
Sistemática
Familia CRANCHIIDAE
En esta familia contiene los llamados calamares cristal, denominados así por presentar un manto transparente. Esta familia se caracteriza por poseer un manto de paredes delgadas que se fusiona a la cabeza en la región nucal y al sifón en las esquinas posterolaterales. Se reconocieron 17 cránquidos (LM = 2.1-37.8 mm), de los cuales cinco organismos no pudieron ser identificados hasta género por presentar el manto dañado. Sin embargo, todos los individuos presentaron dos líneas de tubérculos cartilaginosos en la parte ventral del manto, característicos de la familia (Figura 3-8). En este trabajo se consiguió distinguir tres especies de Leachia.


Leachia dislocata Young, 1972 Figs. 3-4; 23-25).
(n = 2; LM = 36.8, 37.8 mm). Manto alargado, con sutura dorsal marcada, sin lancéola y dos hileras con 26 tubérculos cartilaginosos, los 11 más grandes con forma de corona alargada lateralmente y terminación en punta. Los primeros tres tubérculos presentan arreglo en forma de rombo, el segundo tubérculo grande, notablemente desplazado hacía la línea media del manto. Ojos pedunculados, con 7 fotóforos internos y tres fotóforos medios, cromatóforos no observados.

Leachia pacifica Issel, 1908 (grupo, posiblemente compuesto por más de una especie o subespecie) (Figs. 5-6; 26-27).
(n = 8; LM = 4.6-8.9 mm). Manto con sutura dorsal marcada. Dos hileras de tubérculos, cada una con 4-5 tubérculos cartilaginosos en forma de espinas, los primeros tres tubérculos con arreglo en forma de rombo, el segundo de los cuales es grande estay notablemente desplazado hacía el resto de la línea media del manto. Ojos pedunculados, sin fotóforos. Esta especie esta reportada dentro de un grupo, por lo que es posible que la variedad de formas de los tubérculos sean parte de las variaciones morfológicas de la misma especie, o bien que pertenezcan a otras especies dentro del grupo.
Leachia danae Joubin, 1931 (Figs. 7-8; 28-30)
(n = 2; LM = 14.8, 15.9 mm). Presenta 2 líneas de tubérculos cartilaginosos, cada una con 7-9 tubérculos en forma de diamante y terminación en punta. Ojos pedunculados con tres fotóforos internos embebidos. 2romatóforos no observados.
Familia ENOPLOTEUTHIDAE
Esta familia se caracteriza por incluir a calamares de tamaño pequeño a mediano, con fotóforos embebidos en el manto, cabeza, brazos, sifón y ojos. Se registraron 47 paralarvas (0.6-6 mm LM), once organismos no pudieron ser identificados a nivel de género debido a que eran muy pequeños (LM<2.5 mm), presentaron un manto corto en forma de cono, generalmente revertido. 2on-siderando la forma del cuerpo y otros caracteres como: los ojos prominentes, la corona de brazos corta, la ausencia de fotóforos aparentes, los tentáculos moderadamente largos, los organismos pertenecieron al género Abraliopsis Joubin, 1896. Los organismos identificados como A. sp. 1 y A. sp. 2 fueron descritos por Granados-Amores (2008). De acuerdo a la distribución de los adultos de este género es muy posible que los organismo identificados como Abraliopsis sp. 1 correspondan a A. affinis Pfeffer, 1912. La forma Abraliopsis sp. 2 pudiera corresponder con A. falco Young, 1972. Las especies reconocidas se enlistan a continuación.
Abraliopsis sp. 1 (Figs. 9-10; 31-32)
(n = 6; LM = 2.7-6.0 mm). Manto de forma triangular, broche cartilaginoso recto; superficie del manto ventral con 62 fotóforos epidérmicos arreglados en hileras transversales en dirección antero-posterior, con un arreglo: 6+4+2+6+6+4+6+6+4+4+4+2+2+2+2+2. 2uatro posibles cromatóforos en la región posterior cerca de las aletas. Manto dorsal con lancéola en forma de diamante; sutura dorsal marcada; cromatóforos y fotóforos no observados. Brazos subiguales con ventosas no pedunculadas; fórmula de los brazos II=III>I>IV, con 8 a 10 fotóforos externos repartidos sobre cada brazo; los brazos IV presentan además 3 fotóforos externos en la región distal; no se observaron cromatóforos en los brazos y tentáculos; 4 ganchos en la parte oral de la mano. Región ventral de la cabeza con16 fotóforos (4 verticales por debajo del IV par de brazos, 6 horizontales en la región media, 6 en la parte posterior de la cabeza); en la región dorsal de la cabeza no se observaron cromatóforos y fotóforos. Sifón con 4 fotóforos (2+2). Ojos con 5 fotóforos internos y 5 fotóforos medios. Aletas triangulares.
Abraliopsis sp. 2 (Figs. 11-12; 33-34)
(n = 3; LM = 2.4-6.0 mm). Manto de forma triangular, broche cartilaginoso recto. Región ventral del manto con 8 fotóforos en un arreglo 2+2+2+2 y dos cromatóforos en la parte posterior cerca de las aletas. Manto dorsal, lancéola en forma de diamante y sutura dorsal marcada, sin cromatóforos y fotóforos. Brazos subiguales con ventosas no pedunculadas; fórmula de los brazos III>II>I>IV, par de brazos IV con 1 fotóforo externo en la región distal. Tentáculos, sin cromatóforos aparentes, 2 ganchos en la mano en la parte oral. Porción ventral de la cabeza con un cromatóforo en la región media, porción dorsal de la cabeza, sin cromatóforos. Sifón con 4 fotóforos horizontales en la parte media. Ojos sin cromatóforos, 1 fotóforo interno. Aletas de forma triangular.
Abraliopsis sp. 3
(n = 27; LM = 0.6-2.9 mm). Manto de forma triangular, con presencia de >60 fotóforos distribuidos en la parte ventral del manto. Manto dorsal presenta la sutura dorsal marcada y la lancéola en forma de diamante, fotóforos no observados; broche cartilaginoso recto; brazos con ventosas no pedunculadas, con presencia de fotóforos en el cuarto par de brazos. Tentáculos con fotóforos y 4 ganchos en la mano. 2abeza con fotóforos en parte ventral. Ojos con presencia de 5 fotóforos internos y 5 externos. Aletas triangulares.
Familia OMMASTREPHIDAE
Se recolectaron 47 paralarvas rhynchoteuthion (LM = 0.6-4.4 mm), estadios larvales exclusivos de la familia Ommastrephidae y que se caracterizan por la presencia de dos tentáculos fusionados en forma de una probóscide ventral. Para este intervalo de tamaños, la identificación se basó en la presencia/ausencia de fotóforos en la cavidad del manto y en la superficie ventral de los ojos, en la longitud relativa de la probóscide, y en el tamaño de las dos ventosas laterales de la probóscide en relación con las otras seis. Los organismos pequeños (n = 36, LM < 2.0 mm) no pudieron ser identificados hasta nivel de género, debido a que el manto se encontraba revertido y/o comprimido, no se observaron cromatóforos ni fotóforos viscerales o suboculares; además de su estado de preservación no era bueno (p. ej. en algunos casos sólo se contaba con mantos y/o cabezas).
Stenoteuthis oualaniensis Lesson, 1830 (Figs. 13-14).
(n = 5; LM = 1.1-3.1 mm). Organismos sin probóscide con ventosas laterales alargadas. Un fotóforo en cada ojo y dos fotóforos viscerales. La estructura poblacional de S. oualaniensis es complicada; se han reconocido cinco formas distintas basadas en el tamaño y diferencias morfológicas y morfométricas (Nesis, 1993). En la zona de estudio se distribuyen adultos de la forma mediana, la "típica" S. oualaniensis y de la forma enana; sin embargo, las paralarvas de estas dos formas no pueden distinguirse (Nesis, 1993).
Hyaloteuthis pelagica Bosc, 1802 (Figs. 15-16)
(n = 5; LM = 1.4-4.4 mm). Organismos sin probóscide con ventosas laterales alargadas. Un fotóforo en cada ojo claramente visible y un fotóforo visceral. Dos cromatóforos a cada lado de la cabeza.
Dosidicus gigas Orbigny, 1835
(n = 1; LM = 2.1 mm). La paralarva es una rhynchoteuthion típica, de manto ancho (50-80% su longitud) y probóscide corta, mayor que los brazos y sólo del 25-50% de LM. Presenta probóscide con ventosas laterales alargadas. Sin fotóforos oculares y viscerales (Figs. 17-18; 35). Solamente se encontró en la estación D (Fig. 1).
Familia ONYCHOTEUTHIDAE
Las paralarvas de esta familia se caracterizan por presentar un manto robusto que frecuentemente cubre toda o una parte importante de la cabeza. El gladio se proyecta ligeramente fuera del manto en la región posterior. Presenta un conspicuo cromatóforo en el lado ventral del manto. Cuatro hileras de ventosas en los tentáculos, los brazos IV no están completamente desarrollados. Se recolectaron 30 paralarvas (LM = 0.3-5.3 mm), once organismos no pudieron ser identificados. Se ha reportado la presencia de un complejo de especies denominado "complejo banksi' (Young, 1972), cuyos elementos se traslapan en su distribución. Se identificaron dos formas distintas dentro de este complejo. La diferencia entre ellas se determinó por el número de costillas visibles en la membrana bucal y por la posición, número y acomodo de las ventosas tanto en brazos como en tentáculos (Bolstad, 2010).
Onychoteuthis banksii tipo 1 (Figs. 19-20; 36-37).
(n = 3; LM = 3.1-5.3 mm). Manto con forma cilindrica; manto ventral con 17 cromatóforos en la región anterior en forma de "n'' y 7 cromatóforos en la región posterior, formando un semicírculo; manto dorsal sin cromatóforos. Cabeza retraída en el interior del manto. El Gladio rebasa el límite de las aletas. Sutura dorsal y lancéola marcada. Broche cartilaginoso no observado. Brazos con 2 hileras de ventosas no pediculadas; fórmula de brazos I=II>III>IV; parte aboral del brazo I con 4 cromatóforos, brazo III con 3 cromatóforos en la parte distal del brazo, brazo II-IV sin cromatóforos. Tentáculo con 4 cromatóforos en la región aboral. Aletas redondas.
Onychoteuthis banksii tipo 2
(n = 16; LM = 0.3-5.3 mm). Manto cilíndrico que cubre la mitad de la cabeza. Cromatóforos y fotóforos ausentes en cabeza. Manto ventral y dorsal sin cromatóforos. El Gladio rebasando el límite de las aletas. Sutura dorsal y lancéola marcada. Broche cartilaginoso recto. Brazos con dos filas de ventosas no pedunculadas; formula de brazos I=II=>III>IV; brazos sin cromatóforos. Tentáculos sin cromatóforos, mano sin membrana. Aletas redondas. Sifón grande a nivel de los ojos. Ojos sin cromatóforos ni fotóforos (Figs. 21-22; 38-39).
Familia ARGONAUTIDAE
Los miembros de esta familia se caracterizan por ser de vida pelágica, poseen un manto alargado y musculoso. Se recolectaron 10 paralarvas (LM = 1.3-2.4 mm), un organismo (LM= 2.2) que no pudo ser identificado fue catalogado como Argonauta sp.
Argonauta argo Linne, 1758 (Figs. 40-41).
(n = 7; LM = 1.3 - 3.2 mm; machos). Brazos cortos y de igual longitud, con tres ventosas. Ojos pequeños. Sifón con 2+2 cromatóforos. Región dorsal del manto con cuatro cromatóforos y región ventral con 4 o 5 cromatatóforos en el margen anterior. Dos cromatóforos en la región dorsal de la cabeza. Un cromatóforo en la región ventral de cada ojo y 9-11 cromatóforos viscerales; machos con hectocotilo envuelto en una bolsa denominada "pouch', propia de los machos de esta familia.

Argonauta hians Lightfoot, 1786 (Figs. 42-43).
(n = 2; LM = 2.3, 2.4 mm; machos). Brazos cortos y de igual longitud, con tres ventosas. Ojos pequeños. Brazos con un cromatóforo en la base. Patrón de cromatóforos similar a A. argo, región dorsal del manto de color claro. Seis cromatóforos en la región dorsal de la cabeza (2+4); región visceral con 12 cromatóforos.
Familia OCTOPODIDAE
Se recolectaron un total de 155 paralarvas (LM = 0.2-3.3 mm). La familia se caracteriza por tener un cuerpo corto en forma de saco, sin aletas laterales; concha vestigial ausente o presente como un par de estiletes cartilaginosos embebidos en el manto; brazo tercer par de brazos hectocotilizado; con cromatóforos generalmente de color café obscuro o anaranjado.
(n = 53; LM = 0.5-3.3 mm). Brazos cortos, de distintas dimensiones con un cromatóforo en la región media de cada brazo. Brazos III-IV con un cromatóforo en la base de cada brazo. Sifón con 3 cromatóforos con arreglo 1+2. Región dorsal del manto con 5 cromatóforos por debajo de la región anterior y 2 cromatóforos en la región posterior. Región ventral del manto con 5 cromatóforos en el margen de la región anterior y 5 cromatóforos en la región media sin un patrón definido, 1 cromatóforo en la región posterior. Región dorsal de la cabeza con 2 cromatóforos y región ventral con un cromatóforo por lado. Ojos con un cromatóforo por cada lado. Superficie dorsal de la glándula digestiva con 2 cromatóforos.
Octopus bimaculatus Verrill, 1883 (Figs. 48-51).
(n = 15; LM = 0.6-2.2 mm). Brazos cortos, de distintas dimensiones con 4 ventosas. Brazos con 8 cromatóforos. Sifón con 4 pequeños cromatóforos y 2+2 cromatóforos grandes en su región media. Ojos, con 1 cromatóforo largo. Región dorsal del manto con sólo un pequeño grupo de cromatóforos en la parte posterior. Región ventral del manto cubierta uniformemente con más de 50 cromatóforos. Región dorsal de la cabeza con 8 cromatóforos (2+4+2) y la región ventral con 4 cromatóforos en cada lado del sifón; cromatóforos viscerales no visibles debido a la preservación.
Octopus rubescens Berry, 1953 (Figs. 52-53).
(n = 3; LM = 0.7-2.1 mm). Cuerpo globuloso. Brazos cortos y de igual longitud, con cuatro ventosas. Brazos con seis cromatóforos distribuidos en dos filas y un cromatóforo en la base de cada brazo. Sifón con 2+2 cromatóforos. Patrón de cromatóforos en manto no visible. Cabeza con 10 cromatóforos.
Octopus veligero Berry, 1953 (Figs. 54-55)
(n = 36; LM = 0.3-1.3 mm). Brazos cortos y de igual longitud con 10 ventosas y con 12 cromatóforos distribuidos en dos renglones. Sifón con dos cromatóforos ventrales y dos laterales. Región ventral del manto con >20 cromatóforos dispersos, tanto en la región anterior como en la posterior. Región dorsal de la cabeza con 6 cromatóforos.
(n = 48; LM = 0.2-2.5 mm). Manto con forma ovalada, sin presencia de cromatóforos. Brazos de distintas dimensiones; no se observó broche cartilaginoso; los organismos se dañaron dañados por la fijación.
DISCUSIÓN
Debido a que la presencia de paralarvas es un indicador de las áreas de desove/eclosión y su abundancia puede ser utilizada para evaluar la relación stock-reclutamiento, el interés en el estudio de los estadios tempranos de vida de los cefalópodos se ha incrementado (Okutani & Watanabe, 1983; Wormuth & Roper, 1983; Piatkowski, 1998; Haimovici et al., 2002). Varios trabajos han mostrado la presencia de paralarvas de cefalópodos en aguas tropicales y subtropicales. Específicamente, en tales regiones, se han reportado las mayores abundancias de adultos de las familias Cranchiidae, Enoploteuthidae, Ommastrephidae y Onychoteuthidae, y también las abundancias más altas de paralarvas (Dawe & Stephen 1988; Piatkowski et al. 1993; Bower et al.1999; Vecchione, 1999; Vecchione et al. 2001; Diekmann & Piatowski, 2002).
En nuestro estudio estas familias estuvieron presentes y fueron abundantes, al igual que en el Golfo de California (Granados-Amores, 2008), confirmando que son grandes grupos que dominan en los mares tropicales mexicanos. Además, los resultados del presente trabajo reconocieron a la familia Octopodidae como la más abundante (48.5%; 203.1 individuos • 1000 m-3) y se registró a la familia Argonautidae (13.3%; 55.6 individuos • 1000 m-3), un grupo de cefalópodos oceánicos no abundante en otras regiones (Haimovici et al., 2002).
A nivel mundial, el número de paralarvas presentes en una muestra de zooplancton usualmente va de 1-5 ejemplares (Vecchione, 1987). Sin embargo, una extraordinaria abundancia de paralarvas de calamares omastréfidos (> 12,000 paralarvas en una sola estación de muestreo) fue reportada en el Domo de Costa Rica, Pacífico Tropical Oriental (Vecchione, 1999); esta abundancia estuvo asociada a la isoterma de los 29 °C durante un evento "El Niño'.
En este trabajo se encontró un número relativamente bajo de paralarvas (abundancia media de 16.2 individuos x 1000 m-3), lo que podría atribuirse a diferentes causas:a) un bajo esfuerzo de muestreo con sólo 55,514 m3 de volumen de agua filtrada, b) a la baja abundancia de paralarvas en la zona de estudio, c) a la posible capacidad de las paralarvas para evitar la red Bongo y de acuerdo a Haimovici et al. (2002), d) a la distribución espacial del zooplancton en parches, un fenómeno difícil de superar mediante muestreos convencionales.
La dominancia numérica de paralarvas en la zona de estudio fue intermedia, lo que en conjunto con la baja frecuencia de ocurrencia de la mayoría de las especies, los meses de muestreo, la hora en que se efectuaron los muestreos, y el comportamiento migratorio vertical de las paralarvas, induce a pensar que su presencia fue subestimada por el tipo de muestreo empleado. Por ello consideramos que es necesario realizar un mayor esfuerzo de muestreo, lo que permitirá el registro de especies que se distribuyen en diferentes áreas y épocas del año.
Por ello este trabajo proporciona un primer acercamiento sobre la composición taxonómica y abundancia de las paralarvas de cefalópodos en el Pacífico sur de México.
Se ha mencionado que las paralarvas de muchas especies de cefalópodos se encuentran distribuidas en los primeros 200 m de la columna de agua y que su capacidad de migración vertical aumenta con su crecimiento y que son altamente depredadoras (Sweeney et al., 1992). Dado que los arrastres con la red Bongo utilizados en este estudio incluyeron una columna de agua mues-treada de 200 m de profundidad, se considera que la comunidad de cefalópodos identificada con base en la presencia de sus paralarvas, está bien representada durante los meses de muestreo.
Aunque las paralarvas de octópodos se distribuyeron en toda el área de muestreo, la mayoría de ellas se concentró en las estaciones localizadas cerca de la costa sobre la plataforma continental; presentando un intervalo de tamaño entre 0.2 y 2.5 mm LM, lo cual puede indicar posibles sitios de desove para pulpos adultos y para la eclosión de sus paralarvas. La abundancia de paralarvas de pulpo con respecto a los calamares, se puede explicar por las amplias zonas rocosas y arrecifales en el Pacífico sur de México, ambientes ideales para el reclutamiento a la fase bentónica de los pulpos juveniles, así como para la alimentación y reproducción de los adultos (Alejo-Plata et al., 2012). Sin embargo, las especies de pulpo son poco conocidas en el Pacífico mexicano y sus paralarvas y juveniles no han sido descritas o son poco conocidas, con excepción de O. bimaculatus (Alejo-Plata et al., 2012). Aunado a ello se reconoce que la sistemática de la familia debe ser revisada (Norman & Hochberg, 2005).
Con respecto a los cefalópodos adultos, en el Pacífico mexicano Roper et al. (1995) reconocen 9 especies de pulpos, de las cuales seis no presentan importancia pesquera: Octopus rubescens (en el Golfo de California pesca exploratoria), O. veligero, O. alecto Berry, 1953, O. digueti Perrier & Rochebrune, 1894, O. chierchiae Jatta, 1889 y O. penicillifer Berry, 1954. La pesca artesanal está basada en tres especies: O. macropus Risso, 1826, O. bimaculatus y O. hubbsorum Berry, 1953. De estas, O. digueti y O. rubescens no se reportan para la zona de estudio. En este trabajo se consigna la presencia de paralarvas de O. rubescens, O. bima-culatus y O. veligero. Se registran por vez primera las paralarvas de O. rubescens en el Pacífico Tropical Oriental y se expande su intervalo geográfico de distribución al Golfo de Tehuantepec. Una situación opuesta es la de O. hubbsorum, especie abundante que sostiene la pesquería de pulpo en la zona de estudio, de la cual sin embargo su paralarva no se conoce todavía en la región de estudio. De acuerdo a las observaciones sobre la biología reproductiva de tal especie ¿y la morfología de sus?? huevos antes de la eclosión (Alejo-Plata et al., 2009), es muy posible que las para-larvas agrupadas como Octopus sp.1 correspondan realmente a la especie O. hubbsorum.
El ciclo de vida y la distribución de las especies de la familia Argonautidae son desconocidos en el Pacífico mexicano, sin embargo hay evidencias que indican que tales especies son abundantes. Los picos (mandíbulas) que presentan los Argonautidae son comunes en los contenidos estomacales de peces pelágicos y demersales (Galván-Magaña et al., 2007). En las muestras recolectadas en este estudio los machos presentaron dimorfismo sexual desde las tallas de 1.3 mm LM, con un hectocotilo completamente desarrollado, aunque todavía dentro de su bolsa (pouch); se sabe que las hembras (LM promedio de 70 mm) pueden ser hasta 20 veces más grandes que los machos (Roper et al., 1995).
A partir del análisis de contenidos estomacales de depredadores, así como en registros de pesca exploratoria y paralarvas, se ha estimado la presencia de cerca de 60 taxa de calamares en las aguas mexicanas (McGowan, 1967; Okutani y McGowan, 1969; Young, 1972; Okutani, 1980; Roper et al., 1995; Alejo-Plata et al., 2002; Galván-Magaña et al., 2007; Jereb & Roper, 2010). Los trabajos publicados están básicamente enfocados a especies de importancia comercial, y los temas más frecuentes son la distribución y la abundancia de especies potencialmente explotables y en menor número estudios sobre taxonomía de estadios tempranos y adultos.
Los calamares juegan un importante papel en la red alimenticia de la mayoría de los ecosistemas marinos (Boyle & Roud-house; 2005; Hunsicker, 2010); sin embargo, sus paralarvas han sido poco estudiadas y las áreas de desove de la mayoría de las especies no han sido detectadas. La presencia de paralarvas recién eclosionadas (<3 mm) en este trabajo podría ser indicativo que el desove de estos organismos se produjo en o cerca de la zona investigada.
La diversidad de especies de calamares refleja la variedad de hábitats donde se distribuyen exitosamente. Por ejemplo, los omastréfidos se distribuyen sobre la plataforma continental y en la zona pelágica del océano abierto y son grandes nadadores y activos depredadores. Otras familias como los cránquidos son débiles nadadores con flotabilidad neutral que ocupan ecológicamente nichos parecidos a los cnidarios y sifonóforos. Los calamares mesopelágicos como los enoplotéutidos tienen numerosos fotóforos en la piel y están morfológicamente adaptados para mostrar luminiscencia (Young, 1977).
La diversidad morfológica de los cefalópodos hace difícil la tarea de identificación de estos organismos, aunado a las dificultades de reconocer consistentemente las características sistemáticas diagnosticas debido a la enorme variabilidad de su morfología sobre todo en paralarvas y juveniles (Sweeney et al., 1992). En términos taxonómicos, cada familia cuenta con características propias (diagnósticas), por lo que deben ser tratados de manera diferente.
Son características importantes en paralarvas y juveniles, su talla y el número de fotóforos oculares (p. ej. Familia Cranchiidae); el patrón de fotóforos en ojos, manto, brazos y sifón (p. ej. Enoploteuthidae); o bien características muy especificas como la paralarva rhynchoteuthion de la familia Ommastrefidae. En otros grupos las características particulares de los adultos son las que permiten separar a las especies, por ejemplo en la familia Argonautidae las características de la concha ovígera permiten diferenciar a sus seis especies (Ruper et al., 1995). En el caso de los pulpos, caracteres como la forma del cuerpo, diferencias en la longitud de los brazos, el patrón de cromatóforos e iridióforos y el número de ventosas por brazo, pueden ser utilizados para el reconocimiento de las especies (Sweeney et al., 1992). Las etapas planctónicas se pueden identificar con un alto grado de confianza en especies en que los huevos y las crías están disponibles a partir de especies conocidas de adultos.
Los cromatóforos en el tegumento, especialmente en la región del sifón, manto y brazos, con frecuencia persisten en material preservado y proporcionan el mejor indicio visual para la identificación de los estados planctónicos de cefalópodos (Sweeney et al., 1992). Uno de los factores más importantes que afecta la caracterización morfológica y el análisis morfométrico de los organismos es el efecto del formol, que es utilizado como fijador porque rovoca la desaparición de los patrones de cromatóforos y en casos más severos la destrucción de las aletas, brazos, ojos y tentáculos, así como la contracción de ciertas partes del cuerpo; ocasionando mediciones erróneas. Adicionalmente, las guías de identificación y trabajos publicados no proporcionan los elementos esenciales para su identificación.
Los estudios enfocados a las paralarvas de cefalópodos y su respuesta a variaciones ambientales son escasos en comparación con los de otras larvas de invertebrados o peces (Boletzky, 2003), debido seguramente a que la captura de paralarvas es, generalmente, baja y muy dispersa (Piatowski, 1998). Los datos de las condiciones oceanográficas de una región posiblemente determinan su grado de influencia en la distribución de paralarvas en la zona de estudio. Esta influencia ha sido bien documentada para varias especies de cefalópodos, tanto pelágicos como costeros (p. ej. Dave & Beck, 1985; Parfeniuk et al., 1992; Saito & Kubodera 1993; Rocha et al., 1999; Sakurai et al., 2000). Otros autores han relacionado la distribución y abundancia de las paralarvas de cefalópodos con regiones de surgencias (Young & Hirota, 1998; Rocha et al., 1999; Vecchione, 1999). En el presente trabajo, los resultados sugieren que la presencia de las paralarvas tiene una relación estrecha con las condiciones oceanográficas del Golfo de Tehuantepec, las paralarvas pequeñas (< 3 mm LM) se encontraron en la estación lluviosa (TSM, 29 34 °C, salinidades de 33.1 a 34.4 ups), y las más grandes (>3 mm LM) se observaron en noviembre cuando ocurren los vientos tehuanos. El Golfo de Tehuantepec es una región altamente productiva y de gran complejidad ecológica, debido a sus altos niveles de precipitación pluvial durante la época de lluvias (junio-octubre) y a la presencia de una surgencia eólica en la temporada de tehuanos (noviembre-abril). Durante esta última temporada, el Golfo de Tehuantepec actúa como una bomba de nutrientes, favoreciendo la concentración de clorofila a y la productividad primaria (Lara-Lara et al., 1998).
Esta investigación es la primera sobre la composición taxonómica y abundancia de paralarvas y juveniles de cefalópodos en el Pacifico tropical mexicano. La frecuencia de los cefalópodos en la comunidad zooplanctónica local fue dominante, y a pesar de que el número total de paralarvas y juveniles recolectado fue relativamente bajo, el estudio ofrece nueva información sobre la presencia y abundancia relativa de especies tropicales. Este trabajo presenta una adición al conocimiento de la riqueza de especies de cefalópodos para el Pacífico sur de México y destaca la importancia de efectuar una prospección intensiva para aclarar la identidad y distribución de las especies que allí habitan, sobre todo considerando el creciente desarrollo de las pesquerías artesanales de pulpo en la zona.
AGRADECIMIENTOS
Los autores agradecen a Víctor Magaña Rueda del Instituto de Ciencias de la Atmósfera de la UNAM por proporcionar las muestras de zooplancton de los cruceros ECAC; a Linda Barranco Servín por la determinación de las biomasas. El manuscrito se enriqueció por las sugerencias de dos revisores anónimos.
REFERENCIAS
Alejo-Plata, C., J. L. Gómez-Márquez, S. Ramos-Carrillo & J. E. Herrera-Galindo. 2009. Reproducción, dieta y pesquería del pulpo Octopus (Octopus) hubbsorum (Mollusca: Cephalopoda) en la costa de Oaxaca, México. Revista de Biología Tropical57 (1-2): 63-78. [ Links ]
Alejo-Plata, C., R. García-Guillén & J. Herrera-Galindo. 2012. Paralarvas y juveniles de Octopus bimaculatus(Cephalopoda: Octopodidae) en el Pacífico sur de México. Revista de Biología Marina y Oceanografía 47 (2): 359-365. [ Links ]
Anderson, C. I. H. & P. G. Rodhouse. 2001. Life cycles, oceanography and variability: ommastrephid squid in variable oceanographic environments. Fisheries Research 54:133-143. [ Links ]
Boletzky, S. V. 2003. Biology of early life stages in cephalopod molluscs. Advances in Marine Biology 44: 143-204. [ Links ]
Bolstad, K. 2010. Systematics of the Onychoteuthidae Gray, 1847 (Cephalopoda: Oegopsida). Zootaxa 2696: 1-186. [ Links ]
Bower, J. R. & Y. Sakurai. 1996. Laboratory observations on Todarodes pacificus (Cephalopoda: Ommastrephidae) egg masses. American Malacological Bulletin 13: 65-71. [ Links ]
Bower, J. R., M. P. Seki, R. E. Young, K. A. Bigelow, J. Hirota & P. Flament. 1999. Cephalopod paralarvae assemblages in Hawaiian Islands waters. Marine Ecology Progress Series 185: 203-212. [ Links ]
Boyle, P. & P. Rodhouse. 2005. Cephalod ecology and fisheries. Blackwell Pub. 452 p. [ Links ]
Camarillo-Coop, S., C. A. Salinas-Zavala, M. Manzano-Sarabia & E. A. Ara-gón-Noriega. 2011. Presence of Dosidicus gigas paralarvae (Cephalopoda: Ommastrephidae) in the central Gulf of California, Mexico related to oceanographic conditions. Journal of the Marine Biological Association of the United Kingdom 91 (4): 807-814. [ Links ]
Dawe, E. G. & S. J. Stephen. 1988. The cephalopod assemblage of the Gulf Stream system east of 60 °W. Malacologia 29: 235-245. [ Links ]
Díaz-Uribe, J.G., A. Hernández-Herrera, E. Morales-Bojórquez, S. Martínez-Aguilar, M.C. Suárez-Higuera & A. Hernández- López. 2006. Validación histológica de los estadios de madurez gonádica de las hembras de calamar gigante (Dosidicus gigas) en el Golfo de California, México. Ciencias Marinas 32: 23-31. [ Links ]
Diekmann, R. & U. Piatowski. 2002. Early life stages of cephalopods in the Sargasso Sea: distribution and diversity relative to hydrographic conditions. Marine Biology 141: 123-130. [ Links ]
Galván-Magaña, F. R., J. Olson, N. Bocanegra-Castillo & V. G. Alatorre Ramírez. 2007. Cephalopod prey of the apex predator guild in the epi-pelagic Eastern Pacific Ocean. In Olson, R. j. & J. W. Young (Eds.). The role of squid in open ocean ecosystems. Report of a GLOBEC-CLIOTOP/PFRP Workshop, Honolulu Hawaii, USA. GLOBEC Report 24, pp. 45-48. [ Links ]
Goto, T. 2002. Paralarval distribution of the ommastrephid squid Todarodes pacificus during fall in the southern Sea of Japan, and its implication for locating spawning grounds. Bulletin of Marine Science 71: 299-312. [ Links ]
Granados-Amores, J. R. 2008. Calamares epiplanctónicos de la costa occidental de la península de Baja California, México. Tesis de maestría. Centro Interdisciplinario de Ciencia Marinas del Instituto Politécnico Nacional, 145 p. [ Links ]
Haimovici, M., U. Piatkowski & R. Aguiar dos Santos. 2002. Cephalopod paralarvae around tropical seamounts and oceanic island do of the northeastern coast of Brazil. Bulletin of Marine Science 71: 313-330. [ Links ]
Harman, R. F. & R. E. Young. 1985. The larvae of ommastrephid squids (Cephalopoda: Teuthoidea) from Hawaiian waters. Vie Milieu 35(3/4): 211-222. [ Links ]
Hunsicker, M. E., T. E. Essington, R. Watson & U. R. Sumaila. 2010. The contribution of cephalopods to global marine fisheries: can we have our squid and eat them too? Fish and Fisheries 11: 421-438. [ Links ]
Ichii, T., K. Mahapatra, M. Sakai, D. Inagake & Y. Okada. 2004. Differing body size between the autumn and the winter-spring cohorts of neon flying squid (Ommastrephes bartramii) related to the oceanographic regime in the North Pacific: a hypothesis. Fisheries Oceanography 13: 295-309. [ Links ]
Jereb, P. & C. F. E. Roper (eds.). 2010. Cephalopods of the world. An annotated and illustrated catalogue of cephalopod species known to date. Volume 2. Myopsidand OegopsidSquids. FAO Species Catalogue for Fishery Purposes. No. 4, Vol. 2. Rome, FAO. 605 p. [ Links ]
Lara-Lara, J. R., E. G. Robles-Jarero, M. C. Bazán-Guzmán & E. Millán-Nuñez. 1998. Productividad del fitoplancton. In: Tapia-Garcia, M. (Ed.). El Golfo de Tehuantepec: el ecosistema y sus recursos. Universidad Autónoma Metropolitana-Iztapalapa, México, pp. 51-58. [ Links ]
Markaida, U. & 0. Sosa-Nishizaki. 2001. Reproductive biology of jumbo squid Dosidicus gigas in the Gulf of California, 1995-1997. Fisheries Research: 54: 63-82. [ Links ]
McGowan, J. A. 1967. Distributional atlas of pelagic molluscs in the California Current region. California Cooperative Oceanic Fisheries Investigation Atlas 6: 1-218. [ Links ]
Mujica, A. & A. Rojas. 1985. Composición y abundancia del zooplancton del norte de Chile. Crucero MARCHILE XV-ERFEN VI, Diciembre 1983. Ciencia Tecnología Marina CONA 9: 31-52. [ Links ]
Nigmatullin, Ch. M. & U. Markaida. 2009. Oocyte development, fecundity and spawning strategy of large sized jumbo squid Dosidicus gigas (Oegopsida: Ommastrephidae). Journal of the Marine Biological Ass. U. K. 89 (4): 789-801. [ Links ]
Nesis, K. N. 1993. Population structure of oceanic ommastrephids, with particular reference to Sthenoteuthis oualaniensis: A review. In: Okutani, T., R. K. O'Dor & T. Kubodera (Eds.) Recent Advances in Fisheries Biology. Tokai Univ Press, Tokyo, pp. 375-383. [ Links ]
Norman, M. D. & F. G. Hochberg. 2005. The current state of Octopus taxonomy. Phuket Marine Biological Center Research Bulletin 66: 127-154. [ Links ]
Okutani, T. 1980. Calamares de las aguas mexicanas. Breve descripción de los calamares existentes en aguas mexicanas. Pesca, México. 64 p. [ Links ]
Okutani, T. & T. Watanabe. 1983. Stock assessment by larval surveys of the winter population of Todarodes pacificus Steenstrup (Cephalopoda, Ommastrephidae), with a review of earlier works. Biology and Oceanography 2: 401-431. [ Links ]
Ortega-García, S., J. A. Trigueros-Salmerón, R. Rodríguez-Sánchez, S. Lluch- Cota & H. Villalobos. 2000. El Golfo de Tehuantepec como un centro de actividad biológica y su importancia en las pesquerías. In: Lluch-Belda, D., J. Elorduy-Garay, S.E. Lluch-Cota & G. Ponce-Días (Eds.). BAC: Centros de Actividad Biológica del Pacífico mexicano. CIBNOR. México, pp. 335-356. [ Links ]
Piatkowski, U., W. Welsch & A. Ropke. 1993. Distribution patterns of the early life stages of pelagic cephalopods in three geographically different regions of the Arabian Sea. Pages. In: Okutani, T., R. K. O'Dor & T. Kubodera (Eds.). Recent advances in cephalopod fisheries biology. Tokai Univ. Press, Tokyo, Japan, pp. 417-431. [ Links ]
Piatkowski, U. 1998. Modern target sample techniques provide new insights into the biology of early life stages of pelagic cephalopods. Biología Marina Mediterránea 5: 260-272. [ Links ]
Ramos-Castillejos, J. E., C. A. Salinas-Zavala, S. Camarillo-Coop & L. M. Enriquez-Paredes. 2010. Paralarvae of the jumbo squid, Dosidicus gigas. Invertebrate Biology: 1-12. [ Links ]
Rocha, F., A. Guerra, R. Prego & U. Piatkowsky. 1999. Cephalopod paralarvae and upwelling condition off Galician waters (NW Spain). Journal of Plankton Research 21 (1): 21-33. [ Links ]
Rodhouse, P. G., C. Symon & E. M. C. Hatfield. 1992. Early life cycle of cephalopods in relation to the major oceanographics features of the southwest Atlantic Ocean. Marine Ecology Progress Series 89: 183-195. [ Links ]
Roper, C. F. E., M. J. Sweeney & F. G. Hochberg. 1995. Cephalopods. In: Fisher, W., F. Krupp, C. Sommer, K. E. Carpenter & V. H. Niem (Eds.). Guía FAO para la identificación de especies para los fines de pesca Pacifico Centro-Oriental. Vol. I Plantas e invertebrados. FAO, Rome, pp. 235-253. [ Links ]
Sakurai, Y., H. Kiyofuji, S. Saitoh, T. Goto & Y. Hiyama. 2000. Changes in inferred spawning areas of Todarodes pacificus (Cephalopoda: Ommastrephidae) due to changing environmental conditions. ICES Journal Marine of Science 57:24-30. [ Links ]
Smith, P. E. & S. L. Richardson. 1979. Técnicas modelo para prospección de huevos y larvas de peces pelágicos. Documentos Técnicos de Pesca, FAO. 175 p. [ Links ]
Staaf, D. J., S., S. H. D. Camarillo-Coop, A. C. Haddock, J. Nyack, C. A. Payne, B. A. Salinas- Zavala, L. Seibel, Trueblood, C. Widmer & W. F. Gilly. 2008. Natural egg mass deposition by the Humboldt squid (Dosidicus gigas) in the Gulf of California and characteristics of hatchlings and paralarvae. Journal of the Marine Biology Ass. U. K. 88: 759-770. [ Links ]
Sweeney, M. J., C. F. E. Roper, K. M. Mangold, M. R. Clarke & S. Boletzky. 1992. "Larval" and juvenile cephalopods: A manual for their identification. Smithsonian Contribution to Zoology 513: 1-282. [ Links ]
Trasviña, A. & D. Barton. 1997. Los Nortes del Golfo de Tehuantepec: Dinámica del Océano Costero. In: M. F. Lavín (Ed.). Contribuciones a la Oceanografía Física en México. Monografía No. 3, Unión Geofísica Mexicana, pp. 25-46. [ Links ]
Vecchione. M. 1987. Juvenile ecology. In: Boyle, P. R. (Ed.). Cephalopod life cycles. Volumen II, Comparative reviews. Academic Press, London, pp. 61-84. [ Links ]
Vecchione, M. 1999. Extraordinary abundance of squid paralarvae in the tropical eastern Pacific Ocean during El Niño of 1987. Fisheries Bulletin 97: 1025-1030. [ Links ]
Vecchione, M., C. F. E. Roper, M. J. Sweeney & C. C. Lu. 2001. Distritibution, relative abundance and developmental morphology of paralarval cephalopods in the Western North Atlantic Ocean. NOAA Technical Report NMFS 152. Washington. U.S.A. 54 p. [ Links ]
Voss, N. A. 1980. A generic revision of the Cranchiidae (Cephalopoda: Oegopsida). Bulletin of Marine Science 30 (2): 365-412. [ Links ]
Waluda, C. M., P. G. Rodhouse, G. P. Podestá, P. N. Trathan & G. J. Pierce. 2001. Surface oceanography of the inferred hatching grounds of Illex argentinus (Cephalopoda: Ommastrephidae) and influences on recruitment variability. Marine Biology 139: 671-679. [ Links ]
Wormuth, J. H. & C. F. E. Roper. 1983. Quantitative sampling of oceanic cephalopods by nets: problems and recommendations. Biology and Oceanography 2: 357-377. [ Links ]
Yamamoto, J., T. Shimura, R. Uji, S. Masuda, S. Watanabe & Y. Sakurai. 2007. Vertical distribution of Todarodes pacificus (Cephalopoda: Om-mastrephidae) paralarvae near the Oki Islands, southwestern Sea of Japan. Marine Biology 153: 7-13. [ Links ]
Yatsu, A., R. Tafur, & C. Maravi. 1999. Embryos and rhynchoteuthion paralarvae of the jumbo flying squid Dosidicus gigas (Cephalopoda) obtained through artificial fertilization from Peruvian waters. Fisheries Science 65: 904-908. [ Links ]
Young, R. E. 1972. The systematic and areal distribution of pelagic cepha-lopods from the seas off southern California. Smithsonian Contribution Zoological 97: 1-159 [ Links ]
Young, J. Z. 1977. Brain, behaviour and evolution of cephalopods. Symposium of Zoological Society of London 38: 377-434. [ Links ]
Young, R. E. & R. F. Harman. 1988. "Larva", "paralarva" and "subadult" in cephalopod terminology. Malacologia 29 (1): 201-207. [ Links ]
Young, R. E. & J. Hirota. 1990. Description of Ommastrephes bartramii (Cephalopoda: Ommastrephidae) paralarvae with evidence for spawning in Hawaiian waters. Pacific Science 44:71-80. [ Links ]














