Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.23 no.2 Ciudad de México Mai./Ago. 2013
Parches del zooplancton asociados con dos florecimientos algales nocivos en Bahía de Banderas
Zooplankton patchiness associated with two harmful algal blooms in Bahia de Banderas
Luis Clemente Jiménez-Pérez, María del Carmen Cortés-Lara y Amílcar Levy Cupul-Magaña
Universidad de Guadalajara. Centro Universitario de la Costa. Av. Universidad de Guadalajara No. 203 Delegación Ixtapa. Puerto Vallarta, Jalisco. 48280. México. e-mail: jimenezluisc@yahoo.com.mx.
Recibido: 3 de septiembre del 2012.
Aceptado: 11 de enero de 2013.
RESUMEN
Muestreos rutinarios del plancton de Bahía de Banderas permitieron detectar dos eventos de Mirionecta rubra y Pseudo-nitzschia sp durante 2011. Para identificar las poblaciones de zooplancton más representativas asociadas con el primer evento, se recolectaron catorce unidades de muestras a lo largo de la zona costera, incluyendo dos réplicas sobre la mancha. Los arrastres se hicieron con una red estándar de 40 cm de diámetro de boca y malla de 335 μ. Las máximas abundancias de zooplancton no se registraron en la zona de mayor coloración. De manera contrastante, la recolección de una muestra de agua durante el segundo evento hizo evidente una elevada abundancia de zooplancton que alcanzó un valor de 5 millones de ind/m3, un valor inusual en zooplancton epipelágico del Pacifico mexicano. Esta abundancia fue al menos tres órdenes de magnitud más alta que las registradas en otros parches reportados en diversas zonas costeras del Océano Pacifico. La estructura del zooplancton de ambos eventos fue dominada por el copépodo Acartia tonsa. Eventos intermitentes persistieron localmente hasta finales de abril, cuando se detectó el varamiento de peces globo en las playas. La secuencia de estos eventos parece estar asociada con la ocurrencia de surgencias previamente reportadas en la región de Cabo Corrientes.
Palabras clave: Acartia tonsa, copépodos, mareas rojas, Pseudo-nitzschia, zooplancton.
ABSTRACT
Routine samplings of the Bahia de Banderas plankton communities allowed to detect two Mirionecta rubra y Pseudo-nitzschia sp red tides events during 2011. In order to identify the most representative zooplankton populations associated with the first event, fourteen standard zooplankton tows were made, including two replicates in the reddest waters. Tows were made with a standard net of 40 cm mouth diameter, and 335 μ mesh size. The highest zooplankton abundance was not recorded in the most colored waters. On the contrary, a sample collected in the most colored waters during the second event revealed a high zooplankton abundance of 5 million ind/m3, which is an unusual density value for the epipelagic zooplankton in the Mexican Pacific. This abundance was at least three orders of magnitude higher than those recorded in other epipelagic zooplankton patches in the Pacific Ocean coastal zone. The zooplankton community structure of both events was dominated by the calanoid copepod Acartia tonsa. Red tide events persisted locally until the end of April, when stranded globe fish were detected on the beach. The sequence of these events appears to be associated with the occurrence of upwellings previously reported in the Cabo Corrientes area.
Key words: Acartia tonsa, copepods, Pseudo-nitzschia, red tides, zooplankton.
INTRODUCCIÓN
Las interacciones entre el zooplancton y los florecimientos algales nocivos (FANs) han sido ampliamente estudiadas en las últimas décadas a nivel mundial (Turner & Tester, 1989; Beier & Buskey, 1997; Huntley et al., 1986; Uye & Takamatzu, 1990). Sin embargo, la mayoría de las investigaciones se han efectuado en condiciones de laboratorio. Entre los pocos estudios de campo realizados sobre este tema, se cuenta una caracterización del zooplancton de un FAN dominado por Mirionecta rubra Lohmann, 1908, Cochlodinium sp. y Gymnodinium catenatum Graham, que fue registrado en Bahía de Banderas durante 2001. Al analizar unas muestras de este evento, Gómez et al. (2002) reconocieron la presencia de seis especies y ocho géneros de copépodos. Sin embargo, no se efectuaron determinaciones de sus niveles de abundancia, ni se especificó el número y posición de esas muestras en relación con la marea roja.
Por otra parte, estudios efectuados en el campo presentan situaciones contradictorias. Por ejemplo, en la costa occidental de Baja California, las mareas rojas parecen estar asociadas con la proliferación del zooplancton (Jiménez Pérez, 1999), pero en otras ocasiones la abundancia de zooplancton permanece baja a pesar de la fuerte coloración de las aguas (Jiménez Pérez, 2000). Esta baja correlación espacio-temporal entre algunos FANs y la abundancia de zooplancton herbívoro podría tener varias interpretaciones. Por una parte, podría estar relacionada con el tiempo de respuesta del zooplancton, pues las poblaciones del zooplancton herbívoro no se incrementan al ritmo del fitoplancton. Típicamente, el tiempo de desarrollo del zooplancton herbívoro varía de una semana a meses (Maier, 1989; Peterson & Painting, 1990). Esto significa que las aguas de una marea roja pueden contener pocos herbívoros en su fase inicial, pero si el evento persiste, se podrá dar el caso de que las altas abundancias de fitoplancton y zooplancton coexistan. Por otro lado, hay que considerar el problema de la variabilidad espacial, pues tanto el fitoplancton como el zooplancton se distribuyen en parches de diferentes escalas espaciales y temporales (Haury et al., 1978; Mackas et al., 1985). Por ello, es posible que los patrones espaciales del fitoplancton y zooplancton no coincidan, pues los parches de zooplancton herbívoro podrían estar ubicados en la periferia de una mancha.
Los estudios de laboratorio también han encontrado resultados contradictorios, pues se ha observado que algunos copépodos consumen fitoplancton tóxico sin presentar daños aparentes (Turner & Tester, 1989), mientras que en otras ocasiones presentan cierto rechazo (Beier & Buskey, 1997), lo que parece estar asociado con la toxicidad de los elementos que constituyen un FAN (Huntley et al., 1986; Uye & Takamatzu, 1990). Considerando estas dos posibilidades, se podría esperar que cuando los FANs puedan ser utilizados como alimento por el zooplancton herbívoro, podrían causar un incremento en la producción de huevos relacionado con la alta disponibilidad de alimento (e.g. Palomares-García et al., 2006) y provocar un incremento de las poblaciones del zooplancton herbívoro. Por el contrario, también se podría esperar una disminución poblacional y de las tasas de pastoreo por el rechazo de los FANs como fuente de alimento y sus implicaciones en la fecundidad del zooplancton (Delgado & Alcaraz, 1999; Cullomb & Buskey, 2004), ya que la ingestión de fitoplancton tóxico puede causar parálisis y en ocasiones incluso la muerte de algunos consumidores (Delgado & Alcaraz, 1999). Sin embargo, esto no ha sido fácil de probar en los estudios de campo.
El principal objetivo de esta investigación fue identificar las características estructurales del zooplancton asociado con la ocurrencia de dos eventos de marea roja detectados en Bahía de Banderas durante 2011. En particular, se pretende estimar los niveles de abundancia del zooplancton total, así como de los grupos taxonómicos y poblaciones de herbívoros más representativos de esos eventos.
Área de estudio. Bahía de Banderas (Badeba) se localiza en el Pacífico central mexicano, entre los 20°07' y 21°08' N y 105°10' y 105°45' O. Cuenta con una extensión aproximada de 1,344 km2, producto de sus 32 km de anchura promedio en el eje norte-sur y casi 42 km de longitud en eje este-oeste. El régimen de mareas de Badeba tiene un carácter mixto con una componente semidiurna (Filonov, 2000), y la circulación predominante de las aguas costeras es hacia el noroeste (Moncayo-Estrada et al., 2006). La parte Norte de la bahía se caracteriza por ser somera, incrementándose la profundidad gradualmente hacia el Suroeste, hasta alcanzar profundidades de varios cientos de metros entre Mismaloya y Cabo Corrientes. La geomorfología de la costa presenta planicies anchas y de bajo relieve con estrechas playas arenosas en la parte norte, así como cañones escarpados y rocosos con relieves costeros altos en la parte sur.
MATERIALES Y MÉTODOS
Para documentar la estructura del zooplancton asociado con la marea roja detectada el 9 de febrero de 2011, se realizaron 2 arrastres verticales sobre la mancha y otros 12 arrastres adicionales a lo largo de la costa (Fig. 1). Las muestras fueron recolectadas con una red estándar de 335 μm de luz de malla y 40 cm de diámetro de boca, efectuando arrastres verticales entre la superficie y las cercanías del fondo. En las áreas más profundas los arrastres se hicieron entre los 10 m de profundidad y la superficie. El material biológico recolectado fue preservado con formol a una concentración final del 4%.

De manera paralela se realizó un monitoreo del fitoplancton asociado con los florecimientos algales detectados en este periodo. Estas muestras fueron tomadas a nivel superficial con una botella Van Dorn de 1 litro, directamente sobre las zonas de mayor coloración. Las muestras se preservaron con acetato-lugol 1:100 ml y se depositaron en botellas de plástico de 50 ml. La revisión visual de una muestra, recolectada en la mancha detectada el 10 de marzo de 2011, hizo evidente la inusual abundancia de organismos del zooplancton.
La abundancia fitoplanctónica se determinó por medio del método Utermbl (Hasle, 1978), homogeneizando la muestra y sedimentando por 24 h en cámaras compuestas de 10 ml, así como en cámaras Sedgewick Rafter y marcadas con recuadros de 1 mm2 como marco de referencia. Los conteos se realizaron en un microscopio de objetivos invertidos Carl Zeiss con iluminación de contraste de fase (Hasle, 1978). Para confirmar la identificación de algunas especies se observaron detalles de su morfología externa con un microscopio electrónico de barrido JEOL JSM S410LV.
Casi todas las muestras de zooplancton fueron analizados en su totalidad. Solo en las recolectadas en la entrada a la Marina de Puerto Vallarta y en la desembocadura del río Ameca fue necesario recurrir al submuestreo debido a la gran cantidad de material recolectado. En este caso se utilizó una pipeta Stempel de 5 ml de capacidad para obtener una alícuota que contuvieran cuando menos 400 individuos, cantidad suficiente para obtener un nivel de cuantificación adecuado desde el punto de vista estadístico (Frontier, 1981). Los organismos contenidos en las submuestras fueron depositados en una caja de Petri reticulada, identificados y contados con la ayuda de un microscopio estereoscópico.
La identificación y conteo de los organismos se efectuó a nivel de grupos taxonomicos (e.g., copépodos, quetognatos, medusas, entre otros), solamente los copépodos y cladóceros se identificaron a nivel de especie con la ayuda un microscopio compuesto. La identificación de los copépodos se realizó tomando como referencia los trabajos de Grice (1961), Brodsky (1967) y Palomares-García et al. (1998). Para identificar las poblaciones del zooplancton asociadas con el evento detectado el 10 de marzo de 2011, la muestra de agua recolectada en ese sitio fue filtrada con una malla de 335 μm y observada bajo un microscopio estereoscópico. La identificación y conteo de estos organismos se efectuó siguiendo el mismo procedimiento.
Los datos crudos fueron procesados utilizando diferentes técnicas de análisis multivariado contenidas en el programa PRIMER (Clarke & Warwick, 2001). Para reducir el efecto de la variabilidad espacial de los patrones de abundancia de zooplancton, los datos fueron transformados utilizando la raíz cuadrada de los datos (Krebs, 1989). Los grupos taxonómicos más representativos del primer evento fueron identificados mediante un análisis de Similitud porcentual (SIMPER), considerando aquellos que contribuyeron con el 95% de la similitud observada entre las muestras colectadas. Posteriormente se efectuó una clasificación de los datos, aplicando un análisis de agrupamientos que fue seguido por el Análisis de Escalamiento Multidimensional (MDS). La significancia de esos grupos fue determinada mediante el Análisis de Similitudes (ANOSIM), seguido por el análisis SIMPER, que permitió identificar los grupos taxonómicos y especies más representativos de cada grupo. A partir de los conteos, se efectuaron estimaciones de abundancia, mismas que fueron estandarizadas a 1 m3 de agua filtrada. Estos datos fueron utilizados para describir la distribución espacial del zooplancton total, así como de los grupos más representativos con la ayuda del programa Golden Software (Surfer 8).
RESULTADOS
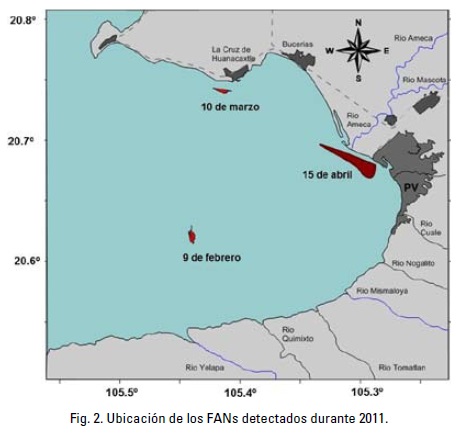
Proliferaciones algales nocivas. Durante 2011 se registraron cuando menos seis eventos de mareas rojas en la Bahía de Banderas. Sin embargo, sólo en dos eventos fue posible recolectar muestras de zooplancton. El primer evento se detectó el 9 de febrero en el centro de la bahía, mientras que el otro el 10 de marzo, cerca de la costa (Fig. 2). Un tercer evento se detectó durante la segunda semana de abril. El evento de febrero fue ocasionado por la proliferación de Mirionecta rubra, mientras que el de marzo fue ocasionado por la proliferación de la diatomea Pseudo-nitzschia sp. Estos eventos alcanzaron abundancias superiores a los 2 y 7 millones de cels.l-1, respectivamente (Tabla 1). El evento detectado en abril fue ocasionado por la proliferación de Dinophysis rotundata Claparéde & Lachmann (Tabla 1). El desarrollo de este último FAN causó una mortandad de peces de cierta consideración que se detectaron varados en las playas. Las poblaciones más afectadas fueron de peces globo, Diodon holocantus Linneaus 1758.

Abundancia de zooplancton. En el muestreo de febrero se detectó un gran parche de zooplancton que abarcó una amplia zona ubicada entre las estaciones 1 y 14, situadas enfrente de la desembocadura del río Ameca y en la entrada a la dársena del puerto, respectivamente (Fig. 3). En esas dos estaciones los niveles de abundancia de zooplancton total alcanzaron valores de 17 x 103 y 15 x 103 ind/ m3, respectivamente. No obstante, estos valores resultan bajos si se comparan con la densidad detectada en la muestra recolectada el 10 de marzo, que alcanzó una densidad de 5 x 106 ind/m3 (Tabla 2). La estructura del zooplancton de este parche fue dominado por copépodos (Figs. 4), siendo Acartia tonsa Dana, 1849, especie dominante (Tabla 2). En la estación 14 también se detectaron importantes densidades de cladóceros, medusas y larvas de gasterópodos.


El SIMPER indicó que la estructura del zooplancton detectado durante el evento de febrero fue dominado por los copépodos. Estos organismos representaron aproximadamente el 90% de todos los organismos capturados en la bahía durante este muestreo, y aproximadamente el 95% de los organismos capturados en el área donde se registró la coloración rojiza de las aguas. Otros grupos taxonómicos que se ubicaron entre los tres más importantes en el orden jerárquico de abundancia fueron los cladóceros y quetognatos.
Los tres grupos taxonómicos más representativos presentaron patrones espaciales distintos. Por ejemplo, en los copépodos se detectaron dos parches de alta abundancia; el más importante, de aproximadamente 10 × 103 ind/m3 estuvo situado en la estación 14, ubicada en la entrada a la dársena de Puerto Vallarta, y otro de 9 × 103 ind/m3, estuvo en la estación 4, ubicada en las inmediaciones del poblado La Cruz (Fig. 5). Los cladóceros también fueron más abundantes en la estación 14, alcanzando una densidad de 5000 ind/m3 (Fig. 6), mientras que los quetognatos presentaron parches de 340 ind/m3 y 250 ind/m3 en las estaciones 3 y 14, respectivamente (Fig. 7).



El análisis de agrupamientos por estación de muestreo, dio como resultado la formación de tres grupos faunísticos. El Grupo I formado por las estaciones Nogalito, Río Cuale y Sheraton y el Grupo II por las dos estaciones Ameca y Entrada. El tercer grupo (Grupo III) estuvo integrado por el resto de las estaciones (Fig. 8). El análisis MDS mostró una situación similar (Fig. 9). Por su parte el ANOSIM indicó que las diferencias en la composición taxonómica de esos agrupaciones fue significativa (R = 0.987; p < 0.05). La estructura taxonómica del grupo I estuvo constituida principalmente por copépodos (78%) y cladóceros (10%), pero también por quetognatos, medusas y larvas de decápodos. En contraste, la estructura del Grupo II que representa el parche, estuvo constituida principalmente por dos grupos: copépodos (82%) y cladóceros (13%). Por otra parte la estructura del Grupo III presentó una mayor dominancia del grupo de los copépodos (95%), que fue acompañada por los quetognatos (1.17%) como grupo representativo.

La estructura comunitaria del parche detectado el 10 de marzo, también presentó una clara dominancia del copépodo A. tonsa, ya que su abundancia relativa representó aproximadamente el 95.0% de todos los animales plactónicos capturados en ese parche (Tabla 2). En el parche del 10 de marzo también se registraron pequeñas poblaciones de los copépodos Centropages furcatus Dana, 1849 y Acartia lilljeborgii Giesbretch, 1889, así como del cladócero Evadne tergestina Claus, 1864 y pocos quetognatos. Sin embargo, estos grupos apenas representaron el 5% de todos los organismos capturados.
DISCUSIÓN
Los resultados obtenidos en esta investigación resultaron hasta cierto punto contradictorios, pero son susceptibles de ser explicados; por una parte, al comparar la ubicación de los patrones espaciales de los grupos dominantes del zooplancton detectado en el parche de febrero, con la localización del núcleo de la marea roja se puede observar que no coinciden. Más aún, la mancha de la marea roja se detectó en una zona donde las abundancias de copépodos, cladóceros y quetognatos fueron bajas. Por el contrario, la elevada densidad de A. tonsa detectada en el centro del evento del 10 de marzo, indicó una coocurrencia entre las abundancias de copépodos y la marea roja que indica una conexión entre la proliferación de las poblaciones de Pseudo-nitzschia sp. y A. tonsa.
En términos generales, se puede considerar que los niveles de abundancia de zooplancton detectados en el parche de febrero fueron notables, pues los valores medidos rebasaron las estimaciones de abundancia de trabajos previos efectuados en la zona costera del Pacifico mexicano. Por ejemplo, Jiménez-Pérez et al. (1988), al estudiar la estructura de un parche del copépodo Calanus pacificus Brodsky, 1948, en la Bahía de Todos Santos, Baja California, estimaron valores de 3 × 103 ind/nf. Smith et al. (1976) y Fiedler (1982) estudiaron diversas poblaciones del zooplancton costero de los Estados Unidos. En el primer caso, Smith et al. (1976) reportaron parches de Acartia clausi Giesbretch, 1889 y Acartia longiremis (Lilljeborg, 1853) que alcanzaron abundancias promedio de 2143 y 1427 ind/m3 en las costas de Oregon. Por su parte en las costas del sur de California, Fiedler (1983) reportó parches de Calanuspacificusy Oncaea media Giesbretch, 1891 de poco mas de 1000 ind/m3, así como de Acartia tonsa, Clausocalanus jobei Frost & Fleminger, 1968 y Evadne sp. de poco mas de 500 ind/m3. Asimismo, los valores medidos en el parche estudiado en febrero, fueron de magnitud similar a los valores más altos detectados por Jiménez-Pérez et al. (1989) y Jiménez-Pérez y Lara-Lara (1990) en los parches de Acartia tonsa y A. californiensis Trisnat, 1976 en Bahía de Todos Santos y Estero de Punta Banda, Baja California, respectivamente. Jiménez-Pérez et al. (1989) registraron valores máximos de 14 × 103 ind/m3 en mayo, así como entre 10 × 103 y 12 × 103 ind/m3 en julio y agosto, mientras que Jiménez-Pérez y Lara-Lara (1990) reportaron un promedio de 15 × 103 organismos de A. californiensis/m3. Los valores detectados en el parche de febrero fueron también de magnitud similar a lo registrados por Arcos (1981), en un denso parche de Acartia levequei Grice, 1964, en aguas de surgencia frente a la costa occidental de las Islas Galápagos, y fueron un orden de magnitud más altos que los valores registrados en los parches de Acartia tonsa asociados en dos eventos de marea roja, ocasionados por la proliferación de Lingoludinium poliedrum en Bahía de Todos Santos, B. C. durante 1999 y 2000 (Jiménez-Pérez, 1999, 2000).
Por otra parte, los 5 × 106 ind/m3, detectados en el parche de marzo es un valor totalmente inusual para el zooplancton del Pacifico mexicano, pues no solo supera con mucho todas las referencias antes mencionadas, sino que también rebasa ampliamente los valores más altos detectados en los parches de zooplancton de varios sistemas arrecifales de Australia (Emery, 1969; Hamner & Carleton, 1979). Emery (1969) reportó parches de Acartia spinata Esterly, 1911 de 110 × 103 ind/m3, mientras que Hamner y Carleton (1979) reportaron valores máximos de A. australis Farran, 1936, del orden de los 300 × 103 ind/m3. Por lo tanto, puede considerarse que los valores registrados en Badeba se encuentran entre los más altos publicados para el zooplancton tropical no solo a nivel regional, sino mundial.
La separación de las estaciones Entrada y Río Ameca detectadas tanto en el análisis de agrupamientos, como Grupo II, así como en el análisis MDS, indican que la ocurrencia de ese FAN alteró de manera significativa la estructura de las comunidades del zooplancton. Esta alteración no estuvo limitada a las poblaciones de copépodos, cladóceros y quetognatos, sino que también pareció tener un importante efecto en los procesos reproductivos de algunas poblaciones de peces e invertebrados bentónicos tales como los gasterópodos y forónidos, pues la abundancia de larvas de peces alcanzó un valor de 133 larvas/m3 en la desembocadura del Río Ameca, mientras que la de los forónidos registró 200 y 90 larvas/m3 en las estaciones Río Ameca y Entrada, respectivamente.
La clara dominancia de Acartia tonsa en ambos parches, pero sobre todo en el parche causado por Pseudo-nitzschia sp., parece indicar que tales poblaciones de copépodos pudieron utilizar a las diatomeas como alimento. Esta situación es interesante, porque existe una controversia sobre el papel que las diatomeas juegan en las cadenas tróficas marinas. Por un lado, el modelo clásico establece un enlace entre la proliferación del fitoplancton rico en diatomeas y la producción de copépodos (Sverdrup, 1953; Turner, 1984; Mann, 1993). Estudios experimentales han mostrado que las proliferaciones de diatomeas estimulan la alimentación de A. tonsa (Butler & Dam, 1994; Besiktepe & Dam, 2002). Incluso, se ha observado que en ocasiones las tasas de ingestión de diatomeas tóxicas como Pseudo-nitzschia multiseries, llegan a ser más altas que las tasas de ingestión de diatomeas no tóxicas (Lincoln et al., 2001). Por otro lado, otros estudios han cuestionado la importancia de las diatomeas como fuente de alimento de alta calidad para los copépodos, por los efectos nocivos que causan en la producción de huevos y su viabilidad (Kleppel et al., 1991; Ianora et al., 1995, 2003; Star et al., 1996; Miralto et al., 1999, 2003) así como en el desarrollo de embriones y larvas nauplio (Poulet et al., 1995; Uye, 1996). Tomando en cuenta estas consideraciones, se infiere que la proliferación de las poblaciones de A. tonsa en el primer parche pudieran estar relacionadas con la proliferación del ciliado Mirionecta rubra. Por otro lado, las proliferaciones de A. tonsa y Pseudo-nitzschia sp. en el segundo parche, podría tener varias interpretaciones. Por una parte, considerando el tiempo de respuesta que el zooplancton requiere para desarrollarse (e.g. Maier, 1989; Peterson & Painting, 1990), se pudiera pensar que la proliferación de A. tonsa fue ocasionada por uno o varios eventos anteriores que no fueron detectados. Sin embargo, su co-ocurrencia en el espacio y tiempo sugiere la posibilidad de que estas poblaciones de copépodos estuvieran utilizando a Pseudo-nitzschia como alimento.
No existen estudios del comportamiento alimenticio de A. tonsa,y los estudios realizados con A. clausimuestran evidencias contradictorias. Por ejemplo, Miralto et al. (1999, 2003), encontraron que la proliferación de Pseudo-nitzschia delicatissima (Cleve) Heiden reduce la viabilidad de los huevos de Acartia clausi, mientras que los estudios de Maneiro et al. (2005) reportan que el consumo de P. delicatissima y P multiseries, no afecta las tasas de ingestión, mortalidad o producción de huevos de A. clausi.
Se estima que el varamiento de peces globo moribundos en la playa, detectado durante el mes de abril, pudo ser causado por un decremento en la concentración de oxígeno disuelto debido al incremento en la densidad de microalgas durante el florecimiento algal nocivo, pues aunque el dinoflagelado Dinophysis rotundata, la especie fitoplanctónica más representativa de este evento contiene cepas tóxicas (Lee et al., 1989), se considera que solo las cepas japonesas producen toxinas, mientras que las cepas de Norteamérica han demostrado ser no tóxicas (Cembella, 1989). En Badeba ya se han registrado varamientos de peces muertos en años anteriores. Por ejemplo, durante un florecimiento del silicoflagelado Dictyocha californica Schrader et Murray, detectado entre el 16 y el 18 de abril de 2009, así como durante el florecimiento de Eutrieptiella marina da Cunha (2.7 7 9 × 109 cels.l-1), que se presentó entre el 25 y 27 de abril del mismo año (Cortés-Lara et al., 2011). En el primer evento las poblaciones de peces más afectados fueron las sardinas, mientras que en el segundo, se registró una importante mortandad de peces del tipo ojotones (Xenistius californiensis (Steindachner, 1876), peces globo, aguja, pargos, morenas y sardinas (Cortés-Lara et al., 2010). En el año 2010 solo se documentaron dos florecimientos no tóxicos en Bahía de Banderas en abril y diciembre. Las especies responsables fueron Mirionecta rubra con 1.143 × 106 cels.l-1, y las diatomeas Pleurosigma elegans, P. normanii, y P. nicobaricum, con abundancias de 2.01 × 106 cels.l-1. Sin embargo, no se registraron eventos de mortalidad de especies marinas.
Por último, la aparición de los FANs y parches de zooplancton en el periodo-invierno primavera en Bahía de Banderas, parecen tener su origen en la ocurrencia de surgencias de Cabo Corrientes, pues tales eventos ocasionan el surgimiento de agua del fondo que fertiliza las aguas superficiales (e.g. Mann & Lazier, 1991). En esta región las surgencias son producidas por el efecto de los vientos y la dirección de la corriente predominante durante condiciones de invierno y primavera (Roden, 1972; Torres-Orozco et al., 2005). Sus efectos han sido identificados y medidos en el incremento de la producción primaria (López-Sandoval et al., 2009a, 2009b) que en ocasiones cubre una amplia región de la costa norte de Jalisco y Sur de Nayarit, incluyendo Badeba (e.g. Figs. 5a, 5b-5c de López-Sandoval et al., 2009b). Por lo tanto, la ocurrencia de los FANs detectados en esta investigación parece ser causada por los eventos de surgencias en Cabo Corrientes. Todo parece indicar que las surgencias que fertilizan las aguas de Badeba, estimulan la proliferación de diferentes especies del fitoplancton y a su vez, estas estimulan la actividad alimenticia y reproductiva de las poblaciones de herbívoros, siendo las poblaciones A. tonsa las que parecen tener una mayor capacidad de respuesta para aprovechar la alta disponibilidad de fitoplancton.
REFERENCIAS
Arcos, F. 1981. A dense patch of Acartia levequei (Copepods: Calanoida) in upwelled Equatorial Undercurrent waters around the Galapagos Islands. Coastal and Estuaries 1: 427-432. [ Links ]
Beier, C. F. & E. J. Buskey. 2007. Effects of the red tide dinoflagellata Karenia brevis on grazing and fecundity in the copepod Acartia tonsa. Journal of Plankton Research 29 (2): 115-126. [ Links ]
Besiktepe, S. & H. G. Dam. 2002. Coupling of ingestion and defecation as a function of diet in the copepod Acartia tonsa. Marine Ecology Progress Series 229: 151-164. [ Links ]
Brodsky, K. 1950. Calanoida of the far eastern seas and polar basins of the USSR. Key to the fauna of the USSR No. 35 Zoological Institute Russian Academy of Science. USSR (Translated from Russian by the Israel Program for Scientific Translations. Jerusalén 1967). 440 p. [ Links ]
Butler, M. & H. G. Dam. 1994. Prodution rates and characteristics of fecal pellets of the copépod Acartia tonsa under simulated phytoplankton blooms conditions: implications for vertical fluxes. Marine Ecology Progress Series 114: 81-91. [ Links ]
Cembella, A. D. 1989. Occurrence of okadaic acid, a major diarrheic shelsifh toxin in natural population of Dinophysis spp from the eastern coast of North America. Journal of Applied Phicology 1: 307-301. [ Links ]
Clarke, K. R. & R. M. Warwick. 2001. Change in marine communities: An approach to statistical analysis and interpretation. Plymouth Marine Laboratory, U.K., 144 p. [ Links ]
Cortés-Lara, M. C., R. Alonso Rodríguez & A. L. Cupul-Magaña. 2010. Eutrieptiella marina (Euglenophyceae) bloom causes significant fish kills in Banderas Bay, Jalisco, Mexico. Harmful Algae News 42: 12-13. [ Links ]
Cortés-Lara, M. C., R. Cortés-Altamirano & A. L. Cupul-Magaña. 2011. Kill fish by Dichtyocha califórnica in Banderas Bay, Jalisco Mexico. Harmful Algae News 43: 14-15. [ Links ]
Cullomb, C. J. & E. J. Buskey. 2004. Effects of the Toxic Red Tide Dinoflagellate (Karenia brevis) on Survival, Fecal Pellet Production and Fecundity of the Copepod Acartia tonsa. In: Steidinger, K. A., J. H. Landsberg, C. R. Tomas & G. A. Vargo (Eds.). Harmful Algae 2002. Florida Fish and Wildlife. Conservation Commission, Florida Institute of Oceanography, and Intergovernmental Oceanographic Commission of UNESCO, pp. 44-46. [ Links ]
Delgado, M. & M. Alcaraz. 1999. Interactions between red tides microalgae and herbivorous zooplankton: the noxious effect of Gyrodinium corsicum (Dinophyceae) on Acartia grani (Copepods: Calanoida). Journal of Plankton Research 21 (12): 2361-2371. [ Links ]
Emery, A. R. 1969. Preliminary observations on coral reef zooplankton. Limnology and Oceanography 13: 293-303. [ Links ]
Filonov, A. E. 2000. Internal tide and tsunami waves in the continental shelf of the Mexican wetern coast. Oceanography of the Eastern Pacific 1: 31-45. [ Links ]
Fiedler, E. P. 1983. Fine scale spatial patterns in the coastal epiplankton off California. Journal of Fisheries Research Board Canada 30: 811-815. [ Links ]
Frontier, S. 1981. Cálculo del error en el recuento de organismos planctónicos. In: Bolvstoskoy, D. (Ed.). Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata Argentina, pp. 163-167. [ Links ]
Gómez, A., S., L. A. Ocaña. & M. Sánchez. 2002. Epiplancton y proliferación multiespecífica de microplancton (marea roja) en la bahía de Banderas, Nayarit. Abril del 2001. Resúmenes XII Reunión Nacional de la Sociedad Mexicana de Planctología. 6-9 de Mayo. Xalapa, Veracruz, p. 34. [ Links ]
Grice, D. G. 1961. Calanoid copepods from equatorial waters of the Pacific Ocean. Fish and Wildlife Service. Special Scientific Report Fisheries 61 (186): 167-246. [ Links ]
Hamner, W. M. & J. H. Carleton. 1979. Copepod swarms: Attributes and role in coral reef ecosystems. Limnology and Oceanography 24 (1): 1-14. [ Links ]
Hasle, G. R. 1978. Using the inverted microscope. In: Sournia, A. (Eds.). Phytoplankton Manual. UNESCO. Paris. pp. 191-196. [ Links ]
Haury, L. R., J. A. McGowan & P. A Wiebe. 1978. Patterns and processes in the time-scales of plankton distributions. In: Steele, J. H. (Ed.). Spatial patterns in plankton communities. Plenum pres. New York, p. 277-327. [ Links ]
Hewitt R. 1981. The value of pattern in the distribution of young fish. P-V Rapport Counsil International Exploration Mer 178: 228-236. [ Links ]
Huntley, M. E., P. Sikes, S. Roman & V. Marin. 1986. Chemically-mediated rejection of dinoflagellate prey by the copepods Calanus pacificus and Paracalanus parvus: a mechanism, occurrence and significance. Marine Ecology Progress Series 59: 97-107. [ Links ]
Ianora, A., S. A. Poulet & A. Miralto. 1995. A comparative study of the inhibitory effect of diatoms on the reproductive biology of the copepod Temora stylifera. Marine Biology 121: 533-539. [ Links ]
Ianora, A., S. A. Poulet & A. Miralto. 2003. The effects of diatoms on copepod reproduction: a reiew. Phycologia 42 (2): 351-365. [ Links ]
Jiménez-Pérez, L. C., M. Mancilla-Peraza & G. M. Martínez-García. 1988. Agrupamiento superficial diurno de Calanus pacificus (Brodsky) en la Bahía de Todos Santos, Baja California. Ciencias Marinas 14 (3): 77-90. [ Links ]
Jiménez-Pérez, L. C. 1989. Variación temporal del zooplancton de la Bahía de Todos Santos Baja California. Ciencias Marinas 15 (3): 81-96. [ Links ]
Jiménez-Pérez, L. C. & J. R. Lara-Lara. 1990. Distribución de biomasa y estructura de la comunidad de zooplancton en el Estero de Punta Banda. Ciencias Marinas 16 (1): 35-48. [ Links ]
Jiménez Pérez, L. C. 1999. Monitoreo del zooplancton costero de la Bahía de Todos Santos, Baja California. Reporte Técnico. Estación de investigación oceanográfica de la Secretaría de Marina. 23 p. [ Links ]
Jiménez Pérez, L. C. 2000. Monitoreo del zooplancton costero de la Bahía de Todos Santos. Reporte Técnico. Estación de investigación oceanográfica de la Secretaría de Marina. 27 p. [ Links ]
Kleppel, G. S. D. V. Holliday & R. E. Piper. 1991. Trophic interactions between copepods and microplankton: a question about the role of diatoms. Limnology and Oceanography 36: 172-178. [ Links ]
Krebs, C. J. 1989. Ecological Methodology. New York. Harper and Row. 654 p. [ Links ]
Lee, J. S., T. Iragashi, S. Fraga, E. Dahl, P. Hougaardt & T. Yasumoto. 1985. Determination of diarrhetic shellfish toxins in various dinoflagellate species. Journal of Applied Phycology 1: 147-152. [ Links ]
Lincoln, J. A., J. J. Turner, S. S. Bates, C. Leger & D. A. Gauthier. 2001. Feeding, egg production and egg hatching success of the copepods Acartia tonsa and Temora longicornis on diets of the toxic Pseudo-nitzschia multiseries and the non-toxic Pseudo-nitzschia pungens. Hydrobiologica 453/454 (1): 107-120. [ Links ]
López-Sandoval, D., J. R. Lara-Lara, S. Álvarez-Borrego. 2009a. Producción primaria fitoplanctónica por sensores remotos en la región frente a Cabo Corrientes, México. Hidrobiológica 19 (3): 185-192. [ Links ]
López-Sandoval, D., J. R. Lara-Lara, M. F. Lavín, S. Álvarez-Borrego & G. Gaxiola-Castro. 2009b. Productividad primaria en el Pacifico oriental tropical adyacente a Cabo Corrientes, México. Ciencias Marinas 35 (2): 169-182. [ Links ]
Mackas, D. L., K. L. Denman & M. R. Abbott. 1985. Plankton patchiness: biology in the physical vernacular. Bulletin of Marine Science 37: 652-674. [ Links ]
Maier, G. 1989. The effect of temperature on development time of eggs, naupliar and copepodite stages of five species of cyclopoid copepods. Hydrobiologia 184: 79-88. [ Links ]
Maneiro, I., P. Iglesias, C. Guisande, I. Riveiro, A. Barreiro, S. Zervoudaki & E. Graneli. 2005. Fate of domoic acid ingested by the copepod Acartia clausi. Marine Biology 148: 123-130. [ Links ]
Mann, K. H. 1993. Physical oceanography, food chains and fish stocks: a review. ICES Journal of Marine Sciences 50: 105-119. [ Links ]
Mann, K. H. & J. R. N. Lazier. 1991. Dynamic of Marine Ecosystems. Blackwell Science Publications, Boston, 466 p. [ Links ]
Moncayo-Estrada, R., J. L. Castro-Aguirre & J. De la Cruz-Agüero. 2006. Lista Sistemática de la Ictiofauna de Bahía de Banderas, México. Revista Mexicana de Biodiversidad 77: 67-80. [ Links ]
Palomares-García, R., E. Suárez Morales & S. Hernández Trujillo. 1998. Catálogo de los copépodos (crustácea) pelágicos del Pacífico Mexicano. Centro Interdisciplinario de Ciencias Marinas (CICIMAR-IPN)/ Colegio de la Frontera Sur. México. 352 p. [ Links ]
Palomares-García, R. J. Bustillos, C. J. Brand-Schmidt, D. López-Cortes & B. Lukas. 2006. Efecto del dinoflagelado tóxico Gymnodinium catenatum sobre el consumo, la producción de huevos y la tasa de eclosión. Ciencias Marinas 32 (1): 111-119. [ Links ]
Peterson, W. T. & S. Painting. 1990. Development rates of the copepods Calanus australis and Calanoides carinatus in laboratory, with discussion of methods used for calculation of development times. Journal of Plankton Research 12 (2): 282-293. [ Links ]
Poulet, S. A., M. Laabir, A. Ianora & A. Miralto. 1995. Reproductive response of Calanus helgolandicus. Abnormal embryonic and naupliar development. Marine Ecology Progress Series 129: 85-95. [ Links ]
Roden, G. 1972. Thermohaline structure and baroclinic flow across the Gulf entrance and the Revillagigedo Islands region. Journal of Physical Oceanography 2: 177-183. [ Links ]
Stabeno, P. J., J. D. Schumacher, K. M. Bailey, R. D. Brodeur & E. D. Cokelet. 1996. Observed patches of walleye pollock eggs and larvae in Shelikof Strait, Alaska: their characteristics, formation and persistence. Fisheries Oceanography 5: 81-91. [ Links ]
Star, M., J. A. Runge & J. C. Therriault. 1996. Harmful effects on certain diatoms on the reproductive success of copepods. In: Penney, R. W. (Ed.). Proceedings of the Fifth Canadian Workshop on Harmfull Marine Algae. Canadian Technical Report of Fisheries and aquatic Sciences. pp. 128-134. [ Links ]
Smith, R. L., Ch. B. Miller & R. L. Holton. 1976. Small scale horizontal distribution of coastal copepods. Journal of Experimental Marine Biology and Ecology 23: 241-253. [ Links ]
Sverdrup, H. U. 1953. On conditions for the vernal blooming of phytoplankton. Journal of the Council International exploration Mer 18: 287-295. [ Links ]
Torres-Orozco, E., A. Trasviña, A. Muhlia-Melo & S. Ortega-García. 2005. Mesoscale dynamics and yellowfin tuna catches in the Mexican Pacific. Ciencias Marinas 31 (4): 671-683. [ Links ]
Turner, J. T. 1984. The feeding ecology of some zooplankters that are important prey ítems of larval fish. NOAA technical Report NMFS 7. 28 p. [ Links ]
Turner, J. T. & E. Graneli. 1992. Zooplankton feeding ecology: grazing during studies of phytoplankton blooms from the west coast of Sweden. Journal of Experimental Marine Biology and Ecology 157 (1): 19-31. [ Links ]
Turner, J. T. & P. A. Tester. 1997. Toxic marine phytoplankton, zooplankton grazers and pelagic food webs. Limnology and Oceanography 42 (5): 1203-1214. [ Links ]
Uye, S. I. 1996. Induction of reproductive failure in the planktonic copepod Calanus pacificus by diatoms. Marine Ecology Progress Series 133: 89-97. [ Links ]
Uye, S. I. & K. Takamatzu. 1990. Feeding interactions between planktonic copepods and red-tide flagellates from Japanese coastal waters. Marine Ecology Progress Series 59: 97-107. [ Links ]














