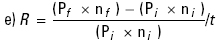Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.22 no.2 Ciudad de México may./ago. 2012
Artículos
Bioenergética de juveniles de langosta de quelas rojas, Cherax quadricarinatus, alimentados con dos dietas artificiales
Bioenergetics of juvenile red claw lobster, Cherax quadricarinatus, fed two artificial diets
Eugenio Díaz-Iglesias,1 Víctor Meza Castillo,2 Marysabel Báez-Hidalgo,1 Ana Denise Re-Araujo3 y Antonio Silva-Loera2
1 Departamento de Acuicultura, Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE), Carretera Ensenada-Tijuana, No. 3918, Baja California, C.P. 22860. México. E-mail: ediaz@cicese.mx
2 Facultad de Ciencias Marinas, Universidad Autónoma de Baja California, Km 103, Carretera Tijuana-Ensenada, Ensenada, Baja California, C.P. 22860, México.
3 Departamento de Biotecnología Marina, CICESE, B.C. México.
Recibido: 17 de octubre de 2011.
Aceptado: 15 de julio de 2012.
RESUMEN
Se evaluó la respuesta metabólica de juveniles de langosta australiana de quelas rojas, Cherax quadricarinatus, alimentados con dos dietas artificiales (Rangen con 35% de proteína y Cherax1 con 32% de proteína de sustrato vegetal), aclimatados a la temperatura preferida de 28 °C en un respirómetro dinámico, midiendo el consumo de oxígeno y la excreción amoniacal durante el ayuno y la alimentación, y determinándose además la mortalidad y el crecimiento. La energía consumida por los juveniles en el alimento (C) fue de (3614.1 ± 591.3 y de 1967 ± 493.8 (J día-1 g-1) con Cherax1 y Rangen respectivamente. La energía eliminada en las heces (F) en los organismos que se alimentaron con Cherax1, equivalente a 42.6 Joules, representó una baja pérdida de energía en la distribución porcentual, presentando una mayor eficiencia metabólica en comparación con la dieta Rangen. El mayor porcentaje de la proteína suministrada a través del alimento ingerido fue canalizado hacia el crecimiento, ya que en los diferentes tratamientos los organismos utilizaron una mezcla de lípidos-proteínas como el principal sustrato energético para cubrir sus requerimientos metabólicos. No se encontraron diferencias en la mortalidad, pero los juveniles alimentados con Cherax1 presentaron un mejor índice de rendimiento, una mayor tasa de crecimiento específica y un incremento en peso 2.2 veces mayor. Los resultados obtenidos demuestran que la dieta experimental Cherax1 puede ser considerada como un alimento de buena calidad y eficiencia para esta especie, por lo que puede sustituir diversas dietas comerciales.
Palabras clave: Balance energético, campo de crecimiento, Cherax quadricarinatus, dietas artificiales, respuesta metabólica.
ABSTRACT
The metabolic response of juvenile Australian red claw lobster, Cherax quadricarinatus, fed two artificial diets (Rangen with 35% protein and Cherax1 with 32% protein of vegetable substrate), acclimated to the preferred temperature of 28 ° C, was evaluated in a dynamic respirometer, measuring oxygen consumption and ammonia excretion during fasting and feeding. Survival and growth were also determined. The energy consumed by juveniles in the food (C) was (mean ± s): 3614.1 ± 591.3 and 1967 ± 493.8 (J day-1 g-1) with Cherax1 and Rangen respectively. Energy eliminated in the feces (F) equivalent to 42.6 Joules by organisms that were fed Cherax1 represented a low energy loss in the percentage distribution, with a higher metabolic efficiency compared to the diet Rangen. The highest percentage of protein supplied through the food was channeled to growth, for all treatments, in which lobsters used a mixture of lipid-protein as the main energy substrate to meet their metabolic requirements. There was no difference in survival, but the juveniles fed Cherax1 had a higher specific growth rate and a 2.2 times higher weight gain than those fed with Rangen. The results show that the experimental diet Cherax1, formulated with plant products, can be considered as a high quality, efficient feed for this species, and that it is a good potential replacement for various commercial diets.
Key words: Artificial diets, Cherax quadricarinatus, energy budget, metabolic response, scope for growth.
INTRODUCCIÓN
En la acuicultura los estudios sobre la nutrición de organismos acuáticos son de gran importancia para el éxito de la producción animal, lo que ha orientado a diseñar alimentos formulados con base en el conocimiento nutricional a nivel bioquímico y fisiológico de las especies a producir (Vega-Villasante et al., 1995; Villareal, 2002). Sin embargo, dietas especializadas para la langosta australiana de quelas rojas (Cherax quadricarinatus Von Martens, 1868), aún no han sido desarrolladas (Garza de Yta et al., 2012).
Las langostas australianas de agua dulce pertenecen a la Familia Parastacidae y se distribuyen únicamente en la región tropical del noreste de Australia (Jones, 1990). Cherax quadricarinatus, presenta un excelente potencial para el cultivo comercial y mercado internacional, ya que dentro de sus principales características se incluyen una tasa de crecimiento rápido, desoves múltiples anuales, comportamiento poco agresivo, tolerancia a condiciones ambientales subóptimas y gran potencial para alcanzar altos precios de mercado (Medley et al., 1994; Gu et al., 1995; Meade & Watts, 1995; Rouse, 1995). Debido a sus características biológicas y su importancia en los cultivos, esta especie ha sido introducida en países del sudeste de Asia, África, Norteamérica y el Caribe. En México, existen las condiciones ambientales adecuadas para el cultivo de la especie, por lo que se ha contemplado su introducción como un buen recurso acuícola con base en su rápido crecimiento y su capacidad de tolerancia a condiciones adversas (Arredondo-Figueroa et al., 1994).
A la fecha, la producción de Cherax en México ha sido limitada, obteniéndose un promedio de 15 toneladas en el año 2000 (Cortés et al., 2002). La investigación realizada desde 1980 sugiere la necesidad de incluir en la dieta ciertos micronutrientes, en particular el colesterol y ciertos ácidos grasos que los crustáceos no tienen, o que poseen una capacidad limitada para sintetizarlos; además son de gran importancia las proporciones de proteínas, lípidos, carbohidratos y algunas sustancias esenciales como vitaminas y minerales (Lee & Wickins, 1992; Villareal, 2002).
El colesterol, es la base en la síntesis de varios esteroides vitales de los organismos; dicho compuesto no puede ser sintetizado por C. quadricarinatus por lo que debe incluirse en la dieta en una concentración no mayor de 0.5% (Kondos, 1990). A pesar de estas investigaciones el conocimiento en la langosta de que-las rojas enfocadas al estudio de su fisiología y nutrición, así como los procesos de alimentación son todavía escasos, lo cual ha limitado el desarrollo del cultivo de esta especie a nivel comercial (Anson & Rouse, 1996).
La temperatura preferida u óptima representa el intervalo de temperatura en donde los organismos pasan más tiempo y con la cual obtienen su mayor crecimiento, logrando que la mayor parte de las funciones fisiológicas se realicen con la mejor eficiencia posible; dicho intervalo puede ser estrecho ó amplio dependiendo de la especie y puede ser afectado por las condiciones ambientales y factores antropogénicos (Lagerspetz, 1974; Reynolds & Casterlin, 1979).
Para determinar la distribución de energía que un organismo utiliza para cubrir sus requerimientos energéticos, se puede realizar un balance energético. Dicho balance es necesario para conocer la eficiencia metabólica de los organismos, las necesidades energéticas, la asimilación y la transferencia de energía obtenida en el alimento consumido (Lucas, 1996). La ecuación de balance energético que puede utilizarse para describir el flujo de energía de los organismos fue propuesta por Klekowski y Duncan(1975). Nelson et al. (1985), incorporaron a la ecuación de balance energético, el costo energético asociado con la digestión y utilización del alimento, que proporciona un incremento en la tasa metabólica debido a los procesos de ingestión, asimilación, transporte, tratamiento bioquímico e incorporación del alimento; factor conocido como incremento de calor aparente (ICA).
Se pronostica, que Cherax quadricarinatus canalizará la energía contenida en la dieta experimental Cherax1 hacia el crecimiento, con mayor eficiencia que la dieta comercial camaroni-na Rangen® con 45% de proteína animal. Esto se fundamenta en el hecho de buscar un contraste marcado en la respuesta metabólica, al comparar una dieta comercial diseñada para camarón con componentes de origen animal, y una dieta práctica y económica elaborada en el laboratorio basada fundamentalmente en elementos de origen vegetal.
MATERIALES Y MÉTODOS
Los organismos juveniles de Cherax quadricarinatus fueron obtenidos de una granja de cultivo comercial de langosta de agua dulce "El Jicarero", ubicada en Cuernavaca, Morelos, y fueron transportados al laboratorio en cajas de polietileno.
Los organismos se pusieron en mantenimiento en estanques ovalados de 2x103 L al exterior, a una temperatura fija de 28 °C ± 1ºC, correspondiente a la temperatura preferida para esta especie (Amador Cano, 2001) Dicha temperatura se mantuvo usando calentadores sumergibles de 1000 Watts conectados a termostatos, con sistema de recirculación de agua dulce, provistos con aireación constante y conectada a un filtro biológico. A los organismos se les proporcionó alimento comercial Rangen 35% dos veces al día y a una proporción del 10% del peso húmedo hasta que alcanzaron un peso de 1.5 - 3.0 g.
De manera aleatoria se seleccionaron 80 juveniles de Che-rax, que se marcaron y se distribuyeron de forma individual en cubetas de plástico las cuales fueron colocadas en cuatro estanques circulares de 500 L, poniendo 20 organismos en cada estanque. Los tratamientos consistieron en dos dietas con 32% y 45% de contenido de proteína y un contenido similar de energía (Tabla 1). Cada una de las dietas se suministró a dos lotes de organismos, predeterminados aleatoriamente; recibiendo el alimento por un periodo de 30 días, tiempo en el cual los organismos de ambos estanques se mantuvieron con aireación, un flujo constante de agua dulce y un régimen de temperatura fija de 28 °C ± 1ºC.Duran-te los experimentos, la temperatura se mantuvo prácticamente constante con variaciones de 0.5 °C, mediante calentadores sumergibles de 1000 Watts, que se conectan a dispositivos reguladores colocados en los estanques circulares de 500 L, provistos de un termómetro digital.
Basándose en lo señalado por Jones y Ruscoe (1996), en relación al hábito alimentario de origen vegetal que Cherax presenta en su ambiente natural, en el presente estudio se elaboró la dieta compuesta Cherax1, obteniendo el análisis bromatológico con ayuda del paquete MIXIT-Win 95/98/NT/2000 © 1995-2001 Agricultural Software Consultans, Inc.; dicha dieta se elaboró usando un tratamiento que incluyó secado, extrusión y peletización.
Tanto los ingredientes, como la dieta elaborada Cherax 1, fueron analizados con objeto de conocer su composición proximal y el contenido calórico, de acuerdo a los métodos descritos más adelante. Los insumos disponibles fueron: 31.5% de harina de trigo, 11.6% de harina de pescado, 28.8% de pasta de soya, 7.3% de gluten de trigo, 1.7% de lecitina líquida, 1.7% de aceite de soya, 0.35% de vitamina C, 0.25% de mezcla vitamínica liquida Omniplus miscelado, 2.8% de alga Spirulina y 14% de zanahoria (Daucus caarota Linneo) como sustrato vegetal. Para determinar el alimento consumido, éste fue proporcionado diariamente a los organismos durante 30 días, el alimento no consumido fue retirado 2 h después de haberse suministrado por medio de un sifón con una malla de 80 μm colocado en el extremo distal del estanque. Dicho alimento remanente se colocó en una estufa a 60 °C para obtener el peso seco. De esta manera el alimento consumido por los organismos se determinó mediante el método gravimétrico considerando la diferencia entre el alimento suministrado y el remanente. El contenido calórico de las dietas artificiales se determinó empleando una bomba calorimétrica PARR.
Las heces se recolectaron diariamente de forma individual después de transcurridas 8 horas de haber recogido el alimento remanente y al día siguiente, antes de dar alimento a los organismos, para lo cual se utilizó la misma técnica empleada en la recolección del alimento remanente. Se obtuvo el peso seco de las heces y se colocaron en un refrigerador para su conservación hasta realizar la determinación del contenido calórico.
Las exuvias, producto de la ecdisis, fueron colectados durante todo el periodo experimental y pesadas para obtener su peso húmedo; además, se etiquetaron y colocaron en una estufa a 60 °C, durante 24 horas para obtener su peso seco. También se mantuvieron en condiciones idóneas para su posterior análisis calorimétrico.
Al término del periodo experimental se calculó el alimento ingerido y la producción de heces durante los 30 días, analizando la respuesta metabólica. Un día antes de comenzar con las mediciones, los organismos fueron colocados en el sistema respirométrico permitiendo así su aclimatación al mismo. Cada organismo fue colocado en un matraz de 1 L y conectado a un sistema semiabierto respirométrico como el descrito por Díaz-Herrera (1989), para medir tanto el consumo de oxigeno de rutina como la excreción amoniacal, en organismos mantenidos en ayuno durante 48 horas, y también el incremento de calor aparente en organismos recién alimentados. Adicionalmente se colocaron dos matraces control que no contenían organismos, con el fin de medir el consumo de oxígeno y la probable producción de amoníaco de los planctontes presentes en el sistema descrito.
La tasa metabólica fue determinada en forma indirecta a través del consumo de oxígeno de los organismos mantenidos en la temperatura preferida, tomando muestras del agua donde se encontraban los organismos y empleando un oxímetro YSI 52 equipado con un sensor polarográfico, en organismos recién alimentados y en organismos con un día de ayuno, alimentando a los organismos durante 2 horas.
La diferencia entre las concentraciones iniciales y finales de oxígeno fue considerada como el consumo de oxígeno de los organismos, el cual se expresó como miligramos de O2 consumido hora-1gr-1. El consumo de oxígeno o respiración (R) se determinó a partir del consumo de oxígeno de los organismos en ayuno.
La medición de la excreción amoniacal de los organismos, se realizó de manera simultánea a la determinación del consumo de oxígeno y en el mismo sistema respirométrico, tomando muestras iniciales y finales de 10 mL de agua, de cada uno de los matraces. La determinación de la concentración amoniacal de las muestras se estimó con el método de azul de indofenol, descrito por Rodier (1981), empleando un espectrofotómetro ELIPTICA 2000, en donde la intensidad del color de la muestra, leído a una longitud de onda de 640 nm era directamente proporcional a la concentración de amoniaco expresada en mg NH3+h-1 g-1 p.s.
La determinación del incremento de calor aparente (ICA), se realizó calculando la diferencia entre el máximo consumo de oxígeno de los organismos alimentados y el consumo de oxigeno de los organismos en ayuno durante un periodo de 48 horas (Beamish & Trippel, 1990). Al término del experimento respirométrico, los organismos se pesaron para obtener su peso húmedo, después se sacrificaron, etiquetaron, y colocaron en una estufa a 60 °C para obtener su peso seco.
Con los datos de los organismos alimentados con las dos dietas expuestos a la temperatura preferida, se calculó el campo de crecimiento, el cuál fue estimado como la diferencia de la energía del alimento consumido, entre la suma de la energía eliminada en la producción de heces, la excreción amoniacal, el consumo de oxígeno-respiración, el incremento aparente de calor y las mudas.
Para determinar del contenido calórico de las muestras obtenidas tanto del alimento suministrado a los organismos, las heces y las mudas, durante la fase experimental, se utilizó una micro bomba calorimétrica PARR, previamente calibrada con ácido benzoico, realizando 3 repeticiones para cada muestra.
El consumo de oxígeno de rutina (R) o respiración y el incremento de calor aparente (ICA), fueron transformados a unidades de energía utilizando el equivalente oxicalórico de 3.53 cal mg-1 de oxígeno consumido (Elliot & Davison, 1975). Los valores de excreción amoniacal se transformaron a energía empleando el equivalente nitró-calórico de 5.73 calorías por gramo de amoniaco excretado (Clifford & Brick, 1979), el consumo de oxígeno, el incremento de calor aparente, la excreción amoniacal, el alimento ingerido, la producción de heces y las mudas, se transformaron a Joules utilizando el factor de conversión de 1 caloría equivalente a 4.1840 Joules (Gnaiger, 1983).
La razón atómica oxígeno-consumido y nitrógeno-excretado (O:N) por los organismos se representó como un índice para determinar cuál de los sustratos metabólicos fue utilizado como fuente principal de energía para cubrir los requerimientos metabólicos de los organismos (Conover & Corner, 1968). Dicho índice fue estimado mediante los valores del consumo de oxígeno y la excreción de amoníaco, obtenidos en el sistema respirométrico. Las tasas fisiológicas determinadas en ambos ensayos experimentales fueron transformadas a átomos-gramo para el cálculo de la razón O:N, utilizando los principios de la termoquímica respiratoria. Con ello, se estimaron las cantidades relativas de lípidos, carbohidratos y proteínas oxidadas que fueron utilizadas como fuente energética por los juveniles de langostas de quelas rojas durante los experimentos.
Los índices de eficiencia de conversión bruta (K1) y de conversión neta (K2), utilizados para los organismos mantenidos en diferentes condiciones experimentales se estimaron con la siguiente fórmula (Klekowski & Duncan, 1975):
Donde:
K1 = índice de eficiencia de conversión bruta;
K2 = índice de eficiencia de conversión neta;
P = energía destinada a formación de biomasa;
E = energía invertida en tejido eliminado (proceso de muda);
C = energía obtenida por el alimento consumido; y
F = energía gastada en la producción de heces.
A los juveniles de Cherax quadricarinatus alimentados con las dietas balanceadas Rangen y Cherax 1, se les midieron las siguientes variables: peso húmedo inicial (g), peso húmedo final (g), incremento en peso húmedo (g), peso seco (g); y los siguientes índices:
a) Tasa de Crecimiento Específica (TCE %): 100* (Ln Pt - Pi)/t
Donde:
Ln Pt: Logaritmo natural del peso al tiempo t
Ln Pi: Logaritmo natural del peso inicial
b) Factor de Conversión Alimenticia (FCA %): 100* [Alimento suministrado (g)/Incremento en peso (g)];
c) Intervalo de Muda (días)
d) Sobrevivencia (%):100* (número final de organismos/número inicial de organismos)
Rendimiento (R g/día) (Díaz-Iglesias et al., 1991):
Donde:
ni = número inicial;
nf = número final;
Pi = Peso inicial en g;
Pf = Peso final en g;
t = tiempo en días.
Los resultados se presentan con la media y el intervalo de confianza al 95%; observándose normalidad y homogeneidad de varianza; las comparaciones de las variables medidas para ambas dietas se realizaron con la prueba "t" de Student (Zar, 1999), usando el programa Statistica 7.
RESULTADOS
Las variables e índices biométricos que indican el desempeño biológico de las langostas de quelas rojas en los experimentos de bioenergética, tales como el incremento en peso, el factor de conversión del alimento y la tasa de crecimiento especifica por tipo de dieta, indicaron que en los tres casos fue favorable la alimentación con la dieta Cherax 1, como puede observarse en la Tabla 2.
Los componentes de la ecuación del balance energético y los índices de eficiencia de conversión, los cuales muestran la eficiencia metabólica de los juveniles de Cherax al utilizar la energía obtenida en el alimento consumido, se presentan en la Tabla 3.
Los valores de energía ingerida del alimento consumido por los organismos a los que se les proporcionó la dieta Cherax 1 fueron casi del doble (p< 0.001) de los organismos alimentados con la dieta Rangen (Tabla 3).
El porcentaje de sobrevivencia de los organismos mantenidos en ambas dietas artificiales durante el periodo experimental fue de 82.5% (Tabla 4).
La energía derivada al metabolismo de rutina en los juveniles alimentados con la dieta Rangen fue de 3.75%, mientras que los organismos alimentados con la dieta Cherax 1, demandaron 2.19% de la energía obtenida a través del alimento, para cubrir el gasto energético causado por la respiración (Fig. 1). No se encontraron diferencias significativas (p> 0.05) en el gasto de la energía empleada para el metabolismo por consumo de oxígeno por parte de los organismos en las diferentes dietas experimentales (Tabla 3).
En los organismos mantenidos en las condiciones experimentales, la energía perdida a través de la producción de heces (F) representó el 1.13% para la dieta Rangen y de 1.18% para Cherax 1 (Fig. 1). Entre ambas dietas se encontraron diferencias significativas (p< 0.05) en la cantidad de energía eliminada en la producción de heces, obteniéndose un valor cercano al doble en las heces de organismos alimentados con la dieta Cherax 1, en comparación con la dieta Rangen, cuyos organismos presentaron un valor mucho menor de energía eliminado a través de las heces (Tabla 3).
La excreción de amoníaco (U) representó un gasto de la energía consumida en el alimento de 0.43% para la dieta Rangen y de 0.36% con la dieta Cherax 1(Fig. 1). Asimismo, la excreción de amoníaco fue significativamente mayor (p< 0.05) en los organismos alimentados con la dieta Cherax 1, que en los organismos que consumieron la dieta Rangen (Tabla 3).
En la Tabla 5 se puede apreciar que el metabolismo energético de las dietas utilizadas (32 y 45 % de proteína) expresaron diferencias significativas en el incremento de calor aparente (ICA), además como la tasa de excreción nitrogenada postalimentaria (UPA) fue significativamente superior (p < 0.05) para la dieta Cherax 1 con el menor contenido proteico.
En relación al proceso de muda, las exuvias de los juveniles de Cherax mostraron diferencias significativas (p < 0.05) en la cantidad de energía destinada a este proceso entre ambas las dietas Rangen y Cherax 1, siendo los organismos alimentados con la dieta Cherax 1, los que utilizaron más energía para el desarrollo de este proceso (Tabla 3).
La energía que los organismos utilizaron para la producción de tejido (P) fue del 91.79% en la dieta Rangen, y de 94.45% en la dieta Cherax 1, encontrándose diferencias significativas entre ambos valores (p < 0.05; Fig. 1).
Los juveniles de Cherax que se alimentaron con la dieta Rangen, convirtieron el 92.2 ± 1.2% de la energía ingerida en energía potencial para construcción de tejido, y tuvieron una eficiencia de conversión neta del 93.4 ± 1.2%. Para los organismos que se alimentaron con la dieta Cherax 1, la eficiencia de asimilación bruta fue del 94.4 ± 1.0%, y convirtieron el 94.8 ± 0.9% de la energía digerida, en energía potencial para el crecimiento.
Los valores de la razón atómica O:N, estimados para los juveniles de Cherax alimentados con la dieta artificial Rangen, fue de 32.8 ± 6.09 y de 28.2 ± 14.17 en los organismos alimentados con la dieta Cherax 1. Los valores de la razón atómica encontrados en los organismos expuestos a las dietas artificiales Cherax 1 y Rangen, demostraron que en ambas condiciones experimentales los organismos presentaron un metabolismo oxidativo no-proteico, utilizando una mezcla de lípidos-proteínas como las principales fuentes de energía para cubrir sus requerimientos metabólicos.
DISCUSIÓN
En el género Cherax, los resultados de alimentación utilizando dietas semipurificadas de referencia han sido poco alentadores. Morrissy (1989) atribuyó los malos resultados en C. tenuimanus (Smith, 1912) al uso de nutrientes inadecuados para la especie en la dieta de referencia. Anson y Rouse (1996) indican que los requerimientos específicos para C. quadricarinatus son distintos a las de otros crustáceos. Villarreal y Peláez (1999) comentan que esta especie de origen australiano, es omnívora y detritívora y se adapta a las condiciones de cautiverio, porque es tolerante a condiciones adversas de factores ambientales, consumiendo preferentemente alimento natural casi en descomposición.
Omnivoría. Estudios anteriores han revelado que la langosta C. quadricarinatus presenta altos niveles de asimilación cuando la dieta se compone en su mayor parte de ingredientes vegetales. Hutchings y Villarreal (1996) y Villareal (2002), han indicado que hasta el 70% de los requerimientos nutricionales de juveniles de Cherax, son cubiertos por la productividad natural en piscinas de cultivo comercial con abundancia de crecimientos vegetales. Calow (1977) comenta que la ingestión de sustratos vegetales promueve el consumo de mayor cantidad y variedad de alimentos, lo que propicia una mejor eficiencia de asimilación.
Los resultados de la presente investigación coinciden con los autores antes mencionados ya que al utilizar la dieta Cherax1 (con un nivel bajo de proteína y alto contenido de materia vegetal), se observó un crecimiento alto y una mejor relación costo/ beneficio. Además el Factor de conversión Alimenticia (FCA) con la dieta Cherax1, fue menor al obtenido con la dieta Rangen. Este resultado seguramente presentaría mejores resultados, si se aplicara la sugerencia de Cortés et al. (2002) (Tabla 6), correspondiente a aumentar la frecuencia de alimentación diaria, lo que reafirmaría su calidad.
Consumo de alimento (C). Este estudio mostró valores altos en el consumo de alimento por parte de los organismos alimentados con ambas dietas, sin embargo, el porcentaje en el consumo de alimento con la dieta Cherax1, fue mayor que con la dieta Rangen, lo que permite inferir, que la ingestión del alimento Cherax1 fue más aceptada por los juveniles, proporcionando un mejor crecimiento (P) de los mismos.
Los resultados de la respuesta metabólica de la langosta australiana de quelas rojas se relacionan con la hipótesis propuesta por Jones y Ruscoe (1996), quienes argumentan que en el medio natural, los hábitos alimenticios de esta especie se complementan con la ingesta de detritos, con un alto contenido de materia orgánica vegetal y animal en estado de descomposición.
En relación a la cantidad de alimento consumido y la utilización de la energía contenida en el mismo, se observaron diferencias importantes respecto lo obtenido por otros autores, lo cual pudo deberse a la composición nutricional y cantidad de energía de la dieta empleada, como lo muestra Escalante (2001) (Tabla 7), observándose que los organismos alimentados con la dieta Cherax1 consumieron mayor cantidad de alimento en comparación con la dieta Rangen. Este porcentaje mayor se reflejó en altos valores en las tasas fisiológicas obtenidas, lo que sugiere que la proporción de energía ingerida en el alimento de la dieta Cherax1 fue mucho mayor; además, las langostas alimentadas con ésta dieta presentaron un mejor rendimiento en el incremento de peso, lo que indica que la dieta Cherax 1 es más adecuada para esta especie de langosta, que la dieta Rangen (Tablas 3 y 5).
Se han realizado varios estudios respecto al consumo de alimento de origen vegetal en acociles. Por ejemplo, Rodríguez & Carmona (2002), utilizando organismos de Cambarellus montezumae Saussure, 1857, alimentados con Elodea canadensis Michx sometida a un proceso de ensilaje, encontraron que la calidad del alimento no era adecuado para un rápido crecimiento, lo que sugiere que los acociles necesitan de proteína animal, sobre todo en sus estadios tempranos, y que los vegetales no son la fuente principal de los macronutrientes requeridos.
En otro trabajo, realizado con el fin de observar el efecto de la fibra dietética y tiempo de vaciado gástrico sobre el crecimiento de Macrobrachium rosenbergii De Man, 1879 (González-Peña et al., 2002), se encontró que la razón de crecimiento específica y la razón de eficiencia proteica, provista a los diferentes niveles de fibra dietética, se incrementaron al aumentar el nivel de fibra y también al incrementarse el tiempo de residencia de nutrientes en el tracto gastrointestinal de los organismos.
Barón Sevilla et al. (1994) al alimentar a Procambarus clarkii Girard, 1852 con cuatro dietas formuladas con diferentes niveles de proteína (20, 25, 30 y 35%) encontraron, que los valores más altos del campo de crecimiento se obtuvieron en los organismos alimentados con las dietas con 25 y 30% de contenido proteico.
Producción (P). Uno de los componentes del balance energético, que referido a la inversión de la energía que los organismos utilizan para la producción de tejido, es el que representa el campo de crecimiento, o Producción (P), que en este caso presentó diferencias significativas entre ambas dietas suministradas durante un periodo de 30 días, mostrando un mayor aprovechamiento en las langostas alimentadas con la dieta Cherax1, que se reflejó en un mayor incremento del peso ganado por los organismos y en un valor más elevado en la tasa de crecimiento especifico (Tabla 3, 7: Fig. 1).
En C. quadricarinatus, Thompson et al. (2003) observaron los efectos de alimentar langostas australianas con dietas artificiales con y sin suplementos de lecitina y/o colesterol; los resultados en el crecimiento sugirieron que una dieta conteniendo 25% de harina de pescado, 4.5% harina de soya, 2% de aceite de hígado de bacalao y 1% de aceite de maíz, fueron suficientes para satisfacer los requerimientos de lecitina y colesterol de los organismos, permitiendo con ello un menor gasto en la formulación de dietas alimenticias; sin embargo los resultados obtenidos en ese estudio utilizando una dieta con el 40% de proteína no parecería ser tan satisfactoria como para considerarla en producción de langosta australianas, debido al menor crecimiento obtenido en comparación al obtenido con la dieta Cherax1 usada en el presente estudio conteniendo sólo el 32% proteína. Webster et al. (1994), evaluaron niveles de proteína entre 25% y 55% en dietas alimenticias para juveniles de Cherax quadricarinatus, encontrando que la dieta conteniendo 33% de proteína era la adecuada, debido a que producía un óptimo crecimiento. Meade y Watts (1995), también evaluaron diferentes niveles de proteína en las dietas obteniendo el resultado más favorable con el 30% de proteína. Castillo et al. (2002), también indicaron que el nivel óptimo de proteína en la dieta de Cherax era del 31%, en comparación con el 25 y el 43% de proteína utilizado en otras dietas probadas. Los resultados de este experimento coinciden con Castillo et al. (2002) ya que al aplicar la dieta Cherax1, con 32% proteína, el incremento en peso y la sobrevivencia de los organismos fue superior a lo obtenido con la dieta Rangen conteniendo 45% proteína.
Los organismos de Cherax destinan un gran porcentaje de la energía obtenida en su crecimiento, lo cual le confiere una ventaja sobre otras especies de langosta australiana con eficiencia de crecimiento menor (Arredondo-Figueroa et al., 1994).
Villarreal (1991) menciona que Cherax tenuimanus (Smith, 1912), destina el 57.5% de la energía consumida hacia el crecimiento; por otra parte Woodland (1967) menciona que Cherax destructor Clark, 1936, destina aproximadamente el 50% de la energía ingerida en el crecimiento. Díaz-Herrera et al. (1992), obtuvieron un campo de crecimiento para M. rosenbergii de 68.01 y 86.67% para langostinos alimentados con las dietas Bovilac (37% proteína) y Purina (44% proteína) respectivamente. A pesar de que Anson y Rouse (1996) mencionan que los problemas en la calidad del agua se reducen al usar dietas peletizadas, mientras que los requerimientos nutricionales no se conozcan a plenitud, los alimentos naturales van a tener que seguir siendo necesarios como suplementos para alcanzar el mejor crecimiento y sobrevivencia de Cherax. Esos autores también han planteado que una combinación de dietas que alternen el alimento artificial con el alimento natural para los juveniles, provee suficientes nutrientes para promover el crecimiento. En otro trabajo realizado evaluando la frecuencia de alimentación en cuatro diferentes frecuencias, Cortés et al. (2002) encontraron que para Cherax la frecuencia óptima de alimentación era de al menos 3 veces al día, y que la razón 4 veces/día incrementaba la biomasa total. Aunque tales resultados muestran ser satisfactorios, tomando en cuenta que su periodo de alimentación fue de 60 días, en comparación con los presentados en este trabajo, cuyo periodo fue de 30 días, en una ración/día, el crecimiento de Cherax al alimentarse con la dieta Cherax1, sería mayor que la encontrada por tal autor, sugiriéndose que al aumentar la frecuencia de alimentación con la dieta Cherax1 el crecimiento sería todavía mayor.
En el presente trabajo se obtuvieron mejores resultados al alimentar a Cherax quadricarinatus con la dieta Cherax1 con 32% de proteína y alto contenido de materia orgánica de origen vegetal; por tanto se podría recomendar el uso de dietas con contenido de proteína de alrededor del 32% con características proximales similares a la dieta Cherax1, para alimentar acociles, a pesar de que para la langosta de quelas rojas no haya un alimento formulado en el mercado con esas características. Huner y Meyer (1979), señalan que los alimentos balanceados para crustáceos producen una inadecuada pigmentación, sin embargo, este señalamiento no coincide con los resultados del presente estudio, en los cuales no se observaron cambios en la coloración de los organismos al usar distintas dietas. Además se encontró que Cherax quadricarinatus aprovecha de manera óptima los componentes de la dieta y además, presenta valores bajos de pérdidas metabólicas, canalizando la mayoría de la energía hacia el crecimiento, y aunque no se les suministró alimento natural, la dieta Cherax1 probó ser un alimento balanceado con gran potencial para incrementar el crecimiento de la especie cultivada a nivel comercial.
Energía eliminada (H). La eliminación de energía vía producción de heces fecales (H) en los juveniles de Cherax quadricarinatus no excedió el 2 % del total de la energía incorporada con el alimento ingerido, al exponerse a ambos alimentos. En los organismos mantenidos en condiciones experimentales, la energía eliminada a través de la producción de heces representó el 1.13% al alimentarse con la dieta Rangen, y el 1.18% con la dieta Cherax1. Esta tasa fisiológica representó una cantidad de energía eliminada por los organismos alimentados con la dieta Cherax1 de cerca del doble de la cantidad de los organismos alimentados con la dieta Rangen, encontrándose diferencias significativas entre ambas dietas (Tabla 3). En juveniles de Cherax, Escalante (2001), obtuvo que la producción de heces de organismos expuestos a condiciones experimentales con una temperatura constante de 28 °C, alimentándose con Rangen 35% proteína, representaron un 3.2% del total de la energía incorporada del alimento ingerido, mientras que en un régimen de temperatura fluctuante de 25-33 °C, se obtuvo un valor de energía eliminada de 4.2% del total del alimento (Tabla 7). En Cherax tenuimanus, Villareal et al. (1991), obtuvo que la producción de heces estuvo relacionada inversamente con el tamaño de los organismos, la cantidad de alimento ingerido y el contenido de proteína en la dieta (del 17 al 48%), la tasa de producción fecal diaria fue de 0.318 ± 0.031 mg g-1 h-1, equivalente al 7% del alimento ingerido por los organismos. Otros autores tuvieron resultados similares al trabajar con adultos de Procambarus clarkii Girard,1852 (Barón Sevilla et al., 1994) y postlarvas y juveniles de Macrobrachium rosenbergii De Man, 1879 (Díaz-Herrera et al., 1992).
La diferencia entre la pérdida de energía vía producción de heces en Cherax con relación a los resultados obtenidos por otros autores puede ser atribuida al tipo y calidad de los alimentos proporcionados, ya que una dieta con niveles altos de fibra, incrementa la producción de heces; la dieta Rangen utilizada en este trabajo contenía más del doble de fibra que la dieta Cherax1, sin embargo los resultados obtenidos difirieron en la cantidad de energía perdida por este proceso. En el presente estudio se obtuvo cerca del doble en producción de heces en los organismos alimentados con la dieta Cherax1; lo cual pudo deberse a la gran cantidad de energía ingerida contenida en la misma.
Respiración (R). La energía invertida en el metabolismo de rutina por los juveniles de Cherax quadricarinatus, a los cuales se le suministraron las diferentes dietas, fue menor (Tabla 3, Fig. 1) que los valores obtenidos por Pérez-Cruz et al. (1995) en Macrobrachium rosenbergii (107.6 a 174.2 J día1 g1 p.s.). Escalante (2001), reportó valores similares en juveniles de Cherax quadricarinatus (107.5 ± 12.0 J día-1 g-1 p.s.) a los obtenidos por Pérez-Cruz et al. (1995) en condiciones de temperatura constante y alimento artificial Rangen para camarón (Tabla 7). Meade et al. (1994, 2002) sugieren que los organismos de M. rosembergiiexpuestos a tensiones menores a 10 kPa Po2, evitan un estrés potencial causado por condiciones anóxicas.
En el actual trabajo, los juveniles de Cherax mantenidos en un régimen de temperatura preferida, presentaron valores similares en el metabolismo de rutina al suministrarle las diferentes dietas, pero al analizar la energía porcentual derivada para este proceso, se encontró una diferencia marcada entre ambas dietas, porque los organismos que se alimentaron con Rangen derivaron la energía en un 3.75% de la energía extraída del alimento, mientras que los juveniles que se alimentaron con Cherax1 lo hicieron en un 2.19% (Tabla 7 , Fig. 1). Lo anterior sugiere que los organismos alimentados con la dieta Cherax 1 utilizaron menos energía para este proceso fisiológico. Ambas dietas utilizadas indican que la digestión del alimento por los juveniles fue eficiente en ambos casos, pero para este estudio con las langostas de quelas rojas, la dieta Cherax1 resultó ser mejor en costo energético ya que al utilizar menor cantidad de energía, conservó la mayor parte de la energía resultante, la cual probablemente pudo ser destinada para el crecimiento.
Excreción nitrogenada (U). El valor de la excreción amoniacal obtenido en los juveniles de Cherax, utilizando la dieta artificial Rangen en condiciones de temperatura constante, fue de 8.4 J día-1 g-1 p.s, el cual fue muy similar a lo reportado por Escalante (2001), bajo las mismas condiciones experimentales de temperatura constante (7.9 ± 1.0 J día-1 g-1 p.s). Sin embargo, en un régimen de temperatura fluctuante el resultado fue de 20.0 (J día-1 g-1 p.s) (Tabla 7).
Para los juveniles de Cherax alimentados con la dieta Cherax1 el valor de excreción amoniacal a través de la orina fue de 13.1 ± 3.6 J día-1 g-1 p.s, mayor a la energía excretada en organismos con la dieta Rangen (Tabla 3).
Para Macrobrachium rosenbergii, Pérez-Cruz et al. (1995) reportaron valores de excreción nitrogenada menores (0.8 a 4.9 J día-1 g-1 p.s). A este respecto Sierra-Uribe et al. (1997) reportan valores de 0.0014 y 0.0013 J día-1 g-1 p. s. para machos y hembras de Procambarus clarkii respectivamente.
Relación O:N. Los cambios en los valores de la razón O:N reflejan el tipo de sustrato metabólico oxidado según diferentes factores, entre los que se encuentran el estadio de desarrollo y el estado fisiológico de los organismos, así como el tipo de dieta proporcionada. Este índice también es indispensable para estimar la relación metabólica entre los organismos y el alimento consumido, ya que refleja el efecto de los niveles de proteína y de la relación energía-proteína de la dieta sobre los organismos. Mayzaud y Conover (1988) mencionan que valores de 3 a 16 son indicativos de oxidación de proteínas, de 16 a 25 corresponden a la utilización de una mezcla de lípidos y proteínas, de 25 a 60 indican catabolismo de lípidos y carbohidratos y por último valores superiores a 60 ocurren cuando hay empleo de carbohidratos. Los valores de la razón atómica O:N estimada para los juveniles de Cherax alimentados con las dos dietas artificiales bajo condiciones experimentales, demostraron que los organismos no utilizaron proteína como sustrato metabólico, manteniéndose el índice en el intervalo considerado como catabolismo no netamente proteico y presentando un metabolismo oxidativo, utilizando una mezcla de lípidos y proteínas como la principal fuente de energía para cubrir sus requerimientos metabólicos. Lo anterior podría indicar que la mayoría de las proteínas obtenidas de ambas dietas (Rangen y Cherax1) fueron utilizadas anabólicamente.
En contraste con estos resultados, el crecimiento de los organismos presentó diferencias significativas, creciendo los organismos alimentados con la dieta Cherax1 cerca del doble de los alimentados con Rangen, lo que hace suponer que la composición de Cherax1, cumplió de forma más satisfactoria los requerimientos nutricionales de los juveniles de quelas rojas, destinándose la mayor cantidad de energía a la producción de tejido y con ello produciendo un mayor crecimiento. Los valores obtenidos en este estudio para la relación O:N utilizando dietas artificiales k fueron muy similares (25.6 y 23.3) a los obtenidos para la misma especie por Díaz-Herrera et al. (2006) utilizando dieta Rangen, manteniendo a los organismos en temperatura constante y fluctuante; y de 33.7 y 24.3 para acociles alimentados con dieta Purina, mantenidos en regímenes de temperatura constante y fluctuante. También se han reportado valores similares de O:N (25.50 a 46.82) para Macrobrachium rosenbergii, para Palaemonetes varians Leach, 1814 (34.2), y para Homarus americanus Milne-Edwards, 1837 (22.1 a 26.7) (Díaz-Herrera et al., 1992; Capuzzo & Lancaster, 1979).
Díaz-Iglesias et al. (2002) evaluaron la bioenergética de alimentos naturales y artificiales en juveniles de langosta espinosa Panulirus argus (Latreille, 1804A encontrando que la relación O:N del alimento basado en quitón, disminuyó a 12.9, indicando catabolismo de proteínas puras, confirmándose los hábitos carnívoros estrictos de esta especie. Resultados similares se han obtenido en estudios con la langosta espinosa Panulirus interruptus (Díaz-Iglesias et. al., 2011).
No en todos los casos las proteínas son utilizadas como sustrato energético, estas sustancias sólo contribuyen al metabolismo energético cuando en la dieta se proporciona una mezcla de lípidos y proteínas insuficiente.
Incremento de calor aparente (ICA). El consumo de oxígeno en los juveniles de Cherax aumentó por la ingestión de alimento, constituyendo un ICA de 79% para los organismos alimentados con la dieta Rangen y representando un gasto del 2.9% de la energía ingerida en el alimento. Para los organismos alimentados con la dieta Cherax1, el ICA fue de 76.6%, utilizando el 1.82% de la energía total consumida en el alimento (Tabla 3).
Se ha establecido que el ICA está relacionado con el metabolismo y desaminación de las proteínas, en esta investigación estos valores difirieron de los encontrados por Escalante (2001), para juveniles de Cherax mantenidos en un régimen de temperatura constante de 28 °C en el cual se reportó un incremento del 39.6 y 45.1% en el consumo de oxigeno de los organismos después de ser alimentados con las dietas Rangen y Purina respectivamente (Tabla 7).
Jobling (1983, 1994) menciona, que el incremento en el consumo de oxígeno, como producto del consumo de alimento, puede tener dos explicaciones: 1) la síntesis de proteína (crecimiento), en tal caso una relación del ICA con la producción de amoníaco no debería existir, 2) la oxidación de aminoácido y por tanto la producción de nitrógeno excretado.
La cantidad de energía invertida en la producción de exuvias por el proceso de la muda en juveniles de crustáceos ha sido poco estudiada. En este estudio, la formación de las exuvias ó mudas de juveniles de Cherax, requirieron el 1.54% de la energía ingerida en el alimento Rangen y el 1.38% de la energía ingerida con la dieta Cherax1 (Figura 1). El intervalo de muda no mostró diferencias significativas en el número de días sucedidos para el proceso de muda.
Conversión de energía (CE). En este estudio, la eficiencia de conversión de la energía absorbida de las dietas artificiales por los juveniles, se expresan como tasas de asimilación bruta (K1) y neta (K2) (Klekowski & Duncan, 1975.). Los juveniles de Cherax que se alimentaron con la dieta Rangen, convirtieron el 92.2% de la energía ingerida en energía potencial para construcción de tejido, y tuvieron una eficiencia de conversión neta del 93.4%. Por otra parte en los organismos alimentados con la dieta Cherax1, la eficiencia de asimilación bruta fue del 94.4%, convirtiendo el 94.8% de la energía digerida en energía potencial para su crecimiento. La eficiencia de conversión obtenida para los organismos en las diferentes dietas no mostró una diferencia muy marcada, sin embargo, existió una notable diferencia en la tasa de ingestión, incremento en peso, tasa de crecimiento especifico, así como en la cantidad de energía canalizada hacia el crecimiento por los organismos expuestos a las diferentes dietas artificiales suministradas.
Los resultados del presente experimento concordaron con lo reportado por Lemos et al. (2001) en postlarvas de Farfantepenaeus paulensis (Pérez-Farfante & Kinsley, 1997) cuya tasa de asimilación neta (K2), demostró que la energía invertida en el crecimiento fue del 52.2 al 56.3%, cuando los organismos se expusieron a condiciones de salinidad de 5 a 25 ups, y que al mantenerlos en una condición de 34 ups, este índice disminuyó (44%). También Valdez (2002), reporta que al trabajar a diferentes salinidades y la dieta Rangen (con 40% de proteína), los juveniles de Litopenaeus vannamei Boone, 1931, presentaron una eficiencia de conversión bruta (K1) del 52.05 a 55.32% de la energía ingerida para el crecimiento, mientras que en juveniles aclimatados a 26 ups de salinidad , la eficiencia de conversión neta (K2) indicó un 60.71 al 66% de la energía absorbida. Considerando la evidencia anterior, se puede afirmar que la tasa de asimilación de crustáceos parece estar influenciada por factores ambientales.
Índice de rendimiento. El índice de rendimiento también denominado incremento relativo en biomasa (Díaz-Iglesias et al., 1991), se ha empleado en crías de postlarvas de langosta Panulirus argus en diversas densidades, aislamiento, temperaturas y alimentación con dietas artificiales en condiciones de laboratorio y los resultados han indicado que al trabajar con una menor densidad de crías, se obtiene la mayor sobrevivencia junto con una tendencia a disminuir el crecimiento.
En este estudio trabajo se utilizó el índice de rendimiento, según el periodo de tiempo transcurrido en experimentación, para los organismos juveniles de Cherax; encontrándose que el rendimiento obtenido del tratamiento con la dieta experimental Cherax1, presentó valores superiores en comparación con la dieta artificial Rangen, lo cual se observó reflejado en la obtención de más del doble del incremento en peso en organismos alimentados con la dieta Cherax1 por un periodo de 30 días, así como en una tasa de crecimiento especifica superior. Por lo anterior se concluye que la dieta Cherax1, cumplió de manera satisfactoria los requisitos metabólicos necesarios para las langostas de quelas rojas, aunque la sobrevivencia fue similar en ambos tratamientos. Para otras especies de crustáceos, como Litopenaeus setiferus (Linnaeus, 1767) (Taboada et al., 1998), al trabajar en el efecto de diferentes niveles de proteína (10, 20, 30, 40 y 50%) en organismo con un peso inicial de 0.19 g, se obtuvo un índice de rendimiento en el crecimiento de los camarones de 0.81 g en 45 días y una tasa de sobrevivencia del 81% al ser alimentados con una dieta con un nivel de proteína del 30%,considerandola como la dieta óptima.
Los juveniles de Cherax quadricarinatus alimentados con la dieta artificial Cherax1 con 32% de proteína, formulada especialmente para esta especie según sus hábitos alimenticios, derivaron al campo de crecimiento el 94.45% de la energía ingerida del alimento, equivalente a 3,357.8 Joules, siendo 1.8 veces mayor que la energía destinada por los organismos mantenidos con la dieta comercial Rangen ®, con 45 % de proteína y 1,798 J.
Asimismo los juveniles de langostas de quelas rojas, alimentados con la dieta Cherax1, presentaron una mayor tasa de crecimiento especifica, que se reflejó en una mayor tasa de consumo de alimento, un mejor índice de rendimiento; así como en una mayor eficiencia en la utilización de la energía incorporada en el alimento. Además, los organismos alimentados con la dieta Che-rax1, presentaron una pérdida de energía menor en la producción de heces fecales (F), equivalente a 42.6 J, y el metabolismo de rutina (R), también expresó un gasto menor de energía, todo lo cual indica una mayor eficiencia metabólica. Asimismo la excreción nitrogenada (U), reflejó valores menores en el consumo de la dieta Cherax 1, indicando un uso más anabólico de las proteínas.
Por último, se concluye que el sustrato metabólico determinado por la relación atómica O:N, indicó que preferentemente se consume una mezcla de lípidos-proteínas equivalente a un valor de 30, no encontrando diferencias significativas entre las dietas
ensayadas, por lo que el mayor porcentaje de las proteínas suministradas fue canalizado hacia el crecimiento.
REFERENCIAS
Amador-Cano, G. 2001. Termorregulación de juveniles y adultos de la langosta de quelas rojas Cherax quadricarinatus. Tesis de Maestría. CICESE. Ensenada, B.C. México, 50 p. [ Links ]
Anson, K. J. & D. B. Rouse. 1996. Evaluation of several commercial feeds and a crustacean diet juvenile Australian redclaw crayfish Cherax quadricarinatus. Journal of Applied Aquaculture 6: 65-76. [ Links ]
Arredondo-Figüeroa, J. L., A. Inclán Sánchez, J. T. Palafox & C. R. Campos. 1994. Desarrollo científico y tecnológico del cultivo de la langosta de agua dulce Cherax quadricarinatus. Secretaría de Pesca. Convenio SEPESCA/UAM-1. 90 p. [ Links ]
Barón Sevilla, B., F. Díaz Herrera & L. F. Bückle Ramírez. 1994. Energy budget for the red swamp crawfish Procambarus clarkii (Crustacea: Cambaridae). Rivista Italiana di Acquacoltura 29:103-107. [ Links ]
Beamish, F. W. H. & E. A. Trippel. 1990. Heat increment: a static or dynamic dimension in bioenergetic models ? Transactions of the American Fisheries Society 119: 649-661. [ Links ]
Calow, P. 1977. Conversion efficiencies in heterotrophic organisms. Biological Reviews 52: 385-409. [ Links ]
Capuzzo, J. M. & B. A. Lancaster. 1979. Some physiological and biochemical considerations of larval development in the American lobster, Homarus americanus. Journal Experimental Marine Biology and Ecology 40:53-62. [ Links ]
Castillo, C. E., L. M. Cisneros, S. L. Ortiz & C. M. Jover. 2002. Evaluación de dietas proteicas en precrías de langosta de agua dulce (Cherax quadricarinatus). I Congreso Iberoamericano Virtual de Acuicultura (CIVA), pp. 1-5. (httw.civa2p://ww002.org). [ Links ] Clifford, H. C. & R. W. Brick. 1979. A physiological approach to the study of growth and bioenergetics in the freshwater shrimp Macrobrachium rosenbergii. Proccedings. World Mariculture Society 10: 710-719. [ Links ]
Conover, R. J. & E. Corner. 1968. Respiration and nitrogen excretion by some marine zooplankton in relation to their live cycles. Journal Marine Biological Association of United Kingdom 48: 49-75. [ Links ]
Cortés, J. E., C. H.Villarreal & R. M. Rendón. 2002. Efecto de la frecuencia alimenticia en el crecimiento y sobrevivencia de juveniles de langosta de agua dulce Cherax quadricarinatus (Decapoda: Parastacidae). I Congreso Iberoamericano Virtual de Acuicultura (CIVA), pp. 882-890. (http://www.civa2002.org). [ Links ]
Díaz-Herrera, F. 1989. Estudio ecofisiológico del langostino gigante Macrobrachium rosenbergii. Tesis Doctoral. Facultad de Ciencias UNAM. México. 110 p. [ Links ]
Díaz-Herrera, F., G. Escalante, A. D. Re & E. Sierra. 2006. Fisiología energética de Cherax quadricarinatus (von Martens, 1868) alimentado con dos dietas, expuesto a un régimen constante y fluctuante de temperatura. Hidrobiológica 16 (1): 35-44. [ Links ]
Díaz-Herrera, F., G. Juárez Castro, E. Pérez-Cruz & L. F. Bückle Ramírez. 1992. Balance energético de postlarvas y juveniles de langostino malayo Macrobrachium rosenbergii de Man (Crustácea: Palaemonidae). Ciencias Marinas 18: 19-32. [ Links ]
Díaz-Iglesias, E., R. Brito-Pérez & M. Báez-Hidalgo. 1991. Cría de postlarvas de langosta Panulirus argus en condiciones de laboratorio. Revista de Investigaciones Marinas 12 (1-3): 323-331. [ Links ]
Díaz-Iglesias, E., M. Báez Hidalgo, E. Perera Bravet & I. Fraga Castro. 2002. Respuesta metabólica de la alimentación natural y artificial en juveniles de la langosta espinosa, Panulirus argus (Latreille, 1804). Hidrobiológica 12 (2):101-112. [ Links ]
Diaz Iglesias E., A. K., Robles Murillo , R. J., Buesa-Más., M. Báez-Hidalgo & M. López-Zenteno. 2011. Bioenergetics of red spiny lobster Panulirus interruptus (Randall, 1840) juveniles fed with mollusc. Aquaculture 318 (1): 207-212. [ Links ]
Elliot, J. M. & W. Davison. 1975. Energy equivalents of oxygen consumption in animal energetics. Oecologia 19: 195-201. [ Links ]
Escalante Almada, G. 2001. Fisiología energética de Cherax quadricarinatus: Efecto de la temperatura y dietas. Tesis de Maestría. CICESE. Ensenada, B. C. México, 41 p. [ Links ]
Garza de Yta, A., D. Davis, D. Roüse, J. Ghanawi & I. P. Saoüd. 2012. Evaluation of practical diets containing various terrestrial protein sources on survival and growth parameters of redclaw crayfish Cherax quadricarinatus. Aquaculture Research 43 (1): 84-90. [ Links ]
Gnaiger, E. 1983. Calculation of energetic and biochemical equivalents of respiratory oxygen consumption. In: Gnaiger, E. & H. Forstner (Eds.). Polarographic oxygen sensor. Springer. Berlín, Alemania. pp. 337345. [ Links ]
González-Peña, M., S. Gómez & G. Moreira. 2002. Effects of dietary fiber on growth and gastric emptying time of the freshwater prawn Macrobrachium rosenbergii (De Man, 1879). Journal World Aquaculture Society 33: 441-447. [ Links ]
Gu, H., P. B. Mather & M. F. Capra. 1995. Juvenile growth performance among stocks and families of red claw crayfish, Cherax quadricarinatus (von Martens,1864). Aquaculture 134: 29-36. [ Links ]
Huner J. V. & S. P. Meyer. 1979. Dietary protein requirements of the red crayfish Procambarus clarkii, grown in a closed system. Proccedings World Mariculture Society 10: 751-760. [ Links ]
Hutchings, R. W. & H. Villarreal. 1996. Biología y cultivo de la langosta de agua dulce Cherax quadricarinatus (redclaw). Manual de Producción. Navimar, S.A. Guayaquil, Ecuador. 374 p. [ Links ]
Jobling, M. 1983. Towards and explanation of specific dynamic actino (SDA). Journal. Fisheries Biology 23: 549-555. [ Links ]
Jobling, M. 1994. Fish bioenergetics. Fish and fisheries series13. Primera edición. Chapman & Hall. London. 309 p. [ Links ]
Jones, C. M. & I. M. Rüscoe. 1996. Production Technology for Red claw Cray-fish (Cherax quadricarinatus). Freshwater Fisheries and Aquaculture Centre Walkamin. Australia. 155 p. [ Links ]
Jones, C. M. 1990. The biology and aquaculture potential of the tropical freshwater crayfish Cherax quadricarinatus. Information Series, vol. Q190028. Queensland Department of Primary Industries, Brisbane. 109 p. [ Links ]
Klekowski, R. Z. & A. Duncan. 1975. Parameters of an energy budget. In: Grodzinski, W., R. Z. Klekowski & A. Duncan (Eds.). Methods for ecological bioenergetics. Blackwell Scientific Publications. Primera edición. Oxford, Inglaterra, pp. 97-149. [ Links ]
Kondos, A. 1990. Supplementary feed essential for crayfish. Australian Fisheries 49 (11): 28-32. [ Links ]
Lagerspetz, K. H. 1974. Temperature acclimation and the nervous system. Biological Review49: 477-54. [ Links ]
Lee, D. 0. & J. F. Wickins. 1992. Crustacean Farming. John Wiley & Sons Inc. New York, 392 p. [ Links ]
Lemos, D., V. N. Phan & G. Álvarez. 2001. Growth, oxigen consumption, ammonia-N excretion, biochemical composition and energy content of Farfantepenaeus paulensis (Crustácea, Decápoda, Penaeidae) early postlarvae in different salinities. Journal Experimental Marine Biology and Ecology. 261: 55-74. [ Links ]
Lucas, A. 1996. Bioenergetics of aquatic animals. Taylor & Francis publications. United Kingdom, 169 p. [ Links ]
Mayzaud, P. & R. J. Conover. 1988. O:N atomic ratio as a tool to describe zoo-plankton metabolism. Marine Ecology Progress Series 45: 289302. [ Links ]
Meade, M. E, J. Doeller, D. Kraus, & S. Watts. 1994. Heat and oxigen flux as a function of PO2 in juvenile australian crayfish Cherax quadricarinatus. Journal of Experimental Zoology 270 (5): 460-466. [ Links ]
Meade, M. E. & S. A. Watts. 1995. Weight gain and survival of juvenile Australian crayfish Cherax quadricarinatus fed formulated feeds. Journal of the World Aquaculture Society 26 (4): 469-474. [ Links ]
Meade, M. E., J. Doeller, D. Kraus & S. Watts. 2002. Effects of temperature and salinity on weight gain, oxigen consumption rate, and growth efficiency in juvenile red claw crayfish Cherax quadricarinatus. Journal of the World Aquaculture Society 33: 188-198. [ Links ]
Morrissy, N. M. 1989. A reference standard diet for crustacean nutrition research. IV. Growth of freshwater crayfish Cherax tenuimanus. Journal of the World Aquaculture Society 20: 103-109. [ Links ]
Nelson, S. G., M. A. Simmons & A. W. Knight. 1985. Calorigenic effect of diets on the grass shrimp Crangon fransiscorum (Crustacea:Crango-nidae). Comparative Biochemical and Physiology 82: 373-376. [ Links ]
Pérez-Cruz, E., F. Díaz-Herrera & J. Luna-Figueroa. 1995. Effect of unilateral eyestalk ablation and photoperiod on energy budget of Macrobrachium rosenbergii (Crustacea:Palaemonidae). Rivista Italiana di Acquacoltura 30: 87-91. [ Links ]
Pérez-Farfante, I. & B. Kensley. 1997. Penaeoid and Sergestoid Shrimps and Prawns of the World: Keys and Diagnoses for the Families and Genera. Washington, D.C.: National Museum of Natural History. ISBN 2-85653-510-0. [ Links ]
Reynolds, W. W. & M. E. Casterlin. 1979. Behavioral termoregulation and activity in Homarus americanus. Comparative Biochemical and Phisiology 64A: 25-28. [ Links ]
Rodier, J. 1981. Análisis de las aguas: aguas naturales, aguas residuales y agua de mar. Omega, Barcelona, España. pp. 138-140. [ Links ]
Rodríguez, S. M. & 0. C. Carmona. 2002. Balance energético de Acocil Cambarellus montezumae (Saussure) (Crustacea:Astacidae:Cambaridae): Perdida de energía en la tasa metabólica. I Congreso Iberoamericano Virtual de Acuicultura (CIVA). pp. 932-938. (http://www.civa2002.org). [ Links ]
Rouse, D. B. 1995 Australian crayfish culture in the Americas. Journal of Shellfish Research 14: 569-572. [ Links ]
Sierra-Uribe, E., F. Díaz-Herrera & L. F. Bückle-Ramírez. 1997. Effect of unilateral eyestalk ablation on the physiological energetics of Pro-cambarus clarkii (Decapoda:Cambaridae) Rivista Italiana di Acquacoltura 32: 105-113. [ Links ]
Taboada, G., G. Gaxiola, R. Pedroza, A. Sánchez, A. Soto & C. Rosas. 1998. Oxigen consumption and ammonia-N excretion related to protein requirements for growth of white shrimp, Penaeus setiferus (L.), juveniles. Aquaculture Research 29: 823-833. [ Links ]
Thompson, K., L. Muzinic, D. Tracey & C. Webster. 2003. Effect on growth, survival, and fatty acid composition of australian red claw crayfish Cherax quadricarinatus fed practical diets with and without suplemental lecithin and/or colesterol. Journal of the World Aquaculture Society 34: 1-10. [ Links ]
Valdez Sánchez, G. 2002. Determinación de la preferencia térmica y fisiología energética de juveniles de Litopenaeus vannameiaclimatados a diferentes salinidades. Tesis de Maestría. CICESE. Ensenada, B. C. México, 68 p. [ Links ]
Vega-Villasante F., H. Nolasco & R. Civera. 1995. The digestive enzymes of the Pacific Brown shrimp Penaeus californiensis .II. Properties of protease activity in the whole digestive tract. Comparative Biochemical and Physiology 112B (1): 123-29. [ Links ]
Villareal, H. 1991. A partial energy budget for the Australian crayfish, Cherax tenuimanus. Journal World Aquaculture Society 22: 252259. [ Links ]
Villarreal, H. & J. Peláez. 1999. Nutrición y alimentación de redclaw. Memorias del Curso Teórico-Práctico de Cultivo de redclaw en Mexico. pp. 1-21. [ Links ]
Villarreal, H. 2002. Avances en la nutrición de Cherax quadricarinatus. In: Cruz-Suárez, L. E., D. Ricque-Marie, M. Tapia-Salazar, M. G. Gaxiola-Cortés & N. Simoes. (Eds.). Avances en Nutrición Acuícola VI. Memorias del VI Simposium Internacional de Nutrición Acuícola. Cancún, Q. R, México. 593 p. [ Links ]
Webster, C. D., L. S. Goodgame-Tiu, J. H. Tidwell & D. B. Rouse. 1994. Evaluation of practical feed formulations with different protein levels for juvenile red claw crayfish (Cherax quadricarinatus). Transactions Kentucky Academic Science 55: 108-112. [ Links ]
Woodland, D. J. 1967. Population study of a freshwater crayfish, Cherax albidus Clark. Ph. D. Thesis, University of New England. 221 p. [ Links ]
Zar, J. H. 1999. Biostatiscal Analysis. Prentice Hall. Sexta edición. USA. pp. 25-150. [ Links ]