Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.21 no.3 Ciudad de México sep./dic. 2011
El estado actual del estudio de florecimientos algales nocivos en México
The actual state of the study of harmful algal blooms in Mexico
Christine J. Band-Schmidt,1 José J. Bustillos-Guzmán,2 David J. López-Cortés,2 Erick Núñez-Vázquez2,3 y Francisco E. Hernández-Sandoval2
1 Centro Interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional. Av. Instituto Politécnico Nacional s/n. Col. Playa Palo de Santa Rita. La Paz, B.C.S., 23096. México. e-mail: cbands@ipn.mx
2 Centro de Investigaciones Biológicas del Noroeste, Mar Bermejo 195, Col. Playa Palo de Santa Rita. La Paz, B.C.S., 23090. México.
3 Investigación para la Conservación y el Desarrollo, A. C. Andador 2 No. 245, Col. Banobras, La Paz, B. C. S., 23080. México.
Recibido: 27 de junio de 2011.
Aceptado: 18 de noviembre de 2011.
RESUMEN
Esta revisión da a conocer el estado de conocimiento de los estudios de Florecimientos Algales Nocivos (FAN) en el ámbito marino en México, con el objeto de evaluar la manera de optimizar los recursos destinados para el estudio de FAN en nuestro país, identificando líneas no abordadas y proponiendo mejoras en las actividades de monitoreo y de investigación que puedan aumentar nuestro conocimiento sobre la complejidad de FAN en nuestras costas. Se realizó una búsqueda bibliográfica de 1940 a 2011 consultando bases de datos, reuniones académicas y libros especializados. El número de investigadores e instituciones involucrados con el estudio de FAN se ha incrementado significativamente en las últimas décadas, lo cual se ve reflejado en el número y calidad de las publicaciones. Sin embargo, la mayoría de los programas y actividades de investigación están basados en muestreos puntuales y programas de investigación a corto plazo, enfocándose a pocas especies de FAN. Actualmente, varias líneas de investigación relacionadas con los FAN se han abordado pobremente o no se han considerado como son los estudios sobre quistes, alelopatía, transportación de especies por aguas de lastre, efecto del cambio climático, utilización de imágenes de satélite, uso de herramientas moleculares, análisis socioeconómicos y estrategias de mitigación, entre otros. Este análisis muestra que ha habido un avance significativo en el estudio de FAN en México, si bien la manera de abordar su estudio ha sido individualizada y dispersa. Se obtendría un mayor avance si se coordinaran los esfuerzos entre los diversos investigadores e instituciones para optimizar los recursos disponibles para el estudio de los FAN.
Palabras clave. Florecimientos algales nocivos, México, monitoreo, publicaciones, toxinas.
ABSTRACT
This review presents an analysis of the state of knowledge of harmful algae studies in the marine environment in Mexico, in order to evaluate how we can optimize the available resources to study these events, identify unattended issues, and propose improvements in monitoring and/or research programs that could help to further understand the complexity of HAB in our coasts. An exhaustive bibliographic revision, from 1940 to 2011, was done consulting specialized data analyses, conference meetings, and specialized books and manuals. The number of researchers and institutions involved in HAB (harmful algal blooms) studies has increased significantly during the last decades, which is reflected in the number and quality of publications. However most of the existing HAB reports are based on sporadic sampling and short-term research programs. Monitoring programs and research activities have been focused in only a few HAB species; many toxic and harmful microalgal species have not been considered. To date, there is no laboratory with the capacity and techniques to analyze all the phycotoxins detected in Mexican coasts. Also, many research areas have not been attended adequately in Mexico such as cyst studies, allelophaty, exotic species, effect of climate change, use of molecular tools and teledetection, socioeconomic analyses, and mitigation strategies among others. This review shows that there has been a significantly improvement in the study of HAB in Mexico. However the studies are still addressed under an individual and disperse way and lack coordination. Greater achievements would be obtained if we concentrate the efforts of researchers and institutions were coordinated in order to optimize the available resources for HAB studies.
Key words: Harmful algal blooms, Mexico, monitoring, publications, toxins.
INTRODUCCIÓN
Un florecimiento algal nocivo (FAN), es un incremento masivo en el número de células fitoplanctónicas que puede consumir el oxígeno o los nutrientes del agua, indispensables para otros organismos, y así afectar a la biota acuática. También pueden ocasionar daños físicos a otros organismos (obstrucción de branquias) y/o causar intoxicaciones a través de la producción de sustancias químicas (toxinas), alterando la fisiología de los organismos afectados (Smayda, 1997). Los FAN pueden causar o no cambios de color del agua.
El estudio de los FAN es un tema que ha captado un gran interés de la comunidad científica. Existe un gran número de programas internacionales dirigidos al estudio de estos eventos (Anderson et al., 2010) que abarcan diversos aspectos, tales como el ciclo de vida de las especies responsables, su taxonomía, biogeografía, ecofisiología, toxicidad, estrategias de mitigación, ecología y regulación de la presencia de sus toxinas en los mariscos entre otros. En México los FAN son eventos comunes, tanto en la costa Pacífica como del Golfo de México y el Caribe, los cuales se han incrementado sustancialmente en los últimos 20 años, en parte por el mayor número de investigadores trabajando en el tema, lo que permite ampliar el número de registros y zonas estudio, aunque también por los cambios en los ecosistemas de origen natural y/o antropogénico (eutrofización, calentamiento global, transporte de organismos, deterioro del ambiente costero, incremento de actividades de acuicultura, uso de fertilizantes para la agricultura, etc.).
Investigadores mexicanos han publicado al menos 13 revisiones relacionadas con los FAN. La mayoría de estos trabajos han abordado el registro de especies responsables de FAN y la producción de toxinas detectadas en nuestras costas (Cortés-Altamirano et al., 1996; Ochoa et al., 1997, 1998, 2002; Cortés-Altamirano, 1998; Gómez-Aguirre, 1998a; Sierra-Beltrán et al., 1998; Herrera-Silveira & Ojeda-Alayón, 1999; Ochoa, 2003; Hernández-Becerril et al., 2007; Cortés-Altamirano & Sierra-Beltrán, 2008), el efecto de FAN en cultivos de camarón (Alonso-Rodríguez & Páez-Osuna, 2003) y en organismos silvestres (Núñez-Vázquez et al., 2011); también se han realizado análisis de trabajos específicos en especies responsables de FAN presentes en nuestras costas (Hernández-Becerril, 1998; Sierra-Beltrán et al., 2005a; Ramírez-Camarena et al., 2006; Band-Schmidt et al., 2010). Estos trabajos evidencían el incremento de registros de FAN, así como el número de especies tóxicas/nocivas y ficotoxinas registradas en nuestro país, que va a la par del número de investigadores trabajando en el tema. La mayoría de esos autores coinciden en concluir en la importancia de implementar un programa de monitoreo en las costas mexicanas para el manejo adecuado de los recursos marinos, así como en realizar estudios multidisciplinarios para un mayor entendimiento de tales eventos. En esta revisión se describe cómo se ha abordado la problemática de los FAN en el ambiente marino en México, mencionando la lista de especies productoras de toxinas, así como de otras que, sin producirlas pueden ocasionar efectos nocivos y describiendo sus impactos. También se hace un análisis de los avances y limitaciones en cuanto a las técnicas de muestreo realizadas por la comunidad científica involucrada, tanto en el estudio de las especies de microalgas nocivas y la detección de toxinas marinas con carácter regulatorio, como en las investigaciones que con esas especies y sus toxinas se están realizando. Finalmente, y a fin de entender la contribución de este trabajo en el contexto de la literatura científica internacional, se presenta un análisis de los foros de difusión de los trabajos de investigadores mexicanos. Con esta revisión se pretende analizar cómo se podrían optimizar los recursos que se tienen para afrontar esta temática, identificando algunos de los problemas emergentes que se podrían presentar en nuestras costas en relación a los FAN y proponiendo planes de manejo o de investigación a medio plazo, aspecto que sigue siendo uno de nuestros mayores retos en el estudio de los FAN.
MATERIALES Y MÉTODOS
Se realizó una revisión bibliográfica de distintos eventos científicos nacionales e internacionales, tales como las reuniones de la Sociedad Mexicana de Planctología (SOMPAC), el Congreso Nacional de Ciencia y Tecnología del Mar de la Secretaría de Educación Pública (SEP), el Congreso Nacional de Ficología de la Sociedad Ficológica Mexicana, el Congreso Latinoamericano de Ciencias del Mar (COLACMAR), el Simposio Internacional de Biología Marina, los "Talleres de Florecimientos Algales Nocivos en México", la reuniones nacionales de "Expertos en animales ponzoñosos y venenosos" del IBT-Universidad Nacional Autónoma de México (UNAM), Inst. Bioclon-Laboratorio Silanes, la reunión Internacional en "Mycotoxins & Phycotoxins" organizado por la Unión Internacional de Química Pura y Aplicada ) IUPAC (por sus siglas en inglés), el Congreso Mundial de Toxinología de la IST y la II Reunión Internacional de Toxinas de Hongos y Algas para la Industria. Se consultaron los manuales de las diferentes instancias gubernamentales coordinadas por la Secretaría de Salud bajo la responsabilidad de la Comisión Federal para la protección contra Riesgos Sanitarios (COFEPRIS) y el Programa Mexicano de Sanidad de Moluscos Bivalvos (PMBSMB) (http://10.0.253.251Intranet/proyectos/Manuales/Lineamientos%20Marea%20Roja.html). También se consultaron publicaciones periódicas internacionales como el "Harmful Algal News", las "Conferencias Internacionales de Harmful Algal Blooms" de la Sociedad Internacional para el Estudio de los Florecimientos Algales Nocivos (ISSHA) y literatura especializada publicada como artículos científicos en revistas indizadas, así como capítulos de libros especializados.
Para detectar los foros tradicionales de difusión de trabajos de investigadores mexicanos, se realizó una búsqueda de publicaciones sobre la temática de FAN desde 1940 y hasta abril, 2011 en la base de datos DIALOG WEB dentro de la categoría de "Water and Aquatic Sciences", que incluye 24 base de datos (http://www.dialogweb.com/servlet/navigation7navigationkey=DialogWeb.root). Para el análisis de las citas se consideraron aquellas con la presencia de autores o coautores mexicanos en los artículos. Los resultados se agruparon por temática, considerándose si estaban publicados en revistas indizadas o no, o bien en libros o capítulos de éstos.
DISCUSIÓN
Especies de fitoplancton responsables de FAN en México. En México existen varias especies microalgales que han sido responsables de FAN y que han impactado a diversos organismos causando intoxicaciones y muerte en el hombre (Tabla 1). A continuación se detalla la información que se conoce de algunas de las especies responsables de FAN más estudiadas en México.
Gymnodinium catenatum Graham, es un dinoflagelado productor de toxinas paralizantes que se distribuye a lo largo del Pacífico Mexicano (Band-Schmidt et al., 2010). Es una de las especies formadoras de FAN de la cual se tiene mayor cantidad de información publicada por autores mexicanos. Fue descrita por primera vez en el Golfo de California (Graham, 1943). Existen pocos registros sobre las condiciones físicas y químicas de los diversos ecosistemas relacionados con los FAN de G. catenatum en México. Sin embargo, de la información existente, se puede concluir que esta especie tolera un amplio intervalo de temperatura, salinidad y proporciones de N:P, lo que probablemente ha permitido su amplia distribución en el Pacífico Mexicano (Band-Schmidt et al., 2010). Los análogos de saxitoxinas que comúnmente se presentan en cepas de G. catenatum del Pacífico Mexicano son: dcSTX, dcGTX2-3, C1 y C2 (Band-Schmidt et al., 2005a). Se han publicado los efectos de estas toxinas en moluscos, ratones y crustáceos (Alonso-Rodríguez et al., 2004b; Estrada et al., 2007, 2010; Pérez-Linares et al., 2008, 2009; Núñez-Vázquez et al., 2008a; Heredia-Tapia et al., 2010). Sin embargo, en el copépodo Acartia clausi (Giesbrecht, 1889) no se encontraron efectos adversos a corto plazo (Palomares-García et al., 2006). Recientemente se han reportado toxinas tipo benzoato (GC1, GC2 y GC3) en una cepa de G. catenatum del Golfo de California (Bustillos-Guzmán et al., 2011), aunque aún falta por comprender las implicaciones que puedan tener estas nuevas toxinas en la regulación sanitaria. Para mayores detalles sobre los FAN de esta especie en México, se puede consultar la revisión realizada por Band-Schmidt et al. (2010).
Pyrodinium bahamense Plate, otro dinoflagelado productor de toxinas paralizantes, es la especie que más intoxicaciones y muertes ha causado en México. Se ha reportado en la región del Golfo de Tehuantepec (Sotomayor-Navarro, 1994), las costas de Guerrero (Gárate-Lizárraga et al., 2011), de Michoacán (Orellana-Cepeda et al., 1998), Golfo de México y el Caribe (Gómez-Aguirre & Licea-Durán, 1998), encontrándose elevadas concentraciones de toxinas paralizantes en moluscos (520-7309 ug equiv. STX 100 g-1) durante FAN de esta especie. Los eventos en el Golfo de Tehuantepec, Oaxaca, en las costas de Guerrero y Michoacán se debieron a la variedad compressum (Bohm) Steidinger, Tester et Taylor de P. bahamense (Orellana-Cepeda et al., 1998; Ronsón-Paulín, 1999; Gárate-Lizárraga et al., 2011). En el FAN de 1995 en las costas de Guerrero y Michoacán se registró una gran mortandad de tortugas y peces (Orellana-Cepeda et al., 1998). En la parte sur del Golfo de México P. bahamense se presenta de manera contínua en diversos estuarios y bahías (Gómez-Aguirre & Licea, 1998; Poot-Delgado & Guzmán-Noz, 2010), encontrándose altas densidades en zonas de manglar (hasta 3000 cel mL-1) en un amplio intervalo de salinidad (3-38 ups) (Gómez-Aguirre & Licea, 1998). Recientemente esta especie se ha registrado en el sur del Golfo de California en abundancias de bajas a moderadas (100110 x 103 cel L-1), presentando una mayor similitud con la variedad bahamense (Martínez-López et al., 2007; Morquecho, 2008a). Al igual que en el Golfo de México, los florecimientos se presentaron en lagunas costeras someras, rodeadas por manglares durante los meses cálidos (25-32 °C), en temporada de lluvias y asociados con concentraciones relativamente elevadas de amonio y fosfatos (Morquecho et al., 2010). Los efectos tóxicos de toxinas paralizantes de moluscos bivalvos (PSP) asociados a FAN de P. bahamense var. compressum en el Pacífico Sur Mexicano, han sido evaluados en exposiciones agudas usando ratón como organismo modelo (Núñez-Vázquez et al., 2008a). Los perfiles cromatográficos de estas toxinas durante los eventos (1989, 1995 y el 2001) que han tenido el mayor impacto en la salud pública en México estuvieron compuestos por STX, GTX2, dcSTX, dcGTX2, dcGTX3 y B1 en el ostión Crassostrea iridesens (Hanley, 1854) STX, NeoSTX, GTX2, GTX3 y B1 en la almeja Donax gracilis (Hanley, 1845) y STX, GTX2, GTX3 y B1 en el mejillón Modiolus capax (Conrad, 1837). En todos los perfiles predominaron las toxinas carbamatadas (Núñez-Vázquez et al., 2007a), de mayor potencial tóxico. A la fecha, no existen estudios de laboratorio referentes a la influencia de factores físicos y químicos sobre la el potencial tóxico de cepas mexicanas de P. bahamense.
Karenia brevis (Davis) G. Hansen et M0estrup, es un dinoflagelado productor de brevetoxinas, agente de FAN en el Golfo de México, generalmente en verano-otoño (Licea et al., 2004), causando mortandad masiva de peces en varias ocasiones, irritaciones en las vías respiratorias en el humano por la transmisión de las toxinas a través del aerosol marino, así como intoxicaciones a través del consumo de moluscos contaminados. Existen reportes desde 1648 en el Golfo de México, de FAN nocivos que sobre la base de las descripciones disponibles (mortandad de peces, irritación en las vías respiratorias) se han asociado con K. brevis (Magaña et al., 2003). Esta especie se ha reportado desde Tamaulipas (Ramírez-Camarena et al., 2006) hasta las costas de Yucatán (Cortés-Altamirano et al., 1995). Se han registrado densidades de hasta 2.3 x 107 cel L-1 en diciembre 2001-enero 2002 en las costas de Veracruz (Secretaría de Salud de Veracruz, 2007). A pesar de ser una especie que causa serias intoxicaciones en las costas mexicanas, no existen datos sobre las condiciones ecológicas que favorecen su presencia.
Especies de diatomeas del género Pseudo-nitzschia spp. se han reportado recientemente en diversos sitios del Pacífico Mexicano, desde Sinaloa hasta B. C. (Sierra-Beltrán et al., 1997; Hernández-Becerril, 1998) y en el Golfo de México (Dortch et al., 1997; Poot-Delgado & Guzmán-Noz, 2010). Varias especies de este género producen ácido domoico, una potente neurotoxina responsable del envenenamiento amnésico (ASP). La primera asociación en México de ácido domoico, producido por Pseudo-nitzschia spp., con muerte de aves fue reportada por Sierra-Beltrán et al. (1997) en la parte sur de la península de Baja California. En 1997 en el Golfo de California, hubo otro FAN de Pseudo-nitzschia spp., donde murieron 766 aves y 67 mamíferos marinos a través del consumo de sardina con un alto contenido de P. australis Frenguelli en sus vísceras. En la Bahía de La Paz, en junio-julio del 2006, se registró un FAN de especies de Pseudo-nitzschia, siendo P. fraudulenta (P.T. Cleve) Hasle, la más abundante (Gárate-Lizárraga et al., 2007b), presentándose también P. pungens (Grunow ex P. T. Cleve) Hasle y P. pseudodelicatissima (Hasle) Hasle. En abril del 2007, en la Bahía de Todos Santos, B. C. se presentó otro FAN de especies de Pseudo-nitzschia (3.02 x 105 cel L-1), siendo P. australis Frenguelli la especie más abundante (García-Mendoza et al., 2009a). Ambos eventos se asociaron a condiciones de surgencia, lo que implica enfriamiento de la temperatura del agua y se detectó la presencia de ácido domoico en muestras de fitoplancton y en la materia orgánica partículada (Gárate-Lizárraga et al., 2007b; García-Mendoza et al., 2009a).
En la parte norte del Golfo de México se han reportado Pseudo-nitzschia spp. de 1990 a 1995, con una abundancia de hasta 1 x 105 cels L-1(Dortch et al., 1997). En uno de los eventos de FAN en esta región se identificó a la especie responsable como P. pseudodelicatissima, que puede ser tóxica (Schnetzer et al., 2007). También se ha reportado a P. multiseries (Hasle) Hasle, una especie citada como tóxica (Fryxell et al., 1990). Poot-Delgado & Guzmán-Noz (2010) en la Bahía de Campeche, reportaron a Pseudo-nitzschia sp. en diciembre 2007 y marzo 2008 con densidades de 6.4-800 x 103 cel L-1.
Especies de Raphidophyceae han sido pobremente estudiadas en México, debido a que las células se desintegran con los fijadores tradicionalmente usados para la preservación de muestras de fitoplancton. Se han reportado varias especies en nuestras costas: Fibrocapsa japonica Toriumi et Takano (Cortés-Lara et al., 2003; Band-Schmidt et al., 2004a), Heterosigma akashiwo (Y. Hada) Y. Hada ex Y. Hada et M. Chihara (Band-Schmidt et al., 2004a), Chattonella marina (Subrahmanyan) Y. Hara et Chihara (Band-Schmidt et al., 2004a, 2005b; Barraza-Guardado et al., 2004; Cortés-Altamirano & Licea-Durán, 2004; Gárate-Lizárraga et al., 2009b; López-Cortés et al., 2011), C. ovata Y. Hara et Chihara (Barraza-Guardado et al., 2004; Cortés-Altamirano et al., 2006b) y C. subsalsa Biecheler (Martínez-López et al., 2006). Estas especies producen un gran número de compuestos tóxicos, brevetoxinas y compuestos análogos (Khan et al., 1995; 1996a, b, 1997; Bourdelais et al., 2002) así como sustancias reactivas de oxígeno (Ishimatsu et al., 1996), incluyendo peróxido de hidrógeno, anión superóxido y radicales hidroxilo (Oda et al., 1994; Tanaka et al., 1994; Twiner & Trick, 2000; Kim et al., 2001), ácidos grasos poliinsaturados libres (Okaichi, 1987), hemaglutininas y hemolisinas (Ahmed et al., 1995; Kuroda et al., 2005). Se ha sugerido que varios de estos compuestos contribuyen a la muerte de peces, dañando los tejidos branquiales y ocasionando la muerte por asfixia (Kim et al., 2001; Tiffany et al., 2001). En México, se han asociado FAN de Chattonella spp. a la mortandad de peces y especies bentónicas en la Bahía Kun Kaak, Sonora en abril de 2003 (Barraza-Guardado et al., 2004) y en las costas de Sinaloa, en abril-mayo del 2006 (Cortés-Altamirano et al., 2006b). En la Bahía de La Paz B.C.S. en el 2005, se reportó una FAN de C. marina (1.9-3.5 x 106 cel L-1) (Band-Schmidt et al., 2005b) y en este mismo año en la Bahía de Navachiste, Sinaloa, hubo un FAN de C. subsalsa, con una abundancia entre 5.0 x 105 y 9.6 x 105 cel L-1 (Martínez-López et al., 2006), si bien en ninguno de esos eventos se observó mortandad de peces. Poco se conoce sobre la ecología de estas especies en aguas mexicanas. Entre marzo y mayo de 2009 se encontró C. marina en la Bahía de La Paz, B.C.S., relacionándose las mayores abundancias con la relajación de los procesos de mezcla (López-Cortés et al., 2011).
Dos especies de Cochlodinium, C. catenatum Okamura y C. polykrikoides Margalef se han reportado en el Pacífico Mexicano desde B.C.S. hasta Colima (Figueroa-Torres & Zepeda-Esquivel, 2001; Cortés-Altamirano & Licea-Durán, 2004; Cortés-Lara et al., 2004; Gárate-Lizárraga et al., 2004a; Ortíz-Lira & Jiménez-Quiroz, 2006; González-Chan et al., 2007), causando la muerte de peces por asfixia (Cortés-Lara et al., 2004; Gárate-Lizárraga et al., 2004a; Ortíz-Lira & Jiménez-Quiroz, 2006). La toxicidad de un aislamiento obtenido de un FAN de C. polykrikoides de la Bahía de La Paz, B.C.S., se evaluó en condiciones experimentales en lisas (Mugil sp.), provocando una mortalidad del 33% (Núñez-Vázquez et al., 2003), posteriormente Dorantes-Aranda et al. (2009, 2010) evaluaron en detalle el efecto tóxico de una cepa obtenida de la Bahía de La Paz, B.C.S. de esta misma especie en pargos lunarejos (Lutjanus gutattus Steindachner, 1869) en cultivo, detectando un importante efecto tóxico a corto plazo. Este dinoflagelado disminuyó la actividad catalasa en el hígado del pez y peroxidación de lípidos. Los peces expuestos a los dinoflagelados, desarrollaron una secreción anormal de moco en las branquias, que estuvo directamente relacionada con la concentración de células de algas. Así se presentó una inhibición de la catalasa hepática y un aumento en la secreción de moco en las branquias cuando se expusieron a 2 x 106 cel L-1 de C. polykrikoides. La peroxidación lipídica fue significativamente diferente en 4 x 106 cel L-1 y el índice de hepatosomático disminuído en 3 x 106 cel L-1. Concluyendo que estos resultados sugieren que el estrés oxidativo contribuye, al menos en parte, en la ictiotoxicidad de esta cepa de C. polykrikoides. Adicionalmente, esos autores detectaron actividad hemolítica en eritrocitos de peces y humanos. La concentración de C. polykrikoides que causo hemólisis en un 50% (HE50) fue 4.88 y 5.27 x 106 cel L-1, para los peces y los eritrocitos humanos, respectivamente. Dado que los ácidos grasos se han asociado con la actividad hemolítica en C. polykrikoides, también se analizó la composición de los ácidos grasos de este dinoflagelado. Los ácidos grasos poliinsaturados: hexadecaenoico (16:0), docosahexaenoico (22:6 n3) y octadecapentaenoico (18:5 n3), fueron encontrados en una abundancia de 62% del totales de ácidos grasos.
La toxicidad de C. polykrikoides, al igual que con las Raphidophyceae se ha relacionado con la presencia de sustancias reactivas de oxígeno (Kim et al., 1999), toxinas hemolíticas (Kim et al., 2001), ácidos grasos poliinsaturados libres (Lee, 1996), concluyéndose que su efecto se debe a una combinación de estos compuestos (Kim et al., 2002). La mayor abundancia de C. catenatum en costas mexicanas se reportó en Bahía de Banderas, Jalisco, en julio-diciembre del 2000, con 10,841 cel mL-1 (Cortés-Lara et al., 2004), en un rango de temperatura de 25 a 32 °C y una salinidad entre 33 y 35 ups. En Bahía de La Paz, en el año 2000, la presencia C. polykrikoides se relacionó con las lluvias, la eutrofización y una temperatura entre 29 y 31 °C (Gárate-Lizárraga et al., 2004a). Son pocas las diferencias taxonómicas entre C. catenatum y C. polykrikoides, dificultando su identificación a nivel de especie. El epicono de C. catenatum es subhemisférico en la parte anterior y el epicono de C. polykrikoides es cupuliforme. La principal diferencia entre ambas especies es la presencia de un estigma (Margalef, 1961). La identificación mediante la secuencias de la región D1-D3 de la LSUrDNA de una cepa aislada de la Bahía de La Paz confirmó su identificación como C. polykrikoides (Mikulski et al., 2008).
El efecto de algunas cepas aisladas del Golfo de California, tales como Prorocentrum lima (Ehrenberg) Dodge, Prorocentrum minimum (Pavillard) Schiller y Amphidinium carterae Hulburt han sido evaluados en ratones así como en levaduras, artemia, peces, camarones y almejas (Heredia-Tapia et al., 2002; Núñez-Vázquez et al., 2003, 2008a; Campa-Córdova et al., 2009). En P. lima, adicionalmente a la presencia de ácido ocadaico, dinofisistoxina-1 y diolésteres (Heredia-Tapia et al., 2002), se determinó la actividad para toxinas de acción rápida (FAT, tipo prorocentroluros) en extractos butanólicos (Núñez-Vázquez et al., 2003), así como se determinó la activación de la enzima superóxido dismutasa (SOD) por estrés oxidativo en camarones y almejas expuestos a distintas concentraciones de esta alga (Campa-Córdova et al, 2009). En P. minimum no se presentó actividad por exposición aguda en ninguno de los organismos evaluados y en A. carterae solo en el caso del bioensayo en ratón se presentó mortalidad (Núñez-Vázquez et al., 2003).
En las costas mexicanas existen muchas más especies de microalgas tóxicas o nocivas como: Akashiwo sanguinea (Hirasaka) Hansen et Moestrup, Ceratium furca (Eherenberg) Claparede et Lachman, Chaetoceros spp., Gambierdiscus spp., entre otras, que han causado diversos impactos en nuestras costas (Tabla 1). De la mayoría de estas especies sólo existen registros puntuales sobre los que se tienen datos del lugar el evento, sus impactos y es sobre la base de literatura científica de otros países que se asume su potencial tóxico o nocivo.
Además de las especies que han causado algún impacto en las costas de México existen otras especies tóxicas como Alexandrium spp., Ostreopsis spp., Dinophysis spp., entre otras, que se han registrado en nuestras costas y que constituyen riesgos potenciales de formación de FAN (Tabla 2). Varias de ellas son productoras de neurotoxinas, palitoxinas, toxinas diarreicas, toxinas amnésicas y ciguatoxinas, pudiendo llegar a causar diversos tipos de intoxicación en diversos organismos y en el hombre. Además de las especies tóxicas existen especies como Chaetoceros spp., Fibrocapsa japonica, Chattonella spp., Prorocentrum spp., etc., productoras de metabolitos no considerados como toxinas, tales como las especies reactivas de oxígeno (ERO), ácidos grasos poliinsaturados libres, y mucílagos, pero que pueden causar efectos letales en otros organismos. Por ello es necesario considerar estas especies dentro de los planes de monitoreo nacionales.
MONITOREO Y PREVENCIÓN
En diferentes partes del mundo y en México, los FAN son eventos recurrentes y han ocasionado alteraciones en los ecosistemas marinos costeros e impactos negativos en actividades productivas como la pesca, acuicultura e indirectamente el turismo (Hallegraeff, 1995; Smayda, 1997; Anderson et al., 2002; Hodkiss & Lu, 2004; Granéli, 2005; Hernández-Becerril et al., 2007), registrándose en algunos casos pérdidas económicas de hasta 300,000 USD día-1 (Llewellyn et al., 2006). El impacto en la economía, la salud ambiental y del humano ha generado la implementación de estrategias de monitoreo, prevención y mitigación sistemática para evaluar probables efectos de los FAN (Franks, 1995; GEOHAB, 2006). En México, la Secretaría de Salud (SS)-Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), la Dirección de Regulación Sanitaria, la Secretaría de Marina (SE-MAR) y el Centro de Estudios Tecnológicos del Mar, dependiente de la Secretaría de Educación Pública (CETMAR-SEP), realizan monitoreos mensuales y obtienen muestras de fitoplancton y medidas de variables físicas y químicas con la finalidad de detectar FAN en una etapa temprana y establecen medidas de prevención cuando las especies responsables sean tóxicas o nocivas. Cabe destacar que estas instituciones tienen una amplia cobertura nacional durante sus muestreos mensuales, por lo que deben tener un gran acervo de información aún por difundir. Otras instituciones de investigación como el Instituto de Ciencias del Mar y Limnología (ICMyL)-Unidad Mazatlán-UNAM y el Instituto Tecnológico de Sonora (ITS), también han realizado monitoreos, sin embargo, los únicos registros a largo plazo de los FAN que existen son los realizados en las costas de Sinaloa y de Guaymas (Cortés-Altamirano, 1987; Manriquez & Molina, 1997; Cortés-Altamirano & Licea-Durán, 2004). Recientemente la Universidad Nacional Autónoma de México (UNAM) y otras instituciones ubicadas en las costas del Pacífico mexicano (Jalisco, Colima, Michoacán y Oaxaca) implementaron la primera campaña en un buque oceanográfico (El Puma-UNAM) con el objetivo específico de estudiar especies productoras de FAN (Hernández-Becerril et al., 2009). El Instituto Nacional de la Pesca (INAPESCA-SEMARNAT) también realiza monitoreos sistemáticos y ha incluido dentro de su página web un sitio denominado "Mareas rojas, florecimientos algales y pesquerías en México" (Barón-Campis et al., 2009; www.inapesca.gob.mx). A partir del 2009 el Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE) implementó un laboratorio especializado llamado FICOTOX para, entre otras actividades, realizar monitoreos de ficotoxinas marinas abarcando la costa occidental de Baja California y California, E.U.A. (García-Mendoza et al., 2009b), iniciando formalmente sus actividades con cursos, asesorías y servicios a partir del 2010 (Peña-Manjarrez, com. pers.). La Universidad de Colima (UCol) en colaboración con la UNAM también está realizando monitoreos estratégicos en las costas de Colima. La Universidad Autónoma Metropolitana Iztapalapa (UAMI) lleva a cabo muestreos en diferentes regiones costeras del país, incluyendo la Bahía de Acapulco (proyecto CONABIO HJ014) además de contar con un cepario de microalgas productoras de FAN (Rodríguez-Palacios et al., 2007). Así también el Centro Interdisciplinario en Ciencias Marinas (CICIMAR-IPN) y el Centro de Investigaciones Biológicas del Noroeste (CIBNOR), han incrementado sus investigaciones de los FAN en la Bahía de La Paz, Bahía Concepción, Bahía Magdalena y otras regiones del Golfo de California y el Pacífico mexicano (Sierra-Beltrán et al., 1996; Gárate-Lizárraga et al., 2001, 2002, 2004b; Morquecho & Lechuga-Devéze, 2003; Band-Schmidt et al., 2004b; López-Cortés et al., 2006, 2008a,b; Martínez-López et al., 2006; Morquecho, 2008b). El CIBNOR cuenta además con una colección de dinoflagelados marinos (CODIMAR-CIBNOR) (http://www.cibnor.mx/eplant.php?pagID=colecciones/codimar/vincul).
En el Golfo de México también participan diversas instituciones en el estudio y monitoreo de FAN: la UNAM con sus diferentes Unidades Académicas, la SEMAR-Armada de México, CINVESTAV-IPN-Unidad Mérida, el Instituto de Ciencias Marinas y el Instituto de Investigación de Pesquerías de la Universidad Veracruzana (UV). En la península de Yucatán el CINVESTAV-IPN, Unidad Mérida desde 1998, implementó un programa de investigación y monitoreo de FAN (Herrera-Silveira et al., 2009). También en Veracruz y Tabasco desde hace 10 años, se llevan a cabo monitoreos sistemáticos para la detección de FAN por los Servicios de Salud de Veracruz (http://sesver.ssaver.gob.mx/portal/page7_pageid=693,1&_dad=portal&_schema=PORTAL). En los diferentes estados de la República Mexicana ubicados en los litorales del Golfo de México se estableció un Plan Binacional para la atención de FAN, que incluye por la parte mexicana a Tamaulipas, Veracruz, Tabasco, Campeche, Yucatán y Quintana Roo, y por la parte Norteamericana a Texas, Lousiana, Mississippi, Alabama y Florida. Este acuerdo internacional tiene entre otros objetivos estandarizar los métodos de monitoreo y análisis de FAN (Álvarez-Góngora, en revisión).
En la década de los 80 se implementó el Plan Nacional de Marea Roja, el cual realizaba monitoreos regulares en zonas donde se presentaban los FAN; posteriormente en el 2001 se creó la Comisión Federal para la Protección Contra Riesgos Sanitarios (COFEPRIS), que también participa en el Plan Binacional (http://10.0.253.251Intranet/proyectos/Manuales/Lineamientos%20Marea%20Roja.html). En marzo de 2005 se integró para los litorales del Pacífico mexicano, Golfo de México y el Caribe mexicano, un Proyecto Nacional de mareas rojas con la participación de todos los estados costeros; citamos in extenso el objetivo: "Establecer un sistema de alerta temprana de FAN con el fin de aplicar medidas preventivas de manera oportuna, tendientes a evitar el consumo de moluscos bivalvos expuestos a mareas rojas toxicas". La COFEPRIS es la institución responsable de coordinar entre otras actividades, los monitoreos de FAN a nivel nacional. Esta institución ha implementado una estandarización de métodos para el monitoreo, incluyendo la recolecta de moluscos bivalvos. La estrategia se desglosa en el manual titulado "Instrucción de Trabajo para el Muestreo de Fitoplancton y Detección de Biotoxinas Marinas" (http://10.0.253.251Intranet/proyectos/Manuales/Lineamientos%20Marea%20Roja.html); su aplicación es seguida por las diferentes instancias gubernamentales nacionales involucradas en el estudio de FAN.
Los métodos de muestreo que generalmente utilizan las instituciones arriba mencionadas, son los sugeridos por la comunidad científica nacional e internacional (Schwoerbel, 1975; Ferrario et al., 1995; Franks, 1995). No obstante algunas instituciones, tales como la SEMAR-Armada de México, además de realizar los moni-toreos en coordinación con otras dependencias, realizan sobre-vuelos, y limpieza de playas, entre otras actividades durante las contingencias de FAN; otras instituciones de investigación científicas, además de los muestreos, que pueden ser sistemáticos o casuales, enfatizan sus estudios asociándolos con diferentes eventos oceanográficos como son los procesos de surgencias (Mee et al., 1986; Smayda, 1997), de transición hidrográfica (Alonso-Rodríguez & Ochoa, 2004; Hernández-Becerril et al., 2007; García-Mendoza et al., 2009a), eutrofización natural y cultural (Cortés-Altamirano & Nuñez-Pasten, 1992; Alonso-Rodríguez et al., 2003; 2004a, b; Herrera-Silveira et al., 2004, 2009; López-Cortés et al., 2006, 2008a), así como en algunos casos su toxicología (Gárate-Lizárraga et al., 2004b, 2005, 2006; Hernández-Sandoval et al., 2009). Destaca que las diferentes instituciones se han enfocado al monitoreo y al detallado estudio de una o dos especies por su grado de peligrosidad. Así pues, en la parte mexicana del Golfo de México se ha dirigido la investigación hacia especies tóxicas como K. brevis, P. bahamense y especies productoras de cigua-toxinas (Licea et al., 2004; Hernández-Becerril & Almazán-Becerril, 2004; Rodríguez-Palacios, 2007, 2009; González-Zihel, 2008; Almazán-Becerril, 2009). En el Pacífico mexicano, incluyendo el Golfo de California, los trabajos se han enfocado principalmente a G. catenatum (Mee et al., 1986; Gárate-Lizárraga et al., 2005, 2006; Band-Schmidt et al., 2010), Pseudonitzschia spp. (Gárate-Lizárraga et al., 2007b; García-Mendoza et al., 2009), P. bahamense (Martínez-López et al., 2007; Morquecho, 2008b; Gárate-Lizárraga & Armas-González, 2011) y recientemente se ha puesto mayor atención a especies del género Chattonella (Band-Schmidt et al., 2004a; Mendoza-Flores, 2011; López-Cortés et al., 2011). De este elenco de especies, algunas han sido aisladas y se han realizado estudios de autoecología, lo que ha permitido realizar estudios de ecofisiología, , su toxicidad y secuenciación genética (Band-Schmidt et al., 2004b, 2006, 2008; Mendoza-Flores, 2011).
MUESTREO BIOLÓGICO
En la actualidad no es posible predecir los eventos de FAN, por lo que es recomendable realizar un monitoreo continuo para la detección temprana de estos eventos. Algunos FAN se han podido determinar con mayor certidumbre con el uso de imágenes satelitales, aunque los estudios apoyados en esta herramienta en México son escasos, no obstante de ser una tecnología muy útil (Aguirre-Gómez et al., 1999; Álvarez-Góngora, 2009, Gómez-Villarreal et al., 2008). Las imágenes satelitales que detectan color asociado a pigmentos microalgales pueden ser útiles para detectar FAN de alta biomasa y que se encuentran distribuidas cerca de la superficie. En los otros casos de FAN de baja biomasa o distribución en capas subsuperficiales, la teledetección puede ayudar a observar distribución de variables físicas asociadas a las masas de agua donde se desarrollan los FAN.
Estrategia de muestreo. Cuando se suscita un FAN se recomienda ubicar la "mancha" con un GPS o geoposicionador, hacer una aproximación de la extensión de la mancha, toma de fotos para evaluar su coloración y se sugiere que dependiendo de la extensión se tomen muestras en diferentes sitios (Franks, 1995), dentro y fuera del ámbito del FAN. Se deben tomar dos tipos de muestras. a) las de botella, que consiste en tomar una muestra de agua de mar en la superficie (de 100 mL a 1 L); posteriormente se le agrega el fijador de elección (para detalles de uso de fijadores ver más adelante). Tomar muestras a diferentes niveles de la columna de agua también es recomendable, para lo cual se pueden utilizar diferentes modelos de botellas de cierre automático; en México rutinariamente se utilizan botellas tipo Niskin, van Dorn y Nansen (Cortés-Altamirano, 1998); de las muestras de agua proveniente de este tipo de botella, se toma una alícuota y se fija. Las muestras fijadas deben conservarse en la oscuridad y etiquetarse con la fecha y hora del muestreo, ubicación geográfica, coloración de FAN, dirección del viento y mortandad de organismos, (en este caso tomar muestras de organismos moribundos y/o muertos, para realizar la necropsia y observar posibles daños en los tejidos); b) otro elenco de muestras denominadas "de red" también deben obtenerse para realizar un análisis cualitativo de otros componentes fitoplanctónicos; incluso algunos autores, cuando se trata de especies tóxicas, han logrado identificar y cuantificar toxinas (Gárate-Lizárraga et al., 2006). La red de cierre automático también puede ser usada para muestras cuantitativas (Franks, 1995). La extracción con red para la colecta de fitoplancton se realiza con arrastres verticales a diferentes profundidades cuando la zona de muestreo tiene suficiente profundidad (Ferrario et al., 1995). La extracción se realiza con una red de nylon para fitoplancton. La abertura del poro es variada: no hay un tamaño estándar debido a los diferentes tipos y tamaño de los organismos (Ferrario et al., 1995), aunque generalmente se usan redes de 20 a 64 um de abertura de poro. La abertura de su diámetro mayor y la longitud de la red es variable: la más usada es de 20 cm por 120 cm, aunque la longitud de la red está en función de su diámetro mayor (Ferrario et al., 1995). La COFEPRIS en su instrucción de trabajo para el muestreo de fitoplancton y detección de biotoxinas marinas (http://10.0.253.251Intranet/proyectos/Manuales/Lineamientos%20Marea%20Roja.html) sugiere una red de 10 a 20 um de luz de malla. El tubo muestreador segmentado (Sutherland et al., 1992; Franks, 1995) es utilizado rutinariamente en los monitoreos coordinados por el CET-MAR combinado con redes de 23 um de luz de malla (Peña-Manjarrez, com. pers.). Para la extracción de microalgas epibentónicas y bentónicas se toman muestras de sedimento, de macroalgas y en algunos casos de fracciones de coral muerto. El uso de botellas para depositar muestras, raspado y agitación del coral y macroalgas es lo más usual (Heredia-Tapia et al., 2002; Okolodkov et al., 2007). La estrategia para la obtención de quistes de dinoflagelados recientes es variable. En ocasiones se utiliza, aunque no es muy recomendable, ya que no se mantiene la estructura del sedimento, una draga tipo Eckman para extraer sedimentos de piso marino. También se pueden emplear tubos sacatestigos, un nucleador gravitatorio, trampas de sedimento u obtención de sedimento vía buceo libre (Matsuoka & Fukuyo, 2000; Band-Schmidt et al., 2003a; Morquecho, 2004).
Fijadores. Los fijadores más utilizados para muestras de fitoplancton son: una solución de lugol, gluteraldehído y formaldehído al 4%, cuyo uso depende del grupo fitoplanctónico de interés y el objetivo del trabajo (Schowerbel, 1975; Boltovskoy, 1995; Ferrario et al., 1995; Cortés-Altamirano, 1998). Un número importante de trabajos utilizan la solución de lugol ácido, la cual además de preservar a los organismos fitoplanctónicos para el autor los colores se enmascaran con el tono del lugol, loque sí preserva son los flagelos y facilita su observación. La dosis del fijador es variada: desde pocas décimas de hasta 1 mL de lugol por cada 100 mL de agua, lo cual permite una buena fijación y evita exceso de tinción de las células. Algunos organismos durante los procesos de fijación se dañan como es el caso de la Rafidofíceas, por lo que se ha sugerido el uso de otros fijadores, o bien analizar muestras vivas. Una combinación de una solución tampón -Hepes parafolmadehído y glutaraldehído, logra conservar la densidad celular sin alterar su morfología (Katano et al., 2009).
Para la preservación de diatomeas se recomienda una solución acuosa de formaldehído comercial y ácido acético al 100% en proporción 1:1 o lugol-acético (Ferrario et al., 1995). La preservación de dinoflagelados bentónicos se realiza agregando a la muestra, formalina al 37% quedando una concentración final de 5%.
En el caso de los quistes, si el estudio implica evaluar la germinación, los recipientes que contienen las muestras se cubren con papel de estaño para evitar el contacto con la luz y se les agrega gas nitrógeno para evitar la germinación. Si sólo se tiene interés en cuantificar e identificar los quistes, se recomienda fijar las muestras de sedimento con formol neutro (10 % del volumen de la muestra) o con gluteraldehído (30 % del volumen de la muestra) la cantidad de fijador, limpieza y concentrado de quistes dependerá de la cantidad de materia orgánica y los objetivos del estudio (Matsuoka & Fukuyo, 2000; Peña-Manjarrez et al., 2005).
Cuantificación de células. Los métodos de conteo de células vegetativas están documentadas detalladamente en Cortés-Altamirano et al. (1998). Para la cuantificación de quistes se puede utilizar una cámara de conteo de Sedgwick-Rafter; para facilitar el conteo de especies tecadas se agrega a la cámara una o dos gotas de una solución de azul de Trypan. El número de células se calcula en relación al peso húmedo del sustrato (Delgado et al., 2005; Okolodkov et al., 2007).
Sensores remotos. Desde 1975, Murphy et al. (1975) iniciaron estudios de fitoplancton tóxico utilizando sensores remotos. Las imágenes de satélite de temperatura superficial del mar, remolinos y frentes oceanográficos, así como la altura del nivel del mar y clorofila a entre otras variables, son una herramienta a gran escala para detectar FAN (Franks, 1995; Hernández-Becerril et al., 2007). A pesar de la sensibilidad de estos sensores, son necesarios los muestreos in situ para correlacionarlos con las imágenes de satélite. En las costas de México se han instalado boyas para el monitoreo de FAN, en el Golfo de México dentro del convenio bilateral para el monitoreo y seguimiento de FAN, principalmente de K. brevis, que incluyó la instalación de tres multisensores en la costa de Veracruz, que registran la temperatura, el pH, la clorofila a y el sílice. Conjuntamente se realizan análisis de brevetoxinas en tiempo real en puntos establecidos. En esta región, también se cuenta con el programa Sistema de Observación de Florecimientos de Algas Nocivas (HABSOS, por sus siglas en inglés), que tiene una aplicación regional basada en el uso del internet para compartir datos, participando instituciones americanas y mexicanas. Este sistema proporciona información de la temperatura del océano, corrientes superficiales, resultados de mediciones oceánicas y atmosféricas, imágenes de satélite y conteos de K. brevis (http://habsos.noaa.gov). También se cuenta con la Estación de Recepción México de la Constelación Spot (ERMEX), que permite el intercambio de imágenes para realizar monitoreos regionales de los FAN.
Traslado de especies. En México existen escasos estudios acerca de microalgas transportadas en las aguas de lastre de los barcos. Diversos especies pueden ser transportados por el agua de estos contendores (Carlton, 1985). En el caso de la ruta marítima entre Manzanillo, México y Hong Kong, China, y en la ruta marítima del puerto de Oakland, E.U.A. a Hong Kong, China se ha documentado el transporte de especies nocivas y tóxicas de diatomeas y dinoflagelados (Dickman & Zhang, 1999; Zhang & Dickman, 1999). A pesar de su relevancia en la biogeografía y acuicultura (Hallegraeff & Bolch, 1992), no existen investigaciones acerca de este tema en México. Desde 1997, los estudios formales de aguas de lastre fueron implementados por diferentes países (Hallegraeff, 1995). En la actualidad México se encuentra entre los 28 países que firmaron la ratificación del "Convenio Internacional para el Control y Gestión del Agua de lastre y Sedimentos de los Buques (BWM Convention) (http://www.IMO.org/OurWork/Environmental/BallastWatermanagement), el cual establece procedimientos para el tratamiento y control del agua de lastre, es necesario aplicar este convenio rigurosamente en México. Es probable que las instancias gubernamentales como COFEPRIS, SEMARNAT y SMAR, que tienen acceso a los contenedores de las aguas de lastre de los barcos que ingresan y egresan en los diferentes destinos marítimos, cuenten con los resultados de los análisis de las muestras de agua que deberían ser dados a conocer a la comunidad científica mexicana como una estrategia de comunicación y apoyo recíproco.
Además es necesario, la aplicación de métodos para eliminar especies exóticas y sus diferentes formas de resistencia. Los métodos sugeridos son: el intercambio de agua de lastre en aguas oceánicas (Williams et al., 1988; Zhang & Dickman, 1999), el aumento de la temperatura del agua (Hallegraeff et al., 1997), y tratamientos químicos y físicos del agua y sedimento entre otros (Bolch & Hallegraeff, 1993; Montani et al., 1995).
La acuicultura es una de las actividades con grandes impactos económicos; sin embargo, alteraciones en el ambiente béntico y pelágico han favorecido la presencia de especies que forman FAN (Gowen & Bradburry, 1987; Delgado et al., 1996; Orellana-Cepeda et al., 2004; Alonso-Rodríguez et al., 2004a; Buchmann et al., 2006). En México, algunas investigaciones de FAN asociadas a la acuicultura, se refieren al cultivo de camarón y atún (Cortés-Altamirano & Agraz, 1994; Cortés-Altamirano et al., 1997; Cortés-Altamirano & Licea-Durán, 1999; Gárate-Lizárraga et al., 2008; Alonso-Rodríguez et al., 2004a, b; Orellana-Cepeda et al., 2004). El transporte comercial de moluscos y peces para cultivo también es un vector de especies de microalgas invasoras (Zenetos et al., 2009) que no están totalmente controladas en México. Otras actividades antrópicas también han influído en la expansión de los nichos de especies productoras de FAN, como es el caso de Gambierdiscus toxicus Adachi et Fukuyo. Esta especie ha ampliado su hábitat en diversos sustratos que favorecen su establecimiento y proliferación, tales como las plataformas petroleras, arrecifes muertos y arrecifes artificiales (Kohler & Kohler, 1992; Lehane & Lewis, 2000; Villareal et al., 2007).
MITIGACIÓN
Debido al impacto de los FAN se han sugerido e implementado en algunos países métodos para su control, los cuales incluyen: métodos físicos como la centrifugación (Kordi, 1998), biológicos (protistas pastoreadores) (Jeong, 2001) y métodos químicos, tales como el propuesto por Jeong y colaboradores (2002), usando hipocloruro de sodio (NaOCl) obtenido por electrólisis del agua de mar y el uso de arcillas (Sengco, 2001; Pan, 2006a; Zou et al., 2006). Las arcillas ecológicamente inertes son de los compuestos minerales no metálicos más empleados en el control de algunos eventos de FAN, debido a su alto poder de floculación y coagulante (Sengco, 2001). Actualmente las arcillas, como es el caso de la arcilla fosfática, la cual es eficiente para controlar proliferaciones de K. brevis (Sengco et al., 2001), son utilizadas en países asiáticos para mitigar los FAN. Con esta misma arcilla se obtuvo un 100 % de eficacia en el control a nivel experimental del dinoflagelado Heterocapsa triquetra (Ehrenberg) Stein (Archambault et al., 2003). Sin embargo, también se demostraron los efectos nocivos de los agregados arcilla- H. triquetra en las branquias de algunos bivalvos, lo que sugirió incrementar las investigaciones acerca de los efectos en la fauna bentónica y los procesos de remoción (Archambault et al., 2003; Sengco & Anderson, 2004). Para el control de la Chrysophycea Aureococcus anophagefferens Margraves et Sieburth bajo condiciones experimentales, resultó muy eficaz el uso de la kaolinita (Yu et al., 2004). La combinación de otros compuestos con arcillas también se ha probado experimentalmente. Tal es el caso de la bentonita húmeda combinada con cloruro de polialuminio, en donde la eficiencia de floculación para controlar a la Haptophycea Prymnesium parvum N. Carter, ha sido entre 80% y 100% de éxito dependiendo de la concentración celular (Sengco et al., 2005). Sin embargo, además de la eficiencia de floculación, también debe evaluarse la eficiencia de remoción de los flóculos (arcilla-células algales) en los sedimentos marinos. Al respecto, Beaulieu et al. (2005), en experimentos con arcilla fosfática con hidroxicloruro de polialuminio para controlar al dinoflagelado no tóxico H. triquetra, concluyeron que con bajo flujo del agua de mar, la remoción del sedimento es poco eficiente, sugiriendo que para el uso de estos materiales minerales es importante evaluar los flujos de corrientes para evitar daños al ambiente bentónico. Una alternativa para optimizar la remoción es el uso del polisacárido natural no tóxico conocido como chitosan, el cual mezclado con algunas arcillas como la sepiolita ha demostrado tener un alto poder de floculación en florecimientos de la cianobacteria Microcystis aeruginosa (Kützing) Kützing, en lagos y estanques altamente eutrofizados, con una eficiente remoción en los sedimentos (Pan et al., 2006b). En México únicamente existen tres referencias al respecto: López-Cortés et al. (2007) mencionan que G. catenatum puede ser removido eficientemente con bentonita cálcica; Fausto-Sotelo (2009) evaluaron experimentalmente, con juveniles de camarón Litopenaeus vannamei (Kützing) Kützing, el efecto de caolín y arcilla roja para controlar el FAN de C. polykrikoides y G. catenatum, concluyendo que el uso de estas arcillas no afectó la salud del camarón, ni alteró la toxicidad de esos dinoflagelados.
FICOTOXINAS
Las especies causantes de los FAN, además de los efectos asociados a la degradación del ecosistema, por su oxidación después de la fase de decaimiento (anoxia), taponamiento de branquias, etc., producen metabolitos que pueden afectar directamente a los organismos a los que son expuestos. Estas moléculas, conocidas como ficotoxinas marinas, son metabolitos secundarios que generalmente se clasifican, de acuerdo a los síntomas que producen en humanos, como toxinas paralizantes (PSP), diarreicas (DSP), amnésicas (ASP), ciguatoxinas (CFP) y de acción rápida (FATs). También existen las brevetoxinas (NSP), azaspirácidos (AZP) y palitoxinas (PTXs) (Yasumoto & Murata, 1993; FAO, 2005; Lagos, 2002) (Tabla 3) entre otras. Los síntomas de los AZP tienen efectos en las vías respiratorias, hígado y sistema digestivo (similar a las toxinas diarreicas) del hombre.
Los FAN tóxicos además de causar impacto durante la duración del evento, pueden presentar efectos negativos posteriores, que consisten en la alteración en la sucesión de especies de los ecosistemas, depositación de materia orgánica, alteración en la comunidad bentónica y acumulación de toxinas, principalmente en organismos que se alimentan por filtración como los moluscos, en los cuales la eliminación de toxinas puede variar con el tiempo.
Así tenemos el caso de la saxitoxina (STX) y sus análogos, que no se eliminan totalmente durante la depuración y pueden permanecer o transformarse en derivados más potentes por el metabolismo de los moluscos permaneciendo por semanas, meses o años, generando un riesgo cuando se consumen (Mons et al., 1998; Sekiguchi et al., 2001; FAO, 2005). Un ejemplo es la almeja Saxidomus giganteus (De Shays), que presenta un tiempo de depuración de toxinas paralizantes prolongado, requiriéndose al menos un año para que esta especie las elimine por completo (Mons et al., 1998). Existen otras especies de organismos filtradores, como los mejillones, en los que la asimilación y eliminación de las toxinas paralizantes se lleva a cabo en semanas (FAO, 2005). Para el caso de especies de moluscos de nuestros litorales, los estudios de depuración solamente se han realizado con la almeja chocolata (Megapitaria squalida Sowerby, 1835), presentando una tasa de depuración moderada de 2 a 3 semanas (Pérez-Cruz, 2007). Hernández-Sandoval et al. (2009), aunque no midieron los tiempos de depuración en moluscos, demostraron durante un FAN de G. catenatum en la Bahía de La Paz, B.C.S., una biotransformación de toxinas menos potentes N-sulfocarbamatadas a toxinas más potentes (carbamatadas) en Dosinia ponderosa (Gray), Periglypta multicostata (Sowerby, 1835), M. squalida, Pinna rugosa (Sowerby, 1835) y Modiolus capax (Conrad, 1837).
A nivel nacional e internacional, diferentes instituciones del sector salud, productivo y de investigación han implementado métodos de control de alimentos marinos contaminados con toxinas para disminuir el riesgo de intoxicaciones humanas (Bern & Luckas, 2008; EFSA 2009, 2010). Las organizaciones mundiales de salud y de control de la seguridad alimentaria reconocen que las ficotoxinas constituyen un problema de salud pública internacional y que las estrategias de veda, basadas en monitoreos son una alternativa de prevención efectiva para evitar el consumo de organismos potencialmente tóxicos (Quilliam, 2003a,b; FAO, 2005; Bern & Luckas, 2008; http://www.cofepris.gob.mx/).
TÉCNICAS EMPLEADAS PARA LA DETECCIÓN DE FITOTOXINAS
Los límites máximos permisibles de concentración de toxinas para el consumo de moluscos en la Unión Europea son establecidos por la European Food Safety Authority (EFSA) (Tabla 4). En México también hay una Norma Oficial, la cual se basa en métodos oficiales estandarizados para la detección de toxinas (AOAC, 1995; NOM-242-SSA1-2005 México; Lawrence et al., 1995 (DA)) (Tabla 5, esta NOM establece que los límites máximos permisibles para el consumo de carne de molusco para toxinas paralizantes es de 800 mg equivalente de saxitoxina/kg, para toxinas diarreicas 160 μg de equivalente de ácido okadaico/kg, para toxinas amnésicas 20 mg de ácido domoico/kg, para neurotoxinas 20 UR/100 g, para yesotoxinas 1 mg/kg, para azaspirácidos 160 mg de equivalente de azaspirácido/kg y para ciguatoxina 2.5 UR/100 g). Dada la oficialidad de esta norma, el bioensayo en ratón es el único ensayo legalmente aceptado para que las autoridades de salud tomen las medidas adecuadas de mitigación y establecimiento de la veda sanitaria total o preventiva en la zona afectada.
En los últimos años exceptuando los análisis de ácido domoico que deben realizale por HPLC de acuerdo a la técnica de Wekel et al., 1995, los métodos físico-químicos para la identificación y detección de toxinas adquirieron una gran aceptación por su rapidez, sensibilidad, precisión y reproductibilidad. Desde una perspectiva humanitaria, son métodos que evitan el sacrificio de animales de laboratorio. Se han realizado trabajos de intercalibración donde se han comparado los resultados obtenidos mediante bioensayo en ratón con los obtenidos por cromatografía líquida de alta resolución (HPLC) (Rourke et al., 2008) con resultados muy alentadores. Estos nuevos métodos podrían ser una alternativa para la determinación de toxinas paralizantes tanto para trabajos de investigación como de regulación sanitaria (Jellett et al., 1992), y así evitar el sacrificio de animales. El uso de HPLC con detectores (arreglo de diodos), de fluorescencia, electroquímicos, espectrometría de masas y masas-masas, proporcionan una mayor sensibilidad para la cuantificación y precisión, además de la ventaja de poder ser automatizados.
SITUACIÓN NACIONAL SOBRE MÉTODOS PARA ANÁLISIS DE TOXINAS MARINAS
Actualmente los laboratorios de salud pública de cada estado costero, supervisados por la COFEPRIS, son los responsables de recolectar muestras de moluscos en su respectivo laboratorio, en caso de no contar con un laboratorio, las muestras se envían al laboratorio certificado en la Cd. de México, lo cual es una desventaja debido a que desde la colecta, hasta el envío y análisis de muestras transcurren más de 24 h. El tiempo de respuesta debe acortarse para que la autoridad competente tome las medidas pertinentes para permitir o evitar la extracción y consumo de moluscos.
En el ámbito nacional, el Laboratorio Nacional de Referencia, perteneciente a la Comisión de Control Analítico y Ampliación de Cobertura (CCAYAC), es el responsable de realizar los análisis de bioensayo en ratón para determinación de ficotoxinas marinas (PSP, DSP, NSP y ciguatoxinas). Desde el punto de vista de capacidad analítica en las instituciones de salud estatales (pertenecientes a la COFEPRIS), sólo 2 cuentan con laboratorios acreditados para la realización de análisis de toxinas. Desde 2010, el Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR, S.C.) cuenta con un laboratorio acreditado para el análisis de toxinas amnésicas y paralizantes.
A nivel nacional existen centros de investigación e instituciones de salud como el CICESE, el CIBNOR, el CICIMAR del IPN, el INC, la Facultad de Medicina, el ICMyL de la UNAM, el CINVESTAV-IPN, el laboratorio Estatal de Salud Pública de Veracruz (LESPV), Guerrero (LESP "Antonio Soberón y Parra") y Yucatán (LESP-Yucatán), la Universidad Autónoma de Ciudad Juárez (UA-CJ), la UAM y la Universidad Autónoma de Guadalajara (UAG), que están trabajando en la implementación de técnicas no acreditadas para la determinación de toxinas marinas como son: cromatografía con detección de fluorescencia, electroforésis, colorimetría, pruebas de inmunoabsorbancia de enzimas conjugadas (ELISA), entre otras. En México se cuenta con cierta capacidad analítica para la determinación de toxinas que generan problemas en nuestras costas, sin embargo, en la mayoría de los casos los métodos utilizados son principalmente por bioensayo en ratón y algunas metodologías por HPLC, como es el caso del CIBNOR, el CICESE y el ICMyL de la UNAM. A nivel nacional, a pesar de la importancia de ésta temática son pocos los grupos de investigación que cuentan con equipo altamente especializado para la detección de estas toxinas.
De los métodos o técnicas empleadas tenemos que el bio-ensayo en ratón puede ser de gran ayuda en la detección de las biotoxinas y en la protección de la salud pública, ya que es un método que ha servido de referencia en casi todo el mundo por más de 30 años. Sin embargo, su mayor desventaja es la falta de especificidad: da la respuesta biológica integrada ante las toxinas, no diferencía entre los diversos tipos de toxinas de un mismo síndrome, ni permite distinguir entre toxinas de distintos grupos extraídas con el mismo solvente. Además, existe subjetividad en el momento en que debe considerarse el tiempo de muerte del ratón en algunos de los síndromes, la duración del bioensayo (para el caso de toxinas diarreicas) y hay una gran exigencia en el mantenimiento de las cepas de ratón, además de los problemas éticos asociados al sacrificio de los ratones. En este último punto es interesante mencionar que en Europa, los grupos ambientalistas han tenido bastante éxito en este rubro. Países como Alemania, Suecia y Noruega no permiten su uso o bien no compran productos que hayan sido analizados con estos métodos. Otro de los problemas de este método es la exigencia de técnicos altamente capacitados, los tiempos prolongados de análisis, el costo y la posibilidad de tener falsos positivos como en el caso de los análisis de toxinas lipofílicas por la presencia de lípidos en las muestras (Suzuki et al., 1996). Los métodos cromatográficos, son los segundos más utilizados, después del bioensayo, en la determinación de las toxinas. Sin embargo, la problemática de su uso radica en la precisión en la separación de las toxinas, la obtención/producción de estándares para su calibración, la estabilidad de las soluciones, su alto costo y personal calificado. Finalmente las técnicas de inmunoabsorbancia con enzimas acopladas (ELISA) están en su mayoría enfocados a una sola toxina, por lo que en presencia de análogos (al menos 57 para las toxinas paralizantes, Wiese et al., 2010) los hace útiles sólo en casos muy particulares. Por ejemplo, para el caso de la PSP, el kit que fue desarrollado inicialmente era exclusivo para la saxitoxina y por lo tanto, los otros análogos no eran detectados. Esto también se aplica para otros grupos de toxinas. En el mercado hay una gran variedad de kits basados en la utilización de anticuerpos (monoclonales o policlonales) para la detección de una gran variedad de ficotoxinas, sin embargo varios de ellos no han sido totalmente evaluados (Van Egmond et al., 2004).
DIFUSIÓN NACIONAL E INTERNACIONAL DE LA INFORMACIÓN SOBRE FAN EN MÉXICO
Se encontraron un total de 189 citas de las cuales un 39.7% (75) están publicadas en revistas indizadas, un 38.0% (72) en capítulos de libros y el resto (42) en revistas no indizadas (Fig. 1). Aunque existen algunos trabajos importantes en el contexto de los FAN antes de 1980, estas investigaciones no fueron realizadas por científicos mexicanos, como fueron los casos de Osorio-Tafall (1942), Graham (1943), Stholer (1959) y Blasco (1977), los cuales contribuyeron al conocimiento de la taxonomía y ecología, principalmente de la parte occidental de Baja California. Posterior a la publicación de estos trabajos, en la década de los años 80, se observa que los estudios sobre FAN son muy incipientes (Fig. 1), asociados principalmente a un evento de gran magnitud y consecuencias negativas en el estado de Sinaloa, publicándose un trabajo sobre ese FAN de G. catenatum en una revista indizada. Este fenómeno también fue motivo para la publicación de varios trabajos de difusión que representaron al menos un 20% del total de trabajos publicados en este periodo. Especies no tóxicas formadoras de manchas, tales como Myrionecta rubra (Lohmann) Hamburger et Buddenbrock y trabajos de cianobacterias también fueron tema de esas publicaciones. De 1991 a 2000, se refleja un mayor interés de la comunidad científica mexicana hacia la temática de los FAN, publicándose alrededor de 73 trabajos, de los cuales el 14% está publicado en revistas indizadas y un 22% en libros. Esto refleja la mayor importancia que se le da a esta temática, así como la mayor difusión e interés de los científicos mexicanos para que sus trabajos se conocieran en el seno de la comunidad científica internacional, tal como en los congresos internacionales sobre Fitoplancton Tóxico (International Conference on Toxic Marine Phytoplankton) y sobre Florecimientos Algales Tóxicos (Harmful and Toxic Algal Blooms) patrocinados por la Comisión Oceanográfica Intergubernamental (Intergubernamental Oceanographic Commission) y la Sociedad Internacional para el Estudio de los Florecimientos Algales Nocivos (ISSHA). La temática de estos trabajos es similar a la de la década anterior (Fig. 2); sin embargo, es interesante notar que temas sobre toxinas asociadas a los FAN así como sus efectos en organismos son abordados por primera vez. La mayor parte de estos trabajos son sobre la relación del ácido domoico y su asociación con la muerte de aves marinas, ciguatoxinas y reportes de FAN de P. bahamense var. compressum.
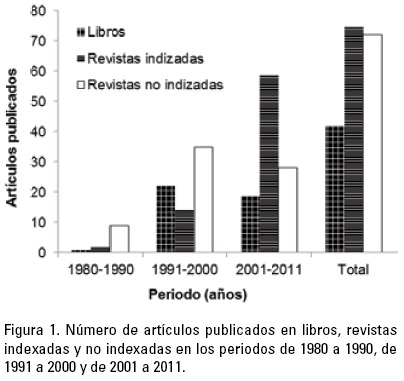

Del 2001 al 2011 se nota claramente el avance de la investigación que se refleja en una mayor cantidad de publicaciones en revistas indizadas que representan más del 50% de lo publicado (Fig. 1). En cuanto a los temas tratados (Fig. 2), los trabajos sobre monitoreo continúan siendo los más numerosos y dan lugar a un incremento del número de publicaciones relacionadas con ecología, efectos de toxinas y ciclos de vida, con particular énfasis en quistes. En contraparte, los temas sobre taxonomía y toxicología, así como las revisiones y los artículos de difusión disminuyen. El interés por especies antes no consideradas como un potencial impacto en la salud ambiental, tales como las pertenecientes a los géneros Ostreopsis y Chatonella, son también evidentes.
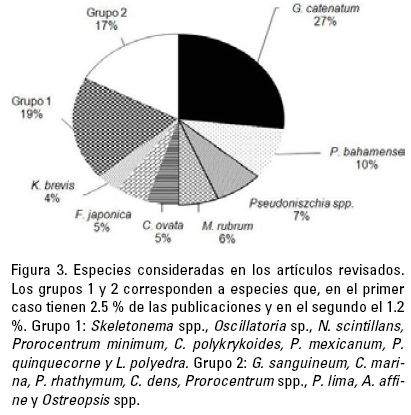
En cuanto a las especies consideradas en las publicaciones analizadas (Fig. 3), G. catenatum es la especie con mayor número de publicaciones, representando el 25% de las citas. Es seguida por trabajos relacionados con P. bahamense (9.8%) y diatomeas del género Pseudo-nitzschia spp. (7%). Las Rafidofíceas también forman parte importante de las publicaciones (11%), con las especies C. marina, C. ovata y F. japonica, como las principales. Skeletonema spp., Noctiluca scintillans (Macartney) Kofoid et Swezy, Lingulodinium polyedra (Stein) Dodge, Cochlodinium polykrykoides Margalef, Prorocentrum spp., Prorocentrum mínimum (Pavillard) Schiller, P. mexicanum Tafall, P. quinquecorne Abé, P. rhathymum Loeblich, Shirley et Schmidt, P. lima (Ehrenberg) Dodge, Alexandrium affine (H. Inoue et Y. Fukuyo) Balech, Gymnodinium sanguineum K. Hirasaka, Dinophysis dens Pavillard, Ostreopsis spp. y Oscillatoria spp., fueron también tema de estas publicaciones aunque en porcentajes mucho menores (<2%).
Es claro que en México el interés sobre la temática de los FAN se ha incrementado en las últimas 2 décadas. Este interés se debe en parte al aumento en la incidencia de FAN a nivel mundial que es consecuencia de una degradación significativa de los ecosistemas, repercutiendo en la mortalidad de peces, aves y mamíferos marinos y pérdidas económicas principalmente en regiones donde las actividades de acuicultura son importantes (Cortés-Altamirano & Sierra- Beltrán, 2008; Núñez-Vázquez et al., 2011). La salud humana también ha sido afectada, principalmente por intoxicaciones al ingerir alimentos contaminados por los organismos que forman estos florecimientos. Aunado a lo anterior, podríamos argumentar que se están formando grupos de investigación nuevos además de que otros se están consolidando. Por ejemplo, investigadores de ICMyL de la UNAM, CICIMAR-IPN, CICESE y el CIBNOR son ejemplo de esta formación y consolidación de grupos interesados en esta temática.
En cuanto a los tópicos abordados, los trabajos relacionados con la descripción de eventos (monitoreo) son los más numerosos. Esto se debe en parte a iniciativas de instituciones académicas que tienen programas de monitoreo o bien a la participación de investigadores en comités estatales de vigilancia y prevención de estos eventos. Por ejemplo, derivado de los fenómenos de FAN en nuestras costas y sus efectos en la salud humana, se promulga la Norma Oficial Mexicana (NOM-EM-005-SSA1-2001) que obliga a los estados con litorales a monitorear permanentemente sus costas como una medida preventiva para proteger la salud de la población frente a estos fenómenos. Así, las instituciones avocadas al cumplimiento de esta norma recurren necesariamente a los expertos de las instituciones de educación superior e investigación a fin de optimizar esta medida y apoyar la investigación sobre la incidencia de este fenómeno. Otro aspecto importante, que se deriva del presente análisis es que la aproximación ecológica, es decir, el tratar de entender el fenómeno en relación con la información ambiental, está aumentando de manera considerable en la última década (de 9% al 15%), indicando que estamos pasando de la investigación descriptiva a una más interpretativa. También es notorio en algunos trabajos, la colaboración de investigadores con diversas fortalezas técnicas y académicas. Por ejemplo, la problemática de la taxonomía de especies formadoras de FAN ha sido tratada desde la perspectiva de la óptica (Álvarez-Borrego et al., 2008) o bien con métodos moleculares en algunas especies (Band-Schmidt et al., 2003b, 2008; Mendoza-Flores, 2011). Desde el punto de vista de las especies mencionadas en nuestras publicaciones, las que producen toxinas son las más investigadas, particularmente aquellas productoras de toxinas paralizantes (G. catenatum y P. bahamense) y amnésicas (Pseudo-nitzschia spp.).
La contribución de la comunidad científica mexicana a la temática de los FAN es difícil de evaluar dada la gran cantidad de temas y revistas publicados en la literatura científica internacional, aunque por el bajo número de artículos (< 200) en un periodo de más de 30 años, permiten suponer una baja contribución. Es interesante que cuando comparamos las publicaciones de autores mexicanos sobre especies de las que tenemos más publicaciones, como por ejemplo artículos donde se trata a G. catenatum, con respecto a las publicaciones internacionales (resultados de la búsqueda de G. catenatum en la base de datos ASFA), tenemos que nuestra contribución es de un 8.8 % (de un total de 395 publicaciones), lo que indica que en temas muy específicos estamos realizando una contribución significativa a nivel internacional.
CONCLUSIONES
En México, la mayoría de los reportes de FAN están basados en muestreos puntuales y/o investigaciones a corto plazo, lo cual no permite determinar con mayor certeza las condiciones ambientales bajo las cuales las diversas especies forman FAN. La ausencia de reportes puede indicar tres cosas: 1) que no hubo eventos, 2) que no se registraron, o 3) que no fueron lo suficientemente intensos para captar la atención. Aún así, los registros de especies tóxicas o nocivas y toxinas encontradas en México, siguen incrementándose. Este aumento va a la par del número de investigadores e instituciones relacionados con el tema de los FAN. La diversidad de especies fitoplanctónicas y toxinas registradas en las costas mexicanas es un gran reto para las instituciones responsables del manejo adecuado de nuestros recursos.
Es necesario establecer un plan de monitoreo con mayor cobertura, en donde se lleve a cabo un registro de un mayor número de especies tóxicas o nocivas. Se requiere también estandarizar los métodos de monitoreo y análisis de muestras a nivel nacional. En el ámbito académico, este tema ha sido ponderado en diversos foros, pero no se ha logrado concretar.
Para la determinación de toxinas, aún no existe un laboratorio con la capacidad en infraestructura, analítica y equipo para abordar la gran gama de toxinas a las que estamos expuestos. Las perspectivas de futuro en cuanto al análisis de ficotoxinas marinas son: incrementar el número de metodologías para analizar diferentes tipos de toxinas, así como aumentar el número de laboratorios especializados en el país. Es necesario también dirigir más investigaciones hacia el desarrollo de nuevas tecnologías para el monitoreo de FAN.
De las especies fitoplanctónicas que forman FAN de manera más frecuente, en nuestras costas existe información sobre su distribución, cuestiones básicas de su ecología, periodicidad, en algunos casos de su toxicidad, efectos tóxicos y/o nocivos. Sin embargo, de una gran mayoría (90%) de especies sólo se cuenta con reportes de su presencia. La implementación de ceparios en las diferentes zonas costeras para el cultivo y mantenimiento de especies nativas ayudará a facilitar los estudios de autoecología de las diversas especies de interés.
Dentro del estudio de FAN existen varias líneas de investigación que aún no se han abordado en nuestro país o son incipientes, como son las investigaciones sobre quistes, alelopatía, función biológica, introducción de especies exóticas, efecto del cambio climático, aplicación de imágenes de satélite y de herramientas moleculares, análisis socioeconómicos, impacto en la acuicultura y vida silvestre, estrategias de mitigación, estudios de biosintesis, metabolismo y excreción, relación estructura-actividad, genotoxicidad, exposición crónica a FAN, potencial biomédico o biotecnológico de las especies FAN, entre otros.
Esta revisión refleja que en nuestro país ha habido un avance significativo en el estudio de FAN. Sin embargo, seguimos estudiando los FAN de manera individual y dispersa. Es necesario encaminarnos y coordinarnos entre los especialistas con el objetivo de unificar esfuerzos que se están realizando entre las diversas instituciones y colegas para poder continuar avanzando hacia una mejor observación y manejo adecuado de estos eventos en nuestro país. El estudio de los FAN debe tener un enfoque multidisciplinario que abarque desde aspectos de la biología molecular, hasta aspectos oceanográficos. También es notorio el atraso que tenemos en el uso de nuevas tecnologías, como son las sondas moleculares y la teledetección. Esto es principalmente un reflejo de la limitación de recursos destinados para el estudio de los FAN en México, así como de la poca colaboración con colegas de otros países.
Sin embargo, en la última década se ha observado una mayor consolidación de algunos grupos de investigadores, lo que podría garantizar en un corto plazo un aumento de la cantidad y calidad de las publicaciones y por tanto, una mayor influencia en la literatura mundial. Un ejemplo claro de esto es la contribución que se ha hecho en el pasado reciente sobre G. catenatum.
AGRADECIMIENTOS
Este trabajo estuvo financiado por proyectos institucionales del IPN (SIP 20110590) y del CIBNOR (PC 0.11 y PC 0.12). Se agradece el apoyo de M. V. Z. G. Arroyo-Gómez (Gerente de seguimiento de programas de la COFEPRIS, S.S.) por la información proporcionada respecto a la normatividad sobre los límites máximos permisibles de algunas toxinas marinas en México. EJNV agradece el apoyo otorgado por FASOL, A.C. para la obtención de muestras de FAN del estado de B. C. S. CJBS es becario COFAA y EDI.
REFERENCIAS
Aguirre-Gómez, R., R. Álvarez & O. Salmerón-García. 1999. Red tide evolution in the Mazatlán Bay area from remotely sensed sea surface temperatures. Geofísica Internacional 38 (2): 63-71. [ Links ]
Ahmed, M. S., S. Khan, O. Arakawa & Y. Onoue. 1995. Properties of hemaglutinins newly separated from toxic phytoplankton. Biochimica et Biophysica Acta 1243: 509-512. [ Links ]
Aké-Castillo, J. A. & Y. Okolodkov. 2009. Pseudonitzschia subcurvata (Bacillariophyceae) in the Gulf of Mexico? Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 40: 6-7. [ Links ]
Aké-Castillo, J. A., Y. B. Okolodkov, K. A. Steidinger, J. A. G. González-González & H. Pérez-España. 2010. Karenia sp. "Mexican hat" first bloom in Mexico. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 41: 16-17. [ Links ]
Aldeco, J., M. A. Monreal-Gómez, M. Signoret, D. A. Salas de León & D. U. Hernández-Becerril. 2009. Occurence of a subsurface anticyclonic eddy, fronts, and Trichodesmium spp. over the Campeche Canyon region, Gulf of Mexico. Ciencias Marinas 35 (4): 333-344. [ Links ]
Almazán-Becerril, A. 2009. Inicio sobre investigaciones en ciguatera en la costa de Quintana Roo. III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
Almazán-Becerril, A. 2000. Estudio taxonómico de algunos dinoflagelados potencialmente tóxicos en el Caribe Mexicano. Tesis de Maestría, Fac. Ciencias, Universidad Nacional Autónoma de México, México, D. F. [ Links ]
Alonso-Rodríguez, R. & F. Páez-Osuna. 2003. Nutrients, phytoplankton and harmful algal blooms in shrimp ponds: a review with special reference to the situation in the Gulf of California. Aquaculture 219 (1-4): 317-336. [ Links ]
Alonso-Rodríguez, R. & J. L. Ochoa. 2004. Hydrology of winter-spring "red tides" in Bahía de Mazatlán, Sinaloa, México. Harmful Algae 3: 163-171. [ Links ]
Alonso-Rodríguez, R., F. Páez-Osuna & I. Gárate-Lizárraga. 2004a. El fitoplancton en la camaronicultura y larvicultura: importancia de un buen manejo. Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México y Comité Estatal de Sanidad Acuícola de Sinaloa, México. 147 p. [ Links ]
Alonso-Rodríguez, R., I. Gárate-Lizárraga, B. Luckas, K. Reinhardt & J. J. Bustillos-Guzmán. 2004b. Mortalidad de larvas de camarón en cultivo en Sinaloa, México, asociado a mareas rojas de Gymnodinium catenatum. In: XIII Reunión Nacional de la Sociedad Mexicana de Planctología. 25-28 abril. Nuevo Vallarta, Jal., México. pp. 54-55. [ Links ]
Alonso-Rodríguez, R. A., D. U. Hernández-Becerril & I. Gárate-Lizárraga. 2008. Catálogo de microalgas de las lagunas costeras de Sinaloa. Serie Lagunas Costeras de Sinaloa. [ Links ] In: Páez-Osuna, F. (Ed.). Instituto de Ciencias del Mar y Limnología-UNAM. México. 198 pp. [ Links ]
Álvarez-Borrego, J., Pech-Pacheco, J. L. & Cortés-Altamirano, R. 2008. Identificación de algunas especies de fitoplancton mediante sistemas óptico-digitales: una primera aproximación. In: Álvarez-Borrego, J. & Chávez-Sánchez, C. (Eds.). Introducción a la identificación automática organismos y estructuras microscópicas y macroscópicas a las imágenes. Univ. de Guadalajara, CICESE y CIAD. México. pp. 61-90. [ Links ]
Álvarez-Góngora, C. 2009. Uso de información derivada de sensores remotos en la detección de florecimientos algales. III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
Álvarez-Góngora, C. & J. A. Herrera-Silveira. 2005. Cuando el mar cambia de color: Florecimientos Algales. Avance y Perspectiva 24: 33-42. [ Links ]
Álvarez-Góngora, C. & J. A. Herrera-Silveira. 2006. Variations of phytoplankton community structure related to water quality trends in a tropical karstic coastal zone. Marine Pollution Bulletin 52: 48-60. [ Links ]
Amandi, M. F., A. Furey, M. Lehane, H. Ramstad & K. J. James. 2002. Liquid chromatography with electrospray ion-trap mass spectrometry for determination of yessotoxins in shellfish. Journal of Chromatography A. 976: 329-334. [ Links ]
Anderson, D. M., P. M. Gilbert & J. M. Burkholder. 2002. Harmful algal blooms and eutrophication: Nutrients sources, composition, and consequences. Estuaries 25 (4b): 704-726. [ Links ]
Anderson, D. M., B. Reguera, G. C., Pitcher & H. O. Enevoldsen. 2010. The IOC International Harmful Algal Bloom Program. History and Science. Oceanography 23 (3): 72-85. [ Links ]
Archambault, M. C., J. Grant & V. M. Bricelj. 2003. Removal eficiency of the dinoflagellate Heterocapsa triquetra by phosphatic clay, and implications for the mitigation of harmful algal blooms. Marine Ecology Progress Series 253: 97-109. [ Links ]
Arcila-Herrera, H., A. Castello-Navarrete, J. Mendoza-Aroya, L. Montero-Cervantes, M. González-Franco & O. W. Brito-Villanueva. 1998. Diez casos de ciguatera en Yucatán. Revista de Investigación Clínica 50 (2): 149-152. [ Links ]
Asociación Oficial de Químicos Analistas (AOAC). 1995. Official Method 959.08 Paralytic Shellfish Poison, Biological Method, Final Action. In: AOAC. Official methods of analysis of AOAC International. 16th Edition. P. Cunniff (Ed.). AOAC International, Arlington, VA, E.U.A. Chapter 35: 21-22. [ Links ]
Ballast Water Management Convention. 2011. Disponible en línea en http://www.IMO.org/OurWork/Environmental/BallastWatermanagement (consultado el 20 de junio, 2011). [ Links ]
Band-Schmidt, C. J., C. H. Lechuga-Devéze, D. M. Kullis & D. M. Anderson. 2003a. Culture studies of Alexandrium affine (Dinophyceae), a non-toxic cysts forming dinoflagellate from Bahía Concepción, Gulf of California. Botánica marina 46: 44-54. [ Links ]
Band-Schmidt, C.J., Lilly, E.L. & D. M. Anderson. 2003b. Identification of Alexandrium affine and A. margalefii (Dinophyceae) using DNA se-quencing and LSU rDNA-based RFLP-PCR assays. Phycologia 42 (3): 261-268. [ Links ]
Band-Schmidt, C. J., L. Morquecho, D. U. Hernández-Becerril, A. Reyes-Salinas & E. Bravo-Sierra. 2004a. Raphidophyceans on the coasts of Mexico. Hydrobiologia 515: 79-89. [ Links ]
Band-Schmidt, C. J., L. Morquecho, C. H. Lechuga-Déveze & D. M. Anderson. 2004b. Effects of growth medium, temperature, salinity and seawater source on growth of Gymnodinium catenatum (Dinophyceae) from Bahía Concepción, Gulf of California. Journal of Plankton Research 26: 1459-1470. [ Links ]
Band-Schmidt, C. J., J. J. Bustillos-Guzmán, I. Gárate-Lizárraga, C. H. Lechuga-Devéze, K. Reinhard & B. Luckas. 2005a. Paralytic shellfish toxin profile in strains of the dinoflagellate Gymnodinium catenatum Graham and the scallop Argopecten ventricosus G. B. Sowerby II from Bahía Concepción, Gulf of California, Mexico. Harmful Algae 4: 21-31. [ Links ]
Band-Schmidt, C. J., A. Martínez-López & I. Gárate-Lizárraga. 2005b. First record of Chattonella marina in Bahía de La Paz, Gulf of California. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 28: 6-7. [ Links ]
Band-Schmidt, C., J. J. Bustillos-Guzmán, L. Morquecho, I. Gárate-Lizárraga, R. Alonso-Rodríguez, A. Reyes-Salinas, K. Releer & B. Luckas. 2006. Variations of PSP toxin profiles during different growth phases in Gymnodinium catenatum (Dinophyceae) strain isolated from three locations in the Gulf of California, Mexico. Journal of Phycology 42: 757-768. [ Links ]
Band-Schmidt, C. J., D. I. Rojas-Posadas, L. Morquecho & N. Hernández-Saavedra. 2008. Heterogeneity of LSU rDNA sequences and morpho-logy of Gymnodinium catenatum dinoflagellate strains in Bahía Concepción, Gulf of California, Mexico. Journal of Plankton Research 30 (7): 755-763. [ Links ]
Band-Schmidt, C. J., J. J. Bustillos-Guzmán, I. Gárate-Lizárraga, D. J. López-Cortés, E. J. Núñez-Vázquez & F. E. Hernández-Sandoval. 2010. Ecological and physiological studies of Gymnodinium catenatum in the Mexican Pacific: A review. Marine Drugs 8 (1): 1935-1961. [ Links ]
Barón-Campis, S., D. U. Hernández-Becerril, N. O. Juárez-Ruíz & C. Ramírez-Camarena. 2005. Marea roja producida por el dinoflagelado Peridinium quinquecorne en Veracruz, México (Oct.-Nov. 2002). Hidrobiológica 15 (1): 73-78. [ Links ]
Barón-Campis, S. A., C. Ramírez-Camarena, N. O. Juárez-Ruíz, R. Rojas-Crisóstomo & H. Ramírez-García. 2009. Presentación del espacio informativo y de comunicación en el sitio web del INAPESCA denominado: Fitoplancton, florecimientos algales nocivos (FAN) y pesquerías en México. In: III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
Barraza-Guardado, R., R. Cortés-Altamirano & A. Sierra-Beltrán. 2004. Marine die-offs from Chattonella marina and Ch. cf. ovata in Kun Kaak Bay, Sonora in the Gulf of California. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 25: 7-8. [ Links ]
Barton, E. D., P. Tanner, S. G. Turchen, C. L. Tungen, A. Manoguerra & R. F. Clarck. 1995. Ciguatera fish poisoning: A Southern California epidemic. West Journal Medical 163: 31-35. [ Links ]
Beaulieu, S. E., M. R. Sengco & D. M. Anderson. 2005. Using clay to control harmful algal blooms: deposition and resuspension of clay/algal flocs. Harmful Algae 4: 123-138. [ Links ]
Bernd, C. & B. Luckas. 2008. Determination of marine biotoxins relevant for regulations: from mouse bioassay to coupled LC-MS methods. Analytical Bioanalytical Chemistry 391: 117-134. [ Links ]
Blasco, D. 1977. Red tide in the upwelling region of Baja California. Limnology and Oceanography 22: 255-263. [ Links ]
Bolch, C. J. & G. M. Hallegraeff. 1993. Chemical and physical treatment options to kill toxic dinoflagellate cysts in ships' ballast water. Journal of Marine Environmental Engineering 1: 23-29. [ Links ]
Boltovskoy, A. 1995. Taxonomía y morfología de los dinoflagelados: Métodos de trabajo. In: Alveal, K., M. E. Ferrario, E. C. Oliveira & E. Sar (Eds.). Manual de métodos ficológicos, Universidad de Concepción, Chile, 55-82 pp. [ Links ]
Borbolla-Sala, M. E., F. A. Colín-Osorio, M. R. Vidal-Pérez & M. May-Jiménez. 2006. Marea roja de Tabasco 2005, Karenia brevis. Salud en Tabasco 12 (2): 425-433. [ Links ]
Bourdelais, A. J., C. R. Tomas, J. Naar, J. Kubanek & D. G. Baden. 2002. New fish-killing algal in coastal Delaware produces neurotoxins. Environmental Health Perspectives 110(5): 465-470. [ Links ]
Buchmann, A. H., V. A. Riquelme, M. C. Hernández-González, D. Várela, J. E. Jiménez, L. A. Enríquez, P. A. Vergara, R. Guíñez & L. Filón. 2006. A review of the impacts of salmonoid farming on marine coastal ecosystems in the southeast Pacific. Journal of Marine Science 63: 1338-1345. [ Links ]
Bustillos-Guzmán, J. J, P. Vale & C. J. Band-Schmidt. 2011. Presence of benzoate-type toxins in Gymnodinium catenatum Graham isolated from the Mexican Pacific. Toxicon 57: 922-926. [ Links ]
Cabrera-Mancilla, E., C. Ramírez-Camarena, L. Muñoz-Cabrera & A. Monreal-Prado. 2000. Primer registro de Gymnodinium catenatum Graham (Gymnodinaceae) como causante de marea roja en la Bahía de Acapulco, Gro. México. In: Ríos-Jara, E., E. Juárez-Carrillo, M. Pérez-Peña, E. López-Linares, E. G. Robles-Jarero, D. U. Hernández-Becerril & M. Silva-Briano (Eds.). Estudios sobre plancton en México y el Caribe. Sociedad Mexicana de Planctología y Universidad de Guadalajara: Guadalajara, México, pp. 85-86. [ Links ]
Campa-Córdova, A. I., E. J. Núñez-Vázquez, A. Luna-González, M. J. Romero-Geraldo & F. Ascencio-Valle. 2009. Superoxide dismutase activity in juvenile Litopanaeus vannamei and Nodipecten subnodosus ex-posed to the toxic dinoflagellate Prorocentrum lima. Comparative Biochemical Physiology- Part C: Pharmacology & Toxicology 149 (3): 317-322. [ Links ]
Carlton, J. T. 1985. Transoceanic and interoceanic dispersal of coastal marine organisms: the biology of ballast water. Oceanography and Marine Biology: and Annual Review 23: 313-374. [ Links ]
Cervantes-Cianca, R. C., J. M. Gómez-Barrón, N. Chantiri-Pérez, R. Azamar, R. Méndez, L. Muñoz-Cabrera & C. Ramírez-Camarena. 2002. Marea roja por Gymnodinium breve en la costa de Veracruz, efectos y estrategias de una contingencia. In: IX Congreso Nacional de Ciencia y Tecnología del Mar. Nuevo Vallarta, Nay., México. [ Links ]
Ciminiello, P., C. Dell'Aversano, E. Fattoruso, M. Forino, S. Magno, F. Guerrini, R. Pistocchi & L. Boni. 2003. Complex yessotoxins profile in Prorocentrum reticulatum from north-western Adriatic Sea revealed by LC-MS analysis. Toxicon 42: 7-14. [ Links ]
Cohen-Fernández, E. J., E. Meave del Castillo, I. H. Salgado-Ugarte & F. F. Pedroche. 2006. Contribution of external morphology in solving species complex-the case of Prorocentrum micans, Prorocentrum gracile and Prorocentrum sigmoides (Dinoflagellata) from the Mexican Pacific coast. Phycological Research 54: 330-340. [ Links ]
Cohen-Fernández, E. J., F. F. Pedroche, M. Rodríguez-Palacios, S. Álvarez-Hernández & E. Meave del Castillo. 2010. Molecular phylogeny of Prorocentrum (Dinoflagellate) from the Pacific coast of Mexico based on the parsimony analysis of fragments of LSUrDNA and SSUr-DNA. International Journal of Plant Physiology and Biochemistry. 2: 29-37. [ Links ]
Comisión Federal para la Protección contra Riesgos Sanitarios. 2011. Gobierno Federal. Salud. http://www.cofrepris.gob.mx (consultado el 16 de junio 2011). [ Links ]
Cortés-Altamirano, R. 1987. Observaciones de mareas rojas en la Bahía de Mazatlán, Sinaloa, México. Ciencias Marinas 13: 1-19. [ Links ]
Cortés-Altamirano, R. 1998. Mareas rojas. AGT Editores. México. 161 pp. [ Links ]
Cortés-Altamirano, R. & A. Núñez-Pasten. 1992. Doce años (1979-1990) de registros de mareas rojas en la Bahía de Mazatlán, Sinaloa, México. Anales del Instituto de Ciencias del Mar y Limnología, UNAM 19(1): 113-121. [ Links ]
Cortés-Altamirano, R. & H. C. Agraz. 1994. Presencia de Prorocentrum minimum (Pav.) Schiller en estanques de cultivo de camarón. Ciencias del Mar-UAS, 13: 11-16. [ Links ]
Cortés-Altamirano, R. & S. Licea-Durán. 1999. Florecimientos de microalgas nocivas en estanques para cultivo semi-intensivo de camarón en México. Revista Latinoamericana de Microbiología 41: 157-166. [ Links ]
Cortés-Altamirano, R., & S. Licea-Durán. 2004. Discoloration of microalgal blooms as a bioindicating parameter at Bahía de Mazatlán, México. Biología Tropical 52: 27-34. [ Links ]
Cortés-Altamirano, R. & A. P. Sierra-Beltrán. 2008. Biotoxins from freshwater and marine harmful algal blooms ocurring in Mexico. Toxin Reviews 27 (1): 27-77. [ Links ]
Cortés-Altamirano, R., L. Muñoz-Cabrera & O. Sotomayor-Navarro. 1993. Envenenamiento paralítico por mariscos (PSP), causado por el dinoflagelado Pyrodinium bahamense var. compressum en la Costa Suroeste de México. Anales del Instituto de Ciencias del Mar y Limnología, UNAM 20 (1): 43-54. [ Links ]
Cortés-Altamirano, R., D. U. Hernández-Becerril & R. Luna-Soria. 1995. Evaluación y prevención de los efectos de las mareas rojas en la Bahía de Mazatlán (1994). Ciencias del Mar, UAS 14: 10-14. [ Links ]
Cortés-Altamirano, R., D. U. Hernández-Becerril & R. Luna-Soria. 1996. Red tide in Mexico: A review. In: T. Yasumoto, Y. Oshima & Y. Fukuyo (Eds.). Harmful and Toxic Algal Blooms. IOC-UNESCO. Sendai, Japón. pp. 101-104. [ Links ]
Cortés-Altamirano, R., A. F. Manrique & R. Luna-Soria. 1997. Harmful phytoplankton blooms in shrimp farms from Sinaloa, Mexico. In: 7th International Conference on Harmful Algae. p. 56. [ Links ]
Cortés-Altamirano, R. & S. Licea-Durán. 1999. Florecimientos de microalgas nocivas en estanques para cultivo semi-intensivo de camarón en México. Rev. Latinoam. Microb. 41: 157-166. [ Links ]
Cortés-Altamirano, R. 2010. Mareas rojas en México: Impacto y perspectivas. Resúmenes de la XVI Reunión Nacional de la Sociedad Mexicana de Planctología y IX International Meeting of the Mexican Society of Planktology. La Paz, B. C. S., México. 27-30 de abril del 2010. p: 1 [ Links ]
Cortés-Altamirano, R., A. Sierra-Beltrán & R. Barraza-Guardado. 2006a. Mortandad de peces debido a microalgas nocivas y toxicas: Cinco casos de marea roja en la costa continental del Golfo de California (2003-2004). In: Salas, S., Cabrera, M. A., Ramos, J. Flores, D. & J. Sánchez (Eds.). 1a Conferencia de Pesquerías Costeras en América Latina y el Caribe. Evaluando, Manejando y Balanceando Acciones. Mérida, Yuc., México, pp: 79-90. [ Links ]
Cortés-Altamirano, R., I. Alonso-Rodríguez & A. Sierra-Beltrán. 2006b. Fish mortality associated with Chattonella marina and C. cf. ovata (Raphidophyceae) blooms in Sinaloa (Mexico). Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 31: 7-8. [ Links ]
Cortés-Altamirano, R. R. Luna-Soria, J. L. Pech-Pacheco & J. Álvarez-Borrego. 1998. In: Cortés-Altamirano, R. (Ed.) Las Mareas rojas. Editorial AGT Editor, S.A., México, D.F. pp. 13-32. [ Links ]
Cortés-Lara, M. C., M. C. Gómez-Villareal & R. Cortés-Altamirano. 2001. Mortandad de peces debido a Cochlodinium catenatum (Okamura, 1916) en Bahía de Banderas, Jalisco Nayarit. In: VIII Cong. Asoc. Inv. Mar de Cortés. II Simposio Internacional del Mar de Cortés. Ensenada, B. C., México, p. 60 [ Links ]
Cortés-Lara, M. C., R. Cortés-Altamirano & A. C. Magaña. 2003. First record of Fibrocapsa cf. japonica in Matanchen Bay, Nayarit, Mexican Pacific coast. Harmful Algae News IOC Newsletter on toxic algae and algal blooms 24: 1-4. [ Links ]
Cortés-Lara, M. C., R. Cortés-Altamirano & A. Sierra-Beltrán. 2004. Presencia de Cochlodinium catenatum (Gymnodinales: Gymnodinaceae) en mareas rojas de Bahía Banderas en el Pacífico Mexicano. Revista Biología Tropical 52 (Suppl. 1): 35-50. [ Links ]
Cortés-Lara, M. C., R. Cortés-Altamirano, Á. Sierra-Beltrán & A. Reyes-Juárez. 2006. Ostreopsis siamensis (Dinophyceae) a new tycho-planktonic record from Isabel Island National Park, Pacific Mexico. Harmful Algae News IOC Newsletter on toxic algae and algal blooms 28: 4-5. [ Links ]
De Haro, L., M. Hayek-Lanthois, F. Joossen, M.-F. Affaton & J. Jouglard. 1997. Intoxication collective ciguaterique apres ingestion d' un barracuda au Mexique: deductions pron ostique et therapeutique. Medical Tropical 57: 55-58. [ Links ]
De la Garza-Aguilar, J. 1983. Intoxicación alimentaria por ingestión de mariscos contaminados. Salud Pública de México 25: 145-150. [ Links ]
Delgado , G., G. Arencibia., L. De-La Paz & R.E. Nodar.1996. Marea roja en un estanque de cultivo de camarón en Cuba. Revista Cubana de Investigaciones Pesqueras 20 (1): 23-24. [ Links ]
Delgado, G., G. Popowski, C. García, N. Lagos & C. Lechuga-Devéze. 2005. Presence of DSP-toxins in Prorocentrum lima (Ehrenberg) Dodge in Cuba. Revista de Investigaciones Marina 26(3): 229-234. DialogWeb. 2011. http://www.dialogweb.com/servlet/navigation?navigationkey=DialogWeb.root (consultado el 25 de abril 2011). [ Links ]
Dickman, M. & F. Zhang. 1999. Mid-ocean exchange of container vessel ballast water. 2: Effects of vessel type in the transport of diatoms and dinoflagellates from Manzanillo, Mexico to Hong Kong, China. Marine Ecology Progress Series 176: 253-262. [ Links ]
Dorantes-Aranda, J. J., L. M. García de la Parra, R. Alonso-Rodríguez & L. Morquecho. 2009. Hemolytic activity and fatty acids composition in the ichthyotoxic dinoflagellate Cochlodinium polykrikoides isolated from Bahía de La Paz, Gulf of California. Marine Pollution Bulletin 58 (9): 1401-1405. [ Links ]
Dorantes-Aranda, J. J., L. M. García de la Parra, R. Alonso-Rodríguez, L. Morquecho & D. Voltolina. 2010. Toxic effect of the harmful dinoflagellate Cochlodinium polykrikoides on the spotted rose snapper Lutjanus guttatus. Environmental Toxicology 25 (4): 319-326. [ Links ]
Dortch, Q. R. R. Robichaux, S. Pool, D. Milsted, G. Mire, N. N. Rabalais, T. M. Soniat, G. A. Fryxell, R. E. Turner & M. L. Parsons. 1997. Abun-dance and vertical flux of Pseudonitzschia in the northern Gulf of México. Marine Ecology Progress Series 146: 249-264. [ Links ]
ECOHAB. 1995. The ecology and oceanography of harmful algal blooms. A National Research Agenda. Wood Hole Oceanographic Institute, Woods Hole, Mass., E. U. A. 66 p. [ Links ]
Estrada, N., M. J. Romero, A. Campa-Córdova & F. Ascencio. 2007. Effect of the toxic dinoflagellate, Gymnodinium catenatum on the hydrolytic and antioxidant enzymes, in tissues of the giant lion-paw scallop Nodipecten subnodosus. Comparative Biochemical and Physiology, Part C, 146: 502-510. [ Links ]
Estrada, N., C. Rodríguez-Jaramillo, G. Contreras & F. Ascencio. 2010. Effects of induced paralysis on hemocytes and tissues of the giant lions-paw scallop by paralyzing shellfish poison. Marine Biology 157: 1401-1415. [ Links ]
European Food Safety Authority (EFSA). 2009. Marine Marine biotoxins in shellfish- Summary on regulated marine biotoxins. Scientific Opinion of the Panel on Contaminants in the Food Chain (Question No EFSA-Q-2009-00685). The EFSA Journal. 1306: 1-23. [ Links ]
European Food Safety Authority (EFSA). 2010. Panel on contaminants in the food chain: scientific opinion on marine biotoxins in shellfish emergin toxins: ciguatoxin group. EFSA Journal8: 1-38. [ Links ]
FAO. Egmond, H. P. V., Apeldoorn, M. E. V. & Speijer, G. J. A. 2005. Biotoxinas marinas. Estudio de la FAO. Alimentación y nutrición. Institución de salud pública y el medio ambiente de los Países Bajos, pp. 14-20. [ Links ]
Ferrario, M. E., E. A. Sar & S. E. Salas. 1995. Metodología básica para el estudio del fitoplancton con especial referencia a las diatomeas. In: Alveal, K., M. E. Ferrario, E. C. Oliveira & E. Sar (Eds.). Manual de métodos ficológicos, Universidad de Concepción, Chile, pp. 1-23. [ Links ]
Figueroa-Torres, M. G. & M. A. Zepeda-Esquivel. 2001. Mareas rojas del puerto interior, Col., México. Scientia Naturae 3 (2): 39-52. [ Links ]
Franks, P. J. S. 1995. Sampling techniques and strategies for coastal phytoplankton blooms. In: Hallegraeff, G. M., D. M. Anderson & A. D. Cembella (Eds.). IOC manual on harmful marine microalgae manual andguides No. 33, UNESCO, Paris, pp. 25-43. [ Links ]
Fryxell, G. A. M. E. Reap & D. L. Valencic. 1990. Nitzschia pungens Grunow f. multiseries Hasle: Observation of a known neurotoxic diatoms. Beiheft Zur Nova Hedwigia 100: 171-188. [ Links ]
Gárate-Lizárraga, I. 1991. Análisis de una marea roja causada por Noctiluca scintillans (McCartney) Ehr. en Bahía Concepción, Baja California Sur, en febrero de 1989. Revista de Investigación Científica 2: 35-43. [ Links ]
Gárate-Lizárraga, I. & A. Martínez-López. 1997. Primer Registro de una marea roja de Prorocentrum mexicanum (Prorocentaceae) en aguas del Golfo de California. Revista de Biología Tropical. 45(3): 1263-1271. [ Links ]
Gárate-Lizarrága, I. & R. González-Armas. 2011. Ocurrence of Pyrodinium bahamense var. compressum along the southern coast of Baja California Peninsula. Marine Pollution Bulletin 62 (3): 626-630. [ Links ]
Gárate-Lizárraga, I., M. L. Hernández-Orozco, C. J. Band-Schmidt & G. Serrano-Casillas. 2001. Red tides along the coasts of Baja California Sur, Mexico (1984 to 2001). CICIMAR Oceánides 16(2):127-134. [ Links ]
Gárate-Lizárraga, I., C. J. Band-Schmidt, R. Cervantes-Duarte & D. G. Escobedourías. 2002. Mareas rojas de Mesodinium rubrum (Lohmann) Hamburger y Budenbrock ocurridas en el Golfo de California durante el invierno de 1998. Hidrobiológica 12(1): 15-20. [ Links ]
Gárate-Lizárraga, I., D. J. López-Cortés, J. J. Bustillos-Guzmán & F. E. Hernández-Sandoval. 2004a. Blooms of Cochlodinium polykrikoides (Gymnodiniaceae) in the Gulf of California, Mexico. Revista de Biología Tropical 52: Supl. (1): 51-58. [ Links ]
Gárate-Lizárraga, I., J. J. Bustillos-Guzmán, R. Alonso-Rodríguez & B. Luckas. 2004b. Comparative paralytic shellfish toxin profiles in two marine bivalves during outbreaks of Gymnodinium catenatum (Dinophyceae) in the Gulf of California. Marine Pollution Bulletin 48: 378-402. [ Links ]
Gárate-Lizárraga, I., J. J. Bustillos-Guzmán, L. Morquecho, C. J. Band-Schmidt, R. Alonso-Rodríguez, K. Releer, B. Luckas, Á. Reyes-Salinas & D. T. Góngora-González. 2005. Comparative paralytic shellfish toxin profiles in the strains of Gymnodinium catenatum Graham from the Gulf of California, Mexico. Marine Pollution Bulletin 50: 208-236. [ Links ]
Gárate-Lizárraga, I., J. J. Bustillos-Guzmán, D. J. López-Cortés, F. Hernández-Sandoval, K. Releer & B. Luckas. 2006. Paralytic shellfish toxin profiles in net phytoplankton samples from Bahía Concepción, Gulf of California, Mexico. Marine Pollution Bulletin 52: 800-815. [ Links ]
Gárate-Lizárraga, I., C. J. Band-Schmidt, G. Verdugo-Díaz, M. S. Muñetón-Gómez & F. E. Félix-Pico. 2007a. Dinoflagelados (Dinophyceae) del sistema lagunar Magdalena-Almejas. In: Funes-Rodríguez, R., J. Gómez-Gutiérrez & R. Palomares-García (Eds.). Estudios ecológicos en Bahía Magdalena. CICIMAR-IPN, FORMAR-Gob. de B. C. S., México, pp. 145-174. [ Links ]
Gárate-Lizárraga, I., C. J. Band-Schmidt, J.J. Bustillos-Guzmán & D.J. López-Cortés. 2007b. Bloom of Pseudo-nitzschia fraudulenta in Bahía de La Paz, Gulf of California (June-July 2006). Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 32: 6-7. [ Links ]
Gárate-Lizárraga, I., B. Pérez-Cruz, J. Díaz-Ortiz & C. J. Band-Schmidt. 2008. Microalgas y biotoxinas marinas en las costas mexicanas. Conversus 9: 22-26. [ Links ]
Gárate-Lizárraga, I., C. J. Band-Schmidt, D. J. López-Cortés & M. S. Muñetón-Gómez. 2009a. Bloom of Scrippsiella trochoidea (Gonyaula-caceae) in a shrimp pond from the southwestern Gulf of California, Mexico. Marine Pollution Bulletin 58: 145-149. [ Links ]
Gárate-Lizárraga, I., C. J. Band-Schmidt, D. J. López-Cortés & J. J. Busti-llos-Guzmán. 2009b. Raphidophytes in Bahía de La Paz, Gulf of California. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 40: 1-4. [ Links ]
Gárate-Lizárraga, I., J. A. Díaz-Ortíz, B. Pérez-Cruz, M. A. Alarcón-Romero, L. A. Chávez-Almazán, J. L. García-Barbosa & S. López-Silva. 2011. A multi-species dinoflagellate bloom and shellfish toxicity in the Costa Grande, Guerrero, Mexico (December 2010). CICIMAR Oceánides 26 (1): 67-71. [ Links ]
García-Hernández, J. 2008. Acidenhanced Harmful Algal Blooms (HABS). In: N. T. Hofer (Ed.). Marine pollution: new research. Nova Publishers, pp: 9-13. [ Links ]
García-Hernández, J., L. García-Rico, M. E. Jara-Marini, R. Barraza-Guardado & W. A. Hudson. 2005. Concentrations of heavy metals in sedi-ment and organisms during a harmful algal bloom (HAB) at Kun Kaak Bay, Sonora, Mexico. Marine Pollution Bulletin 50 (7): 733-739. [ Links ]
García-Mendoza, E., D. Rivas, Á. Olivos-Ortíz, Á. Almazán-Becerril, C. Castañeda-Vega & J. L. Peña-Manjarrez. 2009a. A toxic Pseudo-nitzschia bloom in Todos Santos Bay, northwestern Baja California, Mexico. Harmful Algae 8: 493-503. [ Links ]
García-Mendoza, E., I. Santiago-Morales & G. Cabrales-Talavera. 2009b. FICOTOX: Monitoreo e Investigación ecotoxicológica asociada a florecimientos algales nocivos (FAN). In: III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
GEOHAB. 2006. Global Ecology and Oceanography of Harmful Algal Blooms. HABs in Eutrophic Systems. In: Glibert, M.P. (Ed.)., IOC and SCOR, Paris and Baltimore, 74 p. [ Links ]
Gilmartin, M. & N. Revelante. 1978. The phytoplankton characteristics of the Barrier Island lagoons of the Gulf of California. Estuarine and Coastal Marine Science 7: 29-47. [ Links ]
Gómez-Aguirre, S. 1998a. First record of Pyrodinium bahamense (Dinoflagellata) in brackish waters of the Mexican Caribbean Coast. Annales del Instituto de Biología de la UNAM Serie Zoología 69 (1): 121-123. [ Links ]
Gómez-Aguirre, S. 1998b. Red tide occurrences recorded in Mexico from 1980-1992. Annales del Instituto de Biología de la UNAM Serie Zoología 69 (1): 13-22. [ Links ]
Gómez-Aguirre, S. & S. Licea. 1998. Blooms of Pyrodinium bahamense (Dinophyceae) in coastal lagoons of the southern Gulf of Mexico and Mexican Caribbean. In: Reguera, B., J. Blanco, M. L. Fernández & T. Wyatt (Eds.). Harmful Algae. Xunta de Galicia and Intergovernmental Oceanographic Commission of UNESCO. pp. 61-62. [ Links ]
Gómez-Tagle, Á. 2007. Informe de evaluación correspondiente al mes de agosto del 2007. Componentes Inocuidad y Sanidad Acuícola. Comité de Sanidad Acuícola de Baja California Sur. 7 pp. [ Links ]
Gómez-Villarreal, M. C., M. D. Martínez-Gaxiola & J. L. Peña-Manjarrez. 2008. Proliferaciones algales 2000-2001 en Bahía de Banderas, México según el sensor SeaWiFS. Revista de Biología Tropical 56 (4): 1653-1664. [ Links ]
Góngora-González, D. T. 2003. Estudio taxonómico de Peridiniales (Dinophyceae): relación entre los estadios quísticos y vegetativos. Tesis de Maestría en Ciencias (Uso, manejo y preservación de los recursos naturales, orientación: biología marina), Centro de Investigaciones Biológicas del Noroeste, México, 72 p. [ Links ]
González-Chan, R. B., Hernández-Silva, L., Navarro-Ornelas, J. G. & Blanco-Padilla, M. A. 2007. Proliferación algal nociva en las Bahías de Puerto de Manzanillo, Colima (marzo-mayo 2007). En: Recursos y Medio Ambiente: Memorias del XIV Congreso Nacional de Ciencia y Tecnología del Mar. 29-31 octubre del 2007, Nuevo Vallarta, México (disco compacto). [ Links ]
González-Zihel, M. 2008. Quintana Roo desarrolla acciones de protección contra riesgos sanitarios por la ingesta de pescado contaminado por ciguatoxina. Revista Red Sanitaria 11: 1-5. [ Links ]
Goto, H., T. Igarashi, M. Yamamoto, M. Yasuda, R. Sekuguchi, M. Watai, K. Tanno & T. Yasumoto. 2001. Quantitative determination of marine toxins associated with diarrhetic poisoning by liquid chromatography coupled with mass spectrometry. Journal of Chromatography A. 907: 181-189. [ Links ]
Gowen, R. J. & N. B. Bradbury. 1987. The ecological impact of salmonoid farming in coastal waters: A review. Oceanographic Marine Biology Annales Review A 25: 563-575. [ Links ]
Graham, H. W. 1943. Gymnodinium catenatum, a new dinoflagellate from the Gulf of California. Transactions American Microscopical Society 62(3): 259-261. [ Links ]
Granéli, E. 2005. Eutrophication and Harmful Algal Blooms. In: Wassmann, P. & K. Olli (Eds.). Drainage basin nutrient input and eutrophication: An Integrated approach. University of Troms0, Noruega, pp. 99-112. [ Links ]
Guardado-Barraza, R., R. Cortés-Altamirano & A. Sierra-Beltrán. 2004. Marine die-offs from Chatonella marina and Ch. cf. ovata in Kun Kaak Bay, Sonora in the Gulf of California. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 25: 7-8. [ Links ]
Hallegraeff, G. M. 1993. A review of harmful algal blooms and their apparent global increase. Phycologia 32: 79-99. [ Links ]
Hallegraeff, G. M. 1995. Harmful algal blooms: A global overview. In: Hallegraeff, G.M., Anderson, D.M., Cembella, A.D. (Eds.) Intergovernmental Oceanographic Commission of UNESCO, París, pp.1-22. [ Links ]
Hallegraeff, G. M. 1998. Transport of toxic dinoflagellates via ship's ballast water: bioeconomic risk assessment and efficacy of possible ballast water management strategies. Marine Ecology Progress Series 168: 297-309. [ Links ]
Hallegraeff, G. M. & C. J. Bolch. 1992. Transport of diatom and dinoflagellate resting spores in ship's ballast water: implications for plankton biogeography and aquaculture. Journal of Plankton Research 14 (8): 1067-1084. [ Links ]
Hallegraeff, G. M., J. P. Valentine, J-A. Marshall & C. J. Bolch. 1997. Temperature tolerance of toxic dinoflagellate cysts: application to the treatment of ship's ballast water. Aquatic Ecology A31: 47-52. [ Links ]
Heredia-Tapia, Á., B. O. Arredondo-Vega, E. J. Núñez-Vázquez, T. Yasumoto, M. Yasuda & J. L. Ochoa. 2002. Isolation of Prorocentrum lima (Syn. Exuviaella lima) and diarrhetic shellfish poisoning (DSP) risk assessment in the Gulf of California, Mexico. Toxicon 40 (8): 1121-1127. [ Links ]
Heredia-Tapia, Á., Á. I. Campa-Córdova, C. J. Band-Schmidt, E. J. Núñez-Vázquez & J. J. Bustillos-Guzmán. 2010. Lipid peroxidation in the bivalve mollusks Dosinia ponderosa and Crassostrea gigas exposed to the toxic dinoflagellate Gymnodinium catenatum. In: XVI Reunión de la Sociedad Mexicana de Planctología A.C. y IX International Meeting of the Mexican Society of Planktology, La Paz, B.C.S. México, p. 57. [ Links ]
Hernández-Becerril, D. U. 1998. Species of the planktonic diatom Pseudo-nitzschia of the Pacific coasts of Mexico. Hydrobiologia 379 (1-3): 77-84. [ Links ]
Hernández-Becerril, D. U. & A. Vázquez-Martínez. 1993. Fitoplancton en Aguas Costeras de Quintana Roo: Composición y Distribución. V Congreso Latinoamericano de Ciencias del Mar. 27 de Septiembre-1 Octubre. La Paz, B. C. S., México. p. 96. [ Links ]
Hernández-Becerril, D. U., M. E. Meave del Castillo & C. Flores-Granados. 2003. Dinoflagelados del orden Dinophysiales en las costas mexicanas. pp. 19-42. In. Barreiro, M. T., M. E. Meave del castiilo, G. Figueroa-Torrres & M. Signoret (eds). Planctología Mexicana. Sociedad Mexicana de Planctología, A.C. (SOMPAC). 284 p. [ Links ]
Hernández-Becerril, D. U. & A. Almazán-Becerril. 2004. Especies de dinoflagelados del género Gambierdiscus (Dinophyceae) del Mar Caribe Mexicano. Revista de Biología Tropical 52 (Suppl. 1): 77-87. [ Links ]
Hernández-Becerril, D. U., E. Bravo-Sierra & A. A. Aké-Castillo. 2007. Phytoplankton on the western coast of Baja California in two different seasons in 1998. Scientia Marina 71(4): 735-743. [ Links ]
Hernández-Becerril, D. U., R. Alonso-Rodríguez, C. Álvarez-Góngora, S. Á. Barón-Campis, G. Ceballos-Corona, J. Herrera-Silveira, M. E. Meave del Castillo, N. Juárez-Ruíz, F. Merino-Virgilio, Á. Morales-Blake, J. L. Ochoa, E. Orellana-Cepeda, C. Ramírez-Camarena & S. Rodríguez-Raciel. 2007. Toxic and harmful marine phytoplankton microalgae (HABs) in Mexican coasts. Journal of Environmental Science Health Part A 42 (10): 1349-1363. [ Links ]
Hernández-Becerril, D. U., S. Á. Barón-Campis, J. G. Ceballos-Corona, Á. Morales-Blake & M. C. Rodríguez-Palacios. 2009. Presentación y estrategia de trabajo del proyecto "Fitoplancton tóxico y nocivo del Pacífico Tropical mexicano: Caracterización de las especies y comunidades, y variables ambientales asociadas a los eventos tóxicos y nocivos. III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
Hernández-Becerril, D. U., S. Escobar-Morales, S. P. Moreno-Gutiérrez & S. Barón Campis. 2010. Two new species of potentially toxic phytoplankton species from the Mexican Pacific. 14th International Conference on Harmful Algae. Hersonisso-Creta, Grecia. 1-5 Noviembre 2010. 137 p. [ Links ]
Hernández-Sandoval, F., D. J. López-Cortés, E. J. Núñez-Vázquez, C. J. Band-Schmidt, I. Gárate-Lizárraga & J. J. Bustillos-Guzmán. 2009. Toxinas paralizantes en moluscos bivalvos durante una proliferación de Gymnodinium catenatum en la Bahía de La Paz, México. Hidrobiológica 19 (3): 245-256. [ Links ]
Herrera-Silveira, J. Á. & I. Ojeda-Alayón. 1999. Las mareas rojas. Biodiversitas 5 (24): 7-11. [ Links ]
Herrera-Silveira, J. Á. & S. M. Morales-Ojeda. 2009. Evaluation of the health status of coastal ecosystem in southeast Mexico: Assess-ment of water quality, phytoplankton and submerged aquatic vegetation. Marine Pollution Bulletin 59: 72-86. [ Links ]
Herrera-Silveira, J. Á., F. Á. Comin, N. Aranda-Cirerol, L. Troccoli & L. Capurro. 2004. Coastal water quality assessment in the Yucatán Peninsula: management implications. Ocean & Coastal Management 47: 625-639. [ Links ]
Herrera-Silveira, J. Á., C. Álvarez-Góngora, F. Virgilio-Marino, Á. Trujillo, I. Mariño, C. Enriquez, D. Robledo & Y. B. Okolodkov. 2009. Investigación y Monitoreo de los florecimientos algales en la costa del norte de Yucatán. III Taller sobre Florecimientos Algales Nocivos (FAN): Integración del conocimiento sobre eventos de FAN en México. Secretaría de Salud, subsecretaría de regulación, control y fomento sanitario, Laboratorio Estatal de Salud Pública "Dr. Galo Soberón y Parra", 9-11 noviembre, Acapulco, Gro., México. [ Links ]
Herrera-Silveira, J., C. Álvarez-Góngora, F. Virgilio-Marino & A. Aguilar-Trujillo. 2010. Mareas rojas en las costas de Yucatán. Biodiversidad y desarrollo humano en Yucatán, amenazas a la biodiversidad. México. [ Links ]
Hess, P., T. Butter, á. Peterson, J. Silke & T. McMahon. 2009. Performance of the EU-harmonized mouse bioassay for lipophilic toxins for detection of azaspiracids in naturally contaminated mussel (Mytilus edulis) hepatopancreas tissue homogenates characterized by liquid chromatography coupled to tandem mass spectrometry. Toxicon 53: 713-722. [ Links ]
Hodgkiss, I. J. & S. Lu. 2004. The effects of nutrients and ratios on phytoplankton abundance in Junk Bay, Hong Kong. Hydrobiologia 512: 215-229. [ Links ]
Holmes, M. J., R. J. Lewis & N. C. Gillespie. 1990. Toxicity of Australian and French Polynesian strains of Gambierdiscus toxicus (Dinophyceae) grown in culture: Characterization of a new type of maitotoxin. Toxicon 28: 1159-1172. [ Links ]
Hummert, C., M. Ritscher, K. Reinhardt & B. Luckas. 1997. Analysis of the characteristic PSP profiles of Pyrodinium bahamense and several strains of Alexandrium sp. by HPLC based on ion-pair chromatographic separation, post-column oxidation, and fluorescence detection. Chromatographia 45: 312-316. [ Links ]
Ishimatsu, Á., T. Oda, M. Yoshida & M. Ozaki. 1996. Oxygen radicals are probably involved in the mortality of yellowtail by Chattonella marina. Fisheries Science 62: 836-837. [ Links ]
Jellett, J. F., L. J. Marks, J. E. Stewart, M. L. Dorey, W. W. Wright & J. F. Lawrence. 1992. Paralytic shellfish poisoning (saxitoxin family) bioassays: automated determination endpoint determination and standardization of the in vitro tissue culture bioassay, and comparison with the standard mouse bioassay. Toxicon 30: 1143-1156. [ Links ]
Jeong, H. J. 2001. Developing a method of controlling the outbreak and maintenance of red tide using mass-cultured grazers. In: Aquatic Sciences meeting, American Society of Limnology and Oceanography, American Society of Limnology and Oceanography, Albuquerque, N. Mexico, E.U.A. p. 74. [ Links ]
Jeong, H. J., H. R. Kim, K. I. Kim & K. Y. Kim. 2002. NaOCl produced by electrolysis of natural seawater as a potential method to control marine redtide dinoflagellates. Phycologia 41 (6): 643-656. [ Links ]
Katano, T., M. Yoshida, J. Lee, M. S. Han & Y. Hayami. 2009. Fixation of Chattonella antiqua and C. marina (Raphidophyceae) using Hepes-Buffered paraformaldehyde and glutaraldehyde for flow cytometry and light microscopy. Phycologia 48 (6): 473-479. [ Links ]
Keynan, Y. & I. Pottesman. 2004. Neurological symptoms in a traveler returning from Central America. Journal of Internal Medicine 256: 174-175. [ Links ]
Khan, S., M. S. Ahmed, O. Arakawa & Y. Onoue. 1995. Properties of neuro-toxins separated from a harmful red tide organism Chattonella marina. The Israeli Journal of Aquaculture-Bamidgeh 47: 137-141. [ Links ]
Khan, S., O. Arakawa & Y. Onoue. 1996a. A toxicological study of the marine phytoflagellate, Chattonella antiqua (Raphidophyceae). Phycologia 35: 239-244. [ Links ]
Khan, S., O. Arakawa & Y. Onoue. 1996b. Neurotoxin production by a chloromonad Fibrocapsa japonica (Raphidophyceae). Journal of the World Aquaculture Society 27: 254-263. [ Links ]
Khan, S., O. Arakawa & Y. Onoue. 1997. Neurotoxins in a toxic red tide of Heterosigma akashiwo (Raphidophyceae) in Kagoshima Bay, Japan. Aquaculture Research 28: 9-14. [ Links ]
Kim, D. K., Á. Nakamura, T. Okamoto, N. Komatsu, T. Oda, Á. Ishimatsu & T. Muramatsu. 1999. Toxic potential of the Raphidophyte Olisthodiscus luteus: mediation by reactive oxygen species. Journal of Plankton Research 21: 1017-1027. [ Links ]
Kim, D. K., T. Okamoto, T. Oda, K. Tachibana, K. S. Lee, Á. Ishimatsu, Y. Matsuyama & T. Homjo. 2001. Possible involvement if the glycocalyx in the ichthyotoxicity of Chattonella marina (Raphidophyceae): immunological approach using antiserum against cell surface structures of flagellate. Marine Biology 139: 625-632. [ Links ]
Kim, D., T. Oda, D., Muramatsu, D. Kim, Y. Matsuyama & T. Honjo. 2002. Possible factors responsible for the toxicity of Cochlodinium polykrikoides, a red tide phytoplankyon. Comparative Biochemistry and Physiology. Part C. 132, 415-423. [ Links ]
Kohler, S. T. & C. C. Kohler. 1992. Dead bleached coral provides new surface for dinoflagellates implicated in ciguatera fish poisonings. Environmental Biology of Fishes 35: 413-416. [ Links ]
KORDI, 1998. Optimizing the red-tide treatment system. BSPE97669-00-1032-3. Korea Ocean Research and Development Institute. Ansan. Repuplic of Korea 26 p [ Links ]
Kuroda Á., T. Nakashima, K. Yamaguchi & T. Oda. 2005. Isolation and characterization of light-dependent hemolytic cytotoxin from harmful red tide phytoplankton Chattonella marina. Comparative Biochemistry and Physiology Part C 141: 297-305. [ Links ]
Lagos, N. 2002. Principales toxinas de origen fitoplanctónico: Identificación y cuantificación mediante cromatografía líquida de alta resolución. In: Sar, E.A., M.E. , Ferrario & B. Reguera. (Eds). Floraciones Algales Nocivas en el Cono Sur Americano. Instituto Español Oceanográfico. pp. 57-69. [ Links ]
Lawrence, J. F. & B. Niedzwiadek. 2001. Quantitative determination of Paralytic Shellfish Poisoning toxins in shellfish by using prechromatographic oxidation and liquid chromatography with fluorescence detection. Journal of AOAC 84: 1099-1108. [ Links ]
Lawrence, J. F., C. F. Charbonneau & C. Ménard. 1991. Liquid chromatographic determination of domoic acid in mussels, using AOAC paralytic shellfish poison extraction procedure: Collaborative study. Journal of AOAC 74: 68-72. [ Links ]
Lawrence, J. F., Menard, C., & Cleroux, C. 1995. Evaluation of prechromatographic oxidation for liquid chromatographic determination of paralytic shellfish poisons in shellfish. Journal of AOAC.Int 78: 514:520. [ Links ]
Lawrence, J. F., B. Niedzwiadek & C. Menard. 2004. Quantitative determination of Paralytic Shellfish Poisoning toxins in shellfish using prechromatographic oxidation and liquid chromatography with fluorescence detection: Interlaboratory Study. Journal of AOAC 87: 83-100. [ Links ]
Lawrence, J. F., B. Niedzwiadek & C. Menard. 2005. Quantitative determination of Paralytic Shellfish Poisoning toxins in shellfish using prechromatographic oxidation and liquid chromatography with fluorescence detection: Collaborative Study. Journal of AOAC 88: 1714-1732. [ Links ]
Lee, J.-S. 1996. Bioactive components from the red tide plankton Cochlodinium polykrikoides. Journal of the Korean Fisheries Society. 26, 165-173. [ Links ]
Lee, J. S., T. Yanagi, R. Kenma & T. Yasumoto. 1987. Fluorometric determination of diarrhetic shellfish toxins by high performance liquid chromatography. Agricultural and Biological Chemistry 51: 877-881. [ Links ]
Lee, J. S., T. Igarashi, S. Fraga, E. Dahl, P. Hovgaard & T. Yasumoto. 1989. Determination of diarrhetic shellfish toxins in various dinoflagellate species. Journal of Applied Phycology 1: 147-152. [ Links ]
Lehane, L. & Lewis, R. J. 2000. Ciguatera: Recent advances but the risk remains. International Journal of Food Microbiology 61: 91-125. [ Links ]
Licea, S., M. E. Zamudio, R. Luna & J. Soto. 2004. Free living dinoflagellates in the southern Gulf of Mexico. Report of data (1979-2002). Phycological Research 52. 419-428. [ Links ]
Licea-Durán, S., M. E. Zamudio, R. Luna & J. Soto. 2006a. Free-living dinoflagellates in the southern Gulf of Mexico: Report of data (1979-2002). Phycological Research 52 (4): 419-428. [ Links ]
Licea-Durán, S., Á. Navarrete, R. Rodríguez, J. Bustillos-Guzmán, C. Martínez & C. Ramírez. 2006b. Monitoring a bloom of Pyrodinium bahamense var. compressum occurring in El Salvador, Guatemala and Mexico (November 2005-March 2006). 12th International Conference on Harmful Algae, Copenhagen, Dinamarca. p. 219. [ Links ]
Lechuga-Devéze, C. H. & A. Sierra-Beltrán. 1995. Documented case of Ciguatera on the Mexican Pacific Coast. Natural Toxins 3: 415-418. [ Links ]
Lewis, R. J., M. Sellin, M. Á. Poli, R. S. Norton, J. K. MacLeod & M. M. Sheil. 1991. Purification and characterization of ciguatoxins from moray eel (Lycodontis javanicus, Murenidae). Toxicon 29: 1115-1127. [ Links ]
Lewis, R. J., M. J. Holmes, P. F. Alewood & A. Jones. 1994. Ion spray mass spectrometry of ciguatoxin-1 maitotoxin-2 and 3, and related marine polyether toxins. Natural toxins 2: 56-63. [ Links ]
Lewis, R. J. 1995. Detection of ciguatoxins and related benthic dinoflagellate toxins: in vivo and in vitro methods. In: Hallegraeff, G. M., D. M. Anderson, A. D. Cembella & H. O. Enevoldsen (Eds.). Manual on Harmful Marine Microalge. UNESCO-IOC, Paris. 135-161 pp. [ Links ]
Llewellyn, L., Á. Negri & A. Robertson. 2006. Paralytic shellfish toxins in tropical oceans. Toxins reviews 25: 159-196. [ Links ]
López-Cortés, Á. 1999. Population changes of benthic cyanobacteria during a shrimp production operation. Archives Hydrobiology Supplement 129: 245-248. [ Links ]
López-Cortés, Á., F. García-Pichel, U. Nubel & R. Vázquez-Juárez. 2001. Cyanobacterial diversity in extreme environments in Baja California, Mexico: a polyphasic study. International Microbiology 4: 227-236. [ Links ]
López-Cortés, D. J., J. J. Bustillos-Guzmán & I. Gárate-Lizárraga. 2006. Unusual mortality of krill (Crustacea: Euphausiacea) in Bahía de La Paz, Gulf of California. Pacific Science 60 (2): 235-242. [ Links ]
López-Cortés, D. J., J. J. Bustillos-Guzmán, I. Gárate-Lizárraga, C. J. Band-Schmidt, S. Chavéz & F. E. Hernández-Sandoval. 2007. Uso de arcillas para control experimental de Mareas rojas: Perspectivas de investigación. II Taller sobre Florecimientos Algales Nocivos, Ensenada, B.C. México. [ Links ]
López-Cortés, D. J., J. J. Bustillos-Guzmán, I. Gárate-Lizárraga, C. J. Band-Schmidt & F. H. Hernández-Sandoval. 2008a. Dos eventos de mareas rojas durante el monitoreo de nutrientes en dos granjas atuneras. Primera Reunión Bienal de la Agenda de Investigación del Ordenamiento Ecológico Marino del Golfo de California. La Paz, B.C.S., México. [ Links ]
López-Cortés, D. J., I. Gárate-Lizárraga, J. J. Bustillos-Guzmán & F. E. Hernández-Sandoval. 2008b. Blooms of Myrionecta rubra in Bahia de La Paz, Gulf of California, Mexico in early summer 2005. CICIMAR Oceánides 23 (1-2):1-10. [ Links ]
López-Cortés, D. J., C. J. Band-Schmidt, J. J. Bustillos-Guzmán, I. Gárate-Lizárraga, F. E. Hernández-Sandoval & E. J. Núñez-Vázquez. 2011. Coocurrencia de Chattonella marina y Gymnodinium catenatum en la Bahía de La Paz, Golfo de California (primavera 2009). Hidrobiológica 21 (2): 185-196. [ Links ]
Magaña, H. Á., C. Contreras & T. Á. Villarreal. 2003. A historical assessment of Karenia brevis in the western Gulf of Mexico. Harmful Algae 2 (3): 163-171. [ Links ]
Manrique, F. Á. & R. E. Molina. 1997. Presencia de mares rojas en la Bahía de Bacochibampo, Guaymas, Sonora, México. Hidrobiológica 7: 81-86. [ Links ]
Margalef, R. 1961. Hidrografía y fitoplancton de un área marina de la costa meridional de Puerto Rico. Investigaciones Pesqueras 18 (76): 78. [ Links ]
Martínez-López, Á., C. J. Band-Schmidt, D. Escobedo-Urías & A. E. Ulloa-Pérez. 2006. Bloom of Chattonella subsalsa in an impacted coastal lagoon in the Gulf of California. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 31: 1-4-5. [ Links ]
Martínez-López, Á., Á. E. Ulloa-Pérez & D. C. Escobedo-Urías. 2007. First record of vegetative cells of Pyrodinium bahamense (Gonyalucales Goniodomataceae) in the Gulf of California. Pacific Science 61 (2): 289-293. [ Links ]
Martínez-López, Á., D. Escobedo-Urías, Á. E. Ulloa-Pérez & G. R. Aguirre. 2008. Dynamic of Prorocentrum minimum bloom in the northern litoral of Sinaloa, Mexico. Continental Shelf Research 28 (14): 1693-1701. [ Links ]
Manrique, F. Á. & R. E. Molina. 1997. Presencia de mares rojas en la Bahía de Bacochibampo, Guaymas, Sonora, México. Hidrobiológica 7: 81-86. [ Links ]
Mateo-Cid, L. E., Á. C. Mendoza-González, I. Aguilar-Rosas & L. E. Aguilar-Rosas. 2006. Algas marinas bentónicas de Puerto Peñasco, Sonora, México. Hidrobiológica 16 (1): 45-65. [ Links ]
Matsuoka, K. & Y. Fukuyo. 2000. Guía técnica para el estudio de los quistes de dinoflagelados actuales. WESTPAC-HAB/WESTPAC/IOC. 30 p. [ Links ]
Meave del Castillo, M. E., S. Rodríguez & M. Vargas. 2006. Blooms of Pyrodinium bahamense var. compressa along the Central American Pacific coast and south of Mexico. 12th International Conference on Harmful Algae, Copenhagen, Dinamarca, p. 239. [ Links ]
Meave del Castillo, M. E., M. E. Zamudio-Reséndiz & M. Herrera-Galindo. 2010a. Bloom of Alexandrium cf. tamarensein Oaxaca's Coast, Mexico, during May 2009. 14th International Conference on Harmful Algae. 1-5 November, Hersonissos, Creta, Grecia. 141 p. [ Links ]
Meave del Castillo, M. E. & M. E. Zamudio-Resendiz. 2010b. Karenia species in Mexican Pacific. 14th International Conference on Harmful Algae. 1-5 November Hersonissos, Creta, Grecia. 142 p. [ Links ]
Mee, L. D., R. Cortés-Altamirano & L. M. García de La Parra. 1984. Di-nitrogen fixation in a eutrophic tropical bay. Estuarine, Coastal and Shelf Science 19 (4): 477-483. [ Links ]
Mee, L. D., M. Espinosa & G. Díaz. 1986. Paralytic shellfish poisoning with a Gymnodinium catenatum red tide on the Pacific coast of Mexico. Marine Environmental Research 19: 77-92. [ Links ]
Mendoza-Flores, Á. 2011. Identificación de cepas del género Chattonella (Clase: Raphidophyceae) aisladas del Golfo de California a partir de la región 5.8S del ácido ribonucleico ribosomal (ARNr) y del gen citocromo C oxidasa subunidad 1. Tesis de licenciatura (Biología Marina), UABCS, México. 59 p. [ Links ]
Mikulski, C. M., Y. T. Park, K. L., Jones, C. K., Lee, W. Á., Lim, Y., Lee, C. Á., Scholin & G. C. Doucette. 2008. Development ad field application of the rRNA-targeted probes for the detection of Coclhlodinium polykrikoides Margalef in Korean coastal waters using whole cell hibridization formtas. Harmful Algae 7. 347-359. [ Links ]
Miles, C. O., Samdal, I. A., Jensen, D. J., Quilliam, M. Á., Petersen, D., Briggs, L. M., Rise, F., Cooney, J. M. & A. L. Mackenzie. 2005. Evidence for numerous analogs of yessotoxin in Proroceratium reticulatum. Harmful Algae. 4:1075-1091. [ Links ]
Mines, C. O., Samdal, I. A., Aasen, J. Á., Jensen, D. J., Quilliam, M. Á., Petersen, D., Briggs, L. M., Wilkins, Á. L., Rise, F., Cooney, J. M. & A. L. MacKenzie. 2005. Evidence for numerous analogs of yessotoxin in Protoceratium reticulatum. Harmful Algae 4: 1075-1091. [ Links ]
Mons, M. N., E. H. P. Van & G. J. Á. Speijers. 1998. Paralytic shellfish poisoning: A review. RIVM Report 388802 005. [ Links ]
Montani, S. S. Meksumpun & K. Ichimi. 1995. Chemical and physical treatments for destruction of phytoflagellate cysts. Journal of Marine Biotechnology 2: 179-181. [ Links ]
Morquecho, L. 2004. Estudio de la dinámica poblacional de dinoflagelados en Bahía Concepción, Golfo de California: Relación entre la fase quística y vegetativa. Tesis de Doctorado en Ciencias (Uso, manejo y preservación de los recursos naturales. Orientación: biología marina), Centro de Investigaciones Biológicas del Noroeste, S.C., México, 76 p. [ Links ]
Morquecho, L. 2008a. Morphology of Pyrodinium bahamense Plate (Dinoflagellata) near Isla San José, Gulf of California, Mexico. Harmful Algae 7: 664-670. [ Links ]
Morquecho, L. 2008b. Colección de Dinoflagelados Marinos (CODIMAR). Centro de Investigaciones Biológicas del Noroeste, S. C. La Paz, B. C. S. México. Disponible en línea en: http://www.cibnor.mx/es/investigacion-joomla/colecciones-biologicas/codimar (consultado el 30 de mayo 2011). [ Links ]
Morquecho, L. & C. H. Lechuga-Devéze. 2003. Dinoflagellate cysts in recent sediments from Bahía Concepción, Gulf of California. Botánica Marina 46: 132-141. [ Links ]
Morquecho, L., R. Alonso-Rodríguez, J. Á. Arreola-Lizárraga & A. Reyes-Salinas. 2010. Related factors during moderate blooms of Pyrodinium bahamense var. bahamense in two coastal lagoons from the southern Gulf of California.14th International Conference on Harmful Algae. Hersonissos-Creta, Grecia. 1-5 Noviembre. p. 43. [ Links ]
Murphy. E. B., K. Á. Steidinger, B. S. Roberts, J. Williams & J. W. Jr. Jolley. 1975. An explanation for the Florida east coast Gymnodinium breve red tide of November 1972. Limnology and Oceanography 20: 481-486. [ Links ]
Norma Oficial Mexicana. 2005. PROY-NOM-242-SSA1-2005. Productos y servicios. Productos de la pesca frescos, refrigerados, congelados y procesados. Especificaciones sanitarias y métodos de prueba. pp. 17-22. [ Links ]
Núñez-Vázquez, E. J., Bustillos-Guzmán, J., Heredia-Tapia, Á., Yasumoto, T., Cruz-Villacorta, Á., Band-Schmidt, C. J., Gárate-Lizárraga, I., López-Cortés, D., Hernández-Sandoval, F. E. & Ochoa, J. L. 2009. Múltiples toxinas marinas en el hígado de Mycteroperca prionura, M. rosacea y Lutjanus colorado asociados a la ciguatera en la isla El Pardito, B. C. S., México. Resúmenes del III Taller sobre Florecimientos Algales Nocivos: Integración del conocimiento sobre eventos de FAN en México, 9-11 de Noviembre, Acapulco, Gro., México. p. 52. [ Links ]
Núñez-Vázquez, E. J., Á. Almazán-Becerril, Á. Heredia-Tapia, D. U. Hernández-Becerril, L. Troccoli-Ghinaglia, B. O. Arredondo-Vega, J. Á. Herrera-Silveira, J. L. Vázquez-Castellanos & J. L. Ochoa. 2000. Incidencia del envenenamiento por Ciguatera en México. 4ª Reunión de expertos en envenenamientos por animales ponzoñosos. Instituto de Biotecnología, Universidad Nacional Autónoma de México, International Society of Toxinology -Panamerican Section, Inst. Bioclon, Lab. Silanes. 30-31 de marzo, Cuernavaca, Mor., México pp. 56-57. [ Links ]
Núñez-Vázquez, E. J., Á. Heredia-Tapia, J. C. Pérez-Urbiola, R. Alonso-Rodríguez, J. Arellano-Blanco, Á. Cordero-Tapia, J. Pérez-Linares & J. L. Ochoa. 2003. Evaluation of dinoflagellate toxicity implicated in recent HAB events in the Gulf of California, Mexico. In: HABTech 2003 Workshop. Nelson, New Zealand Cawthron Report No. 906. p. 90. [ Links ]
Núñez-Vázquez, E. J., Á. Cordero-Tapia & G. Arnaud. 2007a. Origen e Impacto de las Biotoxinas Marinas en la Salud de Tortugas Marinas-Salud Pública. 1er Encuentro Internacional de Medicina de la Conservación. 18-21 de julio. Vitoria, Brasil. [ Links ]
Núnez-Vázquez, E. J., J. J. Bustillos-Guzmán, C. Ramírez-Camarena & F. E. Hernández-Sandoval. 2007b. Perfiles cromatográficos de toxinas paralizantes en moluscos bivalvos asociados a Pyrodinium bahamense var. compressum en el Pacífico Sur Mexicano. II Taller sobre Florecimientos Algales Nocivos (Mareas Rojas), 21-23 de noviembre, Ensenada, B. C., México. p. 18. [ Links ]
Núñez-Vázquez, E. J., Á. Cordero-Tapia, J. L. Ochoa & J.J. Bustillos-Guzmán. 2008a. Histopatología por exposición aguda a las biotoxinas marinas de importancia en Salud Pública en México. In: XVII Congreso Nacional de Patología Veterinaria. Candanosa-Aranda, E. (Ed.). Sociedad Mexicana de Patólogos Veterinarios, A. C. Facultad de Medicina Veterinaria y Zootecnia-Universidad Nacional Autónoma de México. México. pp: 518-524. [ Links ]
Núñez-Vázquez, E. J., J. L. Ochoa, C. J. Band-Schmidt, I. Gárate-Lizárraga, Á. Heredia-Tapia, D. J. López-Cortés, F. E. Hernández-Sandoval & J. J. Bustillos-Guzmán. 2008b. Ciguatera in Mexico. 13th International Conference on Harmful Algae. 3-7 November, Hong Kong, China. p. 98. [ Links ]
Núñez-Vázquez, E. J., I. Gárate-Lizárraga, C. J. Band-Schmidt, Á. Cordero-Tapia, D. J. López-Cortés, F. E. Hernández-Sandoval, Á. Heredia-Tapia & J. J. Bustillos-Guzmán. 2011. Impact of Harmful Algal Blooms on wild and culture animals in the Gulf of the California. Journal of Environmental Biology 32(4): 407-412. [ Links ]
Ochoa, J. L. 2003. Mareas rojas. Proliferaciones Micro-algales Nocivas y Biotoxinas Marinas en México: Impacto en Salud Pública, Pesquerías, Acuacultura y Medio Ambiente. Gobierno del Estado de B. C. S., SEP, CIBNOR. México. 84 p. [ Links ]
Ochoa, J. L., Á. Sierra-Beltrán, Á. Cruz-Villacorta & E. Núñez-Vázquez. 1996. Domoic acid in Mexico. In: R. W. Penney (Ed.). 5th Canadian Workshop on Harmful Marine Algae. St. John's, Newfounland, Canada. Department of Fisheries and Oceans. Canadian Technical Report of Fisheries Aquatic Science 2138: 82-90. [ Links ]
Ochoa, J. L., Á. Sánchez-Paz, Á. Cruz-Villacorta, E. J. Núñez-Vázquez & A. Sierra-Beltrán. 1997. Toxicevents in the North Pacific Coastlinein Mexico during 1992-1995: origin and impact. Hydrobiologia 352: 195-200. [ Links ]
Ochoa, J. L., Á. Sierra-Beltrán, G. Alonso-Colmenares, H. Barrada-Sánchez, Á. Cruz-Villacorta, E. Núñez-Vázquez & A. Sánchez-Paz. 1998. Biotoxins in the Pacific coasts of Mexico. In: M. Miraglia, H. van Egmond, C. Brera & J. Gilbert (Eds.). Mycotoxins and Phycotoxins-Developments in Chemistry, Toxicology and Food Safety. International Union Purity Analytical Chemistry (IUPAC). IX IUPAC International Symposium on Mycotoxins and Phycotoxins. Rome, Italy. Alaken, Inc. Fort Collins Co. U. S. pp: 441-448. [ Links ]
Ochoa, J. L., D. u. Hernández-Becerril, S. E. Lluch-Cota, B. O. Arredondo-Vega, E. Núñez-Vázquez, Á. Heredia-Tapia, J. Pérez-Linares & R. Alonso-Rodríguez. 2002. Marine biotoxins and harmful algal blooms in Mexico's Pacific litoral. In: Taylor, M. F. J. R. & V. L. Trainer (Eds.). Harmful algal blooms in the PICES region of the North Pacific. 10th Annual Meeting North Pacific Marine Science Organization (PICES). Victoria, B. C. Canadá. PICES Scientific Report No. 23, pp. 119-128. [ Links ]
Oda, T., Á. Ishimatsu, S. Takeshita & T. Muramatsu. 1994. Hydrogen peroxide production by the red tide flagellate Chattonella marina. Bios-cience, Biotechnology & Biochemistry 58: 957-958. [ Links ]
Okaichi, T. 1987. Red tides problems for aquaculture in Japan. The problems of toxic red dinoflagellate blooms in aquaculture. In: B. Dael, D.G. Baden, B., Barry Mck., L. Edler, S. Fraga, I. R. Jenkinson, G. M. Hallegraeff, T. Okaichi et al.,) (Ed.) Sherkin, Island, Eire, pp. 50-51. [ Links ]
Okolodkov, Y. B. & I. Gárate-Lizárraga. 2006. An annotated checklist of dinoflagellates (Dinophyceae) from the Mexican Pacific. Acta Botánica Mexicana 74: 1-154. [ Links ]
Okolodkov, Y. B., G. Campos-Bautista, I. Gárate-Lizárraga, J. Á. G. González-González, M. Hoppenrath & V. Arenas. 2007. Seasonal changes of benthic and epiphytic dinoflagellates in the Veracruz reef zone, Gulf of Mexico. Aquatic Microbial Ecology 47: 223-237. [ Links ]
Okolodkov, Y. B., F. C. Merino-Virgilio, J. Á. Herrera-Silveira, S. Espino-a-Matías & M. R. Parsons. 2009. Gambierdiscus toxicus in the southeastern Gulf of Mexico. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 40: 12-14. [ Links ]
Orellana-Cepeda, E., E. Martínez-Romero, L. Muñoz-Cabrera, P. López-Ramírez, E. Cabrera-Mancilla & C. Ramírez-Camarena. 1998. Toxicity associated with blooms of Pyrodinium bahamense var. compressum in Southwestern Mexico. In: Reguera, B., J. Blanco, M. L. Fernández & T. Wyatt (Eds.). Harmful Algae. Xunta de Galicia and Intergovernmental Oceanographic Commission of UNESCO. p. 60. [ Links ]
Orellana-Cepeda, E., C. Granados-Machuca & J. Serrano-Esquer. 2004. Ceratium furca: One possible cause of mass mortality of cultured blue-fin tuna at Baja California, Mexico. In: Steidinger, K. A., J. H. Landsberg, C. R. Tomas & G. A. Vargo (Eds.). Harmful Algae 2002. Florida Fish and Wildlife Conservation Commission, Florida Institute of Oceanography y Intergovernmental Oceanographic Commission of UNESCO, pp. 514-516. [ Links ]
Orellana-Cepeda, E., R. Canino-Herrera, E. Santamaría del Ángel, C. Granados-Machuca, M. Valdéz & L. Á. Morales-Zamorano. 2007. Florecimiento de Ceratium divaricatum frente a la costa Noroeste de Ensenada, Baja California, durante la primavera de 2007. II Taller sobre Florecimientos Algales Nocivos, CICESE, CET-MAR, Ensenada, B. C. México. p. 12. [ Links ]
Ortíz-Lira, J. H. & Jiménez-Quiroz, M. del C. 2006. Registros de eventos de Marea Roja en Manzanillo, Colima (1986-2004). En: los Recursos Pesqueros y Acuícolas de Jalisco, Colima y Michoacán. Jiménez-Quiroz, M. del C. & Espino-Barr, E. (Eds). SAGARPA, INP, CRIP Manzanillo, México, pp: 324-334. [ Links ]
Osorio-Tafall, B. F. 1942. Notas sobre algunos dinoflagelados planctónicos marinos de México, con descripción de nuevas especies. Anales de la Escuela Nacional de Ciencias Biológicas-IPN, México 2: 435-447. [ Links ]
Palomares-García, R., J. J. Bustillos-Guzmán, C.J. Band-Schmidt, D. J. López-Cortés & B. Luckas. 2006. Effect of the toxic dinoflagellate Gymnodinium catenatum on the grazing, egg production, and hatching success of the copepod Acartia clausi. Ciencias Marinas 32: 97-119. [ Links ]
Pan, G., M. M. Zhang, H. Chen, H. Zou & H. Yan. 2006a. Removal of cyanobacterial blooms in Taihu Lake using local soil. I. Equilibrium and kinetic screening on the flocculation of Microcystis aeruginosa using commercially available clays and minerals. Environmental Pollution 141: 195-200. [ Links ]
Pan, G., H. Zou, H. Chen & X. Yuan. 2006b. Removal of cyanobacterial blooms in Taihu Lake using local soil. III. Factors affecting the remo-val efficiency and an in situ field experiment using chitosan-modified local soil. Environmental Pollution 141: 206-212. [ Links ]
Park, D. L. 1994. Evolution of method for assessing ciguatera toxins in fish. Environmental Contamination and Toxicology 136: 1-19. [ Links ]
Parrilla-Cerrillo, M. C., J. L. Vázquez-Castellanos, E. O. Sáldate-Castañeda & L. M. Nava-Fernández. 1993. Brotes de toxiinfecciones alimentarias de origen microbiano y parasitario. Salud Pública de México 35: 456-463. [ Links ]
Pérez-Cruz, B. 2007. Tasa de depuración de toxinas paralíticas producidas por Gymnodinium catenatum (Graham, 1943) en la almeja chocolate Megapitaria squalida (Sowerby, 1835). Tesis de Maestría en Ciencias (Recursos marinos), Centro Interdisciplinario de Ciencias Marinas, IPN, México. 70 p. [ Links ]
Pérez-Linares, J., J. L. Ochoa & A. Gago-Martínez. 2008. Effects of PSP toxins in white leg shrimp Litopenaeus vannamei Boone, 1931. Journal of Food Science 73 (4): 671-673. [ Links ]
Pérez-Linares, J., J. L. Ochoa & A. Gago-Martínez. 2009. Retention and tissue damage of PSP and NSP toxins in shrimp: Is cultured shrimp a potential vector of toxins to human population? Toxicon 53: 185-195. [ Links ]
Peña-Manjarrez, J. L., J. Helenes, G. Castro-Gaxiola & E. Orellana-Cepeda. 2005. Dinoflagellates cysts and blooms at Todos Santos Bay, B.C. Mexico, 1999-2000. Continental Shellfish Research 25: 1375-1393. [ Links ]
Pérez-Cruz, B., Gárate-Lizárraga, I., Díaz-Ortíz, J., Alarcón-Tacuba, M., Alarcón-Romero, M. á., López-Silva, S. & Salgado-Sales, P. 2010. Florecimientos Algales Nocivos en la Bahía de Acapulco, Guerrero (1991-2009). Resúmenes de la XVI Reunión Nacional de la Sociedad Mexicana de Planctología y IX International Meeting of the Mexican Society of Planktology. La Paz, B. C. S., México. 27-30 de abril del 2010. p: 45 [ Links ]
Plan Binacional de marea roja. Disponible en línea en: http://intranet/proyectos/manuales/lineamientos%20Marea%20Roja (consultado el 20 de junio, 2011). [ Links ]
Poot-Delgado, C.Á. & Y.A. Guzmán-Noz. 2010. Composición y abundancia del fitoplancton marino, con énfasis en las especies potencialmente tóxicas y/o nocivas, en la Bahía de Campeche, México. 3er Congreso Internacional de Investigación. Octubre, Parral, Chihuahua, pp. 437-444. [ Links ]
Poot-Delgado, C. á., R. á. Novelo-Salazar & B. Pérez-Cruz. 2009. Primer reporte de Pyrodinium bahamense var. bahamense (Gonyaulacales: Goniodomataceae) dinoflagelado tóxico, en la Bahía de Campeche, México. XVI Congreso de Ciencia y Tecnología del Mar. [ Links ]
Quilliam, M. Á. 2003a. The role of chromatography in the hunt for red tides toxins. Journal of Chromatography A. 1000: 527-548. [ Links ]
Quilliam, M. á. 2003b. Chemical methods for lipophilic shellfish toxins. In: Hallegraeff, G., D. M. Anderson & A. D. Cembella (Eds.). Manual on harmful marine microalgae. Intergovermental oceanographic commission of UNESCO, Paris, ISBN 92-3-103871-0, pp. 211-245. [ Links ]
Quilliam, M. Á., Hardstaff, W. R., Ishida, N., McLahlan, J. L., Reeves, á. R., Ross, N. W. & A. J. Windust. 1996. Production of diarrhetic shellfish poisoning (DSP) toxins by Prorocentrum lima in culture and development of analytical methods. In: Yasumoto, T., Oshima, Y. & Y. Fukuyo (Eds.). Harmful and Toxic Algal Blooms. IOC-UNESCO, Paris, pp. 289-292. [ Links ]
Quiñones-Vega, C. M. 2000. Intoxicación por ciguatera en Yucatán. Boletín epidemiológico. Hospital General "Agustín O'Horán" Urgencias Pediátricas. Mérida, Yuc., México, pp. 3-6. [ Links ]
Ramírez-Camarena, C. 1999. Mortandades de peces asociadas a florecimientos de Gymnodinium breve. VIII Congreso Latinoamericano de Ciencias del Mar. Trujillo, Perú, pp. 604-605. [ Links ]
Ramírez-Camarena, C., L. Muñoz-Cabrera, E. Cabrera-Mancilla, R. Castro-Ramos, P. López-Ramírez & E. Orellana-Cepeda. 1996. Identificación de la marea roja frente a la costa suroeste de México en Oct.-Dic. 1995. I Reunión Internacional de Planctología y VIII Reunión Nacional de la Sociedad Mexicana de Planctología, Pátzcuaro, Mich., México, p. 47. [ Links ]
Ramírez-Camarena, C., R. Cortés-Altamirano & L. Muñoz-Cabrera. 1999. Mareas rojas provocadas por el dinoflagelado Gymnodinium catenatum (Gymnodiniales: Gymnodiniaceae) en la Bahía de Mazatlán, Sin., México, en 1997. Revista de Biología Tropical 47 (Supl. 1): 77-80. [ Links ]
Ramírez-Camarena, C., R. Rojas-Crisóstomo, L. Muñoz-Cabrera, S. Sarniento-Nafate & N. O. Juárez-Ruíz. 2002. Mortandad de peces e intoxicaciones humanas en la Costa de Chiapas en el 2001. IX Congreso Nacional de Ciencia y Tecnología del Mar. Nuevo Vallarta, Nay. México, pp. 1-2. [ Links ]
Ramírez-Camarena, C., D. U. Hernández-Becerril, S. Barón-Campis & N. O. Juárez-Ruíz. 2006. Mareas rojas de Karena brevis en costas mexicanas del Golfo de México: Revisión de 1996 a 2005. XII Congreso Nacional de Ciencia y Tecnología del Mar. [ Links ]
Ramírez-Camarena, C., D. U. Hernández-Becerril & C. S. Barón. 2010. Cyanobacteria blooms associated to harmful effects on shrimps in a tropical coastal lagoon from Mexico. ICT8 29 Aug.-4 September, Istanbul, Turquía. pp [ Links ]
Rhodes, L., P. Mcnabb, M. de Salas, L. Briggs, V. Beuzenberg & M. Glads-tone. 2006. Yessotoxins production by Gonyaulax spinifera. Harmful Algae 5: 148-155. [ Links ]
Rourke, W. Á., C. J. Murphy, G. Pitcher, J. M. Van De Riet, G. Burns, K. M. Thomas & M. A. Quilliam. 2008. Rapid postcolumn methodology for determination of paralytic toxins in shellfish tissue. Journal of AOAC 91: 589-597. [ Links ]
Rodríguez-Palacio, M. C., C. Lozano-Ramírez, S. Álvarez-Hernández & G. L. de Lara-Isassi. 2006. First Record of harmful bloom of Gymnodinium catenatum along the Michoacán coast, Mexico. 12th International Conference on Harmful Algae, Copenhagen, Dinamarca. p. 270. [ Links ]
Rodríguez-Palacios, M. C., S. Álvarez-Hernández, G. de Lara-Isassi & C. Lozano-Ramírez. 2007. Establecimiento de una colección de organismos productores de FAN en aguas del Pacífico Mexicano. II Taller sobre Florecimientos Algales Nocivos, Ensenada, B.C. México. p. 29. [ Links ]
Ronsón-Paulín, J. á. 1999. Análisis retrospectivo y posibles causas de mareas rojas tóxicas en el litoral del sureste mexicano (Guerrero, Oaxaca, Chiapas). Ciencia y Mar. Universidad del Mar9: 49-55. [ Links ]
Sáldate-Castañeda, O., J. L. Vázquez-Castellanos, J. Galván, á. Sánchez-Anguiano & A. Nazar. 1991. Intoxicaciones por toxina paralizante de molusco en Oaxaca. Salud Pública en México 33: 240-247. [ Links ]
Schnetzer, Á., P. E. Miller, R. á. Schaffner, B. Stauffer, B. Jones, S. B. Weisberg, P. M. DiGiacomo, W. Berelson & D. A. Caron. 2007. Blooms of Pseudo-nitzschia and domoic acid in the San Pedro Channel and Los Angeles harbor areas of the Southern California Bight, 2003-2004. Harmful Algae 6, 372-387. [ Links ]
Schwoerbel, J. 1975. Métodos de hidrobiología. Hermann Blume (Ed.)., Madrid, España. 262 p. [ Links ]
Secretaría de Salud de Veracruz. 2007. Programa florecimiento de algas nocivas. http://sesver.ssaver.gob.mx/portal/page?_pageid=693,1&_dad=portal&_schema=PORTAL (consultado el 20 de junio, 2011). [ Links ]
Sekiguchi, K., S. Sato, T. Ogata, S. Kaga & M. Kodama. 2001. Accumulation and depuration kinetics of paralytic shellfish toxins in the scallop Patinopecten yessoensis fed Alexandrium tamarense. Marine Ecology Progress Series 220: 213-218. [ Links ]
SEMARNAP-PROFEPA. 1997. Mortandad de mamíferos marinos cuyos cadáveres arribaron a las costas de Sinaloa. Informe Técnico. México. [ Links ]
Sengco, R. M. 2001a. The aggregation of clay minerals and marine microalgal cell: physicochemical theory and implications for controlling harmful algal blooms. Doctor of Philosophy Thesis, Massachusetts Institute of Technology and Woods Hole Oceanographic Institution, E.U. 237p. [ Links ]
Sengco, R. M., Á. Li, K. Tugend, D. Kulis & D. M. Anderson. 2001b. Removal of red- and brown- tide cells using clay flocculation. I. Laboratory culture experiments with Gymnodinium breve and Aureococcus anophagefferens. Marine Ecology Progress Series 210: 41-53. [ Links ]
Sengco, R. M. & D. M. Anderson. 2004. Controlling Harmful Algal Blooms through clay flocculation. Journal Eukaryotic Microbiology 51(2): 169-172. [ Links ]
Sengco, R. M., J. Á. Hagstrom, E. Granéli & D. M. Anderson. 2005. Removal of Prymnesium parvum (Haptophyceae) and its toxins using clay minerals. Harmful Algae 4: 261-274. [ Links ]
Sierra-Beltrán, Á. P., M. L. Morquecho-Escamilla, C. Lechuga-Devéze & J. L. Ochoa. 1996. PSP monitoring programa at Baja California Sur, Mexico. In: Yasumoto, T., Y. Oshima & Y. Fukuyo (Eds.). Harmful and toxic Algal Blooms. IOC-UNESCO, París, pp. 105-108. [ Links ]
Sierra-Beltrán, Á. P., M. Palafox-Uribe, J. Grajales-Montiel, Á. Cruz-Villacorta & J. L. Ochoa. 1997. Sea bird mortality at Cabo San Lucas, Mexico: evidence that toxic Pseudonitzschia sp. is spreading. Toxicon 35: 447-453. [ Links ]
Sierra-Beltrán, Á., Á. Cruz, E. Núñez-Vázquez, L. M. Del Villar, J. Cerecero & J. L. Ochoa. 1998. An overview of the marine food poisoning in Mexico. Toxicon 36 (11): 1493-1502. [ Links ]
Sierra-Beltrán, Á., J. L. Ochoa, S. E. Lluch-Cota, Á. Cruz-Villacorta, R. Rosiles, M. López-Valenzuela, L. M. Del Villar-Ponce & J. Cerecero-Gutiérrez. 1999. Pseudonitzschia australis (Frenguelli), responsable de la mortandad de aves y mamíferos marinos en el Alto Golfo de California, México. In: Tresierra-Aguilar, A. E. & Z. G. Culquichicón-Malpica (Eds.). VIII Congreso Latinoamericano en Ciencias del Mar. Trujillo, Perú, pp. 886-887. [ Links ]
Sierra-Beltrán, Á., R. Cortés-Altamirano, J. P. Gallo-Reynoso, S. Licea & J. Egido-Villareal. 2005a. Is Pseudo-nitzschia pseudodelicatissima toxin the principal cause of sardines, dolphins, sea lions and pelicans mortality in 2004 in Mexico. Harmful Algae News, IOC Newsletter on toxic algae and algal blooms 29: 6-8. [ Links ]
Sierra-Beltrán, Á. P., R. Cortés-Altamirano & M. C. Cortés-Lara. 2005b. Occurences of Prorocentrum minimum (Pavillard) in Mexico. Harmful Algae 4 (3): 507-517. [ Links ]
Sirenko, L. Á. & T. V. Parshykova. 2008. Biochemical method for quantitative estimation of cyanobacteria toxins. In: Evangelista, V., L. Barsanti, A. M. Frassanito, V. Passarelli & P. Gualtieri (Eds.). Algal toxins:nature, ocurrence, effect and detection, pp. 235-245. [ Links ]
Sistema de Observación de Florecimientos de Algas Nocivas. 2011. Disponible en línea en http://habsos.noaa.gov (consultado el 20 de junio, 2011). [ Links ]
Smayda, T. J. 1997. What is a bloom? A commentary. Limnology Oceanography 42. 1132-1136. [ Links ]
Smayda, T. J. & C. S. Reynolds. 2001. Community assembly in marine phytoplankton: application of recent models to harmful dinoflagellate blooms. Journal of Plankton Research 23 (5): 447-461. [ Links ]
Sotomayor-Navarro, O. 1994. Desarrollo de la marea roja tóxica producida por Pyrodinium bahamense var. compressum en el Golfo de Tehuantepec México. 1989-1990. Comp. Oceanog. Golfo de Tehunatepec. EIO. SC. DGON SM: 087-113. [ Links ]
Sotomayor-Navarro, O. & E. Domínguez-Cuellar. 1993. Toxic red tide of Pyrodinium bahamense var. compressum, in the Tehuantepec Gulf, and the Central American Pacific System. In: Sixth International Conference on Toxic Marine Phytoplankton, Nantes, Francia, p. 185. [ Links ]
Steller, D. L., R. Riosmena-Rodríguez, M. S. Foster & L. Á. Roberts. 2003. Rhodolith bed diversity in the Gulf of California: the importance of rhodolith structure and consequences of disturbance. Aquatic Conservation: Marine and Freshwater Ecosystems 13: 5-20. [ Links ]
Stholer, R. 1959. The red tide of 1958 at Ensenada, Baja California, Mexico. Weliger 2:32-35 [ Links ]
Sullivan, J. J., M. M. Wekell & L. L. Kentala. 1985. Application of HPLC for the determination of PSP toxins in shellfish. Journal of Food Science 50: 26-29. [ Links ]
Sutherland, T. F., C. Leonard & F. J. R. Taylor. 1992. A segmented pipe sampler for integrated profiling of the upper water column. Journal of Plankton Research 14: 915-923. [ Links ]
Suzuki, T., R. Yoshizawa, T. Kawamura & M. Yamasaki. 1996. Interference of Free Fatty Acids from te Hepatopancreas of Mussels with the Mouse Bioassay for Shellfish Toxins. Lipids 31 (6): 641-645. [ Links ]
Tanaka, K., Y. Muto & M. Chimada, 1994. Generation of superoxide anion radicals by the marine phytoplankton organism Chattonella antiqua. Journal of Plankton Research 16: 161-169. [ Links ]
Terán-Suárez, J. M., G. V. Castro, H. F. Mayor-Nucamendi & J. A. Brito-López. 2006. Florecimientos Algales en Tabasco. Salud en Tabasco 12 (1): 414-422. [ Links ]
Tiffany, M. Á., S. B. Barlow, V. E. Matey & S. H. Hulbert, 2001. Chattonella marina (Raphidophyceae), a potentially toxic alga in the Salton Sea, California. Hydrobiología 466: 187-194. [ Links ]
Trocoli-Ghinaglia, L. & J. A. Herrera-Silviera. 1999. Fitoplancton e hidrografía en una zona costera con descargas de agua subterránea. X Reunión Nacional de la Sociedad Mexicana de Planctología, A. C. y III Reunión Internacional de Planctología. 28-30 de abril, Mazatlán, Sin., México. p 18. [ Links ]
Trocoli-Ghinaglia, L., J. Herrera-Silveira & F. Comín. 2004. Structural variations of phytoplankton in the coastal seas of Yucatán, Mexico. Hydrobiologia 519 (1-3): 85-102. [ Links ]
Turrubiates- Morales, J. R. 1994. Registro de Gymnodinium sanguineum Hirasaka 1922, en la marea roja observada en Bahía Tortugas, B. C. S. durante abril-agosto de 1991. In: Siqueiros-Beltrones, D. (Ed.). IX Simposium Internacional de Biología Marina. La Paz, B. C. S., México, pp. 81-85. [ Links ]
Twiner, M. C. & C. G. Trick, 2000. Possible physiological mechanisms for production of hydrogen peroxide by the ichthyotoxic flagellate Heterosigma akashiwo. Journal of Plankton Research 22: 1961-1975. [ Links ]
Vale, P. 2008a. Fate of benzoate paralytic shellfish toxins from Gymnodinium catenatum in shellfish and fish detected by precolumn oxidation and liquid chromatography with fluorescence detection. Journal of Chromatography A 1190: 191-197. [ Links ]
Vale, P. 2008b. Complex profiles of hydrophobic paralytic shellfish poisoning compounds in Gymnodinium catenatum identified by liquid chromatography with fluorescence detection and mass spectrometry. Journal of Chromatography A 1195: 85-93. [ Links ]
Vale, P. & M. A. Sampayo. 2001. Domoic acid in Portuguese shellfish and fish. Toxicon 39: 893-904. [ Links ]
Vale, P. & H. Taleb. 2005. Assessment of the quantitative determination of paralytic shellfish poisoning toxins by pre-column derivatization and elimination of interfering compounds by solid-phase extraction. Food Additives and Contaminants. 22(9): 838-846. [ Links ]
Vale, P., I. Rangel, B. Silva, P. Coelho & A. Vilar. 2009. Atypical profiles of paralytic shellfish poisoning toxins in shellfish from Luanda and Mussulo bays, Angola. Toxicon 53: 176-183. [ Links ]
Vale, P. & Sampayo M. 2002. Evaluation of marine biotoxin's accumulation by Acanthocardia tuberculatum from Algarve, Portugal. Toxicon, 40: 511-517 [ Links ]
Van Egmond, H. P, M. E. Van Apeldoorn & G. J. Á. Speijers. 2004. Marine Biotoxins FAO Food and Nutrition Papers 80, 295 pp. [ Links ]
Villarreal, T. Á., S. Hanson, S. Qualia, E. L. E. Jester, H. R. Granade & R. W. Dickey. 2007. Petroleum production plataforms as sites for the expansion of ciguatera in the northwestern Gulf of Mexico. Harmful Algae 6: 253-259. [ Links ]
Wiese, M., P. M. D'Agostino, T. K., Mihali, M. C. Moffitt, & B. A. Neilan. 2010. Neurotoxic Alkaloids: Saxitoxin and Its Analogs. Marine Drugs. 8: 2185-2211. [ Links ]
Williams, R. J., F. B. Griffiths, E. J. Van der Wal & J. Kelly. 1988. Cargo vessel ballast water as a vector for the transport of non-indigenous marine species. Estuarine Coast Shelf Science 26: 409-420. [ Links ]
Yasumoto, T., M. Murata, Y. Ishibashi, M. Fukui & A. M. Legrand. 1992. Structure determination of ciguatoxin of Moray Eels and Gambierdiscus toxicus. In: Tosteson, T.R. (Ed.). 3rd International Conference on Ciguatera Fish Poisoning. Puerto Rico, 1990. Polyscience Publications, Quebec, Canadá, pp. 3-12. [ Links ]
Yasumoto, T. & M. Murata. 1993. Marine toxins. Chem. Rev. 93: 1897-1909. [ Links ]
Yu, R. C., C. Hummert, B. Luckas, P. Y. Qian & M. J. Zhou. 1998. Modified HPLC method for analysis of PSP toxins in algae and shellfish from China. Chromatographia 48: 671-676. [ Links ]
Yu, Z, M. R. Sengco & D. M. Anderson. 2004. Flocculation and removal of the brown tide organism, Aureococcus anophagefferens (Chrysophyceae), using clays. Journal of Applied Phycology 16: 101-110. [ Links ]
Zenetos, Á., M. Á. Pancucci-Papadopulus, S. Zogaris, E. Papastergiadou, L. Vardakas, K. Aligizaki & A. N. Economou. 2009. Aquatic alien species in Greece (2009): tracking source, patterns and effects on the ecosystem. Journal of Biological Research-Thessaloniki 12: 135-172. [ Links ]
Zepeda-Esquivel, M. Á., M. I. Resendíz-Flores & L. Á. Morales-Zamorano. 2007. Identificación de Ostreopsis sp. en la columna de agua de Bahía Azufre en la Isla Clarión. II Taller sobre Florecimientos Algales Nocivos, 21-23 de noviembre, Ensenada, B. C. p 11. [ Links ]
Zhang, F. & M. Dickman. 1999. Mid-Ocean Exchange of container vessel ballast water. 1: Seasonal factors affecting the transport of harmful diatoms and dinoflagellates. Marine Ecology Progress Series 176: 243-251. [ Links ]
Zou, H., G. Pan, H. Chen & X. Yuan. 2006. Removal of cyanobacterial blooms in Taihu Lake using local soil. II. Effective removal of Microcystis aeruginosa using local soil and sediments modified by chitosan. Environmental Pollution 141: 201-205. [ Links ]














