Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.21 no.3 Ciudad de México sep./dic. 2011
Estructura de la comunidad de peces estuarinos en un hábitat con vegetación sumergida: variación estacional y nictémera
Estuarine fish community structure in a submerged aquatic vegetation habitat: seasonal and diel variations
Manuel Castillo-Rivera, Selene Ortiz-Burgos y Rocío Zárate-Hernández
Laboratorio de Peces, Departamento de Biología, Universidad Autónoma Metropolitana, Unidad Iztapalapa. Avenida San Rafael Atlixco 186, Colonia Vicentina. México, D.F. 09340. México. e-mail: crma@xanum.uam.mx
Recibido: 07 de julio de 2011.
Aceptado: 14 de noviembre de 2011.
RESUMEN
Con el propósito de analizar las variaciones temporales en la comunidad de peces de un ambiente con vegetación sumergida, se realizaron seis ciclos nictémeros en un año (1989-1990) usando una red chinchorro. En total se recolectaron 17,105 individuos correspondientes a 66 especies. La riqueza y diversidad de especies difirieron significativamente entre meses y su variación estacional estuvo relacionada con la temperatura y la salinidad. En la escala nictémera, no existieron diferencias significativas en los valores de riqueza, diversidad y equidad obtenidos, entre la noche y el día. El análisis de escalamiento multidimensional mostró que las variaciones en las recolectas estuvieron relacionadas principalmente con las variaciones en el tiempo, existiendo cambios significativos (evidenciados por un análisis de varianza múltiple) en la composición de especies entre meses. Aunque existió una clara dominancia de Anchoa mitchilli durante todo el año, los cambios estacionales en la estructura de la comunidad se debieron a la sucesión cíclica en la abundancia de otras especies, determinada en primer grado por sus tolerancias fisiológicas y en segundo grado por patrones de alimentación. A pesar de que la comunidad no mostró diferencias significativas en su composición entre el día y la noche, los análisis de conglomerados demostraron que en ciertos meses existió una tendencia a separar las colectas diurnas de las nocturnas, asociadas cada una alternativamente a las realizadas en horas crepusculares, con una mayor captura de especies pelágicas-planctófagas durante el día y bentónicas-depredadoras en la noche, mientras que las más abundantes mostraron un comportamiento crepuscular. Así, los cambios estacionales en la comunidad están principalmente relacionados con las condiciones físico-químicas, mientras que a nivel nictémero, existe sólo una ligera influencia del ciclo de luz/oscuridad.
Palabras clave: Ruppia marítima, equidad, especies dominantes, ciclo luz/oscuridad, alimentación.
ABSTRACT
In order to analyze the temporal variations of an estuarine fish community in a submerged aquatic vegetation habitat, we completed six bimonthly 24 h sampling cycles (using a seine net) over a 1-year period (1989-1990). A total of 17,105 individuals, corresponding to 66 fish species were captured. Species richness and diversity showed significant differ-ences among months and its seasonal variation was mainly related to temperature and salinity. At diel scale, richness was higher at night and diversity during the day, although these parameters showed no significant differences between these two periods. A non-metric multidimensional scaling showed that the ordination of the samples was mainly related to seasonal variation, which showed significant differences in species composition between months (MANOVA). Despite a wide dominance of Anchoa mitchilli throughout the year, seasonal changes in species composition were due to the cyclical succession of populations of other species, primarily determined by their physiological tolerances and secondly, by feeding patterns. Although there were no significant changes between day and night in overall species abundance, cluster analyses showed that coincidentally in months with lower nocturnal light (new moon and first quarter), diurnal and nocturnal samples were clearly segregated, and associated alternatively with samples of twilight hours. During daytime, pelagic-planktophagous species were abundant and benthic-predatory ones in the night, whereas the most abundant species showed a twilight pattern of activity. So, seasonal changes in fish community are mainly related to physicochemical conditions, whereas diel variation was slightly related to the light/darkness cycle.
Key words: Ruppia marítima; evenness; dominant species; light/darkness cycle; feeding patterns.
INTRODUCCIÓN
Los estuarios se caracterizan por una alta variabilidad temporal en las condiciones ambientales, lo que puede promover cambios importantes en la estructura de las comunidades de peces que las habitan (Moyle & Cech, 2004). La variación temporal en estas comunidades presenta dos escalas principales: las que ocurren a lo largo de un año y las que tienen duración de un solo día (nictémera). En relación con la variación estacional, se ha observado que la abundancia, la riqueza de especies y la diversidad, se encuentran asociadas a las oscilaciones estacionales de las condiciones ambientales, principalmente temperatura y salinidad (Lubbers et al., 1990; Methven et al., 2001; Castillo-Rivera et al., 2002; Akin et al., 2003; Jung & Houde, 2003; Hoeksema & Potter, 2006; Barreiros et al., 2009). Similarmente, la variabilidad estacional en la composición de especies también se encuentra afectada por estos factores (Tsou & Matheson, 2002; Jung & Houde, 2003; Barletta et al., 2005; Vasconcellos et al., 2010), ya que la reproducción, desove y reclutamiento de las diferentes especies pueden suceder en distintos tiempos (de acuerdo con sus tolerancias fisiológicas), lo que deriva en una sucesión estacional en sus poblaciones (Methven et al., 2001; Hagan & Able, 2003; Martino & Able, 2003; Hoeksema & Potter, 2006; Ribeiro et al., 2006).
A nivel nictémero, se ha observado que en comunidades de peces estuarinos, la abundancia y riqueza de especies tienden a ser mayores durante la noche, lo cual se ha relacionado con la capacidad de los peces para evadir las redes durante las horas luz (Morrison et al., 2002; Jelbart et al., 2007), con patrones de alimentación y/o con estrategias de evasión de la depredación (Lubbers et al., 1990; Nagelkerken et al., 2000; Griffiths, 2001b; Hoeksema & Potter, 2006; Hagan & Able, 2008). Asimismo, se han observado cambios significativos en la composición de especies entre el día y la noche, los cuales también se han relacionado con el ciclo luz/oscuridad (Pessanha & Araújo, 2003; Castillo-Rivera et al., 2010) y con el estado de la marea (Morrison et al., 2002; Ribeiro et al., 2006).
La presencia de vegetación sumergida también juega un papel importante en la estructuración de las comunidades estuarinas, observándose que en estos ambientes existe mayor abundancia y riqueza de especies (Wyda et al., 2002; Kanouse et al., 2006). Lo anterior, principalmente debido a que por su mayor complejidad estructural y productividad, proveen protección y refugio contra depredadores, además de ofrecer una mayor disponibilidad y diversidad de alimento (Lubbers et al., 1990; Nagelkerken et al., 2000; Ribeiro et al., 2006).
En este contexto, el objetivo del presente estudio fue analizar las variaciones temporales en la estructura de la comunidad de peces, en un hábitat con vegetación sumergida, bajo la hipótesis de que la variación de las condiciones ambientales a lo largo del año, puede tener influencia sobre los requerimientos y tolerancias fisiológicas de las especies, y en consecuencia, afectar la estructura de la comunidad. Asimismo, considerando que en esta laguna la marea tiene poca amplitud (menos de 15 cm) y que el efecto de evasión del arte de pesca es reducido en aguas de alta turbidez (Castillo-Rivera et al., 2010), también se consideró la hipótesis que las variaciones nictémeras están principalmente relacionadas con el ciclo luz/oscuridad.
MATERIALES Y MÉTODOS
Área de estudio. La laguna de Pueblo Viejo se ubica al norte del estado de Veracruz, en el límite con el estado de Tamaulipas (2205'-2213' N y 9750'-98 00' O), con una superficie aproximada de 89 km2 (Fig. 1). Es un sistema somero (profundidad promedio de 1.31 m) y en general presenta una condición mesohalina (salinidad promedio 13) (Castillo-Rivera et al., 2002). En la parte sur, la laguna presenta un hábitat homogéneo caracterizado por parches de pastos (Ruppia maritima Linnaeus).

Método de muestreo. Durante un año (1989-1990), cada dos meses se realizaron ciclos de 24 horas tomando muestras cada dos horas, en una localidad que tipifica el hábitat con vegetación sumergida de la laguna, realizándose en total 72 muestreos. Los peces fueron capturados por medio de un chinchorro playero de 30 m de largo con una profundidad de 1 m y luz de malla de 1 cm, cubriéndose un área de arrastre aproximada de 1,500 m2. La salinidad, temperatura y oxígeno disuelto fueron evaluados simultáneamente en cada muestreo. Adicionalmente, en cada ciclo se evaluó la cobertura total de pastos (m2), a través de transectos (cada dos metros) perpendiculares a la línea de costa.
Parámetros de la comunidad y abundancia relativa de las especies. Para caracterizar la estructura de la comunidad, se evaluó la riqueza, diversidad y equidad de especies. La riqueza fue considerada como el número total de especies registradas en cada muestreo y la diversidad fue evaluada por medio del índice no-sesgado de Simpson (1-D). Para evaluar la equidad se utilizó el  , que tiene la ventaja de ser menos dependiente de la riqueza de especies (Smith & Wilson, 1996; Magurran, 2004). Adicionalmente, para cada mes de colecta, se estimó la abundacia relativa de cada especie (porcentaje del número de individuos de cada especie entre el número total de individuos de todas las especies).
, que tiene la ventaja de ser menos dependiente de la riqueza de especies (Smith & Wilson, 1996; Magurran, 2004). Adicionalmente, para cada mes de colecta, se estimó la abundacia relativa de cada especie (porcentaje del número de individuos de cada especie entre el número total de individuos de todas las especies).
Análisis bioestadístico. Para evaluar diferencias significativas en el comportamiento estacional y nictémero de las variables ambientales, y de los parámetros de la comunidad, se aplicaron análisis de varianza de una vía (F), cuando se cumplían los supuestos subyacentes a este análisis. Cuando no se cumplieron aún después de trasformaciones matemáticas, fueron empleadas pruebas de Kruskal-Wallis (H). Para evaluar la asociación entre variables se utilizó el coeficiente de correlación no-paramétrica de Spearman (rs), debido a que invariablemente existieron violaciones de al menos uno de los supuestos de las correlaciones paramétricas.
Con el fin de analizar los cambios en la composición de especies, inicialmente se calculó una matriz de distancias con base en el índice de Bray-Curtis, sobre las abundancias de todas las especies. Posteriormente se aplicó un análisis de escalamiento multidimensional no-métrico (EMDNM), considerando los 72 muestreos, para representar gráficamente la posible formación de ensambles de peces, asociados a la variación temporal de las condiciones ambientales. A partir de la matriz de Bray-Curtis, para cada uno de los seis ciclos nictémeros, se realizaron análisis de conglomerados (AC) con la técnica de fusión UPGMA, para describir el patrón nictémero de similitud en especies. Finalmente, a la matriz de abundancia de todas las especies se le aplicaron análisis de varianza múltiple de una vía (ANDEVAM), utilizando la lambda de Wilks (λ) como criterio para evaluar diferencias significativas en la composición de especies tanto entre meses, como entre día y noche. Esto permite interpretar los cambios en la estructura de la comunidad, no solo en términos de presencia ausencia de las especies, sino también en términos de la abundancia relativa de las mismas. En todos los análisis multivariados, se utilizó la raíz cuadrada  de la abundancia de las especies, como sugieren Gotelli y Ellison (2004), para este tipo de variable.
de la abundancia de las especies, como sugieren Gotelli y Ellison (2004), para este tipo de variable.
RESULTADOS
Variables ambientales. A partir de los 72 muestreos realizados, se observó que los promedios mensuales de la temperatura (Fig. 2a) y oxígeno disuelto mostraron diferencias significativas (H = 55.689, g.l. = 5, p < 0.001; H = 31.142, g.l. = 5, p < 0.001; respectivamente), existiendo una correlación significativa inversa entre estos promedios (rs = -0.943; n = 6; p = 0.005). La salinidad (Fig. 2b) también mostró diferencias significativas entre meses (H = 67.246; g.l. = 5; p < 0.001), mientras que la cobertura de los pastos alcanzó un máximo durante mayo y mínimos durante julio-septiembre (Fig. 2c). A nivel nictémero, la temperatura, salinidad y oxígeno disuelto alcanzaron sus valores más altos a las 14:00 h (Fig. 3a-c), descendiendo progresivamente hasta alcanzar los valores más bajos durante las horas nocturnas. Sin embargo, solo el oxígeno disuelto fue significativamente mayor durante el día que en la noche (H = 5.067; g.l. = 1; p = 0.024).


Parámetros de la comunidad. En los 72 muestreos se colectaron un total de 17,105 individuos correspondientes a 66 especies de peces (Tabla 1). Los promedios mensuales de la riqueza mostraron diferencias significativas entre meses (F = 35.548; g.l. = 5/66; p < 0.001), con un pulso en julio y los valores bajos de septiembre a noviembre (Fig. 2a). Similarmente, los valores mensuales de la diversidad mostraron diferencias significativas (H = 34.949; g.l. = 5; p < 0.001), presentando el valor más bajo en el mes de septiembre y los más altos durante mayo-julio (Fig. 2b). La equidad no mostró diferencias significativas entre meses (p = 0.08), pero los promedios mensuales de este parámetro se correlacionaron con la cobertura de pastos (Fig. 2c; rs = 0.886; n = 6; p = 0.019). A nivel nictémero, los parámetros de la comunidad no mostraron diferencias significativas entre los promedios diurnos y nocturnos (p's > 0.41; Fig. 4a-c).


En relación con la influencia de las variables ambientales sobre los parámetros de la comunidad, la temperatura se correlacionó significativamente de forma directa con la riqueza (Fig. 2a; rs = 0.360; n = 72; p = 0.002) y la diversidad (rs = 0.329; n = 72; p = 0.005). Similarmente, la salinidad mostró correlaciones significativas directas con la riqueza (rs = 0.337; n = 72; p = 0.004), diversidad (Fig. 2b; rs = 0.504; n = 72; p < 0.001) y equidad (rs = 0.329; n = 72; p = 0.005).
Composición de especies. Los resultados del EMDNM mostraron una ordenación de los datos relacionada con la variabilidad estacional en la estructura de la comunidad de peces (Fig. 5). Así, los conjuntos de especies tendieron a agruparse por mes, siendo la composición de especies durante mayo y julio las que mostraron una mejor separación. Durante marzo, una colecta (12:00 h) se relacionó más con las muestras de enero, mientras que dos de enero (10:00 y 14:00 h) se agruparon con las de marzo. En el mes de noviembre, las muestras colectadas durante el día (08:00 a 16:00 h) se separaron claramente, pero las nocturnas (20:00 a 04:00 h) se mezclaron con las muestras de septiembre. De acuerdo con el ANDEVAM, entre los meses existieron diferencias significativas en la composición de especies (X < 0.001; p = 0.002).
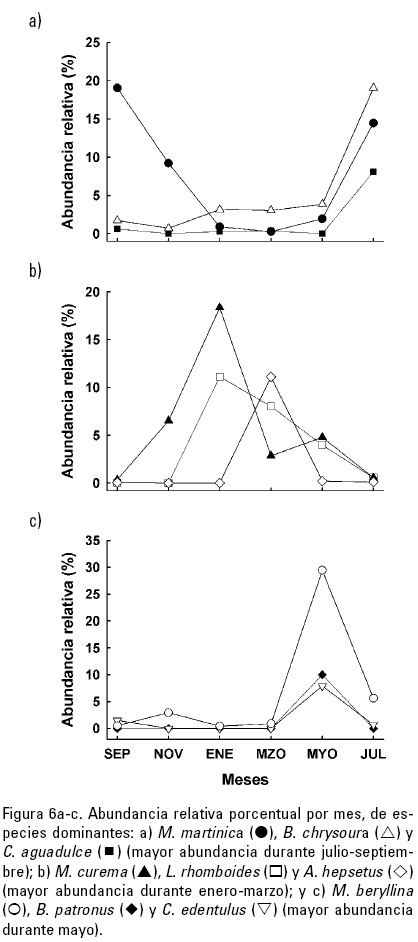
El ensamble de peces correspondiente a septiembre estuvo dominado en orden de abundancia por Anchoa mitchilli, Membras martinica, Bairdiella chrysoura y Cathorops aguadulce, mientras que en noviembre permanecieron como especies dominantes solo A. mitchilli y M. martinica. En el mes de enero dominaron A. mitchilli, Mugil curema, Ctenogobius boleosoma y Lagodon rhomboides, mientras que en marzo las especies más abundantes fueron A. mitchilli, A. hepsetus, Orthopristis chrysoptera, L. rhomboides, Archosargus probatocephalus, C. boleosoma y M. curema. En mayo hubo un cambio importante en la composición de especies, siendo las dominantes Menidia beryllina, A. mitchilli, Brevoortia patronus y Cetengraulis edentulus. Finalmente en julio, también hubo un cambio importante en la composición de especies con respecto a mayo, siendo las especies dominantes A. mitchilli, B. chrysoura, M. martinica y C. aguadulce. El comportamiento mensual de la abundancia relativa (%) de especies dominantes se muestra en la figura 6a-c.
En la ordenación vía EMDNM también se observó cierta separación entre las muestras del día y la noche, en los ciclos de noviembre, enero y mayo (Fig. 5). En noviembre y enero, las colectas diurnas quedaron separadas de las colectas crepusculares y nocturnas, mientras que en mayo las colectas nocturnas quedaron separadas del resto.
En este sentido, los resultados del AC mostraron que en noviembre (Fig. 7b) se separaron dos grandes grupos, el primero de ellos se formó con las colectas diurnas, mientras que el segundo se formó con las colectas nocturnas y crepusculares. En enero (Fig. 7c), aunque de manera menos conspicua, las colectas nocturnas y del amanecer (06:00 h) se separaron de las del día y anochecer (18:00 h). En mayo (Fig. 7e), la colecta de las 14:00 h se separó de las demás, las cuales a su vez formaron dos grupos, uno de ellos concentró las capturas diurnas y crepusculares, mientras que el otro concentró las colectas nocturnas. En los ciclos nictémeros septiembre (Fig. 7a), marzo (Fig. 7d) y julio (Fig. 7f), los diferentes grupos formados por los AC, muestran mezclas de las colectas realizadas durante el día, con las realizadas durante la noche y horas crepusculares.
No obstante, la separación de las muestras diurnas de las nocturnas observada en los AC de noviembre, enero y mayo, un ANDEVAM considerando todos los meses en conjunto, demostró que la composición de especies entre el día y la noche no presenta diferencias significativas (X = 0.081; p = 0.534). A pesar de esta falta de diferencias, algunas especies mostraron un patrón nictémero regular. Así, M. beryllina y B. patronus presentaron un patrón de captura preferentemente diurno, mientras Opsanus beta y C. aguadulce fueron principalmente capturadas durante la noche. La especie A. mitchilli presentó un patrón nocturno-crepuscular, mientras que M. martinica mostró un patrón preferentemente crepuscular-diurno.
DISCUSIÓN
Variables ambientales. Los factores ambientales mostraron una variación significativa a lo largo del año. Así, el comportamiento mensual de la temperatura siguió el patrón regional del área de estudio (García, 1988; Castillo-Rivera et al., 2002) y en general, el patrón de variación estacional que se ha observado en los estuarios del golfo de México y del Atlántico noroeste (Lubbers et al., 1990; Methven et al., 2001; Tsou & Matheson, 2002; Hagan & Able, 2003). Este comportamiento estacional de la temperatura y su relación inversa con el oxígeno disuelto, también es un patrón relativamente común en otros ecosistemas costeros como el estuario de Mad Island en Texas (Akin et al., 2003), cayos de Florida (Acosta et al., 2007) y en la bahía de Chesapeake (Jung & Houde, 2003). Por su parte, la salinidad siguió el comportamiento inverso al régimen de precipitación local (García, 1988; Castillo-Rivera et al., 2002). Por el contrario, a nivel nictémero la temperatura y salinidad tendieron a permanecer estables a lo largo del día (sin diferencias significativas), mientras que el oxígeno disuelto fue la única variable que mostró diferencias entre el día y la noche, asumiendo que esto se debe a la actividad fotosintética de las plantas (Hunding, 1973). En este sentido, las variables ambientales tendieron a mostrar diferencias entre meses, mientras que entre el día y la noche, estas diferencias fueron menos comunes.
Parámetros de la comunidad. El patrón estacional de la riqueza y diversidad de especies encontrado en el presente estudio, con pulsos en verano y valores bajos en invierno, es un patrón constante en muchas comunidades de peces templadas y tropicales (Tsou & Matheson, 2002; Hagan & Able, 2003; Pessanha et al., 2003; Hoeksema & Potter, 2006). En un amplio contexto, la estacionalidad en la diversidad de peces y su relación con la variabilidad mensual de la temperatura, ha sido ampliamente documentada en estudios previos, encontrándose correlaciones significativas entre éstas (Layman, 2000; Methven et al., 2001; Jung & Houde, 2003; Barreiros et al., 2004), el cual en la laguna de Pueblo Viejo, puede ser constante a través de los años (Castillo-Rivera et al., 2002).
La salinidad también ha sido señalada como un factor importante en la determinación del comportamiento estacional de la diversidad (Jung & Houde, 2003; Barreiros et al., 2004), lo cual también se pudo observar en el presente estudio, donde la diversidad y la riqueza, se correlacionaron significativamente con la salinidad, atribuyéndose a migraciones por las tolerancias fisiológicas de diferentes especies. No obstante, en algunos estuarios se ha encontrado una fuerte oscilación estacional en la equidad (Layman, 2000; Tsou & Matheson, 2002; Barreiros et al., 2004), en el hábitat con vegetación sumergida de la laguna de Pueblo Viejo la equidad fue relativamente estable a lo largo del año (sin diferencias significativas entre meses). Esto implica que los cambios significativos entre meses en la diversidad, podrían estar determinados por los cambios estacionales en el número de especies (la riqueza también con diferencias significativas entre meses), más que por la homogeneidad con la que se distribuyen mensual-mente cada una de las abundancias de las especies.
A nivel nictémero, en el presente estudio la riqueza, diversidad y equidad, no mostraron diferencias significativas entre el día y la noche, lo cual podría deberse en parte, a la relativa estabilidad ambiental entre estos períodos. Por el contrario, en ambientes sin vegetación sumergida se ha encontrado que comúnmente el número de especies capturadas durante la noche es significativamente mayor (Gibson et al., 1996; Layman, 2000; Methven et al., 2001; Morrison et al., 2002; Hoeksema & Potter, 2006; Hagan & Able, 2008; Castillo-Rivera et al., 2010). Estas diferencias podrían deberse a la presencia de vegetación sumergida, la cual al proveer refugio y protección contra depredadores (Lubbers et al., 1990; Ribeiro et al., 2006), permitiría a las especies nocturnas extender su actividad. Similarmente a lo sucedido con los factores ambientales, los parámetros de la comunidad en la laguna de Pueblo Viejo variaron significativamente entre meses, mientras que su respectiva variabilidad nictémera fue menos conspicua.
Composición de especies. La comunidad de peces estuvo dominada por A. mitchilli, la cual fue la especie más abundante durante todos los meses (excepto en mayo). Aunque en muchos estudios, esta especie ha sido considerada como estuarino-dependiente (Akin et al., 2003; Jung & Houde, 2003; Lewis et al., 2011), debido a que desova dentro de la laguna de Pueblo Viejo (Sánchez-Ramírez & Ocaña-Luna, 2002) y a la alta abundancia que presenta dentro de este sistema (Castillo-Rivera et al., 1994), se le puede considerar estuarino-residente. No obstante lo anterior, existieron cambios estacionales significativos en la estructura de la comunidad (ANDEVAM), los cuales se debieron a una sucesión estacional en las poblaciones de otras especies, a través de sustituciones progresivas o drásticas entre meses (Fig. 6a-c).
De acuerdo con los resultados del EMDNM, las colectas realizadas en septiembre y noviembre, y las de enero y marzo, mostraron cierto grado de superposición entre sí y/o una sustitución progresiva de especies, lo cual en parte se debe a que fueron muestras cronológicamente contiguas. Un cambio sustancial en la composición de especies sucedió en mayo, mientras que en julio, aunque existió un cambio importante en la composición de especies con respecto a mayo, el patrón característico fue el mismo al observado en septiembre, dando como resultado una sucesión cíclica dentro del año estudiado, como ha sido observado en otros estuarios (Tsou & Matheson, 2002; Hoeksema & Potter, 2006).
Es común que las comunidades de peces presenten diferencias estacionales en la composición de especies. Estos cambios se dan regularmente como resultado de los desfases en los tiempos de desove, así como de las correspondientes inmigraciones y emigraciones secuenciales de las distintas especies (Akin et al., 2003; Hagan & Able, 2003; Barreiros et al., 2004; Hoeksema & Potter, 2006). Eventualmente, también han sido observados cambios en la composición, relacionados con las fluctuaciones estacionales en la disponibilidad de alimento (Pessanha et al. 2003; Madurell et al., 2004; Castillo-Rivera et al., 2010). Tanto las historias de vida de las especies, como en general, la variación en la estructura de la comunidad, son a su vez moduladas de manera importante por condiciones ambientales como la temperatura y salinidad (Methven et al., 2001; Tsou & Matheson, 2002; Hagan & Able, 2003; Jung & Houde, 2003; Pessanha & Araújo, 2003; Ribeiro et al., 2006).
En la laguna de Pueblo Viejo, los cambios estacionales en la estructura de la comunidad de peces parecen estar determinados en parte por las tolerancias fisiológicas de las especies y en menor grado por las preferencias alimentarias relacionadas con las historias de vida de las especies. En julio-septiembre, con condiciones de temperatura alta y salinidad baja, predominaron las especies con afinidad dulceacuícola (C. aguadulce) y marinas tolerantes a las bajas salinidades (B. chrysoura y M. martinica) (Fig. 6a). En enero-marzo cuando las temperaturas fueron bajas, y se incrementa la salinidad, predominaron especies que durante alguna etapa de su ciclo vital, muestran preferencia por temperaturas relativamente bajas (M. curema, L. rhomboides, A. hepsetus, A. probatocephalus y O. chrysoptera) (Fig. 6b). En mayo, cuando existen condiciones de salinidad y temperatura altas, y en el sistema se presenta un pulso de producción fitoplanctónica (De la Lanza & Cantú, 1986; Contreras, 1995), predominaron especies pelágicas fitoplanctófagas (B. patronus y C. edentulus) y zoo-planctófagas (M. beryllina) (Fig. 6c). Así, una sucesión estacional de especies puede reflejar las diferentes respuestas de éstas a las condiciones físicas ambientales (Yáñez-Arancibia et al., 1988; Akin et al., 2003).
A nivel nictémero, en muchas comunidades de peces, se ha registrado que existen cambios en las poblaciones, los cuales suceden rápida o gradualmente y coinciden con la transición entre el día y la noche, jugando un papel importante el ciclo luz/oscuridad (Pessanha & Araújo, 2003; Pessanha et al., 2003; Axenrot et al., 2004), llegándose a formar distintivos ensambles de peces entre estos períodos (Methven et al., 2001; Guest et al., 2003; Hoeksema & Potter, 2006; Jelbart et al., 2007; Kopp et al., 2007; Hagan & Able, 2008). No obstante lo anterior, en el presente estudio no se detectaron cambios significativos (ANDEVAM) en la composición de especies, lo cual también ha sido observado para un ambiente sin vegetación en la misma laguna (Castillo-Rivera et al., 2010) y en otros sistemas (Gibson et al., 1996; Layman, 2000; Griffiths, 2001b; Ribeiro et al., 2006).
En este sentido, los resultados del EMDNM y de los AC, indican que la estructura de la comunidad presenta ciertos patrones nictémeros, los cuales pueden estar definidos por la presencia-ausencia de ciertas especies o por cambios sustanciales en sus abundancias relativas (Morrison et al., 2002; Hoeksema & Potter, 2006). Estos patrones parecen estar relacionados, aunque de manera no concluyente, con el ciclo luz/oscuridad, al menos en tres de los seis ciclos nictémeros, donde también podría incidir de manera importante la fase lunar. Durante los ciclos nictémeros de noviembre, enero y mayo, se formaron ensambles de peces característicamente diurnos y nocturnos, a los cuales alternativamente estuvieron asociadas colectas hechas durante horas crepusculares. En estos ciclos los muestreos se realizaron durante luna nueva (noviembre y enero) o cuarto creciente (mayo), existiendo poca luz nocturna, lo que contribuyó a una mejor diferenciación de los ensambles de peces entre el día y la noche. Por el contrario, en marzo y julio, los muestreos se realizaron con luna llena, lo que pudo haber permitido que las poblaciones de peces típicamente diurnas extendieran un poco mas su actividad hacia la noche, generando poca diferenciación día/noche en estos ensambles.
Los ensambles de peces diurnos estuvieron caracterizados por especies pelágicas planctófagas (M. beryllina y B. patronus), mientras que los ensambles nocturnos los caracterizaron especies bentónicas depredadoras (O. beta y C. aguadulce) (Salazar, 1995; Castillo-Rivera, 2001). La mayor dominancia de planctófagos durante el día y depredadores durante la noche, ha sido señalada desde Hobson (1965). Las especies más abundantes A. mitchilli y M. martinica, presentaron un comportamiento crepuscular. En este sentido, se ha observado que una mayor actividad de los peces durante las horas de penumbra, les permite condiciones de poca luz para atenuar la depredación, pero la suficiente para detectar a las presas (Clark & Levy, 1988; Wootton, 1990). Una mayor actividad crepuscular, podría ser una ventaja adaptativa para especies que por su alta abundancia y talla pequeña, representan presas potenciales para otros peces, pero también son importantes depredadoras de zooplancton.
Así, las variaciones nictémeras en los ensambles de peces en la laguna de Pueblo Viejo, como en otras comunidades de peces (Morrison et al., 2002; Pessanha et al., 2003; Hoeksema & Potter, 2006; Ribeiro et al., 2006; Kopp et al., 2007; Hagan & Able, 2008), pueden estar asociadas a estrategias de alimentación y evasión de depredadores, las cuales podrían estar a su vez moduladas por el ciclo luz/oscuridad.
AGRADECIMIENTOS
Se agradece a la Universidad Autónoma Metropolitana, unidad Iztapalapa, por el apoyo financiero para realizar la presente investigación. Asimismo, se agradece al Dr. Isaías H. Salgado-Ugarte, a la Dra. Ana Laura Lara-Domínguez, al Dr. Xavier Chiappa-Carrara y a un revisor anónimo, sus valiosos comentarios, los cuales permitieron en gran medida mejorar la presente contribución. Por último, se agradece a la Cooperativa de Pescadores de la Laguna de Pueblo Viejo, por los permisos de recolecta de material biológico y por su valiosa asistencia en el trabajo de campo.
REFERENCIAS
Acosta, A., C. Bartels, J. Colvocoresses & M. F. D. Greenwood. 2007. Fish assemblages in seagrass habitats of the Florida Keys, Florida: spatial and temporal characteristics. Bulletin of Marine Science 81: 1-19. [ Links ]
Akin, S., K .O. Winemiller & F. P. Gelwick. 2003. Seasonal and spatial variations in fish and macrocrustacean assemblage structure in Mad Island Marsh estuary, Texas. Estuarine, Coastal and Shelf Science 57: 269-282. [ Links ]
Axenrot, T., T. Didrikas, C. Danielsson & S. Hansson. 2004. Diel patterns in pelagic fish behaviour and distribution observed from a stationary, bottom-mounted, and upward-facing transducer. ICES Journal of Marine Science 61: 1100-1104. [ Links ]
Barletta, M., A. Barletta-Bergan, U. Saint-Paul & G. Hubold. 2005. The role of salinity in structuring the fish assemblages in a tropical estuary. Journal of Fish Biology 66: 45-72. [ Links ]
Barreiros, J. P., V. Figna, M. Hostim-Silva & R. S. Santos. 2004. Seasonal changes in a sandy beach fish assemblage at Canto Grande, Santa Catarina. South Brazil. Journal of Coastal Research 20 (3): 862-870. [ Links ]
Barreiros, J. P., J. O. Branco, F. F. Júnior, L. Machado, M. Hostim-Silva & J. R. verani. 2009. Space-time distribution of the ichthyofauna from Saco da Fazenda estuary, Itajaí, Santa Catarina, Brazil. Journal of Coastal Research 25 (5): 1114-1121. [ Links ]
Castillo-Rivera, M. 2001. Biología trófica de especies de peces dominantes en ecosistemas estuarinos del Golfo de México. Tesis de Doctorado en Ciencias Biológicas, Universidad Autónoma Metropolitana, México. 192 p. [ Links ]
Castillo-Rivera, M., G. Moreno & R. Iniestra. 1994. Spatial, seasonal, and diel variation in abundance of the bay anchovy, Anchoa mitchilli (Teleostei: Engraulidae), in a tropical coastal lagoon of Mexico. The Southwestern Naturalist 39 (3): 263-268. [ Links ]
Castillo-Rivera, M., J. A. Zavala-Hurtado & R. Zarate. 2002. Exploration of spatial and temporal patterns of fish diversity and composition in a tropical estuarine system of Mexico. Reviews in Fish Biology and Fisheries 12: 167-177. [ Links ]
Castillo-Rivera, M., R. Zárate-Hernández, S. Ortiz-Burgos & J. Zavala-Hurtado. 2010. Diel and seasonal variability in the fish community structure of a mud bottom estuarine habitat in the Gulf of Mexico. Marine Ecology 31: 633-642. [ Links ]
Clark C. W. & D. A. Lew. 1988. Diel vertical migration by juvenile sockeye salmon and the antipredator window. The American Naturalist 131: 271-290. [ Links ]
Contreras E. F. 1995. Producción primaria fitoplanctónica en lagunas costeras. Revista de Investigaciones Marinas 16: 11-21. [ Links ]
De la Lanza E. G. & M. C. Cantú. 1986. Cuantificación de clorofilas y aplicación del índice de diversidad de pigmentos (D430/D665) para estimar el estado biótico de la laguna de Pueblo Viejo, Ver. Universidad y Ciencia 3: 31-42. [ Links ]
García, E. 1988. Modificaciones al sistema de clasificación climática de Köppen. 4a Ed. Instituto de Geografía. Universidad Nacional Autónoma de México. México. 217 p. [ Links ]
Gibson, R. N., L. Robb, M. T. Burrows & A. D. Ansell. 1996. Tidal, diel and longer term changes in the distribution of fishes on a Scottish sandy beach. Marine Ecology Progress Series 130:1-17. [ Links ]
Gotelli, N. J. & A. Ellison. 2004. A primer of ecological statistics. Sinauer Associates. Sunderland, Massachusetts. 510 p. [ Links ]
Griffiths. S. P. 2001a. Factors influencing fish composition in an Australian intermittently open estuary. Is stability salinity-dependent? Estuarine, Coastal and Shelf Science 52:739-751. [ Links ]
Griffiths, S. P. 2001b. Diel variation in the seagrass ichthyofaunas if three intermittently open estuaries in south-eastern Australia: implications for improving fish diversity assessments. Fisheries Management and Ecology 8: 123-140. [ Links ]
Guest M.A., R. M. Connolly & N. R. Loneragan. 2003. Seine nets and beam trawls compared by day and night for sampling fish and crustaceans in shallow seagrass habitat. Fisheries Research 64: 185-196. [ Links ]
Hagan S. M. & K. W. Able. 2003. Seasonal changes of the pelagic fish assemblage in a temperate estuary. Estuarine, Coastal and Shelf Science 56: 15-29. [ Links ]
Hagan S. M. & K. W. Able. 2008. Diel variation in the pelagic fish assemblage in a temperate estuary. Estuaries and Coasts 31: 33-42. [ Links ]
Hobson, E. S. 1965. Diurnal-nocturnal activity of some inshore fishes in the Gulf of California. Copeia 291-302. [ Links ]
Hoeksema S. D. & I. C. Potter. 2006. Diel, seasonal, regional and annual variations in the characteristics of the ichthyofauna of the upper reaches of a large Australian microtidal estuary. Estuarine, Coastal and Shelf Science 67: 503-520. [ Links ]
Hunding, C. 1973. Diel variation in oxygen production and uptake in a microbenthic littoral community of a nutrientpoor Lake. Oikos 24 (3): 352-360. [ Links ]
Jelbart, J. E., P. M. Ross & R. M. Connolly. 2007. Patterns of small fish distributions in seagrass beds in a temperate Australian estuary. Journal of the Marine Biological Association of the United Kingdom 87: 1297-1307. [ Links ]
Jung S. & Houde E.D. 2003. Spatial and temporal variabilities of pelagic fish community structure and distribution in Chesapeake Bay, USA. Estuarine, Coastal and Shelf Science 58: 335-351. [ Links ]
Kanouse S., M. K. La Peyre & J. A. Nyman. 2006. Nekton use of Ruppia marítima and non-vegetated bottom habitat types within brackish marsh ponds. Marine Ecology Progress Series 327: 61-69. [ Links ]
Kopp, D., Y. Bouchon-Navaro, M. Louis & C. Bouchon. 2007. Diel differences in the seagrass fish assemblages of a Caribbean island in relation to adjacent habitat types. Aquatic Botany 87: 31-37. [ Links ]
Layman, C. A. 2000. Fish assemblage structure of the shallow ocean surf-zone on eastern shore of Virginia Barrier Islands. Estuarine, Coastal and Shelf Science 51: 201-213. [ Links ]
Lewis, M. A., L. R. Goodman, C. A. Chancy & S.J. Jordán. 2011. Fish assem-blages in three Northwest Florida urbanized Bayous before and after two hurricanes. Journal of Coastal Research 27 (1): 35-45. [ Links ]
Lubbers, L., W. R. Boynton & W. M. Kemp. 1990. Variations in structure of estuarine fish communities in relation to abundance of submersed vascular plants. Marine Ecology Progress Series 65: 1-14. [ Links ]
Madurell, T., Cartes, J. E. & M. Labropoulou. 2004. Changes in the structure of fish assemblages in a bathyal site of the Ionian Sea (eastern Mediterranean). Fisheries Research 66: 245-260. [ Links ]
Magurran, A. E. 2004. Measuring biological diversity. Oxford: Blackwell Publishing. 256 p. [ Links ]
Martino, E. & K. W. Able. 2003. Fish assemblages across the marine to low salinity transition zone of a temperate estuary. Estuarine, Coastal and Shelf Science 56 (5-6): 967-985. [ Links ]
Methven, D. A., R. L. Haedrich & G. A. Rose. 2001. The fish assemblage of a Newfoundland estuary: diel, monthly, and annual variation. Estuarine, Coastal and Shelf Science 52:669-687. [ Links ]
Morrison, M. A., M. P. Francis, B. W. Hartill & D. M. Parkinson. 2002. Diurnal and tidal variation in the abundance of the fish fauna of a temperate tidal mudflat. Estuarine, Coastal and Shelf Science 54: 793-807. [ Links ]
Moyle P. B. & J. J. Cech. 2004. Fishes: An introduction to ichthyology, 5th ed. Prentice-Hall, New Jersey. 612 p. [ Links ]
Nagelkerken, I., M. Dorenbosch, W. C. E. Verbek, E. Cocheret de la Moriniére & G. van der Velde. 2000. Day-night shifts of fishes between shallow- water biotopes of a Caribbean bay, with emphasis on the nocturnal feeding of Haemuliadae and Lutjanidae. Marine Ecology Progress Series 194: 55-64. [ Links ]
Nelson, J. S. 2006. Fishes of the world, 4th ed. Wiley, New York. 624 p. [ Links ]
Pessanha, A. M. & F. G. Araújo. 2003. Spatial, temporal and diel variations of fish assemblages at two sandy beaches in the Sepetiba Bay, Rio de Janeiro, Brazil. Estuarine, Coastal and Shelf Science 57: 817-828. [ Links ]
Pessanha , A. L., F. G. Araújo, M. C. Costa de ázevedo & I. Dias Gomes. 2003. Diel and seasonal changes in the distribution of fish on southeast Brazil sandy beach. Marine Biology 143: 1047-1055. [ Links ]
Ribeiro, J., L. Bentes, R. Coelho, J. M. S. Gonqalves, P. G. Lino, P. Monteiro & K. Erzini. 2006. Seasonal, tidal and diurnal changes in fish assemblages in the Ria Formosa lagoon (Portugal). Estuarine, Coastal and Shelf Science 67: 461-474. [ Links ]
Salazar, M. L. 1995. Biología y ecología de la familia Atherinidae (Osteichthyes) de la laguna de Pueblo Viejo, Veracruz. Tesis de Licenciatura en Biología, Facultad de Estudios Superiores-Zaragoza, UNAM. 79 p. [ Links ]
Sánchez-Ramírez, M. & A. Ocaña-Luna. 2002. Temporal variability in the abundance of the bay anchovy Anchoa mitchilli (Valenciennes, 1848) eggs and spawning biomass in Pueblo Viejo Lagoon, Veracruz, Mexico. Hidrobiológica 12 (2):157-162. [ Links ]
Smith, B. & J. B. Wilson. 1996. A consumer's guide to evenness indices. Oikos 76:70-82. [ Links ]
Tsou, T. S. & R. E. Matheson, Jr. 2002. Seasonal changes in the nekton community of the Suwannee River estuary and the potential impacts of freshwater withdrawal. Estuaries 25 (6B): 1372-1381. [ Links ]
Vasconcellos, R. M., F. G. Araújo, J. N. S. Santos & M. A. Silva. 2010. Short-term dynamics in fish assemblage structure on a sheltered sandy beach in Guanabara Bay, Southeastern Brazil. Marine Ecology 31: 506-519. [ Links ]
Wootton, R.J. 1990. Ecology of teleost fishes. Chapman and Hall, London. 404 p. [ Links ]
Wyda, J. C., L. A. Deegan, J. E. Hughes & M. J. Weaver. 2002. The response of fishes to submerged aquatic vegetation complexity in two ecoregions of the mid-Atlantic bight: Buzzards Bay and Chesapeake Bay. Estuaries 25 (1): 86-100. [ Links ]
Yáñez-Arancibia, A., A. L. Lara-Domínguez, J. L. Rojas-Galaviz, P. Sánchez-Gil, J. W. Day Jr. & C. J. Madden. 1988. Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogeneity (southern Gulf of Mexico). Journal of Fish Biology (Supplement A) 33: 191-200. [ Links ]














