Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.21 no.2 Ciudad de México may./ago. 2011
Espectro trófico del bagre Ictalurus punctatus (Silurifomes: Ictaluridae), en la presa Lázaro Cárdenas, Indé, Durango, México
Trophic spectrum of the catfish Ictalurus punctatus (Siluriformes: Ictaluridae), in the Lázaro Cárdenas reservoir, Indé, Durango, Mexico
Gabriel Fernando Cardoza Martínez,1 José Luis Estrada Rodríguez,1 Fernando Alonzo Rojo,1 Carmen Leticia Mar Tovar2 y Frances Gelwick3
1 Centro de Estudios Ecológicos, Escuela Superior de Biología, Universidad Juárez del Estado de Durango. Avenida Universidad S/N, Fraccionamiento Filadelfia Gómez Palacio, Durango. 35010 México
2 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Valle de Guadiana, km. 5 carretera Durango–El Mezquital, 34000, Durango, Dgo. México
3 Universidad de Texas A & M, College Station, Texas, USA . E–mail: biologo_gabriel@hotmail.com
Recibido: 10 de diciembre del 2010.
Aceptado: 27 de julio de 2011.
RESUMEN
Se analizó el contenido de 240 estómagos de Ictalurus punctatus (Rafinesque, 1818), colectados de 2006 a 2007, con el objetivo de determinar su espectro trófico, su variación por talla y época climática. Los contenidos estomacales se analizaron en laboratorio y los organismos se determinaron hasta nivel de orden. Los datos obtenidos fueron analizados por métodos cuantitativos y cualitativos. Los órdenes más frecuentes fueron Perciformes y Atheriniformes que corresponden a peces forraje, así como algas verdes del orden Charales. Además, se encontraron otros siete órdenes de invertebrados: Schizodonta, Odonata, Himenoptera, Orthoptera, Hemiptera, Homoptera y Scorpionida, además de dos órdenes de plantas: Poales y Fabales. El orden Perciforme constituyó casi la mitad del total del peso del contenido estomacal, seguido por los órdenes Atheriniforme y Charales. En las estaciones de verano e invierno se presentó el mayor número de estómagos vacíos, mientras que en primavera se encontró el mayor número de estómagos llenos. La cantidad de alimento ingerida en la estación de invierno fue significativamente menor que en las demás estaciones. El principal alimento en primavera, verano y otoño, fueron los peces, mientras que en invierno hubo mayor preferencia por las algas.
Palabras clave: Alimentación, bagre, embalse, Durango, estaciones del año.
ABSTRACT
Having the objective of determining their trophic spectrum and their variations within a year, the contents of 240 stomachs of Ictalurus punctatus (Rafinesque, 1818) were analyzed from 2006 to 2007. The items of the stomach contents were determined to the order level. The data was analyzed by different quantitative and qualitative methods. The most frequent orders were Perciforms and Atheriniforms corresponding to forage fish, along with green algae of the Charales order. Also, seven orders of invertebrates were found: Schizodonta, Odonata, Himenoptera, Orthoptera, Hemiptera, Homoptera and Scorpionida, and two orders of plants: Poales and Fabales. The Perciform order made up almost half of the total weight of the stomach contents, followed by the Atheriniform and the Charales orders. The greatest number of empty stomachs showed up during summer and winter, while the greatest number of filled–up stomachs was found during the spring season. The quantity of food consumed during winter time was significantly lower than the amount consumed during all other seasons. The kind of food consumed during the spring, summer and autumn was mainly fish, while algae were preferred during the winter season.
Key words: Feeding, catfish, reservoir, Durango, seasons.
INTRODUCCIÓN
El estudio de la dieta de los peces es un aspecto básico en la generación de conocimiento sobre el funcionamiento de los ecosistemas en que habitan, el desempeño que cumplen en los mismos y la posición que éstos ocupan en la trama trófica (Prejs & Colomine, 1981; King, 2005; Glass &Watts, 2009). El alimento es un elemento esencial del medio ambiente acuático que influye en la supervivencia y reproducción de los organismos, tanto la cantidad como la calidad del alimento pueden influir en ellos (Franssen & Gido, 2006; Brewer & Rabeni, 2008). Algunas especies están especializadas en un solo tipo de alimento, otras por su parte poseen la capacidad de alimentarse de varios recursos a la vez, de tal manera que son consideradas como especies generalistas (Poot–Salazar, 2005; Edds et al., 2002). El género Ictalurus incluye especies piscívoras–omnívoras como l. punctatus, que se alimenta principalmente en los fondos de cuerpos de agua. Su dieta incluye en mayor medida insectos bentónicos, cangrejos, moluscos, crustáceos y otros peces (Batzer et al., 2000; Edds et al., 2002; Navarro, 2002). Algunos estudios han demostrado que organismos de l. punctatus con longitudes totales mayores a 50 cm se alimentan exclusivamente de peces, mientras que organismos con longitudes menores recurren a un amplio espectro de alimento de manera oportunista (Cannamela et al., 1978; Perry, 1969). Adicionalmente, de acuerdo con información de capturas comerciales obtenidas por los pescadores de la presa El Palmito, l. punctatus es la segunda especie en importancia comercial. Por medio de un mayor conocimiento de su biología en el embalse, se pueden tomar medidas para favorecer la estabilidad poblacional. En este contexto, los objetivos del presente trabajo fueron: determinar el espectro trófico de l. punctatus, determinar las diferencias en la alimentación de acuerdo a las tallas de los organismos y establecer la variabilidad alimenticia con relación a la época del año.
MATERIALES Y MÉTODOS
Área de estudio. La presa Lázaro Cárdenas se localiza en la parte centro norte del estado de Durango. El embalse se encuentra localizado entre los 25° 40'4.05" N y 105° 05' 17.9" 0. Se abastece por la afluencia de dos ríos principales: el Sextín, también llamado El Oro, por el noroeste, y el Ramos al suroeste. Ambos ríos tienen su origen en la Sierra Madre Occidental. La presa Palmito tiene una capacidad de almacenamiento de 3,336 millones de metros cúbicos de agua y una superficie de inundación de 15,241 hectáreas (INEGI, 1989). La vegetación predominante se compone de matorral micrófilo espinoso, géneros Prosopisy Acacia, también persisten los pastizales del género Asistida (INEGI, 1978).
Material biológico analizado. Para conocer la alimentación de l. punctatus se analizó su contenido estomacal. Se realizaron muéstreos mensuales en el período comprendido de agosto de 2006 a julio de 2007 para completar un ciclo anual alimentario. Las muestras se obtuvieron de las capturas que realizaron los pescadores comerciales de la Sociedad de Solidaridad Social Pescadores del Palmito S. C. L. mediante redes agalleras con aberturas que variaron entre 4y 4.5 pulgadas. Los meses incluidos en cada estación se consideraron como sigue: primavera (marzo, abril y mayo), verano (junio, julio y agosto), otoño (septiembre, octubre y noviembre) e invierno (diciembre, enero y febrero). Se analizaron un total de 20 estómagos por mes para obtener una muestra total anual de 240 ejemplares. A todos los organismos se les tomaron los siguientes datos biométricos: longitud total (Lt), longitud estándar (Std) y peso. Los datos se obtuvieron con ayuda de un ictiómetro de campo con exactitud de 1 mm, y una balanza de reloj con exactitud de 25 g. Los estómagos fueron extraídos mediante disección y fueron conservados en formol al 10% para su posterior análisis (Díaz & Soto, 1988). Cada estómago se pesó lleno y vacío para calcular por diferencia el peso del contenido estomacal en gramos. El contenido estomacal fue colocado en una caja Petri para poder observarlo con ayuda de un microscopio estereoscópico. Los componentes alimenticiosfueron separados y determinados hasta el nivel taxonómico de orden con base en claves de identificación de Bland y Jacques (1947), para insectos y otros invertebrados, Ortega (1984) para algas, Rzedowski & Rzedowski (2001) para plantas y Álvarez (1950) y Miller y colaboradores (2009) para peces. Cada tipo de alimento fue pesado por separado para calcular su proporción. La materia orgánica animal o vegetal no identificada fue considerada como detritus de acuerdo con Jiménez–Badillo & Nepita–Villanueva (2000).
Los resultados se analizaron por métodos cualitativos y cuantitativos. El método cualitativo fue el de frecuencia de ocurrencia, el cual se calculó con la fórmula F= n/N • 100; donde F es la frecuencia de aparición de la presa, n el número de estómagos que contienen una presa determinada y N el número total de estómagos con alimento. Mediante los porcentajes obtenidos por ésta fórmula se distinguieron tres categorías de presas: Accidentales F < 10, Secundarios 10 < F < 50 y Preferenciales F > 50 (Franco & Bashirullah, 1992). Este método indica las posibles preferencias alimenticias de un organismo. El método cuantitativo utilizado fue el índice gravimétrico (W), el cual se expresa como sigue:

También se aplicó el índice de repleción (IR), el cual indica la condición de llenado del estómago, se expresa con la siguiente fórmula:

Para determinar el estado de llenado del estómago, se tomó en cuenta la escala propuesta por Franco & Bashirullah (1992): IR < 0.5 estómago vacío, 0.5 < IR < 1.0 estómago semilleno, IR > 1.0 estómagos llenos. Para calcular el índice de vacuidad (IV) se aplicó la siguiente fórmula:
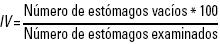
La cual indica el porcentaje de estómagos vacíos en el total de los organismos muestreados.
Con la finalidad de determinar diferencias en el número de presas ingeridas con relación a la longitud del pez, se formaron grupos de talla y se aplicó un análisis de varianza de una vía (ANOVA) y una vez establecida la diferencia significativa, se empleó la prueba de Tukey (p < 0.05).
Para determinar diferencias estacionales en la cantidad de alimento ingerido por los organismos, se aplicó un segundo ANOVA (p < 0.05) y la prueba de comparaciones múltiples LSD (p < 0.05) para establecer las estaciones en que se presentó mayor cantidad de alimento. Para lo anterior se empleó el paquete estadístico SPSS 17.0.
RESULTADOS
Del total de estómagos de peces examinados a lo largo de las cuatro estaciones, 58 correspondieron a machos, 108 a hembras y 74 que no fue posible su determinación, debido a que lasgónadasno eran visibles o a que el grado de desarrollo de estas no permitía la diferenciación. Los organismos muestreados presentaron un peso promedio de 724.8 g (±316.7 g) y una longitud total promedio de 41.1 cm (±5.1 cm). El espectro trófico total de los individuos de I. punctatusse constituyó de 14 presas o categorías tróficas, de los cuales 12, de acuerdo a su importancia en peso, corresponden a los siguientes órdenes: Perciformesy Atheriniformes (peces), Odonata, Himenoptera, Orthoptera, Hemiptera y Homoptera (insectos), Schizodonta (bivalvos), Scorpionida (alacrán), Charales (algas verdes de la clase Charophyceae), Fabales (semillas) y Poales (gramínea). Las dos categorías restantes corresponden a detritus, que incluye materia orgánica no identificada y restos de peces, que se componen de escamas, espinas y otros pequeños fragmentos en un avanzado estado de degradación. De acuerdo al índice de frecuencia, los órdenes de peces Atheriniformes y Perciformes, al igual que las algas Charales, son los que presentan la mayor ocurrencia en los estómagos a lo largo de las cuatro estaciones del año, con 22.3%, 22.9% y 21.7% respectivamente, por lo que se clasifican en la categoría de elementos secundarios. Los restantes órdenes: Fabales, Schizodonta, Odonata, Himenoptera, Orthoptera, Hemiptera, Poales, Homóptera y Scorpionida, así como los restos de peces y detritus que presentaron menos del 10% de frecuencia de ocurrencia,fueron considerados elementos accidentales. Ningún ítem presa tuvo más de 50% de frecuencia de ocurrencia, por lo que no se encontraron elementos preferenciales. Sin embargo, las especies de peces forraje de los órdenes Perciformes y Atheriniformes constituyeron un alimento recurrente a lo largo de las estaciones del año con 67.2 % del peso total del contenido estomacal (Tabla 1).
Diferencias alimenticias por grupo de talla. La intensidad en la alimentación reflejada en el índice de repleción presentó fluctuaciones según la talla del pez. En promedio, los bagres con longitud total de 41–45 cm registraron estómagos semillenos, con un IR de 0.6. En la misma categoría se establecieron los peces con longitud total de más de 50 cm, con un IR de 0.5. Las tallas de los peces con estómagos vacíos fueron las comprendidas entre 29–35,36–40 y 46–50 cm, con un IR de 0.4,0.4 y 0.2 respectivamente. Ningún grupo de talla alcanzó la categoría de estómagos llenos. Las preferencias alimenticias de acuerdo a la longitud del pez se muestran en la Tabla 2. Cuando los individuos alcanzaron tallas de 50 cm ó más de longitud total su alimentación se basó casi exclusivamente en peces forraje. El número promedio de ítems presa consumidos por los grupos de peces con tallas de 46–50 y 51 cm ó más fue significativamente menor (p < 0.05, Tabla 2) en comparación con los peces con 36–40 y 41–45 cm de longitud total.
Diferencias en la alimentación por estaciones. En la estación de primavera, el alimento de l. punctatus se constituyó principalmente de peces (Perciformes y Atheriniformes) con un 58.6% del peso total del contenido estomacal, seguido de los bivalvos, algas y otros ítems presa. En esta estación se apreció un espectro mayor en la cantidad de ítems consumidos por los individuos muestreados (Tabla 1). La estación de verano se distinguió por una alimentación casi exclusivamente de peces (Perciformes y Atheriniformes) con un 94.1% del peso del contenido estomacal, manteniendo un espectro amplio de ítems consumidos. En la estación de otoño, las algas constituyeron uno de los alimentos principales del bagre con un 18.8% del peso total del contenido estomacal. De igual manera, los peces forraje se mantuvieron dentro de las principales presas, sin embargo, presentaron una importante disminución en proporción al total del alimento y en comparación a la estación anterior con solo el 64.5%. Finalmente, en la estación de invierno las algas se constituyeron como el principal ítem presa para el bagre, con un 38.7% del total del contenido estomacal y con el 36.5% de ocurrencia en los estómagos muestreados. Los peces constituyeron el segundo alimento más importante con 33.9% deltotal del alimento. En la estación de invierno, en promedio los peces consumieron significativamente menor cantidad de alimento en comparación con las otras estaciones del año (p < 0.05, Tabla 1). El índice de repleción mostró variación a lo largo de las cuatro estaciones que duró el estudio, de esta manera la estación con mayor número de estómagos vacíos fue verano con el 80%, seguido de invierno con el 78%, mientras que el mayor número de estómagos llenos se presentó en primavera con 18.3%.
DISCUSIÓN
Michelsen y colaboradores (1994) manifiestan que el detrito es una fuente de alimento consumida por los peces en las épocas en que no hay suficiente disponibilidad de alimentos de origen animal. En el presente trabajo se constató que debido a que los principales ítems presa de origen animal (Atheriniformes y Perciformes) se mantienen disponibles todo el año, la categoría detritus no llega a tener grandes cambios en los índices de frecuencia de ocurrencia y gravimétrico, permaneciendo constante en la categoría de alimentos accidentales (F < 10), con la excepción de la estación de primavera donde con el mínimo valor alcanzó la categoría de alimento secundario. En un estudio sobre la composición alimenticia del bagre de canal l. punctatus en el Lago Texoma–Texas, EUA se indica que los organismos con 50 cm o más de longitud total presentaron un espectro trófico especializado exclusivamente hacia los peces, en comparación con tallas menores (10–30 cm) en donde se observó un espectro trófico más amplio. En el mismo estudio se encontró que del total de los organismos examinados, los peces ocurrieron en 61% de los estómagos, seguidos por 53% de insectos acuáticos, 48% de vegetación y detritus, 24% de semillas y 21% de insectos terrestres (Edds et al., 2002). Todos los grupos antes mencionados se presentaron de igual manera en los estómagos del bagre en la presa El Palmito y de la misma forma la composición de la dieta se modifica conforme lo hace su longitud. Los organismos con 36–45 cm de longitud total presentaron una dieta generalista, por el contrario, cuando alcanzaron una talla de 46 cm o más de longitud total, sus preferencias alimenticias se especializaron casi exclusivamente hacia los peces. Cambios similares en la dieta con respecto a la ontogenia se reportan en diferentes estudios sobre alimentación en especies del género Ictalurus (Perry, 1969; Sule et al., 1981). Se puede considerar a los peces de los órdenes Perciformes y Atheriniformes como fundamentales en la dieta del bagre, ya que constituyeron el primer lugar en cuanto a peso y ocurrencia se refiere. Es importante resaltar la importancia de los peces forraje y las algas en la dieta del bagre, que si bien en ninguna estación alcanzan la categoría de alimentos preferenciales, constituyeron el 80.2% del peso total del contenido estomacal. Diferentes estudios sostienen que la dieta de los peces es un reflejo de la disponibilidad, abundancia y ocurrencia de presas en el ambiente (Yáñez et al., 1976; Jiménez–Badillo & Nepita–Villanueva, 2000; Sánchez–Gonzáles et al., 2001; Marques et al., 2009) y que de alguna manera su disponibilidad puede determinar la preferencia alimentaria. En el presente trabajo se observó que la alimentación de l. punctatus depende en parte de la disponibilidad y abundancia estacional de ciertos recursos, como las algas del orden Charales y las hormigas pertenecientes al orden Himenoptera, los cuales fueron consumidos en las cuatro estaciones, debido posiblemente a que permanecen disponibles para los peces todo el año. De manera similar, las acacias dentro del orden Fabales son el grupo de plantas dominante en las márgenes de la presa Lázaro Cárdenas (INEGI, 1978), lo cual se refleja posiblemente en que sea el único grupo de plantas terrestres (semillas) que ocurrió en los estómagos en tres de las cuatro estaciones del año. Sin embargo, otras investigaciones sugieren que algunos grupos de peces, entre ellos los miembros de la familia Ictaluridae presentan cierto grado de preferencia alimentaria hacia algunos ítems en particular, a pesar de tener la posibilidad de alimentarse de diferentes fuentes (Jackson, 1995; Jaramillo, 2009; Moreno et al., 2009). En el presente trabajo se constató que los organismos muestreados mostraron cierta selección sólo en algunos alimentos consumidos. Lo anterior se sustenta en el hecho de que en el embalse coexisten una gran variedad de especies ícticas, como Astyanax spp., Notropis chihuahua (Woolman, 1892), Gila conspersa (Garman, 1881), Rhinichthys sp., entre otros (Pérez–Ponce de León & Choudhury, 2002; Palacios, 2008), sin embargo, en los estómagos sólo ocurrieron especies pertenecientes a los órdenes Perciformes y Atheriniformes, lo cual indica una posible discriminación de presas por parte de los individuos al alimentarse. Esta preferencia hacia ciertas especies de peces forraje es reportada en otros estudios sobre alimentación de especies del género Ictalurusen embalses de EE.UU. (Perry, 1969; Edds et al., 2002). Adicionalmente, estos cambios alimenticios con relación a la ontogenia ocurren como respuesta a los requerimientos energéticos y nutricionales de acuerdo al crecimiento de los peces, además de las capacidades de los peces de diferente talla para capturar ciertas presas (Sumnton & Greenwood, 1990; Deudero, 2001). Para l. punctatus en la presa Lázaro Cárdenas la talla del pez, la estacionalidad, la disponibilidad de los recursosy la selección de ciertostipos de alimentos (Atheriniformes y Perciformes), son factores que influyen directamente en la variación cualitativa y cuantitativa en la alimentación. Es recomendable continuar con estudios que contribuyan a determinar la función que desempeña cada especie dentro de la comunidad, en especial aquellas que son introducidas y que presentan una importancia comercial como l. punctatus, así como los cambios ocasionados sobre las poblaciones de peces nativos, lo cual redundará en un adecuado manejo de la ictiofauna de la presa Lázaro Cárdenas.
AGRADECIMIENTOS
La presente investigación no hubiera sido posible sin la ayuda incondicional de la Sociedad de Solidaridad Social Pescadores del Palmito. Este trabajo forma parte del macroproyecto denominado "Desarrollo de un modelo para planes de manejo integral de embalses: pesquería, recreación y ecoturismo sustentable en el Palmito, Dgo.", existiendo participación interinstitucional: Escuela Superior de Biología–UJED, INIFAP, Universidad de Texas A & M, con fondos de la SAGARPA–CONACYT–COFUPRO.
REFERENCIAS
Álvarez, J. 1950. Claves para la determinación de peces en las aguas continentales mexicanas. México. Secretaría de Marina. 72 p. [ Links ]
Batzer, D. P., C. R. Pusateri & R. Vetter. 2000. Impacts of fish predation on marsh invertebrates: direct and indirect effects. Wetlands 20 (2): 307–312. [ Links ]
Bland, R. & H. Jacques. 1947. How to know the insects. Dubuque, Iowa: Wm. C. Brown Company Publishers. 56 p. [ Links ]
Brewer, S. K. & C. F. Rabeni. 2008. Seasonal and diel habitat shifts by juvenile ictalurids in a flow–regulated prairie river. The American Midland Naturalist 159 (1): 42–54. [ Links ]
Cannamela, D. A., J. D. Brader & D. W. Johnson. 1978. Feeding habits of catfishes in Barkley and Kentucky Lakes. Proceedings of the Annual Conference of Southeastern Association of Fish and Wildlife Agencies 32: 686–691. [ Links ]
Deudero, S. 2001. Interespecific trophic relationship among pelagic fish species underneath FADs. Journal of Fish Biology 58: 53–67. [ Links ]
Díaz, G. & L. A. Soto. 1988. Hábitos alimenticios de peces depredadores del sistema lagunar Huizache–Caimanero, Sinaloa, México. Anales Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 15:97–124. [ Links ]
Edds, D. R., W. J. Matthewrs & F. P. Gelwick. 2002. Resource use by large catfishes in a reservoir: Is there evidence for interactive segregation and innate differences? Journal of Fish Biology 60: 739–750. [ Links ]
Franco, L. & K. M. Bashirullah. 1992. Alimentación de la lisa (Mugil curema) del Golfo de Cariaco–Estado Suche, Venezuela. Zootecnia Tropical 10 (2): 219–238. [ Links ]
Franssen, N. R. & K. B. Gido.2006. Use of stable isotopes to test literature–based trophic classifications of small–bodied stream fishes. American Midland Naturalista (1): 1–10. [ Links ]
Glass, K. A. & B. D. Watts. 2009. Osprey diet composition and quality in high–and low–salinity areas of lower Chesapeake Bay. Journal of Raptor Research 43 (1): 27–36. [ Links ]
INEGI (Instituto Nacional de Estadística, Geografía e Informática). 1978. Carta temática INEGI. Escala 1:50,000. (G13C29). México, D.F. [ Links ]
INEGI (Instituto Nacional de Estadística, Geografía e Informática). 1989. Carta temática INEGI. Escala 1:250,000. (G13–8). México, D.F. [ Links ]
Jackson, D. C. 1995. Distribution and stock structure of blue catfish and channel catfish in macrohabitats along riverine sections of the Tennessee–Tombigbee Waterway. North American Journal of Fisheries Management 15: 845–853. [ Links ]
Jaramillo, A. M. 2009. Estudio de la biología trófica de cinco especies de peces bentónicos de la costa de Cullera. Relaciones con la acumulación de metales pesados. Tesis Doctoral. Departamento de Ingeniería Hidráulica y Medio Ambiente, Universidad Politécnica de Valencia, España. 389 p. [ Links ]
Jiménez–Badillo, B. M. & M. R. Nepita–Villanueva. 2000. Espectro trófico de la tilapia Oreochromis aureus (Perciformes: Cichlidae) en la presa Infiernillo, Michoacán–Guerrero, México. Revista de Biología Tropical 48 (2/3): 487–494. [ Links ]
King, D. T. 2005. Interactions between the American white pelican and aquaculture in the southeastern United States: an overview. Water–birds 28 (Special Publication 1): 83–86. [ Links ]
Marques, J. F., C. M. Teixeira, A. Pinheiro, K. Peschke & H. N. Cafjral. 2009. A multivariate approach to the feeding ecology of the channel flounder, Syacium micrurum (Pisces, Pleuronectiformes), in Cape Verde, Eastern Atlantic. Ciencias Marinas 35 (1): 15–27. [ Links ]
Michelsen, K, J. Pedersen, K. Christoffersen & F. Jensen. 1994. Ecological consequences of food partitioning for the fish population structure in a eutrophic lake. Hydrobiologia 291:35–45. [ Links ]
Miller, R. R., W. L. Minckley & S. M. Norris. 2009. Peces dulceacuícolas de México. CONABIO, SIMAC, ECOSUR, Consejo de Peces del Desierto. México, D.F. 559 p. [ Links ]
Moreno, X. G., L. A. Afjitia, A. Favila, F. J. Gutiérrez & D. S. Palacios. 2009. Ecología trófica del pez Arothron meleagris (Tetraodontiformes: Tetraodontidae) en el arrecife de Los Frailes, Baja California Sur, México. Revista de Biología Tropical 57 (1–2): 113–123. [ Links ]
Navarro, A. 2002. Ensayo de dos Modelos de policultivo empleando bagre (Ictalurus punctatus) tilapia híbrida (Oreochromis niloticus vs. Oreochromis mossambicus) y langostino (Macrobachium tenellum) en estanques semi–rústicos, caso Jocotepec, Jalisco. Tesis de Maestría en Acuacultura. Facultad de Ciencias Marinas, Universidad de Colima, México. 46 p. [ Links ]
Ortega, M. M. 1984. Catálogo de algas continentales recientes de México. UNAM. México. 566 p. [ Links ]
Palacios, O. A. 2008. Diversidad de la ictiofauna en el Río Nazas, Dgo., México. Tesis Profesional de Licenciatura. Escuela Superior de Biología, Universidad Juárez del Estado de Durango, México. 73 p. [ Links ]
Pérez–Ponce de León, G. & A. Choudhury. 2002. Adult endohelminth parasites of ictalurid fishes (Osteichthyes: Ictaluridae) in Mexico: Empirical evidence for biogeographical patterns. Comparative Parasitology 69(1): 10–19. [ Links ]
Perry, W. G. 1969. Food habits of blue and channel catfish collected from a brackish–water habitat. The Progressive Fish–Culturist 31: 47–50. [ Links ]
Poot–Salazar, A. V., W. G. Canto–Meza & M. E. Vega–Candejas. 2005. Hábitos alimenticios de Floridichtys polyommus Hubbs, 1936 (Pisces: Cyprinodontidae) en dos sistemas lagunares costeros. Hidrobiológica 15 (2 Especial): 183–194. [ Links ]
Prejs, A. & G. Colomine. 1981. Métodos para el estudio de los alimentos y las relaciones tróficas de los peces. Universidad Central de Venezuela. Caracas. 127 p. [ Links ]
Rzedowski, G. C. & J. Rzedowski. 2001. Flora fanerogámica del Valle de México. 2a Edición. Instituto de Ecología y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Michoacán, México. 1406 p. [ Links ]
Sánchez–Gonzáles, S., R. Ruiz–Campos & S. Contreras–Balderas. 2001. Feeding ecology and habitat of threespine stickleback, Gasterosteus aculeatus microcephalus, in a remnant population of northwestern Baja California, México. Ecology of Freshwater Fish 10:191–197. [ Links ]
Sule, M. J., J. M. McNurney & D. R. Halffield. 1981. Food habits of some common fishes from heated and unheated areas of Lake Sangchris. Illinois Natural History Survey Bulletin 32: 500–519. [ Links ]
Sumton, W. & J. Greenwood. 1990. Pre– and post–flood feeding ecology of four species of juvenile fish from the Logan–Albert estuarine system, Moretón Bay, Queensland. Australian Journal of Marine and Freshwater Research 41:795–806. [ Links ]
Yáñez, A. A., G. Curiel & V. L. Yáñez. 1976. Prospección biológica y ecológica del bagre marino Galeichthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México (Pisces: Ariidae). Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 3 (1):125–180. [ Links ]














