Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.21 no.2 Ciudad de México may./ago. 2011
Biología y cultivo de Macrobrachium tenellum: Estado del arte
Biology and culture of Macrobrachium tenellum: State of the art
Luis Daniel Espinosa–Chaurand,1 Manuel Alejandro Vargas–Ceballos,2 Manuel Guzmán–Arroyo,3 Hector Nolasco–Soria,4 Olimpia Carrillo–Farnés,5 Olimpia Chong–Carrillo6 y Fernando Vega–Villasante1
1 Laboratorio de Acuicultura Experimental. Centro Universitario de la Costa. Universidad de Guadalajara. Av. Universidad No. 203, Del. Ixtapa, Puerto Vallarta, Jalisco, 48280 México. E–mail: fernandovega.villasante@gmail.com
2 Licenciatura en Biología. Centro Universitario de la Costa. Universidad de Guadalajara.
3 Instituto de Limnología. Centro Universitario de Ciencias Biológicas y Agropecuarias. Universidad de Guadalajara.
4 Centro de Investigaciones Biológicas del Noroeste. La Paz, Baja California Sur. México.
5 Facultad de Biología. Universidad de La Habana. La Habana, Cuba.
6 Editorial Gente Nueva. La Habana.
Recibido: 9 de septiembre de 2010.
Aceptado: 13 de abril de 2011.
RESUMEN
El presente trabajo tiene como propósito reunir y clasificar la información existente sobre aspectos biológicos y de cultivo del langostino Macrobrachium tenellum, de una forma clara y secuencial, que permita integrar el conocimiento para desarrollar nuevos caminos en la investigación y aprovechamiento sustentable de este recurso. Se abordan diversos temas que incluyen la taxonomía y sistemática, distribución geográfica, ecología, reproducción, desarrollo, patologías, pesca y acuicultura de la especie, tomando en cuenta toda la información generada por diversos autores, desde hace cuatro décadas a la fecha. Se concluye que existen vacíos importantes en el conocimiento de aspectos básicos y aplicados sobre la biología de la especie y que se requiere un gran esfuerzo de investigación para la correcta comprensión de este organismo nativo, que permita su protección y adecuado aprovechamiento. Se recomienda poner especial interés en estudios que permitan conocer completamente su distribución, el efecto de la contaminación y la pérdida de sus hábitats naturales. Es necesario también revisar la normatividad de aprovechamiento y conservación, así como desarrollar y mejorar las técnicas de manejo acuicultural.
Palabras clave: Langostino, Macrobrachium tenellum, estado del arte, biología, cultivo.
ABSTRACT
This research aims to collect and classify information on the biology and culture of the prawn Macrobrachium tenellum, in a clear and sequential manner, which would integrate the knowledge to develop new ways in research and sustainable exploitation of this resource. It covers various topics including taxonomy and systematics, geographic distribution, ecology, reproduction, development, pathology, fisheries and aquaculture of this species, taking into account all the information generated by different authors, from four decades to today. We conclude that there are significant knowledge gaps of basic and applied aspects of the biology of the species and this requires a great deal of research for the correct understanding of this native organism to allow for its protection and proper utilization. It is recommended to take special interest in studies to fully know its distribution, the effects of pollution and the loss of its natural habitats. It is necessary to review the regulations for the use and conservation, and to develop and improve aquacultural management techniques.
Key words: Prawn, Macrobrachium tenellum, state of the art, biology, culture.
INTRODUCCIÓN
Los sistemas acuiculturales han tomado relevancia en los últimos veinte años debido a que se presentan como una opción viable en la generación de beneficios bioecológicos, nutrimentales y socioeconómicos para los individuos, comunidades y empresas que los desarrollan. La acuicultura es la actividad que tiene como objetivo la reproducción, crianza, cultivo y comercialización de animales y plantas acuáticos (Vega–Villasante & Chong, 2006).
Los beneficios ecológicos y económicos de la acuicultura solo se logran por medio del adecuado manejo de las poblaciones naturales y de los sistemas de cultivo de organismos acuáticos, a través del conocimiento primario de su biología y ecología, y del desarrollo de biotecnologías que permitan su utilización sustentable. Por lo anterior, es imprescindible establecer un panorama certero del conocimiento generado de las especies con potencial económico para usarlo como base en actuales y futuras investigaciones.
Los crustáceos son muy importantes alrededor del mundo para la satisfacción de las necesidades de alimentación del hombre, ya sea como producto alimenticio directo de la pesca, como recurso fundamental en las cadenas tróficas de otros recursos pesqueros y como organismos de cultivo. De cualquier manera, directa o indirectamente, generan un beneficio nutrimental y/o económico a todos los usuarios del recurso en los diferentes niveles en que estos intervienen.
Los langostinos de la familia Palaemonidae son los crustáceos más diversos dentro del orden Decápoda; tienen una amplia distribución geográfica y batimétrica, y están representados por numerosas especies en los sistemas marinos, estuarinos y dulceacuícolas (Hernández–Sandoval, 2008). De las 48 especies registradas en el Pacífico centro–oriental, los palemónidos ocupan el segundo lugar en abundancia entre las familias del infraorden Caridea, incluyendo organismos de aguas marinas, salobres y dulces (Hendrickx, 1995). Sólo algunos son de importancia comercial, y entre éstos, la mayoría pertenece al género Macrobrachium (Román–Contreras, 1979; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Luna et al., 2007), reconociéndose actualmente 127 especies que son aprovechadas para la alimentación humana (Holthuis, 1952a; Guzmán–Arroyo, 1987). Sin embargo, el Sistema Integrado de Información Taxonómica (ITIS) registra alrededor de 291 especies y subespecies de Macrobrachium (ITIS, 2010). El inicio de su importancia económica dentro de la acuicultura data desde los años 60's, con el reporte de Román–Contreras (1979) acerca de las condiciones óptimas de reproducción, crecimiento y cultivo de los langostinos susceptibles de explotación.
De las cuatro especies de importancia comercial del género Macrobrachium en América Latina M. carcinus (Linnaeus, 1758), M. acanthurus (Wiegmann, 1836), M. americanum (Bate, 1868), y M. tenellum (Smith, 1871); la última ha sido considerado un buen candidato para el cultivo ya que se encuentra en altas densidades en la naturaleza, no es agresiva y puede tolerar un amplio y fluctuante intervalo de temperatura, salinidad y concentración de oxígeno (Ponce–Palafox et al., 2002).
Específicamente, la generación de conocimientos sobre M. tenellum empezó desde los años 70's, cuando Guzmán (1975, 1976, 1977) y Guzmán et al. (1977) sentaron las bases para la investigación del género y de la especie en el marco del "Programa General de Investigación de los Langostinos del género Macrobrachium en México: Parte I. Especies del Pacífico". Adicionalmente, en el periodo de 1978 a 1985 se presentaron diversos ensayos, informes, ponencias y trabajos que describen técnicas de cultivo bajo condiciones controladas, cultivo experimental, mecanismos de selección y biosinopsis de cultivo, fecundidad y desarrollo larval, disponibilidad de larvas y parasitismo (Guzmán–Arroyo, 1987). Por su parte, Ponce–Palafox et al. (2002) mencionan que los estudios realizados para el cultivo de M. tenellum se han enfocado hacia la producción de larvas y postlarvas, alimentación, técnicas de reproducción, comparación de crecimiento y supervivencia de esta especie y de M. rosenbergii (de Man, 1879), crecimiento en micropresas, tanques y estanques rústicos en mono y policultivo con tilapia, densidad de siembra y ensayos básicos de fisiología.
Posterior a la primera oleada de conocimiento, la investigación de M. tenellum se rezagó por la introducción al país de la tecnología para el cultivo del langostino malayo (M. rosenbergii). Aunque en las últimas décadas se retomó la experimentación, la información generada está fraccionada y dispersa. El propósito de este trabajo es reunir y clasificar la información existente sobre los aspectos biológicos y de cultivo del langostino M. tenellum de una forma clara y secuencial, que permita integrar el conocimiento para desarrollar nuevos caminos en la investigación y aprovechamiento sustentable de este recurso.
SISTEMÁTICA Y TAXONOMÍA
Los nombres comunes o vernáculos utilizados para el M. tenellum son langostino, moya, camarón de río, chacal, manudo, cauques, pupo, cauque de pinzas largas, acamayas, piguas, mayacaxtles, mayas, varillado o brazolargo y popotillo (Román–Contreras, 1979; Cabrera, 1983; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Ponce–Palafox et al., 2002; García–Ulloa et al., 2004; Pérez–Velázquez et al., 2006b).
La sinonimia de la especie es Palaemon tenellum (Smith, 1871); Palaemon longipes (Lockington, 1878) (non Oliver, 1811) (Jayachandran, 2001). Su clasificación taxonómica es la siguiente (Román–Contreras, 1979; Ruíz–Santos, 1988; Guzmán–Arroyo, 1987; Hendrickx, 1995; Arzola–González & Flores–Campaña, 2008):

MORFOLOGÍA
Los juveniles, hembras y machos de M. tenellum (Figs. 1–2, 3 respectivamente) son de color café claro, fondo gris–verdoso pálido, con manchas anaranjadas en las articulaciones de los pereiópodos y líneas gruesas y delgadas en el abdomen y carapacho (Boschi, 1974; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001).
El rostrum es largo y curvado hacia arriba en su borde superior, con una parte proximal convexa y dentada, y una distal desarmada recta o cóncava, casi alcanzando el extremo anterior de la escama antenular; presenta de 9 a 11 dientes dorsales con un espacio entre ellos, después, un diente posorbital terminado en forma bífida (dos espinas). En la porción ventral del rostrum tiene de 4 a 7 dientes continuos, que en su porción media se inclinan hacia delante. El abdomen muestra una pleura con margen claro y una punta media, y la pleura del segundo segmento abdominal se sobrepone al primero y tercero. El primero y el segundo par de pereiópodos presentan quelas o pinzas; el segundo par es muy desarrollado, con pereiópodos alargados, iguales o casi iguales, delgados y simétricos en machos (de forma igual en las hembras, pero de menor tamaño). La pinza está recubierta de pequeñas espinas o pubescencia aterciopelada, los dedos son largos de aproximadamente 0.8 a 1.0 veces la longitud de la palma y entre ellos puede apreciarse un espacio al cerrarse la pinza. El carpo puede ser igual o más largo que el mero (Boschi, 1974; Guzmán–Arroyo, 1987; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Hernández et al., 2007). A veces el abdomen tiene cromatóforos de color oscuro (Holthuis, 1952b).
DISTRIBUCIÓN
En la costa del Pacífico, M. tenellum se distribuye desde Mule–gé, en la parte media y oriental de la Península de Baja California (27° latitud Norte) hasta el extremo sur de dicha península y desde Yavaros, Sinaloa (26° 45' latitud Norte) en México, hasta el río Chira, en el Norte de Perú (5° latitud Sur) e isla Galápagos (regiones intertropicales delimitadas por las isotermas de los 18° C) (Figura 4) (Holthuis, 1952b; Boschi, 1974; Goodyear et al., 1976; Guzmán et al., 1981; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988; New, 1988; Arroyo–Renteria & Magaña–Ríos, 2001; Jayachandran, 2001; Arzola–González & Flores–Campaña, 2008). Es posible localizarlo en aguas dulces y salobres continentales desde el nivel del mar hasta 800 a 1000 msnm, en ambientes con una temperatura anual mínima de 16° C y máxima de 32° C, y en zonas con precipitación total que fluctúa entre los 400 y 1350 mm anuales (Guzmán–Arroyo, 1987; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Jayachandran, 2001).

ECOLOGÍA
M. tenellum habita aguas dulces y salobres oligohalinas; es muy adaptable a ambientes diversos ya que se le encuentra tanto en estuarios y ríos, como en lagunas costeras (Holthuis, 1952b; Boschi, 1974; FAO, 1974; Román–Contreras, 1979; Guzmán–Arroyo, 1987; New, 1988; Román–Contreras, 1991; Hendrickx, 1995; Schiff & Hendrickx, 1997; Signoret–Poillon & Soto, 1997; Arroyo–Renteria & Magaña–Ríos, 2001; Jayachandran, 2001; Ponce–Palafox et al., 2002; Espino–Barr et al., 2006). Lo anterior le proporciona una plasticidad morfológica y cromática característica para cada uno de estos ambientes (Guzmán–Arroyo, 1987).
Puede ser activo tanto en el día como en la noche, aunque se ha establecido que es preferentemente nocturno (Goodyear et al., 1976), manteniéndose enterrado casi todo el día (Ponce–Palafox, 2002). Habita en las partes bajas de las cuencas hidrográficas con corrientes lentas (Espinosa, 1986) que desembocan en el mar o cerca de éstas (Boschi, 1974; FAO, 1974), donde las aguas son tranquilas y claras o semiclaras, con temperaturas superiores a 23° C (Goodyear et al., 1976; Espinosa, 1986; Román–Contreras, 1991; Ponce–Palafox et al., 2002).
Su comportamiento general en los cuerpos de agua se asocia positivamente con la insolación y la salinidad, y negativamente con la profundidad, el oxígeno y la turbidez (Guzmán–Arroyo, 1987). Por ejemplo, Guzmán–Arroyo (1987) encontró que 33.78 °C). en la laguna costera de Tres Palos, Guerrero, México, los juveniles prefieren aguas con menores profundidades (1.75 m) y con temperaturas alrededor de los 29.8 °C; mientras que las hembras y los machos se encontraron a 2.25 y 2.3 m de profundidad con temperaturas de 30.9 y 31.1 °C, respectivamente. Por su parte, Schiff & Hendrickx (1997) reportaron a este langostino en el Golfo de California, a profundidades de 3 a 5 m, con requerimientos de salinidad más elevada para los juveniles (4.19 ups), respecto a hembras y machos (3.94 y 4.02 ups). Algo parecido ocurre para el oxígeno disuelto ya que los juveniles prefieren una concentración de 5.59 mg L–1, mientras que hembras y machos son encontrados entre 4.88 y 4.98 mg L–1. De igual manera, Hernández et al. (2007) mencionan que los especímenes colectados en su investigación fueron encontrados en aguas con variaciones en sólidos totales disueltos (0.52–1.58 g/L), pH (6.7–8.9) y temperatura (17.3 ºC a los 33.78 ºC).
Se ha reportado que M. tenellum habita sobre fondos arenosos, limosos, limo–arcillosos, rocosos, cerca de los manglares o entre raíces sumergidas, plantas acuáticas, debajo de hojas y palos en descomposición, en aguas con abundancia de detritus y materia en diferentes grados de descomposición (Boschi, 1974; Goodyear et al., 1976; Román–Contreras, 1979; New, 1988; Román–Contreras, 1991; Hendrickx, 1995; Signoret–Poillon & Soto, 1997; Arroyo–Renteria & Magaña–Ríos, 2001; Espino–Barr et al., 2006). Así, Guzmán–Arroyo (1987) observó que en la laguna costera de Tres Palos, Guerrero, México, M. tenellum prefería los sedimentos de arcilla–limosos como sustratos, debido a que allí se localizaba al 60.47% de la población. Por otro lado, en cuerpos de agua costeros en el Golfo de California, Schiff & Hendrickx (1997) encontraron a esta especie en fondos fangosos con presencia de plantas halófitas.
Generalmente esta especie se reproduce en primavera y verano. Aprovecha la época de lluvias para bajar por los caudales de los ríos a las zonas costeras, donde la salinidad es de alrededor de 12 ups, ya que los adultos necesitan penetrar en aguas salobres para cumplir su ciclo reproductivo (Boschi, 1974; FAO, 1974). Con frecuencia, es posible encontrar adultos y sub–adultos de este langostino en praderas de pastos marinos (Ruppia), o cerca de la boca de lagunas salobres (Boschi, 1974; Hendrickx, 1995), como son los estuarios y lagunas costeras; en ocasiones, se hallan en las áreas de influencia limnética (Guzmán–Arroyo, 1987).
Su ciclo biológico lo fuerza a realizar migraciones reproductivas hacia las zonas cercanas a los estuarios donde desova; al alcanzar su estado adulto, avanza hacia las aguas salobres bajando por los ríos en los periodos de lluvias. El desarrollo larval se realiza en aguas salobres y permanecen en estas zonas hasta etapas juveniles y de adultos jóvenes. Al aumentar la salinidad, remontan río arriba para encontrar agua dulce y retornar hacia sus zonas habituales (Román–Contreras, 1979; Guzmán–Arroyo, 1987; Ponce–Palafox et al., 2002).
M. tenellum puede abandonar el medio acuático por cortos periodos de tiempo para librar obstáculos que impidan sus migraciones, sobre todo cuando se dirige a áreas de reclutamiento (Espinosa, 1986), aunque presentan aparente incapacidad de desplazarse fuera del agua por la debilidad de sus pereiópodos en comparación con el peso de su cuerpo (Ponce–Palafox et al., 2006).
Los principales impedimentos de las migraciones naturales de M. tenellum, que causan una disminución seria de sus poblaciones en los ríos y cuerpos de agua sobre las franjas de la costa donde habita, son de carácter antrópico, como los embalses o represas construidos en las cuencas hidrológicas, y la contaminación generada por desechos urbanos e industriales (Espinosa, 1986).
En resumen, M. tenellum presenta una amplia adaptabilidad a diferentes ambientes y de igual forma, una diversa distribución ecótica (Tabla 1).
Pérez–Velázquez et al. (2006a) reportan que los grupos de edad se van reemplazando en el transcurso del año de acuerdo al ciclo de vida de la especie. Similar a lo anterior, Guzmán–Arroyo (1987) observó que los patrones de distribución y abundancia de M. tenellum en la Laguna de Tres Palos, Guerrero, México, difieren en tiempo y espacio. En el segundo trimestre, la abundancia y distribución se homogenizan, y la mayor abundancia se encontró entre los meses de mayo y julio (biomasa de 21.68 kg/ha). Por su parte, Román–Contreras (1991), trabajando en la Laguna de Coyuca, Guerrero, México, menciona que M. tenellum es la especie numéricamente dominante entre los invertebrados de ese lugar, el cual presentó su mayor abundancia en los meses más secos (enero a junio). De igual manera, Arzola–González y Flores–Campaña (2008), observaron en el estero El Verde, Sinaloa, México, que la moya es una especie temporal de distribución espacial restringida al verano, con mayor abundancia hacia la boca del río Quelite que alimenta el estero. Gelin y Gravez (2002), en su estudio sobre el conocimiento y conservación de las lagunas costeras de la Isla Galápagos, reportan por primera vez a M. tenellum en la isla como uno de los cuatro crustáceos existentes en algunas de sus lagunas costeras donde se encuentran coexistiendo con alta diversidad de peces.
El langostino M. tenellum habita comúnmente con otros miembros del género Macrobrachium, como M. americanum, M. diguett (Bouvier, 1895), M. acanthochirus (Villalobos, 1967) y M. occidentale (Holthuis, 1950); aunque en ambientes estuarinos sólo se ha encontrado con M. diguetti (Goodyear et al., 1976; Guzmán–Arroyo, 1987; Pérez–Velázquez et al., 2006b). Román–Contreras (1979) reportó a las charritas (Cichlasoma trimaculatum Günther 1867), cutetes (Galeichthys caerulescens Günther, 1864) y ocasionalmente, algunos peneidos y alfeidos como fauna de acompañamiento durante su captura, mientras que en la Laguna costera de Tres Palos, Guerrero, México, Guzmán–Arroyo (1987) registró un patrón similar en la abundancia de M. tenellum con el de la lisa (Mugil curema Valenciennes 1836), una relación inversamente proporcional con el del camarón blanco (Litopenaeus vannamei Bonne, 1931), asociado en una forma alta y negativa, mientras que con la mojarra charra (Cichlasoma trimaculatus Günther, 1867) y con la tilapia (Oreochromis aureus Linnaeus, 1757), los ciclos de aparición se traslapaban parcialmente. En otra laguna de Guerrero, Román–Contreras (1991) reportó que los decápodos que comparten el hábitat con M. tenellum son: L. vannamei, Far–fantepenaeus brevirostris (Kingsley, 1878), F. californiensis (Holmes, 1900), M. americanum, Potimirim glabra (Kingsley, 1878), Callinectes arcuatus (Ordway, 1863), Sesarma sulcatum (Smith, 1870), Glyptograpsus impressus (Smith, 1870) y larvas de Atya margaritacea (A. Milne–Edwards, 1864); mientras que en la parte fluvial se observó junto con M. occidentale, M. americanum, M. acanthochirus, M. diguetti, A. margaritacea y P. glabra.
Por su parte Holthuis (1952b) menciona que L. stylirostris (Stimpson, 1874) ha sido encontrado junto con M. tenellum en aguas dulces, a distancias considerables del mar. Gelin y Gravez (2002), en su estudio sobre el conocimiento y conservación de las lagunas costeras de la Islas Galápagos, identificaron a M. tenellum junto con peces como Chanos chanos (Forsskål, 1775), Mugil galapagensis (Ebeling, 1961), Gerres cinereus (Walbaum, 1792), Lutjanus jordani (Gilbert, 1898), Centropomus nigrescens (Günther, 1864), Dormitatorlatifrons(Richardson, 1844), D. maculatus (Bloch, 1792) y Eleotris picta (Kner, 1863), y crustáceos como M. americanum, algunos ostrácodos y amphipodos, y moluscos como Ellobium stagnalis; Orbigny, 1835.
CARACTERES SEXUALES Y REPRODUCCIÓN
Existe un marcado dimorfismo sexual en la especie y es posible identificar los sexos visualmente cuando son adultos (Román–Contreras, 1979; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988; Lara, 2003). En formas juveniles, es posible identificar el sexo a partir de los 10 mm, para lo que se utilizan caracteres constantes tales como la posición del gonoporo, el apéndice masculino y el punto duro del primer somito abdominal de los machos (Guzmán–Arroyo, 1987).
Cabrera (1983) propone un carácter práctico para el dimorfismo sexual con el cual, a través de características macroscópicas, se puede diferenciar el tamaño de la pleura del segundo segmento abdominal, la cual es significativamente mayor (p < 0.025) en las hembras que en los machos, y esta diferencia se hace más marcada al aumentar la longitud del cefalotórax.
Los machos tienen un segundo par de pereiópodos muy desarrollados, tan grandes como el cuerpo del organismo (Román–Contreras, 1979; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988), aunque existen ejemplares machos que presentan los segundos pereiópodos de tamaño desigual, generalmente el pereiópodo izquierdo es el de menor tamaño (Román–Contreras, 1979). El cefalotórax es más ancho en proporción al resto del cuerpo y cuenta con un gonoporo en la base del quinto par de coxopoditos. En los machos, los coxopoditos están alineados en líneas paralelas (Figura 5) y el apéndice masculino se presenta en el endopodito del segundo par de pleópodos. Mientras que en las hembras, el segundo par de periópodos es similar al resto y el gonoporo se encuentra en la base del tercer par de coxopoditos (Román–Contreras, 1979; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988).
En las hembras, la alineación de los coxopoditos es en forma de cono, con la parte más amplia hacia el abdomen (Figura 6), las placas tergolaterales (pleuras) son de mayor tamaño, a medida que éstas maduran sexualmente se hace notoria su pigmentación y se observa la presencia de sedas ovígeras (vellosidades) en el endopodito y exopodito de los pleópodos (Guzmán–Arroyo, 1987). Las hembras recién desovadas se diferencian fácilmente de las otras porque presentan el abdomen más ancho y las pleuras del primer al cuarto segmento abdominal extendidas a manera de cuchara, lo que proporciona mayor volumen a la región ventral (Román–Contreras, 1979).
Las gónadas se pueden observar a través de la parte dorsal del cefalotórax. En los machos la gónada es de color marrón, mientras que en las hembras presenta un color verde olivo (Guzmán–Arroyo, 1987).
La talla reportada para que las hembras alcancen su madurez sexual es desde los 30 mm; las tallas más comunes van de los 45 a los 62 mm, aunque pueden presentarse hembras maduras hasta los 97 mm (Guzmán et al., 1981; Guzmán–Arroyo, 1987; Ruíz–Santos, 1988; Ponce–Palafox et al, 2002). En ambiente natural, se observan hembras ovígeras entre los 56 a 101 mm, mientras que bajo condiciones controladas se han encontrado hembras con huevecillos en el abdomen, de longitudes entre 46 y 50 mm (Román–Contreras, 1979; Guzmán–Arroyo, 1987). Según las condiciones ambientales, la población varía en su tamaño medio, el cual aparece íntimamente ligado con el tamaño en que las hembras alcanzan su madurez sexual (Guzmán–Arroyo, 1987).
Con relación a la alimentación, García–Ulloa et al. (2004) sugieren un requerimiento de proteína por debajo de 35% para la maduración, desarrollo gonadal y desove de esta especie.
Guzmán (1975, 1976, 1977) desarrolló una escala de madurez sexual para hembras de M. tenellum (Tabla 2), que se aplica bajo el supuesto de que los fenómenos biológicos y fisiológicos ocurren de manera similar en los machos para que, al llegar la época de reproducción, ambos sexos concurran simultáneamente en el desarrollo y madurez gonadal. Esta escala también es aplicable a otras especies de langostinos como M. acanthurus, M. americanumo M. carcinus (Guzmán–Arroyo, 1987).

La proporción sexual de M. tenellum en la naturaleza varía con la temporada y localidad. Por ejemplo, Guzmán et al. (1981) y Guzmán–Arroyo (1987) registraron una proporción de 1 hembra: 1 macho en lagunas costeras de Guerrero, México. Para la misma zona, Román–Contreras (1979) encontró una proporción sexual de 1:1 en el mes de agosto, cuando aumenta el número de hembras ovígeras, mientras que en los meses de mayo a julio (cuando los individuos alcanzan mayor desarrollo), la proporción de sexos registró disparidad. Por su parte, Pérez–Velázquez et al. (2006a) mencionan que en Nayarit, México, la proporción de sexos fue similar, aunque para el mes de octubre predominaron los machos y, de manera similar a los anteriores autores, observaron que el mayor número de hembras reproductivas se obtuvo en julio (70% con huevecillos, 30% recién eclosionadas). De acuerdo a los trabajos mencionados, se puede apreciar que el número de hembras aumenta durante la temporada reproductiva y la de machos fuera de ella (Guzmán et al., 1981), mientras que la proporción de sexos está siempre a favor de los machos (Román–Contreras, 1979). Sin embargo, en el estudio realizado por Signoret y Brailovsky (2002) en la laguna costera de Coyuca de Benítez, Guerrero, México, se concluyó que la proporción fue dos hembras por macho.
La proporción esperada de hembras maduras y ovígeras se puede establecer con relación a las condiciones de temperatura, precipitación y salinidad, observándose las mayores correlaciones de las hembras maduras con la temperatura y precipitación, estableciendo que a mayor temperatura y precipitación, mayor grado de madurez en las hembras; mientras que por otro lado, entre menor sea la salinidad en el agua, existirán más hembras ovígeras (correlación negativa). Al parecer, la respuesta de los ciclos de maduración de M. tenellum concuerda más con las variables ambientales regionales que con las locales (Guzmán et al., 1981).
En las lagunas costeras el periodo de reproducción es bien definido, lo cual coincide con la disminución de la salinidad, la temperatura y la abundancia de detritus acarreados por los afluentes de agua dulce; dicho fenómeno marca el inicio de los movimientos migratorios de adultos hacia las áreas de reproducción (Román–Contreras, 1979), coincidiendo con la temporada de lluvias (Guzmán–Arroyo, 1987; Ruíz–Santos, 1988). Aunque en general M. tenellum se puede reproducir durante gran parte del año (Román–Contreras, 1979).
Las hembras sexualmente maduras mudan antes del apareamiento (Román–Contreras, 1979), mostrando un comportamiento similar al descrito para otras especies como Cryphiops caementarius (Molina 1872). Existen cuatro fases en las cuales se presenta el cortejo, apareamiento e impregnación (Tabla 3) (Guzmán–Arroyo, 1987).

Después del apareamiento, las hembras colocan los huevecillos en las sedas de los pleópodos, dentro de una cavidad incubadora bajo el abdomen, formada por las proyecciones laterales de las pleuras. Los huevos quedan adheridos a los pleópodos por medio de secreciones producidas por glándulas cementantes (Guzmán–Arroyo, 1987).
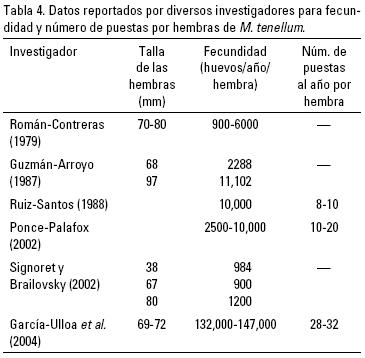
En la Tabla 4 se muestra el número de puestas por año y huevecillos por puesta, reportados por diversos investigadores para M. tenellum. Guzmán–Arroyo (1987) menciona que existe una cierta relación entre las variables longitud de la hembra–número de huevecillos, y peso de la hembra–número de huevecillos, siendo mayor con el peso que con la longitud, y que dicha relación varía con la fecha y con el estadio de desarrollo del huevecillo. Aunque Román–Contreras (1979) apuntó que el número de huevecillos de M. tenellum no está relacionado con la longitud total de la hembra, sino que existen amplias variaciones con rangos que fluctúan entre 900 y 10,800 huevecillos, y que este número varía según el mes.
DESARROLLO EMBRIONARIO
Para M. tenellum se ha reportado una duración del desarrollo embrionario de 16 a 17 días, tanto para hembras ovígeras capturadas en el medio silvestre como para aquellas mantenidas en condiciones controladas de laboratorio (Guzmán–Arroyo ,1987; Ruíz–Santos, 1988; Ponce–Palafox et al., 2002).
Durante el desarrollo embrionario, la hembra manifiesta un marcado cuidado de los huevecillos que consiste en la limpieza sistemática, mediante el uso del primer par de pereiópodos, descartando los muertos. Aunado a esto, muestra un constante movimiento de los pleópodos para mantener una circulación del agua y oxigenación en torno a los huevecillos (Guzmán–Arroyo, 1987).
Los huevecillos de M. tenellum son de forma elíptica con un diámetro promedio de 0.55 mm (Román–Contreras, 1979; Guzmán–Arroyo, 1987; Ponce–Palafox et al., 2002). García–Ulloa et al. (2004) reportaron un diámetro de los huevecillos de 475 a 575 um, volumen promedio de 57 um3 y peso seco individual promedio de 32 ug. Por otro lado, Román–Contreras (1979) encontró un rango de 443 a 617 um de diámetro para la misma especie.
Al inicio del desarrollo embrionario se observa la segmentación holoblástica desigual, alcanzando el estado de 8 blastómeros a las 4 horas, de 16 blastómeros a las 6.5 horas y la formación de la mórula con 32 blastómeros en la siguiente división; el blastoporo se detecta 32 horas después de la tercera división (Guzmán–Arroyo, 1987).
A medida que evoluciona el desarrollo embrionario, los huevecillos presentan cambios en su coloración, mismos que coinciden con etapas bien definidas del crecimiento del embrión (Guzmán–Arroyo, 1987). Guzmán et al. (1978) elaboró una escala de color para huevecillos de M. tenellum colectados en cuerpos de agua de Guerrero, México, mediante experiencias de campo y laboratorio: Estadio A, verde, contenido homogéneo; Estadio B, verde amarillo, polo visible; Estadio C, amarillo, estructuras visibles; y Estadio D, marrón, embrión oculado.
Observaciones similares a esta escala de desarrollo embrionario han sido descritas por otros investigadores que han mencionado que cuando los huevecillos son frescos, su coloración también puede ser amarillo brillante, anaranjados cuando están en desarrollo intermedio a dos o tres días de la eclosión, verde oliváceos cuando están en estado avanzado de desarrollo y café cuando están listos para eclosionar (Román–Contreras, 1979; Avendaño, 1994).
Se ha registrado que es posible encontrar dos estadios de desarrollo embrionario en una misma puesta, que indica que dicho proceso es cronológicamente diferencial, es decir, se puede apreciar en una masa ovígera, óvulos fecundados con vitelo uniformemente distribuidos, hasta huevecillos con embriones bien desarrollados y con ojos perfectamente visibles; también es posible encontrar estadios intermedios en algunas hembras, pero son menos frecuentes (Román–Contreras, 1979; Guzmán–Arroyo, 1987).
De manera simultánea al desarrollo embrionario, la hembra desarrolla también su gónada nuevamente, y muy poco tiempo después de la eclosión de las larvas, está en posibilidades de volver a mudar y reproducirse (Guzmán–Arroyo, 1987). Cumplido el tiempo de desarrollo embrionario, la eclosión inicia después de 24 a 48 horas, dando paso al nacimiento, que ocurre al atardecer y en las primeras horas de la noche (siempre en agua salobre) (Guzmán–Arroyo, 1987; Ponce–Palafox et al., 2002). En los desoves de hembras no fecundadas, los huevecillos son fijados, pero al cabo de unos días se desprenden (Guzmán–Arroyo, 1987).
Etapa larvaria. Esta etapa tiene una duración de 24 días durante los cuales las larvas demuestran hábitos preferentemente nocturnos (Cabrera et al., 1979; Ruíz–Santos, 1988; Ponce–Palafox et al., 2002). Las larvas de M. tenellum pasan de 8 a 11 fases bien definidas antes de la metamorfosis, y su crecimiento larval se logra a través de 12 mudas (Cabrera et al., 1979; Ponce–Palafox et al., 2002), las seis primeras corresponden a estadios morfológicos. No se han observado diferencias aparentes en las últimas mudas (Cabrera et al., 1979).
En sus primeras etapas, las larvas son prebentónicas o nadadoras y desarrollan necesariamente esta parte de su ciclo de vida en aguas salobres, por ello prefieren aguas con salinidad aproximada de 12 a 18 ups, con poca turbidez y temperaturas medias; mientras que en etapas más avanzadas prefieren condiciones limnéticas con aguas más turbias, de mayor pH, bajas concentraciones de oxígeno, temperatura, salinidad y alcalinidad que las encontradas en lagunas costeras, lo cual representa el preámbulo para el inicio de sus futuras vidas en aguas dulces, particularmente en ríos (Guzmán–Arroyo, 1987; Ruíz–Santos, 1988; Avendaño, 1994; Ponce–Palafox et al., 2002).
RECLUTAMIENTO Y ABUNDANCIA
Después de la etapa larvaria, al adquirir hábitos bentónicos, se lleva a cabo el reclutamiento como postlarvas y juveniles (Cabrera et al., 1979; Guzmán–Arroyo, 1987). Román–Contreras (1979) menciona que en las lagunas costeras de Guerrero, México, el reclutamiento se presenta en invierno y parte de la primavera. Ruiz–Santos (1988) reportó que el reclutamiento en la laguna de Tres Palos, Guerrero, México, se efectúa entre los meses de enero a marzo, cuando los langostinos alcanzan una talla de 22.5 mm. En este sentido Guzmán–Arroyo (1987) estimó que el reclutamiento por unidad de área en esta misma laguna, fue de 59.5 organismos/ m2, mientras que el número por unidad de área del reclutamiento a la etapa juvenil, fue de 18.6 org/m2.
La mayor abundancia se observó a mayores temperaturas en el ambiente y en el agua (Ruíz–Santos, 1988). Román–Contreras (1979) reportó la mayor abundancia y tallas en los meses de junio a octubre en lagunas costeras de Guerrero, México. Guzmán–Arroyo (1987) coincide con lo anterior y también menciona que las hembras superaron en número a los machos, aunque estos presentaron una mayor distribución espacial. Por su parte, Pérez–Velázquez et al. (2006b) reportaron en el Río Ameca menor abundancia de M. tenellum y una proporción sexual mayor a favor de los machos. A través de datos de biomasa total, se ha determinado que el ciclo de vida de M. tenellum es de 16 a 17 meses.
CRECIMIENTO Y METABOLISMO
El crecimiento que presentan los langostinos durante toda su vida está limitado por el número de mudas que un ejemplar puede experimentar en un periodo anual. Este fenómeno está restringido a su vez por las condiciones ambientales predominantes (Román–Contreras, 1979). El crecimiento máximo es alcanzado a los cinco meses de edad para las hembras y seis meses para los machos, lo que coincide con la llegada a la madurez sexual (Guzmán–Arroyo, 1987; Ruíz–Santos, 1988). Los machos alcanzan tallas más grandes (7.3% mayor) en el mismo periodo de crecimiento y hasta en tiempos más cortos que las hembras (Román–Contreras, 1979; Ruíz–Santos, 1988; Espino–Barr et al., 2006). Considerando lo anterior, Ruíz–Santos (1988) elaboró las siguientes ecuaciones de crecimiento para machos y hembras:
Machos: Longitud en el tiempo
t = 142.14 (1– exp [–0.3035(t–0.4183)]),
Hembras: Longitud en el tiempo
t = 115.07 (1– exp [–0.2273(t–0.0154)]),
Se ha sugerido que la tasa de crecimiento de este organismo está asociada a la cantidad de oxígeno disuelto presente en el medio acuático, mientras que parámetros como la temperatura, precipitación y pH, determinan las fluctuaciones de la densidad y la biomasa (Ruíz–Santos, 1988). Aunque dependiendo de las condiciones medioambientales, M. tenellum varía en su tamaño y peso medio (Tabla 5). Por ejemplo, los individuos de las poblaciones riparias tienden a ser de mayor tamaño que las que viven en lagunas costeras (Guzmán–Arroyo, 1987). Las diferencias en número o tamaño son dadas por la ecología local (Guzmán et al., 1981).

También se ha mencionado que la tasa de crecimiento de M. tenellum mantiene una relación inversa con la temperatura ambiente y precipitación, lo que a su vez influye sobre la temperatura del agua y la salinidad; así mismo la profundidad y nivel del agua son otros factores que afectan el crecimiento de los langostinos (Ruíz–Santos, 1988). Por otro lado, Román–Contreras (1979) estableció que el tamaño de los organismos está relacionado con el gradiente de salinidad.
Por su parte, Cuevas–Félix (1980) elaboró las ecuaciones de crecimiento con base en la concentración de oxígeno disuelto en el agua, que describen la relación del peso y el consumo del oxígeno total (O2 = 0.16 X0.62), y la relación del oxígeno y del peso específico (O2 / X = 0.16X–038), a una temperatura de 25 °C, en una concentración de oxígeno de 5–6 mg O2 / L y trabajando con machos de 1–5 g. Concluyó que los machos con promedio de peso de 2.78 ± 1.07 g consumen 0.134 ± 0.035 mg O2 g–1 h–1.
La tasa de consumo de oxígeno puede considerarse una respuesta del tipo II, propuesto por Kinne (1971), en la que el metabolismo respiratorio se incrementa a salinidades bajas, disminuyendo hasta mantenerse constante en salinidades intermedias (12 y 17%), donde se registran los valores mínimos, y se incrementa de nueva cuenta a mayores salinidades.
En M. tenellum, la concentración osmótica de la hemolinfa permanece constante alrededor de 531 mmol kg–1, lo que significa que es un fuerte hiper–hipo–osmoregulador, con un punto isosmótico de 533 mmol kg–1 lo cual apunta a que es una especie que recientemente invadió el ambiente dulceacuícola (Aguilar–Juárez, 1995; Aguilar et al., 1998).
Signoret–Poillon y Soto (1997) encontraron en su estudio del comportamiento osmoregulador de M. tenellum y M. acanthurus a diferentes salinidades, que la presión osmótica interna promedio de los organismos en agua dulce, fue de 419 ± 10.3 mmol kg–1, mientras que en un rango de 0 a 20 ups —como hiper–regulador— su punto isosmótico fue de 640 mmol kg–1. A mayores salinidades, M. tenellum se vuelve hipoconformador, lo cual corresponde al comportamiento de un organismo eurihalino (Aguilar–Juárez, 1995). La salinidad máxima tolerada por M. tenellum fue de 28 ups (Signoret–Poillon & Soto, 1997).
Aguilar–Juárez (1995) reporta que la tasa de excreción nitrogenada del M. tenellum se mantiene constante en respuesta a variaciones de salinidad, y que al parecer, la excreción de amonio se realiza por difusión pasiva y no por la presencia de bombas de intercambio activo Na+/NH4+. También menciona que en presencia de agua dulce y medios ligeramente salinos, este langostino cataboliza una mezcla de lípidos y carbohidratos, pero al incrementar la salinidad del medio hasta los 12–17 ups, las proteínas se vuelven su principal sustrato energético cediendo su lugar a la mezcla de lípidos y carbohidratos cuando se alcanzan salinidades de 22 a 27 ups.
La etapa de crecimiento de juvenil a adulto del M. tenellum, se desarrolla en aguas dulces (Avendaño, 1994; Aguilar et al., 1998). Durante su retorno al agua dulce, las postlarvas encaran un esfuerzo en el incremento metabólico y disminuyen su consumo de oxígeno, que después se estabiliza. Con relación a su comportamiento respiratorio, es destacable la adaptación para penetrar y desarrollar una completa existencia en el agua dulce (Aguilar–Juárez, 1995; Aguilar et al., 1998).
Los rangos óptimos de calidad de agua para langostino se presentan con un pH de 7 a 8.5 (Navarro–Hurtado, 2002), mostrando una preferencia térmica de 28 °C y con un intervalo de 27 a 30.6 °C. Los valores de la temperatura letal incipiente superior puede llegar a ser hasta los 43 ± 0.4 °C (Hernández et al., 1995; Hernández–Rodríguez, 1994; Hernández et al., 1996). El intervalo preferencial de temperaturas seleccionadas por M. tenellum puede ser utilizado como un criterio a fin de localizar zonas adecuadas para su cultivo, además, la variación diaria y estacional de los factores ambientales determina su distribución y abundancia en el hábitat (Hernández–Rodríguez, 1994; Hernández et al., 1995).
El índice de mortalidad disminuye y la expectativa de vida crece a medida que el organismo arriba a la etapa adulta (Guzmán–Arroyo, 1987), ya que las tasas instantáneas de mortalidad son mayores en los jóvenes, disminuyen en las hembras, y los machos presentan los valores más bajos.
ALIMENTACIÓN
Tanto el tipo de alimento como la estrategia de alimentación representan factores de vital importancia en el aporte de la energía necesaria para el adecuado desarrollo y crecimiento de organismos acuáticos (Vega–Villasante & Chong, 2006), lo cual se refleja en el crecimiento de los animales en cultivo (Jayachandran, 2001) . Se ha reportado que en la naturaleza, los estadios larvales de M. tenellum consumen fitoplancton y zooplancton como principales fuentes de alimento (Guzmán–Arroyo, 1987). Por otro lado, los adultos presentan hábitos omnívoros y detritívoros, con un amplio espectro trófico; consumen insectos, larvas, vegetales, pequeños crustáceos y moluscos, anélidos, detritus orgánico, restos de organismos y semillas (Goodyear et al., 1976; Guzmán–Arroyo, 1987) y pueden llegar al canibalismo (Holthuis 1980; Hendrickx, 1995; New, 2000).
En el medio natural salen al atardecer principalmente para alimentarse, pues son de hábitos nocturnos (Avendaño, 1994; Arroyo–Renteria & Magaña–Ríos, 2001; Ponce–Palafox et al., 2002) .
Bajo condiciones de laboratorio, Avendaño (1994) recomienda los nauplios de Artemia (Leach, 1819) para la alimentación de las larvas en sus primeros días. Se ha observado que en cautiverio aceptan el alimento artificial (Guzmán–Arroyo, 1987), así como cladóceros y larvas de culícidos (Ponce–Palafox et al., 2002). García–Ulloa et al. (2008) encontraron que es posible sustituir totalmente la harina de pescado por harina de soya de su dieta elaborada sin afectar el crecimiento de los organismos.
La ración diaria de alimento pueden ajustarse desde 10 hasta 3% del peso corporal en la etapa de engorde (Ponce–Palafox et al., 2002). Avendaño (1994) recomienda ajustar las ración de acuerdo al peso de los langostinos: para organismos de 5 a15 g, el suministro de alimento correspondería al 3.2% de la biomasa total por estanque; 2% cuando los animales alcanzan 16–25 g de peso promedio; y 1.41% de 26 g en adelante, repartiéndola en una o dos alimentaciones diarias (entre las 5:00 y 6:00 hrs y/o a las 17:00 hrs). Dicha estrategia alimenticia genera un factor de conversión alimenticia de 1:1.8 a 1:2.3 (Avendaño, 1994).
Guzmán–Arroyo (1987) indica que las necesidades nutricionales de esta especie son de 29% de proteína, 37% de carbohidratos, 28% de grasas y 5% de vitaminas. El requerimiento de proteína es mayor en las etapas larvarias y juveniles. Pese a los esfuerzos realizados hasta la fecha con relación al estudio de la nutrición de M. tenellum, aún no se conocen de manera exacta los requerimientos para cada una de sus etapas.
ENFERMEDADES, PARÁSITOS Y PREDADORES
Las enfermedades, parásitos, depredadores y competidores son factores importantes que influyen en la producción del langostino cultivado y en las poblaciones naturales de M. tenellum. Cuando en los estanques se presentan condiciones adversas (altas densidades de organismos, exceso de alimento o problemas de calidad de agua), es posible registrar considerables pérdidas (Ponce–Palafox et al., 2005).
De acuerdo con Ponce–Palafox et al. (2005), los factores adversos al cultivo de la especie en estanques rústicos pueden ser (por orden de importancia): baja concentración de oxígeno en los estanques causando anoxia; enfermedades nutricionales (principalmente falta de proteína en la dieta, aún no determinado); enfermedad del caparazón (iniciada generalmente por daños mecánicos en el caparazón, seguida por ataque de bacterias y/o hongos, no necesariamente mortal); enfermedad de la mancha negra; Isópodos Bopíridos; huevos de insectos; músculo blanco (por estrés de altas densidades, temperaturas extremas, etc.); oscurecimiento de branquias (problemas de calidad de agua); coloración roja (dada por alta intensidad de luz, dietas deficientes y estrés); protozoarios y crecimiento de algas.
La falta de oxígeno o anoxia ha sido reconocida como la causa más importante en la mortalidad de este langostino en las granjas acuícolas. Esta condición empieza cuando las lecturas del oxígeno disuelto al amanecer se encuentran alrededor de 3 mg/L —o menos— por varios días consecutivos y la transparencia mediante el disco de Secchi registra valores menores de 20 cm. Esta problemática es causada por el aumento drástico en las comunidades de microalgas de los cuerpos de agua naturales o de sistemas de producción, mismas que impiden el adecuado funcionamiento de las branquias y al mismo tiempo, causan bajas concentraciones de oxígeno, principalmente por la noche (Mac–Gibbon, 2008). Se ha observado que como un comportamiento de estrés pre–crisis, los organismos se agrupan a las orillas de los estanques. La mortalidad del langostino se da principalmente en aquellos animales que han mudado recientemente o se encuentran dañados. La hipoxia en los estanques de cultivo ocurre por lo general después de una mortandad masiva de fitoplancton ya que provocan un incremento en la demanda bioquímica de oxígeno (Ponce–Palafox et al., 2005). Debido a lo anterior, se recomienda que el disco Secchi debe marcar de 30 a 40 cm de transparencia (Arboleda–Obregón, 2006).
Los insectos acuáticos pueden llegar a ser un problema, ya que en langostinos adultos se han encontrado múltiples y pequeñas estructuras de consistencia coriácea que se presentan como cadenas dobles o triples sobre el exoesqueleto del animal que presumiblemente, corresponden a huevecillos de estos invertebrados (Román–Contreras, 1979). De igual manera, en los estanques bajos y con mal manejo, se ha identificado sobre los langostinos, un parásito que se conoce comúnmente como pupa (Tricoricea) (Avendaño, 1994).
Existen isópodos parásitos del género Probopyrus que afectan frecuentemente al género Macrobrachium (Figura 7). Entre las especies conocidas se encuentran P. oviformis(Nierstrasz & Brender a Brandis, 1932), P. panamensis (Richardson, 1912), P. papaloapanesis (Rioja, 1948) y P. pandalicola (Packard, 1879) (Román–Contreras, 1979; Guzmán & Román, 1983; Guzmán–Arroyo, 1987; Román–Contreras, 1991; Arroyo–Renteria y Magaña–Ríos, 2001). La mayor abundancia del parásito se presenta en localidades con altos problemas de alteración humana (contaminación de las aguas por efluentes domésticos e industriales) (Guzmán & Román, 1983).
En general, la época del año con mayor incidencia de este parásito, corresponde a la época de secas y en las tallas medias de los langostinos, poco antes del inicio de las lluvias, cuando las condiciones medioambientales son más críticas debido a temperaturas y salinidades más elevadas (Guzmán & Román, 1983; Guzmán–Arroyo, 1987; Román–Contreras, 1991).
P. pandalicola se localiza en el langostino sobre la superficie media de los branquiostegos (Ponce–Palafox et al., 2005) alojándose en la cavidad branquial sin presentar una preferencia lateral (Guzmán & Román, 1983; Guzmán–Arroyo, 1987). En condiciones naturales se ha reportado una incidencia del 17% (Román–Contreras, 1991) y en poblaciones bajo cultivo hasta un 30% (Ponce–Palafox et al., 2005). La presencia del parásito sugiere su incidencia en el huésped en edades tempranas y se hace más evidente cuando alcanzan entre los 20 a 30 mm. Las tallas donde se han encontrado organismos parasitados fluctúan de 28 a 67 mm, con un promedio de 45.2 mm. El reporte del tamaño máximo de un langostino parasitado ha sido entre los 60 y 70 mm, lo que puede explicar la expectativa de vida de los organismos parasitados en torno a este límite. Sin embargo, en periodo de lluvias se ha reportado la presencia del parásito en organismos de tallas mayores (Guzmán & Román, 1983; Guzmán–Arroyo, 1987; Román–Contreras, 1991).
Guzmán–Arroyo (1987) encontró una preferencia de P. pandalicola por las hembras, en una proporción 4.24:1. Mientras que Arroyo–Renteria y Magaña–Ríos (2001) observaron que afectó más a los machos que a las hembras. Esta contradicción puede deberse a factores naturales y condiciones externas de cada sistema en el cual se encontraban los organismos. En cultivo, se ha sugerido el incremento de la salinidad como medida profiláctica y sanitaria para controlar dicho parásito desde sus etapas iniciales (Guzmán–Arroyo, 1987).
P. pacificensis (Román–Contreras, 1993) tiene también como huésped definitivo a M. tenellum, y su distribución registrada es desde el sur de Nayarit, Jalisco, Michoacán y Guerrero (Ocaña–Luna et al., 2009). Signoret y Brailovsky (2002), reportaron que en la laguna de Coyuca de Benítez, Guerrero, el 53% de la población portaba este parásito. Por su parte, Ocaña–Luna et al. (2009) capturaron langostinos entre 57 y 64 mm, con isópodos de ambos sexos en uno de los costados del cefalotórax.
Lara (2003) concluyó que no existe aún evidencia que los metales pesados constituyan un factor de riesgo ecológico en el M. tenellum debido a las bajas concentraciones encontradas en el cuerpo del langostino; pero a su vez, reportó que esta especie registró concentraciones corporales considerablemente mayores de metales pesados en comparación con M. americanum, y que es a través de la adsorción superficial como principalmente llegan a ellos. De igual manera, determinó que las hembras acumulan más metales pesados en sus tejidos que los machos, y que esto se observa a la par, con más frecuencia en los individuos pequeños que en los grandes.
Por otro lado, un factor importante en la disminución y/o control de las poblaciones naturales son los depredadores, entre los cuales destacan las gaviotas grises y blancas (Larus modestus Shudi, 1843, y L. dominicanus Lichtenstein, 1823 ), la huaca (Nycticorax nycticorax Linnaeus, 1758), las garzas (Ardea egretta Gmelin, 1789, y A. candidisima Molina, 1782), al martín pescador (Chloroceryle americana Gmelin, 1788), patos, jaibas, peces como la lisa y los chihuiles (Román–Contreras, 1979) y los neonatos de cocodrilo (Crocodylus acutus Cuvier, 1807) (Cupul–Magaña et al., 2008).
APROVECHAMIENTO: PESCA Y ACUICULTURA
En México, se explotan fundamentalmente cuatro especies del género Macrobrachium, dos en los ríos y lagunas costeras del Golfo de México, M. carcinusy M. acanthurus,y dos en el Pacífico, M. americanum y M. tenellum. Este último es una especie de importancia pesquera comercial en las comunidades a lo largo de su distribución natural, por lo que existe la necesidad de generar la información necesaria para su cultivo (Boschi, 1974; Guzmán–Arroyo, 1987; New, 1988; Román–Contreras, 1991; Espino–Barr et al., 2006; Hernández–Sandoval, 2008).
Su importancia económica se basa en su utilización como alimento (Goodyear et al., 1976; Cabrera, 1983). Es sujeto de pesca tradicional en las poblaciones ribereñas de ríos y lagunas costeras en muchas zonas de México, El Salvador y Guatemala (Cabrera, 1983), y se aprovecha para el autoconsumo o para su venta local (Espino–Barr et al., 2006). Los langostinos son un recurso pesquero alternativo de temporada que cobra cada vez mayor interés económico por parte de los pescadores locales (Pérez–Velázquez et al., 2006b), aunque en algunas ocasiones puede estar en segundo término, si se considera que se captura junto con M. americanum (Espino–Barr et al., 2006).
Los langostinos de la especie M. tenellum, aparecen ocasionalmente en mercados locales, regionales y centro turísticos; son ofrecidos temporalmente en restaurantes, se consumen frescos o cocidos y pueden utilizarse como carnada (Román–Contreras, 1991; Hendrickx, 1995; Arzola–González & Flores–Campaña, 2008). Tiene una demanda menor para el consumo comparado con M. americanum (Arroyo–Renteria & Magaña–Ríos, 2001).
Se distinguen dos formas básicas para el aprovechamiento del género M. tenellum, una es la pesca y la otra es la acuícultura. Ambas se realizan tanto en áreas naturales (ríos, estuarios y lagunas costeras), como en artificiales (presas, bordos y canales) y especiales (estanques artificiales) (Guzmán–Arroyo, 1987).
El langostino soporta una intensa pesquería artesanal en ríos y lagunas costeras, constituyendo un importante renglón económico en su área de distribución por volumen de extracción y por la extensión de esta área (Guzmán–Arroyo, 1987). Usualmente, su pesquería se desarrolla en muchas de las comunidades rurales de la costa del Pacífico (Hernández–Sandoval, 2008). Pese a ello, M. tenellum es una especie de importancia comercial secundaria en México y El Salvador (Hendrickx, 1995), de la cual no se tienen estadísticas de captura oficiales (Guzmán–Arroyo, 1987). Sin embargo, se considera una pesquería bien establecida, ya que se practica regionalmente y además se complementa con otras actividades (Arroyo–Renteria & Magaña–Ríos, 2001; Espino–Barr et al., 2006), y una pequeña parte de su producción se exporta (Arzola–González & Flores–Campaña, 2008).
Guzmán (1987) mencionan que desde 1964 hasta 1985, su producción en México aumentó de 400 a 2600 toneladas. Existen cuerpos estuarinos en donde sus poblaciones se han visto mermadas por una sobreexplotación debido a su pesca y consumo local (Signoret–Poillon & Soto, 1997); por lo anterior, se considera que la especie y sus hábitat pudieran alcanzar niveles de riesgo debido a factores como la presión de pesca, asentamientos humanos, contaminación y los cambios en aportes fluviales (Espino–Barr et al., 2006). Por su parte, Sánchez–Granados (2008) menciona que este tipo de proyectos proporcionan ciertas bondades y capacidad para la conservación de la especie beneficiando a las comunidades asentadas en las riberas de los ríos al proporcionarles alimento rico en proteína y proveer la información necesaria para detener los métodos de explotación irracional de esta y otras especies.
En lagunas costeras del Pacífico mexicano, M. tenellumpresenta poblaciones numéricamente superiores a otras especies comerciales; su captura es relativamente fácil, y en ocasiones se realiza junto con camarones peneidos (Ruíz–Santos, 1988; Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Arzola–González & Flores–Campaña, 2008). Esto se debe a que el camarón y el langostino se presentan alternadamente en el ciclo anual, mostrando una abundancia inversamente proporcional entre uno y otro (Guzmán–Arroyo, 1987).
La pesca de esta especie se intensifica en las épocas de lluvias que en México se dan entre los meses de julio a septiembre y hasta octubre (Ruíz–Santos, 1988; Arroyo–Renteria & Magaña–Ríos, 2001; Pérez–Velázquez et al., 2006b). Durante las primeras avenidas del río es cuando se obtienen cantidades considerables de estos organismos, mientras que escasea en los meses siguientes (Arroyo–Renteria & Magaña–Ríos, 2001), con una disminución considerable del recurso en los meses de invierno y a mediados del periodo de seca (Román–Contreras, 1979). Las tallas predominantes capturadas fluctúan de 50 a 80 mm en las hembras, y de 55 a 110 mm en los machos, lo cual está asociado a un considerable aumento de la biomasa y del número de individuos, registrando que las tallas más grandes se capturan a partir del séptimo mes (Ruíz–Santos, 1988). Durante 1991, en el río Baluarte, Sinaloa, México, el 23.5% de los langostinos capturados correspondió a M. tenellum, representando el tercer recurso en importancia de las siete especies de Macrobrachium capturadas regularmente (Arroyo–Renteria & Magaña–Ríos, 2001).
El langostino se pesca por métodos artesanales. Las formas directas de captura son la manual, con haces de ramas, con redes tipo cuchara, arpones o fisgas y atarrayas, mientras que en su captura indirecta se utilizan nasas, aros, trampas cónicas o tapesco, trapos y un colador de fabricación artesanal que se coloca en la salida de los tapos; esta última tiene baja selectividad y alta eficiencia de captura (Guzmán–Arroyo, 1987; Román–Contreras, 1991; Pérez–Velázquez et al., 2006). Los artes de pesca más empleados son la atarraya (Hendrickx, 1995; Arroyo–Renteria & Magaña–Ríos, 2001; Pérez–Velázquez et al., 2006), el chinchorro y la red de arrastre; estas dos últimas tienen un factor promedio de selectividad de 74.2 mm y de 58.3 mm respectivamente, usando una malla de 10 mm; la diferencia del factor está dado por la profundidad de operación de las redes (Guzmán–Arroyo, 1987).
El gobierno mexicano establece en la Norma Oficial Mexicana NOM–009–PESC–1993, una veda de pesca para M. americanum y M. tenellum en aguas continentales de jurisdicción federal del océano Pacífico, para proteger a estas especies durante la temporada de desove y reproducción, que comprende del 1 de agosto al 31 de octubre (Norma Oficial Mexicana, 1994). Guzmán–Arroyo (1987) comenta que los ciclos de captura del langostino dependen de los ciclos de precipitación inmediatos, disminuyendo su pesca cuando aumenta la precipitación por las condiciones climáticas y por la selectividad de las artes de pesca como la atarraya, el chinchorro y la red de arrastre, que por la luz de su tejido pueden permitir la pesca de solo un estrato de la población y dejar al resto.
Dentro de la escala potencial en la acuicultura, M. tenellum es considerado dentro de un nivel alto, esto sobre especies grandes de tipo ripario como M. americanum y M. carcinus (Guzmán–Arroyo, 1987), ya que se encuentran altas densidades en condiciones naturales (Ponce–Palafox et al., 2006), debido a que soporta amplios intervalos de las variables ambientales (Aguilar–Juárez, 1995), tiene una gran capacidad de adaptación al medio ambiente, un rápido crecimiento, acepta una amplia variedad de alimentos y posee características gregarias, compensado su menor tamaño con su volumen de producción (Guzmán–Arroyo, 1987). Después de la disminución y cierre de proyectos del cultivo de langostino malayo M. rosenbergiien México, se contempló la posibilidad de intensificar los estudios orientados a la domesticación y producción en estanques de las especies de langostino nativas como M. tenellum lo cual es necesario debido a su importancia biológica, ecológica, acuícola y comercial (Ponce–Palafox et al., 2002).
Los sistemas de cultivo son de varios tipos: extensivo, semi–intensivo e intensivo (Guzmán–Arroyo, 1987); en cualquiera de ellos se deben realizar dos ciclos por año para amortizar la inversión (Avendaño, 1994). El cultivo del langostino "popotillo" se realiza primeramente produciendo las crías en instalaciones y con técnicas especiales extrapoladas de la tecnología productiva de M. rosenbergii, para posteriormente, realizar la engorda en estanques de agua dulce (no más de 3 ups de salinidad) (Guzmán–Arroyo, 1987), aunque el cultivo de esta especie puede llevarse a cabo en aguas con salinidades desde los 0 a los 9 ups, ya que en este intervalo las proteínas contenidas en el alimento pueden ser utilizadas en el crecimiento y no como sustrato energético, que es el objetivo principal de las prácticas acuiculturales (Aguilar–Juárez, 1995).
La temperatura mínima del agua para el crecimiento es de 22 °C, ya que los animales dejan de crecer a menos de 20 °C y mueren por debajo de los 15 °C (Guzmán–Arroyo, 1987), por ello se consideran las regiones tropicales como óptimas para su cultivo (Avendaño, 1994). El pH debe fluctuar entre 6.5 y 8.0, mientras que la concentración de oxígeno disuelto no deberá ser menor a 4 ppm. Se debe tener cuidado especial con el contenido de carbonatos en el agua, ya que un alto contenido es perjudicial para los organismos durante su crecimiento (Guzmán–Arroyo, 1987).
Desde el punto de vista económico es más rentable una granja productora de postlarvas que una granja de engorda, aun cuando la inversión sea más elevada (Guzmán–Arroyo, 1987). Los requisitos para el establecimiento de un laboratorio de producción de postlarvas del langostino M. tenellum, son: disponibilidad de agua dulce y salobre suficiente, sin contaminantes, contar con infraestructura básica como servicios de comunicación, carretera, energía eléctrica, servicios generales, proveedores, etc. (Avendaño, 1994).
Avendaño (1994) describe tres métodos para el cultivo de larvas:
1) Agua verde: consiste en la introducción de 30 postlarvas de langostino por cada litro de agua enriquecida con microalgas, es de fácil operación pero poco productivo;
2) Abierto de agua clara: ajustando una densidad de 30–50 larvas/litro de agua y realizando recambios forzosos de agua salobre; es un método delicado pero eficiente; la alimentación consiste en nauplios de Artemia sp.; y
3) Cerrado de aguas claras: Es igual al anterior pero con filtrado de agua.
El transporte de postlarvas a los sitios de producción se realiza en agua con 4 ups y a 22 °C para disminuir su metabolismo, ajustando la densidad de transporte a 625 organismos/L. Las pruebas de estrés en postlarvas se realizan de dos maneras. La primera se lleva a cabo cambiando drásticamente la temperatura del agua, de 29 a 20 °C, y esperando 30 min para volver a colocarlas a 29 °C. Si el comportamiento observado durante 10 horas o hasta un día es normal, las larvas están bien. El segundo es ofreciendo alimento, si lo comen activamente significa que los organismos se encuentran en condiciones adecuadas para ser sembrados (Avendaño, 1994).
Se recomienda que la granja deba contar con un mínimo de 10 hectáreas de estanquería de engorda para que sea rentable (Avendaño, 1994). Los estanques de engorda son usualmente rústicos con una extensión de 0.5 ha a 2.0 ha de espejo de agua, con profundidades de 0.9 a 1.5 m, un gasto mínimo de agua de 2 a 3 L seg–1 ha–1, y aplicando fertilización después del llenado (Guzmán–Arroyo, 1987; Avendaño, 1994). La fertilización orgánica puede ser en base a estiércol bovino a razón de 700 kg ha–1 y la fertilización inorgánica se realiza con 20 kg de trifosfato colocándolo a la entrada de agua del estanque. Las densidades de siembra para los estanques de guardería van de 79 a 150 organismos m–2 y en los estanques de engorda la densidad óptima promedio es de 4 organismos m–2 (Avendaño, 1994). Aunque algunos autores, como Ponce–Palafox et al. (2006), sugieren también que en estanques rústicos con refugios, utilizando una dieta balanceada (25% de proteína) y ajustando la ración al 3% de peso corporal del organismo por día, se pueden sembrar hasta 14 organismos m–2.
Se ha observado que a densidades muy altas, se obtiene baja productividad por lesiones del caparazón suave al momento de la muda (Ponce–Palafox et al., 2006), lo que puede disminuirse o evitarse si se colocan refugios para proveer seguridad a los langostinos que mudan y evitar su depredación por el resto de los langostinos, con lo cual probablemente se contribuya a elevar la supervivencia (García–Ulloa et al., 2008).
Como una estrategia alternativa de producción, se recomienda sembrar juveniles grandes de 1.5 a 2 g para optimizar la supervivencia y el tiempo de crecimiento (Ponce–Palafox et al., 2006). Se pueden hacer resiembras cada dos meses para tener un cultivo continuo y cosechas selectivas de los machos más grandes por el efecto de los morfotipos sociales en la población que inhiben el crecimiento de los demás machos (Avendaño, 1994). Se utiliza la cosecha selectiva para lograr mejores rendimientos (Ponce–Palafox et al., 2006). En los sistemas contiguos monofásicos se practica la resiembra de dos organismos por cada uno cosechado, estimando la sobrevivencia a 50% (Avendaño, 1994).
Dentro de la rutina de manejo de un estanque de cosechas continuas, se recomienda realizar biometrías cada mes, mantener una turbidez mínima de 35 cm y cosechar cada semana o cada 15 días. Cada año y medio se debe permitir el descanso sanitario de la estanquería para reducir la materia orgánica y evitar condiciones anaeróbicas o microaeróbicas, lo cual se realiza drenando el estanque y aplicando cal a zonas estancadas; y si la cantidad de materia orgánica es considerable, se recomienda voltear el suelo con arado (Avendaño, 1994).
Las producciones pueden fluctuar entre 1.5 a 3 ton ha–1 año–1 (Guzmán–Arroyo, 1987; Avendaño, 1994; Ponce–Palafox et al., 2006). Se pueden obtener 1.5 cosechas por año (Guzmán–Arroyo, 1987; Ponce–Palafox et al., 2006). Existen fluctuaciones entre los rendimientos alcanzados y reportados, los cuales fluctúan desde los 472.2 kg a los 2 310 kg ha–1 año–1, presentando ganancias en peso promedio por individuo de 0.3 a 0.84 g semana–1, tasas específicas de crecimiento de 1.42 para hembras y 1.53 para machos y un factor de conversión alimenticia de 1.5 (Ponce–Palafox et al., 2002; Ponce–Palafox et al., 2006). En laboratorio, se registraron tasas de crecimiento específicas entre 1.82 a 2.62% día–1 usando dietas con diferentes porcentajes de inclusión de harina de soya (Garcia–Ulloa et al., 2008). Por otro lado, Se ha reportado que a partir de los 160 días de cultivo es posible encontrar proporciones importantes (alrededor de 40%) de organismos de tamaño comercial (120 mm) dentro de la población en cultivo (Ponce–Palafox et al., 2002), siendo proporcionalmente mayores (50%) los machos que las hembras, tanto en talla como en peso (Ponce–Palafox et al., 2006). Por este motivo, algunos autores, como Ponce–Palafox et al. (2006), recomiendan que los cultivos comerciales sean monosexuales y basarse principalmente en producción de machos.
En zonas templadas, M. tenellum puede alcanzar su talla comercial en tan solo seis meses (Navarro–Hurtado, 2002) demostrando la potencialidad de la especie en sistemas de cultivo comercial en estanques rústicos, al cosechar langostinos de 50–60 g de peso (Ponce–Palafox et al., 2002). Generalmente después de la cosecha, los organismos son puestos en hielo o congelados para su traslado a los lugares de venta. Ponce–Palafox et al. (2002) observaron que el tiempo de vida útil de los langostinos cuando se almacenan en canastas con hielo es de 10 días, manteniendo una aceptable calidad según pruebas químicas, microbiológicas y sensoriales.
Uno de los grandes problemas en la acuicultura es el óptimo aprovechamiento de los embalses de agua, incluyendo la columna de agua de los mismos, por lo que una de las técnicas que puede aplicarse con M. tenellum es el policultivo, al cual podrían incorporarse la tilapia o el bagre Estos sistemas han reportado mejores resultados que en el monocultivo tradicional, con densidades de siembra de langostinos de hasta 8 organismos m–2 (Navarro–Hurtado, 2002).
CONCLUSIONES
En la presente investigación se refleja la información disponible sobre el langostino M. tenellum que demuestra que existen vacíos importantes en el conocimiento de aspectos básicos y aplicados sobre la biología de esta especie. Si bien gran parte de los documentos publicados abordan aspectos sobre su ecología y distribución, se requiere aún de un gran esfuerzo de investigación para lograr llenar las lagunas que permitan la correcta comprensión de su biología integral y por ende su protección y aprovechamiento como recurso natural nativo. La falta de un registro actualizado y permanente de sus poblaciones en los ríos y lagunas costeras de nuestro país, aunado a prácticas de pesquería indiscriminada y no reportada, lo hacen una especie con potencial fragilidad ecológica. De gravedad resulta también, la poca información existente sobre los efectos que en sus poblaciones pueden tener la contaminación de los cursos de agua con insecticidas y herbicidas agrícolas, metales pesados, detergentes y otros compuestos derivados de la actividad doméstica e industrial. Nada se sabe sobre el impacto de la reducción o pérdida de los caudales de ríos y arroyos usados por estos organismos para completar su ciclo vital. Los intentos por establecer técnicas de manejo y cultivo son aún insuficientes, y mayor atención debe darse a este aspecto, lo que podría detonar en su protección a través de un correcto manejo de las poblaciones silvestres que propicien beneficios a nivel rural y comercial. La investigación de esta y otras especies nativas de Macrobrachium de México, debe ser de interés no sólo para un grupo disperso de científicos y técnicos, sino de las instituciones encargadas de la protección, estudio y aprovechamiento de los recursos naturales de nuestro país.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT–Beca 34091) y al Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL – Proyecto 06–2009–661) por apoyar esta investigación. A los integrantes del Laboratorio de Acuicultura Experimental del Centro Universitario de la Costa–UdeG por su apoyo. Nuestro reconocimiento al Dr. Manuel García Ulloa Gómez (Laboratorio de Ciencias Marinas, Universidad Autónoma de Guadalajara, Barra de Navidad, Jalisco, Mexico) por las amables correcciones y sugerencias.
REFERENCIAS
Aguilar, M., F. Díaz, & F. L. Buckle. 1998. The effect of salinity on oxygen consumption and osmoregulation of Macrobrachium tenellum. Marine Freshwater Behaviour and Physiology 31: 105–113. [ Links ]
Aguilar–Juárez, M. 1995. Efecto de la salinidad sobre el metabolismo respiratorio, excreción nitrogenada y osmoregulación en Macrobrachium tenellum de Mulegé, Baja California Sur, México. Tesis de Maestría en Ciencias (Ecología Marina), Departamento de Acuicultura, División de Oceanología, CICESE, México. 46 p. [ Links ]
Arboleda–Obregón, D. A. 2006. Limnología aplicada a la acuicultura. Revista Electrónica Veterinaria (REDVET)3 (11): 1–24. [ Links ]
Arroyo–Renteria, G. & L. Magaña–Ríos. 2001. Contribución al conocimiento de las especies de Macrobrachium y Atya con especial referencia a los langostinos en el cauce del río baluarte (1991). Tesis de Licenciatura en Biología Pesquera, Facultad de Ciencias del Mar, UAS, México. 58 p. [ Links ]
Arzola–González, J. F. & L. M. Flores–Campaña. 2008. Alternativas para el aprovechamiento de los crustáceos decápodos del estero El Verde Camacho, Sinaloa, México. Universidad y Ciencia, Trópico Húmedo 24 (1): 41–48. [ Links ]
Avendaño, M. E. 1994. Cultivo de Langostino. Colección Nacional de Manuales de Capacitación Pesquera. Secretaría de Pesca de México. Ed. Lito Roda. D.F. México. 20 p. [ Links ]
Boschi, E. E. 1974. Biología de los crustáceos cultivables en América Latina. In: FAO. 1974. Actas del Simposio sobre Acuicultura en América Latina. Volumen 2 – documentos de reseña. Informe de Pesca 159 vol. 2. Montevideo, Uruguay. 1–24 p. [ Links ]
Cabrera, P. J. 1983. Carácter práctico para diferenciación de sexos en Macrobrachium tenellum (Crustacea: Decapoda: Natatia). Revista de Biología Tropical 31 (1): 159–160. [ Links ]
Cabrera, J., C. Chávez & C. Martínez. 1979. Fecundidad y cultivo de Macrobrachium tenellum (Smith) en el laboratorio. Anales del Instituto de Biología– Universidad Nacional Autónoma de México 50: 127–152. [ Links ]
Cuevas–Félix, M. E. 1980. Tasas respiratorias del langostino Macrobrachium tenellum (Smith). Tesis de Licenciatura en Biología. Facultad de Ciencias, Universidad Nacional Autónoma de México. D. F., México. pp. 27–40, 47. [ Links ]
Cupul–Magaña, F. G., A. Rubio–Delgado, F. Molano–Rendón & A. Reyes–Juárez. 2008. Contenido estomacal de neonatos de Crocodylus acutus (Cuvier, 1807) en Boca Negra, Jalisco. Boletín de la Sociedad Herpetológica Mexicana 16 (2): 41–45. [ Links ]
Espino–Barr, E., B. A. García, G. M. Puente, A. C. Zamorano, A. O. Ahumada & E. Cabral–Solís. 2006. Análisis preliminar de los aspectos biológicos del langostino mazacate Macrobrachium tenellum, en el estado de Colima. Presentación en cartel. In: Espino, B. E., A. M. Carrasco & G. M. Puente. 2006. Memorias del III foro Científico de Pesca Ribereña. Centro Regional de Investigaciones Pesqueras de Manzanillo, Instituto Nacional de la Pesca, SAGARPA. Jalisco, México, pp. 93–94. [ Links ]
Espinosa, J. L. 1986. El Langostino: Un alimento en peligro. Serie medio ambiente en Coatzacoalcos, Volumen X. Centro de Ecodesarrollo. D.F., México. 96 p. [ Links ]
FAO. 1974. Actas del Simposio sobre Acuicultura en América Latina. Volumen 2 – documentos de reseña. Informe de Pesca 159 vol. 2. Montevideo, Uruguay. 130 p. [ Links ]
García–Ulloa, M., H. Rodríguez & T. Ogura. 2004. Calidad del huevecillo de dos especies de langostino (Palemonidae) del género Macrobrachium (M. rosenbergii, De Man 1879, y M. tenellum, Smith, 1871) variando la dieta de los reproductores: índices morfométricos. Avances en Investigación Agropecuaria 8 (2): 1–8. [ Links ]
García–Ulloa, G. M., L. A. López–Aceves, J. T. Ponce–Palafox, H. Rodríguez–González, & J. L. Arredondo–Figueroa. 2008. Growth of fresh–water prawn Macrobrachium tenellum (Smith, 1871) juveniles fed isoproteic diets subtituting fish meal by soya bean meal. Brazilian Archives of Biology and Technology 51 (1): 57–65. [ Links ]
Gelin, A. & V. Gravez. 2002. Knowledge and conservation of Galapagos Islands Costal Lagoons (Ecuador). Basler Stiftung für Biologische Forschung, Charles Darwin Biological Station and Galapagos National Park. 94 p. [ Links ]
Goodyear, R., V. Martínez & J. B. Del Rosario. 1976. Moluscos y crustáceos decápodos del Rio Chiriquí (1976). Universidad de Panamá. In: Biota de Panamá. 2008. http://biota.wordpress.com/2008/04/25/los–peces–del–rio–chiriqui–y–afluentes–principales/ (consultado el 09 de octubre de 2010). [ Links ]
Guzmán, A. M. 1975. Biología, Ecología y Pesca del chacal Macrobrachium tenellum en lagunas costeras del Estado de Guerrero. Informe Técnico I. Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. México. 25 p. [ Links ]
Guzmán, A. M. 1976. Biología, Ecología y Pesca del chacal Macrobrachium tenellum en lagunas costeras del Estado de Guerrero. Informe Técnico II. Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. México. 32 p. [ Links ]
Guzmán, A. M. 1977. Biología, ecología y pesca del chacal Macrobrachium tenellum en lagunas costeras del Estado de Guerrero. Informe Técnico III. Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. México. 30 p. [ Links ]
Guzmán, A. M. & R. C. Román. 1983. Parasitismo de Probopyrus pandalicola (Isopoda, Bopyridae) sobre el langostino Macrobrachium tenellum en la costa pacífica de Guerrero y Michoacán, México. Trabajos presentados a la conferencia internacional sobre Recursos Marinos del Pacífico. Viña del Mar, Chile, pp. 345–357. [ Links ]
Guzmán, A. M., J. Cabrera & C. Kensler. 1977. Notes on Macrobrachium species in México. In: Hanson, J. A. y Goodwin, H. L. (Ed.). Shrimp and prawn farming in the western Hemisphere. Dowden Hatchinson & Ross Inc. Penn., USA, pp. 315–316. [ Links ]
Guzmán, A. M., C. Kensler & B. A. Granados. 1978. Los langostinos del género Macrobrachium en México y sus posibilidades de cultivo. II Simposio de la Asociación Latinoamericana de Acuicultura. México, pp 28–31. [ Links ]
Guzmán, A. M., G. J. L. Rojas & G. L. D. González. 1981. Ciclo anual de maduración y reproducción del "Chacal" Macrobrachium tenellum y su relación con factores ambientales en las lagunas costeras de Mitla y Tres Palos, Guerrero, México (Decapoda: Palaemonidae). Anales del Instituto de Ciencias del Mar y Limnología 9 (1): 67–80. [ Links ]
Guzmán–Arroyo, M. 1987. Biología, ecología y pesca del langostino Macrobrachium tenellum (Smith, 1871), en lagunas costeras del estado de Guerrero, México. Tesis de Doctorado en Ciencias del Mar (Oceanografía Biológica y Pesquera), Instituto de Ciencias del Mar y Limnología, Colegio de Ciencias y Humanidades, UNAM. D.F., México. 319 p. [ Links ]
Hendrickx, M. E. 1995. Camarones. In: W. Fischer, F. Krupp, W. Scneider, C. Sommer, K. E. Carpenter & V. H. Niem (Eds.). Guía FAO para la identificación de especies para los fines de pesca. Pacífico centro–oriental. Vol. 1. Plantas e invertebrados. Roma, Italia, pp. 417–537. [ Links ]
Hernández, R. M., R. F. Buckle & H. F. Díaz. 1995. Preferred temperature of Macrobrachium tenellum (Crustacea, Palaemonidae). Revista Italiana di Acquacoltura 30: 93–96. [ Links ]
Hernández, R. M., R. F. Buckle & H. F. Díaz. 1996. Critical thermal maximum of Macrobrachium tenellum. Journal of Thermal Biology 21 (2): 139-143. [ Links ]
Hernández, L., G. Murugan, G. Ruiz–Campos & A. Maeda–Martínez. 2007. Freshwater shrimp of the genus Macrobrachium (Decapoda: Palaemonidae) from the Baja California Peninsula, México. Journal of Crustacean Biology 27 (2): 351–369. [ Links ]
Hernández–Rodríguez, M. 1994. Tolerancia térmica del langostino Macrobrachium tenellum (Crustacea: Palaemonidae) de Baja California Sur, México. Tesis de Maestría en Ciencias (Oceanologia–Ecología Marina), Departamento de Acuicultura, División de Oceanologia, CICESE. Baja California, México. 86 p. [ Links ]
Hernández–Sandoval, P. 2008. Efecto de la temperatura en el crecimiento y sobrevivencia del langostino Macrobrachium occidentale y del acocil Cherax quadricarinatus. Tesis de Maestría en Ciencias (Recursos Naturales y Medio Ambiente), Departamento de Acuicultura, Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional, IPN. Sinaloa, México. 60 p. [ Links ]
Holthuis, L. B. 1952a. A general revision of the palaemonidae (Crustacea: Decapoda: Natatia) of the Americas. II. The subfamuly Palaemonidae. Allan Hancock Foundation Occasional Papers 12: 11–132. [ Links ]
Holthuis, L. B. 1952b. On a Collection of decapod crustacea from The Republic of El Salvador (Central America). Zoologische Verhandelingen 23: 1–45. [ Links ]
Holthuis, L. B. 1980. FAO Species Catalogue I. Shrimps and Prawns of the World. An annotated catalogue of species of interest to fisheries. FAO Fisheries Synopsis 125 (1): 1–271. [ Links ]
ITIS. 2010. Integrated Taxonomic Information System, Página web: http://www.itis.gov/servlet/SingleRpt/SingleRpt7search_topic=TSN&search_value=96220 (consultado el 11 de octubre de 2010). [ Links ]
Jayachandran, K. V. 2001. Palaemonid Prawns: Biodiversity, taxonomy, biology and management. Ed. Science Publishers, Inc. Enfield, NH, USA. 192 p. [ Links ]
Kinne, O. 1971. Salinity: animals – Invertebrates. In: Kinne, O. (Ed.), Marine Ecology, Vol. I. Wiley & Sons, New York, USA, pp. 821–996. [ Links ]
Lara V., M. A. 2003. Origen, cantidad y destino de metales pesados en langostinos del Rio Marabasco, México. Tesis de Maestría en Ciencias, Facultad de Ciencias, Universidad de Colima. Colima, México. 79 p. [ Links ]
Luna, M., C. Graziani, E. Villarroel, M. Lemus, C. Lodeiros & G. Salazar. 2007. Evaluación de tres dietas con diferente contenido proteico en el cultivo de postlarvas del langostino de rio Macrobrachium rosenbergii. Zootecnia Tropical 25 (2): 111–121. [ Links ]
MacGibbon, D. J. 2008. The effects of different water quality parameters on prawn (Macrobrachium rosenbergii) yield, phytoplankton abundance and phytoplankton diversity at New Zealand prawns limited, Wairakei, New Zealand. Tesis de Maestría en Ciencias (Ecología y Biodiversidad), Universidad Victoria de Wellington. 132 p. [ Links ]
Navarro–Hurtado, A. 2002. Ensayo de dos modelos de policultivo empleando bagre (Ictalurus punctatus) tilapia hibrida (Oreochromis niloticus vs. Oreochromis mossambicus) y langostino (Macrobrachium tenellum), en estanques semi–rusticos caso Jocotepec, Jalisco. Tesis de Maestría en Ciencias (Acuacultura), Facultad de Ciencias Marinas, Universidad de Colima. Colima, México. 56 p. [ Links ]
New, M. B. 1988. Freshwater Prawns: Status of global aquaculture, 1987. NACA Technical Manual No. 6. A World Food Day Publication of the Network of Aquaculture Centers in Asia. Bangkok, Thailand. 58 p. [ Links ]
New, M. B. 2000. History and global status of freshwater prawn farming. In: New M.B. & W.C. Valenti (Eds). Freshwater prawn culture: the farming of Macrobrachium rosenbergii. Oxford, England, Blackwell Science. pp. 1–11. [ Links ]
Norma Oficial Mexicana. 1994. NOM–009–PESC–1993, Establecimiento de épocas y zonas de veda para la pesca de diferentes especies de la flora y fauna acuática en aguas de jurisdicción federal de los Estados Unidos Mexicanos. Diario Oficial de la Federación. México, D.F., 16 de marzo. [ Links ]
Ocaña–Luna, A., L. A. Martínez–Guzmán & M. Sánchez–Ramírez. 2009. Nuevo registro del parásito Probopyrus pacificensis (Isopoda: Bopyridae) en el Sur de Nayarit y Norte de Jalisco, México. Nota científica. Revista Mexicana de Biodiversidad80: 259–261. [ Links ]
Pérez–Velázquez, P. A., P. Ulloa–Ramírez & J. L. Patiño–Valencia. 2006a. Estado general de la pesquería del camarón moya Macrobrachium tenellum de la región estuarina de Nayarit. In: Espino, B. E., A. M. Carrasco & G. M. Puente. Memorias del III foro Científico de Pesca Ribereña. Centro Regional de Investigaciones Pesqueras de Manzanillo, Instituto Nacional de la Pesca, SAGARPA. Jalisco, México, pp. 17–18. [ Links ]
Pérez–Velázquez, P. A., P. Ulloa–Ramírez & J. L. Patiño–Valencia. 2006b. Análisis preliminar de la pesquería comercial de langostinos del rio Ameca, Nayarit. Presentación en cartel. In: Espino, B. E., A. M. Carrasco & G. M. Puente. Memorias del III foro Científico de Pesca Ribereña. Centro Regional de Investigaciones Pesqueras de Manzanillo, Instituto Nacional de la Pesca, SAGARPA. Jalisco, México, pp. 19–20. [ Links ]
Ponce–Palafox J. T., F. C. Arana–Magallon, H. Cabanillas–Beltrán & H. Esparza. 2002. Bases biológicas y técnicas para el cultivo de los camarones de agua dulce nativos del Pacífico americano Macrobrachium tenellum (Smith, 1871) y M. americanum (Bate, 1968). I Congreso Iberoamericano Virtual de Acuicultura. pp. 534–546. [ Links ]
Ponce–Palafox J. T., R. González, O. Romero, I. Febrero–Toussaint, J. L. Arredondo–Figueroa, H. Esparza–Leal & G. M. García–Ulloa. 2005. Enfermedades del camarón de agua dulce Macrobrachium tenellum y M. rosenbergii durante el cultivo comercial en estanques rústicos, en empresas rurales. Revista Electrónica Veterinaria (REDVET) 6 (12): 1–12. [ Links ]
Ponce–Palafox J. T., G. M. García–Ulloa, J. L. Arredondo–Figueroa, D. Hernández–Ocampo, J. Díaz–Álvarez, G. Aldama–Rojas & H. Esparza–Leal. 2006. El cultivo del camarón de agua dulce Macrobrachium tenellum en estanques rústicos. Comunicación Científica. IV Congreso Iberoamericano Virtual de Acuicultura. pp. 655–660. [ Links ]
Román–Contreras, R. 1979. Contribución al conocimiento de la biología y ecología de Macrobrachium tenellum (Smith) (Crustacea, Decapoda, Palaemonidae). Anales del Centro de Ciencias del Mar y Limnología 6 (2): 137–160. [ Links ]
Román–Contreras, R. 1991. Ecología de Macrobrachium tenellum (De–capoda:Palaemonidae) en la laguna Coyuca, Guerrero, Pacífico de México. Anales del Instituto de ciencias del Mar y Limnología 18 (1): 87–96. [ Links ]
Ruiz–Santos, H. 1988. Estudio de la edad y crecimiento del langostino Macrobrachium tenellum (Smith, 1871) en la laguna de Tres Palos, Gro. Tesis de Maestría en Ciencia del Mar (Oceanografía Biológica y Pesquera), Colegia de Ciencias y Humanidades, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. D.F. México. 78 p. [ Links ]
Sánchez–Granados, O. A. 2008. Adaptabilidad del camarón de rio nativo (Macrobrachium tenellum) en estanques de arcilla bajo un régimen natural/controlado y su influencia en su crecimiento y reproducción en el área de Chaguantique. Informe Técnico de Proyecto. REDISAL–Consejo Nacional de Ciencia y Tecnología de El Salvador. Disponible en línea en http://www.redisal.org.sv/proyectos/view/926 (consultado el 10 de junio de 2010). [ Links ]
Schiff, H. & M. E. Hendrickx. 1997. An introductory survey of ecology and sensory receptors of tropical eastern pacific crustaceans. Italian Journal of Zoology 64 (1): 13–30. [ Links ]
Signoret–Poillon G. & E. Soto. 1997. Comportamiento osmoregulador de Macrobrachium tenellum y Macrobrachium acanthurus (Decapoda: Palaemonidae) en diferentes salinidades. Revista de Biología Tropical 45 (3): 1085–1091. [ Links ]
Signoret, G. & D. Brailovsky. 2002. Population study of Macrobrachium tenellum (Smith 1871) in Coyuca de Benítez Lagoon, Guerrero, México. In: Escobar–Briones, E. & F. Alvarez (Eds.). Modern approaches to the study of Crustacea. Springer, Kluwer Academic – Plenum Publishers. USA, pp. 125–129. [ Links ]
Vega–Villasante, F. & O. Chong. 2006. El Dicamarón, Diccionario de camaronicultura. Universidad de Guadalajara. Universidad de La Habana. 2a. ed. Ed. Ediciones de la Noche. 123 p. [ Links ]














