Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.19 no.3 Ciudad de México dic. 2009
Artículos
Primer registro de Phialella quadrata y ampliación del límite de distribución de ocho especies de hidromedusas (Hydrozoa) en el Océano Atlántico Occidental
First record of Phialella quadrata and range extension of eight species of hydromedusae (Hydrozoa) in the Western Atlantic Ocean
María de los Angeles Mendoza–Becerril1, Alberto–Ocaña–Luna1*, Marina Sánchez–Ramírez1 y Lourdes Segura–Puertas2†
1 Instituto Politécnico Nacional. Escuela Nacional de Ciencias Biológicas, Lab. de Ecología. Dpto. de Zoología. Prolongación de Carpio y Plan de Ayala s.n. Col. Sto. Tomás. México, D. F. 11340. México. *E–mail: jocana@encb.ipn.mx
2 Universidad Nacional Autónoma de México, Instituto de Ciencias del Mar y Limnología Unidad Académica Puerto Morelos. P. O. Box 1152, Cancún, Q. Roo, 77500, México.
Recibido: 5 de agosto de 2008.
Aceptado: 28 de octubre de 2009.
RESUMEN
Los nuevos registros que se presentan en este trabajo, amplían la distribución geográfica conocida de nueve especies de hidromedusas, que fueron recolectadas en la Laguna Madre, Tamaulipas, México. La identificación de Phialella quadrata constituye el primer registro para el Océano Atlántico Occidental, mientras que Ectopleura dumortieri lo es para el Golfo de México y Clytia folleata para la región norte del mismo. Se extiende el área geográfica de distribución de Bougainvillia superciliaris, Nemopsis bachei, Sarsia tubulosa y Clytia globosa a menor latitud, mientras que Eirene tenuis y Octophialucium medium a mayor latitud.
Palabras clave: Nuevos registros, Leptothecata, Anthoathecata, Laguna Madre.
ABSTRACT
The new records provided here extend the geographic distribution know of nine hydromedusae species collected in the Laguna Madre, Tamaulipas, Mexico. The record of Phialella quadrata is the first one for the Western Atlantic Ocean, while Ectopleura dumortieri is registered for the first time in the Gulf of Mexico and Clytia folleata in the north of the same gulf. The geographic distribution of Bougainvillia superciliaris, Nemopsis bachei, Sarsia tubulosa and Clytia globosa is extended to a lower latitude, while Eirene tenuis and Octophialucium medium increase to a higher latitude.
Key words: New records, Leptothecata, Anthoathecata, Laguna Madre.
INTRODUCCIÓN
Las hidromedusas son depredadores que actúan en los primeros niveles de la cadena trófica del ecosistema marino, por lo que afectan la abundancia de estadios larvarios y adultos de diversos organismos zooplanctónicos (Purcell, 1985; Purcell & Arai, 2001). La abundancia y distribución de esta fauna depende de los patrones de comportamiento de las propias especies (Arai, 1992) y de la interacción con factores biológicos, químicos y físicos (Graham et al., 2001).
La distribución de las hidromedusas se altera por el transporte pasivo a través de masas de agua (van der Spoel, 1991) y por mecanismos asociados a las actividades humanas (p. ej. tráfico marítimo), estos últimos dan lugar a la introducción de especies no nativas, las cuales pueden modificar la estructura de las comunidades autóctonas y causar un impacto económico negativo (Ruíz et al., 1997).
Los estudios sobre hidromedusas realizados en la zona nerítica y oceánica del Golfo de México han sido realizados por: Sears (1954), Simmons (1957), Moore (1962), Hopkins (1966), Burke (1975), Segura–Puertas (1992), Suárez–Morales et al. (2002) y Loman–Ramos et al. (2007).
En las últimas décadas se han incrementado los trabajos que dan a conocer nuevos registros geográficos de hidromedusas en aguas mexicanas del Golfo de México; entre ellos se encuentran los de: Canudas–González (1979); Segura–Puertas (1992); Correia–Valenca & Segura–Puertas (1996) y Loman–Ramos et al. (2007) entre otros.
En este trabajo se da a conocer por primera vez la presencia de Phialella quadrata (Forbes, 1848) y la ampliación del límite de distribución geográfico de ocho especies de hidromedusas en el Océano Atlántico Occidental, identificadas por primera vez en la Laguna Madre, Tamaulipas, México, por tal motivo se analiza la distribución mundial y los intervalos de salinidad y temperatura en los cuales se localizaron a las especies.
MATERIALES Y MÉTODOS
Los ejemplares se obtuvieron de la recolecta de zooplancton en la Laguna Madre, Tamaulipas, México (23° 48' y 25° 30' N, 97° 23' y 97° 52' O). La laguna posee una superficie de 2,000 km2 y una profundidad promedio de 0.7 m (Ayala Castañares & Segura, 1968). Fue declarada como área natural protegida, con carácter de área de protección de flora y fauna por la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT, 2005). Esta laguna junto con la Laguna Madre de Texas, E. U. A. forman el sistema hipersalino más extenso del mundo (Tunell, 2002).
Al sur de la Laguna Madre se establecieron 20 estaciones de muestreo, durante octubre 1997, enero, mayo y julio, 1998, las cuales fueron referenciadas geográficamente (Fig. 1 y tabla 1).
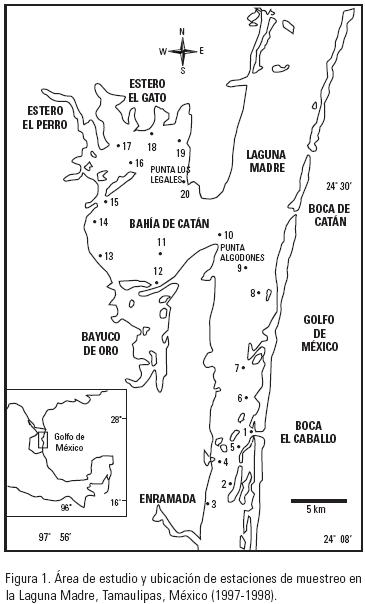
La toma de muestras se realizó mediante arrastres superficiales, con una red de zooplancton de apertura de malla de 500 µm y boca de 50 cm de diámetro, las muestras biológicas se fijaron en formalina al 4 % neutralizada con borato de sodio. Se midió in situ la salinidad y la temperatura superficiales. Los ejemplares fueron separados de la muestra completa e identificados de acuerdo a las descripciones de: Mayer (1910), Russell (1953), Kramp (1959), Kramp (1961) y Bouillon & Boero (2000). Para cada especie se señala: fecha (día/mes/año): estación (número de individuos). Los parámetros ambientales están referidos a los sitios de recolecta de cada especie. Los ejemplares están depositados en la Colección de Invertebrados Planctónicos, de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional.
RESULTADOS
Las nueve especies registradas en el presente estudio pertenecen al Phylum Cnidaria, Subphylum Medusozoa, Clase Hydrozoa, Subclase Hydroidolina y se agrupan en los Ordenes: Leptothecata y Anthoathecata de acuerdo a la clasificación propuesta por Marques & Collins (2004). Se analizaron 60,709 medusas, de las cuales el 97.5 % correspondieron a Eirene tenuis (Browne, 1905) y el 2.5 % a Bougainvillia superciliaris (L. Agassiz, 1849), Nemopsis bachei L. Agassiz, 1849, Sarsia tubulosa (M. Sars, 1835), Clytia folleata (McCrady, 1859), Clytia globosa (Mayer, 1910), Octophialucium medium Kramp, 1955, Phialella quadrata y Ectopleura dumortieri (van Beneden, 1844).
A continuación se proporcionan los datos del material recolectado en la laguna, así como la distribución mundial para cada especie.
Orden Anthoathecata:
Familia Bougainvillidae Lûtken, 1850
Bougainvillia superciliaris (L. Agassiz, 1849). (Fig. 2a)
Material examinado: 23/10/1997: 7(1), 9(2); 24/10/1997: 11(5), 12(4), 13(34), 14(26), 15(21), 16(1), 20(37). 22/01/1998: 2(1), 5(5), 9(11); 24/01/1998: 10(114), 11(543), 12(323), 14(35), 15(43), 16(9), 17(6), 18(5), 19(1), 2(48). 03/05/1998: 10(6), 11(22), 12(37), 13(7), 14(1), 15(4), 16(17), 18(3), 19(1), 20(13).
Parámetros ambientales: 21–45 ups y 18–28°C.
Registros previos: Alaska; Point Borrow: MacGinitie (1955; en Kramp, 1961). Rusia; Mar Kara: Yashnow (1952), Mar Blanco: Mayer (1910), Mar de Barents: Mayer (1910), Mar de Bering: Yashnow (1952). China; Chaefoo: Chow & Huang (1958). Canadá; Vancouver: Foerster (1923). E. U. A; Islas Aleutianas: Bigelow (1913). Dinamarca: Kramp (1927). Alemania; Mar Báltico: Künne (1937; en Kramp, 1961). Mar del Norte: Künne (1952; en Kramp, 1961). Inglaterra: Kramp (1930). Irlanda: Kramp (1926). Groenlandia: Mayer (1910), Pedersen & Smidt (2000). Noreste de Canadá: Dunbar (1942; en Kramp, 1961), Percey & Fife (1981). Noreste de E.U.A: Agassiz (1849), Agassiz (1865), Mayer (1910).
Nemopsis bachei L. Agassiz, 1849. (Fig. 2b)
Material examinado: 22/01/1998: 9(3); 24/01/1998: 10(1), 11(19), 12(11), 14(13), 15(23), 16(1), 18(1).
Parámetros ambientales: 21–35 ups y 18–21°C.
Registros previos: Reino Unido de Gran Bretaña: Russell (1970). Norte de Holanda: Kramp (1959), Streftaris et al. (2005). Francia; Estuario de Gironda: Tiffon (1957; en Kramp, 1961). Costa oriental E.U.A: Agassiz (1865), Haeckel (1879; en Kramp, 1961), Mayer (1910), Malone (1977), Purcell & Nemazie (1992). Norte del Golfo de México: Simmons (1957), Moore (1962), Burke (1975).
Familia Corynidae Johnston, 1836
Sarsia tubulosa (M. Sars, 1835). (Fig. 2c)
Material examinado: 22/01/1998: 1(4), 4(2), 6(5). 02/05/1998: 6(2).
Parámetros ambientales: 32–35 ups y 21–27 °C.
Registros previos: Alaska; Point Barrow: McGinitie (1955; en Kramp, 1961). Japón: Uchida (1927). Oeste de Canadá: Foerster (1923), Arai (1976), Mills (1984). E. U. A; Friday Harbor: Mills (1984), Costello & Colin (2002). Indopacífico: Bouillon et al. (2004). Rusia; Mar Blanco: Russell (1953). Alemania; Mar Báltico: Russell (1953). Noruega: Sars (1835), Hosia & Båmstedt (2007). Dinamarca: Kramp (1915, en Kramp, 1961), Hansson & Kiørboe (2006). Portugal; Islas Azores: Russell (1970). Mar Negro: Russell (1953). España: Gili et al. (1988), Madin (1991), Medel & López–González (1996). Reino Unido de Gran Bretaña: Russell (1953). Irlanda: Mayer (1910), Southward (1954), Ballard & Myers (2000). Suroeste de Groenlandia: Pedersen & Smidt (2000). Noreste de Canadá: Dunbar (1942; en Kramp, 1961). E.U.A; Bahía de Chesapeake: Schuchert (2001).
Orden Leptothecata:
Familia Campanularidae Johnston, 1836
Clytia folleata (McCrady, 1859). (Fig. 2d)
Material examinado: 24/10/1997: 12(5), 17(1). 22/01/1998: 4(3). 03/05/1998: 10(1), 20(2). 29/07/1998: 4(2), 5(1), 6(7); 30/07/1998: 13(1), 20(6).
Parámetros ambientales: 35–50 ups y 21–31 °C.
Registros previos: África; Bahía Sta. Helena: Buecher & Gibbons (2000). Este de E.U.A: McCrady (1857), Mayer (1910). Sureste de México: Loman–Ramos et al. (2007), Segura–Puertas & Damas–Romero (1997), Ramos & Segura–Puertas (2004), Suárez–Morales et al. (1999). Brasil: Vannucci (1957).
Clytia globosa (Mayer, 1910). (Fig. 3a)
Material examinado: 03/05/1998: 20(1).
Parámetros ambientales: 43.0 ups y 28.0 °C.
Registros previos: India; Vishàkhapatnam: Ganapati & Nagabhushanam (1958). Sureste de E.U.A: Mayer (1910).
Familia Eirenidae Haeckel, 1879
Eirene tenuis (Browne, 1905). (Fig. 3b)
Material examinado: 23/10/1997: 1(2), 2(12), 3(11), 4(62), 5(20), 6(3), 8(4), 9(59), 10(59); 24/10/1997: 11(259), 12(1215), 13(7247), 14(4283), 15(1700), 16(797), 17(4223), 18(2), 20(3722). 02/05/1998: 8 1). 29/07/1998: 1(1), 5(5), 6(1), 8(16); 30/07/1998: 10(268), 11(2622), 12(5704), 13(14267), 14(145), 15(43), 16(7), 18(7), 19(26), 20(12406).
Parámetros ambientales: 35–51 ups y 24–31 °C.
Registros previos: República de las Maldivas: Browne (1905). India; Nicobar: Kramp (1958). Caribe Mexicano: Segura–Puertas & Damas–Romero (1997).
Familia Malagazzidae Bouillon, 1984
Octophialucium medium Kramp, 1955. (Fig. 3c)
Material examinado: 03/05/1998: 10(1).
Parámetros ambientales: 38 ups y 25°C.
Registros previos: Oeste de África: Kramp (1955), Kramp (1957). Sureste de México: Loman–Ramos et al. (2007), Segura–Puertas (1992).
Familia Phialellidae Russell, 1953
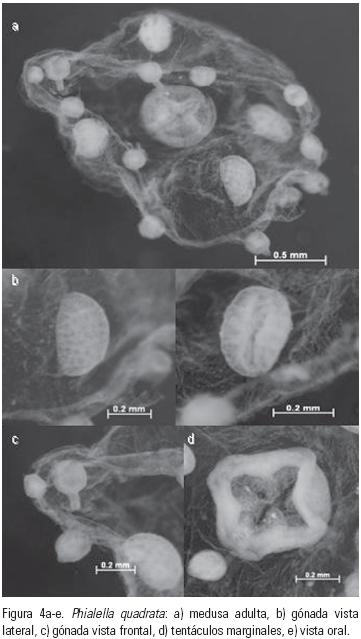
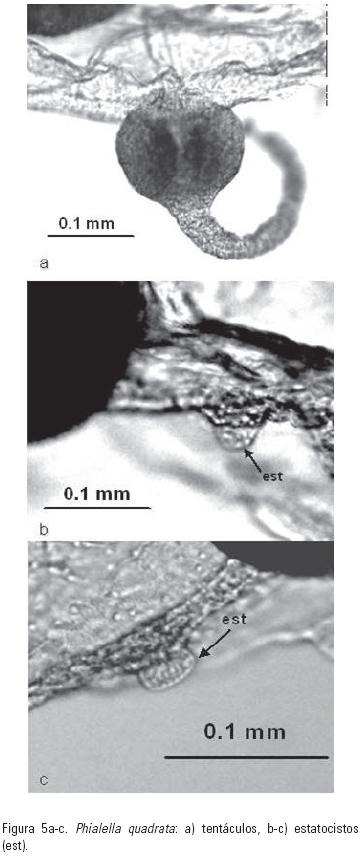
Phialella quadrata (Forbes, 1848). (Figs. 4 y 5)
Material examinado: 03/05/1998: 10(2).
Parámetros ambientales: 38 ups y 25°C.
Registros previos: Sur de Australia: Watson (1992), Hewitt (2002). Nueva Zelanda; Isla Suroriental: Russell (1953), Roper et al. (1983), Bouillon (1995). Chile: Fagetti (1973); Bahía Mejillones: Palma & Apablaza (2004), Palma et al. (2007); Fiordo de Comau: Galea et al. (2007a). Holanda: Mayer (1910). Reino Unido de Gran Bretaña: Forbes (1848); suroeste del Canal de la Mancha a la costa este de Escocia: Russell (1953). Suroeste de Irlanda: Ballard & Myers (2000). Mar Mediterráneo; Italia, Croacia, Montenegro, Albania y sur del Mar Adriático: Schmidt & Benovic (1977). Francia: Galea, (2007). España: Medel & López–González (1996). África; Golfo de Guinea: Kramp (1955); Bahía Sta. Helena: Buecher & Gibbons (2000).
Familia Tubulariidae Fleming, 1828
Ectopleura dumortieri (van Beneden, 1844). (Fig. 3d)
Material examinado: 22/01/1998: 4(1); 24/01/1998: 12(2), 18(2). 29/07/1998: 7(1).
Parámetros ambientales: 21–37 ups y 18–29°C.
Registros previos: China; Chefoo: Chow & Huang (1958). Índia; Vishàkhapatman: Ganapati & Nagabhushanam (1958), Trivandrum: Nair (1951), Fairway Buoy–Cochin: Vannucci et al. (1970). Pacífico Mexicano: Foerster (1923). Colombia, Ecuador y Perú: Segura–Puertas (1984). Chile: Palma & Apablaza (2004), Galea et al. (2007a, b). Dinamarca: Kramp (1933; en Russell, 1953), Allwein (1968; en Russell, 1970). Alemania; Estuario Elbe: Kühl (1962; en Russell, 1970). Bélgica: van Beneden (1866). Mar Mediterráneo: Stechow (1923; en Kramp, 1961), Bouillon et al. (2004). España: Madin (1991), Medel & López–González (1996). Egipto: Zakaria (2004). Portugal: Sousa e Silva & Dos Santos–Pinto (1949). Costa oriental de Reino Unido de Gran Bretaña: Mayer (1910), Kramp (1933; en Russell, 1953). África; Golfo de Guinea: Thiel (1938), Bahía Sta. Helena: Buecher & Gibbons (2000), Great Fishbay: Vanhöffen (1920). Noreste de E. U. A: Mayer (1910). Brasil: Vannucci (1957), Migotto et al. (2002).
DISCUSIÓN
La presencia de P. quadrata en el área de estudio constituye el primer registro para el Océano Atlántico Occidental, su distribución previa contemplaba las costas de Chile y el Océano Atlántico Oriental (norte de Europa y África).
Se da a conocer por primera vez la presencia de E. dumortieri en el Golfo de México, había sido observada para la costa noreste de E.U.A. por Mayer (1910) y en el hemisferio sur en las costas de Brasil por Vannucci (1957), mientras que C. folleata amplia su distribución en la región norte del Golfo de México cuyos registros anteriores se restringían, de acuerdo a Mayer (1910) y Loman–Ramos et al. (2007), a la costa este de E.U.A. y al Sur del Golfo de México, respectivamente.
Los nuevos registros de B. superciliaris, N. bachei, S. tubulosa y C. globosa amplian su área de distribución conocida hasta el sur del Océano Atlántico Occidental, ya que tenían como límite la costa este de E. U. A. La presencia de E. tenuis y O. medium en la laguna permiten ubicarlas a mayor latitud (24° N); previamente habían sido recolectadas a una latitud norte máxima de 21° 07' (Mar Caribe Mexicano) por Segura–Puertas & Damas–Romero (1997) y a 20° 50' (Sur del Golfo de México) por Loman–Ramos et al. (2007).
Se ha observado que las poblaciones de algunas especies de medusas fluctúan con los cambios de las condiciones ambientales naturales (temperatura, precipitación, salinidad, oxígeno disuelto, presión atmosférica y productividad) y aquellos provocados por las actividades humanas (pesquera, portuaria, industrial, de urbanización y turística) (Mills, 2001). Por lo que la agregación y la distribución de estos organismos pueden estar condicionadas por la variación de factores biológicos, físicos y químicos en diversos cuerpos de agua; por ejemplo el periodo corto de la fase medusoide que poseen algunas hidromedusas puede determinar su registro escaso, como lo indica Segura–Puertas (1992) para O. medium, o el potencial de adaptación que poseen algunas especies a altos grados de dilución del agua, que les permite ingresar a sistemas lagunares (Ramírez & Zamponi, 1981), como probablemente ocurrió con B. superciliaris, N. bachei y E. dumortieri, o bien la capacidad de permanecer en condiciones hiperhalinas como: E. tenuis, B. superciliaris y C. folleata.
En el área de estudio P. quadrata se recolectó en zonas con 38 ups y 25 °C, valores mayores a los señalados por Roper et al. (1983), Buecher & Gibbons (2000), Palma & Apablaza (2004) y Galea et al. (2007a) en diversos cuerpos de agua donde la salinidad y temperatura oscilan entre 2–35 ups y 8–23 °C, respectivamente. Además se ha mencionado a P. quadrata como criptogénica por Hewitt (2002) e Inglis et al. (2005) y cosmopolita por Galea et al. (2007b).
Bougainvillia superciliaris se encontró en lugares en los que la temperatura fue de 28 °C, a pesar de ser considerada por Russell (1953) como una especie propia de la región ártica donde predominan temperaturas entre 1–11 °C. Kramp (1959) menciona que esta especie al ser transportada por corrientes que se dirigen a latitudes menores amplía su distribución y puede ser una especie euritérmica; esta característica puede conferirle la capacidad de establecerse en la Laguna Madre.
El intervalo de temperatura en el que se observó a N. bachei (18–21 °C) y los datos referidos por Moore (1962) en el norte del Golfo de México (11–16 °C), sugieren que esta especie se distribuye principalmente en temperaturas frías. Los valores de salinidad en los que se presentó en este estudio (21–35 ups) y en anteriores trabajos como los de Burke (1975) (5 ups); Moore (1962) (5.6 y 15 ups) y Simmons (1957) (45–75 ups), indican que la especie puede permanecer en ambientes oligohalinos, euhalinos e hiperhalinos.
Russell (1953) consideró a S. tubulosa como una especie boreal (región con temperaturas de 3–16 °C) sin embargo Edwards (1978) menciona la presencia de hidroides desde los 2 °C hasta los 20 °C cuando hay disponibilidad de alimento, lo que sugiere que su reproducción no está relacionada sólo con la temperatura. Por otro lado Mills (1984) consideró que esta especie es tolerante a cambios de salinidad de hasta 38 ups. En la Laguna Madre se registró en lugares con temperaturas desde 21 °C y con salinidades entre 32 y 35 ups; de acuerdo a estos valores y a lo anteriormente señalado se puede decir que la laguna proporciona condiciones favorables para la permanencia de la especie.
Clytia folleata y E. tenuis se presentaron en la Laguna Madre en sitios con salinidades hasta 50 y 51 ups, respectivamente y en temperaturas máximas de 31 °C, parámetros mayores a los señalados por Suárez–Morales et al. (1999), quienes registraron a Clytia folleata en lugares con 34–38 ups y con 26–28 °C y Loman–Ramos et al. (2007) quienes la reportan en sitios con 23.7–36.4 ups y 27.6–29.9 °C, mientras que Segura–Puertas & Damas–Romero (1997) encontraron a E. tenuis en zonas con 31.5 ups y 28 °C.
Ectopleura dumortieri se recolectó en sitios con 21–37 ups, lo que amplia su límite superior de tolerancia, ya que había sido registrada sólo en lugares con 30.6 ups por Hopkins (1966). La presencia de O. medium en zonas con 38 ups sobrepasa el límite de salinidad encontrado previamente (34–36 ups) por Segura–Puertas (1992) y de 30–36 ups por Loman–Ramos et al. (2007) para la especie; estos intervalos de salinidad indican que es probable que se trate de una especie marina que puede entrar a sistemas costeros de manera ocasional.
Las hidromedusas también pueden ampliar sus límites de distribución geográfica debido a su capacidad de dispersión natural, la cual actúa de manera local (Graham et al., 2001). La fase medusoide es una forma de dispersión activa durante un periodo corto de tiempo, en contraste con la fase bentónica, que tiene la capacidad de permanecer durante periodos prolongados e incluso ser permanente (Cornelius, 1995).
La dispersión de la fase planctónica de las hidromedusas puede ocurrir por el movimiento de corrientes y masas de agua (van der Spoel, 1991; Wolff, 2005); por ejemplo N. bachei ha sido registrada en la costa oeste del Océano Atlántico (Agassiz, 1865; Mayer, 1910), así como en el norte del Golfo de México (Moore, 1962; Burke, 1975) y en la Laguna Madre de Texas (Simmons, 1957) esto sugiere una posible penetración a través de corrientes a la Laguna Madre, Tamaulipas. Sin embargo, es importante considerar que la adhesión de sus colonias de hidroides a los cascos de los barcos, actúa como un mecanismo de dispersión, el cual ha propiciado el transporte de esta fase de la especie desde la costa este de E. U. A. hasta el Golfo de México (Moore, 1962), así como su introducción en el Atlántico Europeo (Wolf, 2005) y en el Mar Mediterráneo (Streftaris et al., 2005).
Con base en este estudio, el número de especies de hidro–medusas en la costa mexicana del Golfo de México se eleva a 75.
AGRADECIMIENTOS
A la Secretaría de Investigación y Posgrado (SIP) del Instituto Politécnico Nacional (I.P.N.) y a la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) por el financiamiento otorgado para la realización de este estudio. A la M. en C. Laura Celis Gutiérrez por su valioso apoyo en el trabajo de laboratorio. Al Dr. Pedro García Barrera por la revisión crítica al manuscrito final, así como a los revisores anónimos por sus atinados comentarios.
REFERENCIAS
Agassiz, A. 1865. Ilustrated Catalogue of the Museum of Comparative Zoölogy, at Harvard College Part II. North American Acalephae Cambridge, Massachusetts. 234 p. [ Links ]
Agassiz, L. 1849. Contributions to the natural history of the Acalephae of North America. Part. I. On the naked–eyed Medusae of the shores of Massachussetts, in their perfect state of development. Memoirs of the American Academy of Arts and Sciences 4 (9): 221–316. [ Links ]
Allwein, J. 1968. Seasonal occurrence of Hydromedusae at Helsingør, Denmark, 1966–1967. Ophelia 5: 207–214. [ Links ]
Arai, M. N. 1976. Behaviour of Planktonic coelenterates in temperature and salinity discontinuity layers. In: Mackie, G.O. (Ed.). Coelenterate Ecology and Behavior: Plenum Publishing, New York, United States of America, pp. 211–218. [ Links ]
Arai, M. N. 1992. Active and Passive Factors Affecting Aggregations of Hydromedusae: A Review. Scientia Marina 56 (2–3): 99–108. [ Links ]
Ayala Castañares, A. & L. R. Segura. 1968. Ecología y Distribución de los Foraminíferos Recientes de la Laguna Madre, Tamaulipas, México. Boletín del Instituto de Geología, Universidad Nacional Autónoma de México 87: 1–89. [ Links ]
Ballard, L. & A. Myers. 2000. Observations on the seasonal occurrence and abundance of gelatinous zooplankton in Lough Hyne. Co. Cork, south–west Ireland. Biology and Enviromental: Proceedings of the Royal Irish Academy 100 (B): 75–83. [ Links ]
Bigelow, H. B. 1913. Medusae and Siphonophorae collected by the U. S. Fisheries steamer "Albatross" in the north–western Pacific, 1906. Proceedings of the United States National Museum 44: 1–119. [ Links ]
Bolton , T. F. & W. Graham. 2004. Morphological variation among populations o fan invasive jellyfish. Marine Ecology Progress Series 278: 125–139. [ Links ]
Bouillon, J. 1995. Hydromedusae of the New Zealand Oceanographic Institute (Hydrozoa, Cnidaria). New Zealand Journal of Zoology 22: 223–238. [ Links ]
Bouillon, J. & F. Boero. 2000. Phylogeny and Classification of Hydroidomedusae. Thalassia Salentina 24: 5–296. [ Links ]
Bouillon, J., M. D. Medel, F. Pagès, J. M. Gili, F. Boero & C. Gravili. 2004. Fauna of the Mediterranean Hydrozoa. Scientia Marina 68 (2): 5–438. [ Links ]
Browne, E. T. 1905. Hydromedusae, with a revision of the Williadae and Petasidae. Fauna and Geography of the Maldive and Laccadive Archipelagoes, volume II, Part 3, India, pp. 742–749. [ Links ]
Buecher, E. & M. J. Gibbons. 2000. Interannual variation in the composition of the assemblages of medusae and ctenophores in St Helena Bay, Southern Benguela Ecosystem. Scientia Marina 64 (Suppl. 1): 123–134. [ Links ]
Burke, D. W. 1975. Pelagic Cnidaria of Mississippi Sound and Adjacent Waters. Gulf Research Reports 5 (1): 23–38. [ Links ]
Canudas–González, A. 1979. Contribución al conocimiento de las medusas (Coelenterata) de la Laguna Términos, Camp. México. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 6 (1): 183–188. [ Links ]
Chow, T. H. & M. C. Huang. 1958. A study on hydromedusae of Chefoo. Acta Zoologica Sinica 10: 173–191. [ Links ]
Cornelius, P. F. S. 1995. North–West European Thecate Hydroids and their Medusae. In: Barnes, S. K. & J. H. Crothers (Eds.). Synopses of the British Fauna. The Linnean Society of London and The Estuarine and Coastal Sciences Association, 50 (1): 347p. [ Links ]
Correia–Valenca, K. & L. Segura–Puertas. 1996. Nuevos registros de dos especies de Anthomedusae (Pandeidae y Niobiidae) en el Golfo de México. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 22 (1): 125–157. [ Links ]
Costello, J. H. & S. P. Colin. 2002. Prey resource use by coexistent hydromedusae from Friday Harbor, Washington. Limnology and Oceanography 47 (4): 934–942. [ Links ]
Dunbar, M. J. 1942. Marine macroplankton from the Canadian Eastern Arctic. II Medusae, Siphonophora, Pteropoda and Chaetognatha. The Canadian Journal of Research 20 (D): 71–77. [ Links ]
Edwards, C. 1978. The hydroids and medusae Sarsia occulta sp. nov., Sarsia tubulosa and Sarsia loveni. Journal of Marine Biological Association of the United Kingdom 58: 291–311. [ Links ]
Fagetti, E. 1973. Medusas de Aguas Chilenas. Revista de Biología Marina Valparaíso 15 (1): 31–75. [ Links ]
Foerster, R. E. 1923. The hydromedusae of the west coast of North America, with special reference to those of the Vancouver Island region. Contributions to Canadian Biology 12 (1): 219–277. [ Links ]
Forbes, E. 1848. A monograph of the British naked–eye Medusae. Ray Society, London. 104 p. [ Links ]
Galea, H. R. 2007. Hydrozoa, La Ciotat and nearby areas, Mediterranean coast of France. Check List 3 (3): 193–199. [ Links ]
Galea, H. R., V. Häussermann & G. Försterra. 2007a. Hydrozoa, fjord Comau, Chile. Check List 3 (2): 159–167. [ Links ]
Galea, H. R., V. Häussermann & G. Försterra. 2007b. Cnidaria, Hydrozoa: latitudinal distribution of hydroids along the fjords region of southern Chile, with notes on the world distribution of some species. Check List 3 (4): 308–320. [ Links ]
Ganapati, P. N. & R. Naganhushanam. 1958. Seasonal distribution of the Hydromedusae off the Visakhapatnam coast. Memoirs of the Oceanography, Andhra University 2 (62): 91–99. [ Links ]
Gili, J. M., F. Pagès, A. Sabatés & J. D. Ros. 1988. Small–scale distribution of a cnidarian population in the western Mediterranean. Journal of Plankton Research 10 (3): 385–401. [ Links ]
Graham, W. N., F. Pagès & W. M. Hammer. 2001. A physical context for gelatinous zooplankton aggregations: a review. Hydrobiologia 451: 199–212. [ Links ]
Haeckel, E. 1879. Das system der Medusen. Erster Theil einer Monographie der Medusen. Jena. 360 p. [ Links ]
Hansson, L. J. & T. Kiørboe. 2006. Prey–specific encounter rates and hadling efficiencies as causes of prey selectivity in ambush–feeding hydromedusae. Limnology and Oceanography 51 (4): 1849–1858. [ Links ]
Hewitt, C. L. 2002. Distribution and Biodiversity of Australian Tropical Marine Bioinvasions. Pacific Science 56 (2): 213–222. [ Links ]
Hopkins, T. L. 1966. The plankton of St. Andrew Bay System Florida. Publications of the Institute of Marine Science, University of Texas 11: 12–64. [ Links ]
Hosia, A. & U. Båmstedt. 2007. Seasonal changes in the gelatinous zooplankton community and hydromedusa abundances in Korsfjord and Fanafjord, western Norway. Marine Ecology Progress Series 351: 113–127. [ Links ]
Inglis, G., N. Gust, I. Fitridge, O. Floerl, C. Woods, B. Hayden & G. Fenwick. 2005. Opua Marina: Baseline survey for non–indigenous marine species. Research Project ZBS 2000/04. Biosecurity New Zealand Technical Paper No: 2005/14. 50 p. [ Links ]
Kramp, P. L. 1915. Medusae. Ctenophora and Chaetognathi from the Great Belt and the Kattegat in 1909. Medd. Kommunikation Havundersøg, København Serie Plankton 1 (12): 1–20. [ Links ]
Kramp, P. L. 1926. Medusae. Part II Anthomedusae. Danish Ingolf–Exped 5 (10): 1–120. [ Links ]
Kramp, P. L. 1927. The Hydromedusae of the Danish waters. Kongelige Danske Videnskabernes Selskab 12 (1): 1–291. [ Links ]
Kramp, P. L. 1930. Hydromedusae collected in the south–western part of the North Sea and in the eastern part of the Channel in 1903–1914. Mémoires du Musée Royal d'Histoire Naurelle de Belgique 45: 1–55. [ Links ]
Kramp, P. L. 1933. Ocasional notes on Coelenterata, II. Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening København 94: 237–247. [ Links ]
Kramp, P. L. 1955. The Medusae of the tropical west coast of Africa. Atlantide Report 3: 239–324. [ Links ]
Kramp, P. L. 1957. Hydromedusae of the Discovery Collections. 'Discovery' Report 29: 1–128. [ Links ]
Kramp, P. L. 1958. Some Mediterranean Hydromedusae collected by A. K. Totton in 1954 and 1956. Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening København 119: 115–128. [ Links ]
Kramp, P. L. 1959. The Hydromedusae of the Atlantic Ocean and adjacent waters. Dana Report 46: 3–283. [ Links ]
Kramp, P. L. 1961. Synopsis of the Medusae of the world. Journal of the Marine Biological Association of the United Kingdom 40: 1–469. [ Links ]
Kühl, H. 1962. Die Hydromedusen der Elbmündung. Abhandlungen der Verhandlung Naturwissenschaftliche 6: 209–232. [ Links ]
Künne, C. 1937. Ueber als 'Fremdlinge' zu bezeichnende Grossplanktonten in der Ostsee. Rapports Conseil International pour l'Exploration de la Mer. 102: 1–7. [ Links ]
Künne, C. 1952. Untersuchungen ubre das Grossplankton in der Deutschen Buche und im Nordsylter Wattenmeer. Helgolaender Wissenschaftliche Meeresuntersuchungen 4: 1–54. [ Links ]
Loman–Ramos, L., U. Ordóñez–López & L. Segura–Puertas. 2007 Variación espacial de la comunidad de medusas (Cnidaria) del sur del Golfo de México, durante otoño de 1999. Hidrobiológica 17 (1): 203–212. [ Links ]
Macginitie, G. E. 1955. Distribution and ecology of the marine invertebrates of Point Barrow, Alaska. Smithsonian Miscellaneous Collections 128: 1–201. [ Links ]
Madin, L. P. 1991. Distribution and Taxonomy of Zooplankton in the Alboran Sea and Adjacent Western Mediterranean, A Literature Survey and Field Guide. Woods Hole Oceanographic Institution, Technical Report WHOI–91–26. 147 p. [ Links ]
Malone, T. C. 1977. Plankton Systematics and Distribution. Marine EcoSystems Analysis (MESA). New York Bight Atlas Monograph 13, Institute Albany, New York. 45 p. [ Links ]
Marques, A. C. & A. G. Collins. 2004. Cladistic analysis of Medusozoa and cnidarian evolution. Invertebrate Biology 123 (1): 23–42. [ Links ]
Mayer, G. A. 1910. Medusae of the World volume I, II. The Hydromedusae. Carnegie Institution of Washington, Washington, United States of America. 498 p. [ Links ]
McCrady, J. 1857. Gymnophthalmata of Charlestone Harbour. Proceedings of the Elliott Society of Natural History 1: 103–221. [ Links ]
Medel, M. D. & P. J. López–González. 1996. Updated catalogue of hydrozoans of the Iberian Peninsula and Balearic Islands, with remarks on zoogeography and affinities. Scientia Marina 60 (1): 183–209. [ Links ]
Migotto, A. E., A. C. Marques, A. C. Morandini & F. L. Da Silveira. 2002. Checklist of the Cnidaria Medusozoa of Brazil. Biota Neotropica 2 (1): 1–31. [ Links ]
Mills, C. E. 1984. Density is altered in Hydromedusae and Ctenophores in response to change in salinity. Biological Bulletin 166: 206–215. [ Links ]
Mills, C. E. 2001. Jellyfish blooms: are populations increasing globally in response to changing ocean conditions?. Hydrobiologia 451: 55–68. [ Links ]
Moore, D. R. 1962. Occurrence and Distribution of Nemopsis bachei Agassiz (Hydrozoa) in the Northern Gulf of Mexico. Bulletin of Marine Science of the Gulf and Caribbean 12 (3): 399–402. [ Links ]
Nair, K. K. 1951. Medusae of the Trivandrum Coast. Part I. Systematics. Bulletin of the Central Research Institute, University of Travancore, Series C. Natural Sciences 2: 47–75. [ Links ]
Palma, S. & P. Apablaza. 2004. Abundancia estacional y distribución vertical del zooplancton gelatinoso carnívoro en un área de surgencia en el norte del Sistema de la Corriente de Humboldt. Investigaciones Marinas, Valparaíso 32 (1): 49–70. [ Links ]
Palma, S., P. Apablaza & N. Silva. 2007. Hydromedusae (Cnidaria) of the Chilean southern channels (from the Corcovado Gulf to the Pulluche–Chacabuco Channels). Scientia Marina 71 (1): 65–74. [ Links ]
Pedersen, S. A. & E. L. B. Smidt. 2000. Zooplankton Distribution and Abundance in West Greenland Waters, 1950–1984. Journal of Northwest Atlantic Fishery Science 26: 45–102. [ Links ]
Percey, J. A. & F. J. Fife. 1981. The biochemical composition and energy content of Artic marine macrozooplankton. Arctic 34 (4): 307–313. [ Links ]
Purcell, J. E. 1985. Predation on Fish Eggs and Larvae by Pelagic Cnidarians and Ctenophores. Bulletin of Marine Science 37: 739–755. [ Links ]
Purcell, J. E. & D. A. Nemazie. 1992. Quantitative feeding ecology of the hydromedusan Nemopsis bachei. Marine Biology 113 (2): 305–311. [ Links ]
Purcell, J. E. & M. N. Arai. 2001. Interactions of pelagic cnidarians and ctenophores with fish: a review. Hydrobiologia 451: 27–44. [ Links ]
Ramírez, F. C. & M. O. Zamponi. 1981. Hydromedusae. In: Boltovskoy D. (Ed.). Atlas del Zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino. Publicación Especial del Instituto Nacional de Investigación y Desarrollo Pesquero, Mar de Plata, Argentina, pp. 443–469. [ Links ]
Ramos, G. & L. Segura–Puertas. 2004. Seasonal ocurrence of Reef–Related Medusae (Cnidaria) in the western Caribbean Sea. Gulf and Caribbean Research 16: 1–9. [ Links ]
Roper, D. S., M. J. Simons & M. B. Jones. 1983. Distribution of zoo–plankton in the Avon–Heathcote Estuary, Christchurch. New Zealand Journal of Marine and Freshwater Research 17: 267–278. [ Links ]
Ruíz, G. M., J. T. Carlton, E. D. Grosholz & A. H. Hines. 1997. Global Invasions of Marine and Estuarine Habitats by Non–Indigenous Species: Mechanisms, Extent, and Consequences. American Zoologist 37: 621–632. [ Links ]
Russell, F. S. 1953. The Medusae of the British Isles I. Anthomedusae, Leptomedusae, Limnomedusae, Trachymedusae and Narcomedusae. Cambridge University Press, Great Britain. 530 p. [ Links ]
Russell, F. S. 1970. The Medusae of the British Isles II. Pelagic Scyphozoa, with a supplement to the first volume on Hydromedusae. Cambridge University Press, Great Britain. 283 p. [ Links ]
Sars, M. 1835. Beskrivelser og Iagttagelser over nogle mcerkelige eller nye I Havet ved den Bergeske Kyst levende Dyr, Bergen. 81 p. [ Links ]
Schmidt, H. E. & A. Benovic. 1977. Notes on Hydromedusae (Cnidaria) from the Adriatic Sea. Journal of the Marine Biological Association of the United Kingdom 57: 635–640. [ Links ]
Schuchert, P. 2001. Survey of the Family Corynidae (Cnidaria, Hydrozoa). Revue Suisse de Zoologie 108: 739–878 [ Links ]
Sears, M. 1954. Hydromedusae of the Gulf of Mexico. Fishery Bulletin of the fish wildlife service 55: 273–274. [ Links ]
Segura–Puertas, L. 1984. Morfología, sistemática y zoogeografía de las medusas (Cnidaria, Hydrozoa y Scyphozoa) del Pacífico Tropical Oriental. Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Publicación especial 8: 1–320. [ Links ]
Segura–Puertas, L. 1992. Medusae (Cnidaria) from the Yucatán Shelf and Mexican Caribbean. Bulletin of Marine Science 51 (3): 353–359. [ Links ]
Segura–Puertas, L. & M. Damas–Romero. 1997. Variación estacional de la comunidad de medusas (Cnidaria) en la Laguna Bojórquez, Cancún, México. Hidrobiológica 7: 59–64. [ Links ]
Segura–Puertas, L., E. Suárez–Morales & L. Celis. 2003. A checklist of the Medusae (Hydrozoa, Scyphozoa and Cubozoa). Zootaxa 194: 1–15. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). 2005. Decreto por el que se declara área natural protegida, con el carácter de área de protección de flora y fauna, la región conocida como Laguna Madre y Delta del Río Bravo, ubicada en los municipios de Matamoros, San Fernando y Soto la Marina, en el estado de Tamaulipas, con una superficie total de 572,808–60–94.22 hectáreas. Diario Oficial de la Federación. México, D. F. abril 14: 7–14. [ Links ]
Simmons, E. G. 1957. An ecological survey of the upper Laguna Madre de Texas. Publications of the Institute Marine Science, University Texas 4 (2): 156–200. [ Links ]
Southward, A. J. 1954. Some notes on Man medusae. Report of the Marine Biological Station, Port Erin 1953, No. 66 Isle of Man, pp. 17–22. [ Links ]
Sousa E Silva, E. de & J. Dos Santos–Pinto. 1949. Plancton da Baía de S. Martinho do Porto. Boletim Sociedades Portuguesa de Ciencias Naturales 2 (2): 203–241. [ Links ]
Streftaris, N., A. Zenetos & E. Papathanassiou. 2005. Globalization in marine ecosystems: the story of non–indigenous marine species across European Seas. Oceanography and Marine Biology 43: 419–453. [ Links ]
Stechow, E. 1923. Zur Kenntnis der Hydroidenfauna des Mittelmeeres. Amerikas und anderer Gebiete, II. Zoologische Jahrbucher Abtheilung für Systematik 47: 29–270. [ Links ]
Suárez–Morales, E., L. Segura–Puertas & R. Gasca. 1999. A Survey of the Reef–Related Medusa (Cnidaria) community in the western Caribbean Sea. Gulf Research Reports 11: 23–31. [ Links ]
Suárez–Morales, E., R. Gasca, L. Segura–Puertas & D. C. Biggs. 2002. Planktonic cnidarians in a cold–core ring in the Gulf of Mexico. Anales del Instituto de Biología, Universidad Nacional Autónoma de México 73 (1): 19–36. [ Links ]
Thiel, M. E. 1938. Die Leptolinae der 'Meteor'–Expedition in systematis–cher Betrachtung. I Anthomedusen, II Leptomedusen. Zoologischer Anzeiger 121: 289–303. [ Links ]
Tiffon, Y. 1957. Présence de Nemopsis bachei (Agassiz) dans les eaux saumâtres de la Gironde (Anthomédusae) Recherches sur la faune de I'estuaire de la Gironde, II. Vie Milieu 7: 550–553. [ Links ]
Tunell Jr., J. W. 2002. Geography, Climate and Hydrography. In: Tunell Jr., J. W, & F. W. Judd (Eds.). The Laguna Madre of Texas and Tamaulipas. Texas A & M University Press, United States of America, pp. 7–27. [ Links ]
Uchida, T. 1927. Studies on Japanese Hydromedusae. I Anthomedusae. Journal of the Faculty of Science Imperial University Tokyo 1: 145–241. [ Links ]
Van Beneden, P. J. 1866. Recherches sur la Faune littorale de Belgique (Polypes). Mémoires de L'Academie Royale Belgique Classes des Sciences 36: 3–207. [ Links ]
Van der Spoel, S. 1991. Hydromedusan distribution patterns. Hydrobiologia 216/217: 489–496. [ Links ]
Vanhöffen, E. 1920. Colenterata pelagica. Beiträge zur Meeresfauna Westafr 3: 16–17. [ Links ]
Vannucci, M. 1957. On Brazilian hydromedusae and their distribution in relation to different water masses. Boletim do Instituto Oceanográfico de la Universidad de São Paulo, Brasil 8 (1–2): 23–109. [ Links ]
Vannucci, M., V. Santhakumari & E. P. Dos Santos. 1970. The ecology of hydromedusae from the Cochin area. Marine Biology 7: 49–58. [ Links ]
Watson, J. E. 1992. The hydroid community of Amphibolis seagrasses in south–eastern and south–western Australia. Scientia Marina 56 (2–3): 217–227. [ Links ]
Wolff, W. J. 2005. Non–indigenous marine and estuarine species in the Netherlands. Zoologische Mededelingen Leiden 79: 1–116. [ Links ]
Yashnov, V. A. 1952. Coelenterates from the Pacific Ocean around Kamchatka. Investment Far–East Seas U. S. S. R. Moscow 3: 95–98. [ Links ]
Zakaria, H. Y. 2004. Pelagic Coelenterates in the waters of the western part of the Egyptian Mediterranean Coast during summer and winter. Oceanología 46 (2): 253–26. [ Links ]














