Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.19 no.2 Ciudad de México Mai./Ago. 2009
Artículos
Colonización de hojas en descomposición de Eucalyptus camaldulensis Dehnhardt por invertebrados en un cauce secundario del río Paraná medio
Invertebrate colonization on Eucalyptus camaldulensis Dehnhardt leaf litter breakdown in an anabranche of the Middle Parana River
María Celeste Galizzi1 y Mercedes Marchese1,2
1 Facultad de Humanidades y Ciencias. Universidad Nacional del Litoral (UNL). Ciudad Universitaria 3000. Santa Fe, Argentina. *E–mail: celegalizzi@argentina.com
2 Instituto Nacional de Limnología (INALI–CONICET–UNL).
Recibido: 30 de mayo de 2008.
Aceptado: 18 de marzo de 2009.
RESUMEN
Hojas de Eucalyptus camaldulensis, fueron recolectadas después de la abscisión y se colocaron 6 g de hojas secas en bolsas de nylon de 5 mm de abertura de malla en un cauce secundario del río Paraná medio (31° 40'S y 60° 33' O). Se extrajeron 3 réplicas a los 7, 14, 28, 56 y 112 días durante un período de estiaje del agua (mayo–septiembre, 2002). El coeficiente de descomposición (k) fue de 0.0131 d–1 a los 112 días. El tiempo necesario estimado para que se descomponga el 95% del material vegetal fue de 36 días, teniendo en cuenta el coeficiente k obtenido. La mayor densidad de invertebrados (600 ind.g–1 de peso seco de hojas) y riqueza taxonómica (39 taxa) fueron obtenidas a los 112 y 14 días de exposición, respectivamente. Los quironómidos y bivalvos fueron los taxa dominantes en la colonización de hojas en descomposición. Los colectores – recolectores (principalmente Naididae y Chironominae) dominaron las primeras etapas de la sucesión y los colectores – filtradores (Limnoperna fortunei) aumentaron notablemente en las etapas finales. Mientras que los trituradores (Polypedilum spp.) fueron más abundantes durante las primeras fases de la colonización.
Palabras clave: Eucalyptus camaldulensis, descomposición, grupos funcionales.
ABSTRACT
Eucalyptus camaldulensis leaves collected at abscission and 6 g dry weight were placed innylon bags of 5 mm mesh net in a secondary channel of Middlle Parana River (31° 40'S y 60° 33' W). Three replicates were collected after 7, 14, 28, 56 and 112 days during low water level (may–september 2002). The decay coefficient (k) calculated over 112 days was 0.0131 d–1. The time estimated for 95% of leaves decomposition was 36 days according to the k obtained. The highest invertebrate density (600 ind.g–1 of leaves dry weight) and taxonomic richness (39 taxa) were obtained at 112 days and 14 days of leaf decomposition, respectively. The colonization on decomposing leaves was dominated by chironomids and mussels. Gatherers–collectors (Naididae and Chironominae) were dominant during the first time and filterers–collector (Limnoperna fortunei) increasing at the end of colonization experiment. The shredders (Polypedilum spp.) were more abundant in the first and media colonization phases.
Key words: Eucalyptus camaldulensis, decomposition, feeding functional groups.
INTRODUCCIÓN
La vegetación riparia se considera como la fuente principal de ingreso de energía en los ríos de primer orden y la descomposición de sus hojas es una función importante de los ecosistemas acuáticos (Vannote et al., 1980; Webster & Benfield, 1986; Paul et al., 2006). Por otro lado, en grandes ríos con llanura aluvial el – mayor aporte de materia orgánica lo constituyen las macrofitas que pueden alcanzar una producción alta (Neiff, 1979; Bayo et al., 1981; Junk & Howard–Williams, 1984; Sabattini & Lallana, 2007). Sin embargo, la selva en galería en las riberas de los cauces secundarios menores, aporta una cantidad importante de hojas que se acumulan (principalmente en aguas bajas) formando parches discretos que son colonizados y utilizados como recursos tróficos por los invertebrados. Por lo tanto, las hojas que ingresan al río ofrecen un hábitat nuevo para ser colonizado por hongos, bacterias e invertebrados que participan en su proceso de descomposición y sólo parte de los nutrientes liberados son transportados aguas abajo (Cummins et al., 1989; Richardson, 1991, Magee, 1993; Graça, 2001; Graça et al., 2001,2005; Mathuriau & Chauvet, 2002).
La descomposición es función de diversos factores (físicos, químicos y biológicos) que interactúan; los hongos y bacterias digieren la celulosa y liberan compuestos simples que pueden ser asimilados por los invertebrados. La rapidez con que se lleve a cabo esta liberación de nutrientes dependerá de las condiciones hidráulicas y del enriquecimiento de nutrientes del sistema, así como de la composición química de las hojas (Ardón et al., 2006; Poi de Neiff et al., 2006). El proceso de descomposición es afectado positivamente por la calidad nutricional de las hojas (principalmente nitrógeno) y negativamente por el porcentaje de ligninas y fenoles (Ostrofsky, 1997).
El resultado de la degradación enzimática microbiana y la abrasión física es la materia orgánica particulada en fracción gruesa (MOPG), que a su vez es fragmentada por los trituradores a materia orgánica particulada fina (MOPF).
Numerosos autores han estudiado la tasa de descomposición de las hojas de diversas especies de árboles en distintas regiones geográficas incluyendo Eucalyptus camaldulensis Dehnhardt, Eucalyptus globulus La Billardière, Tessaria integrifolia Ruiz et Pavón, Salix humboldtiana Willdenow, Copernicia alba Morong, Alnus glutinosa (Linnaeus) Gaertner, Populus nigra Linnaeus, Populus canadensis Moench y Castanea sativa Miller (Neiff & Poi de Neiff, 1991; Schulze & Walker, 1997; Pozo et al., 1997; Casas & Gessner, 1999; Poi de Neiff & Casco, 2001; Salmoiraghi et al., 2001; Baldy et al., 2002; Mathuriau & Chauvet, 2002; Capello et al., 2004; Hoffman, 2005; Azevedo–Pereira et al., 2006; Rueda–Delgado et al., 2006; Galizzi & Marchese, 2007).
En este trabajo se propuso analizar la colonización por invertebrados en hojas en descomposición de una especie exótica muy utilizada en forestación en América del Sur como Eucalyptus camaldulensis Dehnhardt (= E. rostrata Schltdl); analizando el reemplazo de especies a lo largo del proceso de descomposición para determinar los grupos funcionales de los invertebrados colonizadores y evaluar su participación en la degradación de la materia orgánica.
MATERIALES Y MÉTODOS
Las observaciones de descomposición y colonización se llevaron a cabo en el río Tiradero Viejo (31° 40'S y 60° 33'O), cauce secundario del río Paraná medio. Las hojas de E. camaldulensis fueron tomadas de árboles en pie y secadas al aire. Un total de 6 g de hojas se colocó en bolsas de nylon flexible de 10 cm de ancho, 30 cm de largo y 5 mm de abertura de malla siguiendo la estrategia descrita en Wantzen y Wagner (2006). Estas bolsas se colocaron el 16 de mayo de 2002 en la ribera derecha del río (31° 40' y 60° 33'W) y se recolectaron 3 réplicas a los 7, 14, 28, 56 y 112 días respectivamente. Se registraron: velocidad de la corriente (con flotadores), pH (con potenciómetro Hellige), oxígeno disuelto (con oxímetro YSI), temperatura del agua subsuperficial (con termómetro estándar) y tamaño de grano de los sedimentos de fondo (según escala de Wentworth, 1932).
En el laboratorio, las hojas se extrajeron de las bolsas y se lavaron filtrándose el detritus y los organismos retenidos en el interior de cada una a través de un tamiz de 200 µm. Las hojas y la materia orgánica particulada retenida (MOP) se secaron en estufa a 65 °C durante 24 horas y se pesaron en una electrobalanza. Posteriormente, sólo la materia orgánica particulada se calcinó a 550 °C durante 2 horas en una mufla para obtener el contenido en materia orgánica por incineración expresada en gramos peso seco porque la materia orgánica particulada es en mayor parte originada por la descomposición de las hojas, pero las bolsas pueden actuar como trampas de sedimentación de materia orgánica particulada fina (MOPF) y ultrafina (MOPUF) también. Los organismos, previamente teñidos con eritrosina para facilitar su observación, fueron extraídos de la muestra usando un microscopio estereoscópico y se conservaron en alcohol al 70 %. El total de los organismos en cada una de las réplicas, fue analizado cuali y cuantitativamente, obteniéndose el valor de la media (ind. g–1 peso seco hoja) y la desviación estándar. Se analizó también la densidad y riqueza de especies. El coeficiente de correlación de Pearson se calculó con los datos de materia orgánica obtenida por incineración y la abundancia de los invertebrados y entre densidad, riqueza de taxa y peso seco de las hojas.
El índice de Bray–Curtis se determinó para la densidad de invertebrados obtenida en cada fecha de muestreo con objeto de analizar la disimilitud. De este análisis se obtuvo un dendrograma por el método de pares no ponderados (UPGMA). Se determinaron los grupos funcionales en relación con la clasificación de Merrit y Cummins (1996) y Cummins et al. (2005).
El coeficiente de descomposición para las hojas de E. camaldulensis se calculó según el modelo exponencial negativo de Petersen and Cummins (1974)
Wt = W0 e –kt
Donde Wt, es el peso después de t días,
W0 es el peso inicial, y
k es el coeficiente de descomposición.
RESULTADOS
La profundidad del sitio de muestreo en la ribera derecha del río Tiradero Viejo varió entre 0.65 m (09/09/2002) y 1.56 m (13/06/2002) en relación con el nivel hidrométrico del río Paraná en el puerto de la ciudad de Santa Fe (Tabla 1). La velocidad de la corriente presentó un valor promedio de 0.61 m · s–1 (± 0.2). La composición granulométrica de los sedimentos del fondo del río Tiradero Viejo en el área de estudio fue del 38.07% de arena, 44.30% de limo y 27.63 % de arcilla. La temperatura del agua osciló entre 12.5 °C y 20 °C, la conductividad entre 70 µS cm–1 y 100 µS cm–1, mientras que el pH se mantuvo constante con un valor de 7.2 durante todo el periodo de muestreo. La concentración de oxígeno disuelto en el agua fluctuó entre 10.94 mg · l–1 y 3.7 mg. · l–1, registrándose el menor valor en relación al menor nivel del agua con prácticamente nula velocidad de la corriente. La visibilidad del disco de Secchi osciló entre 23 y 53 cm, coincidiendo el menor valor con la altura máxima del nivel del río Paraná, debido a un efecto de resuspensión de sedimentos finos y mayor transporte de sólidos suspendidos (Tabla 1).
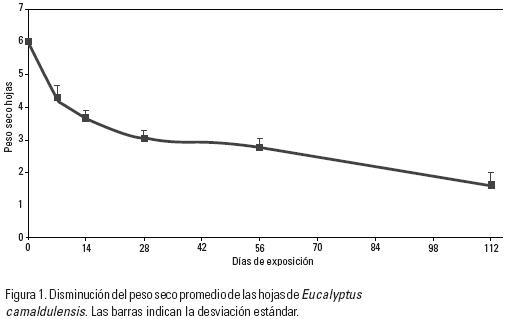
La pérdida de peso seco de las hojas de E. camaldulensis fue rápida durante los primeros 14 días del estudio, llegando a perder un 37.8% del peso total (Fig. 1). El coeficiente de decaimiento, k, obtenido con base en los 112 días de permanencia en las bolsas en el agua fue de 0.0131 d–1. Con base en k se calculó el tiempo necesario estimando para la descomposición del 95% del material vegetal fue de 36 días.
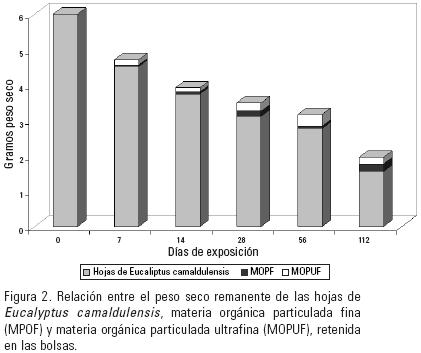
En el transcurso del estudio, la materia orgánica particulada fina (MOPFF) fue aumentando gradualmente, alcanzando su máximo valor al día 112 (0.21 g de peso seco; (Fig.2). La materia orgánica particulada ultrafina (MOPUF) presentó su valor máximo (0.33 g de peso seco) a los 56 dias de exposición , etapa en la cual se observó una disminución en la cantidad de individuos por gramos de peso seco (ind. g–1).
La densidad de invertebrados colonizadores de hojas en descomposición de E. camaldulensis presentó variaciones a lo largo del tiempo, obteniéndose el valor máximo a los 112 días de exposición (600 ind. g peso seco hoja; (Fig. 3).

La riqueza de taxa osciló entre 22 especies el día 56 y 39 a los 14 días de exposición (Fig. 3).
El grupo taxonómico más abundante que se encontró colonizado a los siete días del proceso de descomposición fue el de los quironómidos (28%), representados por Polypedilum spp., Phanopsectra sp., Ablabesmyia (Karelia), seguido por el de los oligoquetos (25%), representado por Pristina leidyi Smith, 1896, Dero obtusa d'Udekem, 1885, Dero sawayai Marcus, 1943 y Dero multibranchiata Steiren, 1892 y los ostrácodos (16%; Tabla 3). A los 14 días hubo un incremento de los oligoquetos (30%) y bivalvos (Limnoperna fortunei Dunker, 1857) (10%), los quironómidos se mantuvieron constantes (24%) y los ostrácodos disminuyeron (12%). Al día 28 se registró una reducción de oligoquetos (15%) y un aumento de quironómidos (36%), bivalvos (15%) y gasterópodos (13%; Fig. 4).
A los 56 días los oligoquetos mostraron un segundo incremento (65%); el resto de los grupos disminuyó. A los 112 días los quironómidos disminuyeron, representando un 2% y el grupo más abundante fue el de los bivalvos (86%), representados por L. fortunei (Fig. 4).
Del empleo del índice de Bray–Curtis a la densidad de especies registradas se evidencia una mayor disimilitud entre el comienzo del proceso de colonización y el resto del estudio (Fig. 5).
Se obtuvieron correlaciones significativas (p <0.05) con la aplicación del índice de Pearson sólo entre la densidad y peso seco de hojas remanente (r= –0.75), con la materia orgánica particulada fina (r= 0.82) y entre la riqueza de taxa y la materia orgánica particulada ultrafina (r= –0.88).
Se registraron cinco grupos funcionales, siendo los colectores–recolectores los más abundantes durante las primeras etapas de descomposición (Tabla 2).

Los colectores filtradores fueron el grupo funcional con número mayor de individuos en las fases finales del proceso de descomposición y colonización, debido a la colonización realizada por el bivalvo introducido, Limnoperna fortunei.
Los trituradores se mantuvieron constantes a lo largo del estudio y aumentaron a los 56 días donde alcanzaron su valor máximo. Este grupo estuvo representado por los quironómidos, especialmente Polypedilum spp.
Los raspadores alcanzaron su valor máximo en las etapas intermedias del proceso de colonización. Los depredadores se mantuvieron constantes durante todo el estudio, disminuyendo en las etapas finales (Fig. 6).

DISCUSIÓN
Las diferencias en el tiempo requerido para la descomposición de las diversas plantas está determinado por la calidad de las hojas, incluyendo la concentración de carbono orgánico y de nutrientes (Ardón et al., 2006; Poi de Neiff et al., 2006). Por esta y otras razones, como la temperatura del agua, pH, composición de la biota (Chauvet et al., 1993; Irons et al., 1994; Gessner et al., 1999) así como también por la metodología empleada, el coeficiente de decaimiento puede variar. Las tasas de descomposición de hojas en arroyos forestados se ha clasificado por Petersen & Cummins (1974) en tres categorías de procesamiento: baja (<0.005 d–1), media (0.005–0.010 d–1) y rápida (>0.010 d–1) en base al tiempo requerido. Schulze y Walker (1997) obtuvieron un k de 0.0149 d–1 para E. camaldulensis y este estudio obtuvo un valor similar (k 0.0131 d–1 ) para la misma especie y para el mismo intervalo de temperatura. Por lo tanto presenta una tasa de descomposición rápida de acuerdo la clasificación de Petersen y Cummins (1974), mientras que otras especies (Eucalyptus blakelyi Maiden, E. marginata Donn, E. globulus La Billardière) presentan una tasa de descomposición baja o media (Tabla 3).
El tiempo requerido para que se descomponga el 95% de las hojas de E. camaldulensis (36 días) fue menor que el registrado para las especies nativas como Tessaria integrifolia donde fue de 56 días (Galizzi & Marchese, 2007), Copernicia alba de 94 días (Poi de Neiff & Casco, 2001) y para plantas palustres, tales como Panicum elephantipes Nees ex Trinius que fue de 81 días (Poi de Neiff & Bruquetas de Zozaya, 1991) y Polygonum accuminatum Kunth de 40 días (Poi de Neiff & Bruquetas de Zozaya, 1989). Se puede inferir, por lo tanto que las áreas forestadas con Eucalyptus aportan materia orgánica de rápida descomposición a los ríos.
Schulze y Walker (1997) y Pozo et al. (1997) reconocieron que las hojas de Eucalyptus se lignifican luego de la abscisión y contienen niveles altos de tanino que son tóxicos para algunos animales, así como también que las hojas de eucaliptos se descomponen mayoritariamente por la acción de microorganismos. Este hecho podría explicar la variación en el tiempo requerido por la descomposición del 95% de las hojas.
El número máximo de individuos registrado por bolsa (600 ind.g–1) fue mayor que el registrado (479 ind.g–1) por Schulze y Walker (1997) para E. camaldulensis. En relación con otras especies vegetales, el número de individuos por bolsa registrado para E. camaldulensis fue mayor que el reportado para Tessaria integrifolia (478 ind.g–1 y 136 ind.g–1, según Galizzi & Marchese, 2007 y Neiff & Poi de Neiff, 1991, respectivamente) y Copernicia alba (149 ind.g–1, de acuerdo con Poi de Neiff & Casco, 2001) y menor que para Salix humboldtiana (815 ind.g–1, según Capello et al., 2004).
Las hojas en descomposición de E. camaldulensis fueron colonizadas sólo por 39 taxa, mientras que Schulze y Walker (1997) encontraron 128 taxa en hojas de la misma especie en Australia, donde es nativa.
El aumento en la densidad de invertebrados colonizadores en hojas de descomposición, como las de Eucalyptus, ocurre cuando las hojas comienzan a ser más utilizadas como recurso trófico (Schulze & Walker, 1997). En coincidencia, en nuestro estudio la densidad se relacionó positivamente con el aumento de materia orgánica particulada fina resultante del proceso de descomposición de las hojas, mientras que la riqueza de taxa lo hizo inversamente con el aumento de la fracción ultrafina. Este hecho sumando a que las hojas de Eucalyptus se descomponen mayoritariamente por la acción de los microorganismos, podría explicar que la mayoría de los taxa registrados en este estudio son colectores de MOPF utilizando como recurso trófico a hongos y bacterias asociadas al detritus. Estos invertebrados utilizan los detritos como sustrato o alimento participando indirectamente en la descomposición (Mathuriau & Chauvet, 2002).
Teniendo en cuenta la clasificación de grupos tróficos de Cummins et al., (2005) quienes señalan que los invertebrados que mastican broza o tejidos vivos de plantas vasculares son trituradores, podemos considerar que los quironómidos como Polypedilum spp. y Phanopsectra spp. cumplieron esta función en el proceso de descomposición de E. camaldulensis. En coincidencia, Callisto et al. (2007) reconocen resultados donde algunas especies de quironómidos son capaces de utilizar hojas condicionadas como fuente de alimento. No obstante, en la mayoría de los trabajos realizados en regiones tropicales y subtropicales señalan la escasez de trituradores en el proceso de descomposición de hojas de la vegetación riparia (Dudgeon & Wu, 1999; Neiff & Poi de Neiff, 1991; Mathuriau & Chauvet, 2002; Wantzen et al., 2002; Capello et al., 2004; Rueda–Delgado et al., 2006; entre otros). Una de las posibles explicaciones de esta escasez en las regiones tropicales es que la actividad microbiana es más rápida y efectiva que en las regiones templadas (Irons, et al., 1994; Wantzen et al., 2007).
AGRADECIMIENTOS
Al Dr. K. M. Wantzen por las sugerencias recibidas en el diseño experimental como director del Proyecto WW–DECOEX (World – Wide Aquatic Leaf DECOmposition Experiment). A la Lic. S. Capello por su contribución con los datos de materia orgánica. A la Universidad Nacional del Litoral por el subsidio otorgado (CAI+D) para realizar parte de este estudio.
REFERENCIAS
Ardón, M., L. A. Stallcup & C. A. Pringle. 2006. Does leaf quality mediate the stimulation of leaf breakdown by phosphorus in Neotropical streams?. Freshwater Biology 51: 618–633. [ Links ]
Azevedo – Pereira, H. V. S., M. A. S. Graça & J. M. gonzales. 2006. Life history of Lepidostoma hirtum in Iberian stream and its role in organic matter processing. Hydrobiologia 559: 183–192. [ Links ]
Baldy, V., E. Chauvet, J. Y. Charcosset & M. O. Gessner. 2002. Microbial dynamics associated with leaves decomposing in the main stem and floodplain pond of a large river. Aquatic Microbial Ecology 28: 25–3. [ Links ]
Bayo, V., V. Lallana, E. Lorenzatti & C. Marta. 1981. Evaluación cuantitativa de la vegetación acuática en islas del valle aluvial del río Paraná Medio. Ecología 6: 67–72. [ Links ]
Briggs, S. V. & M. T. Maher. 1983. Litter fall and leaf decomposition in a river red gum (Eucalyptus camaldulensis) swamp. Australian Journal Botany 31: 307–316. [ Links ]
Bunn, S. E. 1988a. Processing of leaf litter in two northern jarrah forest stream, Western Australia, I. Seasonal differences. Hydrobiologia 162: 201–210. [ Links ]
Bunn, S. E. 1988b. Processing of leaf litter in two northern jarrah forest stream, Western Australia, II. The role of macroinvertebrates and the influence of soluble polyphenol and inorganic sediment. Hydrobiologia 162: 211–223. [ Links ]
Callisto, M., J. F. Conçalves Jr. & M. A. S. Graça. 2007. Leaf litter as a posible food source fro chironomids (Diptera) in Brazilian and Portuguese headwater stream. Revista Brasileira de Zoología 24 (2): 442–448. [ Links ]
Campbell, I. C. & L. Fuchshaber. 1995. Polyphenols, condensed tannins and processing rates of tropical and temperate leaves in an Australian stream. Journal North American Benthological Society 14: 174–182. [ Links ]
Capello, S., M. Marchese & I. Ezcurra de Drago. 2004. Descomposición y colonización por invertebrados de hojas de Salíx humboldtiana en la llanura aluvial del río Paraná Medio. Amazoniana 18 (1/2): 125–143. [ Links ]
Casas, J. J. & M. O. Gessner. 1999. Leaf litter breakdown in a Mediterranean stream characterised by travertine precipitation. Freshwater Biology 41: 781–793. [ Links ]
Chauvet, E., N. Giani & M. O. Gessner. 1993. Breakdown and invertebrate colonization of leaf litter in two contrasting stream: significance of oligochaetes in a large river. Canadian Journal Fisheries Aquatic Science 50: 488–495. [ Links ]
Cummins, K. W., R. W. Merritt & P. C. N. Andrade. 2005. The use of invertebrate functional groups to characterize ecosystem attributes in selected stream and rivers in south Brazil. Studies on Neotropical Fauna and Environment 40 (1): 69–89. [ Links ]
Cummins, K. W., M. A. Wilzbach, D. M. Gates, J. B. Perry & W. B. Taliaferro.1989. Shredders and riparian vegetation. Bioscience 39: 24–30. [ Links ]
Dudgeon, D. & K. K. Y. Wu. 1999. Leaf litter in a tropical stream: food or substrate for macroinvertebrates?. Archiv für Hydrobiologie 146: 65–82. [ Links ]
Galizzi, M. C. y M. Marchese 2007. Descomposición de hojas de Tessaria integrifolia (Asteraceae) y colonización por invertebrados en un cauce secundario del río Paraná Medio. Interciencia 32 (8): 535–540. [ Links ]
Gessner, M. O., E. Chauvet & M. Dobson. 1999. A perspective on leaf litter breakdown in streams. Oikos 85: 377–384. [ Links ]
Graça, M. A. S. 2001. The role of invertebrates on leaf litter decomposition in streams – a review. International Revue Hydrobiologie 86 (4–5): 383–393. [ Links ]
Graça, A. S., f. Bärlocher & M. O. Gessner. 2005. Methods to study litter decomposition: a practical guide. Springer–Verlag 329 p. [ Links ]
Graça A. S., R. C. Ferreira & C. N. Coimbra. 2001. Litter processing along a stream gradient: the role of invertebrates and decomposer. Journal North American Benthological Society 20 (3): 408–420. [ Links ]
Hoffman, A. 2005. Dynamics of fine particulate organic matter (FPOM) and macroinvertebrates in natural and artificial leaf packs. Hydrobiologia 549: 167–178. [ Links ]
Irons, J. G. III, M. W. Oswood, R. J. Stout & C. M. Pringle. 1994. Latitudinal patterns in leaf breakdown: is temperature really important? Freshwater Biology 32: 401–411. [ Links ]
Junk, W. J. & C. Howard–Williams. 1984. Ecology of aquatic macrophytes in Amazonia. In: Sioli, H. (Ed.). The Amazon, limnology and landscape ecology of a mighty tropical river and its basin. Junk Publishers, pp.269–293. [ Links ]
Magee, P. A. 1993. Detrital accumulation and processing in wetlands. Fish and Wildlife leaflet. Waterfowl Management Handbook. [ Links ]
Mathuriau, C. & E. Chauvet. 2002. Breakdown of litter in a neotropical stream. Journal North American Benthological. Society 21 (3): 384–396. [ Links ]
Merritt, R. W. & K. W. Cummins. 1996. An introduction to the Aquatics Insects of North America. Kendal–Hunt Publishing Company Iowa. 862 p. [ Links ]
Neiff, J. J. 1979. Fluctuaciones de la vegetación acuática en ambientes del valle de inundación del Paraná Medio. Physis 38: 41–53. [ Links ]
Neiff, J. J. & A. Poi de Neiff. 1991. Litterfalll, leaf decomposition and litter colonization of Tessaria integrifolia (ompositae) in the Paraná River Floodplain. Hydrobiologia 203: 45–52. [ Links ]
Ostrofsky, M. L. 1997. Relationship between chemical characteristics of autumn – shed leaves and aquatic processing rates. Journal North American Benthological Society 16 (4): 750–759. [ Links ]
Paul, M. J., J. L. Meyer & C. A. Couch. 2006. Leaf bre akdown in streams differing in catchment land use. Freshwater Biology 51: 1684–1695. [ Links ]
Petersen, R. C. & K. W. Cummins. 1974. Leaf processing in a woodland stream. Freshwater Biology 4: 343–368. [ Links ]
Poi de Neiff, A. & I. Y. Bruquetas de Zozaya. 1989. Efecto de las crecidas sobre poblaciones de invertebrados que habitan macrófitas emergentes en islas del río Paraná. Revue Hydrobiologie Tropicale 22 (1): 13–20. [ Links ]
Poi de Neiff, A. & I. Y. Bruquetas de Zozaya. 1991. Colonización por invertebrados de macrófitos emergentes durante su descomposición en el río Paraná. Revue Hydrobiologie Tropicale 24 (3): 209–216. [ Links ]
Poi de Neiff, A. & S. L. Casco. 2001. Caída de hojas, descomposición y colonización por invertebrados en palmares de la planicie de inundación del río Paraná (Chaco, Argentina). Interciencia 26 (11): 567–571. [ Links ]
Poi de Neiff, A, J. J. Neiff & S. Casco. 2006. Leaf litter decomposition in three wetland types of the Paraná River floodplain. Wetlands 26 (2): 558–566. [ Links ]
Pozo, J., E. Gonzáles, J. R. Díez, J. Molinero & A. Elósegui. 1997. Inputs of particulate organic matter to streams whit different riparian vegetation. Journal North American Benthological Society 16 (3): 602–611. [ Links ]
Richardson, J. S. 1991. Food, microhabitat, or both? Macroinvertebrate use of leaf accumulations in a montane stream. Freshwater Biology 27: 169–176. [ Links ]
Rueda – Delgado, G., K. M. Wantzen & M. Beltrán Tolosa. 2006. Leaf – litter decomposition in an Amazonian floodplain stream: effects of seasonal hydrological changes. Journal North American Benthological Society 25 (1): 233–249. [ Links ]
Sabattini, R. & V. H. Lallana. 2007. Aquatic Macrophytes. In: Iriondo, M., J. C. Paggi & M. J. Parma (Eds.). The Middle Paraná River. Limnology of a Subtropical wetland. Springer–Verlag, pp. 205–224. [ Links ]
Pidgeon, R. W. J. & S. C. Cairns. 1981. Decomposition and colonization by invertebrates of native and exotic leaf material in a small stream in New England (Australia). Hydrobiologia 77: 113–127. [ Links ]
Salmoiraghi, G., B. Gumiero, A. Pasteris, S. Prato, C. Bonacina& G. Bonomi. 2001. Breakdown rates and macroinvertebrate colonization of alder (Alnus glutinosa) leaves in an acid lake (Lake Orta, N. Italy), before, during and after a liming intervention. Journal Limnology 60 (1): 127–133. [ Links ]
Schulze, D. & K. Walker. 1997. Riparian eucalyptus and willows and their significance for aquatic invertebrates in their River Murray, South Australia. Regulated Rivers Research and Management. 13: 557–577. [ Links ]
Vannote, R. L., G. W. Minshall, K. W. Cummins, J. R. Sedell & C. E. Cushing. 1980. The River Continuun Concept. Canadian Journal Fisheries Aquatic Science 37: 130–137. [ Links ]
Wantzen, K. M. & R. Wagner. 2006. Detritus processing by invertebrate shredders: a neotropical – temperate comparison. Journal North American Benthological Society 25 (1): 216–232. [ Links ]
Wantzen, K. M., J. M. Mathooko, C. Yule & C. M. Pringle. 2007. Organic matter dynamics and processing in tropical streams. In: Dudgeon, D. & C. Cressa (Eds.) Tropical Stream Ecology. Elsevier. pp. 37–45. [ Links ]
Wantzen, K. M., R. Wagner, R. Suetfeld & W. J. Junk. 2002. How do plant–herbivore interactions of trees influence coarse detritus processing by shredders in aquatic ecosystems of different latitudes? Verhandlungen Internationale Vereinigung Limnologie 28: 1–7. [ Links ]
Webster, J. R. & E. F. Benfield. 1986. Vascular plant breakdown in freshwater ecosystems. Annual Review of Ecology and Systematics 17: 567–594. [ Links ]
Wentworth, C. 1932. A scale of grade and class terms fro clastic sediments. Journal Geology. 30: 377–392. [ Links ]














