Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.19 no.2 Ciudad de México Mai./Ago. 2009
Artículos
Patrones de diversidad de ciliados del plancton en la laguna de Chautengo, Guerrero, México
Diversity patterns of planktonic ciliates in Chautengo lagoon, Guerrero, Mexico
Celia Bulit1* y Carlos Díaz–Ávalos2
1 Departamento El Hombre y su Ambiente, Universidad Autónoma Metropolitana, Unidad Xochimilco, Calzada del Hueso 1100, México D.F., 04960. México. *E–mail: cbulit@correo.xoc.uam.mx
2 Instituto de Investigaciones en Matemáticas Aplicadas y en Sistemas, Universidad Nacional Autónoma de México, Apdo. Postal 20–726, México D.F., 01000.
Recibido: 1 de septiembre de 2008.
Aceptado: 26 de marzo de 2009.
RESUMEN
El estudio de la distribución espacial de la diversidad del plancton contribuye al conocimiento de la estructura y el funcionamiento de los ecosistemas. Se estudió la organización espacial de la diversidad de ciliados del plancton en la laguna de Chautengo, Guerrero, con los objetivos de: 1) identificar y caracterizar los patrones espaciales de diversidad de ciliados y su variación estacional, y 2) evaluar la influencia de factores ambientales sobre la diversidad. Se aplicó un análisis geoestadístico de simulación condicional a los valores de H' (índice de diversidad de Shannon), calculados a partir de muestras recolectadas en 40–45 sitios de la laguna durante las épocas de lluvias y de secas. Las interrelaciones entre la diversidad de ciliados y el ambiente lagunar se evaluaron usando un análisis de componentes principales (ACP). Se identificaron 36 morfoespecies de ciliados pláncticos; H' varió entre 0.08 y 1.9 y se distribuyó en manchones. El ACP indica que la diversidad de ciliados cambió estacionalmente y en función de las características hidrodinámicas derivadas de la apertura y cierre de la boca lagunar. Durante la temporada de lluvias y cuando la barra estuvo abierta, se presentó una mayor heterogeneidad espacial con numerosos manchones de diversidad de menor extensión (1.6 km), en los cuales dominó el ciliado fototrófico Myrionecta rubra. En contraste, en temporada de secas y cuando la boca de la laguna permaneció cerrada, se encontraron dos manchones de diversidad de mayor tamaño (2.7 km), en los que dominaron Lohmanniella oviformis y Tintinnopsis sp. Se discute el impacto sobre las redes tróficas de la distribución en manchones de la diversidad de ciliados.
Palabras clave: Ciliados planctónicos, índice de Shannon, patrones espaciales, lagunas costeras.
ABSTRACT
The study of the spatial distribution of plankton diversity is important, as it contributes to gain insight about ecosystems structure and functioning. We studied the spatial organization of planktonic ciliate diversity in Chautengo lagoon, Guerrero. The objectives were 1) to identify and characterize the spatial patterns of ciliate diversity and their seasonal variability, and 2) to assess the influence of environmental factors on diversity distribution. Conditional simulation geostatistical analysis was applied to H' (Shannon diversity index), computed from samples collected in 40–45 sites in the lagoon in rainy and dry seasons. The relationship between ciliate diversity and lagoonal environment was examined using principal component analysis (PCA). We identified 36 planktonic ciliate morphospecies; H' ranged from 0.08 to 1.9 and was patchily distributed. PCA indicated that ciliate diversity changed according to the seasons and the hydrodynamics of the sand bar opening and closing. In the rainy season, when the sand bar was open, a higher spatial heterogeneity was prevalent, with many smaller patches (1.6 km) dominated by the phototrophic Myrionecta rubra. In contrast, during the dry season and when the sand bar was closed, two larger diversity patches (2.7 km) prevailed and the dominant ciliates were Lohmanniella oviformis and Tintinnopsis sp. The impact of the patchily distributed ciliate diversity on the food webs is discussed.
Key words: Planktonic ciliates, Shannon index, spatial patterns, coastal lagoons.
INTRODUCCIÓN
El estudio de la diversidad biológica tiene una larga tradición en distintos campos de la ecología; sin embargo, su distribución espacial ha sido abordada de manera restringida y más aún en ecosistemas marinos (Cyr & Pace, 2003).
La diversidad del plancton y sus cambios espaciales y temporales han recibido atención desde mediados del siglo anterior (Hutchinson, 1961). Los ciliados pláncticos constituyen un grupo abundante, rico en especies y ecológicamente importante por su papel en el circuito microbiano (Pierce & Turner, 1992), cuya diversidad ha sido menos estudiada que la de otros grupos del plancton, incluso en aguas marinas, donde el enfoque se ha centrado principalmente en los tintínidos (Dolan, 2000, Dolan et al., 2006, entre otros). Los ciliados son organismos con un espectro trófico amplio y su abundancia en ecosistemas costeros, en particular en las lagunas (Bulit et al., 2003; Bulit et al., 2004), influye en la estructura y el funcionamiento de las redes tróficas.
Aunque existen antecedentes sobre la distribución de la diversidad de distintos grupos de organismos: ciliados del suelo (Acosta–Mercado & Lynn, 2002); diatomeas fósiles (Kienel & Kumke 2002); copépodos (Beaugrand & Ibáñez, 2002); peces (Rueda & Defeo, 2003), no hay información sobre esta distribución en ciliados planctónicos de ecosistemas costeros tropicales como las lagunas. En ese sentido, el presente trabajo tuvo los siguientes objetivos: 1) identificar y caracterizar los patrones espaciales de diversidad de ciliados y su variación estacional y 2) evaluar la influencia de factores ambientales sobre la diversidad.
MATERIALES Y MÉTODOS
Área de estudio. La laguna de Chautengo se localiza en la Costa Chica de Guerrero (Fig. 1), en una cuenca poco industrializada, donde se mantiene el proceso natural de apertura y cierre de la boca. Es un cuerpo de agua somero, con una profundidad máxima de 1.9 m y 36 km2 de superficie; recibe los aportes de los ríos Nexpa y Copala y de algunos arroyos temporales.

La laguna se comunica con el mar a través de una boca estrecha (100–200 m) ubicada en la parte central de la barra arenosa, hacia el sur; el ciclo estacional determina su apertura y cierre periódicos, de manera que la boca permanece abierta, por lo regular, desde junio hasta enero. El momento de la apertura depende básicamente de que la precipitación pluvial se concentre en unos pocos días al inicio de la temporada. En esta región tropical hay dos estaciones climáticas: lluvias (mayo–octubre) y secas (noviembre–abril; Bulit et al., 2004).
Recolección y procesamiento de las muestras. Para evaluar los patrones espaciales en la distribución de la diversidad de ciliados del plancton a escala lagunar (km) se colectaron muestras en 40–45 sitios de la laguna. Diez de ellos se ubicaron a escala lagunar y los restantes 30–35 sitios se localizaron en una cuadrícula central (C, indicado en Fig. 1) de 40 × 40 m, a distancias de 1 y 10 m entre sí, en octubre de 2000, enero, marzo, mayo y agosto de 2001. La diferencia de escalas en el diseño del muestreo permitió obtener información importante para construir los variogramas (ver Análisis geoestadístico).
Las muestras de agua se tomaron a 0.4 m de profundidad, con una botella tipo Niskin, de 400 ml, construida especialmente para aguas someras. Se homogeneizaron y se almacenaron 100 ml de cada una, preservándolas con solución ácida de lugol, con una concentración final de 2 %. Se sedimentaron alícuotas en cámaras de 5 ml, se blanquearon con tiosulfato de sodio y las células de ciliados se identificaron y enumeraron, observándolas con un microscopio invertido Zeiss Axiovert 125 CFI, con alto aumento (200×, 400× y 1000×), equipado con epifluorescencia y contraste de fases. La identificación de los ciliados se basó en las descripciones de Marshall (1969), Small y Lynn (1985), Montagnes et al. (1988), Montagnes y Lynn (1991), Lynn y Gilron (1993), Agatha y Riedel–Lorje (1997) y Strüder–Kypke et al. (2002). Adicionalmente, las muestras fueron teñidas con DAPI en la misma cubeta de sedimentación y observadas con epifluorescencia para caracterizar la morfología nuclear, como un elemento diagnóstico para la identificación (Strüder–Kypke et al., 2002).
La diversidad de ciliados de cada muestra fue estimada calculando el índice de Shannon (H)
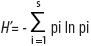
donde pi es la proporción de individuos de cada especie y s es el número total de especies en la muestra, con base en logaritmos naturales (Magurran, 1988).
La temperatura del agua y la salinidad se midieron con un termohalinoconductividímetro YSI 30, en tanto que la transparencia se determinó con un disco de Secchi.
Análisis de componentes principales. El ACP es una técnica de ordenación útil para reducir la información existente a pocas dimensiones, conservando gran parte de la variación de la información original. Las variables que influyen sobre la dinámica hidrobiológica del ecosistema lagunar se identificaron mediante esta técnica, con el programa CANOCO 4.5 (ter Braak & Smilauer, 2002). Se escogió este método porque los resultados de un análisis preliminar de correspondencias sin tendencias indicaron que las respuestas de las variables eran lineales (Leps & Smilauer, 2003). Se analizaron las correlaciones entre la temperatura, la salinidad, la transparencia, la longitud, la latitud y el índice de diversidad de ciliados. También se incluyeron en el análisis la estación climática (lluvias y secas) y el estado de la barra (abierta y cerrada), como variables nominales suplementarias. Estas variables se agregaron al diagrama de ordenación mediante la regresión de sus datos respecto a los ejes previamente calculados (ter Braak & Smilauer, 2002). Los datos originales (excepto latitud y longitud) fueron transformados logarítmicamente debido a la diferente naturaleza de sus escalas de medición.
Análisis geoestadístico de los patrones de diversidad a escala lagunar. La geoestadística es una herramienta útil para analizar los patrones de distribución espacial de variables ecológicas (Goovaerts, 1997). En este trabajo se modelaron las distribuciones de la diversidad de ciliados (H'), de la salinidad, de la temperatura y de la transparencia usando simulación condicional, método geoestadístico que permite representar un fenómeno espacial a partir de los datos observados (Chilès & Delfiner, 1999). Los datos condicionantes para elaborar los mapas de predicciones, se tomaron en diez estaciones de muestreo a escala lagunar y en 30–35 estaciones de la cuadrícula central (Fig. 1), separadas por distancias de 1 y 10 m para obtener información del variograma cerca del origen. Se calcularon los variogramas, que expresan la variación del índice de diversidad a medida que aumenta la distancia entre los sitios de muestreo, y se les ajustaron modelos exponenciales y esféricos, con efecto "pepita" (Montero–Lorenzo & Larraz–Iribas, 2008). Dichos modelos son dos respuestas diferentes, que indican el aumento de la varianza de la diversidad de ciliados a medida que la distancia entre los puntos de muestreo aumenta; el efecto pepita representa la varianza cuando la distancia entre dos puntos de muestreo es infinitesimal. En trabajos previos (Bulit et al., 2003; Bulit et al., 2004; Díaz–Avalos et al., 2006) se han expuesto en detalle técnicas geoestadísticas aplicadas a la distribución espacial de la abundancia de ciliados.
Usando los modelos mencionados se produjeron mil simulaciones, a través de la descomposición de la matriz de covarianza (Chilès & Delfiner, 1999). Los mapas que se presentan son el promedio de esas simulaciones y en ellos, los manchones se definen como aquellas regiones del cuerpo lagunar donde la diversidad de ciliados está por encima del tercer cuartil de los valores de simulación condicional (Bulit et al., 2004). También se calcularon los intervalos empíricos de confianza para la ubicación de los manchones, a partir de las envolturas correspondientes al 2.5 % y al 97.5% de las simulaciones condicionales (Diggle, 2003), usando un ejemplo gráfico para ilustrar esta aplicación. La simulación condicional se llevó a cabo con S–Plus (MathSoft). El análisis de los mapas de diversidad y de los factores abióticos se complementó con los resultados del ACP.
RESULTADOS
Variables ambientales y su relación con la diversidad. Los factores abióticos variaron espacial y temporalmente. La distribución de la temperatura mostró dos regiones de menor temperatura junto a la barra lagunar: una en enero (27.4°C; Fig. 2d), cuando la boca estuvo abierta, y la otra en marzo (29.7°C; Fig. 2f) cuando estuvo cerrada; en esa región la columna de agua fue más profunda (1.9 m). El rango de variación de temperatura fue de 5°C aproximadamente (26.5–31.6°C) considerando los datos de todos los muestreos (Fig. 2a–j). La salinidad fue mayor (34 ups) cerca de la boca de la laguna, mientras estuvo comunicada con el mar, y las aguas menos salinas (0 y 5.5 ups) se encontraron cerca de la desembocadura de los ríos (Fig. 2b, i). La salinidad tuvo una variación de 4 – 5 ups durante la estación seca (26 – 31 ups en enero y 26 – 30 ups en marzo; Fig. 2e, g) y una variación máxima de 34 ups durante la estación de lluvias (0 – 34 ups en octubre; Fig. 2b) y 15 – 30 ups en mayo (Fig. 2i). Las aguas más transparentes se encontraron siempre cerca de la boca lagunar, y las aguas más turbias, en las regiones internas de la laguna (Fig. 2c, h, j). El rango de variación de la transparencia fue de 0.4 m durante la estación seca (0.3 – 0.7 m en enero y marzo) y llegó a un máximo de 1.2 m en la estación de lluvias (0.3 a 1.5 m en octubre y 0.25 – 1.0 m en mayo; Fig. 2c, j). Los variogramas de transparencia en enero y de temperatura en mayo no mostraron estructura espacial, por lo que los mapas correspondientes no pudieron obtenerse.
El análisis de componentes principales indicó que la estructura en las matrices de variables ambientales y diversidad de ciliados es compleja. Los cuatro primeros componentes principales explicaron el 85.8% de la variación existente en todas las variables; el análisis pasivo de la interrelación con la estación climática y con el estado de la barra incrementó a 91.1 % la variación explicada. Los valores propios de los dos primeros componentes fueron 0.294 y 0.253 y entre ambos representaron el 54.8% de la variación total de los datos, que se incrementó a 67.5% cuando se incluyeron las variables suplementarias (Tabla 1).

Cada uno de los ejes principales mostró asociaciones particulares con las variables y con los sitios de muestreo. En el diagrama de ordenación (Fig. 3) se aprecia que el primer componente principal está influenciado fuertemente por la salinidad y la temperatura, estableciendo un eje hidrodinámico relacionado con la apertura de la barra lagunar y con la época de lluvias. En cambio, los pesos opuestos de la transparencia y de la latitud sobre el segundo componente principal establecen un eje determinado por la morfología de la laguna, que representa la influencia de aguas marinas en las que la luz penetra más profundamente, y que se asocian con el aumento del índice de diversidad hacia el sur de la laguna. El tercer componente estuvo fuertemente determinado por H' y por la longitud (Tabla 1), mostrando una relación inversa, y que caracterizan al eje mayor de la laguna. Adicionalmente, las variables suplementarias representadas por la época de lluvias y por la barra abierta, se correlacionaron positivamente con el primer componente principal, ayudando a interpretar los ejes de ordenación y aumentando el porcentaje de varianza explicada. En cambio, el estado de la barra cerrada y la estación de secas se correlacionaron con la temperatura, de manera opuesta a la diversidad.

La correlación entre las variables permitió distinguir tres grupos: el primero, en el cual se correlacionan la longitud, el índice de diversidad, la época de lluvias y la barra abierta; el segundo grupo, en el que se asocian H' y la transparencia, y el tercer grupo donde se aprecia la correlación positiva entre la salinidad, la temperatura, la barra cerrada y la época de secas.
Patrones en la diversidad de ciliados. En la laguna se identificaron treinta y seis morfoespecies de ciliados, con distintas características tróficas (Tabla 2); el índice de diversidad de la comunidad varió entre 0.08 y 1.90. El análisis geoestadístico permitió identificar patrones de distribución espacial de la diversidad, con características particulares en cada estación climática.

La simulación condicional de los datos obtenidos durante la época de lluvias predijo la existencia de varios manchones de diversidad en la laguna, ubicados en las regiones donde el valor de W'estuvo en el cuartil superior de la distribución (Fig. 4). En octubre de 2000 los manchones se ubicaron en las zonas donde H'> 0.6 (valor del cuartil superior, tomado como base para la definición de manchón propuesta); un manchón alargado, con un tamaño promedio de 1.6 km, bordeó la barra lagunar y allí se encontró la diversidad más alta (H'=1.9) observada en este estudio (Fig. 4a). El intervalo de confianza, representado por las envolturas correspondientes al 2.5 y al 97.5%, fue de 0.0 a 1.7. En mayo de 2001, al inicio de la segunda estación lluviosa, se identificaron manchones en los lugares donde H' > 0.8; el patrón espacial de los manchones fue semejante al de octubre, con un tamaño promedio de 1.6 km (Fig. 4b); H' varió entre 0.3 y 1.5 y tuvo un intervalo de confianza entre 0.6 y 1.0.

Los resultados de la estación de secas mostraron un único manchón de diversidad en la laguna (Fig. 5). En enero de 2001, el manchón de diversidad tuvo 2.7 km de tamaño promedio, y se localizó en los lugares donde H' > 1.1 (Fig. 5a); por otra parte, H' varió entre 0.1 y 1.4 y el intervalo de confianza osciló entre 0.8 y 1.4. En marzo de 2001 se localizó un único manchón de diversidad (2.7 km) en los sitios donde H' > 1.2 (Fig. 5b); H' varió entre 0.1 y 1.3 y su intervalo de confianza osciló entre 1.1 y 1.4.

Para ilustrar la aplicación de los intervalos de confianza se incluye un ejemplo gráfico: la Fig. 6b muestra el manchón de diversidad calculado con el promedio de mil simulaciones condicionales en enero de 2001, mientras que las Figuras 6a y 6c representan el valor inferior (0.8) y el superior (1.4) respectivamente, del intervalo de confianza.

DISCUSIÓN
Los cambios estacionales alteran la diversidad biológica y sus patrones espaciales. El uso de métodos espacialmente explícitos, como los geoestadísticos, reveló que la diversidad de ciliados en la laguna de Chautengo está estructurada en manchones, cuya ubicación, número y tamaño varían temporalmente. Adicionalmente, se identificaron las asociaciones entre la salinidad, la temperatura, la transparencia, las estaciones climáticas, el estado de la barra lagunary la diversidad de ciliados del plancton, indicativas del efecto de la variabilidad ambiental.
De acuerdo con el ACP, en la laguna de Chautengo, la variabilidad ambiental es un fenómeno multidimensional, situación que ha sido documentada en otras lagunas costeras (Medina–Gómez & Herrera–Silveira, 2003). El ACP permite identificar la contribución de diferentes parámetros y de condiciones ambientales, como el estado de la barra lagunary las estaciones climáticas, y su asociación con el aumento en la diversidad de ciliados. La dinámica hidrológica se caracteriza por un gradiente de salinidad (Componente 1), generado por los cambios estacionales y por el ciclo de apertura y cierre de la boca lagunar. La variación de H', asociada con aguas transparentes, se vincula con el gradiente latitudinal de la laguna (Componente 2), y las aguas cercanas a la boca, con influencia marina, albergan una mayor diversidad de ciliados. La transparencia en estas zonas más profundas se acentúa debido a que el sedimento es grueso, arenoso, y su resuspensión por efecto del viento y de las corrientes de marea es menor que en las regiones internas. El intercambio con el agua marina pudo haber propiciado, por una parte, la entrada a la laguna de ciliados neríticos como Favella ehrenbergii (Claparède & Lachmann, 1858), Jörgensen 1924, Eutintinnus fraknoii Daday 1887; el aumento de salinidad de las aguas también pudo haber estimulado el exquistamiento de ciliados en los sedimentos lagunares (Kim & Taniguchi, 1997). En una laguna del Mediterráneo se presentó un efecto similar, que promovió el desarrollo de comunidades de tintínidos (Lam–Hoai et al., 1997). Por lo tanto, a medida que las aguas marinas entran en la laguna, podrían delinearse las lenguas de diversidad ilustradas en este estudio. Por otra parte, en la época de lluvias, la escorrentía y las aguas de los ríos Nexpa y Copala pudieron haber transportado ciliados típicamente dulceacuícolas como Coleps sp., Cothurnia sp., Halteña sp. y Stentorsp. Este enriquecimiento de la diversidad se manifiesta en la presencia de manchones cercanos a las desembocaduras de los ríos. De manera que cuando los flujos externos provenientes del mar, de los ríos y de la precipitación pluvial perturbaron el sistema lagunar generando condiciones ambientales variables, se presentó una mayor heterogeneidad espacial con numerosos manchones de diversidad de menor extensión (1.6 km), en los cuales dominó el ciliado Myrionecta ruba (Lohmann) Jankowski, 1976. Este ciliado fotótrofo (Tabla 2) ha generado considerable interés por su peculiar endosimbiosis con criptofitas, su capacidad de producir florecimientos y por ser un eslabón hacia niveles tróficos superiores a través de su consumo por larvas de copépodos y de peces (Montagnes et al., 2008). En la laguna de Chautengo, M. rubra es un componente importante de la red trófica (Bulit et al., 2004).
En contraste, cuando la boca de la laguna permaneció cerrada y el sistema estuvo relativamente aislado, se apreció mayor homogeneidad hidrobiológica y se encontraron manchones de diversidad únicos y de mayor tamaño (2.7 km), en los que dominaron Lohmanniella oviformis Leegard, 1915 y Tintinnopsis sp. Este tíntinido es alguívoro (Tabla 2) y puede ingerir ciano–bacterias, muy abundantes en la laguna y representadas por los géneros Anabaena, Oscillatoria, Phormidium, entre otros. Lohmanniella retiene partículas de hasta 4–5 µm (Fenchel, 1987), es bacterívoro y puede aprovechar la abundancia de las bacterias, cuya variación es marcadamente estacional (Soto–Castor et al., 2002). Aproximadamente el 20% de las morfoespecies de ciliados encontradas son bacterívoras, lo que sugiere que esta vía trófica es importante.
Las lagunas costeras son ecosistemas diferenciados de los aledaños, cuya producción primaria y secundaria son generalmente altas y pueden sustentar el desarrollo de pesquerías y de actividades de acuacultura (Contreras–Espinosa & Warner, 2004). Sin embargo, el conocimiento de las relaciones entre la diversidad microbiana y el funcionamiento de las lagunas costeras está en sus etapas iniciales (Danovaro & Pusceddu, 2007). Por consiguiente, el estudio de la diversidad (H') de organismos del plancton y su distribución puede ayudar a dilucidar los mecanismos responsables y su modo de acción, así como el impacto sobre otros componentes del ecosistema. En este trabajo se identificaron treinta y seis morfoespecies de ciliados y se encontró que el índice de diversidad alcanzó un máximo de 1.9, resultado mayor que otros obtenidos con métodos similares de identificación, en diferentes ambientes acuáticos (Dolan & Marrasé, 1995; James & Hall, 1995; Vaqué et al., 1997; Kopylov et al., 2001). Por lo tanto, puede especularse que los ciliados ocupan un rango amplio de nichos ecológicos en el plancton de las lagunas costeras, potencialmente mayor que en otros ecosistemas. En ese sentido, actualmente se reconoce la existencia de redes tróficas complejas con numerosas especies de ciliados que participan tanto en el circuito microbiano como en la cadena trófica "clásica" (Pierce & Turner, 1992; Stickney et al., 2000). Como los ciliados realizan distintas funciones tróficas, los cambios en su diversidad pueden influir sobre múltiples niveles, desde las bacterias hasta los peces. En este trabajo se ha demostrado que un ecosistema puede estar fragmentado, en tiempo y en espacio, en regiones de alta y baja diversidad. Por lo tanto, los manchones y los huecos de diversidad albergarán distintas especies de ciliados, conformando distintas vías de producción y de consumo coexistentes.
Como señalamiento final, la diversidad y la distribución global de los protistas en general, y de los ciliados en particular, constituyen un tópico controvertido (Fenchel & Finlay, 2004; Katz et al., 2005; Foissner et al., 2008). El número total de especies de ciliados y su naturaleza ubicua están a discusión. Para evaluar su diversidad se necesita una estrategia de muestreo adecuada y este estudio sugiere que la distribución espacial de la diversidad es una característica a considerar para obtener estimaciones correctas. Esta conclusión es válida también para el estudio de los ciliados terrestres (Acosta–Mercado & Lynn, 2002), lo que permite inferir que el concepto puede tener implicaciones ecológicas de mayor alcance.
AGRADECIMIENTOS
Agradecemos al Dr. David J. S. Montagnes, de la Universidad de Liverpool, su valioso apoyo en la identificación de los ciliados. Asimismo agradecemos a dos revisores anónimos las atinadas observaciones que contribuyeron a mejorar este trabajo.
REFERENCIAS
Acosta–Mercado, D. & D. H. Lynn. 2002. A preliminary assessment of spatial patterns of soil ciliate diversity in two subtropical forests in Puerto Rico and its implications for designing an appropriate sampling approach. Soil Biology and Biochemistry. 34: 1517–1520. [ Links ]
Agatha, S. & J. C. Riedel–Lorje. 1997. Morphology, infraciliature, and ecology of halteriids and strombidiids (Ciliophora, Oligotrichea) from coastal brackish water basins. Archiv für Protistenkunde 148: 445–459. [ Links ]
Beaugrand, D. & F. Ibañez. 2002. Spatial dependence of calanoid cope–pod diversity in the North Atlantic Ocean. Marine Ecology Progress Series 232: 197–211. [ Links ]
Bulit, C., C. Díaz–Ávalos & D. J. S. Montagnes. 2004. Assessing spatial and temporal patchiness of the autotrophic ciliate Myrionecta rubra: a case study in a coastal lagoon. Marine Ecology Progress Series 268: 55–67. [ Links ]
Bulit, C., C. Díaz–Ávalos, M. Signoret & D. J. S. Montagnes. 2003. Spatial structure of planktonic ciliate patches in a tropical coastal lagoon: an application of geostatistical methods. Aquatic Microbial Ecology 30: 185–196. [ Links ]
Chilés, J. P. & P. Delfiner. 1999. Geostatistics: modeling spatial uncertainty. Wiley Interscience, New York, 695 p. [ Links ]
Contreras–Espinosa, F. & B. G. Warner. 2004. Ecosystem characteristics and management considerations for coastal wetlands in Mexico. Hydrobiologia 511: 233–245. [ Links ]
Cyr, H. & M. L. Pace. 2003. Magnitude and patterns of herbivory in aquatic and terrestrial ecosystems. Nature 361: 148–150. [ Links ]
Danovaro, R. & A. Pusceddu. 2007. Biodiversity and ecosystem functioning in coastal lagoons: Does microbial diversity play any role? Estuarine, Coastal and Shelf Science 75: 4–12. [ Links ]
Díaz–Ávalos, C., C. Bulit & D. J. S. Montagnes. 2006. Comparison of spatial methods for the assessment of planktonic patches. Environmental and Ecological Statistics 13: 163–181. [ Links ]
Diggle, P. J. 2003. Statistical analysis of spatial point patterns. Arnold, London, 159 p. [ Links ]
Dolan, J. R. 2000. Tintinnid ciliate diversity in the Mediterranean Sea: longitudinal patterns related to water column structure in late spring–early summer. Aquatic Microbial Ecology 22: 69–78. [ Links ]
Dolan, J. R. & C. Marrasé. 1995. Planktonic ciliate distribution relative to a deep chlorophyll maximum: Catalan sea, NW Mediterranean, June 1993. Deep–Sea Research Part I–Oceanographic Research Papers 42: 1965–1987. [ Links ]
Dolan, J. R., R. Lemée, S. Gasparini, L. Mousseau & C. Heyndrickx. 2006. Probing diversity in the plankton: using patterns in Tintinnids (planktonic marine ciliates) to identify mechanisms. Hydrobiologia 555: 143–157. [ Links ]
Fenchel, T. 1987, Ecology of Protozoa: the biology of free–living phago–trophic protists. Science Tech Publishers, Madison, 197 pp. [ Links ]
Fenchel, T. & B. J. Finlay. 2004. The ubiquity of small species: patterns of local and global diversity. BioScience 54(8):777–784. [ Links ]
Foissner, W., A. Chao & L. A. Katz. 2008. Diversity and geographic distribution of ciliates (Protista: Ciliophora). Biodiversity and Conservation 17: 345–363. [ Links ]
Goovaerts, P. 1997. Geostatistics for natural resources evaluation. Oxford University Press, New York. 483 p. [ Links ]
Hutchinson, G.E. 1961. The paradox of the plankton. The American Naturalist 95: 137–145. [ Links ]
James, M. R. & J. A. Hall. 1995. Planktonic ciliated protozoa: their distribution and relationship to environmental variables in a marine coastal ecosystem. Journal of Plankton Research 17: 659–683. [ Links ]
Katz, L. A., G. B. McManus, O. Snoeyenbos–West, A. Griffin, K. Pirog, B. Costas, W. Foissner. 2005. Reframing the 'Everything is everywhere' debate: evidence for high gene flow and diversity in ciliate morphospecies. Aquatic Microbial Ecology 41: 55–65. [ Links ]
Kienel, U. & T. Kumke. 2002. Combining ordination techniques and geostatistics to determine the patterns of diatom distributions at Lake Lama, Central Siberia. Journal of Paleolimnology 28: 181–194. [ Links ]
Kim, Y. O. & A. Taniguchi. 1997. Seasonal variation of excystment pattern of the planktonic oligotrich ciliate Strombidium conicum. Marine Biology 28: 207–212. [ Links ]
Kopylov, A. I., D. B. Kosolapov & M.V. Flint. 2001. Microplanktonic communities in the coastal waters, harbor, and salt lagoon of Saint Paul Island (Pribilof Islands, Bering Sea): structural and functional analysis. Oceanology 41: 94–104. [ Links ]
Lam–Hoai, T., C. Rougier & G. Laserre. 1997. Tintinnids and rotifers in a northern Mediterranean coastal lagoon. Structural diversity and function through biomass estimations. Marine Ecology Progress Series 152:13–25. [ Links ]
Leps, J. & P. Smilauer. 2003. Multivariate analysis of ecological data. University of South Bohemia, Ceske Budejovice. 110 p. [ Links ]
Lynn, D. H. & G. L. Gilron. 1993. Strombidiid ciliates from coastal waters near Kingston Harbour, Jamaica (Ciliophora, Oligotrichia, Strombidiidae). Journal of the Marine Biological Association of the U.K. 73: 47–65. [ Links ]
Magurran, A. E. 1988. Ecological diversity and its measurement. Princeton University Press, Princeton, 179 p. [ Links ]
Marshall, S. M. 1969. Protozoa. Order: Tintinnida. In: J. Fraser & V. Hansen (Eds.). Fiches d'identification du zooplancton. Fiches 117–127. Conseil International pour l'Exploration de la Mer, Paris. 81 p. [ Links ]
Medina–Gomez, I. & J. A. Herrera–Silveira. 2003. Spatial characterization of water quality in a karstic coastal lagoon without anthropogenic disturbance: a multivariate approach. Estuarine, Coastal and Shelf Science 58: 455–465. [ Links ]
Montagnes, D. J. S., J. Allen, L. Brown, C. Bulit, R. Davidson, C. Diaz–Avalos, S. Fielding, M. Heath, N. P. Holliday, J. Rasmussen, R. Sanders, J. J. Waniek & D. Wilson. 2008. Factors Controlling the Abundance and Size Distribution of the Phototrophic Ciliate Myrionecta rubra in Open Waters of the North Atlantic. Journal of Eukaryotic Microbiology 55: 457–465. [ Links ]
Montagnes, D. J. S. & D. H. Lynn. 1991. Taxonomy of choreotrichs, the major marine planktonic ciliates, with emphasis on the aloricate forms. Marine Microbial Food Webs 5: 59–74. [ Links ]
Montagnes, D. J. S., D. H. Lynn, D. K. Stoecker & E. B. Small. 1988. Taxonomic descriptions of one new species and redescription of four species in the family Strombidiidae (Ciliophora, Oligotrichida). Journal of Protozoology 35: 189–197. [ Links ]
Montero–Lorenzo J. M. y B. Larraz–Iribaz 2008. Introducción a la geostadistica lineal. Netbiblo S.L., Coruña. España. 144 p. [ Links ]
Pierce, R. W. & J. T. Turner. 1992. Ecology of planktonic ciliates in marine food webs. Reviews in Aquatic Sciences 6: 139–181. [ Links ]
Rueda, M. & O. Defeo. 2003. Spatial structure of fish assemblages in a tropical estuarine lagoon: combining multivariate and geostatistical techniques. Journal of Experimental Marine Biology and Ecology 296: 93–112. [ Links ]
Small, E. B. & D. H. Lynn. 1985. Phylum Ciliophora Doflein, 1901. In: J.J. Lee, S.H. Hutner & E.C. Bovee (Eds.). An illustrated guide to the Protozoa. Allen Press, Lawrence, KS, pp. 393–575. [ Links ]
Soto–Castor, R., C. Bulit, A. Esquivel–Herreran & A. Pérez–Rojas. 2002. Bacterial abundance and hydrological variation in a tropical lagoon during the rainy season. Oceánides 17: 13–29. [ Links ]
Stickney, H. L., R. R. Hood & D. K. Stoecker. 2000. The impact of mixotrophy on planktonic marine ecosystems. Ecological Modelling 125: 203–230. [ Links ]
Strüder–Kypke, M. C., E. R. Kypke, S. Agatha, J. Warwick & D. J. S. Montagnes. 2002. Theuser–friendly guide to coastal planktonic ciliates. http://www.liv.ac.uk/ciliate/site/index.htm. [ Links ]
Ter Braak, C. J. F. & P. Smilauer. 2002. Canoco Reference Manual and CanoDraw for Windows User's guide: Software for Canonical Community Ordination (version 4.5). Microcomputer Power, Ithaca, New York. 500 p. [ Links ]
Vaqué, D., H. A. Blough & C. M. Duarte. 1997. Dynamics of ciliate abundance, biomass and community composition in an oligotrophic coastal environment (NW Mediterranean). Aquatic Microbial Ecology 12: 71–83. [ Links ]














