Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.19 no.2 Ciudad de México may./ago. 2009
Artículos
Estudio citogenético de poblaciones mexicanas de Gelidium sclerophyllum (Gelidiales, Rhodophyta)
Cytogenetic study in Mexican populations of Gelidium sclerophyllum (Gelidiales, Rhodophyta)
Ma. Edith Ponce–Márquez1,2, Dení Rodríguez2*, Norma López2, Luisa Alba Lois3 y Ma. de los Ángeles Aguilar4
1 Estudiante de Doctorado (Biología Marina) Posgrado en Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (UNAM) A. P. 70–592, Ciudad Universitaria, México, D.F. 04510, México.
2 Laboratorio de Ficología, Facultad de Ciencias. UNAM. *E–mail: denirodriguez@ciencias.unam.mx
3 Laboratorio de Biología Molecular y Genómica, Facultad de Ciencias. UNAM.
4 Laboratorio de Genética. Dpto. Ciencias de la Salud. División. C.B.S. Universidad Autónoma Metropolitana–Iztapalapa, A.P. 55–535, Col. Vicentina, Iztapalapa, México, D.F. 09340.
Recibido: 23 de mayo del 2008.
Aceptado: 4 de marzo del 2009.
RESUMEN
El objetivo del presente estudio fue establecer la presencia de talos gametofíticos y tetrasporofíticos en poblaciones locales de Gelidium sclerophyllum, una especie endémica del Pacífico tropical oriental. Los resultados están sustentados en análisis cromosómicos y cariológicos de seis poblaciones de playa Las Cuatas, Guerrero, México, durante un ciclo estacional. Se confirmó la presencia de talos gametofíticos y tetrasporofíticos en las poblaciones; lo cual permitió constatar que el ciclo de alternancia de generaciones tipo "Polysiphonia" se presenta por lo menos en un período dentro del ciclo anual. Los resultados permitieron establecer una variación en el número cromosómico de 3, 4 y 5 cromosomas en el tetrasporofito, cuyo número modal fue de 2n = 4 cromosomas, y una variación de 1, 2 y 3 cromosomas en el gametofito (número modal n = 2). Los valores cromosómicos fueron encontrados simultáneamente en el mismo talo, pero con variaciones en su frecuencia de aparición dentro de las diferentes poblaciones a lo largo del año.
Palabras clave: Cromosomas, citogenética, cariotipo, Rhodophyta, Gelidium.
ABSTRACT
The aim of this study was to establish the presence of tetrasporophytes and gametophytes in populations of Gelidium sclerophyllum, a species endemic to the Eastern Tropical Pacific. The results are based on karyological and chromosome analysis of six populations from the Las Cuatas beach, Guerrero, Mexico, during a seasonal cycle. It were confirmed the presence of tetrasporophytic and gametophytic thalli in populations, proving that the Polysiphonia type of the alternation of generations cycle was present at least one period within the annual cycle. The results establish a variation of the chromosome number of 3, 4 and 5 chromosomes in the tetrasporophyte whose modal number was 2n = 4 chromosomes, and a variation of 1, 2 and 3 chromosomes in the gametophyte (modal number n = 2). Chromosome values were found in the same thallus, but with variations in their frequency of occurrence in different populations throughout the year.
Key words: Chromosomes, cytogenetics, karyotype, Rhodophyta, Gelidium.
INTRODUCCIÓN
Gelidium sclerophyllum W.R. Taylor fue descrita, originalmente, con base en especímenes recolectados en Golfo Dulce, Costa Rica. Su distribución actual se restringe a la costa este del Pacífico; comprendiendo desde la localidad tipo, ya mencionada, hasta el estado de Sonora en la parte norte del Golfo de California (Rodríguez, 1996). Gelidium sclerophyllum se caracteriza por su morfología externa: ápices anchos y redondeados, en ocasiones con forma de corazón en ejes erectos maduros esbeltos y elongados (Rodríguez & Rivas–Lechuga, 1997; Rodríguez, et al., en prensa), presenta fases alternantes (isomórficas) indistinguibles en estado vegetativo como en la mayoría de las especies del género. El reconocimiento de los diferentes talos en campo y laboratorio se hace, normalmente, a partir de la presencia de ramas esporangiales o, en su caso, de las ramas cistocárpicas, asumiendo que se trata del tetrasporofito y del gametofito femenino respectivamente. En diversas localidades del Pacífico Tropical Mexicano (Serviere et al., 1993; Rodríguez & Rivas, 1997), mientras los tetrasporofitos con esporangios evidentes son abundantes, los gametofitos con cistocarpos prominentes hacia ambos lados de la rama, y ostiolos en cada una de las caras del cistocarpo, evidentemente biloculares, son muy escasos. Esto sugiriere una incongruencia en el ciclo reproductivo de alternancia de generaciones (tipo Polysiphonia) y quizá, un predominio de la reproducción asexual por propagación vegetativa y/o esporogénesis mitótica.

Para demostrar que estos fenómenos se están llevando a cabo se necesita establecer la relación proporcional poblacional de talos tetrasporofitos vs. gametofitos, usando herramientas diferentes a las convencionales mencionadas anteriormente. Además es necesario confirmar si la meiosis se lleva a cabo en la esporogénesis.
Los estudios de citogenética y en particular el establecimiento de los números de ploidía constituyen una posible solución para determinar la presencia de talos haploides y diploides en una población. Los estudios de este tipo, a pesar de haber constituido una práctica corriente en la genética de poblaciones desde hace muchos años, ha sido, sin embargo, intermitente y escasa en el terreno de la sistemática.
En Rhodophyta, los cromosomas son de forma esférica y de tamaño reducido, variando entre los 0.25 y los 3.5 µm (Cole, et al., 1983; Del Grosso, 1981; Kapraun & Freshwater, 1987; Rao, 1971). Esto contrasta con los cromosomas mitóticos de algunas especies de algas verdes (Chlorophyta) y de plantas superiores, que pueden llegar a medir hasta 10 µm (Stebbins, 1976).
Los antecedentes más tempranos sobre estudios citogenéticos en especies de algas rojas datan de principios del siglo pasado. El primer reporte data de 1904, con los estudios de Wolfe sobre Nemalion helminthoides (Velley) Batters (como N. multifidum) especie en la que encontró un número cromosómico de n= 8 y 2n= 16. Posteriormente, Yamanouchi (1906) determinó el número cromosómico de Polysiphonia flexicaulis (Harvey) Collins (como P. violacea) como n= 20 y 2n= 40; Lewis, en 1909, encontró ploidias de n= 7 y 2n= 14 en Griffithsia globulifera Harvey et Kützing (como G. bornetiana). Ya para el último tercio del siglo pasado, se reconocieron fenómenos de deleción en Porphyra rosengurtii Coll et Cox (Kapraun & Freshwater, 1987) y de fusión seguida de una no–disyunción en Bangia vermicularis Harvey (Cole et al., 1983), procesos que producen variaciones en los números cromosómicos específicos. Con el conocimiento de dichos procesos ha sido posible determinar fenómenos de apomeiosis, apomixis (partenogénesis y apogamia) e incrementos espontáneos en el número cromosómico (autopoliploidías) a lo largo de las historias de vida de diferentes especies (Lewis, 1996). Todos estos datos han servido de soporte en numerosos estudios taxonómicos, sistemáticos y de ciclos de vida para diferentes taxa (Swanson et al., 1981).
No obstante, a más de un siglo de iniciados los estudios citogenéticos en algas rojas y considerando la alta diversidad de especies para el grupo a nivel mundial (> 5000), el conocimiento de los números de ploidía se restringe a menos de 500 taxa (Magne, 1964; Dixon, 1966; Cole 1990; Ponce, 1999).
En el caso de las especies de Gelidium se conocen los números cromosómicos para sólo un 10% de las mismas, a pesar de la trascendencia comercial del género. El ciclo de vida tipo "Polysiphonia" (Dixon, 1982; Masuda, et al., 1996), sólo se ha demostrado para Gelidium coulteri Harvey (Macler & West, 1987), con una reconstrucción de éste a partir del crecimiento en cultivo de sus diferentes fases. A su vez, sólo contamos con una única evidencia sobre la meiosis espórica en G. latifolium Bornet ex Hauck (Maggs & Rico, 1991).
Con la intención de contribuir al conocimiento de la biología reproductiva de Gelidium sclerophyllum, se realizó un estudio poblacional para conocer la incidencia de talos gametofitos y esporofitos en un ciclo estacional, a partir de la identificación de los diferentes números de ploidía. Adicionalmente, se describe el tamaño de los cromosomas, se elabora el cariotipo de la especie y se desarrolla un análisis de variación cromosómica.
METODOLOGIA
El estudio se realizó en el estado de Guerrero en la localidad denominada Playa Las Cuatas, Zihuatanejo, situada al noroeste del estado. Esta playa se localiza a 65 millas náuticas al norte de la bahía de Zihuatanejo, Guerrero, ubicada muy cerca de la punta rocosa de Punta Ixtapa al noroeste del puerto de Zihuatanejo. Las Cuatas forma parte del complejo de playas y bahías de la zona, con ubicación geográfica entre los 17° 39' 50'' y 17° 39' 59'' L N y los 101° 35' 17'' y 101° 35' 37'' L O, (INEGI, 1989; Fig. 1). En conjunto la playa mide alrededor de 550 m y su orientación con respecto a la línea de costa es de este a oeste, En el extremo oriental se encuentra un acantilado rocoso de aproximadamente 35 m de altura, en el extremo occidental se ubican dos canales de corriente.

Se realizaron salidas de campo a playa Las Cuatas, durante primavera, verano, otoño e invierno de 2004. El muestreo se realizó en la zona mesolitoral media y baja, sobre 6 poblaciones ubicadas bajo diferentes condiciones de exposición al oleaje en las zonas rocosas de las estaciones I, II y III (Fig. 1). Los talos completos de Gelidium sclerophyllum, se desprendieron manualmente con ayuda de espátula o cuchillo (Knudsen, 1966; Ortega et al., 1993).
Las muestras, siempre equivalentes a 2 cm2 fueron colocadas en bolsas de plástico para ser transportadas a la playa en donde se les aplicó un solución de etanol–ácido acético glacial 3:1 (Austin ,1959), durante un período de 12 a 24 hrs, y posteriormente fueron trasladados a etanol al 70 %.
El estudio cariológico se realiza utilizando la técnica de "squash" con orceína aceto–clorhídrica al 2%, descrita por Giménez–Martín et al., (1982) y Kapraun & Freshwater (1987). Se hidrolizó el material con HCl 1N, por un período de 5 a 10 minutos. Posteriormente se hicieron cortes manuales de 1 a 2 mm del tejido usando las zonas de crecimiento apical, generalmente procedente de ápices vegetativos y sólo ocasionalmente en ápices de ramas tetrasporangiales y cistocárpicas, se tiñeron con orceína aceto–clorhídrica y se realizó el "squash". Para determinar el número cromosómico de la especie, las preparaciones se observaron en un microscopio óptico Zeiss (100x), se analizaron al microscopio 20 mitosis de la mejor calidad por talo, en un total de 10 talos de cada una de las poblaciones en cada estación del año. El número cromosómico de talos de ambas fases (gametofítica y tetrasporofítica) fueron determinados a través del análisis de células en profase tardía y metafase temprana. Las mitosis de mejor calidad fueron fotografiadas en un microscopio Axioskop Mc80 Zeiss (Germany) y digitalizadas en un Scanner Macintosh. Otras fotografías fueron tomadas con cámara digital integrada a un microscopio Nikon Eclipse 2000. El número cromosómico se confirmó con la técnica de hematoxilina de Wittman, aplicada durante 24 hrs en la obscuridad (Tseng & Sun, 1989). Además, en el talo tetrasporofítico se hicieron tinciones con DAPI (diclorhidrato de 4',6–diamidino–2–fenilindol) (Novaczek et al., 1986) y las preparaciones se observaron y fotografiaron con un microscopio de epifluorescencia Nikon Eclipse 800.
Considerando el total de las mitosis analizadas para los talos diploides (200 / población / estación) se realizó un análisis de la frecuencia de cada uno de los números cromosómicos encontrados.
RESULTADOS
Durante las cuatro estaciones del año, en las seis poblaciones se encontraron talos tetrasporofíticos (Fig. 2) en cantidad suficiente para obtener las mitosis requeridas, mientras que talos gametofíticos fueron registrados solamente en tres poblaciones durante septiembre y con una abundancia tan baja que no fue posible contar con las mitosis previstas por población, entre éstos se localizaron sólo algunas frondas con cistocarpos evidentes (Fig. 6).

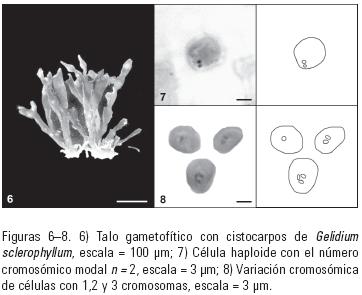
Del análisis de las mitosis se consiguió establecer que los cromosomas son de aspecto globoso, con un tamaño de 0.8 mm de longitud máxima. En ambas fases se presentaron variaciones en el número cromosómico en el mismo ápice. En los tetrasporofitos se observaron valores de 2n = 3–5 esto es, se encontraron algunas células con 3, otras con 4 y otras con 5 cromosomas (Figs. 3 – (4)-5) y los gametofitos presentaron valores de n = 1–3 (Figs. 7–8).
Las figuras 9 – (10) – 11 corresponden a fotografías de cromosomas teñidos con hematoxilina de Wittman, en las cuales pudimos confirmar el número cromosómico haploide y diploide de la especie. Las figuras 12 y 13 nos muestran el material nuclear con epifluorescencia pero con mala definición de los cromosomas; en la primera se puede observar una célula con 2 cromosomas y en la segunda un anillo de cromatina.

El resultado del análisis de frecuencia muestra la presencia consistente de células con 3 a 5 cromosomas en los talos tetrasporofitos (Fig. 14). El cariotipo de la especie se muestra en la figura 15.


DISCUSIÓN
La presencia de talos tetrasporofíticos y gametofíticos en la playa Las Cuatas, Guerrero, México, independientemente de su frecuencia de aparición y de las variaciones en sus números de ploidía, indica que el ciclo de alternancia de generaciones se lleva a cabo por lo menos durante el verano, e indiscutiblemente es del tipo "Polysiphonia" (Dixon, 1982), quedando totalmente demostrado por la presencia de talos cistocárpicos.
En las cuatro estaciones se encontraron ejemplares diploides, la mayoría en estado vegetativo, por lo que muy probablemente en ausencia de gametofitos la población se esté renovando de manera asexual, ya sea por producción de esporas mitóticas o por propagación vegetativa a partir del crecimiento del eje postrado o por fragmentación del talo. La presencia de talos cistocárpicos en una época del año (septiembre) pudiera indicar que la reproducción sexual y con ella el ciclo de vida completo, solo se está llevando a cabo durante el verano. Cabe mencionar que realizar un conteo de cromosomas meióticos es más exacto (Guerra, 2008), sin embargo a pesar de múltiples intentos realizados con esporangios de la especie, aunque se pudieron hacer conteos en el microscopio, no se consiguieron imágenes claras para certificar el conteo del número haploide. Las imágenes de los cromosomas mitóticos de Gelidium sclerophyllum producidas en este estudio, muestran alta concordancia con aquellas registradas para otras especies de Rhodophyta como las de Porphyra spp. (Kapraun & Freshwater, 1987) Gracilaria verrucosa (Hudson) Paperfuss (Godin et al., 1993) y Sirodotia huillensis Welwitsch ex W. et G. S. West (Carmona et al., 2006), así como con aquellas reportadas anteriormente para Gelidium, como G. serrulatum J. Agardh (Kaneko, 1968), G. latifolium (Maggs & Rico, 1991) G. pristoides (Turner) Kützing (Carter, 1993), G. americanum (W. Taylor) Santelices y G. floridanum W. Taylor (Kapraun, et al., 1993). De acuerdo con los datos cromosómicos que reportan éstos y otros autores para especies de Gelidium, los números de ploidía n = 2 y 2n = 4 encontrados, no son significativamente diferentes ni excepcionales. Los números cromosómicos reportados para otras especies de este género varían como sigue: n= (4) 5 – 29 y 2n= 9 – 58 (Kapraun & Bailey, 1989; Maggs & Rico, 1991; Kapraun et al., 1993). Gelidium sclerophyllum se encuentra en el grupo de las especies con números cromosómicos bajos junto con Gelidium floridanum y G. sesquipedale (Clemente) Thuret.
La variación de ± 1 cromosoma en células de los talos de Gelidium sclerophyllum, se ha registrado ampliamente en estudios previos de algas marinas (Knaggs, 1964; Athanasiadis, 1983; Goff & Coleman, 1986; Maggs & Rico, 1991) y en algas de agua dulce (Ramírez, 2006), incluso con una variación de más de 10 cromosomas (Yabu, 1979; Maggs, 1988), por lo que tampoco resulta excepcional dicha variación.
Hay que considerar que la variación mencionada es extrema y significa aproximadamente un 50% del total del genoma, sugiriendo fallas en la división mitótica, lo que parece poco razonable; por lo que los datos de la variación en el número cromosómico, podría ser sólo aparente y debida a limitaciones técnicas.
Sin embargo, Maggs y Rico (1991) reportan una variación de ± 2 cromosomas en ejemplares de Gelidium latifolium con un número haploide de 29 cromosomas, explicando que esto sucede como una alternancia de eventos aneuploides y poliploides, como los propuestos para otros grupos algales (Ulvales en Kapraun & Bailey, 1992). En la definición clásica (Stansfield, 1992), un evento de aneuploidía se refiere a las variaciones en el número cromosómico que no son de juegos completos, sino solamente de parte de ellos, por lo que no resulta ser un múltiplo exacto del número haploide, pueden ser hiperploide (4n+1) o hipoploide 4n–1 (monosómico 2n–1, trisómico 2n+1, tetrasómico 2n+1); por su parte, la poliploidía, se refiere al incremento del número cromosómico en juegos completos, el cual puede ser triploide 3n, tetraploide 4n, pentaploide 5n, o mayor como ha sido reportado en especies de Cladophora, Chlorophyceae (Meave, 1997) y en especies de Batrachospermaceae, Rhodophyta, donde la poliploidia se explica a través de la fecundación del carpogonio por numerosos espermatangios (Carmona et al., 2006).
No obstante, recientemente Guerra (2008) propone una reconceptualización de aneuploidía, poliploidía y otros conceptos relacionados en un intento por establecer el significado citotaxonómico y evolutivo de la variación en los números cromosómicos de especies de plantas. Menciona que la aneuploidía se refiere en efecto a la pérdida o ganancia de uno o más cromosomas implicando deleciones y duplicaciones de muchos genes, resultando en una constitución cromosómica desbalanceada, usualmente letal o deletérea, sugiriendo repercusiones importantes en la capacidad de respuesta de las generaciones sucesivas de la especie a las diferentes condiciones del medio ambiente. Asimismo afirma que este tipo de variaciones en el número cromosómico no tiene implicaciones evolutivas claras más allá del nivel de especie (Guerra, 2000).
Como resulta evidente, el significado biológico de la variación de los números cromosómicos constituye un objeto de estudio actual y en desarrollo que requiere no sólo de mayor cantidad de datos de diferentes especies sino de un replanteamiento del contexto teórico de interpretación de dicha variación numérica de los cromosomas.
AGRADECIMIENTOS
Los autores agradecen al posgrado del Instituto de Ciencias del Mar y Limnología, UNAM; al Dr. Javier Carmona del Laboratorio de Ficología de la Facultad de Ciencias, UNAM, México, por la revisión de este manuscrito; a Alberto Sarmiento por el gran apoyo en el trabajo de campo, al M. en C. Alejandro Martínez Mena por las toma de fotografías de cromosomas con el microscopio y al Biol. José Antonio Hernández Gómez por las fotografías de los ejemplares y el procesamiento de las imágenes.
REFERENCIAS
Athanasiadis, A. 1983. The life history of Antithamnion heteroclajum (Rhodophyta, Ceramiales) in culture. Botánica Marina 26: 153–7. [ Links ]
Austin, A. P. 1959. Iron–alum aceto–carmine staining for chromosomes and other anatomical features of Rhodophyceae. Stain Technology 34: 69–75. [ Links ]
Carmona J., G. Montejano & J. O. Necci. 2006. Ecology and morphological characterization of gametophyte and 'Chantransia' stages of Sirodotia huillensis (Batrachospermales, Rhodophyta) from a stream in central Mexico. Phycological Research 54: 108–115. [ Links ]
Carter, A. R. 1993. Chromosome observations relating to bispore production in Gelidium pristoides (Gelidiales, Rhodophyta). Botánica Marina 36: 253–256. [ Links ]
Cole, K. M., B. J. hymes & R. G. Sheath. 1983. Karyotypes and reproductive seasonality of the genus Bangia (Rhodophyta) in Brihsh Columbia, Canada. Journal of Phycology 19: 136–45. [ Links ]
Cole, K. M.1990. Chromosomes. En: (Cole K.M. & R.G. Sheath, Eds.) Biology of the red algae. Cambridge University Press, New York, pp. 73–101. [ Links ]
Del Grosso, F. 1981. Studio cariologico in Sirodotia huillensis (Welw.) Skuja (Rhodophyta). Informi Botanico Italiano 13: 126–127. [ Links ]
Dixon, P. S. 1966. The Rhodophyceae. En: (M.B.E. Godward, Ed.) The Chromosomes of the Algae. New York, pp. 168–204. [ Links ]
Dixon, P. S. 1982. Life histories in the Florideophyceae with particular reference to the Nemaliales sensu lato. Botanica Marina 25: 611–621 [ Links ]
Giménez–Martín, G., A. González–Fernández, A. Del Campo & C. De La Torre. 1982. The role of protein synthesis in cell progression through G2 and mitosis in plant multinucleate cells. Biology, Cell. 46: 161–174. [ Links ]
Godin, J., C. Destombe & C. A. Maggs. 1993. Unusual chromosome number of Gracilaria verrucosa (Gracilariales, Rhodophyta) in the Cape Griz–Nez area, northern France. Phycologia 32: 291–294. [ Links ]
Goff, L. J. & A. W. Coleman. 1986. A novel pattern of apical cell polyploi–dy, sequential polyploidy reduction and intercellular transfer in the red alga Polysiphonia. American Journal of Botany 73: 1109–1130. [ Links ]
Guerra, M. 2000. Chromosome number variation and evolution in monocots. En (Wilson, K. L. & D. A. Morrison (Eds.) Monocots: Systematics and Evolution. CSIRO, Melbourne, pp. 127–136. [ Links ]
Guerra, M. 2008. Chromosome numbers in plant cytotaxonomy: concepts and implications. Cytogenetic Genome Research 120: 339–350. [ Links ]
INEGI (Instituto Nacional de Estadística Geográfica e Informática). 1989. México. Datos básicos de la geografía de México. 142 p. [ Links ]
Kaneko, T. 1968. Morphological and developmental studiés of Gelidiales. II. On Acanthopeltis japonica Okamura. Bulletin Faculty Fisheries Hokluido University 19: 165–172. [ Links ]
Kapraun, D. F. & J. C. Bailey .1989. Karyology and nuclear DNA content of Gelidium pusillum (Gelidiales, Rhodophyta) from North Carolina, USA. Japan Journal of Phycology 37 (3): 201–207. [ Links ]
Kapraun, D. F. & J. C. Bailey. 1992. Karyology and cytophotometric estimation of nuclear DNA variation in seven species of Ulvales (Chlorophyta). Journal of Applied Phycology 40: 13–24. [ Links ]
Kapraun, D. F. & D. W. Freshwater .1987. Kariologycal studies of five species of Porphyra (Bangiales, Rhodophyta) from the North Atlantic and Mediterranean. Phycologia 26: 82–87. [ Links ]
Kapraun, D. F., J. A. Dutcher & W. Freshwater. 1993. Quantification and characterization of nuclear genome in commercial red seaweeds: Gracilariales and Gelidiales. Hydrobiologia 260/261: 679–688. [ Links ]
Knaggs, F. W. 1964. Cytological and life–history studies in the genus Rhodochorton. British Phycological Bulletin. 2: 393. [ Links ]
Knudsen, J. W. 1966. Biological techniques. Harper & Row Publishers. New York, pp. 26–37. [ Links ]
Lewis, R. J. 1996. Chromosomes of the brown algae. Phycologia 35:19–40. [ Links ]
Macler, B. A. & J. A. West. 1987. Life history and physiology of the red alga, Gelidium coultari, in unialgal culture. Aquaculture 61: 281–293. [ Links ]
Maggs, C. A. 1988. Intraspecific life history variability in the Florideophycidae (Rhodophyta). Botanica Marina 31: 465–490. [ Links ]
Maggs, C. A. & J. M. Rico. 1991. A karyological demonstration of meiosis in Gelidium latifolium (Gelidiaceae, Rhodophyta) from Ireland. Phycologia 30: 487–494. [ Links ]
Magne, F. 1964. Recherches caryologiques chez les Floridées (Rhodophycées). Cuh Biología Marina 5: 461–671. [ Links ]
Masuda, M., K. Kogame & M. D. Guiry. 1996. Life history of Gymnogongrus griffithsiae (Phyllophoraceae, Gigartinales) from Ireland: implications for life history interpretation in Rhodophyta. Phycologia 35: 421–434. [ Links ]
Meave Del Castillo M. E. 1997. Taxonomía y Distribución de las Cladophorales (Chlorophyta) en la región de la Huasteca Potosina. Tesis de Doctorado. Facultad de Ciencias, UNAM, México. 419 p. [ Links ]
Novaczek I., C. J. Bird & J. L. Mclachlan. 1986. Culture and field study of Stilophora rhizodes (Phaeophyceae, Chordariales) from Nova Scotia, Canada. British Phycological Journal 21: 407–416. [ Links ]
Ortega, M. M., J. L. Godínez & M. M. Ruvalcaba. 1993. Una clave de campo de las algas pardas de las costas mexicanas del Golfo de México y Mar Caribe. AGT Editores. México. 42 p. [ Links ]
Ponce, M. E. 1999. Estudio Citogenético en Macroalgas Marinas: Contribución a la biología de algunas especies y a la resolución de problemas taxonómicos, México. Tesis de Maestría. Facultad de Ciencias, UNAM, México. 125 p. [ Links ]
Rao, C. S. P. 1971. Sex chromosomes of Wrangelia argus Mont. Botanica Marina 14: 113–115. [ Links ]
Ramírez R. R. 2006. Caracterización del microhábitat, variación morfológica y eproductiva en poblaciones de Prasiola (Prasiolales, Chlorophyta) en ríos de la región central de México. Tesis de Maestría. Facultad de Ciencias, UNAM, México. 103 p. [ Links ]
Rodríguez, D. 1996. Vegetative propagation of Gelidium sclerophyllum Gelidiales, Rhodophyta) by fragmentation. Hydrobiologia 21: 361–365. [ Links ]
Rodríguez, D. & G. Rivas. 1997. Gelidium sclerophyllum (Gelidiaceae: Gelidiales): Evaluación de caracteres para la segregación intergenérica. Revista de Biología Tropical 44 (3) / 45 (1): 305–310. [ Links ]
Rodríguez, D., N. López & J. González–González. (en prensa). Gelidiales en las costas del Pacífico mexicano con énfasis en las especies tropicales. Monografías Ficológicas III. UAM–I, México, D.F. [ Links ]
Serviere, E., D. Rodríguez & J. González–González. 1993. Gelidiaceae (Rhodophyta) in Bahía de Banderas, Western Pacific, México. Hidrobiologia 260/261: 45–50 [ Links ]
Standsfield, W. D. 1992. Genética. 3er. Ed. McGraw Hill. México. 574 p. [ Links ]
Stebbins, G.L. 1976. Chromosome, DNA and plant evolution. Evolutionary Biology 9: 1–34 [ Links ]
Swanson, C. P. , T. Merz & W. J. Young. 1981. Cytogenetics: The Chromosome in Division, Inheritance, and Evolution. Englewood Cliffs, N.J.: Prentice–Hall. 350 p. [ Links ]
Tseng C. K. & A. Sun. 1989. Studies on the alternation of the nuclear phases and chromosome numbers in the life history of some species of Porphyra from China. Botanica Marina 32: 1–8. [ Links ]
Yabu, H. 1979. Cytological observations on Ptilota pectinata (Gunn) Kjellm. and P. pectinata f. litoralis Kjellm (Ceramiales, Rhodophyta). Japan Journal of Phycology 27: 17–24. [ Links ]
Yamanouchi, S. 1906. The life history of Polysiphonia violacea. Botanical Gazzetta. 41: 425–433. [ Links ]














