Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.18 supl.1 Ciudad de México ago. 2008
Asociaciones de larvas de peces en relación a cambios ambientales en las Bahías Chamela, Jalisco y Santiago–Manzanillo, Colima (2001–2002)
Larval fish associations related to environmental changes in Bahía Chamela, Jalisco and Santiago–Manzanillo, Colima (2001–2002)
Claudia A. Silva–Segundo1*, René Funes–Rodríguez1, Martín E. Hernández–Rivas1, Eduardo Ríos–Jara2, Elva G. Robles–Jarero2 y Alejandro Hinojosa–Medina1
1 Centro Interdisciplinario de Ciencias Marinas. Av. IPN s/n. Col. Playa Palo de Sta. Rita A. P. 592. La Paz Baja California Sur, México C. P. 23096. * E–mail: ssclaudiaa@hotmail.com.
2 Centro Universitario de Ciencias Biológicas y Agropecuarias. Universidad de Guadalajara. Km. 15.5 Carretera Nogales. Las Agujas Nextipac. Zapopan, Jalisco. C. P. 45110.
Recibido: 18 de noviembre de 2006
Aceptado: 20 de diciembre de 2007
RESUMEN
Se analizó la influencia de los factores ambienta les sobre las asociaciones espacio–temporales de larvas de peces frente a Bahía Chamela, Jalisco y el conjunto de bahías Santiago–Manzanillo, Colima, durante un ciclo anual (2001–2002). Se identificaron dos agrupaciones relacionadas con la fisiografía de la costa y el hábitat de los adultos, una frente a Bahía Chamela integrada por una mezcla de especies de hábitats costero, demersal e intermareal–submareal (Bregmaceros bathymaster, Bairdiella sp., Cynoscion sp., Engraulis mordax y Labrisomidae tipo 1) y otra en Santiago–Manzanillo compuesta por especies de origen lagunar e intermareal–submareal (Eucinostomus sp., Abudefduf troschelii, Haemulidae tipos 2 y 3, así como Enneanectes sexmaculatus). La organización temporal estuvo influenciada por la alternancia entre dos periodos (cálido y templado) definidos por la variabilidad ambiental regional. El periodo cálido estuvo caracterizado por especies principalmente tropicales (Harengula thrissina, Eucinostomus sp., Auxis sp. y Haemulidae tipo 3), relacionadas con una mayor temperatura y precipitación pluvial, en cambio durante el periodo templado dominaron las especies de afinidad tropical–subtropical (B. bathymaster, Bairdiella sp., Cynoscion sp. y E. mordax), relacionadas con una menor temperatura e incrementos en las concentraciones de nutrimentos, clorofila–a y zooplancton.
Palabras clave: Peces, larvas, asociaciones, Jalisco, Colima.
ABSTRACT
Spatial and temporal structure of fish larvae associations and their relationship to the environmental variability were studied at Bahía Chamela, Jalisco, and Santiago–Manzanillo complex, Colima, during 2001–2002. Two spatial aggregations were found, related to the coastal physiography and to the adult habitat. The first was observed at Bahía Chamela, which integrated a combination of species belonging to coastal, demersal and inshore habitats (Bregmaceros bathymaster, Bairdiella sp., Cynoscion sp., Engraulis mordax, and Labrisomidae type 1) and the other in Santiago–Manzanillo composed by species from lagoon and inshore areas (Eucinostomus sp., Abudefduf troschelii, Haemulidae type 2 and 3, and Enneanectes sexmaculatus). Temporal organization was influenced by the environmental shift between two periods (warm and temperate) defined by the regional environmental variability. The warm period was characterized by tropical species (Harengula thrissina, Eucinostomus sp., Auxis sp., and Haemulidae type 3), related to high temperature and rainfall, while temperate period was dominated by species with a tropical–subtropical affinity (B. bathymaster, Bairdiella sp., Cynoscion sp., and £ mordax) and related to lower temperature and elevated nutrients, chlorophyll a and plankton concentrations.
Key words: Fish, larvae, assemblages, Jalisco, Colima.
INTRODUCCIÓN
Las asociaciones de larvas de peces se refieren a grupos de larvas que ocurren en un tiempo y área similar, durante el cual, es importante un hábitat apropiado con los requerimientos y/o condiciones ambientales necesarios para asegurar las oportunidades de supervivencia. Por lo que el estudio de las asociaciones provee de información sobre la estructura de la comunidad y de las áreas y épocas de los peces en reproducción. Se considera que son los procesos oceánicos los responsables del origen, mantenimiento o interrupción de las asociaciones (p. e., dinámica oceánica, hidrografía y topografía del área) (Fuiman & Werner, 2002).
La conformación de las asociaciones puede ser propia de cada región y generalmente está relacionada con factores físico–químicos y biológicos. Por ejemplo, se ha observado que las características topográficas y el hábitat de los adultos influyen en la formación de las asociaciones de larvas de peces (Richardson et al., 1980; Sabatés, 1990; Sanvicente–Añorve et al., 1998; Funes–Rodríguez et al., 2002). La dinámica oceánica es otro factor que determina la conjunción de faunas que caracterizan las asociaciones con diferente afinidad biogeográfica (Moser & Smith, 1993; Grothues & Cowen, 1999; Franco–Gordo et al., 2002; Aceves–Medina et al., 2003). También, la distribución de larvas ha sido relacionada con base a diferentes factores ambientales tales como salinidad, temperatura, productividad, densidad y estratificación del agua (Grioche et al., 1999; Marancik et al., 2005). Así como, la organización de las asociaciones es relacionada con los ciclos reproductivos de las especies, que a su vez, son influenciados por el ambiente hidrográfico (Walker et al., 1987; Lazzari, 2000; Feyrer, 2004) y los requerimientos de subsistencia (Frank & Leggett, 1983; Somarakis et al., 2000).
Los listados sistemáticos de larvas de peces en el área del Pacífico Central Mexicano muestran la gran diversidad íctica de la región (Ahlstrom, 1971, 1972; Acal, 1991; Franco–Gordo et al., 1999). No obstante, la determinación taxonómica de los ejemplares, en algunos casos, está limitada a nivel familia debido al escaso número de descripciones de huevos y larvas de peces de afinidad tropical. En las costas de Jalisco y Colima, se han realizado estudios para conocer la distribución y abundancia de huevos y larvas de peces, los cuales, mencionan que la mayor abundancia y riqueza de especies ocurre en el periodo templado y que la zona costera es más diversa, con respecto de la oceánica (Franco–Gordo et al., 2000; Franco–Gordo et al., 2003; Franco–Gordo et al., 2004). Otros estudios se han enfocado a conocer la variación espacio–temporal de larvas de peces de familias de interés comercial, donde se menciona una relación entre los ciclos de reproducción y la variabilidad ambiental (Navarro–Rodríguez et al., 2001; Flores–Vargas et al.,2004).
En el área de estudio sólo existe un antecedente que identifica una relación entre las asociaciones de larvas de peces y el sistema de corrientes superficiales del Pacífico Central Mexicano (Franco–Gordo et al., 2002). La temporalidad de los procesos de circulación del agua superficial en la zona de estudio consiste de tres periodos (Wirtky, 1965, 1966; Badan, 1997). El primero, que es más duradero y estable de agosto a diciembre, cuando la Corriente Costera de Costa Rica (CCC) está más desarrollada, a causa de que la Zona de Convergencia Intertropical (ZCIT) se encuentra en su posición boreal extrema (10° N) y la Contracorriente Ecuatorial está más desarrollada. El segundo periodo es de febrero a abril, cuando la CCC esta muy debilitada y es entonces, cuando un flujo que proviene del norte en dirección sureste, aparece como extensión de la Corriente de California (CC). Finalmente, el tercer periodo de mayo a julio (transición), es determinado cuando la ZCIT regresa a su posición boreal y la Contracorriente Ecuatorial reaparece, para alimentar a la CCC hasta Cabo Corrientes (Wirtky, 1965, 1966; Badan, 1997).
Los estudios que describen las características oceanográficas locales en las costas de Jalisco y Colima son recientes y están principalmente enfocados a identificar las ondas internas y la variabilidad en los campos de temperatura y salinidad (Filonov et al., 1996; Filonov et al., 2000). Sin embargo, las características ambientales locales que pudieran determinar los patrones de asociación y hacer posible la coexistencia de larvas en área y tiempo determinado, son aún poco conocidos. En este contexto, el presente estudio tiene por objeto analizar la estructura de las asociaciones de larvas de peces en función de la variabilidad ambiental (temperatura, precitación pluvial, nutrimentos, concentración de clorofila–a y zooplancton) frente a Bahía Chamela, Jalisco y el conjunto de bahías Santiago–Manzanillo, Colima, durante un ciclo anual (2001–2002).
MATERIALES Y MÉTODOS
El plan básico de estaciones consistió de seis sitios de muestreo: cuatro estaciones dispuestas a lo largo de la línea de costa frente a Bahía Chamela, en la porción central de la costa de Jalisco y dos al interior del conjunto de bahías de Santiago y Manzanillo, Colima (Fig. 1). Las campañas de muestreo fueron realizadas con periodicidad mensual de agosto del 2001 a julio del 2002. Los muestreos se realizaron a bordo de una lancha con motor fuera de borda. Se hicieron arrastres oblicuos a una profundidad de 20 m, con una duración de 6 minutos a una velocidad de 1 m s–1. Se recolectaron un total de 72 muestras de plancton con una red cónica simple de 505 µm de luz de malla y 0.50 m de diámetro en su boca; provista de un flujómetro digital para estimar el volumen de agua filtrada. De forma simultánea se obtuvieron las variables de salinidad (refractómetro); temperatura superficial del mar (termómetro de inmersión); oxígeno disuelto (oxímetro); transparencia del agua (disco secchi) y muestras de agua para determinar la concentración de nutrimentos y clorofila–a (botellas oceanográficas tipo Niskin de cinco litros) a profundidades de 0, 5, 10, 15 y 20 m. Los datos de precipitación pluvial fueron proporcionados por la Estación Biológica de la Universidad Nacional Autónoma de México y el Servicio Meteorológico Nacional.
En el laboratorio, se midió el biovolumen zooplanctónico por el método de volumen desplazado (Beers, 1976) y los valores fueron estandarizados en ml m–3. Las larvas de peces fueron separadas en su totalidad (7,858 larvas) e identificadas hasta el máximo nivel taxonómico posible, utilizando como las principales fuentes bibliográficas a Moser (1996) y Beltrán–León y Ríos–Herrera (2000), además de bibliografía especializada para Blennioidei (Brogan, 1992); Opisthonema spp. (Funes–Rodríguez et al., 2004); Engraulis mordax (Bolin, 1936) y Trachurus symmetric us (Ahlstrom & Ball, 1954). Los especímenes aún no descritos fueron agrupados a nivel de familia o género con la leyenda de "tipo"; de acuerdo al patrón de pigmentación y de merística (Muraenidae tipo 1, Caranx sp. tipo 1, Larimus sp. tipo 1). Los conteos de larvas de peces fueron estandarizados a abundancias por 10 m2 de superficie marina, de acuerdo al procedimiento estándar para la estimación del tamaño del stock de peces, a partir del censo de huevos y larvas (Smith & Richardson, 1977).
Los datos de clorofila–a y nutrimentos (nitritos, nitratos y fosfatos) se obtuvieron a partir del método espectrofotométrico (Strickland & Parsons, 1972) y posteriormente los valores de clorofila–a y nutrimentos fueron integrados de 0–20 m de profundidad.
El análisis de semejanza ecológica fue utilizado para evaluar la asociación espacio–temporal de larvas de peces (modo Q y R), mediante la distancia métrica de Chebyshev y como algoritmo de agrupamiento el método de Ward (programa de STATISTICA–v 6.0). Las relaciones entre las larvas y los parámetros ambientales se obtuvieron por medio del Análisis de Correspondencia Canónica (ACC), el cuál se basa en regresiones lineales múltiples entre la matriz principal (abundancia de larvas de peces) y la matriz secundaria (variables ambientales; Ter Braak, 1986); además se aplicó el método de Monte Carlo, con 1000 iteraciones para evaluar estadísticamente las correlaciones, utilizando el programa PC–ORD v4.6 (McCune & Mefford, 1999). Las especies raras o escasas con frecuencia de ocurrencia menor al 5% de las estaciones muestreadas fueron descartadas del análisis, para evitar una débil información clasificatoria (Field et al., 1982). Los valores de abundancia de larvas fueron transformados a logaritmo base 10 y las variables ambientales se transformaron a valores estándar, donde la media de un conjunto de valores es cero y la varianza es uno (X=0; σ=1; Zar, 1996). Los análisis de semejanza ecológica y de ordenación se realizaron de forma espacial y temporal. La matriz de datos para realizar el análisis espacial fue construida a partir de la suma total de la abundancia de cada especie en cada localidad (26 especies / 6 localidades) y la matriz de datos de forma temporal se hizo a través de la sumatoria total de la abundancia de cada especie en cada uno de los meses de estudio (26 especies / 12 meses). La matriz espacial de la representación de los parámetros ambientales fue elaborada del promedio de cada variable en cada localidad (5 parámetros / 6 localidades) y la matriz temporal se hizo con el promedio de cada variable del total de los meses (5 parámetros / 12 meses).
RESULTADOS
Marco Ambiental. La variabilidad de la temperatura superficial del mar (TSM) durante un ciclo anual, permitió identificar dos periodos, uno templado y otro cálido, así como, una diferenciación de los parámetros ambientales entre las localidades de Bahía Chamela y Bahía Santiago–Manzanillo. Durante el periodo denominado templado (de noviembre a mayo), la TSM varió entre 19.0 a 26.0 °C. Las localidades de Bahía Chamela (Punta Soledad, El Púlpito, Isla Pajarera y Careyes) presentaron una temperatura ligeramente menor (22.0–24.0 °C), en comparación al conjunto de Bahías Santiago–Manzanillo (23.0–26.0 °C) (Fig. 2a). Durante este periodo, la precipitación pluvial (Pp) fue nula, con excepción de febrero, siendo de 70.8 mm en Chamela y de 117 mm en Santiago–Manzanillo (Fig. 2b). La concentración de nitritos varió entre 0.08 y 1.7 mg m–2, con valores máximos en diciembre en Isla Pajarera (1.7 mg m–2) y en mayo, en Careyes y Santiago (1.4–1.5 mg m–2; Fig. 2c). Las concentraciones de nitratos fueron muy variables (0.8–35.8 mg m–2) y hubo un notable incremento en todas las localidades durante el mes de mayo (>10 mg m–2). Los valores máximos fueron en Santiago (35.8 mg m–2) y El Púlpito (19.12 mg m–2) en noviembre (Fig. 2d). Las concentraciones de fosfatos variaron entre 1.08 y 6.28 mg m–2, con valores máximos en Careyes durante febrero (6.2 mg m–2; Fig. 3a). La concentración de clorofila–a también fue muy variable de noviembre a mayo (1.2–26.0 mg m–2), con valores máximos en marzo (19–26 mg m–2) en todas las localidades, con excepción de Manzanillo (Fig. 3b). El biovolumen zooplanctónico varió entre 0.1 y 3.2 ml m–3; con un incremento que fue mayor de marzo a mayo (>0.7 ml m–3) en todas las localidades, con valores máximos en El Púlpito (3.2 ml m–3) en mayo y Careyes (2.2 ml m–3) en enero (Fig. 3c). La transparencia del agua varió entre 2.5 y 17 m, siendo menor de marzo a mayo (Fig. 3d).
En contraste, durante el periodo cálido (junio a octubre), la TSM fue comparativamente mayor (26.0–31.0 °C) (Fig. 2a). La Pp fue muy variable (26.5–488.0 mm), siendo mayor en Santiago–Manzanillo (488 mm) durante agosto (Fig. 2b). Las concentraciones de nitritos y fosfatos no mostraron una tendencia definida debido a su alta variabilidad mensual y entre las localidades. La concentración de nitritos varió de 0.13 a 1.58 mg m–2, con un incremento en septiembre en El Púlpito (Fig. 2c). Los fosfatos presentaron una variación de 0.4 a 6.8 mg m–2, con un incremento en octubre en todas las localidades (Fig. 3a). Las concentraciones de nitratos fueron bajas (<3.3 mg m–2) y el valor promedio fue tres veces menor, con respecto al periodo templado (Fig. 2d). La concentración de clorofila–a varió de 0.4 a 8.0 mg m–2 (Fig. 3b). El biovolumen zooplanctónico presentó valores de 0.06 a 1.7 ml m–3 (Fig. 3c). Finalmente, la transparencia del agua fue de 4 a 20 m de profundidad, siendo en promedio similar a la temporada templada (10 m), debido a una disminución en la transparencia en septiembre en todas las localidades (Fig. 3d).
Asociación y ordenación espacial de las larvas de peces.
Los 98 taxa específicos correspondieron a 43 familias y 15 órdenes. Se logró identificar a 45 taxa hasta nivel de especie, 24 a nivel de género y 29 diferentes tipos a nivel de familia (lista de especies con su respectiva autoridad nomenclatural se muestra en la Tabla 1). En los análisis solo se utilizaron a 26 taxa específicos con frecuencia de ocurrencia igual o mayor al 5% de las estaciones muestreadas (Tabla 2).
Análisis de semejanza ecológica. El análisis de la semejanza ecológica separó dos grupos: uno que incluyó las localidades de Bahía Chamela (zona "Norte") y otro a las de Santiago–Manzanillo (zona "Sur") a una distancia de 10.5 en el dendrograma. A su vez, se identificaron dos asociaciones de especies (I y II) (distancia de 11.8). La asociación (I) estuvo integrada por una mezcla de especies de diferente hábitat que se ubican principalmente en la zona norte (localidades de Bahía Chamela) y a su vez fue subdividida en dos subgrupos (Ia y Ib) (distancia de 8.0). El subgrupo Ia estuvo integrado por 10 especies que presentan su mayor densidad en Isla Pajarera, donde estuvieron con mayor abundancia Bregmaceros bathymaster (costero), Bairdiella sp. y Cynoscion sp. (aguas costeras y demersales). El subgrupo Ib incluyó a seis especies que presentaron su mayor densidad en Punta Soledad (la localidad más norteña) representado principalmente por Engraulis mordax y Labrisomidae tipo 1 (costero e intermareal–submareal). La asociación (II) fue integrada por 10 especies, todas ellas relacionadas principalmente con aguas costeras poco profundas y de origen lagunar, con mayor densidad en Bahía Santiago (Eucinostomus sp., Abudefduf troschelii, Haemulidae tipo 2 y 3 y Enneanectes sexmaculatus; Fig. 4).
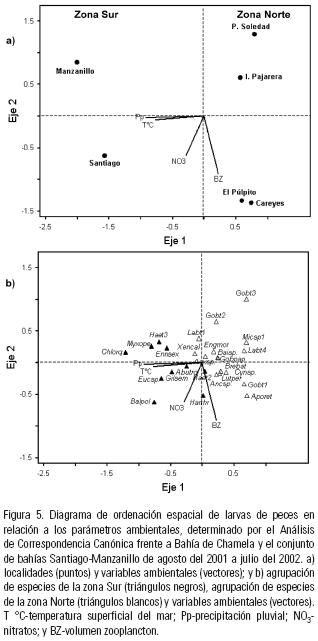
Análisis de ordenación. El Análisis de Correspondencia Canónica (ACC) mostró que cuatro variables ambientales estuvieron estrechamente correlacionadas con las localidades de muestreo y la distribución de larvas. El CCA explicó el 68% del total de la varianza en los dos primeros ejes, con un coeficiente de correlación de Pearson de 1 (p <0.05). El primer eje, contribuyó con el 46.6% de la varianza explicada, con un eigenvalor de 0.163. En este eje, la precipitación pluvial (Pp) y la temperatura superficial del mar (TSM) presentaron una correlación negativa entre las especies y las localidades de muestreo (r = –0.992 y r = –0.831, respectivamente). El segundo eje contribuyó con el 21.4% de la varianza explicada (eigenvalor = 0.075). En este eje, biovolumen zooplanctónico y la concentración de nitratos estuvieron negativamente correlacionados con las especies y las localidades (r = –0.949 y r = –0.642, respectivamente; Tabla 3).
En las localidades de Santiago–Manzanillo (zona Sur) ocurrieron principalmente especies representativas de aguas costeras poco profundas y de origen lagunar (Eucinostomus sp., Abudefduf troschelii, Gillellus semicinctus, Chloroscombrus orqueta, Myxodagnus opercularis, Haemulidae tipo 3, Enneanectes sexmaculatus y Balistes polylepis) relacionadas con temperaturas, precipitación pluvial y nitratos relativamente altas. En cambio, en las localidades de Bahía Chamela (El Púlpito y Careyes), solo algunas especies del hábitat costero y de arrecife tuvieron relación con altas concentraciones del biovolumen zooplanctónico (Harengula thrisssina y Haemulidae tipo 2; Fig. 5).
Asociación y ordenación temporal de las larvas de peces
Análisis de semejanza ecológica. El análisis de semejanza ecológica utilizado para encontrar la asociación temporal separó dos grupos de meses que son consistentes con la variabilidad ambiental (cálida y templada), a una distancia de 18.0 (Fig. 6). En el segundo dendrograma analizado para observar las asociaciones de especies, se identificó a dos grupos (I y II) separados a una distancia de 14.3 (Fig. 6). El grupo I de especies estuvo conformado por ocho taxa de afinidad tropical–subtropical, que tuvieron su mayor abundancia en mayo (B. bathymaster, Bairdiella sp., Cynoscion sp. y E. mordax). El grupo II de especies fue subdividido en dos subgrupos (IIa y IIb; distancia de 6.3). El primero (IIa) incluyó a especies de afinidad tropical siendo las más conspicuas Eucinostomus sp., Auxis sp., Haemulidae tipo 3 y H. thrissina y el segundo (IIb) a once especies presentes a lo largo del año, con incrementos principalmente en enero y abril siendo Labrisomidae tipo1, A. troschelii, Anchoa sp. y E. sexmaculatus, como las más abundantes (Fig. 6).
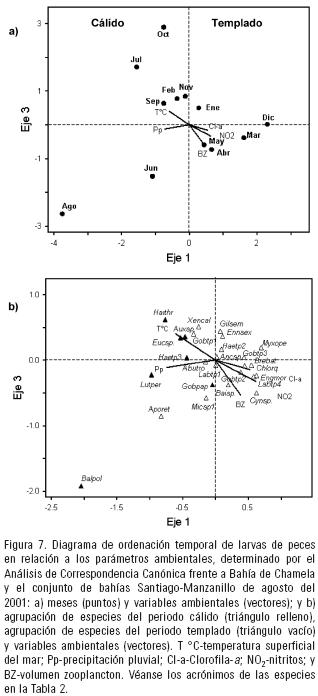
Análisis de ordenación. El CCA mostró una mayor significancia estadística (p <0.05) entre el primer y tercer eje, entre ambos explicaron el 34.1% de la varianza acumulada, con un coeficiente de correlación de Pearson de 0.9 (p <0.05). El primer eje explicó el 21.3% de la varianza (eigenvalor = 0.209), donde se muestra que la concentración de nitritos y clorofila–a (r = 0.702 y r = 0.606, respectivamente) tienen una correlación positiva con los meses de muestreo; en cambio, las especies presentaron una correlación negativa con la precipitación pluvial y la TSM (r = –0.825 y r = –0.672, respectivamente). El tercer eje explicó el 12.8% de la varianza (eigenvalor = 0.154), indicando que el biovolumen zooplanctónico se correlaciona negativamente con las especies y los meses (r = –0.575; Tabla 4). El diagrama de ordenación mostró un gradiente temporal con altas temperaturas y lluvias en el periodo cálido y por el contrario el periodo templado con bajas temperaturas y lluvias, así como las mayores concentraciones de zooplancton, nitratos y clorofila–a. En este diagrama, las especies de afinidad tropical se relacionaron con la mayor temperatura y precipitación pluvial (H. thrissina, Eucinostomus sp., Auxis sp., Haemulidae tipo 3 y Lutjanus peru). En cambio, el grupo de especies tanto tropical como subtropical presentaron su mayor abundancia durante el periodo templado, relacionadas con altas concentraciones de clorofila–a, nitritos y zooplancton (B. bathymaster, E. mordax, Bairdiella sp., Cynoscion sp., C. orqueta, Labrisomidae tipo 4 y Gobiesocidae tipo 2; Fig. 7).
DISCUSIÓN
La organización espacio–temporal de las asociaciones de larvas de peces en las Bahías de Chamela y Santiago–Manzanillo estuvo relacionada con la fisiografía de la costa y el hábitat de los adultos, así como con la variabilidad estacional de los parámetros ambientales en un periodo cálido (junio–octubre) y otro templado (noviembre– mayo). Esto se observó en los resultados de los análisis multivariables de la distribución temporal y espacial de las larvas, en los cuales se identificaron dos tipos de asociaciones en estrecha relación con las características topográficas de cada región. Esto significa que las localidades sobre la línea de costa, frente a Bahía Chamela, están más expuestas a la influencia del agua oceánica adyacente, como se observó en la mezcla de especies de diferente hábitat (costero, demersal y aguas poco profundas), además de la presencia de algunas especies mesopelágicas y oceánicas (Vinciguerria lucetia, Diaphus sp., Exocoetidae tipo 1 y Auxis sp.) que ocurrieron de manera esporádica y en baja abundancia. En cambio en Santiago–Manzanillo, la extensión de la plataforma continental y el resguardo de la bahía, no permiten la mezcla de faunas de diferente hábitat por lo que las especies fueron predominantemente de origen lagunar.
El área donde existe la conjunción de biotas de diferentes orígenes, es conocida como zona de transición. Las agrupaciones transicionales están integradas por la combinación de especies de origen lagunar y oceánico, las cuales indican un gradiente de distribución costa–océano en función de la topografía y la amplitud de la plataforma continental (Richardson et al., 1980; Sabatés, 1990; Sanvicente–Añorve et al., 1998; Funes–Rodríguez et al., 2002; Marancik, 2005). De acuerdo a lo anterior, Bahía Chamela presentó esta característica, pero no fue posible demostrar un gradiente costa–océano debido a limitaciones del plan de muestreo, ya que se realizó únicamente en la zona costera. No obstante, en las costas de Jalisco y Colima, un gradiente costa–océano fue identificado por Franco–Gordo et al. (2002) durante el periodo cálido, quienes también observaron, que por procesos de flujos de corrientes, las asociaciones de larvas fueron más homogéneas durante el periodo templado.
Otro factor que pudiera contribuir con la mezcla de especies, es el flujo de energía hacia la costa originado por ondas internas (Filonov et al., 1996) que no solamente dependen de la intensidad de la marea barotrópica, sino también, del ángulo de la pendiente del talud continental en Jalisco y Colima. Sin embargo, para comprobar la relación entre las ondas internas y el transporte pasivo de las larvas de peces, se requiere de un estudio que contemple la hidrodinámica de la zona costera.
Los resultados obtenidos sobre la variabilidad temporal estuvieron estrechamente relacionados con la variabilidad de los campos de temperatura y salinidad en la zona costera de Jalisco y Colima descritos por Filonov et al. (2000). Estos autores mencionan que de junio a diciembre la columna de agua se encuentre estratificada debido a un incremento en la irradiación solar e intercambio de calor océano–atmósfera, así como de una disminución en la salinidad por precipitaciones y escurrimientos. El resto del año, la columna de agua es homogénea (principalmente abril–mayo) debido a que la evaporación no es intensa, la precipitación es escasa y existe una baja temperatura del aire y de la capa superficial del mar, que aunado a la intensificación del viento, origina el rompimiento de la termoclina (Filonov et al., 2000).
Al respecto, es conocido que en aguas estratificadas los nutrimentos quedan atrapados en las capas más profundas, por lo que la incorporación de los mismos es limitada, en cambio, en aguas homogéneas ocurre la intrusión de nutrimentos, clorofila–a y zooplancton debido al efecto del viento (Bakun, 1996). Las diferencias en las características hidrológicas de la columna de agua (mezcla o estratificación) influyen en la conformación de las asociaciones de larvas, lo cual al parecer está relacionado con las estrategias reproductivas de los adultos (Hernández–Miranda et al., 2003). Esto explicaría la presencia de una asociación integrada principalmente por especies de afinidad biogeográfica tropical durante el periodo cálido (agua estratificada) y de otra que incluye especies de diferente afinidad biogeográfica (subtropical y tropical) en el periodo templado (agua homogénea).
Estudios realizados para explicar la supervivencia y el éxito en el reclutamiento, señalan que las especies responden tanto a ciclos de producción del ambiente (Frank & Leggett, 1983; Somarakis et al., 2000); como también a la selección del área y época de reproducción de los adultos que comparten requerimientos comunes (Fuiman & Werner, 2002). De tal forma que es de esperar que a un incremento en la abundancia de los individuos, pudiera tener relación con un ambiente favorable para el desarrollo de sus primeros estadios. Esto explicaría el incremento en la riqueza y el número de larvas registrados en un corto periodo (abril–mayo), en coincidencia con incrementos y valores máximos de zooplancton. Al respecto, se conoce que un gran número de especies se reproducen usualmente en periodos denominados como "desoves sincronizados" (Johannes, 1978); al mismo tiempo que es reconocida la importancia del acoplamiento entre los productos del desove y su alimento (Cushing, 1990). Por otro lado, el hecho de encontrar larvas a lo largo del año, pudiera implicar que los adultos tengan desoves múltiples, como ha sido sugerido por Lauth y Olson (1996) en situaciones donde la disponibilidad de presas es relativamente incierta para garantizar la supervivencia de sus larvas, como usualmente ocurre en regiones tropicales.
La variabilidad temporal de las asociaciones del presente estudio, es consistente con la formación de dos asociaciones una para el periodo cálido y otra para el templado, que estuvieron relacionadas con el sistema de corrientes superficiales del Pacífico Tropical Oriental (Franco–Gordo et al., 2002). Se observó una relación con los cambios en la intensificación de la Corriente Costera de Costa Rica de gran escala que causan cambios pronunciados en función del tiempo (Wirtky, 1965; 1966; Badan, 1997; Lavín et al., 2006). De acuerdo a los antecedentes hidrográficos y biológicos, se explica la alternancia entre un periodo cálido y otro templado, como lo que ocurre en zonas subtropicales y templadas (Martínez–López et al., 2001; Smith & Eppley, 1982; Hernández–Miranda et al., 2003).
Finalmente, es importante señalar que no es sencillo explicar la presencia de larvas de dos especies migratorias, relacionadas con la Corriente de California frente a Bahía Chamela (Engraulis mordax y Trachurus symmetricus), cuyo limite sureño es la Península de Baja California. Una posible explicación pudiera ser la expansión del hábitat de los adultos; tal vez relacionado con el evento de enfriamiento La Niña ocurrido entre 2000 y 2001 (Schwing et al., 2002). En tanto que también, pudiera deberse a la influencia de un giro de mesoescala que afecta la corriente costera y transporta agua de la Corriente de California hacia la costa (Lavín et al., 2006), como el mecanismo de transporte de estas larvas frente a la costa de Bahía Chamela.
Se concluye que la estructura temporal de las asociaciones de larvas de peces está determinada por la variabilidad ambiental regional. Durante el periodo templado, la asociación estuvo conformada por una mezcla de especies de afinidad tropical–subtropical, en un ambiente caracterizado por una alta concentración de nitritos, clorofila–a y biomasa zooplanctónica. En cambio durante el periodo cálido, las especies fueron predominantemente de origen tropical, en un medio caracterizado por una alta precipitación pluvial y alta temperatura superficial del mar. La organización espacial de las asociaciones de larvas de peces difiere entre Bahía Chamela y Santiago–Manzanillo, de acuerdo a la fisiografía de la costa y el hábitat al que pertenecen los adultos.
AGRADECIMIENTOS
Este estudio fue apoyado por el proyecto SIMORELOS–CONACYT (2001–2003) "Evaluación de la comunidad planctónica y su relación con especies de importancia pesquera, en la costa de Jalisco y Colima, México" (20000306013), el Instituto Politécnico Nacional (SIP 20060142) y Fondos Sectoriales (11716). Los autores RFR y AHM son becarios COFAA y EDI; y CASS recibió apoyo CONACYT para estudios de posgrado. Los autores expresamos nuestro agradecimiento a los revisores anónimos del presente estudio.
REFERENCIAS
Acal, E. D. 1991. Abundancia y diversidad del ictioplancton en el Pacífico centro de México, Abril 1981. Ciencias Marinas 17 (1): 25–50. [ Links ]
Aceves–Medina, G., S. P. A. Jiménez–Rosenberg, A. Hinojosa–Medina, R. Funes–Rodríguez, R. J. Saldierna, D. Lluch–Belda, P. E. Smith & W. Watson. 2003. Fish larvae from the Gulf of California. Scientia Marina 67 (1): 1–11. [ Links ]
Ahlstrom, E. H. 1971. Kinds and abundance of fish larvae in the Eastern Tropical Pacific, based on collections made on Eastropac I. Fishery Bulletin 69 (1): 3–77. [ Links ]
Ahlstrom, E. H. 1972. Kinds and abundance of fish larvae in the Eastern Tropical Pacific on the second multivessel Eastropac survey, and observations on the annual cycle of larval. Fishery Bulletin 70 (4): 1153–1242. [ Links ]
Ahlstrom, E. H. & O. P. Ball. 1954. Description of eggs and larvae of jack mackerel (Trachurus symmetricus) and distribution and abundance of larvae in 1950 and 1951. Fishery Bulletin 56: 285–402. [ Links ]
Badan, A. 1997. La Corriente Costera de Costa Rica en el Pacífico Mexicano. In: M. F. Lavín (Ed.). Contribuciones a la Oceanografía Física en México, Monografía No.3, Unión Geofísica Mexicana, pp. 99–112. [ Links ]
Bakun, A. 1996. Patterns in the ocean: Ocean Processes and Marine Population Dynamics. Univ. Calif. Sea Grant, San Diego, in cooperation with Centro de Investigaciones Biológicas del Noroeste, La Paz, B. C. S., México. 323 p. [ Links ]
Beers, J. R. 1976. Volumetric methods. In: H. F. Steedman (Ed.). Zooplankton, fixation and preservation. Monographs on Oceanographic Methodology. (4). Paris: UNESCO Press. Paris, pp. 56–60. [ Links ]
Beltrán–León, B. S. & R. Ríos–Herrera. 2000. Estadios tempranos de peces del Pacífico Colombiano. Instituto Nacional de Pesca y Acuicultura. Buenaventura–Colombia. I y II. 727 p. [ Links ]
Bolin, R. 1936. Embryonic and early larval stages of the California anchovy. California Fish and Game 22: 314–321. [ Links ]
Brogan, M. W. 1992. Ecology of larval fishes around reefs in the Gulf of California, México. University of Arizona. 161 p. [ Links ]
Cushing, D. H. 1990. Plankton production and years–class strength in fish populations: an update of the match/mismatch hypothesis. Advances in Marine Biology 26:250–293. [ Links ]
Feyrer, F. 2004. Ecological segregation of native and alien larval fish assemblages in the southern Sacramento–San Joaquin Delta. American Fisheries Society Symposium 39: 67–79. [ Links ]
Field, J. G., K. R. Clarke & R. M. Warwick. 1982. A practical strategy for analyzing multispecies distribution patterns. Marine Ecology Progress Series 8: 37–52. [ Links ]
Filonov, A. E., C. Monzón & I. Tereshschenko. 1996. Acerca de las condiciones de generación de las ondas internas de marea en la costa occidental de México. Ciencias Marinas 22 (3): 225–272. [ Links ]
Filonov, A. E., I. E. Tereshschenko, C. O. Monzón, M. E. González–Ruelas & E. Godínez–Domínguez. 2000. Variabilidad estacional de los campos de temperatura y salinidad en la zona costera de los estados de Jalisco y Colima, México. Ciencias Marinas 26 (2): 303–321. [ Links ]
Flores–Vargas, R., M. C. Navarro–Rodríguez, S. Hernández–Vázquez, R. Saldierna–Martínez & R. Funes–Rodríguez. 2004. Distribución y abundancia de larvas de pleuronectiformes en la costa de Jalisco y Colima, México. Boletín del Centro de Investigaciones Biológicas. 38 (2): 65–80. [ Links ]
Franco–Gordo, C., R. Flores–Vargas, C. Navarro–Rodríguez, R. Funes–Rodríguez & R. Saldierna–Martínez. 1999. Ictioplancton de las costas de Jalisco y Colima, México (diciembre 1995 a diciembre 1996). Ciencias Marinas 25 (1): 107–118. [ Links ]
Franco–Gordo, C., E. Suárez–Morales, E. Godínez & R. Flores–Vargas. 2000. A seasonal survey of the fish larvae community of the central Pacific coast of México. Bulletin of Marine Science 67: 1–14. [ Links ]
Franco–Gordo, C., E. Godínez–Domínguez & E. Suárez–Morales. 2002. Larval fish assemblages in waters off the central Pacific coast México. Journal of Plankton Research 24 (8): 775–784. [ Links ]
Franco–Gordo, C., Godínez–Domínguez, E. Suárez–Morales & L. Vásquez–Yeomans. 2003. Diversity of ichthyoplankton in the central Mexican Pacific: a seasonal survey. Estuarine, Coastal and Shelf Science 57: 111–121. [ Links ]
Franco–Gordo, C., E. Godínez–Domínguez, A. E. Filonov, I. E. Tereshchenko & J. Freire. 2004. Plankton biomass and larval fish abundance prior to and during the El Niño period of 1997–1998 along the central Pacific coast of México. Progress in Oceanography63 (3): 99–123. [ Links ]
Frank, K. T. & W. C. Leggett. 1983. Multispecies larval fish associations: accident or adaptation? Canadian Journal of Fisheries and Aquatic Sciences 40: 754–762. [ Links ]
Fuiman, L. E. & R. G. Werner. 2002. Fishery Science. The unique contributions of early life stages. Blackwell Science. Oxford, UK. 325 p. [ Links ]
Funes–Rodríguez, R., C. Flores–Coto, A. Esquivel–Herrera, M. A. Fernández–Alamo & A. Gracia–Gásca. 2002. Larval fish community structure along the west coast of Baja California during and after the El Niño event (1983). Boletín de Ciencias del Mar 70 (1): 41–54. [ Links ]
Funes–Rodríguez, R., A. Hinojosa–Medina, G. Aceves–Medina, R. Saldierna–Martínez & M. Hernández–Rivas. 2004. Diagnosis taxonómica y distribución de la abundancia de los primeros estadios de vida de los peces pelágicos menores. In: Quiñónez–Velázquez, C. y J. F. Elorduy–Garay (Eds.). Ambiente y pesquería de pelágicos menores en el noroeste de México. CICIMAR–IPN. La Paz, B. C. S., pp. 27–56. [ Links ]
Grioche, A., P. Koubbi & X. Harlay. 1999. Spatial patterns of ichthyo–plankton assemblages along the eastern English Channel French coast during spring 1995. Estuarine, Coastal and Shelf Science 49: 141–152. [ Links ]
Grothues, T. M. & R. K. Cowen. 1999. Larval fish assemblages and water mass history in a major faunal transition zone. Continental Shelf Research 19: 1171–1198. [ Links ]
Hernández–Miranda, E., A. T. Palma & F. P. Ojeda. 2003. Larval fish assemblages in nearshore coastal waters off central Chile: temporal and spatial patterns. Estuarine, Coastal and Shelf Science 56: 1075–1092. [ Links ]
Johannes, R. E. 1978. Reproductive strategies of coastal marine fishes in the tropics. Environmental Biology of Fishes 3: 65–84. [ Links ]
Lauth, R. R. & R. J. Olson. 1996. Distribución y abundancia de escómbridos larvales en relación al ambiente físico en el noroeste del Recodo de Panamá. Inter–American Tropical Tuna Commission 21 (3): 149–167. [ Links ]
Lavín, M. F., E. Beier, J. Gómez–Valdés, V. M. Godínez & J. García. 2006. On the summer poleward coastal current off SW México. Geophysical research Letters 33: 1 –4. [ Links ]
Lazzari, M. A. 2000. Dynamics of larval fish abundance in Penobscot Bay, Maine. Fishery Bulletin 99: 81–93. [ Links ]
Marancik, K. E., L. M. Clough & J. A. Hare. 2005. Cross–shelf and seasonal variation in larval fish assemblages in the southeast United States continental shelf off the coast of Georgia. Fishery Bulletin 103: 108–129. [ Links ]
Martínez–López, A., R. Cervantes–Duarte, A. Reyes–Salinas & J. E. Valdez–Holguín. 2001. Cambio estacional de clorofila a en la Bahía de la Paz, B. C. S., México. Hidrobiológica U (1): 45–52. [ Links ]
McCune, B. & M. J. Mefford. 1999. PC–ORD. Multivariate Analysis of Ecology Data. v4.0. MjM Software. Gleneden Beach. Oregon, USA. [ Links ]
Moser, H. G. (Ed.). 1996. The early stages of fishes in the California Current Region. California Cooperative Oceanic Fisheries Investigations. Atlas 33. Allen Press Inc. Lawrence, Kansas. 1505 p. [ Links ]
Moser, H. G. & P. E. Smith. 1993. Larval fish assemblages of the California Current region and their horizontal and vertical distributions across a front. Bulletin of Marine Science 53 (2): 645–691. [ Links ]
Navarro–Rodríguez, M. C., S. Hernández–Vázquez, R. Funes–Rodríguez & R. Flores–Vargas. 2001. Distribución y abundancia de larvas de peces de la familia Haemulidae, Sciaenidae y Carangidae de la plataforma continental de Jalisco y Colima. Boletín del Centro de Investigaciones Biológicas 35 (1): 1–24. [ Links ]
Richardson, S. L., J. L. Laroche & M. D. Richardson. 1980. Larval fish assemblages and association in the North–east Pacific Ocean along the Oregon coast, winter–spring 1972–1975. Estuarine and Coastal Marine Science 2: 671–699. [ Links ]
Sabatés, A. 1990. Distribution pattern of larval fish populations in the Northwestern Mediterranean. Marine Ecology Progress Series 59: 75–82. [ Links ]
SanviceNTE–Añorve L., C. Flores–Coto & L. Sánchez–Velasco. 1998. Spatial and seasonal patterns of larval fish assemblages in the southern Gulf of Mexico. Bulletin of Marine Science 62 (1): 17–30. [ Links ]
Schwing B. F., T. Murphree., L. De Witt & P. M. Green. 2002. The evolution of oceanic and atmospheric anomalies in the northeast Pacific during the El Niño and La Niña events of 1995–2001. Progress in Oceanography 54: 459–491. [ Links ]
Smith, P. E. & R. W. Eppley. 1982. Primary production and the anchovy population in the Southern California Bight: comparison of times series. Limnology and Oceanography 27: 1–17. [ Links ]
Smith, P. E. & S. L. Richardson.1977. Standard techniques for pelagic fish and larva survey. FAO Fisheries Technical Paper 175. Roma. 99 p. [ Links ]
Somarakis, S., E. Maraveya & N. Tsimenides. 2000. Multispecies ichth–yoplankton associations in epipelagic species: is there any intrinsic adaptive function? Belgian Journal of Zoology 130 (1): 125–129. [ Links ]
Strickland, J. D. H. & T. R. Parsons. 1972. A practical handbook of seawater analysis. Bulletin 167. Fisheries Research Bd. Canada, Ottawa, Ontario. Canada. 310 p. [ Links ]
Ter Braak, J. F. 1986. Canonical correspondence analysis: a new eigenvector technique for multivariate direct gradient analysis. Ecology 67 (5): 1167–1179. [ Links ]
Walker, H. J., W. Watson & A. M. Barnett. 1987. Seasonal occurrence of larval fishes in the nearshore southern California Bight of San Onofre, California. Estuarine, Coastal and Shelf Science 25: 91–109. [ Links ]
Wirtky, K. 1965. Surface currents of the Eastern Tropical Pacific ocean. Inter–American Tropical Tuna Commission Bulletin 9 (5): 271–304. [ Links ]
Wirtky, K. 1966. Oceanography of the Eastern Equatorial Pacific Ocean. Oceanography and Marine Biology Annual Review k 33–68. [ Links ]
Zar, J. H. 1996. Biostatistical analysis. Third edition. Prentice Hall, New Jersey. 662 p. [ Links ]














