Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.18 supl.1 Ciudad de México ago. 2008
Variación espacial de larvas de lutjánidos y serránidos en la Plataforma de Yucatán
Spatial variation of Snapper and Grouper larvae in Yucatan Shelf
Elsa Falfán–Vázquez1*, Uriel Ordóñez–López1 y Margarita Órnelas–Roa1
1 Centro de Investigación y de Estudios avanzados del Instituto Politécnico Nacional. Laboratorio de Plancton Marino. Km. 6 Antigua carretera a Progreso. Apdo. Postal 73, Cordemex, 97310, Mérida, Yucatán, México. * E–mail: efalfan@mda.cinvestav.mx.
Recibido: 8 de enero de 2007
Aceptado: 8 de noviembre de 2007
RESUMEN
El objetivo fue analizar la abundancia y distribución de los serránidos y lutjánidos en la Península de Yucatán. Se analizaron 45 muestras de ictioplancton colectadas durante una campaña oceanográfica (Yucatán03–A) en el mes de septiembre del 2003, los arrastres fueron superficiales con una red tipo Bongo. Un total de 3,963 organismos fueron colectados, pertenecientes a 50 familias, tres (Carangidae, Gobiidae y Clupeidae) representaron más del 50% de la densidad. Las familias Lutjanidae y Serranidae estuvieron dentro de las nueve más abundantes con una densidad total de 713.8 ±60 org./100 m3. Serranidae estuvo representada por especies de los géneros Anthias, Diplectrum, Liopropoma, Serranus y Epinephelus fulvus, mientras que Lutjanidae por Lutjanus analis, L. campechanus, L. griseus y L. synagris. La especie con mayor densidad fue L. synagris, representando el 28.9% del material revisado, seguida de E. fulvus, L. analis y L. campechanus. El análisis de agrupación de las estaciones permitió identificar tres zonas oceanográficas a nivel horizontal: Oeste, Centro y Surgencia (en el este). Las larvas de serránidos se distribuyeron principalmente en la zona Centro, mientras que las de los lutjánidos en el este de la plataforma de Yucatán, sugiriéndose que los desoves de peces de estas familias ocurren en distintas zonas de la plataforma, evitando así la competencia por el alimento en sus primeras etapas larvarias. La corriente de Yucatán provoca un transporte de Ekman que produce un afloramiento que genera un incremento de fitoplancton, zooplancton e ictioplancton que favorece el reclutamiento de los peces, un rápido crecimiento y disminución de su estadio larval.
Palabras clave: Ictioplancton, Lutjanidae, Serranidae, distribución, Plataforma de Yucatán.
ABSTRACT
The objective was to analyze the abundance and distribution of snappers and groupers in the Yucatan shelf. We analyzed forty–five samples of ichthyoplankton that were taken from oceanographic research (Yucatan03–A) during September 2003. Superficial tows were made with a Bongo net. A total of 3,963 organisms were collected, they belong to 50 fish families. Three families (Carangidae, Gobiidae y Clupeidae) represented more than 50% of the density. Lutjanidae and Serranidae families were within the nine most abundant families, with a total density of 713.8 ±60 org./100 m3. Serranidae family is represented by species of the genus Anthias, Diplectrum, Epinephelus, Liopropoma, Serranus and Epinephelus fulvus, whereas Lutjanidae is represented by Lutjanus analis, L. campechanus, L. griseus and L. synagris. The highest density species was L. synagris, representing 28.9% of material reviewed, followed by E. fulvus, L. analis and L. campechanus. The analysis of the cluster of stations allowed identifying three oceanographic zones at a horizontal level: West, Center and Upwelling (in the East). The groupers larvae were distributed mainly in the Center whereas snappers larvae were distributed in the East of the shelf, this suggests that the spawning of these families occurred in different parts of the shelf, avoiding in this way the competition for food in their first larval stages. The current of Yucatan promotes an Ekman transportation that produces an upwelling that generates an increment of phytoplankton, zooplankton and ichthyoplakton that favors the fish recruitment, a fast growth and a diminution of their larval stage.
Key words: Ichthyoplankton, Lutjanidae, Serranidae, distribution, Yucatan shelf.
INTRODUCCIÓN
La plataforma de Yucatán es una región de gran importancia pesquera por ser hábitat natural de numerosas especies de importancia comercial cuya explotación constituye la forma de vida y trabajo de muchos pueblos ribereños. Un elemento de marcada influencia en el valor pesquero y productivo de esta región es el afloramiento que se produce en la porción oriental del talud de la plataforma frente al estado de Yucatán, que favorece la producción primaria (Piñeiro et al., 2001).
Aunque existe una gran diversidad de especies presentes en la plataforma, son pocas las familias que constituyen la mayor parte del volumen de capturas (Castro–Suaste et al., 2000); entre ellas se encuentran los lutjánidos y serránidos (comúnmente llamados pargos y meros, respectivamente), quienes son de gran importancia comercial (Allen, 1985; Bullock & Smith, 1991; Heemstra & Randall, 1993; Castro–Aguirre et al., 1999). No obstante, la importancia de estos recursos, el conocimiento de la fase larval de estas familias es limitado. Los trabajos hasta ahora realizados proporcionan información sobre la distribución general de la abundancia de larvas de peces (Juárez, 1975; Olvera–Limas et al., 1988; David et al., 1997; Vega–Cendejas & Hernández, 2004; Ordóñez–López & García–Hernández, 2005).
En la actualidad, los estudios taxonómicos de las larvas de lutjánidos y serránidos están comenzando a proveer información que permitirá realizar estudios ecológicos por debajo del nivel de familia. Una limitante para estos estudios es la baja cantidad de larvas de estas especies en los muestreos, debido a que se encuentran en hábitats de difícil acceso para los artes de colecta (Leis, 1986; Richards et al., 1994; Richards & Roepke, 1996; Richards, 2006).
Un mejor conocimiento de la taxonomía larval de estos organismos es necesario para ayudar a determinar áreas y temporadas de desove, para definir la estructura del stock de especies importantes o para monitorear el efecto de cambios en el ambiente sobre la abundancia del stock.
Este trabajo tuvo como objetivo analizar la abundancia y distribución de los serránidos y lutjánidos en la Península de Yucatán, así como su relación con las características oceanográficas del área de estudio durante el verano 2003.
MATERIAL Y MÉTODOS
El área de estudio comprendió la plataforma continental de la Península de Yucatán. Las aguas que se encuentran en esta región provienen en su mayoría de la corriente de Yucatán la cual debido a factores oceanográficos, continentales y a la oscilación estacional de las masas de agua provoca un afloramiento de aguas profundas, teniendo su máxima extensión durante la primavera (Bulanienkov & García–Díaz, 1975; Merino, 1992; 1997). Este afloramiento genera un incremento en los nutrimentos superficiales, provocando un aumento en la productividad del ecosistema que origina altos valores de biomasa de copépodos y larvas de peces (García, 1980).
El material planctónico analizado provino de la campaña oceanográfica Yucatán03–A, realizada a bordo del B/O ONJUKO del 18 al 25 de septiembre de 2003 cubriendo un total de 45 estaciones en el norte de la península (Fig. 1). El material fue colectado efectuando arrastres superficiales de 10 minutos con una red tipo Bongo de 60 cm de diámetro y mallas de 303 y 505 µm. En cada boca de las redes se colocaron flujómetros para estimar el agua filtrada (Smith & Richardson, 1979). Las muestras obtenidas fueron fijadas y preservadas en una solución formalina en agua de mar al 5% y neutralizadas con borato de sodio (Olvera–Limas et al., 1992). Los datos de temperatura, salinidad y oxigeno disuelto superficiales fueron registradas con una sonda CTD. Los datos de Cl–a fueron obtenidos por espectrofotometría (Parsons et al., 1984).
Para establecer zonas de afinidad hidrológica, se aplicó una técnica de clasificación jerárquica aglomerativa en modo Q a los datos transformados (log 10) de las variables del medio (Temperatura, Oxígeno disuelto, Nitritos y Amonio), esta prueba fue comparada con un ANOVA (Normalidad 1–α= 0.05, prueba de Shapiro–Wilk; F para homogeneidad de varianzas y Bartlett) para saber si existían diferencias significativas entre las zonas (Zar, 1984; Sokal & Rohlf, 1995).
De las 45 muestras colectadas se estimó la biomasa zooplanctónica, para lo cual se utilizó la técnica del peso húmedo y la información generada se expresó en mg/100 m3 (Olvera–Limas et al., 1992).
Las larvas de lutjánidos y serránidos fueron removidas, contadas y determinadas al mínimo taxón posible (Richards et al., 1994; Richards & Roepke, 1996; Richards, 2006), del total de las muestras colectadas. La densidad de las larvas fue expresada en org./100 m3.
Para representar la variación espacial de la abundancia de las familias se construyeron gráficos de abundancia continua (SURFER ver. 8, Golden Software, Inc. 2002). Finalmente, se efectuó un análisis de correspondencia canónica (ACC) con el fin de conocer las posibles relaciones entre las especies y los principales parámetros oceanográficos registrados.
RESULTADOS Y DISCUSIÓN
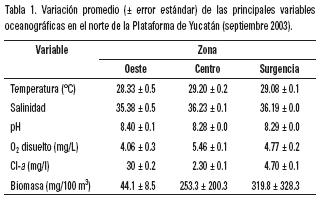
El análisis de agrupación de las estaciones basado en los valores transformados de las variables del medio (T, O2, NO2, NH4), permitió identificar horizontalmente tres zonas oceanográficas en el área de estudio, estas fueron designadas arbitrariamente como: Zona Oeste (estaciones 1–8), Zona Centro (estaciones 9–22) y Zona de Surgencia (estaciones 24–56; Fig.1). Cada grupo fue significativamente distinto (p <0.05) con respecto a los otros en términos de las variables del medio. Las aguas superficiales se caracterizaron por presentar temperaturas y salinidades mayores de 28.9 °C ± 0.1 y 36.0 °C ± 0.1 respectivamente. En tanto que el oxígeno disuelto presentó valores promedio de 4.8 ± 0.1 mg/L y un pH de 8.3 ± 0.02 (Tabla 1). Estos valores coinciden con los registrados por David et al. (1997) y De la Lanza–Espino (2001) para la misma zona. Por otro lado los valores promedio de Cl–a (3.1 ± 0.1 mg/L) y biomasa zooplanctónica (1497.1 ± 282.1 mg/100 m3) sugieren una importante productividad planctónica en la región, particularmente en la zona nororiental se registran los mayores valores de Cl–a y biomasa. Al respecto Merino (1992) ha señalado la presencia de una surgencia que eleva aguas ricas en nutrientes y fertiliza la región superficial incrementando las concentraciones de fitoplancton y zooplancton (García, 1980; David et al., 1997).
De manera general, un total de 3,963 larvas de peces fueron colectadas, con una densidad total de 14,347.8 ± 351.6 org./100 m3. El 92.6% de larvas fueron determinadas al mínimo taxón posible y correspondieron a 50 familias, 86 géneros y 110 especies. Nueve familias representaron más del 57% de la abundancia total. En general las larvas estuvieron presentes en toda la península, no obstante su mayor concentración se localizó en la Zona de Surgencia con valores de 12,108 org./100 m3.
Particularmente para el complejo Lutjanidae–Serranidae, el 4.9% del ictioplancton colectado correspondió a larvas de serránidos (72 larvas) y lutjánidos (125 larvas), representando una densidad total de 713.8 ± 60.0 org./100 m3. Se identificaron cinco taxa para cada familia. Lutjanus synagris (Linnaeus, 1758) fue la especie con mayor densidad al representar un 28.9% del material. Otras especies importantes fueron Epinephelus fulvus (Linnaeus, 1758) (15.2%), Lutjanus analis (Cuvier, 1828) (14.7%) y Lutjanus campechanus (Poey, 1860) (14.7%) (Tabla 2).
Las larvas de los serránidos presentaron una amplia distribución, sin embargo, su mayor concentración se localizó en la Zona Centro (Fig. 2A). Particularmente fueron escasas las larvas de Anthias sp., que sólo se localizaron en la Zona Oeste (Est. 2) y las de E. fulvus y Liopropoma sp. en la Zona Centro (Est. 20). En contraste Diplectrum sp. y Serranus sp. se registraron en las tres zonas aunque con baja abundancia. Al respecto Olvera–Limas et al. (1988; 1989), han registrado la presencia de larvas de serránidos en toda la Zona Económica Exclusiva del Golfo de México (ZEEGM), con una mayor concentración de larvas hacia la porción noro–riental de la Península de Yucatán, particularmente hacia el talud continental y durante la primavera e invierno. Asimismo, estos autores registraron la presencia de especies pertenecientes a 9 géneros durante la primavera dentro de los cuales Centropristis y Diplectrum fueron los más abundantes, mientras que Centropristis y Liopropoma lo fueron en verano. De la misma manera Sánchez–Velasco y Flores–Coto (1994) reportaron que las larvas de familia Serranidae constituyeron entre 2 y el 9 % del ictioplancton recolectado en la porción nororiental de la plataforma de Yucatán, siendo las larvas del genero Diplectrum las más abundantes. En tanto larvas de los géneros Serranus, Epinephelus, Serraniculus y Anthias, variaron de poco abundantes a escasas.
Las larvas de la familia Lutjanidae se localizaron preferentemente hacia la porción nororiental de la Península de Yucatán, las mayores concentraciones de Lutjanus synagris, L. analis y L. campechanus en esta región sugieren que los desoves ocurrieron cerca de la costa (Tabla 2 y Fig. 2B). Acorde con lo anterior Olvera–Limas et al. (1988; 1989), reconocieron la presencia de larvas de lutjánidos en la ZEEGM. Tales autores señalan la baja abundancia de larvas en el sur del Golfo de México, con un incremento de las mismas sobre el talud continental de la plataforma de Yucatán. Igualmente, destacan la presencia de tres especies: Rhomboplites aurorubens (Cuvier, 1829), L. campechanus y L . vivanus (Cuvier, 1828); siendo las dos primeras las más abundantes durante el verano. En tanto que Sánchez–Velasco y Flores–Coto (1994) indicaron que las larvas de los pargos fueron menores al 2.3% del material ictioplanctónico recolectado en verano y primavera en la porción oeste de la plataforma de Yucatán, siendo R. aurorubens la especie más abundante de las 4 registradas.
Las diferencias observadas en la distribución de abundancia de los serránidos y los lutjánidos sugieren que los desoves ocurrieron en distintas zonas de la plataforma de Yucatán; lo que quizá evite la competencia por alimento en sus primeras etapas larvarias. Por otro lado, la fricción de la corriente de Yucatán con el talud continental provoca un transporte de Ekman que es perpendicular al talud con dirección oeste, que debido a la elevación del fondo en la misma dirección conduce al ascenso de aguas profundas ricas en nutrientes. Este mecanismo implica que el afloramiento solamente se presentará cuando existe contacto entre la corriente y el fondo (sobre el talud o la plataforma) y que la intensidad del afloramiento dependerá de la velocidad de la corriente (Merino, 1992; Piñeiro et al., 2001). Este fenómeno genera un incremento del fitoplancton, zooplancton e ictioplancton en la plataforma de Yucatán; además, la existencia de un aumento en la cantidad del alimento disponible conduce a incrementar el reclutamiento de peces. Dicha condición trófica permite un rápido crecimiento de los organismos y genera una disminución en la duración del estadio larval, ventajas importantes si consideramos que la zona esta rodeada de aguas pobres en nutrientes.
En este mismo sentido Merino (1992), ha señalado que la corriente de Yucatán a su paso por el margen Este de la plataforma, conforma un giro ciclónico frente a Cabo Catoche, el cual podría operar como un mecanismo concentrador de materiales y organismos, aumentando la eficiencia productiva del ecosistema. La disponibilidad de alimento permite sostener una mayor abundancia y riqueza de larvas de peces costeros y marinos, hecho que también ha sido mencionado por David et al. (1997). Finalmente es probable que las larvas de serránidos y lutjánidos en su aclimatación dentro del giro ciclónico migren posteriormente a hábitats costeros cercanos. Al respecto Vega–Cendejas y Hernández (2004) y Ordóñez–López & García–Hernández (2005) han señalado la importancia de las praderas de pastos marinos sobre el margen litoral y dentro de los sistemas costeros como áreas de crianza y alimentación de larvas y juveniles de peces marinos en el norte de la Península de Yucatán.
El ACC explicó el 62.9% de la varianza entre los componentes I y II. También, permitió registrar la relación de las larvas de Liopropoma sp. y Epinephelus fulvus con la salinidad, temperatura y oxígeno disuelto, en tanto Lutjanus sp. con la bio–masa zooplanctónica. Lutjanus analis, L. synagris y Diplectrum sp. con la concentración de clorofila–a y Anthias sp. con el pH (Fig. 3).
Las relaciones registradas de las especies de lutjánidos y serránidos con los descriptores de la productividad planctónica sugieren que el fitoplancton y el zooplancton constituyen un alimento potencial para las etapas tempranas de pargos y meros. Al respecto Cushing (1972) ha señalado que la disponibilidad del alimento para larvas de peces es un factor importante que gobierna la abundancia de los peces marinos. Esto podría ser importante si consideramos la surgencia que se presenta en la región NE de la península, misma que genera un incremento en los nutrimentos superficiales, provocando un aumento en la productividad primaria del ecosistema que origina altos valores de biomasa zooplanctónica; alimento que podría sostener importantes abundancias de larvas de peces (García, 1980). Asimismo, la relación de las especies con la temperatura y salinidad sugieren condiciones óptimas para el desove y sobrevivencia de los serránidos en la Zona Centro y de los lutjánidos en la zona de Surgencia (al E de la plataforma). Al respecto Olvera–Limas et al. (1988), registraron una elevada ocurrencia de larvas de lutjánidos en la plataforma de Yucatán con temperaturas que oscilaron entre los 24.6 y 26.6 °C y salinidades de 35.9 a 36.4. En tanto las larvas de los serránidos se presentaron en temperaturas de 24.7 °C y 25.7 °C y salinidades de 36 y 36.2. Un aspecto adicional es la escasa información a la tolerancia de las especies a los cambios de pH.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a los oficiales y personal de la Secretaría de Marina de la estación de Investigaciones Oceanográficas de Progreso, Yucatán, así como a la tripulación B/O ONYUKU. El presente trabajo forma parte del trabajo de investigación doctoral del primer autor, en el CINVESTAV–IPN Unidad Mérida.
REFERENCIAS
Allen, G. R. 1985. FAO species catalogue Snappers of the World. An annotated and illustrated catalogue of lutjanid species known to date. FAO Fisheries Synopsis 125(6): 1–208. [ Links ]
Bulanienkov, S. K. & C. García–Díaz. 1975. Influencia de los procesos atmosféricos en el afloramiento del banco de Campeche. Revista de Investigación Pesquera. Instituto Nacional de Pesca, Cuba 1(2): 99–140. [ Links ]
Bullock, L. H. & G. Smith. 1991. Seabasses (Pisces: Serranidae). Memoirs of the Hourglass Cruises. Florida Marine Research Institute. Florida. 243 p. [ Links ]
Castro–Aguirre, J. L., H. Espinosa–Pérez & J. J. Schmitter–Soto. 1999. Ictiofauna Estuarino–Lagunar y Vicaria de México. Colección de Textos Politécnicos. Serie Biotecnologías–IPN, LIMUSA, México. 711 p. [ Links ]
Castro–Suaste, T., G. Mexicano–Cintoria & O. Defeo. 2000. Las pesquerías del estado de Yucatán (México): evolución y manejo durante el período 1976 – 1997. Oceánides 15(1): 47–61. [ Links ]
Cushing, D. H. 1972. The production cycle and numbers of marine fish. Zoology Society of London Symposium 29: 213–232. [ Links ]
David, A. W., C. B. Grimes, T. D. Leming, G. Ortuño & A. Monreal 1997. Phytoplankton biomass, zooplankton and larval fish assemblages associated with the Yucatán upwelling area. In: Kumpf, H. E. & A. C. Jones (Eds.) Proceeding of the XX Annual Mexus–Gulf Symposium. NOAA Technical Memorandum NMFS–SEFS–403. pp. 15–17. [ Links ]
De La Lanza–Espino, G. 2001. Características Fisicoquímicas de los Mares Mexicanos. Editado por Instituto de Geografía (Universidad Nacional Autónoma de México) y Plaza & Valdés, México. 149 p. [ Links ]
García, C. 1980. Caracterización general del Banco de Campeche. Revista de Investigación Pesquera. Instituto Nacional de Pesca, Cuba 5(2): 1–10. [ Links ]
Golden Software, Inc. 2002. Surface Mapping System. Golden Software, Inc. 809 14th Street, Golden Colorado 80401–1866. [ Links ]
Heemstra, P. C. & J. E. Randall. 1993. Groupers of the world (Family Serranidae, Subfamily Epinephelinae). An annotated and illustrates catalogue of the grouper and lyretail species known to date. Food and Agricultural Organization Fisheries Synopsis 125(16): 1–382. [ Links ]
Juárez, M. 1975. Distribución cuantitativa y algunos aspectos cualitativos del ictioplancton del Banco de Campeche. Revista de Investigaciones de Cuba. Centro de Investigación Pesquera –Instituto Politécnico Nacional 1(1): 27–71. [ Links ]
Leis, J. M. 1986. Review of the early life history of tropical groupers (Serranidae) and snappers (Lutjanidae). In: J. J. Polovina & S. Ralston (Eds.) Tropical snappers and groupers: Biology and fisheries management. Westview Press, Inc. Boulder, Colorado., pp. 189–237. [ Links ]
Merino, I. M. 1992. Afloramiento en la plataforma de Yucatán: estructura y fertilización. Tesis doctoral. Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México. México, Distrito Federal. 276 p. [ Links ]
Merino, I. M. 1997. Upwelling on the Yucatan shelf: hydrographic evidence. Journal of Marine Systems 13: 101–121. [ Links ]
Olvera–Limas, R. M., J. A. García–Borbón, E. Ramírez, A. Cid del Prado, M. Cortés, L. Cerecedo & R. E. Sánchez. 1988. Distribución y abundancia por especies de las larvas de peces de las familias Carangidae, Clupeidae, Lutjanidae, Sciaenidae, Scombridae y Serranidae en la Zona Económica Exclusiva del Golfo de México. Informe Final Instituto Politécnico Nacional – Consejo Nacional de Ciencia y Tecnología (PCECCNA–040602). Instituto Nacional de Pesca, Secretaria de Pesca. México. 105 p. [ Links ]
Olvera–Limas, R. M., J. A. García–Borbón, L. G. Gómez, M. Cortés, E. Cid del Prado, L Cerecedo, E. Sánchez & G. Ortuño–Manzanares. 1989. Atlas de Distribución y Abundancia del Ictioplancton en la Zona Económica Exclusiva Mexicana del Golfo de México. Instituto Nacional de Pesca, Secretaria de Pesca, México. 82 p. [ Links ]
Olvera–Limas, R. M., M. A. Padilla & G. Ortuño M. 1992. Manual de métodos para las investigaciones ictioplanctónicas del Instituto Nacional de la Pesca. Secretaria de Pesca. México. México, Distrito Federal. 66 p. [ Links ]
Ordóñez–López, U. & V. D. García–Hernández, 2005. Ictiofauna juvenil asociada a Thalassia testudinum en Laguna Yalahau, Quintana Roo. Hidrobiológica 15(2): 195–204. [ Links ]
Parsons, T. R., Y. Maita & C. M. Lalli. 1984. Determination of chlorophylls and total carotenoids : spectrophotometric method. In: Parsons, T. R., Y. Maita & C. M. Lalli. A manual of chemical and biological methods for seawater analysis. Pergamon Press Inc., Elmsford, New York, USA. pp. 101–104. [ Links ]
Piñeiro, R., E. Giménez, V. Moreno, R. Burgos & A. Betanzos. 2001. Características térmicas del Banco de Campeche. INP SAGARPA México. Ciencia Pesquera 14: 83–87. [ Links ]
Richards, W. J. (ED.) 2006. Early Stages of Atlantic Fishes. An Identification Guide for the Western Central North Atlantic. Vol. I y II. C.R.C. Taylor & Francis. New York, USA. 2640 p. [ Links ]
Richards, W. J. & A. Roepke. 1996. Guide to the Identification of the Early Life History Stages of Fishes of the familiy Serranidae of the Western Central Atlantic. NOAA Technical Memorandum, NMFS–SEFSC–XXX. Miami, Florida, United States. 158 p. [ Links ]
Richards, W. J., K. C. Lindeman, J. L. Shultz, J. M. Leis, A. Roepke, M. E. Clarke & B. H. Comyns. 1994. Preliminary Guide to the Identification of the Early Life History Stages of Lutjanidae Fishes oh the Western Central Atlantic. NOAA Technical Memorandum, NMFS–SEFSC–345. Miami, Florida, United States. 49 p. [ Links ]
Sánchez–Velasco, L. & C. Flores–Coto. 1994. Larval fish assemblages at the Yucatan Shelf and in the Mexican Caribbean Sea during the upwelling period (spring, 1985). Science Marine 58(4): 289–297. [ Links ]
Smith, P. E. & S. L. Richardson. 1979. Standar techniques for pelagic fishes eggs and larvae surveys. FAO Fisheries Technical Paper 175. Miami, Florida, USA. 107 p. [ Links ]
Sokal, R. R. & F. Rohlf. 1995. Biometry. The principles and practice of statistics in biological research. Third edition. W. H. Freeman and Company. New York. 887 p. [ Links ]
Vega–Cendejas, M. E. & M. Hernández. 2004. Fish community structure and dynamics in a coastal hypersaline lagoon, Rio Lagartos, Yucatan, Mexico. Estuarine, Coastal and Shelf Science 60: 285–299. [ Links ]
Zar, J. H. 1984. Biostatistical analysis. 2nd Ed. Prentice–Hall, Englewood–Cliffs, New York. 718 p. [ Links ]














