Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.18 supl.1 Ciudad de México ago. 2008
Composición y dinámica del fitoplancton en un lago urbano hipertrófico
Taxonomical composition and dynamics of phytoplankton in an urban hypertrophic lake
María Guadalupe Oliva Martínez 1*, Armando Rodríguez Rocha1, Alfonso Lugo Vázquez1 y María del Rosario Sánchez Rodríguez1
1 Proyecto de Investigación en Limnología Tropical, UIICSE, FES Iztacala, UNAM. Av. De los Barrios No. 1, Los Reyes Iztacala, Tlalnepantla 54090, Estado de México. * Autor para correspondencia: oliva@servidor.unam.mx.
Recibido: 8 de enero de 2007
Aceptado: 30 de enero de 2008
RESUMEN
Se presenta la composición y dinámica anual del fitoplancton del somero e hipertrófico Lago Tezozomoc, D.F. Se realizaron muestreos mensuales de superficie en la zona litoral y limnética del lago, durante septiembre de 2003 a agosto de 2004. Se midieron temperatura, pH, oxígeno disuelto, conductividad (K25), clorofila a y nutrimentos (N y P). El fitoplancton se identificó y se cuantificó, incluyendo el de talla menor a 2 µm. Se encontraron 50 especies, las Chlorophyta fueron el grupo más abundante y con mayor número de especies. Entre septiembre y diciembre del 2003, dos especies de Microcystis fueron muy abundantes en el lago. Merismopedia punctata, Selenastrum minutum, Chlamydomonas globosa, Monoraphidium caribeum y el picofitoplancton fueron dominantes. Se distinguieron dos épocas: una fría y seca (septiembre a abril) y otra cálida y lluviosa (mayo a agosto). Durante la primera, se registró un menor promedio de temperatura (17.6 °C), concentración de nutrimentos (P–PO4 = 2.21, N–NO3 = 0.4 mg L–1) y clorofila a (200 µg L–1), mientras que la K25 (985 µS cm–1) y el oxígeno disuelto (10.1 mg L–1) fueron más elevados, predominando C. globosa, Cyclotella meneghiniana, Monoraphidium griffithii, Cryptomonas ovata y Microcystis spp. En la segunda, la temperatura promedio se incrementó (21 °C), lo mismo que los nutrimentos (P–PO4 = 3.31, N–NO3 = 3.3 mg L–1) y la clorofila a (295 µg L–1), disminuyendo la K25 (808 µS cm–1) y el oxígeno disuelto (6.8 mg L–1). Las especies dominantes fueron S. minutum, M. caribeum, Chlorogonium minimum y el picoplancton. Las especies presentes y las condiciones ambientales indicaron claramente el estado hipertrófico del lago.
Palabras clave: Lagos urbanos, fitoplancton, eutrofización, Microcystis, Chlorococcales.
ABSTRACT
Taxonomic composition and temporal fluctuation of the phytoplankton community inhabiting the urban, hypertrophic shallow lake Tezozomoc, D.F. was analyzed. Water samples were taken monthly at the littoral and limnetic areas of the lake, from September 2003 to August 2004. Temperature, pH, dissolved oxygen, conductivity (K25), chlorophyll a, and nutrients (N and P) concentrations were measured. Phytoplankton was identified and counted including the fraction smaller than 2 µm. Fifty phytoplankton species were identified, being Chlorophyta the dominant group. Two species belonging to the genus Microcystis showed high abundances in the lake from September to December 2003. Merismopedia punctata, Selenastrum minutum, Chlamydomonas globosa and Monoraphidium caribeum, as well as picophytoplankton, were dominant. Environmental and biological data clearly reflected two different seasons in the lake: one cold and dry season (September to March) and the second, warm and wet (April to August). Along the first season, mean values of water temperature (17.6 °C), nutrients (P–PO4 = 2.21, N–NO3 = 0.4 mg L–1) and chlorophyll a (200 µg L–1) were lower, while K25 (985 µS cm–1) and dissolved oxygen (10.1 mg L–1) concentrations were the higher. Dominant species along the period were C. globosa, Cyclotella meneghiniana, M. griffithii, Cryptomonas ovata and Microcystis spp. The second period had the higher mean values of water temperature (21 °C), nutrients concentration (P–PO4 = 3.31, N–NO3 = 3.3 mg L–1) and clorophyll a (295 µg L–1), while K25 (808 µS cm–1) and dissolved oxygen concentrations (6.8 mg L–1) decreased. S. minutum, M. caribeum, Chlorogonium minimum and the picophytoplankton were dominant. Identified species and the environmental conditions values indicated the hypertrophic state of the Tezozomoc lake.
Key words: Urban lakes, phytoplankton, eutrophication, Microcystis, Chlorococcales.
INTRODUCCIÓN
La eutrofización de los ambientes acuáticos es un proceso originado por el incremento de nutrimentos, que se traduce en una alta y fluctuante densidad del fitoplancton y frecuentes cambios en su composición (Pollingher, 1986). El rápido y continuo aporte de nutrimentos hacia los cuerpos de agua de diversas regiones del mundo, ha ocasionado que muchos de ellos alcancen el estado de eutrofia extrema, denominado hipertrofia (Alvarez–Cobelas & Jacobsen, 1992) que se caracteriza por muy elevadas concentraciones de nutrimentos, así como de clorofila a, generalmente de origen fitoplanctónico. Lamentablemente, numerosos cuerpos de agua de nuestro país ya se encuentran en condiciones de hipertrofia, y diversos lagos urbanos mexicanos son ejemplos típicos de este problema (Alcocer et al., 1988; Quiroz et al., 2004; Quiroz et al., 2006). Los lagos urbanos poseen características que los hacen únicos en cuanto a condiciones y problemáticas. Sin embargo, a pesar de ser cada vez más comunes han recibido poca atención (Schueler & Simpson, 2003), han sido escasamente estudiados y la dinámica del fitoplancton hipertrófico es insuficientemente conocida (Alvarez–Cobelas & Jacobsen, 1992).
Los lagos urbanos son ambientes acuáticos muy importantes para las grandes ciudades, ya que representan lugares significativos de recreación para sus habitantes. Actualmente son los cuerpos de agua que un mayor número de personas visita, conoce y utiliza (Schueler & Simpson, 2003), se definen considerando su tamaño (superficie menor a 2.6 km2), profundidad (promedio de 6 m o menos), origen del agua (residual), tipo de cuenca de depósito y usos: recreativo, abastecimiento de agua, contenedores de lluvia o cualquier otro relacionado con actividades antropogénicas (Schueler & Simpson, 2003). Gracias a que la mayoría son de tamaño reducido, en ellos se pueden hacer estudios a escala sobre la dinámica de otros cuerpos de agua de mayor tamaño (Labounty, 1995).
Algunos aspectos de la ecología del fitoplancton en lagos urbanos han sido estudiados por Edson y Jones (1988) quienes determinaron la variación espacio temporal del fitoplancton de los lagos suburbanos de Virginia, E.U. Redfield (1991) estudió la dinámica de los nutrimentos en tres de estos ambientes. Lim (2003) investigó la variación en la calidad del agua en una cuenca urbana tropical en Singapur. En México, los estudios limnológicos sobre lagos urbanos son hasta ahora escasos. Entre los trabajos realizados se pueden citar los de Alcocer et al. (1988) que evaluaron el efecto del dragado sobre el estado trófico del Lago Viejo de Chapultepec; Alcocer y Lugo (1995) describen las condiciones ambientales del Lago Viejo de Chapultepec; Lugo et al. (1998) investigaron el efecto sobre la comunidad planctónica del programa de control del lirio acuático (Eichhornia crassipes (Martius) Solms) mediante la aplicación de herbicidas en la Presa de Guadalupe, Estado de México. En la zona metropolitana de la Ciudad de México, Tavera et al. (2000) estudiaron las Chlorococcales del Lago de Xochimilco, Distrito Federal. Martínez–Arroyo y Jáuregui (2000) analizaron la relación de los parámetros metereológicos en la zona circundante y las variables físicas, químicas y biológicas del agua de los lagos urbanos Chapultepec y Xochimilco, para evaluar el impacto de la presencia de estos cuerpos de agua sobre las condiciones ambientales de las zonas urbanas aledañas. Escobar–Briones et al. (2002) determinaron la estructura de las comunidades que se desarrollan en un estanque dentro de Ciudad Universitaria, D.F.
Para el lago urbano Tezozomoc, existen algunos trabajos previos realizados como tesis de licenciatura, tales como los de Arzate (2002) que estudió la alimentación del pez guppy (Poecilia reticulata Peters) y su relación con algunos parámetros ambientales. Botello (2002) y Solano (2002) estudiaron aspectos reproductivos de Poecilia reticulata en diferentes épocas del año y Verver y Vargas (2005) investigó la dinámica espacio temporal de los parámetros físicos y químicos, así como su relación con la clorofila a. Hasta el momento no existen para el lago urbano Tezozomoc publicaciones relacionadas con el estudio del fitoplancton. El objetivo fundamental del presente trabajo fue conocer la composición taxonómica y dinámica temporal del fitoplancton en el Lago Tezozomoc pues estos datos son básicos para entender la dinámica de los cuerpos de agua hipertróficos y deben ser considerados para el adecuado manejo y conservación de los mismos.
ÁREA DE ESTUDIO
El Lago Tezozomoc se localiza al noroeste de la Delegación Azcapotzalco, D.F. colindando al norte y noroeste con el municipio de Tlalnepantla y al oeste con el municipio de Naucalpan, entre las coordenadas 19° 29' 05" N y 99° 12' 36" O, a los 2250 m.s.n.m. con una extensión de 27 hectáreas. Posee un clima de tipo C(w0) templado subhúmedo con lluvias en verano, la temperatura media anual oscila entre los 12 y 16 °C, mientras que la temperatura más cálida se presenta en mayo entre los 18 y 19 °C y la más fría en diciembre y enero con temperaturas de entre 11 y 12 °C, precipitación del mes más seco menor de 40 mm (García, 2004). La vegetación del parque está constituida por tres estratos: herbáceo, arbustivo y arbóreo. El lago se ubica en la parte central del parque, posee una superficie de 17,000 m2 con una capacidad de 38,000 m3. La profundidad mínima es de 0.5 m y la máxima de 2.40 m (Arzate, 2002). La planta de papiro (Cyperus papyrus Linnaeus) es la única macrofita acuática que se encuentra en el lago y se ubica en la estación L1 del presente estudio (Fig. 1). El agua que abastece al parque proviene de la planta de tratamiento de aguas residuales "El Rosario", operada por la Dirección General de Operación Hidráulica (DGOH), el abastecimiento es diario a razón de 6 L s–1 (Solano, 2002). El único pez que habita en el lago es el "guppy" (Poecilia reticulata), y existe un número importante de tortugas de orejas rojas (Trachemys spp. Se encuentran diferentes especies de aves acuáticas, como el zambullidor pico pinto (Podylimbus podiceps Linnaeus), el pato de pekín o blanco (Anas platyrhynchos Linnaeus) "domesticus"), el pato golondrino (Anas acuta Linnaeus) y el pato tepalcate (Oxyura jamaicensis Gmelin), entre otros (Ramírez, 2000).
MATERIALES Y MÉTODOS
Se realizaron muestreos mensuales durante el ciclo septiembre 2003 a agosto 2004. Se designaron 6 sitios de colecta, tres en la zona litoral (L1, L2 y L3) y tres en la zona limnética del lago (E1, E2 y E3; Fig. 1); para la cuantificación del fitoplancton se tomaron muestras directas de superficie, utilizando botellas de 500 ml en cada sitio de muestreo. Dicho volumen fue suficiente ya que contenía una elevada densidad de fitoplancton. Las muestras se fijaron con acetato de lugol hasta obtener una tonalidad ámbar o café (Moreno, 2003). Como apoyo para la identificación taxonómica se hicieron arrastres horizontales con una red de fitoplancton con abertura de malla de 20 um y las muestras se fijaron con formol al 4% para obtener un concentrado. Se midieron in situ y en el nivel de superficie (20 cm de profundidad) la concentración de oxígeno disuelto (OD), conductividad específica (K25) y la temperatura, utilizando un equipo multisensor YSI 85; el pH se evaluó con un potenciómetro Oakton pH 500. En el laboratorio se midieron: fósforo reactivo disuelto (P–PO4) con el método del ácido ascórbico, nitratos (N–NO3) por reducción de cadmio, nitritos (N–NO2) por diazotización y nitrógeno amoniacal (N–NH3) por el método de Nessler, con un laboratorio portátil HACH DREL/2000 (HACH, 1993). Para la clorofila a se empleó el método de extracción en frío (4 °C) con metanol. La lectura de concentración se realizó en un espectrofotómetro HACH DREL/2000 y se usó la fórmula de Marker et al. (1980). Debido a un problema logístico, no se obtuvieron datos ambientales para el mes de septiembre.
La composición del fitoplancton se determinó con un microscopio Carl Zeiss con óptica de contraste de fases. La cuantificación se hizo con el método de Utermöhl (Wetzel & Likens, 2000), utilizando una cámara de sedimentación de 5 ml en un microscopio invertido modelo D Carl Zeiss con óptica de contraste de fases y aumentos de 204x a 806x. La identificación taxonómica y sistema de clasificación se hizo con las obras de Comas (1996), Cox (1996), Håkansson (2002), Hegewald y Silva (1988), Komárek (1999), Prescott (1982), y Popovsky y Pfiester (1990). La validez taxonómica de las especies se confirmó utilizando el Integrated Taxonomic Information System (2002).
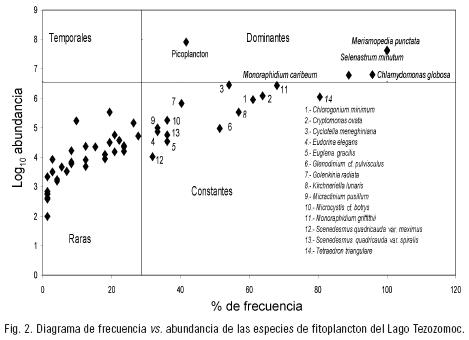
El número de céls. ml–1 se obtuvo con la fórmula indicada por APHA et al. (1985) y se contaron 400 individuos de la especie más abundante, con lo cual el intervalo de confianza para la estimación de la media fue de ± 10% (Wetzel & Likens, 2000). Para el caso de organismos coloniales como Microcystis se contaron las colonias que medían entre 30 y 90 µm de diámetro. El picofitoplancton se cuantificó con el aumento de 806x, y aunque no se determinó su identidad taxonómica, algunas observaciones con fluorescencia indicaron que se trataba de cianobacterias. Los datos de la abundancia del fitoplancton se homogenizaron transformándolos mediante la fórmula log10 (n+1). Para analizar la variación temporal del fitoplancton, se utilizó el programa Statistica versión 6.0 con el que se hizo el análisis de agrupamientos. Se elaboró una gráfica bivariada de frecuencia vs abundancia, con la que se determinaron las especies dominantes (alta frecuencia y alta abundancia), temporales (baja frecuencia y alta abundancia), constantes (alta frecuencia y baja abundancia) y raras (baja frecuencia y abundancia) durante el periodo de estudio (García de León, 1988).
RESULTADOS
Riqueza específica. Se determinaron 50 especies distribuidas en 26 géneros. En la clase Chlorophyceae se ubicaron 39 especies, 5 en Cyanobacteria, 3 Euglenophyceae y una en Dinophyceae, Cryptophyceae y Bacillarophyceae, respectivamente. En la tabla 1 se presenta la lista sistemática de las especies con sus autoridades. El diagrama de frecuencia vs. abundancia (Fig. 2) mostró que Merismopedia punctata, Chlamydomonas globosa, Selenastrum minutum Monoraphidium caribeum y el picofitoplancton fueron dominantes; 13 especies se determinaron como constantes, de las cuales Cyclotella meneghiniana, Cryptomonas ovata, Chlorogonium minimum, Kirchneriella lunaris, Monoraphidium griffithii, Microcystis cf. botrys y Tetraedron triangulare presentaron densidades importantes. Treinta y tres especies fueron raras (Tabla 1).
Variación temporal del fitoplancton. Entre las especies dominantes, la cianobacteria colonial de tamaño pequeño Merismopedia punctata presentó las densidades más constantes y elevadas (alrededor de 3 x 106 céls. ml–1) en el lago (Fig. 3a), y sus mayores picos de densidad promedio (hasta 6 x 106 céls. ml–1) se presentaron en noviembre y abril. Las máximas densidades de la volvocal flagelada C. globosa (1.5 x 106 céls. ml–1) se observaron en octubre y en enero y a partir de marzo su densidad disminuyó considerablemente hasta casi desaparecer al final del estudio (Fig. 3b). La clorococal S. minutum estuvo presente con densidades bajas entre septiembre y marzo, pero a partir de abril sus densidades se incrementaron y alcanzó el promedio máximo (8.5 x 106 céls. ml–1) en agosto (Fig. 3c). M. caribeum, también clorococal, tuvo abundancias máximas (1.5 x 106 céls. ml–1) entre marzo y julio, siendo considerablemente menos abundante el resto del tiempo (Fig. 3d). El picofitoplancton, integrado por cianobacterias, apareció con un pico de gran abundancia (40 x 106 céls. ml–1) en el mes de abril y posteriormente permaneció con densidades menores hasta el final del estudio (Fig. 3e).
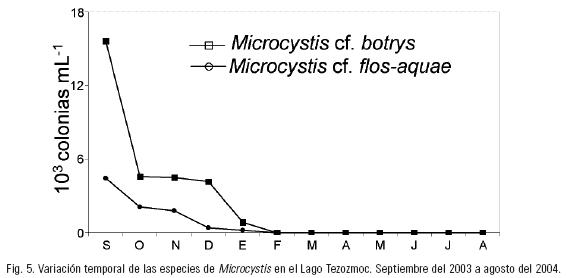
De las especies que resultaron constantes, las que presentaron las densidades más elevadas fueron la clorococal M. griffithii, que abundó en diciembre y enero (densidad promedio de 1 x 106 céls. ml–1) mientras que el resto del tiempo sus densidades fueron bajas (Fig. 4a), y la diatomea C. meneghiniana, con picos de abundancia (1.5 x 106) en noviembre y diciembre (Fig. 4b). La volvocal C. minimum, y las clorococales K. lunaris y T. triangulare aportaron abundancias importantes, pero menores que las especies anteriormente citadas, en los meses de abril y junio, mayo, y julio y diciembre, respectivamente (Figs. 4c, d y e). Cryptomonas ovata, una criptofita flagelada, fue abundante (hasta 35,000 céls. ml–1) de septiembre de 2003 a marzo de 2004, después se mantuvo con densidades muy bajas (Fig. 4f). Desde septiembre hasta diciembre de 2003 se observaron densidades elevadas de colonias de Microcystis cf. botrys y M. cf. flos–aquae, cianobacterias coloniales que forman natas muy conspicuas en los cuerpos de agua, pero después del mes de febrero de 2004, estas especies desaparecieron del lago (Fig. 5). El análisis de cluster mostró la similitud entre los meses de muestreo tomando en consideración sólo las densidades de las especies más abundantes. Se definieron dos épocas: una fría y seca, de septiembre del 2003 a marzo del 2004 y otra cálida y lluviosa de abril del 2004 a agosto del mismo año. El valor de 1–r entre los dos grupos fue de 0.045, lo que denota una elevada similitud entre las dos épocas del sistema (Fig. 6a). Las especies que definen a la primera época, considerada como de final de lluvias y de toda la temporada de frío y secas fueron: C. globosa, C. meneghiniana, M. griffithii y C. ovata, además de las especies de Microcystis. En cambio, la época cálida y lluviosa estuvo marcada por el dominio de S. minutum, M. caribeum, C. minimum y el picofitoplancton. M. punctata y T. triangulare estuvieron presentes en ambas épocas con densidades elevadas.
Variables físicas y químicas. El análisis de agrupamientos realizado con los datos de las variables ambientales mostró la presencia de dos épocas en el lago: la primera, de octubre del 2003 a abril de 2004, y la segunda de mayo a agosto del 2004, siendo el mes de julio el que mayor diferencia presentó, aunque se unió al segundo grupo (Fig. 6b). El primer grupo corresponde al final de la época de lluvias y a la época seca y fría del año, mientras que el segundo incluye los meses cálidos y lluviosos. En la primera se presentaron los valores más bajos de temperatura (promedio de 17.6 °C) , alcanzando el valor mínimo (14.5 °C, Fig. 7) en enero; también en esta etapa se midieron los valores promedio más elevados de la conductividad específica (K25) (985 µS cm–1) y de concentración de oxígeno disuelto (10.1 mg L–1); en cambio, las concentraciones promedio de P–PO4 (2.21 mg L–1), clorofila a (200 µg L–1) y N–NO3 (0.4 mg L–1) fueron menores que en los meses siguientes. De mayo a agosto la temperatura promedio fue mayor (21 °C), la conductividad fue menor (808 µS cm–1) y las concentraciones promedio de N–NO3 (3.1 mg L–1), clorofila a (295 µg L–1) y P–PO4 (3.31 mg L–1) aumentaron, mientras que las de oxígeno disuelto disminuyeron (6.8 mg L–1). La concentración de N–NH3 fue también mayor en la segunda época (1.83 vs. 1.10 mg L–1). Las concentraciones promedio de N–NO2 mantuvieron valores similares a lo largo de las dos épocas (Tabla 2).

DISCUSIÓN
Riqueza específica. Los grupos taxonómicos dominantes en los lagos hipertróficos son las Cyanobacteria (Chroococcales, Oscillatoriales y Nostocales), las Chlorophyceae (Chlorococcales y Volvocales), las Cryptophyceae (Cryptomonas y Rhodomonas) y las Euglenophyceae (Euglena, Phacus y Trachelomonas). Las diatomeas generalmente alcanzan biomasas mucho menores que los grupos precedentes y principalmente se observan especies céntricas como Cyclotella meneghiniana, Stephanodiscus hantzschii y Aulacoseira sp. entre otras. En general, se considera que la diversidad de los lagos hipertróficos es menor comparada con la de sistemas no hipertróficos (Álvarez–Cobelas & Jacobsen, 1992). Los grupos taxonómicos encontrados en el Lago Tezozomoc, fueron similares a lo citado anteriormente. La riqueza específica del fitoplancton (50 especies), coincidió con la de otros cuerpos de agua urbanos y eutróficos como los lagos Arancio y Rosamaría en Italia, donde se registraron 56 y 46 especies, respectivamente (Naselli–Flores & Barone, 2000). Esta misma tendencia se presentó en el Lago Pampulha, Brasil, donde Figueredo y Giani (2001) identificaron 46 especies. Naz y Türkmen (2005) registraron 41 especies para el Lago Gölbasi en Turquía. Al comparar los datos citados por Rojo et al. (1999) y Ortega–Mayagoitia y Rojo (2000a, 2000b) para el humedal de Las Tablas de Daimiel (LTD), España, un sistema de islas y cuerpos de agua hipertróficos y someros, con los del presente estudio, el número de especies de los grupos taxonómicos dominantes del Lago Tezozomoc fue menos diverso: Chlorophyta (39 especies vs. 37 en LTD), Cyanobacteria (5 especies vs. 12 en LTD), Euglenophyta (3 especies vs. 18 en LTD), Bacillariophyceae (1 especie vs 9 en LTD), Dinophyceae (1 especie vs. 4 en LTD) y Cryptophyceae (1 especie vs. 8 en LTD). En el Lago Tezozomoc las Chlorococcales fueron el grupo más diverso, como ocurre en muchos sistemas hipertróficos (Alvarez–Cobelas & Jacobsen, 1992). De las 39 especies de Chlorophyta, 34 fueron Chlorococcales, mientras que las Volvocales tuvieron 5 representantes. Ortega–Mayagoitia y Rojo (2000b) citan 24 taxa para Chlorococcales y 7 Volvocales para Daimiel.
Dominancia de especies. Las especies dominantes presentes en este estudio han sido registradas en numerosos cuerpos de agua de condiciones eutróficas e hipertróficas. C. globosa es mencionada por Temponeras et al. (2000) para el lago eutrófico Doïrani en Grecia. M. punctata y C. meneghiniana han sido citadas por Zafar (1986) en lagos desde oligotróficos hasta hipertróficos. Álvarez–Cobelas y Jacobsen (1992) mencionan también que esta última especie aparece en diversos estados tróficos, incluso en sistemas hipertróficos. En México Komárek y Komárková–Legnerová (2002a), registraron a M. punctata en el Lago Cuitzeo, Michoacán. C. ovata fue encontrada por Richerson et al. (1986) y Kozak (2005) en lagos eutróficos. M. griffithii y K. lunaris son citadas por Temponeras et al. (2000) como dominantes en el Lago Doïrani, Grecia. Comas (1996) menciona que M. griffithii y M. caribeum son especies comunes en los lagos eutróficos de Cuba, y en México M. griffithii es citada por Tavera et al. (2000) en los canales de Xochimilco, en condiciones eutróficas.
De las especies constantes y raras encontradas en el Lago Tezozomoc, Coelastrum pseudomicroporum, Micractinium pusillum, Pandorina morum, Pediastrum boryanum y Schroederia setigera son mencionadas por Kalff y Watson (1986), Ortega–Mayagoitia y Rojo (2000a) y Temponeras et al. (2000), para cuerpos de agua con niveles de eutróficos a hipertróficos similares a los del presentes estudio. En México, especies como Golenkinia radiata, M. pusillum y P. boryanumson citadas para los canales de Xochimilco, considerados como eutróficos (Tavera et al., 2000). Microcystis flos–aquae ha sido registrada por Komárek (1991), para el Lago Yogo, Japón. Sant' Anna y Acevedo (2000), Komárek y Komárková–Legnerová (2002b), Sant' Anna et al. (2004) citan a M. botrys como una especie formadora de florecimientos en lagos eutróficos del estado de Sao Paulo, Brasil. La riqueza específica y el tipo de especies encontradas en el Lago Tezozomoc son indicadoras de su condición hipertrófica.
Variación temporal del fitoplancton. A pesar de que la biomasa algal y la composición específica sean claras indicadoras de cuerpos de agua hipertróficos someros, no se han establecido patrones claros de sucesión en estos lagos, como los que se han encontrado en lagos profundos (Munawar & Munawar, 1986; Álvarez–Cobelas & Jacobsen, 1992; Rojo et al., 2000). Con la información de diferentes regiones del mundo se han sugerido cuatro tipos de sucesión estacional para ambientes hipertróficos someros: I) con dominancia de las cianobacterias durante todo el año; II) con períodos cortos en los que dominan las diatomeas (otoño–invierno y principios de primavera), con la dominancia de cianobacterias el resto del año y en algunos casos, con picos cortos de clorococales; III) donde las cianobacterias dominan al final de la primavera y el verano, dominando las clorococales mezcladas con diatomeas y criptoficeas el resto del año; IV) dominancia de poblaciones de flagelados como las volvocales y criptofíceas además de las clorococales (Álvarez–Cobelas & Jacobsen, 1992). La sucesión temporal del fitoplancton observada en el Lago Tezozomoc no coincide estrictamente con ninguno de los tipos señalados, aunque tuvo mayor parecido con el tipo II. Inició con un predominio de cianobacterias (Merismopedia, Microcystis) y flagelados como Chlorogonium y Cryptomonas en el mes de septiembre. El dominio de las cianobacterias continuó hasta el mes de enero junto con la presencia importante de las clorococales, y en el mes de diciembre de Cyclotella meneghiniana (diatomea). En el mes de febrero se presentó un pulso de Cryptomonas ovata con una disminución de casi todas las demás especies. En marzo, Merismopedia y Tetraedron dominaron. A partir de abril se incrementaron las densidades de la mayoría de la especies de fitoplancton y los grupos dominantes pasaron a ser las clorococales, volvocales y las cianobacterias de dimensiones pequeñas que integran el picofitoplancton, condición que se mantuvo hasta el final del estudio (agosto). Según los escasos estudios existentes en cuerpos de agua someros el picofitoplancton suele ser más abundante en la época de verano, lo cual coincide parcialmente con lo observado. La densidad más elevada se encontró al final de la primavera, al igual que se ha observado en algunos otros lagos (Szelag–Wasielewska, 1999).
Según los mismos autores, las concentraciones de N–NH4+ y de materia orgánica disuelta son los factores que determinan la sucesión. El tipo II de sucesión se presenta en cuerpos de agua con concentraciones promedio de N–NH4+ inferiores a 1 mg L–1; en el Lago de Tezozomoc las concentraciones promedio fueron superiores a este valor, lo que podría explicar las diferencias observadas. El predominio de las cianobacterias como Microcystis y de flagelados como Chlamydomonas, Cryptomonas y Chlorogonium se asoció principalmente con las temperaturas menores y con valores promedio más bajos de los nutrimentos (fósforo reactivo y nitrógeno en forma de nitratos y de amoniaco). En cambio, al incrementarse la temperatura y también las concentraciones de nutrimentos, Microcystis y los flagelados disminuyeron fuertemente sus densidades. Lo anterior sería una indicación de que estos grupos proliferan cuando la concentración de nutrimentos es elevada, pero sin llegar a los valores más altos. También el efecto de la temperatura es notable, pues además del cambio en el tipo de especies dominantes, se produce un aumento evidente en la concentración de clorofila a, señalando que las densidades de fitoplancton se incrementan. Se concluye que a pesar de las condiciones hipertróficas permanentes en el Lago Tezozomoc, se presenta una sustitución temporal de especies fitoplanctónicas y la variación de la concentración de clorofila a. Estos cambios parecen estar fuertemente influidos por la marcha anual de la temperatura y las variaciones asociadas en las concentraciones de nutrimentos. Naselli–Flores (2000) menciona que la variación del fitoplancton responde a las fluctuaciones de la temperatura y a la variable asociada que es la cantidad de radiación solar. Esteves (1988), con base en datos generados en Brasil, afirma que el fitoplancton de las regiones tropicales muestra una variación temporal menos contrastante que la observada en lagos templados, y que en los lagos tropicales someros la mezcla frecuente de la columna de agua y la turbulencia generada dificultan el reconocimiento de los factores ambientales de mayor influencia sobre la variación temporal del fitoplancton. Pero se reconocen la disponibilidad de nutrimentos, la radiación solar disponible y la precipitación como los más importantes.
Con relación a la temperatura, una característica de los lagos someros es que la columna de agua se mezcla frecuentemente por la acción del viento. Los lagos someros son típicamente polimícticos, debido a que la acción del viento provoca la mezcla de la columna de agua, alterando su estabilidad e impidiendo la limitación de nutrimentos, lo cual favorece el crecimiento de especies algales con bajas tasas de sedimentación y altas tasas de crecimiento como son las de dimensiones pequeñas (Scheffer, 1998). Verver y Vargas (2005) menciona que el Lago Tezozomoc presenta pequeñas variaciones de temperatura y periodos repetidos de circulación entre lapsos cortos de calentamiento y estratificación térmica débil, lo que lo convierte en polimíctico, (Fig. 7). Especies de los géneros Monoraphidium y Microcystis, al igual que el picofitoplancton, se consideran indicadores de la presencia de capas de agua mezcladas y poco profundas (Reynolds et al., 2002). Otro numeroso grupo de géneros de fitoplancton presentes en el Lago Tezozomoc son indicadores de condiciones de baja profundidad de la columna de agua y de elevadas concentraciones de nutrimentos. Entre los más importantes se pueden mencionar a Monoraphidium, Pandorina, Eudorina, Coelastrum, Golenkinia, Pediastrum, Scenedesmus y Cryptomonas (Reynolds et al., 2002).
Como ya se ha mencionado, dentro de los componentes importantes del fitoplancton del lago, se encontraron dos especies de cianobacterias del género Microcystis: M. cf. botrys y M. cf. flos–aquae; ambas especies referidas como potencialmente tóxicas (Komárek & Komárková–Legnerová, 2002b; Sant' Anna et al., 2004), por lo que sería necesario realizar estudios relacionados con su ecología y fisiología en condiciones naturales y de cultivo para definir adecuadamente su identidad taxonómica. Paerl (1988) y Pizzolon (1996) consideran que densidades de cianobacterias superiores a 1 x 104 cels. ml–1 ya pueden ser interpretadas como un florecimiento. Las especies de Microcystis en el Lago Tezozomoc superaron estos valores durante el lapso de septiembre a diciembre de 2003, indicando la existencia de un florecimiento durante ese lapso. La presencia de grandes densidades de esas especies puede llegar a significar un riesgo de toxicidad para los organismos que habitan en el lago, así como para las personas que entran en contacto con el agua.
De acuerdo con los criterios de la OECD (1982) los lagos hipertróficos son aquellos con concentraciones de clorofila a iguales o mayores a 100 ug L–1. Alvarez–Cobelas y Jacobsen (1992) retoman este criterio y señalan que el valor promedio de clorofila a en la hipertrofia debe ser mayor a 100 µg L–1. El Lago Tezozomoc sobrepasó ampliamente este valor durante todo el lapso estudiado, aunque mostró fluctuaciones notables. Sin embargo, la clorofila a, al igual que otras características ya señaladas, confirman claramente su condición de hipertrofia. Es de resaltar que el valor máximo medido de concentración de clorofila a en el Lago Tezozomoc (1320 µg L–1) resultó más elevado que los máximos de otros lagos hipertróficos de Eurasia (1000 µg L–1) y apenas menor que el medido en un estanque de oxidación de alta tasa (1470 µg L–1) en Barcelona, España (Alvarez–Cobelas & Jacobsen, 1992). La fluctuación de las concentraciones de clorofila en el Lago Tezozomoc fue muy amplia (108 – 1320 µg L–1), comportamiento que es típico de los lagos hipertróficos (Barica, 1980).
En conclusión, la composición taxonómica del fitoplancton del Lago Tezozomoc resultó similar a la de otros lagos hipertróficos. Sin embargo, el patrón de variación temporal de las especies no coincidió exactamente con alguno de los observados en otros ambientes similares, aunque mostró los típicos pulsos de especies que se presentan en lagos hipertróficos. Como se ha observado en otros ambientes tropicales someros, la temperatura y la radiación solar, así como la fluctuación de las concentraciones de nutrimentos, parecieron ser las causas más importantes para el cambio de la dominancia en las especies de fitoplancton. Todos estos factores indican que el fitoplancton del Lago Tezozomoc comparte numerosas características con otros ambientes hipertróficos, pero también presenta condiciones particulares, probablemente asociadas a su ubicación geográfica y a las condiciones climáticas locales.
AGRADECIMIENTOS
El presente estudio contó con el financiamiento del programa PAPIIT extraordinario 2004 de la DGAPA de la UNAM (Clave: IX239604) y también fue parcialmente apoyado por el Programa PAPCA 2006–2007 de la FES Iztacala, UNAM. Agradecemos a Jaqueline Verver y Vargas y a Hyrais Castro por su apoyo en los muestreos. Reconocemos a las autoridades de la Delegación Azcapotzalco y a los responsables del Parque Tezozomoc por su apoyo logístico y el permiso para trabajar en el lago. Los comentarios y sugerencias de M. del Rosario Ortega Murillo y J. L. Gómez Márquez, así como los de un evaluador anónimo, mejoraron sustancialmente el manuscrito.
REFERENCIAS
Alcocer, D. J., E. Kato, E. Robles & G. Vilaclara. 1988. Estudio preliminar del efecto del dragado sobre el estado trófico del Lago Viejo de Chapultepec. Contaminación Ambiental 4 43–56. [ Links ]
Alcocer, D. J. & A. Lugo.1995. The urban lakes of Mexico City (Lago Viejo de Chapultepec). Lakeline 15 (2): 14–31. [ Links ]
Álvarez–Cobelas, M. & B. A. Jacobsen. 1992. Hypertrophic phytoplankton: an overview. Freshwater Forum 2: 184–199. [ Links ]
A.P.H.A., A.W.W.A. & W.P.C.F. American Public Health Association, American Water Workers Association, Water Pollution Control Federation. 1985. Standard methods for the Examination of Water and Wastewater. 16ª. Ed., Washington, D.C. USA. 1268 p. [ Links ]
Arzate, G. 2002. Contribución al estudio de la alimentación de Poecilla reticulata y su relación con algunos parámetros ambientales en el lago del Parque Tezozomoc, Atzcapotzalco Tesis de Licenciatura (Biología), Facultad de Estudios Superiores Iztacala, UNAM, México. 41 p. [ Links ]
Barica, J. 1980. Why hypertrophic ecosystems? In: Barica, J. & Mur, L. R. (Eds). Hypertrophic Ecosystems. Developments in Hidrobiology 2. Dr. W. W. Junk Publishers. La Haya. pp. IX–XI. [ Links ]
Botello, A. C. 2002. Estudio de algunos aspectos reproductivos de Poecilla reticulata (Pisces: Poecillidae) del lago del Parque Tezozomoc de julio a diciembre del 2002. Tesis de Licenciatura (Biología). Facultad de Estudios Superiores Iztacala, UNAM, México. 83 p. [ Links ]
Comas, G. A. 1996. Las Chlorococcales dulceacuícolas de Cuba. Biblioteca Phicologica. J. Crammer. Berlin. 192 p. [ Links ]
Cox, E. J. 1996. Identification of freshwater diatoms from live material. Chapman & Hall, London. 158 p. [ Links ]
Edson, J. J. & R. C. Jones. 1988. Spatial, temporal and store runoff–related variations in phytoplankton community structure in a small, suburban reservoir. Hydrobiologia 169: 353–362. [ Links ]
Escobar–Briones, E., A. M. Cortés–Aguilar, M. García Ramos, L. M. García–Ortíz & A. Y. Simas–Del Castillo. 2002. Structure of a pond community in Central Mexico. Hydrobiologia 467: 133–139. [ Links ]
Esteves, F. De A. 1988. Fundamentos de Limnología. Interciencia–FINEP, Rio de Janeiro. 575 p. [ Links ]
Figueredo, C. & A. Giani. 2001. Seasonal variation in the diversity and species richness of phytoplankton in a tropical eutrophic reservoir. Hydrobiologia 445: 165–174. [ Links ]
García De León, A. 1988. Generalidades del Análisis de Cúmulos y del Análisis de Componentes Principales. Divulgación Geográfica. Instituto de Geografía, UNAM, México. 29 p. [ Links ]
García, E. 2004. Modificaciones al Sistema de Clasificación Climática de Köppen. Serie Libros No. 6. 5ª Ed. Instituto de Geografía, UNAM, México. 90 p. [ Links ]
Hach, Company. 1993. Drel, 2000 Advanced Water Quality Laboratory. Procedures manual USA. Hach Co.166 p. [ Links ]
Håkansson, H. 2002. A compilation and evaluation of species in the general Stephanodiscus, Cyclostephanos and Cyclotella with a new genus in the family Stephanodiscaceae. Diatom Research 17 (1): 1–139. [ Links ]
Hegewald, E. & P. C Silva. 1988. Annotated Catalogue of Scenedesmus and Nomenclaturally Reeled Genera, including original descriptions and figures. Gebruder Borntraeger, Berlin. 586 p. [ Links ]
Integrated Taxonomic Information System. 2002. Página electrónica, www.itis.usda.gov. [ Links ]
Kalff, J. & S. Watson. 1986. Phytoplankton and its dynamics in two tropical lakes: a tropical and temperate zone comparison. Hydrobiologia 138: 161–176. [ Links ]
Komárek, J. 1991. A review of water–bloom forming Microcystis species with regard to populations from Japan. Algological Studies 64: 115–127. [ Links ]
Komárek, J. 1999. Cyanoprokaryota 1. Teil: Chroococcales. Gustav Fischer, Alemania. 548 p. [ Links ]
Komárek, J. & J. Komárková–Legnerová. 2002a. Contribution to the knowledge of planktic Cyanoprokaryotes from central Mexico. Preslia 74: 207–233. [ Links ]
Komárek, J. & J. Komárková. 2002b. Review of the European Microcystis–morphospecies (Cyanoprocaryotes) from nature. Czech Phycology, Olomouc 2: 1–24. [ Links ]
Kozak, A. 2005. Seasonal changes occurring over four years in a reservoir's phytoplankton composition. Polish Journal of Environmental Studies 14 (4): 451–465. [ Links ]
Labounty, J. 1995. What's an urban lake worth? Lakeline 15: 6–7. [ Links ]
Lim, S. H. 2003. Variations in the water quality of a small urban tropical catchment: implications for load estimation and water quality monitoring. Hydrobiologia 494: 57–63. [ Links ]
Lugo, A., L. A. Bravo–Inclán, J. Alcocer, M. L. Gaytán, M. G. Oliva, M. R. Sánchez, M. Chávez & G. Vilaclara. 1998. Effect on the planktonic community of the chemical program used to control water hyacinth (Eichhornia crassipes) in Guadalupe Dam, Mexico. Aquatic Ecosystem Health and Management 1: 333–343. [ Links ]
Martínez–Arroyo, A. & E. Jáuregui. 2000. On the environmental role of urban lakes in Mexico City. Urban Ecosystems 4: 145–166. [ Links ]
Marker, A. F. H., C. A. Crowther, & R. J. M. Grunn. 1980. Methanol and acetone as solvents for estimating chlorophyll a and phaeopigments by spectrophotometry. Archiv für Hydrobiologie Beiheft (Ergebnisse der Limnologie) 14: 52–69. [ Links ]
Moreno, J. L. 2003. Fitoplancton. In: De la Lanza, E.G. & P. Hernández (Eds.). Manual para la colecta, el manejo y las observaciones de campo para bioindicadores de la calidad del agua. AGT Editor. pp. 43–107. [ Links ]
Munawar, M. & I. F. Munawar. 1986. The seasonality of phytoplankton in the North American Great Lakes, a comparative synthesis. Hydrobiologia 138: 85–115. [ Links ]
Naselli–Flores, L. 2000. Phytoplankton assemblages in twenty–one Sicilian reservoirs: relationships between species composition and environmental factors. Hydrobiologia 424: 1–11. [ Links ]
Naselli–Flores, L. & R. Barone. 2000. Phytoplankton dynamics and structure: a comparative analysis in natural and man–made water bodies of different trophic state. Hydrobiologia 438: 65–74. [ Links ]
Naz, M. & B. M. Türkmen. 2005. Phytoplankton biomass and species composition of Lake Gölbasi (Hatay–Turkey). Turkish Journal of Biology 29: 49–56. [ Links ]
OECD, 1982. Eutrophication of Waters. Monitoring, Assesment and Control. OECD, Paris. 164 p. [ Links ]
Ortega–Mayagoitia, E. & C. Rojo (2000a). Fitoplancton del parque Nacional Las Tablas de Daimiel. III. Diatomeas y Clorofitas. Anales Jardín Botánico de Madrid 58 (1): 17–37. [ Links ]
Ortega–Mayagoitia, E. & C. Rojo (2000b). Fitoplancton del parque Nacional Las Tablas de Daimiel. II. Las Cianofíceas, Los Dinoflagelados, Las Criptofíceas, las Crisofíceas y las Xantofíceas. Anales Jardín Botánico de Madrid 57 (2): 251–266. [ Links ]
Paerl, H. W. 1988. Nuisanse phytoplankton blooms in coastal, estuarine and inland waters. Limnology and Oceanography 33 (4): 823–847. [ Links ]
Pizzolon, L. 1996. Importancia de las cianobacterias como factor de toxicidad en las aguas continentales. Interciencia 21 (6): 239–245. [ Links ]
Pollingher, U., 1986. Phytoplankton periodicity in a subtropical lake (Lake Kinneret, Israel). Hydrobiologia 138: 127–138. [ Links ]
Popovsky, J. & A. L. Pfiester. 1990. Dinophyceae (Dinoflagellida). Gustav Fischer Verlag Jena Sttugart, Alemania. 270 p. [ Links ]
Prescott, G. W. 1982. Algae of the Western Great Lakes Area. Otto Koeltz Science Publishers, Alemania. 977 p. [ Links ]
Quiroz, C. H., L. M. Z. Mora, I. M. Astudillo, J. R. García. 2004. Variación de los organismos fitoplanctónicos y la calidad del agua en el lago de Chapala, Jalisco, México. Acta Universitaria 14 (1): 47–58. [ Links ]
Quiroz, C. H., O. P. Solis, J. R. García, I. F. A. Molina & M. V. Díaz. 2006. Variación de componentes fitoplanctónicos en un bordo temporal utilizado para acuicultura extensiva en Norte del Estado de Guerrero, México. Revista Electrónica de Veterinaria REDVET 7 (11): 1–25. http://www.veterinaria.org/revistas/redvet. [ Links ]
Ramírez, B. P. 2000. Aves de humedales en zonas urbanas del noroeste de la Ciudad de México. Tesis de Maestría (Biología), Facultad de Ciencias. UNAM, México. 188 p. [ Links ]
Redfield, G. W. 1991. Phosphorus, chlorophyll and the comparative limnology of three su burban lakes in Northern Virginia, U.S.A. Verhandlungen Internationale Vereinigung Limnologie 24: 1294–1299. [ Links ]
Reynolds, C. S., V. Huszar, C. Kurk, L Naselli–Flores & S. Melo. 2002. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research 24: 417–428. [ Links ]
Richerson, P. J., P. J. Neale, W. Wurtsbaugh, R. T. Alfaro & W. Vinccent, 1986. Patterns of temporal variation in Lake Titicaca. A high altitude tropical lake. I. Background, physical and chemical processes, and primary production. Hydrobiologia 138: 205–220. [ Links ]
Rojo, C., E. Ortega–Mayagoitia & V. Conforti. 1999. Fitoplancton del Parque Nacional de las Tablas de Daimiel. I. Las Euglenofitas. Anales del Jardín Botánico de Madrid 57(1):15–23. [ Links ]
Rojo, C., E. Ortega–Mayagoitia & M. Álvarez–Cobelas. 2000. Lack of pattern among phytoplankton assemblages. Or, what does the exception to the rule mean? Hydrobiologia 424: 133–139. [ Links ]
Sant' Anna, C. L. & M. T. P. Acevedo. 2000. Contribution to the knowledge of potenciallity toxic Cyanobacteria from Brazil. Nova Edwigia 71 (3–4): 359–38. [ Links ]
Sant' Anna, C. L., M. T. P. Acevedo, P. A. C. Senna, J. Komárek & J. Komárková. 2004. Planktic Cyanobacteria from São Paulo State, Brazil: Chroococcales. Revista Brasileira de Botânica 27 (2): 1–19. [ Links ]
Schueler, T. & J. Simpson. 2003. Why urban Lakes are different. Watershed Protection Techniques 1 (2): 747–750. [ Links ]
Solano, B. N. 2002. Aspectos reproductivos de Poecilla reticulata Pisces:Poecillidae) en el lago del Parque Tezozomoc, Atzcapotzalco de enero a junio del 2001. Tesis de Licenciatura (Biología), FES Iztacala, UNAM, México. 41 p. [ Links ]
Scheffer, M. 1998. Ecology of Shallow Lakes. Chapman & Hall. London. 357 p. [ Links ]
Szelag–Wasielewska, E. 1999. Autotrophic picoplankton dynamics in a small shallow lake. Hydrobiologia 408/409: 301–306. [ Links ]
Tavera, R., E. Novelo & A. Comas. 2000. Chlorococcalean algae (s.l.) from the ecological Park of Xochimilco, Mexico. Algological Studies 100: 65–94. [ Links ]
Temponeras, M., J. Kristiansen & M. Moustaka–Gouni. 2000. Seasonal variation in phytoplankton composition and physical–chemical features of the shallow Lake Doïrani, Macedonia, Greece. Hydrobiologia 424: 109–122. [ Links ]
Verver y Vargas, G. J. 2005. Dinámica espacio–temporal de los parámetros físicos y químicos y su relación con la clorofila a en un lago urbano eutrófico. Tesis de Licenciatura (Biología), FES Iztacala. UNAM, México. 55 p. [ Links ]
Wetzel, R. G. & G. R Likens. 2000. Limnological Analyses. Springer–Verlag, Nueva York. 429 p. [ Links ]
Zafar, A. R. 1986. Seasonality of phytoplankton in some South Indian lakes. Hydrobiologia 138: 177–187. [ Links ]














