Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.18 no.3 Ciudad de México Dez. 2008
Artículos
Abundancia y distribución de juveniles de Farfantepenaeus aztecus (Ives 1891), F. duorarum (Burkenroad 1939) y Litopenaeus setiferus (Linnaeus 1767) en la Laguna Madre, Tamaulipas, México
Juveniles abundance and distribution of Farfantepenaeus aztecus (Ives 1891), F. duorarum (Burkenroad 1939) and Litopenaeus setiferus (Linnaeus 1767) in Laguna Madre, Tamaulipas, Mexico
Alberto Ocaña–Luna, Gabriela Hernández–Batún y Marina Sánchez–Ramírez
Departamento de Zoología, Escuela Nacional de Ciencias Biológicas, I.P.N. Prol. de Carpió y Plan de Ayala s/n, Col. Plutarco Elias Calles (Casco de Santo Tomás). México, D. F., 11340 México. E –mail: jocana@encb.ipn.mx
Recibido: 30 de enero de 2007
Aceptado: 22 de mayo de 2008
RESUMEN
Se analizó la distribución y abundancia de los juveniles de camarones peneidos en Laguna Madre, en base a las recolectas realizadas en los meses de octubre (1997) y enero, mayo, julio (1998), con una red cónica de 50 cm de diámetro y 505 de apertura de malla, con un flujómetro adaptado a la misma. Además se tomaron datos de salinidad y temperatura superficial. Se realizó un análisis de varianza (ANOVA) y una prueba de rangos múltiples (SNK) para comparar las tallas entre las especies. La especie más abundante fue Farfantepenaeus aztecus con el 84.5% de la abundancia total, seguida por Litopenaeus setiferus con el 10.6% y Farfantepenaeus duorarum con el 3.4%, en el invierno la abundancia de F. aztecus y L. setiferus fue mayor. Se observaron diferencias significativas entre las tallas de juveniles de F. aztecus (11.7 mm) y L. setiferus (11.8 mm) con respecto a la talla de F. duorarum (11.0 mm) (F = 7.81, p = 0.05; SNK = 0.71, p = 0.05; SNK = –0.83, p = 0.05).
Palabras clave: Camarones juveniles, Penaeidae, laguna costera, Golfo de México.
ABSTRACT
The Penaeid shrimp planktonic juvenile distribution and abundance from Laguna Madre were analyzed, based in samples collected in the months of October 1997, January, May and July 1998 with a conical net of 50 cm diameter and 505 mesh size, with an adapted flowmeter; moreover water salinity and superficial temperture data were recorded. The size among species was compared with a variance analysis (ANOVA) and a multiple ranks test (SNK). Farfantepenaeus aztecus was the most abundant species with 84.5% of the total abundance, following by L. setiferus with 10.6% and F. duorarum with 3.4%. The abundance of F. aztecus and L. setiferus was greatest during the winter. Significant differences were observed between the sizes of juveniles of F. aztecus (11.7 mm) and L. setiferus (11.8 mm) with respect to the size of F. duorarum (11.0 mm) (F = 7.81, p = 0.05; SNK = 0.71, p = 0.05; SNK = –0.83, p = 0.05).
Key words: Shrimp juvenile, Penaeidae, coastal lagoon, Gulf of Mexico.
INTRODUCCIÓN
En el litoral del Golfo de México y Mar Caribe Mexicano, el camarón es la tercera pesquería en cuanto a volumen de captura total, después de la mojarra y el ostión; su captura comprende el 27% del total nacional y se realiza en tres zonas de importancia: al norte del Golfo de México (Tamaulipas y Veracruz); en la Sonda de Campeche (Tabasco y Campeche) y en el Mar Caribe Mexicano (Quintana Roo) (Wakida–Kusunoki et al. 2006).
Las especies de camarones peneidos que se encuentran distribuidas en estas regiones son: camarón café (Farfantepenaeus aztecus (Ives, 1891)); camarón rosado (Farfantepenaeus duorarum (Burkenroad 1939)); camarón blanco (Litopenaeus setiferus (Linnaeus 1767)); camarón rojo (Farfantepenaeus brasiliensis (Latreille 1817)); camarón roca (Sicyonia brevirostris Stimpson, 1871); camarón siete barbas (Xiphopenaeus kroyeri (Heller 1862)) (Pérez–Farfante & Kensley 1997; Navarrete del Proo & Gracia 1996; Wakida–Kusunoki et al. 2006) y camarón rosado sin manchas (Farfantepenaeus notialis (Pérez–Farfante 1967) (Pérez–Castañeda & Defeo 2000), de las cuales sólo las tres primeras tienen la mayor importancia económica en la zona.
De las lagunas costeras de México la Laguna Madre es la segunda más grande en superficie y es uno de los seis ecosistemas hipersalinos en el mundo junto con Laguna Madre de Texas en EUA; Laguna Ojo de Liebre en la costa del Pacífico en Baja California, México; Laguna de Sivash, adyacente al Mar de Azov sobre la Península de Crimea, Ucrania; Golfo Spencer, al sur de Australia y Bahía Shark al oeste de Australia (Tunnell 2002).
En el año 2005 la Laguna Madre, Tamaulipas fue declarada como área natural protegida, por ser un ecosistema hipersalino con una gran riqueza de humedales, flora y fauna (SEMARNAT, 2005).
En la laguna se llevan a cabo de manera continua las pesquerías de: camarón, ciertas especies de peces y otras más de crustáceos y moluscos; además de ser considerada como área de crianza, refugio y de alimentación (Leija–Tristán et al. 1995).
Una fase del ciclo de vida de los camarones peneidos se lleva a cabo en lagunas costeras donde son alimento de algunos peces como: Cynoscion spp. y Stellifer spp. (De Sylva 1985), por lo que los estudios de juveniles son de gran importancia debido a que tienen una elevada mortalidad.
Entre los trabajos realizados sobre la pesquería del camarón café F. aztecus, en la costa noroccidental del Golfo de México se encuentran los de Chávez (1973); Arreguín–Sánchez y Chávez (1985) y Castro y Arreguín–Sánchez (1991), entre otros. En cuanto a las fases inmaduras de este camarón están las investigaciones de: Castro–Meléndez et al. (1990) quienes analizaron la incidencia de juveniles de F. aztecus, en la Laguna Almagre, Tamaulipas.
En particular para la Laguna Madre, Leija–Tristán et al. (1995) analizaron la variación de la abundancia y la composición por talla y peso de camarones juveniles de F. aztecus. Barba–Macías (1999) observó la variación espacio–temporal de la densidad de juveniles de tres especies de camarones peneidos, mientras que Pérez–Castañeda et al. (2006) evaluaron la variabilidad espacial del género Farfantepenaeus en su fase bentónica.
A pesar de la importancia económica que los camarones peneidos tienen, las fases planctónicas han sido poco estudiadas, estas etapas son altamente susceptibles a la depredación y a las variaciones ambientales que resultan en una alta mortalidad y que finalmente repercuten en el tamaño de la población adulta, por lo que el propósito de este trabajo fue analizar la distribución espacio–temporal de los juveniles planctónicos de F. aztecus, F. duorarum y L. setiferus en la región sur de la Laguna Madre, Tamaulipas.
MATERIALES Y MÉTODOS
La Laguna Madre se localiza al norte del Estado de Tamaulipas (23° 48'–25° 30' norte y 97° 23'–97° 52' oeste). Hacia el norte se encuentra limitada por los depósitos del Río Bravo y hacia el sur por la desembocadura del Río Soto la Marina. Posee una superficie de 2 000 Km2, con una profundidad media de 0.7 m. Se encuentra separada del Golfo de México por una barrera litoral recta y uniforme hacia barlovento e irregular hacia el borde continental (Fig. 1), la depresión de la laguna se rellena parcialmente debido al aporte de agua del Río San Fernando, dividiéndose en dos cuencas: septentrional y meridional (Yáñez & Schlaepfer 1968). La Laguna Madre tiene un clima de tipo BS1(h')hw que es semiseco con lluvias en verano y escasas a lo largo del año con precipitación invernal entre 5 y 10.2% (SPP 1981). El área donde se realizó el presente estudio se ubica en la zona sur, entre los 24° 13' y 24° 34' de Latitud norte y los 97° 42' y 97° 51' Longitud oeste, limitándose al norte con la Bahía de Catán y al sur con La Enramada, con dos bocas: Boca de Catán y Boca el Caballo (Fig. 1).
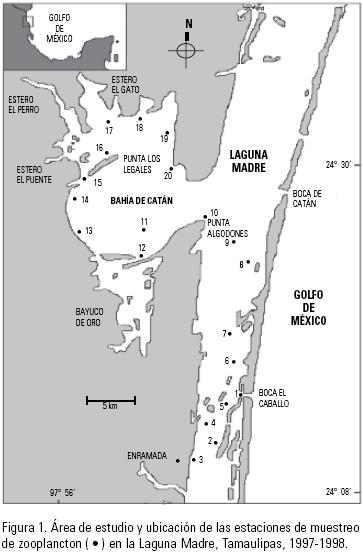
En la región sur de la Laguna Madre se establecieron 20 estaciones de muestreo, distribuidas en dos zonas: entre la Enramada y Punta Algodones (estaciones: 1–10) y en el interior de la Bahía de Catán (estaciones: 11–20; Fig. 1).
Las recolectas se efectuaron en octubre (1997) y enero, mayo, julio (1998), con una red cónica de 1.5 m de largo, con 50 cm de diámetro en la boca y malla de 505 pm, a la que se le colocó un flujómetro para calcular el volumen de agua filtrado. Los arrastres de zooplancton fueron en forma circular en la capa superficial de la columna de agua con una duración de 5 minutos. Las muestras fueron fijadas en formalina al 4% y neutralizadas con borato de sodio. Se tomaron simultáneamente datos de temperatura (°C) y salinidad superficial (ups). De las muestras se separó el total de juveniles de la Familia Penaeidae, los que fueron preservados en alcohol al 70%.
De la estación meteorológica de Soto la Marina se obtuvieron los datos de precipitación mensual y temperatura media, disponibles en el Servicio Meteorológico Nacional (1997–1998), mientras que los datos faltantes para los meses de agosto y septiembre se tomaron de García (2004).
La caracterización del sistema lagunar en función de la salinidad se hizo según el Sistema de Venecia (1958), el cual considera los siguientes tipos de agua: agua dulce <0.5 ups; oligohalina 0.5–5.0 ups; mesohalina 5.1–18.0 ups; polihalina 18.130.0 ups y euhalina >30.0 ups, dentro de esta última la condición hiperhalina >40.0 ups según Contreras–Espinosa (1993).
La identificación de juveniles se realizó en base a los trabajos de Williams (1959), Dobkin (1961; 1970); Ringo y Zamora (1968) y Zamora y Trent (1968), de donde se consideraron las siguientes características: longitud de la espina lateral con respecto a la punta redondeada de la escama antenal, presencia o ausencia de espinas de la carina dorsal del 6° segmento abdominal y el número de espinas rostrales. El número de juveniles por estación
de muestreo se estandarizó como número de org/100 m3.
Se aplicó un análisis de varianza (ANOVA) y una prueba de rangos múltiples (SNK, Student–Newman–Keuls) (Zar 1999) para determinar las diferencias entre las tallas de las tres especies, utilizando una submuestra de los ejemplares recolectados en el mes de enero (n = 30, F. aztecus; n = 22, F. duorarum y n = 30, L. setiferus).
RESULTADOS Y DISCUSIÓN
Meteorología. El análisis del promedio mensual de la precipitación pluvial y la temperatura ambiente permite identificar tres épocas climáticas en la región: lluvias (agosto–octubre), “nortes” (noviembre–marzo) y secas (abril–julio). En la época de lluvias la mayor precipitación pluvial fue de 89.9 a 296.6 mm y valores medios de temperatura ambiente (24.8–28.3 °C); la época de nortes caracterizada por las menores temperaturas a lo largo del año (17.0–22.3 °C) y una precipitación pluvial de 0.4–54.3 mm; mientras que en la época de secas ocurrieron los valores más bajos de precipitación pluvial (0.0–19.2 mm) y máximas temperaturas (26.3–32.8 °C; Fig. 2).

Hidrología. En la Laguna Madre la salinidad del agua superficial presentó variaciones muy amplias de 21.0 a 51.0 ups, con condiciones euhalinas en octubre (35.0–38.0 ups), poli–euhalinas en enero (21.0–36.0 ups) y eu–hiperhalinas en mayo y julio (33.0–46.0 y 36.0–51.0, respectivamente). Durante enero la mínima salinidad ocurrió al norte de la Bahía de Catán donde existe la influencia de los esteros El Gato y El Perro. Mientras la menor temperatura del agua en la laguna fue 18.0 a 22.0 °C, con una temperatura mínima en la bahía (18.0–19.0 °C), provocada por los intensos vientos del norte propios de ésta época. Los máximos valores de salinidad fueron observados en mayo y julio (32.0–51.0 ups, en la misma bahía) (Fig. 3); en este último mes la laguna alcanzó la mayor temperatura de todo el ciclo anual con 29.0 a 31.0 °C, excepto en la Boca El Caballo y su zona de influencia marina (24.0 a 25.0 °C) (Fig. 4), esto puede deberse a la intrusión de una masa de agua marina al sistema, ya que durante la época de lluvias en la zona oceánica entre el sur de Tamaulipas y el norte de Veracruz, la temperatura superficial del agua tuvo un intervalo entre 22.8 y 26.8 °C (Secretaría de Marina 1990), mientras que en la plataforma continental el intervalo de temperatura fluctuó entre 23.0 y 26.0 °C (López–Salgado & Suárez–Morales 1998).


Las variaciones en las condiciones hidrológicas de la Laguna Madre particularmente en lo que se refiere a la salinidad, ya han sido señaladas: así en la región central de la laguna Ocaña–Luna (2000) registró un intervalo de salinidad de 18.0 a 50.0 ups, por otro lado Hildebrand (1958) en la zona norte (Boca Arroyo del Tigre) hasta 117.0 ups durante la época de secas (julio); mientras que Hildebrand (1969) menciona que entre La Capilla y La Boca Sandoval la menor salinidad fue de 9.0 ups en noviembre debido al efecto del Huracán Beulah.
La hipersalinidad de la Laguna Madre tiende a aumentar debido a que su volumen ha descendido considerablemente en años recientes, ya que las aguas de los ríos San Fernando y Bravo han sido desviadas para la irrigación de tierras destinadas a la agricultura (Tunnell 2002).
Distribución y abundancia. Se recolectaron un total de 2954 juveniles de camarones peneidos en la Laguna Madre, de los cuales el 84.5% correspondió a F. aztecus, el 10.6% a L. setiferus y el 3.4% a F. duorarum (Tabla 1).
Farfantepenaeus aztecus, camarón café. Los juveniles de esta especie se encontraron durante todo el ciclo de muestreo con una densidad promedio anual de 128.4 org/100 m3, que representó un porcentaje mayor (84.5%), a lo registrado por Sánchez y Soto (1993) en la Laguna de Alvarado, Veracruz, con un 58.0%. Esto probablemente está relacionado con el área de distribución de los adultos de F. aztecus,ya que se señalan capturas mayores hacia el norte del Golfo de México, en el Estado de Tamaulipas (Navarrete del Proo & Gracia 1996).
Las mayores densidades de juveniles de F. aztecus se registraron en enero con 458.8 org/100 m3, cuando se observaron las menores temperaturas del ciclo anual (18.0–22.0 °C) y salinidades de 28.0–36.0 ups; principalmente en la Boca el Caballo y su zona de influencia marina (Tabla 1; Fig. 1). Durante octubre, mayo y julio las densidades de juveniles fueron bajas en aguas con características euri–hiperhalinas (33.0–46.0 ups) y altas temperaturas (24.0–29.0 °C). La mayor abundancia de juveniles en la Laguna Madre durante enero coincide cercanamente con el mayor reclutamiento estuarino de juveniles en invierno–primavera en el norte del Golfo de México, al parecer después de un gran desove en el otoño (Li & Clarke 2005).
Farfantepenaeus duorarum (camarón rosado). En general la densidad promedio mensual de los juveniles de esta especie fue baja (2.1–11.3 org/100 m3; Tabla 1), se recolectó en intervalos de 18.0 a 31.0 °C y 30.0 a 46.0 ups. De igual manera que F. aztecus, los juveniles de F. duorarum se distribuyeron principalmente en la Boca el Caballo y su zona de influencia en el mes de enero, mientras que en el mes de mayo la mayor abundancia fue en la Bahía de Catán (Fig. 5b).

La baja densidad de juveniles de esta especie, probablemente se deba a que los adultos se encuentran en mayor concentración en la Sonda de Campeche y en la zona occidental de la Península de Florida en EUA como lo señalan Navarrete del Proo y Gracia (1996), donde el periodo de reproducción es de abril a septiembre con dos principales picos: agosto–septiembre y abril–mayo (Gulland 1975).
En Carolina del Norte, EUA, la inmigración de juveniles de esta especie sucede de abril hasta diciembre (Williams 1969), esto coincide con la mayor abundancia de juveniles en la Laguna Madre Sur en mayo.
Litopenaeus setiferus (camarón blanco). Los juveniles de esta especie se recolectaron todo el año, con la mayor abundancia en el mes de enero (Tabla 1; Fig. 5c) en la Boca el Caballo (784.0 org/100 m3) donde la temperatura superficial del agua fue de 21.0 °C mientras que la salinidad fue de 32.0 ups; en julio hubo un pico menor (14.2 org/100 m3) en la zona sur desde Punta Algodones hasta la Enramada en temperaturas entre 24.0–31.0 °C y salinidades de 36.0–45.0 ups; lo anterior difiere de lo observado en la Bahía de Galveston, Texas, donde ocurrieron solamente de mayo a noviembre (Baxter & Renfro 1967).
Durante el mes de enero se registró la máxima abundancia de juveniles de L. setiferus, al igual que F. aztecus (Tabla 1; Fig. 5a, c), principalmente en la Boca el Caballo y su zona de influencia marina, lo que indica la principal época de inmigración a través de esta región, este hecho coincide con lo reportado por Pérez–Castañeda et al. (2006) para reclutas de las especies de Farfantepenaeus spp. al sur de la Laguna Madre durante enero y febrero.
Al relacionar la abundancia de las tres especies con la salinidad y temperatura mediante una prueba de rangos de Spearman (rs), no se encontraron diferencias significativas, este hecho también fue observado al correlacionar la abundancia de juveniles de F. duorarum con la temperatura en la Bahía de Florida (Criales et al. 2003).
De manera general durante enero–julio–octubre la mayor abundancia de juveniles de las tres especies se distribuye hacia el Sur de la Laguna Madre. En la Bahía de Catán se registra la mayor abundancia en mayo, cuando las condiciones de temperatura fueron de 25.5–28.0 °C y salinidad de 38.0–46.0 ups; mientras que durante julio, no se recolectaron juveniles peneidos, cuando se observaron las más altas temperaturas (29.0–31.0 °C) aunado a condiciones hiperhalinas (47.0–51.0 ups) en casi toda la bahía (Figs. 3 y 5; Tabla 1).
Las condiciones de mareas y corrientes favorecen la inmigración de juveniles de camarones peneidos (Caillouet et al. 1970), en particular sobre el principal reclutamiento de F. aztecus en el Norte del Golfo de México (invierno y primavera), Li y Clarke (2005) consideran que los juveniles gradualmente son llevados hacia la costa probablemente por el transporte superficial de Ekman hacia el norte, asociado con los vientos prevalecientes hacia el oeste.
Análisis de tallas de juveniles. Durante la época de mayor abundancia (enero), la talla de los juveniles de F. duorarum (11.0 mm LT) fue significativamente menor que la de F. aztecus (11.7 mm LT) y L. setiferus (11.8 mm LT) (F = 7.81, p = 0.05; SNK = 0.71, p = 0.05; SNK = –0.83, p = 0.05).
La talla de los juveniles de F. aztecus(11.7 mm) y L. setiferus (11.8 mm) en este estudio fueron similares en el primer caso y mayores en el segundo en relación a la talla promedio (12.0 y 7.0 mm, respectivamente) que Baxter y Renfro (1967) registraron durante la inmigración (finales de otoño e invierno) en la Bahía de Galveston, Texas.
La talla de juveniles de F. duorarum (11.0 mm) fue mayor a lo señalado por Allen et al. (1980) en la Bahía de Florida, durante diciembre–enero (5.0–10.0 mm), mientras que en el periodo cálido de marzo–abril este intervalo fue mayor (10.5–14.0 mm).
Análisis del periodo de veda. Debido a que la pesca de camarón es una actividad económica importante en las lagunas costeras del estado de Tamaulipas, es necesario optimizar su aprovechamiento haciendo un manejo sustentable de este recurso. Con este propósito las autoridades pesqueras han establecido periodos de veda temporales y permanentes para todas las especies de camarón presentes en el Golfo de México, incluidas F. aztecus, F. duorarum y L. setiferus; aunque esta veda sólo abarca del 1° de mayo al 29 de agosto como fue publicado por SAGARPA (2006).
Los juveniles de F. aztecus y L. setiferus en la Laguna Madre estuvieron presentes durante todo el año con un pico de mayor abundancia durante el mes de enero (Tabla 1), estos pertenecen al periodo reproductivo de otoño (finales de noviembre y principios de diciembre), ya que como menciona Ewald (1965) el tiempo de permanencia de los estadios larvarios hasta el juvenil planctónico de camarones peneidos en la columna de agua, es aproximadamente de 25 días; esto coincide con lo referido en la zona costera de Texas donde el pico reproductivo de F. aztecus ocurre de septiembre a noviembre (Galaway & Reitsema 1981). Por lo que se recomienda incluir en el periodo de reproducción los meses de noviembre y diciembre, para su protección, en la Laguna Madre (Tabla 2).
AGRADECIMIENTOS
Los autores agradecen a los revisores anónimos sus atinados comentarios al manuscrito.
REFERENCIAS
Allen, D. M., J. H. Hudson & T. J. Costello. 1980. Postlarval shrimp (Penaeus) in the Florida keys: species, size, and seasonal abundance. Bulletin of Marine Science 30 (1): 21–33. [ Links ]
Arreguín–Sánchez, F. & E. A. Chávez. 1985. Estado del conocimiento de las pesquerías de camarón en el Golfo de México. Investigaciones Marinas. CICIMAR 2 (2): 23–44. [ Links ]
Barba–Macías, E. 1999. Variación de la densidad y la biomasa de peces juveniles y decápodos epibénticos de la región central de la Laguna Madre, Tamaulipas, Hidrobiológica 9 (2): 103–106. [ Links ]
Baxter, K. N. & W. C. Renfro. 1967. Seasonal occurrence and size distribution of postlarval brown and white shrimp near Galveston, Texas, with notes on species identification. Fishery Bulletin 66 (1): 149–158. [ Links ]
Caillouet, Jr. C. W., W. S. Perret & R. J. Dugas. 1970. Diel fluctuations in catch of postlarval brown shrimp, Penaues aztecus Ives, with the renfro beam trawl. Bulletin of Marine Science 20 (3): 721–730. [ Links ]
Castro, R. G. & F. Arreguín–Sánchez. 1991. Evaluación de la pesquería de camarón café Penaeus aztecus del litoral Mexicano del Noroeste del Golfo de México. Ciencias Marinas 17 (4): 147–159. [ Links ]
Castro–Meléndez, R. G., M. Medellín–Ávila, C. Bonilla E., E. Rosas–Torres, R. Orta–Nóñez & E. Conde G. 1990. Incidencia de postlarvas de camarón café Penaeus aztecus en la Laguna Almagre, Tamaulipas y relación con las poblaciones de alta mar en el Noroeste del Golfo de México. Instituto Nacional de la Pesca. Secretaría de Pesca. Ciencia Pesquera 7: 121–141. [ Links ]
Chávez, E. A. 1973. A study on a growth rate of brown shrimp (Penaeus aztecus Ives, 1891) from the coast of Veracruz and Tamaulipas, Mexico. Gulf Research Reports 4 (2): 278–799. [ Links ]
Contreras–Espinosa, F. 1993. Ecosistemas costeros mexicanos. Universidad Autónoma Metropolitana. Unidad Iztapalapa. México. 415 p. [ Links ]
Criales. M. M., C. Yeung, D. L. Jones, T. L. Jackson & W. J. Richards . 2003. Variation of oceanographic processes affecting the size of pink shrimp (Farfantepenaeus duorarum) postlarvae and their supply to Florida Bay. Estuarine Coastal Shelf Science 57: 457–468. [ Links ]
De Sylva, D. P. 1985. Nektonic food webs in estuaries. Chap. 11. In: Yáñez–Arancibia, A. (Ed.). Fish community ecology in estuaries an coastal lagoons: towards and ecosystem integration. UNAM Press. México, pp. 233–246. [ Links ]
Dobkin, S. 1961. Early developmental stages of pink shrimp, Penaeus duorarum from Florida waters. USA Fish and Wildlife Service Fishery Bulletin 61: 321–349. [ Links ]
Dobkin, S. 1970. Manual de métodos para el estudio de larvas y primeras postlarvas de camarones y gambas. México. Instituto Nacional de Investigaciones Biológico Pesqueras. Secretaría de Industria y Comercio. Serie de Divulgación. Instructivo 4: 13–17. [ Links ]
Ewald, J. J. 1965. The laboratory rearing of the pink shrimp. Penaeus duorarum. Bulletin of Marine Science 15: 436–449. [ Links ]
Gallaway, B. J. & L. A. Reitsema. 1981. Shrimp spawning site survey In: Jackson, W. B. & E. P. Wilkens (Eds.). Shrimp and Redfish Studies: Bryan Mound Brine Disposal Site off Freeport, Texas, 1979–1991, vol. III. U. S. Department of Commerce, NOAA Technical Memorandum. NMFS–SEFC–676. 84 p. [ Links ]
García, E. 2004. Modificaciones al sistema de clasificación climática de KÖPPEN (para adaptarlo a las condiciones de la República Mexicana). 5ª. Ed. Instituto de Geografía. UNAM. México. 90 p. [ Links ]
Gracia, A., A. Vázquez–Bader, F. Arreguín–Sánchez, L. E. Schultz & J. A. Sánchez. 1997. Ecología de camarones peneidos. In: Flores–Hernández, D., P. Sánchez–Gil, J. C. Seijo & F. Arreguín–Sánchez (Eds.) Análisis y Diagnóstico de los Recursos Pesqueros Críticos del Golfo de México. Universidad Autónoma de Campeche. EPOMEX Serie Científica, 7. pp. 127–144. [ Links ]
Gulland, J. A. 1975. I Informe del camarón del Banco de Campeche. Convenio México–Cubano de Cooperación Científica. Centro de Investigaciones Pesqueras (INP)–Cuba e Instituto Nacional de la Pesca (SIC). 73 p. [ Links ]
Hildebrand, H. H. 1958. Estudios biológicos preliminares sobre la Laguna Madre de Tamaulipas. Ciencia 17 (7–9): 151–173. [ Links ]
Hildebrand, H. H. 1969. Laguna Madre, Tamaulipas: observations on its hydrography and fisheries. Lagunas Costeras. Un Simposio. Memorias Simposio Internacional de Lagunas Costeras. UNAM–UNESCO. México. pp. 679–686. [ Links ]
Leija–Tristán, A., G. A. Rodríguez–Almaraz & F. Jiménez–Guzmán. 1995. Composición, abundancia y distribución espacial del camarón café Penaeus (Farfantepenaeus aztecus), en la Laguna Madre, Tamaulipas, México. Publicaciones Biológicas. Facultad de Ciencias Biológicas/Universidad Autónoma de Nuevo León. México. 8 (1 y 2): 97–108. [ Links ]
Li, J. & A. J. Clarke. 2005. Sea surface temperature and the brown shrimp (Farfantepenaeus aztecus) population on the Alabama, Mississippi, Louisiana and Texas continental shelves. Estuarine Coastal and Shelf Science 64: 261–266. [ Links ]
López–Salgado, I. & E. Suárez–Morales. 1998. Copepod assemblages in surface waters of the Western Gulf of Mexico. Crustaceana 71 (3): 312–330. [ Links ]
Navarrete del Proo, A. & A. Gracia. 1996. La pesquería de camarón en altamar. Golfo de México y Caribe Mexicano. In: Sánchez–Palafox, A., D. F. Fuentes–Castellanos & S. García–Real Peñaloza (Eds.). Pesquerías relevantes de México. Tomo I. Instituto Nacional de la Pesca. Secretaría del Medio Ambiente, Recursos Naturales y Pesca. México. pp. 29–63. [ Links ]
Ocaña–Luna, J. A. 2000. Alimentación del ictioplancton de lagunas costeras de Veracruz y Tamaulipas. Tesis Doctoral. Facultad de Ciencias. UNAM. México. 124 p. [ Links ]
Pérez–Castañeda, R., Z. Blanco–Martínez & J. L. Rábago–Castro. 2006. Distribución de camarones peneidos (Farfantepenaeus spp.) a lo largo de la Laguna Madre, Tamaulipas durante la época de Nortes. XlV Congreso Nacional de Oceanografía. 1a Reunión Internacional de Ciencias Marinas. Manzanillo, Colima. México. [ Links ]
Pérez–Castañeda, R. & 0. Defeo. 2000. Population structure of the penaeid shrimp Farfantepenaeus notialis in its new range extension for the Gulf of Mexico. Bulletin of Marine Science 67 (3): 1069–1074. [ Links ]
Pérez–Farfante, I & B. Kensley. 1997. Penaeoid and sergestoid shrimps and prawns of the word. Keys and diagnoses for the Families and Genera. Tomo 175. Du Museum Nacional D' Histoire Naturelle. 233 p. [ Links ]
Ringo, R. D. & G. Zamora Jr. 1968. A penaeid postlarval character of taxonomic value. Bulletin of Marine Science 18 (2): 471–476. [ Links ]
Sánchez, A. J. & L. A. Soto. 1993. Distribución de camarones inmaduros (Decapoda: Penaeidae) en el sistema lagunar de Alvarado, Veracruz, México. Revista de Biología Tropical41 (1): 81–88. [ Links ]
SAGARPA. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. 2006. Acuerdo por el que se modifica el periodo de veda para la captura de camarón en aguas marinas de jurisdicción federal del Golfo de México, en la zona comprendida desde la desembocadura del Río Bravo en Tamaulipas, hasta la desembocadura del Río Coatzacoalcos en Veracruz, establecido en el artículo primero, fracción I del acuerdo publicado el 28 de abril de 2006. Diario Oficial de la Federación. México, D. F. Agosto 14: 45–46. [ Links ]
Secretaría de Marina. 1990. Atlas oceanográfico nacional. Centro de Datos e Información Oceanográfica. 46 p. [ Links ]
SEMARNAT. Secretaría de Medio Ambiente y Recursos Naturales. 2005. Decreto por el que se declara área natural protegida, con el carácter de área de protección de flora y fauna, la región conocida como Laguna Madre y Delta del Río Bravo, ubicada en los municipios de Matamoros, San Fernando y Soto la Marina, en el Estado de Tamaulipas, con una superficie total de 572, 808–60–9.22 hectáreas. Diario Oficial de la Federación. México, D. F. Abril 14: 7–14. [ Links ]
SPP. Secretaría de Programación y Presupuesto. 1981. Atlas nacional del medio físico. México. pp. 80–97. [ Links ]
Servicio Meteorológico Nacional. 1997–1998. Estación meteorológica Soto la Marina. Tarjetas de resumen mensual y anual. [ Links ]
Sistema de Venecia. 1958. Symposium on the classification of brackish waters, Venice April 8–14, 1958. Archives Oceanography and Limnology 11, Suppl, 1–248. [ Links ]
Tunnell Jr., J. W. 2002. Geography, climate and hydrography. In: Tunnell Jr. J. W. & F. W. Judd (Eds.). The Laguna Madre of Texas and Tamaulipas. Texas A & M University Press. pp. 7–27. [ Links ]
Wakida–Kusunoki, A. T., R. Solana–Sansores, M. E. Sandoval–Quintero, G. Nóñez–Márquez, J. Uribe–Martínez, A. González–Cruz & M. Medellin–Avila. 2006. Camarón del Golfo de México y Mar Caribe. In: Arreguín–Sánchez, F., L. Beléndez–Moreno, I. Méndez–Gómez–Humarán, R. Solana–Sansores & C. Rangel–Dávalos (Eds.). Sustentabilidad y pesca responsable en México, evaluación y manejo. Instituto Nacional de la Pesca. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. México. pp. 427–476. [ Links ]
Williams, A. B. 1969. A ten–year study of meroplankton in North Carolina estuaries: cycles of occurrence among Penaeidean shrimps. Chesapeake Science 10 (1): 36–47. [ Links ]
Williams, A. B. 1959. Spotted and brown shrimp postlarvae (Penaeus) in North Carolina. Bulletin of Marine Science of the Gulf and Caribbean 9 (3): 281–290. [ Links ]
Yánez, A. & C. J. Schlaepfer. 1968. Composición y distribución de los sedimentos recientes de la Laguna Madre, Tamaulipas. Boletín del Instituto de Geología. UNAM 84: 5–34. [ Links ]
Zamora Jr., G. & L. Trent. 1968. Use of dorsal carinal spines to differentiate between postlarvae of brown shrimp, Penaeus aztecus Ives, and white shrimp, P. setiferus (Linnaeus). Contributions in Marine Science 13: 17–19. [ Links ]
Zar, H. J. 1999. Biostatistical analysis. 4th Ed. Prentice Hall New Jersey, USA, 123 p. [ Links ]














