Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.18 no.1 Ciudad de México mar. 2008
Variaciones en la Estructura de Asociaciones de Diatomeas Epifitas de Macroalgas en una Zona Subtropical
Variations in the Structure of Epiphytic Diatom Assemblages in Subtropical Macroalgae
Oscar Ubisha Hernández Almeida1* y David Alfaro Siqueiros Beltrones1
1 Dpto. Plancton y Ecología Marina, Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional. A. P. 592, La Paz, B.C.S., México. 23000. * E–mail: ubisha78@hotmail.com.
Recibido: 16 de enero de 2007
Aceptado: 1 de octubre de 2007
RESUMEN
Se analizaron muestras de diatomeas epifitas de distintos taxa de macroalgas recolectadas en una zona subtropical, con el objetivo de determinar si conformaban una misma asociación y si ésta variaba temporalmente. Para ello se examinó su estructura en términos de abundancias relativas, valor biológico (IVB) de los taxa, diversidad, dominancia y equidad. Las macroalgas se recolectaron en un manchón de la playa El Caimancito, B. C. S. en junio y diciembre de 2001, y abril, mayo y julio del 2002. Específicamente talos de 5 especies: Laurencia pacifica, L. johnstonii, Padina mexicana, P. caulescens e Hydroclathrus clathratus. Sobre estos hospederos se identificaron 211 taxa (especies y variedades) de diatomeas; las más abundantes fueron Cocconeis disculus y C. dirupta. Sin embargo, según el IVB Navicula incerta, Nitzschia frustulum, C. disculus y N. frustulum var. perminuta, determinaron la estructura de las asociaciones. El valor máximo de diversidad (H' = 5) se registró en P. mexicana; el mínimo (H' = 1.48) en Laurencia pacifica. De acuerdo con lo anterior, se discriminaron varias asociaciones de diatomeas epifitas según el género de la macroalga hospedera. La riqueza y diversidad de especies promedio del manchón de macroalgas están entre los más altos medidos para asociaciones de diatomeas epifitas. Los cambios temporales de todo el manchón coincidieron con el cambio estacional propuesto para la bahía en otros estudios, según su temperatura.
Palabras clave: diatomeas epifitas, macroalgas, subtropical, diversidad.
ABSTRACT
Epiphytic diatom samples of various macroalgae from a subtropical bed taxa were analyzed in order to determine if they belonged to a single assemblage, and whether they exhibited time variations. The analysis was based on community structure, i.e. relative abundances, biological value (BVI), species diversity, dominance, and equitability. The macroalgae hosts were collected from a bed located in a beach known as El Caimancito, B. C. S. Specifically five macroalgae taxa were chosen: Laurencia pacifica, L. johnstonii, Padina mexicana, P. caulescens and Hydroclathrus clathratus. The most abundant diatom taxa, out of 211 species and varieties were Cocconeis disculus and C. dirupta. However, according to the BVI the taxa determining the assemblage structure were Navicula incerta, Nitzschia frustulum, C. disculus and N. frustulum var. perminuta. Diversity (H') values of the epiphytic diatom assemblages varied according to macroalgae host genus. The highest diversity value was for P. mexicana (H' = 5), whilst the lowest value (H' = 1.48) was for L. pacifica. The estimated species diversity and richness are among the highest measured for epiphytic diatom assemblages. Time variations in the diatom assemblages of the whole macroalgae bed followed the seasonal variation proposed for Bahía de La Paz based on temperature.
Key words: diatoms, epiphytes, macroalgae, subtropical, diversity.
INTRODUCCIÓN
Las diatomeas son uno los componentes más conspicuos y abundantes en las comunidades epifitas de las macroalgas marinas. Contribuyen significativamente en la productividad de las comunidades bentónicas litorales (Booth, 1981) y sin embargo, se han examinado poco los atributos de las asociaciones que conforman (Main & McIntire, 1974). Las diatomeas epifitas muestran una distribución agregada, debido a su naturaleza oportunista y a las variaciones del medio (Siqueiros–Beltrones, 2002a). Así, su distribución se ha interpretado como un mosaico de asociaciones más o menos discreto y bien definido, o que se traslapan a través de un gradiente de factores físicos y químicos (McIntire & Moore, 1977), pero se sabe poco sobre los factores que determinan la estructura de dichas asociaciones (Booth, 1981). Según comparaciones gruesas entre Zostera marina Linnaeus, Fucus evanescens C. Agardh, Enteromorpha sp., Polysiphonia sp. y Ulva sp., la estructura de asociaciones de diatomeas epifitas puede diferir, tanto en hospederos de la misma especie, como de distintas especies y a través del tiempo. Así, se ha propuesto que el único papel de las macroalgas es de aumentar la superficie de colonización (Main & McIntire, 1974). Sin embargo, Tanaka et al. (1984) encontraron que la riqueza y abundancia de diatomeas epifitas en Sargassum piluriferum (Turner) C. Agardh era mayor que en pasto artificial, por lo que el sustrato vivo estaría influyendo más allá que como mera superficie de fijación.
Lo anterior sugiere que existen interacciones de distintos tipos (físicos, químicos o biológicos) entre las macroalgas y sus diatomeas epifitas, quizá del tipo observado por Lee et al. (1975), quienes proponen que la variación en la estructura de las asociaciones de diatomeas epifitas puede deberse a que existe algún tipo de relación bioquímica entre el hospedero y las diatomeas.
Para la Península de Baja California se cuenta con algunos estudios sobre diatomeas epifitas de macroalgas: Siqueiros–Beltrones y Valenzuela–Romero (2004) registraron 236 taxa de diatomeas epifitas para varias especies de macroalgas: Padina durvillaei Bory Saint–Vincent, Cryptopleura crispa Kylin, Dasya sinicola (Setchell & N.L. Gardner) E.Y. Dawson, Amphiroa vanbosseae M. Lemoine, Acrosorium venulosum (Zanardini) Kylin, Pterocladiella y Dyctiota, observándose que la diversidad (H') fue mínima en Dyctiota sp. (0.99) y máxima sobre Dasya sinicola (2.81). En Macrocystis pyrifera (Linnaeus) C. Agardh, de la región media de la Península de Baja California, se registraron abundancias elevadas de diatomeas epifitas, mientras que en especimenes de Egregia menziessi (Turner) J.E. Areschoug y Eisenia arborea J.E. Areschoug no se observaron diatomeas (Siqueiros–Beltrones et al., 2002); otras observaciones sobre M. pyrifera en la región norte de la península confirmaron la constancia de los taxa dominantes y que, tanto la riqueza como la diversidad de especies, son elevadas sobre este sustrato (Siqueiros–Beltrones & Argumedo–Hernández, 2005; Argumedo–Hernández & Siqueiros–Beltrones, 2007).
Aunado a lo anterior, en estudios realizados al sur de la península (Siqueiros–Beltrones & López–Fuerte, 2006) se registraron elevadas riqueza y diversidad de especies de diatomeas epifitas de raíces de mangle y macroalgas, con valores de H' de 5.2 (máximo) y 4.35 (mínimo); estos trabajos muestran que la diversidad en las asociaciones de diatomeas epifitas en la región es alta, lo cual se puede atribuir en parte a que las distintas especies de macroalgas que cohabitan en un manchón podrían albergar distintas asociaciones de diatomeas.
El análisis anterior sugiere que las asociaciones de diatomeas epifitas de macroalgas podrían variar de acuerdo con diferencias en los hospederos de un cierto nivel taxonómico. Por otra parte, la riqueza específica macroalgal podría incidir directamente en la riqueza de las diatomeas epifitas.
En el área de estudio, la composición macroalgal de afinidad subtropical es resultado de la mezcla entre especies tropicales y templadas, así como de especies endémicas (Jackelman et al., 1991; Rodríguez–Morales & Siqueiros–Beltrones, 1999). Esta gran riqueza y variabilidad de macroalgas proporcionan a su vez gran cantidad de hábitats y superficies de adhesión. Esto explicaría porqué la riqueza de especies de diatomeas epifitas de 12 especies de macroalgas de la zona alcanzó los 270 taxa (Siqueiros–Beltrones & Hernández–Almeida, 2006).
De acuerdo con lo anterior, se pretende contrastar la hipótesis nula de que las asociaciones de diatomeas epifitas no exhiben variaciones entre un hospedero y otro, ya sea de diferente o del mismo taxón, ni a través el tiempo, sino que existe una sola asociación que aprovecha el sustrato que proveen las macroalgas, sin preferencia o variación temporal.
Para contrastar la hipótesis, el objetivo planteado fue determinar si la estructura espacial y temporal de la asociación de diatomeas epifitas, variaba o se mantenía constante, en las especies de macroalgas más frecuentes de un manto subtropical, durante temporadas distintas. Como objetivos particulares se planteó: a) describir la estructura de las asociaciones de diatomeas epifitas en taxa de macroalgas representativos del área de estudio, con base en parámetros de las asociaciones (diversidad, dominancia y equidad); b) determinar si dicha estructura variaba significativamente entre hospederos de distintos taxa; y c) determinar si la estructura de diatomeas epifitas variaba según la temporada de muestreo.
ÁREA DE ESTUDIO
El manchón estudiado se ubica en el submareal de la playa El Caimancito. (Punta Roca Caimancito), dentro de la Bahía de La Paz y se localiza en los 24° 12' 22'' N; 110° 18' 02'' O (Fig. 1). El régimen de marea es tipo semidiurno y las salinidades oscilan entre 34 y 36, dependiendo de la época del año (Jiménez–Illescas et al., 1997). De acuerdo con los regímenes pluviométricos y las temperaturas superficiales del agua de mar (Salinas et al., 1990) en el área de estudio se pueden distinguir tres épocas: de marzo a junio (I), de julio a octubre (II) y de noviembre a febrero (III); las dos últimas son temporada de lluvia, pero la III es además fría. En la boca de la Ensenada de La Paz se han registrado temperaturas promedio de 23.5 C° Para primavera (abril – junio), de 30.25 C° para verano (julio – septiembre) y de 22.75 en invierno (octubre – febrero), sin embargo, esto puede variar con la presencia de fenómenos de mesoescala (Cervantes–Duarte et al., 2001, Martínez–Flores et al., 2006).

MÉTODO
Los muestreos se hicieron durante junio y diciembre del 2001 y abril, mayo y julio del 2002. Con esta táctica se pretendió abarcar las tres temporadas identificadas en el área de estudio, compaginando los períodos de recolecta con los momentos en que el manchón de macroalgas se presentara con la mayor riqueza de especies (Rodríguez–Morales & Siqueiros–Beltrones, 1999). Las especies más frecuentes de macroalgas y por ende que pueden considerarse las más representativas correspondieron a los géneros Hydroclathrus, Padina (ambas Phaeophyta) y Laurencia (Rhodophyta). Aunque solamente este último taxon estuvo presente en junio y diciembre del 2001.
Los muestreos se hicieron manualmente, localizando las especies más frecuentes mediante buceo libre entre los 0 y 5 m de profundidad. Las muestras se guardaron en bolsas de plástico negro y se fijaron en alcohol al 70%. La identificación de las macroalgas se hizo según: Abbott (1972), Wynne y Norris (1976), Abbot y Hollenberg (1976), Hollenberg y Norris (1977).
Procesamiento de muestras e identificación de diatomeas. Para obtener las diatomeas epifitas, en el interior de una caja de petri, los talos de Padina se rasparon con un portaobjetos y los talos de Hydroclathrus y Laurencia se picaron con un bisturí. El material obtenido fue puesto en un tubo de ensaye y oxidado con una mezcla 1:3:5 de muestra, etanol y ácido nítrico para eliminar la materia orgánica (Siqueiros–Beltrones, 2002). El remanente fue lavado con agua destilada hasta alcanzar un pH > 6. De cada macroalga se montaron 5 preparaciones permanentes con Pleurax. Para la identificación de diatomeas se utilizaron las obras de: Schmidt et al. (1874–1959), Peragallo y Peragallo (1897–1908), Hendey (1964), Hustedt (1955), Hustedt (1961–66), Navarro (1982), Foged (1975, 1984), Witkowski et al. (2000) y Siqueiros–Beltrones (2002). La lista florística y un registro iconográfico se presentan en Siqueiros–Beltrones y Hernández–Almeida (2006).
Estructura de las asociaciones. De acuerdo con la elevada riqueza observada, para calcular los parámetros que describen la estructura de las asociaciones se utilizó un tamaño de muestra de 1000 valvas (Siqueiros–Beltrones, 2002). La distribución agregada de las diatomeas se compensó usando dos laminillas en los conteos (original y repetición) de cada especie de macroalga examinada. Los taxa de las diatomeas identificadas se clasificaron según sus abundancias relativas en: muy abundantes (taxa con 200 o más frústulas); abundantes (200 > X > 100); comunes (100 > X > 20); y, raras (20 > X > 1).
Como medidas de diversidad se utilizaron los índices H' de Shannon, el inverso del índice de dominancia de Simpson (1 – λ) y el de equidad (J') de Pielou; como medidas de la dominancia se usaron los índices de Simpson (λ) (Magurran, 1988 y Brower & Zar, 1984) y el valor biológico (IVB) de Sanders (1968). La similitud entre las asociaciones se midió con el índice de Bray–Curtis (Brower & Zar, 1984) y con base en las similitudes calculadas se agruparon las muestras (dendrogramas) mediante algoritmos de unión completa (De La Cruz Agüero, 1994).
Los análisis de las asociaciones de diatomeas epifitas se condujeron en tres niveles de comparación entre hospederos: variación espacial, a nivel especie y de género de macroalga; variación temporal a nivel de género; y variación temporal a nivel de todo el manto de macroalgas.
RESULTADOS
Los taxa más frecuentes de macroalgas fueron los siguientes: las rodofitas Laurencia johnstonii Setchell et Gardner (10 talos), Laurencia pacifica Kylin (7) y las feofitas Padina caulescens Thivy (3), Padina mexicana Dawson (2), Hydroclathrus clathratus(C. Ag.) Howe (3). La estructura de las asociaciones de diatomeas epifitas se examinó solamente en estos taxa.
Se contaron 26,950 valvas que incluyeron 211 taxa identificados (especies y variedades) de diatomeas. De acuerdo con las abundancias relativas, 21 taxa fueron muy abundantes, 11 abundantes, 47 comunes y 132 raros. Los taxa más importantes, de acuerdo con el IVB, fueron Navicula incerta Grunow (IVB = 343), Nitzschia frustulum (Kützing) Grunow (327), Cocconeis disculus (Schumann) Cleve (314) y Nitzschia frustulum var. perminuta Grunow (311), las cuales presentaron abundancias constantes, espacial y temporalmente; estos taxa fueron los principales responsables de la identidad de la estructura de la asociación, pues mantuvieron sus abundancias a pesar de los florecimientos de otras especies más numerosas, e.g., Cocconeis dirupta Gregory (201), la cual, aunque fue muy abundante, tuvo variaciones marcadas de un sustrato a otro en todos los meses. Igualmente, especies abundantes como, Opephora pacifica (Grunow) Petit (260), Navicula agnita Hustedt (194), Rhopalodia musculus Kützing (158), Gomphoseptatum aestuarii (Cleve) Medlin (132) y Psammodyction constrictum (Gregory) Grunow (51) fueron irregulares, por lo que presentaron valores menores de IVB.
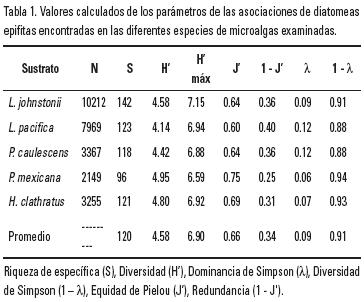
Comparación entre especies de macroalgas. Los valores calculados de los parámetros de las asociaciones de diatomeas epifitas en las distintas especies de macroalgas fueron similares (tabla 1) y muy cercanos al promedio; con excepción de la riqueza los demás parámetros variaron de manera similar. En general, las algas pardas tuvieron menor riqueza, quizás influida por el tamaño de muestra, pero su elevada equidad explica los valores altos de diversidad observados.
En la figura 2 se observa la formación de dos grupos, el primero incluye a las dos especies de Laurencia (al 77 %) y está caracterizado por una proporción similar de las especies muy abundantes Cocconeis disculus y Cocconeis dirupta, seguidas por Navicula incerta, Nitzschia frustulum y Nitzschia frustulum var. perminuta, Opephora pacifica y Rhopalodia musculus. En el grupo formado por Padina mexicana e Hydroclathrus clathratus (58.3%), las abundancias relativas de las especies muy abundantes se comportaron de manera inversa que en Laurencia, es decir, el grupo estuvo caracterizado por Opephora pacifica y N. frustulum como las especies más abundantes, seguidas de N. frustulum var. perminuta, R. musculus, N. incerta, C. dirupta y C. disculus. Mientras que Padina caulescens, ubicada entre los dos grupos, compartió la especie más abundante del primero, debido a que un espécimen presentó un florecimiento de C. disculus. Sin embargo, las abundancias relativas de las especies responsables de la estructura fueron similares a las de P. mexicana.

Recapitulando, no existen diferencias entre especies del mismo género. Los resultados de los parámetros de las asociaciones y de similitud sugieren que Laurencia johnstoniiy Laurencia pacifica se comportan como un único sustrato. Una prueba de independencia a las abundancias relativas (χi = 6.32 y g.l. 14), indicó que no había independencia entre las abundancias relativas de uno y otro sustrato, corroborando que las diatomeas epifitas de las dos especies de Laurencia son parte de una misma asociación.
En el caso de las dos especies de Padina se rechazó la prueba de independencia, pero el comportamiento de las especies responsables de la estructura sugiere que se podría encontrar lo mismo que en Laurencia. De hecho, la composición específica de diatomeas en Padina es muy similar (Siqueiros–Beltrones & Hernández–Almeida, 2006), lo que indica que las asociaciones podrían distinguirse a nivel de género del hospedero.
Comparación a nivel género del hospedero. La diversidad (H') entre géneros varió de 4.87 (Padina) a 4.44 (Laurencia); los demás parámetros siguieron el mismo patrón, excepto la riqueza; lo que pudo deberse a la diferencia en el tamaño de muestra (Tabla 2). Los valores de los parámetros fueron parecidos entre Hydroclathrus y Padina, lo que sugiere que dichos sustratos ofrecen algo en común a las diatomeas, a pesar de que tales macroalgas presentan morfología y ciclo de vida distintos.

Para Laurencia, la diversidad fue ligeramente menor que el promedio y que los otros dos sustratos; los demás parámetros variaron de la misma manera. En este sustrato hubo dos especies muy abundantes; en primer lugar se encontró a Cocconeis disculus y en menor proporción a Cocconeis dirupta; otras especies también influyeron en la identidad de la estructura, a saber: Navicula incerta, Nitzschia frustulum, Nitzschia frustulum var. perminuta, Opephora pacifica y Rhopalodia musculus.
El índice de Bray–Curtis agrupó los dos géneros de algas pardas (60.6); mientras que Laurencia (29) quedó completamente separada del grupo anterior (Fig. 3). Esto aun cuando los dos géneros de feofíceas difirieron en la diatomea más abundante. En Padina fue C. disculus y las otras especies determinantes en la estructura fueron N. frustulum var. perminuta, N. incerta, N. frustulum, O. pacifica, N. agnita y Gomphoseptatum aestuarii. Mientras que en Hydroclathrus sobresalió O. pacifica y las demás especies determinantes fueron N. frustulum var. perminuta, N. frustulum, R. musculus, N. agnita, N. incerta y Psammodyction constrictum. La dominancia de C. disculus en Padina ocurrió en un solo espécimen, por lo que, si se pondera con los demás especímenes, la especie dominante sería N. frustulum, con abundancias similares a las que se encontraron en Hydroclathrus. Ello explica la unión de estos dos géneros y el porqué Padina no se agrupó con Laurencia a pesar de compartir la especie más abundante (C. disculus).

Una prueba de independencia entre las abundancias relativas de epifitas de Hydroclathrus y de Padina (p = 0.05, g.l. 17 y χ2 = 26.32) indicó que no hubo diferencias significativas entre las abundancias relativas de las diatomeas para estos dos sustratos, por lo que podría tratarse de una sola asociación; en donde, cada uno de los géneros de macroalgas funcionaría como parche dentro del manto, aun cuando las características de cada género son distintas, sin embargo, funcionan de manera similar entre miembros de una misma división.
Así, la distribución de las diatomeas epifitas parece estar influida por la identidad del hospedero: 1) Quizá a nivel de división, como se observa en la figura 3, en donde el valor de similitud más alto se obtuvo para los géneros de feofíceas, lo cual corresponde con los parámetros de la asociación que son similares en ambos sustratos (tabla 2); esto sugiere que la estructura de la asociación de diatomeas es la misma. 2) A nivel de género; lo evidencia el hecho de que la diatomea epifita más importante en cada género hospedero es diferente. Máxime porque dichos géneros se hallan, a su vez, en sustratos distintos, con lo que la proporción en las abundancias de las especies de diatomeas podría variar, ya sean sedimentos (Hydroclathrus) o roca (Laurencia y Padina). Sin embargo, la estructura de las asociaciones de diatomeas epifitas se mantiene estable en los distintos sustratos, de acuerdo con los valores de los parámetros (tabla 2).
Variación temporal según el género del hospedero. Laurencia. Los valores de diversidad (H') en este sustrato variaron entre 4.63 (mayo 2002) y 1.48 (julio 2002), en correspondencia con los demás índices (tabla 3). En julio (2002), los valores de H' y J' se encontraron por debajo del promedio, diferenciándose del resto de los valores, que fueron similares. Sin embargo, el valor de diversidad (H' = 4.61) de diciembre (2001) se encontró entre los más altos para este sustrato, a pesar de tener la riqueza más baja; ello se explica por el alto valor de J' asociado, lo cual indica que la distribución de las abundancias influye más sobre el valor de diversidad que la riqueza específica.

La evaluación de los parámetros en conjunto (tabla 3) muestra que abril y mayo (2002) y junio (2001) forman un grupo con valores semejantes, sugiriendo una estructura semejante. Aunque diciembre presentó un valor de diversidad similar, su riqueza y equidad difieren con las observadas por el grupo anterior. Los valores de julio (2002), lo hacen completamente distinto a los demás, lo que puede reflejar una estructura completamente distinta. Este comportamiento es congruente con las fases de principio y final de una sucesión, en donde las variaciones en la comunidad son muy altas con respecto de los valores promedio de los parámetros durante las fases intermedias.
Con base en los valores de similitud de Bray–Curtis (fig. 4) las muestras de abril y mayo (2002) y junio (2001) se agrupan; diciembre (2001) y julio (2002) quedando separados. En particular, la similitud entre mayo (2002) y junio (2001) resulta alta, considerando que son de años diferentes; este grupo comparte a Cocconeis disculus como el taxón más importante, además de: Navicula incerta, Nitzschia frustulum, Nitzschia. frustulum var. perminuta, Opephora. pacifica y Rhopalodia. musculus. Mientras que julio (2002) y diciembre (2001) quedan separados del grupo y entre si, evidenciando cambios temporales en la importancia de los taxa.

La técnica de clasificación, junto con los parámetros comunitarios, sugieren que las asociaciones de diatomeas epifitas en las especies de Laurencia mantuvieron la misma estructura durante los meses de abril y mayo (2002) y junio (2001), los cuales forman parte de la época I (primavera). Julio (2002) podría representar un periodo de transición entre la época I y la II, o bien una asociación con características propias de la época II (verano). Por su parte, diciembre (2001) queda separado, como parte de la época III. Lo anterior evidencia que las diatomeas epifitas de Laurencia siguen el patrón de temporadas propuesto para Bahía de La Paz.
Padina. En este sustrato se obtuvieron los valores de diversidad más altos: H'= 4 en julio y H= 5 en abril (2002) para todo el periodo de estudio, aún con la riqueza más baja. Sin embargo, la equidad tuvo también el valor más alto (0.80) y muestra que este parámetro determina mayor diversidad que el número de especies; en contraste en la asociación de julio (2002), hubo mayor riqueza pero menor diversidad. Por el contrario, la asociación de mayo (2002) mostró una equidad muy similar a la de abril (2002), por lo cual sus valores de diversidad son igualmente altos. Ello sugiere que en estas fechas la asociación es similar, mientras que en julio (2002) comienza a diferir. Asimismo, se reitera que durante abril y mayo de 2002 (época I, seca) se presentan diversidades altas que bajan en julio de 2002 (época II, lluvias; tabla 4).

Según los valores de similitud de Bray–Curtis (fig. 5) se agrupan las muestras de mayo y julio (58 % de similitud), esto se debe a que comparten el taxón Cocconeis disculus; aunque en julio su abundancia fue tres veces mayor, además de que en julio proliferó Gomphoseptatum aestuarii, lo que contribuyó a la baja similitud entre estos dos meses. Por su parte, la segregación de abril puede atribuirse a que el taxón más importante fue Opephora pacifica.

Hydroclathrus. En este hospedero ninguna de las especies más abundantes perteneció al género Cocconeis; el cual sólo aparece entre especies comunes y raras.
Los valores calculados de los parámetros en este sustrato fueron similares (tabla 5). Ocurrió poca variación en S entre julio (71) y abril (79); y presentó valores altos de H' entre 4.5 (abril) y 4.4 (mayo). El máximo de equidad se observó en julio (0.73) y el mínimo en mayo (0.69); la dominancia tuvo su máximo en abril (0.12). De acuerdo con esto, la constancia de los valores de los parámetros de la asociación a través del tiempo podría indicar que este sustrato es favorable y confiere estabilidad a las asociaciones de diatomeas. Con excepción de la riqueza, las asociaciones fueron muy similares a las de Padina, lo que sugiere que las algas pardas son un sustrato favorable para el desarrollo de diatomeas epifitas.

De acuerdo con el índice de Bray–Curtis (Fig. 6) la técnica de unión completa agrupó mayo y julio (2002) (63.7), aunque no compartieron la especie más importante; en mayo fue Nitzschia. frustulum var. perminuta y en julio Rhopalodia musculus. Sin embargo, el comportamiento de las especies que en conjunto determinaron la estructura (N. frustulum var. perminuta, Nitzschia frustulum, Navicula agnita y Navicula incerta) fueron similares, lo cual contribuyó a la similitud de este grupo. Por su parte, en abril (2002) dominó Opehora pacifica, y disminuyeron N. frustulum var. perminuta, N. frustulum, N. agnita y N. incerta, lo que separó a la asociación de este grupo. Esto muestra que la estructura de las asociaciones en este hospedero varió de un mes a otro, sin embargo, el grupo formado es el mismo que en Padina. La variación en estos sustratos fue diferente al de Laurencia, lo que sugiere que el grupo algal al que pertenece el hospedero (rodofita o feofita) podría influir en las variaciones temporales de la estructura de las asociaciones de diatomeas epifitas.

Variación temporal a nivel del manto macroalgal. Según sus abundancias relativas, en junio (2001) se presentaron 7 taxa muy abundantes, 2 abundantes, 8 comunes y 86 raros, en diciembre (2001) 1 : 1 : 14 : 54, en abril (2002) 9 : 6 : 26 : 91, en mayo (2002) 10 : 5 : 30 : 105, y en julio (2002) 8 : 1 : 17 : 86. Los valores de diversidad fueron en general altos: entre H'= 4.87 en mayo (2002) y 3.70 en junio (2001). Diciembre y abril fueron iguales (4.61), aun cuando la riqueza específica fue más baja en diciembre, ya que la asociación presentó la equidad más alta (J') alcanzando 0.75 (Tabla 6).

Pero, aun cuando equidad, redundancia y dominancia parecen segregar dos grupos, los valores de diversidad no presentan diferencias marcadas, salvo en junio. El valor máximo se obtuvo en mayo (primavera), y luego disminuyó, lo que sugiere que la estabilidad en la estructura de las asociaciones podría ir disminuyendo, hacia el verano (época II).
La técnica de unión basada en los valores de Bray–Curtis (Fig. 7) separó diciembre (2001), y un grupo con el resto de las asociaciones (55.2), el cual presenta dos subgrupos con diferentes similitudes; el primero de ellos incluye a abril y mayo (2002) (69), y el segundo a junio de 2001 y julio de 2002 (61.1). El primero comparte a Cocconeis disculus; mientras que en el segundo grupo Nitzschia frustulum, Nitzschia frustulum var. perminuta, Navicula incerta, Navicula agnita, Opephora pacifica y Rhopalodia musculus, son los taxa que lo identifican. En diciembre la especie más importante fue N. frustulum, mientras que C. disculus y Cocconeis diruptafueron poco comunes.

Una prueba de independencia de las abundancias relativas de los meses, indicó que no existe independencia en las abundancias relativas entre abril y mayo (2002) (α = 0.05, g.l. 18); mientras que para el grupo de junio (2001) y julio (2002) sí (α = 0.05, g.l. 18). Estos resultados destacan la importancia de Navicula incerta, Navicula agnita, Nitzschia frustulum, Nitzschia frustulum var. perminuta, Opephora pacifica y Rhopalodia musculus, ya que mantuvieron la identidad y la similitud de ambos grupos, aun al cambiar la especie dominante. En junio (2001) y julio (2002), además, ocurrió un cambio de la época I a la II, lo que se nota en una menor similitud debido al cambio de la especie dominante (Fig. 7). Esto indica que los meses no necesariamente corresponden con los cambios estacionales que exhiben las asociaciones de diatomeas epifitas o sus hospederos.
DISCUSIÓN Y CONCLUSIONES
Los valores de diversidad y riqueza de las asociaciones de diatomeas epifitas de Laurencia johnstonii, Laurencia pacifica, Padina caulescens, Padina mexicana e Hydroclathrus clathratus en El Caimancito son en general mayores que en otros sustratos vivos. En aguas templadas del norte de la Península de Baja California Siqueiros–Beltrones et al. (1985) estimaron H'= 3.71 y S = 235 para diatomeas epifitas de Zostera marina en el intermareal; mientras que los calculados por Siqueiros–Beltrones y Valenzuela–Romero (2004) sobre macroalgas fueron mucho más bajos (H'= 2 y S = 60), aunque las condiciones de su sitio de muestreo fueron distintas (más frío y profundo). Asimismo, los valores registrados por Main y McIntire (1974) sobre macroalgas, son también más bajos (H'=3.37 y REDI = 0.392); en este caso, ello podría atribuirse más a diferencias latitudinales de la diversidad, ya que, en cambio, los valores son similares a los registrados por López–Fuerte y Siqueiros–Beltrones (2006) en raíces (y macroalgas epifitas) de Rhizophora mangle Linné (H'= 4.85 y S = 174), en el intermareal, también en Bahía Magdalena, ubicada en la misma región subtropical. En general los sustratos vivos (pastos marinos, mangles y macroalgas) presentan una equidad alta, lo cual confirma que sus superficies tienen algún efecto sobre la distribución de las abundancias de las diatomeas). Esto es, las macroalgas en el subtrópico presentan un alto epifitismo por diatomeas, lo que aunado a la diversidad de especies de macroalgas repercute sobre la diversidad de especies de diatomeas en los manchones de macroalgas característicos de la zona, que además exhiben variaciones anuales y estacionales aparentemente irregulares (Rocha–Ramírez & Siqueiros–Beltrones, 1991; Rodríguez–Morales & Siqueiros–Beltrones, 1999).
En consecuencia, los valores de riqueza y diversidad promedio (H'= 4.76) en este estudio se encuentran entre los más altos que se han obtenido en estudios sobre diatomeas epifitas, e incluso de la región. Ello obliga a examinar una combinación de factores; además de la región biogeográfica transicional en donde convergen aguas templadas y tropicales y la riqueza del sustrato, debe considerarse la dinámica del área de estudio, i.e., características del submareal somero y aguas de la bahía, y la cercanía del manglar, así como la eventual formación de microhábitats (Pöhn et al., 2001).
Por otra parte, aunque se ha mencionado que la estructura de las asociaciones de diatomeas epifitas llega a diferir entre hospederos de la misma especie (Main & McIntire, 1974), nuestros resultados muestran que la estructura de las asociaciones y la composición son diferentes para cada género de macroalga. Ello refuerza la hipótesis de que existen interacciones de distintos tipos (físicos, químicos o biológicos) entre macroalgas y sus diatomeas epifitas (Lee et al., 1975).
También se debe tomar en cuenta la posible influencia del sustrato que ocupa el hospedero, ya sean sedimentos (Hydroclathrus), o roca (Laurencia y Padina), ya que las especies dominantes encontradas sobre Laurencia y Padina (Cocconeis disculus y Cocconeis dirupta) tienen también hábitos epilíticos, mientras que en Hydroclathrus la especie dominante fue Opephora pacifica, una diatomea forma preferentemente epipsámica. Lo que coincide con lo encontrado por Siqueiros–Beltrones y Sánchez–Castrejón (1999) y López–Fuerte y Siqueiros–Beltrones (2006) en los sedimentos de manglar, donde Opephora mutabilis (Grun.) Sabbe & Vyverman y Opephora krumbeinii (Witk.) Witak & Stachura, (episamicas) fueron las más abundantes.
En este estudio, las diatomeas epifitas comunes en todos los sustratos y responsables de la estructura, fueron formas registradas como epipélicas (Navicula incerta, Nitzschia frustulum y Nitzschia frustulum var. perminuta). Tales taxa son muy móviles y, al no encontrarse sujetas firmemente al sustrato, son susceptibles de ser suspendidas por las corrientes, lo que les confiere una mayor capacidad de colonización (Hudon & Lengendre, 1987), lo cual junto con las corrientes de marea, podrían explicar parte de su constancia y el porqué tuvieron los IVB más altos, ya que en todos los casos mantuvieron la equidad y fueron las responsables de la estructura.
Los análisis de clasificación y abundancias relativas, permitieron corroborar que las asociaciones de diatomeas siguen un patrón temporal, mismo que se vislumbró al examinar los parámetros de sus asociaciones. De acuerdo con esto, las muestras de abril y mayo representa rían mayor estabilidad, y las de junio y julio menor estabilidad. Esto coincide con lo que sería una sucesión teórica, en donde los cambios están dirigidos hacia una comunidad estable. Por lo tanto, es plausible suponer que los valores calculados de los parámetros para abril y mayo representen la fase de mayor estabilidad de la época I. Por otro lado, en junio y julio se podría observar una disminución en la estabilidad asociada al cambio de primavera a verano (época I a la II), lo cual corresponde con los florecimientos de Cocconeis disculus y Cocconeis dirupta; mientras que en diciembre se muestra una asociación totalmente distinta que representaría a la época III (fría).
Así, el patrón de variación temporal de las asociaciones de diatomeas epifitas inferido para el manto macroalgal, se ajustó a las épocas climáticas propuestas para la Bahía de La Paz, definidas por la temperatura, por lo que podría considerarse que esta variable es la que determina el cambio temporal. Así, dentro de cada época ocurrieron variaciones en las asociaciones de diatomeas epifitas en respuesta a cambios a través de sus hospederos. De hecho, se ha observado que la sucesión anual de macroalgas en Bahía de La Paz puede variar, apareciendo comunidades distintas de macroalgas en una misma localidad y de un año a otro (Rocha–Ramírez & Siqueiros–Beltrones, 1991); por lo que los cambios ambientales afectarán la estructura de las asociaciones de diatomeas epifitas, al cambiar el sustrato.
De acuerdo con lo anterior, se confirma que las macroalgas en las zonas subtropicales son sustratos propicios para el desarrollo de asociaciones de diatomeas. Tanto el sustrato vivo (macroalgas), como la combinación de factores tropical y templado (zona de transición) amplían el espectro taxonómico de las diatomeas que conforman las asociaciones en esta zona. Ello explica porqué los valores de riqueza y diversidad promedio observados para estas asociaciones se encuentran entre los más altos obtenidos en estudios sobre diatomeas epifitas.
Asimismo, se refuta nuestra hipótesis (Ho) de que no existen variaciones, temporales o por hospedero en la estructura de las asociaciones de diatomeas epifitas de macroalgas del manchón estudiado. En síntesis, dichas variaciones definen asociaciones para cada género de macroalga, mismas que varían temporalmente. Asimismo, las asociaciones varían según las temporadas propuestas para la Bahía de La Paz a nivel de comunidad de macroalgas.
AGRADECIMIENTOS
Este estudio fue financiado en parte por los proyectos CGPI–2003–211 y 20040024 (IPN), y CONACYT–40778. Alejandra Maza riegos y Elisa Serviere Zaragoza llevaron a cabo la identificación de las macroalgas. La aplicada revisión de los árbitros ayudó a mejorar sustancialmente la elocuencia de este manuscrito.
REFERENCIAS
Abbott, I. A. 1972. Taxonomic and nomenclatural notes on north Pacific Marine algae. Phycologia 11: 259–265. [ Links ]
Abbott, I. A. & G. Hollenberg. 1976. Marine algae of California. Standford University Press, California. 827 p. [ Links ]
Argumedo–Hernández, U. & D. A. Siqueiros–Beltrones. 2007. Cambios en la estructura de las asociaciones de diatomeas epifitas en láminas apicales de Macrocystis pyrifera (L.) C. Ag. Acta Botánica Mexicana 82: 43–66. [ Links ]
Booth, W. E. 1981. A method for removal of some epiphytic diatoms. Botanica Marina 24: 603–609. [ Links ]
Brower, J. E. & J. H. Zar. 1984. Field and laboratory methods for general ecology. Wm. C. Brown. Co. Publ. Dubuque. Iowa. 226 p. [ Links ]
Cervantes–Duarte, R., F. Aguirre–Bahena, A. Reyes–Salinas & J. E. Valdez–Olguín. 2001. Caracterización hidrológica de una laguna costera de Baja California Sur, México. Oceánides 16 (2): 93–107. [ Links ]
De La Cruz Agüero, G. 1994. Sistema de Análisis de Comunidades. Versión 3.0. Dpto. Pesquerías y Biología Marina, Centro Interdisciplinario de Ciencias Marinas, IPN, La Paz, BCS, México. 99 p. [ Links ]
Foged, N. 1975. Some littoral diatoms from the coast of Tanzania. Bibliotheca Phycologica 16. Cramer. Vaduz. 127 p. [ Links ]
Foged, N. 1984. Freshwater and littoral diatoms from Cuba. Bibliotheca Diatomologica 5. Cramer. Vaduz. 243 p. [ Links ]
Hendey, N. I. 1964. An introductory account of the smaller algae of British coastal waters. Part V: Bacillariophyceae (Diatoms). Fisheries Investigation Series. IV: HMSO. London. 317 p. [ Links ]
Hollenberg, G. J. & J. N. Norris. 1977. The red algae Polysiphonia (Rhodomelaceae) in the northern Gulf of California. Smithsonian Contributions to Marine Science. 29 p. [ Links ]
Hudon, C. & P. Legendre, 1987. The ecological implications of growth forms in epibenthic diatoms. Journal of Phycology 23: 434–441. [ Links ]
Hustedt, F. 1955. Marine littoral diatoms of Beaufort North Carolina. Duke University Marine Station Bulletin 6: 1–67. [ Links ]
Hustedt, F. 1959. Die Kieselalgen Deutschland, Österreichs un der Schweiz. In: Rabenhorst (Ed.), Kryptogamen–Flora von Deutschland, Österreichs und der Schweiz, VII Band, II Teil. Koeltz Scientific Book (Reimp. 1991), Leipzig. pp. 1 – 845. [ Links ]
Hustedt, F. 1961–66. Die Kieselalgen Deutschland, Österreichs und der Schweiz. In: Rabenhortst (Ed.), Kryptogamen–Flora von Deutschland, Österreich und der Schweiz, VII Band, III Teil. Koeltz Scientific Books (Reimp. 1991). Leipzig. pp. 1 – 916. [ Links ]
Jackelman, J. J., H. Stegenga & J. J. Bolton. 1991. The marine benthic flora of the Cape Hankglip area and its phytogeographical affinities. South Africa Journal of Botany 57: 295–304. [ Links ]
Jiménez–Illescas, A. R., M. Obeso–Nieblas & D. Salas–De León. 1997. Oceanografía física de La Bahía de La Paz. In: Urbán Ramírez, J. & M. Ramírez Rodríguez. (Eds.). 1997. La Bahía de La Paz; investigación y conservación. Universidad Autónoma de Baja California Sur–Centro Interdisciplinario de Ciencias Marinas/IPN–SCRIPPS. México. pp. 31– 41. [ Links ]
Lee, J. J., M. E. McEnery, E. M. Kennedy & H. Rubin. 1975. A nutritional analysis of a sublittoral diatom assemblage epiphytic on Enteromorpha from a Long Island Salt Marsh. Journal of Phycology 2: 14–49. [ Links ]
López–Fuerte, F. O. & D. A. Siqueiros–Beltrones. 2006. Distribución y estructura de asociaciones de diatomeas en sedimentos de un sistema de manglar. Hidrobiológica 16 (1): 23–33. [ Links ]
Main, S. P. & C. D. McIntire. 1974. The distribution of epiphytic diatoms in Yaquina Estuary, Oregon (U.S.A.). Botanica Marina 17: 88–89. [ Links ]
McIntire, C. D. & W. W. Moore. 1977. Marine littoral diatoms: Ecological considerations. In: Werner, D. (Ed.). The biology of diatoms. Botanical Monographs. University of California Press, Berkeley. pp. 333–371. [ Links ]
Magurran, A. E. 1988. Ecological diversity and its measurement. Princeton University Press. New Jersey. 179 p. [ Links ]
Martínez–Flores, G., R. Cervantes–Duarte & E. González–Rodríguez. 2006. Caracterización de la temperature superficial del mar y climatología de la Bahía de La Paz, B. C. S., México. Oceanides. 21 (1, 2): 81–91. [ Links ]
Navarro, J. N. 1982. Marine diatoms associated with mangrove prop roots in the Indian River, Florida, U.S.A. J. Cramer. Vaduz. Germany. 151 p. [ Links ]
Peragallo, H. & M. Peragallo. 1897–1908. Diatomées marines de France et districts maritimes voisins. M. J. Tempere, Koenigstein. W–Germany. 491 p. [ Links ]
Pöhn, M., K. Vopel, E. Grünberger & J. Ott. 2001. Microclimate of the brown alga Feldmannia caespitula interstitium under zero–flow conditions. Marine Ecology Progress Series 210: 285–290. [ Links ]
Rocha–Ramírez, V. & D. A. Siqueiros–Beltrones. 1991. El Herbario ficológico de la U.A.B.C.S.: elenco florístico de macroalgas para Balandra en la Bahía de La Paz, B.C.S., México. Revista de Investigación Científica, Serie Ciencias del Mar, Universidad Autónoma de Baja California Sur, 2 (1): 13–23. [ Links ]
Rodríguez–Morales, E. O. & D. A. Siqueiros–Beltrones. 1999. Time variations in subtropical macroalgal assemblages from the Mexican Pacific. Oceánides 13 (2): 11–24. [ Links ]
Salinas, Z. C., A. C. Leyva, D. B. Lluch & E. R. Díaz. 1990. Distribución geográfica y variabilidad climática de los regimenes pluviométricos en Baja California Sur, México. Atmósfera 3: 217–237. [ Links ]
Schmidt, A., M. Schmidt, F. Fricke, H. Heiden, O. Müller & F. Hustedt. 1874–1959. Atlas der diatomaceenkunde.. Reisland, Leipzig. Heft 1–120, Tafeln 1–1460. [ Links ]
Siqueiros–Beltrones, D. A. 2002. Diatomeas Bentónicas de la Península de Baja California; Diversidad y Potencial Ecológico. Instituto Politécnico Nacional–Centro Interdisciplinario de Ciencias Marinas – Universidad Autónoma de B.C.S., La Paz, México. 102 p., 43 láms. [ Links ]
Siqueiros–Beltrones, D. A. & U. Argumedo–Hernández. 2005. Florística de diatomeas epifitas en láminas apicales de Macrocystis pyrifera (L.) C. Ag. Oceánides 20 (1, 2): 37–63 [ Links ]
Siqueiros–Beltrones, D. A. & O. U. Hernández–Almeida. 2006. Florística de diatomeas epifitas en macroalgas de un manchón subtropical. Oceánides 21 (1): 11–61. [ Links ]
Siqueiros–Beltrones, D. A. & F. O. López–Fuerte. 2006. Benthic diatoms associated to red mangrove (Rhizophora mangle L.) prop roots in Bahia Magdalena, B.C.S, México. Biología Tropical 54 (1): 287–297. [ Links ]
Siqueiros–Beltrones, D. A. & E. Sánchez–Castrejón. 1999. Association structure of benthic diatoms from a mangrove environment in a Mexican subtropical lagoon. Biotropica 31 (1): 48–70. [ Links ]
Siqueiros–Beltrones, D. A. & G. Valenzuela–Romero. 2004. Benthic diatom assemblages in an abalone (Haliotis spp.) habitat in the Baja Peninsula. Pacific Science 58 (3): 435–446. [ Links ]
Siqueiros–Beltrones, D. A., S. E. Ibarra–Obando & D. H. Loya–Salina. 1985. Una aproximación a la estructura florística de las diatomeas epifitas de Zostera marina y sus variaciones temporales en Bahía Falsa, San Quintín, B. C. Ciencias Marinas 11 (3): 69–88. [ Links ]
Siqueiros–Beltrones, D. A., E. Serviere–Zaragoza, & U. Argumedo–Hernández. 2002. Epiphytic diatoms of Macrocystis pyrifera (L.) C. Ag. from the Baja California Peninsula, México. Oceánides 17 (1): 1–9. [ Links ]
Tanaka, N., K. Ohwada, M. Sugiyama, A. Asakawa & S. Kitamura. 1984. Seasonal occurrences of epiphytic micro–algae on the natural seaweeds and artificial sea–grass in Ago Bay. Bulletin of the Japanese Society of Scientific Fisheries 50 (10): 1665–1669. [ Links ]
Wynne, M. J. & J. N. Norris. 1976. The genus Colpomenia Derbes Solier (Phaeophyta) in the Gulf of California. Smithsonian Contributions to Marine Science 35: 1–18. [ Links ]
Witkowski, A., H. Lange–Bertalot y D. MetzeltIn. 2000. Diatom flora of marine coasts. In: Lange–Bertalot, H. (ed.), Iconographia Diatomologica,Vol. 7. Koeltz Scientific Books. Königstein. pp. 1 – 925. [ Links ]














