Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.18 no.1 Ciudad de México Mar. 2008
Aspectos reproductivos de una población del charal Menidia jordani (Woolman) del Lago de Metztitlán, Hidalgo
Reproductive features of the "charal" Menidia jordani (Woolman) from Lake of Metztitlán, Hidalgo
Ana Laura Ibáñez,1* José Luis García Calderón1 y Roberto Torres–Orozco B.1
1 Universidad Autónoma Metropolitana–Iztapalapa. Departamento. de Hidrobiología, Apdo. Postal 55–535, 09340 México, D.F. Tel: 52 (55) 5804–6585; Fax: 52 (55) 5804–4738. * E–mail: ana@xanum.uam.mx.
Recibido: 10 de febrero de 2007.
Aceptado: 22 de octubre de 2007.
RESUMEN
Menidia jordani es una especie de charal que se distribuye de manera natural en las cuencas de México y del Río Lerma, y tiene en el Lago de Metztitlán, Hidalgo, el límite oriental de su área de distribución en ambientes lénticos. Los resultados del análisis de algunos aspectos de la biología reproductiva de la población de M. jordani que habita en el Lago de Metztitlán mostraron que, a pesar de vivir en un ambiente ubicado en la frontera de su área de distribución, conserva una fenología reproductiva similar a la de otras poblaciones. La máxima longitud estándar observada fue de 58 mm y la talla a la primera madurez sexual fue de 43 mm. Una notable desigualdad en la proporción de sexos a favor de las hembras se observó en todas las colectas, con excepción de la de enero del 2004.
Palabras clave: Menidia jordani, Reserva de la Biosfera Barranca de Metztitlán, México; madurez sexual, fenología, proporción de sexos.
ABSTRACT
Menidia jordani is a silverside species naturally distributed in the Mexican and Lerma drainage areas and has in Metztitlán Lake it most eastern area of distribution in a lentic system. The analysis of the reproductive biology of this species showed that even Metztitlán Lake is the extreme frontier of their distribution conserved its reproduction phenology in relation with other populations. The highest standard length was 58 mm and the length at first sexual maturation was at 43 mm. Sexual ratio inequality was manifested in mayor proportion of females during all collects with exception of January of 2004.
Key words: Menidia jordani, sexual maturation, phenology, sexual ratio, Barranca de Metztitlán, México Biosphere Reserve.
INTRODUCCIÓN
Hasta la primera mitad del siglo XX, los charales o aterinópsidos constituyeron el principal producto pesquero de las aguas interiores de México y actualmente se les cuenta entre los seis primeros lugares de la pesca de escama (SAGARPA, 2002). De las 25 especies de Menidia registradas en las aguas mexicanas 22 son epicontinentales (Miller et al., 2005). De éstas, Menidia jordani (antes Chirostoma jordani) es la que posee la más amplia distribución, ya que se le encuentra en la Cuenca de México, en la del Río Lerma y sus sistemas lacustres asociados (Cuitzeo y Chapala), además de en los Ríos Pánuco, Cazones, Tecolutla y sus tributarios (Barbour, 1973a, Miller et al., 2005) y tiene en el Lago de Metztitlán el límite oriental de su distribución en ambientes lénticos.
Si bien no se dispone de registros documentales previos acerca de la presencia de M. jordani en el Lago de Meztitlán, al menos desde los años sesenta se sabe de su existencia en el Río Tula (Barbour, 1973a). Aunque hasta la fecha este charal no es parte de la pesca comercial que se realiza en el lago, nuestro interés en conocer su comportamiento reproductivo radica en el hecho de que existe una propuesta para introducir en este ambiente otros aterinópsidos, particularmente M. humboldtiana. Además, nos interesa documentar si la ubicación de esta población en los límites del área de distribución de la especie, podría involucrar diferencias en su fisiología y fenología reproductiva en relación con otras poblaciones. En virtud de lo anterior, este trabajo tiene como propósito definir algunos aspectos reproductivos y de comportamiento sexual de M. jordani en un ambiente lacustre ubicado en el límite oriental de su área de distribución natural.
MATERIAL Y MÉTODOS
El lago de Metztitlán se encuentra en el centro de México (20°39' N; 98°50' W), a una altitud aproximada de 1,200 msnm. Forma parte del área de la Reserva de la Biósfera Barranca de Metztitlán y está catalogada como sitio RAMSAR por su importancia para las aves migratorias. Ocupa el extremo noroeste de una cuenca cerrada que posee una superficie de 3,230 km2 y drena al Golfo de México a través de dos túneles, construidos en los años veinte del siglo pasado, que actúan como vertedor de demasías. Según investigaciones neotectónicas y geomorfológicas recientes (Suter, 2004), el lago se originó entre 500 y 1,100 años antes del presente, a partir del represamiento producido por derrumbes que bloquearon el flujo de un tributario del Río Pánuco. En el área predomina un clima seco semicálido, con una temperatura promedio anual de 20.2 °C y una precipitación promedio anual de 440.1 mm, en donde los meses de mayor precipitación son junio, julio y septiembre (BSohw(e)gw", de acuerdo con García, 2004). Es un lago fluctuante, que presenta una superficie, volumen y profundidad media de 1,200 ha, 36 Mm3 y 3 m, respectivamente (Ibáñez et al., 2002). Está sometido a fuertes vientos, procedentes del Golfo de México, que favorecen un patrón de circulación del tipo polimíctico cálido continuo. La columna de agua está siempre bien oxigenada y es rica en materia orgánica gracias a los aportes de la zona agrícola adyacente. Las variaciones de nivel presentan una fase de llenado, de julio a noviembre, asociada con la temporada de lluvias, y otra de descenso de nivel de noviembre a julio, por filtración en la roca caliza y condiciones climáticas (Ibáñez et al., 2002). La tilapia es la principal pesquería de lago, seguida por diversas especies de carpas (Ibáñez et al., 2002).
Para realizar este estudio, se efectuaron nueve colectas de peces, en los meses de marzo, mayo, junio, julio, noviembre y diciembre de 2003 y enero, mayo y julio de 2004, con una red fija de 0.7 cm de luz de malla (de metro y medio de altura y cuatro metros de longitud) en la zona más profunda del embalse, ubicada cerca de su ribera occidental (Fig. 1). En cada ocasión se capturó un promedio 80 ejemplares de M. jordani, que fueron fijados en formalina al 10%. El tamaño de muestra se determinó mediante la fórmula descrita por Daniel (2002) con un grado de precisión de 0.1 cm (Tabla 1). No fue posible completar el ciclo anual de muestreo debido principalmente a problemas de acceso a la ribera lacustre, ya sea por el alejamiento del espejo de agua, en la época de secas, o por inundaciones que bloqueaban los caminos, en la de lluvias.

En el laboratorio, a cada ejemplar se le determinó su longitud total (Lt) y longitud estándar (Ls), con la ayuda de un ictiómetro; el peso vivo, peso eviscerado y peso de las vísceras, con una balanza digital de 0.01 g de precisión; además del sexo y la madurez gonádica, a través de la observación macroscópica de las gónadas. Para la asignación de los estadios de madurez se siguió el criterio de Nikolsky (1963), en donde la fase I es el estadio virgen, la fase V corresponde al desove y la fase VI se considera de descanso.
Se determinó la proporción de sexos, tanto de la muestra total como de cada una de las colectas, mediante la razón de las hembras (H) con respecto al número total de individuos sexados (H/(H+M)). Ante la sospecha de que existieran cardúmenes segregados por sexo, para determinar si se guardaba la proporción 1:1 hembra (H) : macho (M) en cada colecta se realizó una tabla de contingencia de 2 (sexos) X 1 (colecta) y se validó con una prueba de χ2 (1 g.l. y P = 0.05). La talla a la primera madurez sexual se determinó gráficamente a partir de una curva de frecuencia relativa acumulada de las hembras maduras en estadios IV y V en el valor de la talla al 50% de frecuencia (L50). Se determinó el factor de condición de Clark (1928) para cada sexo y muestreo por medio de la relación: K = 100 x (peso eviscerado / Ls3). Los muestreos fueron comparados a través del análisis de varianza, asumiendo condiciones normales e igualdad de varianzas. En caso de homogeneidad de varianzas se utilizó el análisis paramétrico de varianzas (Sachs, 1978). La prueba de Levene se empleó para probar igualdad de varianzas de muestras de diferentes tamaños. Cuando, a pesar de las transformaciones matemáticas, los datos no cumplieron con las premisas, se usó el análisis no paramétrico de Kruskal y Wallis (Zar, 1984) planteando como hipótesis nula la ausencia de diferencias significativas (P < 0.05) entre los valores mensuales. Cuando la hipótesis nula fue rechazada, se usó el análisis múltiple no paramétrico de Dunn's (Zar, 1984).
RESULTADOS
La máxima longitud estándar observada entre los individuos de M. jordani del Lago de Metztitlán fue de 58 mm (Tabla 1). La talla a la primera madurez sexual fue de 43 mm. La proporción de sexos de la muestra total analizada fue de 60% de hembras por 40% de machos, pero en las colectas de marzo, noviembre y diciembre de 2003 y enero y mayo de 2004 se observaron diferencias importantes y significativas en esta proporción (Tabla 2). Las hembras predominaron en todas las colectas, con excepción de la de enero del 2004, en donde sólo representaron el 24%.
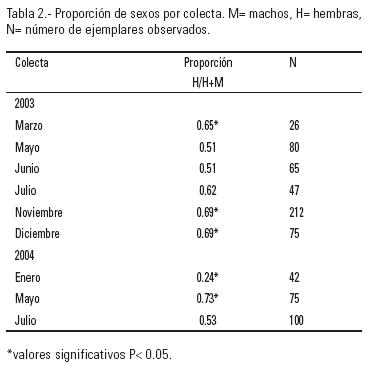
Los estadios de madurez sexual de hembras y machos se muestran en la figura 2. Las mayores proporciones de hembras maduras (fases IV y V) se observaron en marzo y julio de 2003 y julio de 2004, y las de machos maduros, en marzo, junio y julio de 2003 y enero de 2004. No obstante, en todas las colectas se observaron hembras en fases previtelogénicas al igual que machos en estadios de madurez sexual III y IV. Mientras que no fue posible observar en las hembras la fase de reposo (VI; gónadas desovadas), en los machos sí se observó esta fase en la colecta de junio de 2003. El mayor número de individuos en fase V, que representaría el pico de máximo desove advertido, se registró en junio, julio y noviembre de 2003 y en mayo de 2004, en el caso de las hembras, y durante junio, julio y noviembre de 2003, en el de los machos.
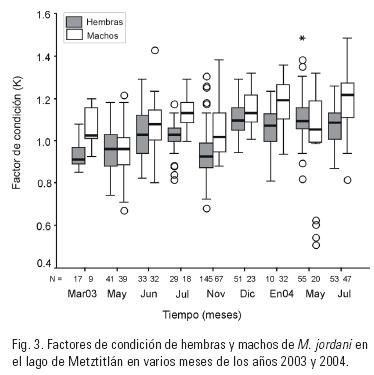
El factor de condición de las hembras difirió significativamente entre marzo–mayo y junio–julio del 2003, y el de los machos, entre enero–mayo y mayo–junio del 2004 (Fig. 3).
DISCUSIÓN
Aunque no existen registros documentales de una probable introducción artificial de M. jordani en el Lago de Metztitlán, llama la atención que su presencia haya sido advertida por los pescadores del lago sólo en fechas recientes. La talla máxima que alcanza en este ambiente, 58 mm, es similar a la que se observa en otras localidades dentro de su área de distribución conocida (Fig. 4), aunque en Chapala no son raros los ejemplares de 70 mm (Barbour, 1973a) y existe un registro de un individuo de 91 mm (Miller, et al., 2005).
La información que ofrece la Tabla 3 sugiere que los aterinópsidos del grupo jordani tienden a reproducirse durante largas temporadas o durante todo el año; sin embargo, antes de plantear alguna generalización debe tenerse en cuenta que la información disponible sobre las temporadas y picos máximos de reproducción es todavía incompleta, pues mientras no existen datos de muchas localidades en donde los miembros de este grupo se distribuyen, en otras localidades este tipo de estudios han sido incluso repetidos.
La ubicación de esta población en el extremo oriental del área de distribución lacustre de la especie tampoco parece afectar de manera importante su fenología reproductiva pues, al igual que en otros ambientes, se observan individuos maduros durante todo el año (Tabla 3).
En cuanto se refiere a la talla de la primera madurez sexual, no es posible establecer comparaciones debido a que, hasta donde sabemos, no existe información documental disponible.
El factor de condición de machos y hembras mostró cambios en algunos meses; sin embargo, no fue posible relacionar estos cambios con los eventos del ciclo reproductivo, pues los valores más altos se observaron en diciembre de 2003 y enero y mayo de 2004.
En algunos aterinópsidos marinos existen cardúmenes monosexuados de machos y hembras que concurren en ciertas áreas durante la época de desove. Conover y Heins (1987) han postulado que la existencia de estos cardúmenes se debe a una "determinación sexual por el ambiente", en particular por la temperatura; fenómeno que ha sido confirmado por Brian y Dyer (2006) para Odontesthes bonariensis. Recientemente, Rojas (2006) informó haber detectado este comportamiento poblacional en el charal prieto, M. attenuatta, del Lago de Pátzcuaro. Las amplias y significativas diferencias en las proporciones de sexos observadas en este estudio sugieren que el mismo fenómeno podría estar ocurriendo en M. jordani del lago de Metztitlán. Así mismo, llama la atención que durante los meses en que se presenta la reproducción la proporción de sexos sea de 1:1. No obstante, para poder probar la existencia de cardúmenes monosexuados en esta especie se debe diseñar un muestreo ad hoc, distinto del que fue realizado por nosotros.
Tanto la talla máxima como el período de reproducción observados en la población de M. jordanidel lago de Metztitlán coinciden con los registrados en otras localidades. Lo anterior sugiere que esta población se encuentra bien adaptada a un lago que se caracteriza por sus amplias fluctuaciones de temperatura, volumen y concentración de nutrientes (Ibáñez et al., 2002). Un factor importante para explicar la presencia de M. jordani en Metztitlán podría ser su condición de ambiente arcillo–trófico, pues ésta es una característica que comparte con Chapala y otros sistemas lacustres (Dávalos–Lind, 1996) que conforman su área de distribución natural. Cabe mencionar que aunque se ha reportado que más del 80% de los individuos de M. jordani del Lago de Metztitlán están parasitados por Bothriocephalus acheilognathi, un céstodo que fue introducido a México junto con la carpa herbívora (Gutiérrez–Cabrera et al., 2005), esta infestación no parece afectar la talla del pez.
El que la población de M. jordani del lago de Metztitlán conserve una fenología reproductiva similar a la de otras poblaciones sugiere que una especie congénere, como M. humboldtiana, también podría adaptarse a las condiciones que imperan en este lago. Si bien la introducción de M. humboldtiana podría generar importantes beneficios económicos, dado el alto valor comercial del pescado blanco, antes de tomar cualquier medida habría que ponderar tanto los riesgos inherentes a una alta incidencia de parasitismo, como la que sufre su congénere, como el hecho, quizás más importante, de que el lago de Metztitlán, y en general la cuenca del río Pánuco, no forma parte de su área de distribución natural (Miller et al., 2005).
AGRADECIMIENTOS
Agradecemos la asistencia de Marco A. Romo Coronel en el trabajo de campo y de laboratorio así como a Juan Juárez Flores por su apoyo en campo y en la elaboración de figuras. Agradecemos a los doctores Irene de los Ángeles Barriga y Guillermo Blancas por su ayuda en la identificación de la especie.
REFERENCIAS
Aceves, M. L. 1989. Estudio bio–ecológico del pescado blanco (Chirostoma) en el Lago de Chapala, Jal. Tesis de Licenciatura. Facultad de Ciencias. Universidad de Guadalajara. Guadalajara, México. 71 p. [ Links ]Fide: Moncayo, R., C. Escalera & V. Segura. 2003. Los pescados blancos del lago de Chapala. Características generales. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, 51–77. [ Links ]
Aguilar, F. J. & N. S. Navarrete. 1996. Crecimiento, condición y mortalidad del charal Chirostoma humboldtianum (Atheriniformes: Atherinidae) en México. Rev. Biol. Trop. 45(1): 573–578. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Bátiz, R. M. & F. E. Ramos. 1985. Sinopsis biológica de una especie de pez blanco (Chirostoma lucius B) de la zona del Lago de Chapala correspondiente al estado de Michoacán. Tesis de Licenciatura. Facultad de Ciencias. Universidad de Guadalajara, México. 133 p. [ Links ]Fide Moncayo, R., C. Escalera & V. Segura. 2003. Los pescados blancos del lago de Chapala. Características generales. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, pp. 51–77. [ Links ]
Barbour, C. 1973a. The Systematics and evolution of the genus Chirostoma Swainson (Pisces, Atherinidae). Tulane Studies in Zoology and Botany 18(3):97–141. [ Links ]
Barbour, C. 1973b. A biographical history of Chirostoma (Pisces: Atherinidae): A species Flock from the Mexican Plateau. Copeia 3: 533–556. [ Links ]
Brian, S. & H. Dyer, H. 2006. Systematic revision of the South American silversides (Teleostei, Atheriniformes). Biocell (Mendoza): 30: 69–88. [ Links ]
Cházaro–Olvera, S., N. A. Navarrete–Salgado & R. Sánchez–Merino 1989. Reproducción y Crecimiento del Charal Chirostoma jordani (Woolman) del embalse Trinidad Fabela, Estado de México. Revista de Zoología, ENEPI, UNAM, México 1:10–18. [ Links ]
Clark, F. 1928. The length–weight relationship of the Californian sardine (Sardina coerulea coerulea) at San Pedro. Fishery Bulletin 12: 22–44. [ Links ]
Conover, D. O. & S. W. Heins. 1987. Adaptative variation in environmental and genetic sex determination in a fish. Science 326: 496–498. [ Links ]
Daniel, W. W. 2002. Bioestadística: base para el análisis de las ciencias de la salud. Limusa Wiley, México. 755 p. [ Links ]
Dávalos–Lind, L. 1996. Phytoplankton and bacterioplankton stress by sediment–borne pollutants. Journal of Aquatic Ecosystem Health 5: 99–105. [ Links ]
Flores, R. D. 1985. Contribución al conocimiento de la biología de las hembras del charal C. humboldtianum (Valenciennes) Pisces: Atherinidae, del embalse Huapango, Edo. de México. Tesis de Licenciatura en Biología, Escuela Nacional de Ciencias Biológicas, IPN, México, 50 pp. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Gallardo–Cabello, M. 1977. Contribución al estudio del Charal de Chapala Chirostoma chapalae, Atherinidae Mugiliformes. Tesis de Licenciatura en Biología, Facultad de Ciencias, UNAM, México. 87 p. [ Links ]
García, E. 2004. Modificaciones al sistema de clasificación climática de Köppen. Serie Libros 6. Instituto de Geografía–UNAM, México. 90 p. [ Links ]
González, B. J. 2002. Descripción de la estructura y ultraestructura del ovario de Chirostoma humboldtiana (Valenciennes, 1835). Tesis de Licenciatura en Biología, Facultad de Estudios Superiores, Iztacala, UNAM. 98 p. [ Links ]Fide Cárdenas, R. 2003. Cultivo de pez blanco Chirostoma humboldtiana. Consideraciones para su producción. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, pp. 191–210. [ Links ]
Gutiérrez–Cabrera, A. E., G. Pulido–Flores, S. Monks & J. S. Gaytán–Oyarzún. 2005. Bothriocephalus acheilognathi Yamaguti, 1934 (Cestoidea: Bothriocephalidae) in freshwater fishes from Metztitlán, Hidalgo, México Hidrobiológica 15 (3): 283–288. [ Links ]
León, F. 2003. Testimonios. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, pp. 252–254. [ Links ]
Ibáñez, A. L., J. L. García–Calderón, A. Pérez Rojas, S. Álvarez Hernández, C. Álvarez Silva & E. Núñez–Portugal. 2002. El Lago de Metztitlán, Hidalgo. In: De La Lanza, G. y J. L. García–Calderón (Comps.). Lagos y Presas de México. Ed. AGT, México, D. F., pp. 253–268. [ Links ]
Miller, R. R., W. L. Minckley, & S. M. Norris. 2005. Freshwater fishes of México. University of Chicago Press. Chicago 490 p. [ Links ]
Moncayo L., M. E., L. R. Flores & A. P. Téllez. 1983. Contribución al conocimiento de la biología del charal Chirostoma humboldtianum (Valenciennes) del embalse Huapango Edo. de México 1981–1982. Resúmenes del VII Congreso Nacional de Zoología. Xalapa, Ver. pp. 121. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Moncayo, R., C. Escalera & V. Segura. 2003. Los pescados blancos del lago de Chapala. Características generales. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, pp. 51–77. [ Links ]
Morelos–López, M. G., V. Segura–García & A. Chacón–Torres. 1994. Desarrollo embrionario del pez blanco de Pátzcuaro Chirostoma estor Jordan, 1873 (Pisces: Atherinidae). Zoología Informa 27:22–46. [ Links ]
Moreno, M. A. 1993. Determinación de la edad, crecimiento y ciclo reproductivo de Chirostoma humboldtianum (Valenciennes), (Pisces: Atherinidae) en el embalse "Cointzio" Mich. Mex. IV Congreso Nacional de Ictiología, 31. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Navarrete S., N. A. 1994. Temporada reproductiva y fecundidad de dos especies de charal C. jordani y C. humboldtianum del Estado de México. Ejercicio calificador. UNAM México. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Navarrete S., N. A. & G. F. Elías. 1995. Reproducción de Chirostoma jordani en el embalse Macua, Edo. de México. Resúmenes del XIII Congreso Nacional de Zoología. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Nikolsky, G. V. 1963. The Ecology of Fishes. Academic Press, London. 352 p. [ Links ]
Palacios–Saucedo, M. C. 1998. Ciclo ovárico y desarrollo embrionario del pez blanco de Zacapu Chirostoma humboldtianum Valenciennes 1835. (Pisces: Atherinidae) en condiciones de cautiverio. Tesis de Licenciatura, Universidad Michoacana de San Nicolás de Hidalgo, Michoacán. [ Links ]Fide Cardenas, R. 2003. Cultivo de pez blanco Chirostoma humboldtianum. Consideraciones para su producción. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, 191–210. [ Links ]
Palacios–Saucedo, M. C. & A. Chacón–Torres. 1998. Biología reproductiva de hembras y desarrollo temprano de Chirostoma humboldtianum. Resúmenes del VI Congreso Nacional de Ictiología. Tuxpan, Ver. pp 18. [ Links ]Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Rauda–Ortega, J. 1987. Contribución al conocimiento de la biología pesquera del charal pinto Chirostoma patzcuaro, Meek 1902 (Pisces Atherinidae) del Lago de Pátzcuaro, Michoacán, México. Tesis de Licenciatura en Biología. Universidad Michoacana de San Nicolás de Hidalgo, Morelia, México. 77 p. [ Links ]
Rojas, P., Ma. de L. Jiménez, M. P. Toledo & L. G. Mares B. 1990. Estimación de algunos parámetros biológico–pesqueros del charal blanco Chirostoma grandocule, Steindacher 1894 (Pisces: Atherinidae) del lago de Pátzcuaro, Mich. In: Compendio de estudios de investigación del Lago de Pátzcuaro, Michoacán. Instituto Nacional de la Pesca. México, pp. 84–106. [ Links ]
Rojas, P. 2006. Aspectos reproductivos del "charal prieto" Chirostoma attenuatum (Meek, 1902) del Lago de Pátzcuaro, Michoacán. Nuevas líneas de investigación en atherinópsidos de México. Hidrobiológica 16 (1): 1–9. [ Links ]
Rosas–Moreno, M. 1976. Datos biológicos de la ictiofauna del lago de Pátzcuaro, con especial énfasis en la alimentación de sus especies. In: Memorias del Simposio sobre pesquerías en aguas continentales. Tuxtla Gtz., Chis 3–5 nov 1976. Instituto Nacional de la Pesca. México, pp. 299–366. [ Links ]
Sachs, L. 1978. Estadistica aplicada. Ed. Labor, Barcelona. 567 p. [ Links ]
Sagarpa. 2002. Anuario estadístico de pesca 2002. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. México. Disponible en internet URL. http://www.sagarpa.gob.mx. [ Links ]
Sánchez, P. S. 1992. Biología reproductiva del charal blanco Chirostoma grandocule (Steindachner, 1894 – Pisces: Atherinidae), del Lago de Pátzcuaro, Michoacán, México. Tesis de Licenciatura en Biología. Universidad Michoacana de San Nicolás de Hidalgo, Morelia, México. 62 p. [ Links ]
Suter, M. 2004. A neotectonic–geomorphologic investigation of the prehistoric rock avalanche damming Laguna de Metztitlán (Hidalgo State, east–central Mexico). Revista Mexicana de Ciencias Geológicas. 21 (3): 397–411. [ Links ]
Torres–Villegas, J. R. 1978. Anatomía e histología del tubo digestivo de Chirostoma promelas con análisis de los hábitos alimenticios. Tesis de Licenciatura en Biología, Escuela Nacional de Ciencias Biológicas, IPN. México. [ Links ] Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pises: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Villagómez, G., H. S. Islas & H. Valencia. 1997. Estudio poblacional de Chirostoma humboldtianum en la Presa Villa Victoria, Edo. de México (Abril de 1994 – Enero de 1995). Resúmenes del V Congreso Nacional de Ictiología. Mazatlán, Sin. pp. 31. [ Links ] Fide Paulo, J. 2000. Situación actual sobre el conocimiento de la Biología del género Chirostoma Swaison (Pisces: Atherinopsidae). Ejercicio predoctoral. Escuela Nacional de Ciencias Biológicas, IPN, México. 213 p. [ Links ]
Villicaña, F. & J. Morales. 2003. Experiencias en el cultivo de pescado blanco Chirostoma promelas en el Centro Acuícola Tizapán el Alto, Jalisco. In: Rojas, P. & D. Fuentes (Comps.). Historia y avances del cultivo de pescado blanco. Instituto Nacional de la Pesca. México, pp. 221–235. [ Links ]
Zar, J. H. 1984. Biostatistical analysis. Prentice Hall International, New Jersey. 718 p. [ Links ]














