Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.17 no.2 Ciudad de México ago. 2007
Artículos
Larvas de moluscos gasterópodos del sur de Quintana Roo, México
Gastropod larvae from the south of Quintana Roo, Mexico
José Juan Oliva Rivera y Alberto de Jesús Navarrete
El Colegio de la Frontera Sur, Unidad Chetumal Departamento de Aprovechamiento y Manejo de Recursos Pesqueros Av. Centenario km. 5.5 A.P. 424 Chetumal, Quintana Roo México. E-mail: joliva@ecosur-qroo.mx
Recibido: 22 de octubre de 2006
Aceptado: 7 de junio de 2007
Resumen
En sus primeras etapas de desarrollo, los caracoles gasterópodos presentan una fase larval plánctica donde su protoconcha sufre transformaciones morfológicas. Dependiendo de cada especie, la concha tiene formas variadas y diferentes tipos de ornamentación que resultan ser un carácter taxonómico importante para su identificación. En este trabajo se describen e ilustran las larvas de gasterópodos recolectadas en muestras de zooplancton en 1996-1998 en Bahía Ascensión, Punta Gavilán, Banco Chinchorro y la Reserva de la Biosfera de Hol-chan en Belice, para la recolección de las muestras, se utilizaron redes de plancton y mediante bombeo. Se encontraron 31 especies que se agruparon en tres órdenes, 18 familias y 20 géneros. La familia Cerithidae fue la mejor representada con tres géneros y siete especies, Naticidae tuvo dos géneros y cuatro especies, en tanto que Epitoniidae tuvo un género y tres especies. Las especies con mayor presencia y distribución fueron Rissoina sp.1, Natica sp. y Limacina sp.
Palabras clave: Moluscos, larvas, Caribe mexicano.
Abstract
In their first development stages, gastropod presents a planktonic larval phase where their proto-shell suffers morphological transformations. Depending on each species, the shell has forms and different types of ornamentation that turn out to be an important taxonomic character for its identification. In this work, plankton gastropod larvae recollected in 1996-1998 at Bahia de la Ascension, Punta Gavilan, Banco Chinchorro and Hol-Chan Marine Reserve in Belize are described and illustrated; samples were collected using plankton nets and a submersible pump. A total of 31 species were found that grouped in three orders, 18 families and 20 genus. The family Cerithidae was the best represented with three genus and seven species, Naticidae had two genus and four species, while Epitoniidae had one genus and three species. Species with higher presence and distribution were Rissoina sp.1, Natica sp. and Limacina sp.
Key words: Mollusks, larvae, Mexican Caribbean.
Introducción
En la etapa larval de los moluscos gasterópodos, a la primera concha se le denomina protoconcha y esta constituida por la primera vuelta o espiral y el ápice, en su fase temprana esta concha es lisa y dependiendo de la especie, a medida que se desarrolla su forma cambia y aparecen ornamentaciones que se vuelven más complejas, por lo que se dice es una característica ancestral o una adaptación para la existencia planctónica (Hickman, 1999 y 2001), de cualquier forma, la ornamentación de la protoconcha es un carácter taxonómico importante, que junto con otros caracteres como la longitud, el numero de vueltas de la concha, la posición de la abertura, y la presencia de un pico, permitirá una identificación plena de los organismos.
En Quintana Roo se reconocen más de 500 especies de caracoles gasterópodos (Vokes & Vokes, 1983) pero se sabe muy poco acerca de las etapas larvales a pesar que son muy abundantes en el plancton marino (Gasca, et al., 1994; de Jesús-Navarrete & Aldana-Arana, 2000).
Los primeros estudios realizados sobre las larvas de este grupo faunístico, incluyeron descripciones de especies con hábitos bénticos. Thiriot-Quievreux (1980) describió 50 especies para la zona de Carolina de Norte; Thiriot-Qievreux & Scheltema (1982) encontraron 42 especies en las costas de Nueva Inglaterra. En el Caribe mexicano, Oliva-Rivera & de Jesús-Navarrete (2000) identificaron 27 especies en Banco Chinchorro, Punta Gavilán y en el Norte de Belice (Reserva de la Biosfera de Hol Chan), mientras que Valtierra-Vega et al. (2000), identificaron 36 especies en el sector centro de la costa de Quintana Roo. No existen más contribuciones en este aspecto para la zona, lo que refleja una carencia de atención hacia este importante grupo. El objetivo de este estudio fue analizar la composición de las larvas en el centro y sur de la costa de Quintana Roo, describirlas y elaborar esquemas para su identificación.
Materiales y métodos
Las recolectas se realizaron en diversos sectores y ambientes del Mar Caribe Noroccidental; la Bahía de la Ascensión (19° 33'-19°42' N y 87°29'- 87° 43' W), Punta Gavilán (18° 21' N y 87° 48' W) y Banco Chinchorro (18° 23'-18° 47' N y 87° 14'-87° 27' W) en Quintana Roo, México y la Reserva de la Biosfera de Hol-Chan en el norte de Belice (Fig. 1). Para la recolección de larvas se utilizaron dos métodos: 1) En los meses de noviembre de 1996, enero de 1997, septiembre de 1997, junio y marzo de 1998, que abarcan las temporadas de nortes, secas y lluvias, se utilizó una red de plancton estándar con luz de malla de 200 µm, que fue arrastrada en círculos, a un metro de profundidad, durante 15 minutos y 2) mensualmente, a partir de noviembre de 1996 hasta diciembre de 1997, se hicieron recolectas por succión con una bomba sumergible, se bombeó agua a un metro de profundidad, recuperando las larvas en un tamiz de 200 µm. Los volúmenes de agua filtrada variaron desde 15 m3 hasta 150 m3. Los organismos capturados se fijaron en una solución de formol al 4 % y se conservaron en viales de vidrio para su estudio. Las larvas fueron identificadas mediante la observación en un microscopio estereoscópico Leika® 2000 y para observar mayores detalles se usó un microscopio compuesto Carl Zeiss®. Se utilizaron las descripciones, claves e ilustraciones de Scheltema (1962), Robertson (1971), Thiriot-Quievreux (1980), Thiriot-Quievreux & Scheltema (1982), Thiriot-Quievreux (1983), Davis et al. (1993), Romero & Valdebenito (2002) para identificar a las especies presentes en las muestras. En las descripciones se tomó en cuenta la forma de la concha, longitud total, tipo y forma de las ornamentaciones, número de vueltas en la espira, presencia o ausencia de canal sifonal y la dirección de la abertura dextrógira y levógira (derecha o izquierda), la presencia de pico y otros caracteres (Fig 2). Los organismos se dibujaron utilizando una cámara clara.
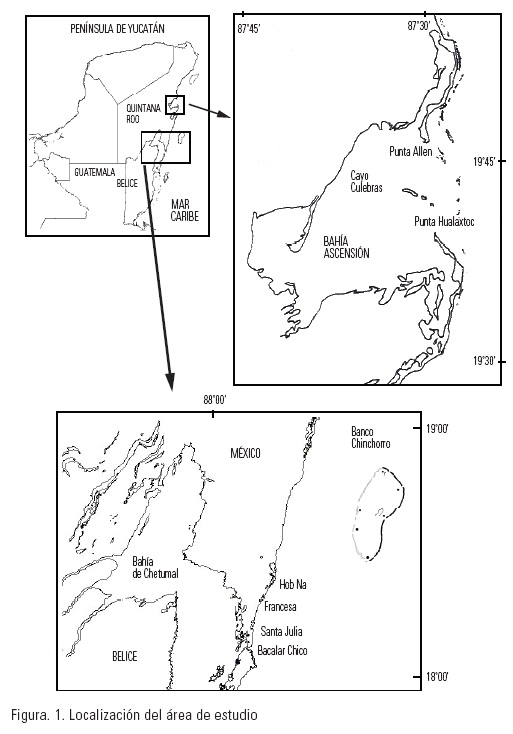

Resultados
Se examinaron un total de 1,820 ejemplares provenientes de las cuatro localidades visitadas, este análisis permitió identificar 31 especies que se agrupan en tres órdenes, 18 familias y 20 géneros, las familias mejor representadas fueron la Cerithidae (tres géneros, siete especies), seguida por Naticidae (dos géneros, cuatro especies) y Epitoniidae (un género, tres especies).
Aunque no se hizo un análisis de abundancia en las áreas estudiadas se pudo determinar que las especies con una mayor frecuencia y distribución fueron Rissoina sp.1 y Natica sp.1.
Descripción de los organismos:
Epitonium sp. 1 (Fig. 3A)
Longitud promedio de la concha 425 µm, forma globosa, con cuatro vueltas, superficie lisa, ápice redondeado, con suturas de la espira de color oscuro, abertura subovalada, dirigida hacia la derecha, sin canal sifonal y sin pico.
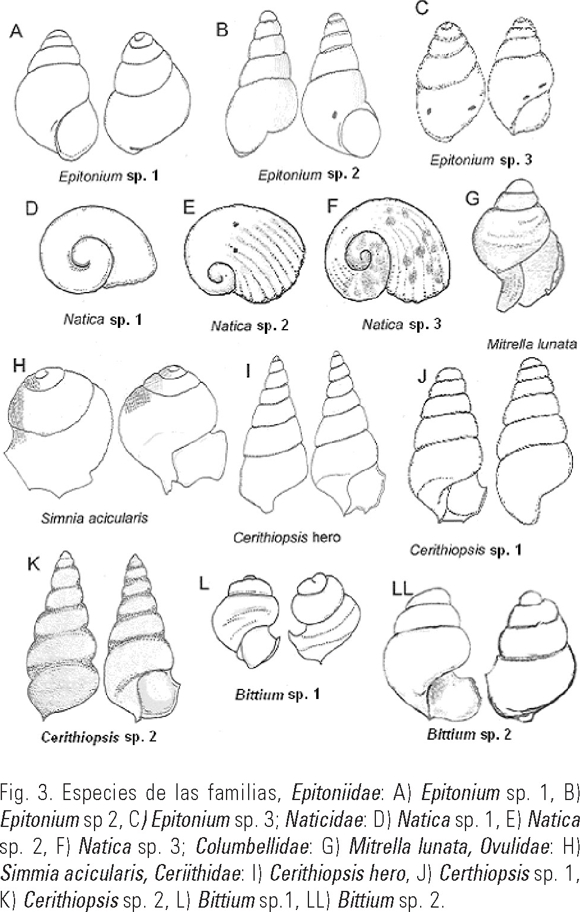
Epitonium sp. 2 (Fig. 3B)
Longitud promedio de la concha 680 µm, forma globosa a cónica, con cinco vueltas, y con ligeros canales longitudinales, suturas ligeramente oscuras, vueltas cerca de la abertura, ligeramente más convexas que las de la columnela, abertura dextrógira, subovalada, sin pico y canal sifonal.
Epitonium sp. 3 (Fig. 3C)
Longitud promedio de la concha 596 µm, de forma alargada y globosa en la parte más ancha formada con cuatro y media vueltas, lisa sin ornamentaciones, abertura subovalada dextrógira, labio delgado sin pico y sin canal sifonal.
Natica sp. 1 (Fig. 3D)
Ancho promedio de la concha 370 µm, de forma globosa ligeramente comprimida, formada por dos y media vueltas, sin ornamentaciones, abertura muy amplia dirigida hacia la derecha, sin canal sifonal.
Natica sp. 2 (Fig. 3E)
Ancho promedio de la concha 350 µm, de forma globosa, con dos vueltas, con surcos de crecimiento ancho y profundo que se extienden a lo largo del cuerpo, la abertura muy amplia dirigida hacia la derecha, sin canal sifonal, de color blanquecino.
Natica sp. 3 (Fig. 3F)
Ancho promedio de la concha 300 µm, de forma globosa, formada por una y tres cuartos de vuelta de color blanquecino grisáceo, con varias manchas irregulares rojizas, abertura amplia dirigida hacia la derecha, sin canal sifonal.
Mitrella lunata Say, 1826 (Fig. 3G)
Longitud promedio de la concha 450 µm, de forma piramidal globosa, con tres y media vueltas, suturas bien marcadas, sin ornamentaciones, ápice redondeado, abertura triangular dextrógira, con un labio grueso hacia los bordes, con canal sifonal grueso y curvo hacia fuera, con una serie de surcos a lo largo del canal.
Simnia acicularis Lamarck, 1810 (Fig. 3H)
Longitud promedio de la concha 547 µm, de forma globosa, con dos y media vueltas, de color marrón claro, ornamentaciones muy visibles formadas por una serie de costillas longitudinales y transversales que aparentan una red, abertura dextrógira de forma subcuadrada y un labio con pico rectangular con los bordes ligeramente sinuosos, canal sifonal pobremente desarrollado.
Cerithiopsis hero Bartsch, 1911 (Fig. 3I)
Longitud promedio de la concha 749 µm, cónica muy alargada, con siete y media vueltas, de color blanquecino y en color castaño en las suturas y la columnuela, partes bajas de las últimas vueltas planas, sin ornamentaciones, abertura dextrógira de forma subcuadrada, pico poco desarrollado sinuoso, canal sifonal poco desarrollado.
Cerithiopsis sp. 1 (Fig. 3J)
Longitud promedio de la concha 576 µm, de forma cónica alargada con cinco y media vueltas, ápice redondeado, suturas oscuras bien marcadas, sin ornamentaciones, abertura dextrógira subcuadrada con un pico ligeramente desarrollado con bordes cuadrados y con pequeñas costillas longitudinales poco marcadas.
Cerithiopsis sp. 2 (Fig. 3K)
Longitud promedio de la concha 730 µm de forma cónica con siete vueltas, color blanquecino, superficie lisa sin ornamentaciones las suturas bien marcadas profundas, abertura dextrógira, subcuadrada; con los bordes sinuosos y delgados y con costillas longitudinales.
Bittium sp. 1 (Fig. 3L)
Longitud promedio de la concha 326 µm de forma globosa con tres y media vueltas con surcos marcados a lo largo de la ultima vuelta, suturas marcadas, abertura dextrógira, de forma subcuadrada y un pico prominente y ancho con los márgenes cuadrados, presenta una serie de canales a lo ancho del pico, sin canal sifonal.
Bittium sp. 2 (Fig. 3LL)
Longitud promedio de la concha 400 µm de forma globosa con cuatro vueltas la segunda y tercer vueltas anchas, el ápice es redondeado, cuerpo liso, sin ornamentaciones, abertura dextrógira presenta un pico desarrollad de forma rectangular y ancho, con los bordes redondeados, sin canal sifonal.
Cerithium atratum Born, 1778 (Fig.4A)
Longitud promedio de la concha 346 µm el cuerpo es globoso, ligeramente alargado, formado por tres y media vueltas, ornamentaciones muy llamativas, costillas verticales y horizontales intercaladas con algunas quillas más gruesas, abertura dextrógira pequeña de forma cuadrada y un pico rectangular con quillas longitudinales bien marcadas, sin canal sifonal.

Cerithium sp.1 (Fig. 4B)
Longitud promedio de la concha 500 µm de forma globosa, formado por tres a cuatro vueltas, presenta ornamentaciones bien marcadas, con costilla verticales y horizontales fuertes, algunas de las quillas ligeramente más gruesas, abertura pequeña dextrógira, con un pico rectangular, doblado hacia adentro y bordes cuadrados.
Rissoina sp. 1 (Fig. 4C)
Longitud promedio de la concha 450 µm, de forma globosa con tres y media vueltas, con costillas o quillas bien marcadas en la última y penúltima vueltas, abertura dextrógira amplia, labio grueso con los bordes rectos, canal sifonal poco desarrollado.
Rissoina sp. 2 (Fig 4D)
Longitud promedio de la concha 670 µm de forma globosa ligeramente alargados con tres y media vueltas, ornamentaciones levemente marcadas por unas líneas en la penúltima y última vueltas, abertura dextrógira con un pico ligeramente desarrollado con los bordes cuadrados, canal sifonal poco desarrollado.
Triphora nigrocincta Adams, 1839 (Fig. 4E)
Longitud promedio de la concha 615 µm de forma cónica alargada, formada por cinco y media vueltas, con ornamentaciones muy llamativas, formadas por costillas horizontales y verticales que dan la apariencia de un "panal de abejas", ápice redondeado, abertura levógira de forma irregular con pico medianamente largo y sinuoso en sus bordes, canal sifonal bien marcado.
Alaba incerta Orbigny, 1842 (Fig. 4F)
Longitud promedio de la concha 634 µm de forma globosa, columnela cónica, ápice redondo romo, ornamentaciones marcadas muy llamativas, con costillas verticales largas y el hueco entre ellas es profundo, abertura dextrógira de forma redonda, con un pico grueso rectangular mediano y doblado hacia adentro, sin canal sifonal.
Litiopa sp. (Fig. 4G)
Longitud promedio de la concha 590 µm, de forma globosa con más de seis vueltas y numerosas ornamentaciones bien marcadas, con costillas transversales gruesas y entre estas costillas delgadas combadas hacia abajo, abertura hacia la derecha de forma circular con un pico rectangular que se ensancha hacia el extremo.
Seila adamsi Lea, 1845 (Fig. 4H)
Longitud promedio de la concha 400 µm, de forma cónica, con cinco a seis vueltas poco marcadas y ornamentaciones formadas por costillas gruesas horizontales y delgadas verticalmente, abertura dextrógira de forma irregular y un pico conspicuo sinuoso, sin canal sifonal.
Aphorrais occidentalis Beck, 1836 (Fig. 4I)
Longitud promedio de la concha 700 µm de forma cónica, formada con dos y media a tres vueltas cortas y ligeramente deprimidas, cuerpo liso sin ornamentaciones, abertura dextrógira y muy amplia, con pico muy largo, delgado y puntiagudo con canales a lo largo de este, canal sifonal desarrollado y ligeramente doblado hacia la izquierda.
Strombus raninus Gmelin ,1791 (Fig. 4J)
Longitud promedio de la concha 900 µm en organismos en su ultima etapa larvaria, de forma globosa y alargados y con cuatro y media a cinco vueltas, concha ornamentada con finas líneas transversales en la ultima vuelta, abertura hacia dextrógira amplia y subovalada con los bordes redondeados y con algunos surcos, canal sifonal recto bien formado.
Strombus gigas Linnaeus, 1758 (Fig. 4K)
Longitud promedio de la concha 250 µm de forma cónica y con tres a tres y media vueltas de color crema translucido, con pequeños gránulos, abertura dextrógira muy amplia y un pico largo con terminación subcuadrada y cuatro a cinco canales longitudinales, presenta un canal sifonal bien formado y recto.
Nassarius albus Say, 1826 (Fig. 4L)
Longitud promedio de la concha 550 µm de forma globosa y tres vueltas, de color amarillo pálido, abertura dextrógira con un pico ancho que termina en punta y marcado con surcos longitudinales, canal sifonal bien desarrollado, dirigido hacia la izquierda y muy ancho, con pequeñas ornamentaciones formadas por líneas longitudinales.
Nassarius sp. (Fig. 4LL)
Ancho promedio de la concha 300 µm, de forma globosa deprimida superficie lisa, sin ornamentaciones aparentes, una pequeña mancha obscura casi en el centro de la primera vuelta, organismos pequeños aparentemente en las primeras etapas de desarrollo, formado por una sola vuelta, abertura muy amplia y levógira, pico agudo conspicuo,
Caecum sp. (Fig. 5A)
Longitud promedio de la concha 300 µm de forma tubular con ornamentaciones formadas por costillas al rededor que forman canales profundos a largo de la concha y que terminan en una punta semi aguda, color blanco translúcido, abertura redonda amplia.
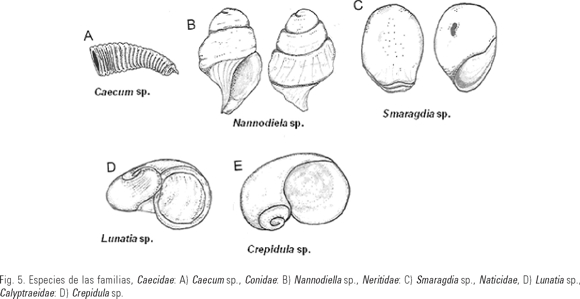
Nannodiella sp. (Fig. 5B)
Longitud promedio de la concha 620 µm, de forma cónica, formada por tres y media vueltas, de color oscuro, y café pálido en las suturas y la columnela, algunas partes del cuerpo con coloración rojiza, con ornamentaciones en el canal sifonal y la primera vuelta, consistentes en líneas longitudinales más o menos gruesas, abertura dextrógira amplia y ovalada con los bordes del labio sinuosos, canal sifonal desarrollado y dirigido ligeramente hacia la izquierda.
Smaragdia sp. (Fig. 5C)
Longitud promedio de la concha 430 µm de formas globosa, formada por una y media vueltas ligeramente granulada, de color café claro y una mancha de oscura fácilmente distinguible a mitad de la concha, abertura dextrógira subovalada amplia, con un borde sinuoso formado por dos a tres capas, sobre la concha y cerca de la abertura con una serie de líneas delgadas cerca del labio.
Lunatia sp. (Fig.5D)
Ancho promedio de la concha 300 µm, larga y espiralada, deprimida, compuesta por una y media vueltas hacia la derecha, lisa de color blanco translúcido presenta ligeros surcos al rededor de los espirales y con una abertura amplia y redondeada.
Crepidula sp. (Fig. 5E)
Ancho promedio de la concha 350 µm de forma espiralaza y deprimida, con una y media vueltas marcadas por pequeños surcos a lo largo del cuerpo, Longitud de la concha casi transparentes, abertura muy grande sin pico, sin canal sifonal.
Discusión
La forma y tipo de ornamentación de la concha de las larvas, se reconocen como caracteres de gran valor taxonómico (Thiriot-Quievreux, 1983; Romero & Valdebenito, 2002). Por lo anterior, es necesario mantenerlas intactas, para no alterar su apariencia física y composición química, que ocasione la pérdida de algunas de sus características. Por lo anterior, es muy recomendable preservar a las larvas en una solución de formol al 4% neutralizada (Davis et al., 1993) y un manejo muy cuidadoso al ser observadas al microscopio ya que algunas son extremadamente frágiles. Durante su desarrollo y hasta la etapa previa a su asentamiento, las larvas de moluscos presentan un marcado polimorfismo, es decir presentan una serie de cambios en su forma y tipo de ornamentación a mediada que estas se desarrollan lo que provoca que se dificulte su identificación taxonómica. Algunas especies encontradas en el área de estudio, de la familia Epitoniidae, tienen una superficie lisa en los primeros días después de la eclosión y a medida que se desarrollan, esta superficie se transforma en una red de intrincadas ornamentaciones. Otra característica que cambia durante el desarrollo es el número de vueltas de la concha. En especimenes de Seila adamsi observados en este estudio, la concha se encuentra formada por seis vueltas promedio, mientras que Thiriot-Quievreux (1980) registra únicamente cinco vueltas, lo que puede corresponder a un estadio más temprano de desarrollo. Las larvas del género Natica recolectadas en este trabajo son muy similares morfológicamente y es común que por esta razón en el pasado se hayan cometido errores de identificación. Valtierra-Vega et al. (2000) describieron cuatro especies de este género para la misma zona; sin embargo, cuando se revisó este material, se logró diferenciar sólo tres especies. Algunas características, como el número de vueltas y las tenues ornamentaciones, hacen la diferencia entre una especie y otra.
Alaba incerta y Litiopa sp. son especies morfológicamente muy similares y resultaron muy difíciles de distinguir; sin embargo, la observación cuidadosa revela diferencias en el tamaño y los tipos de escultura en su concha, en A. incerta las costillas longitudinales son más largas y con gránulos entre ellas, mientras que en Litiopa sp. se encuentran acompañadas con una serie de costillas transversales cortas y cóncavas, características que coinciden con lo observado por Robertson (1971). Para resolver el problema de la polimorfía en una misma especie es recomendable hacer descripciones de las distintas etapas de desarrollo, Scheltema (1962) y Davis et al. (1993) trabajaron con diferentes etapas de desarrollo de caracoles del género Nassarius y tres especies de caracoles de la familia Strombidae, facilitando de este modo su identificación.
Las observaciones hechas con un microscopio compuesto, junto con fotografías en artículos publicados por varios autores y esquemas de las especies, fueron una herramienta útil para determinar las especies estudiadas; sin embargo, es una limitante cuando se quiere hacer un trabajo taxonómico más fino, ya que cuando los organismos son muy parecidos en forma, talla y tipo de ornamentaciones, es necesario tener una mejor perspectiva de estos, que sólo es posible mediante el uso de un microscopio electrónico.
En Quintana Roo, se han identificado más de 500 especies de caracoles (Vokes & Vokes, 1983), sin embargo, los estudios sobre larvas son realmente escasos. Las 34 especies de larvas registradas en este trabajo representan apenas el 6.7 % del total, lo que es significativamente bajo e indica que se requiere mayor atención a este grupo en su fase larval.
Este es un primer esfuerzo que se realiza en las costas del Caribe mexicano, sin embargo, se pretende a futuro el estudio sobre patrones de distribución y abundancia de las especies así como conocer su relación con los factores bióticos y abióticos. El estudio taxonómico y ecológico de las larvas de gasterópodos representa un reto interesante para los biólogos y taxónomos, ya que aun falta mucho por hacer para las aguas del Caribe. Es claro que un mejor conocimiento de su desarrollo y forma de vida permitirá avanzar firmemente hacia el entendimiento completo de la dinámica ecológica del plancton marino.
Agradecimientos
Al Dr. Eduardo Suárez Morales y a la Biól. Marina Emilia González Vallejo, que con sus comentarios permitieron enriquecer este trabajo, agradezco al M. en C. Alejandro Medina Quej y a la Biól. María Teresa Valtierra Vega por su valiosa ayuda en la recolección del material en el campo y la separación de las muestras en el laboratorio.
Referencias
DAVIS, M., C. A. BOLTON & A. W. STONER. 1993. A comparison of larval development, growth, and shell morphology in three Caribbean Strombus species. The Veliger 36(3):236-244. [ Links ]
DE JESÚS-NAVARRETE, A. & D. ALDANA-ARANA. 2000. Distribution and abundance of Strombus gigas veligers at six fishing sites on Banco Chinchorro, Quintana Roo, Mexico. Journal of Shellfish Research 19(2):891-895. [ Links ]
GASCA, R., E. SUÁREZ-MORALES & L. VÁSQUEZ-YEOMANS. 1994. Estudio comparativo del zooplancton (biomasa y composición) en dos bahías del Mar Caribe mexicano. Revista de Biología Tropical 42:595-604. [ Links ]
HICKMAN, C.S. 1999. Adaptative function of gastropod larval shell features. Invertebrate Biology 118:346-356. [ Links ]
HICKMAN, C.S. 2001. Evolution and development of gastropod larval shell morphology: experimental evidence for mechanical defence repair. Evolution and Development 3:18-23. [ Links ]
OLIVA-RIVERA, J. J. & A. DE JESÚS-NAVARRETE. 2000. Composición, distribución y abundancia de larvas de moluscos gasterópodos en el sur de Quintana Roo y norte de Belice. Revista de Biología Tropical 48(4):777-783. [ Links ]
ROBERTSON, R. 1971. Scanning electron microscopy of planktonic larval marine gastropod shells. The Veliger 14:1-12. [ Links ]
ROMERO, M.S. & E. L. VALDEBENITO. 2002. Larvas veliger de gastrópodos Prosobranchia provenientes de Punta Lobos, cuarta región, Chile. Revista Chilena de Historia Natural (75):491-514. [ Links ]
SCHELTEMA, R. S. 1962. Pelagic larvae of New England Intertidal Gastropods I. Nassarius obseletus Say and Nassarius vivex Say. Transactions of American Microscopical Society 81(1):1-11. [ Links ]
THIRIOT-QUIÉVREUX, C. 1980. Identification of some planktonic prosobranch larvae present off Beaufort, North Carolina. The Veliger 23:1-9. [ Links ]
THIRIOT-QUIÉVREUX, C. 1983. Summer meroplanktonic prosobranch larvae occurring off Beaufort, Nort Carolina. Estuaries 6:387-398. [ Links ]
THIRIOT-QUIÉVREUX, C. & R. S. SCHELTEMA. 1982. Planktonic larvae of New England gastropods. V. Bittium alternatum, Thriphora nigrocincta, Cerithiopsis emersoni, Lunatia heros and Crepidula plana. Malacología 23(1):37-46. [ Links ]
VALTIERRA-VEGA, M.T., DE JESÚS-NAVARRETE, A. & J. J. OLIVA-RIVERA. 2000. Análisis de la composición, distribución y abundancia de larvas de moluscos gasterópodos, en la costa sur de Quintana Roo. México. Universidad y Ciencia 16(32):27-34. [ Links ]
VOKES, E.& H. VOKES. 1983. Distribution of shallow-water marine mollusca, Yucatan Peninsula, Mexico. Middle American Research Institute 54:1-183. [ Links ]














