Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.16 no.2 Ciudad de México Ago. 2006
Evaluación ecológica de las comunidades de peces en dos sistemas lagunares estuarinos del sur de Chiapas, México
Ecological evaluation of fish community in two lagoon-estuarine systems of the south of Chiapas, Mexico
Silvia Díaz-Ruiz1, Arturo Aguirre-León2 y Enrique Cano-Quiroga1
1 Laboratorio Ictiología y Ecología Costera, Depto. Hidrobiología, UAM-Iztapalapa, A. P. 55-535, México 09340, D. F. Fax: (5) 804 4738. E-mail: sdr@xanum.uam.mx, kqe70@hotmail.com
2 Laboratorio Ecología Costera y Pesquerías, Depto. El Hombre y su Ambiente, UAM-Xochimilco, A. P. 23-181, México 04960, D. F. Fax: (5) 4837469. e-mail: agla1269@correo.xoc.uam.mx
Recibido: 8 de marzo de 2005
Aceptado: 5 de diciembre de 2005
RESUMEN
En los sistemas lagunares costeros Carretas-Pereyra y Chantuto-Panzacola, Chiapas, México, fue realizado un estudio sobre aspectos ecológicos de las comunidades de peces. En Chantuto-Panzacola se recolectaron un total de 1,456 peces de 31 especies entre marzo y noviembre de 1997. En Carretas-Pereyra se colectaron un total de 3,081 peces, representados por 19 especies, entre febrero y noviembre de 1998. En cada laguna costera se observaron diferentes valores de diversidad y abundancia relacionados con las características ambientales y biológicas de estos sistemas. En Carretas-Pereyra los valores más altos se presentaron en noviembre y abril con H' = 1.8, D = 2.06, biomasa 0.89 g/m2, densidad 0.30 ind/m2 y peso promedio 4.99 g/ind. En Chantuto-Panzacola, los valores más altos se registraron en el mes de marzo con H'= 2.67, D = 3.89 sp/ind, biomasa 1.88 g/m2, densidad 0.25 ind/m2 y peso promedio 7.55 g/ind. Se encontraron diferencias significativas (ANOVA y Tukey, p< 0.05) entre los parámetros ecológicos y las variables ambientales de ambos ecosistemas en los meses de estudio. El análisis discriminante múltiple, mostró que la salinidad y el oxígeno disuelto son los factores más importantes en la variación de la comunidad de Carretas-Pereyra, mientras que la temperatura y la salinidad son los factores más importantes en la comunidad de Chantuto-Panzacola. La frecuencia de aparición y distribución espacial de los peces, permitió definir conjuntos ictiofaunísticos formados por diferentes grupos de peces que habitan estos sistemas. Se definieron 5 especies dominantes en Carretas-Pereyra y 9 en Chantuto-Panzacola, representando el 72 % y 71 % en número y el 81% y 76% en peso de la captura total, respectivamente. Estas especies son Achirus mazatlanus, Atherinella guatemalensis, Caranx hippos, Cathorops fuerthi, Centropomus robalito, Cichlasoma macracanthum, Cichlasoma trimaculatum, Gobiomorus maculatus, Gobionellus microdon y Lile gracilis.
Palabras clave: Diversidad, abundancia, conjuntos ictiofaunísticos, Carretas-Pereyra, Chantuto-Panzacola, Chiapas.
ABSTRACT
In the Carretas-Pereyra and Chantuto-Panzacola systems, Chiapas, Mexico, was carried out studies of fish communities. In Chantuto-Panzacola system between March and November of 1997 a total of 1456 fish represented by 31 species were collected. In Carretas-Pereyra system between February and November of 1998, were collected a total of 3081 fish represented by 19 species. Each coastal lagoon has different values of diversity and abundance related to the environmental and biological characteristics of these estuarine systems. Carretas-Pereyra present its high community values in November and April with H' = 1.8, D = 2.06, biomass = 0.89 g/m2, density = 0.30 ind/m2 and average weight = 4.99 g/ind. Chantuto-Panzacola present its high community values in March with H' = 2.67, D = 3.89, biomass = 1.88 g/m2, density = 0.25 ind/m2 and average weight = 7.55 g/ind. Significant differences (ANOVA and Tukey, p<0.05) were found between the ecological parameters and the environmental variables of both ecosystems in the months of study. The multiple discriminant analysis showed that salinity and dissolved oxygen were the most important factors in variation of the community of Carretas-Pereyra, while temperature and salinity were the most important factors in Chantuto-Panzacola. The frequency analysis and spatial distribution of the fish allowed defining fish assemblages formed by several groups of species that inhabit these systems. Five species were defined as dominant for Carretas-Pereyra and nine for Chantuto-Panzacola, representing 72% and 71% in number and the 81% and 76.4% in weight of the total catch respectively. These species were Achirus mazatlanus, Atherinella guatemalensis, Caranx hippos, Cathorops fuerthi, Centropomus robalito, Cichlasoma macracanthum, Cichlasoma trimaculatum, Gobiomorus maculatus, Gobionellus microdon and Lile gracilis.
Key words: Diversity, abundance, fish assemblages, Carretas-Pereyra system, Chantuto-Panzacola system, Chiapas.
INTRODUCCIÓN
El Golfo de Tehuantepec es una región importante para estudios ecológicos en México, puesto que es una de las principales áreas pesqueras del Pacífico, con gran actividad turística e industrial, incluyendo la actividad petrolera. En la región se localizan sistemas lagunares-estuarinos que se caracterizan por su alta riqueza de recursos biológicos. Debido a esto, es una zona prioritaria para evaluar biológica y ecológicamente los sistemas lagunares y sus recursos.
Se ha discutido ampliamente que los sistemas lagunares-estuarinos de la zona costera tropical se caracterizan por una compleja estructura ecológica, por su gran variedad de hábitats para numerosas especies de invertebrados (moluscos y crustáceos) y de vertebrados (aves, mamíferos y peces) que utilizan intensamente estos ambientes para alimentación, crecimiento, reproducción y como áreas de refugio y protección (Lara-Domínguez & Yáñez-Arancibia, 1999). En particular, los peces usan las lagunas costeras y estuarios en alguna etapa de su ciclo de vida (Yáñez-Arancibia et al., 1985; Díaz-Ruiz et al., 2003), funcionando como reguladores energéticos a través de complejas interacciones biológicas entre ellos y los diferentes hábitats del ecosistema. Dichas interacciones reflejan patrones de utilización de los hábitats lagunares-estuarinos por las comunidades de peces (Yáñez-Arancibia et al., 1985, 1993), lo que influye en la estacionalidad de la biomasa, diversidad, distribución y frecuencia de las poblaciones de peces relacionadas a la heterogeneidad espacial de estos ecosistemas (Yáñez-Arancibia et al., 1993; Lara-Domínguez & Yáñez-Arancibia 1999; Díaz-Ruiz et al., 2003). Actualmente, muchas de estas especies son explotadas o constituyen recursos pesqueros potenciales.
En particular los sistemas lagunares Carretas-Pereyra y Chantuto-Panzacola en la costa sur de Chiapas en el Golfo de Tehuantepec, se ubican en la Reserva de la Biosfera "La Encrucijada" una de las regiones de humedales más rica, diversa y productiva del país (INE-SEMARNAP, 1999). Estas lagunas se caracterizan por su alto valor biológico potencial y elevada producción de recursos pesqueros. En estos sistemas la actividad pesquera artesanal es intensa y está dirigida principalmente al camarón (Secretaría de Pesca, 1994). La pesca de escama para consumo local incluye róbalo (Centropomus nigrescens Günter, 1868; C. robalito Jordan & Gilbert, 1882), lisa (Mugil cephalus Linnaeus, 1758; M. curema Cuvier & Valenciennes, 1836) y mojarra (Cichlasoma macracanthum Günter, 1864). Por estas características, Carretas-Pereyra y Chantuto-Panzacola representan áreas con necesidades de investigación ecológica básica y aplicada, puesto que la información de estos sistemas es escasa y aún se desconocen aspectos de la estructura y función de las comunidades de peces, las relaciones ecológicas y biológicas especies-hábitats y la interpretación ecológica del sistema y su dinámica ambiental, así como, los cambios naturales y/o producidos por actividades antropogénicas (pesca-turismo-urbanización) (Díaz-Ruiz et al., 2004). Por estas razones las investigaciones en estos sistemas costeros deben estar orientadas al conocimiento preciso de las especies, a caracterizar y cuantificar el valor del sistema y sus recursos, para establecer las bases científicas que proporcionen estrategias y alternativas de manejo y conservación de uso planificado a largo plazo en contraste con las necesidades del desarrollo socioeconómico de la zona costera de Chiapas.
Para la región del Pacífico sur mexicano, los trabajos sobre evaluación ecológica de las comunidades de peces son escasos. No obstante, existen algunos estudios que contienen información valiosa sobre ictiofauna en estas costas del Golfo de Tehuantepec, como los de Ramírez-Hernández et al. (1964), Chávez (1979), Castro-Aguirre (1982), Bianchi (1991) y Díaz-Ruiz et al. (2004) quienes evalúan de manera particular aspectos de la estructura de las comunidades de peces en sistemas lagunares de las costas de Chiapas. Con base en estos estudios, es posible precisar que sólo algunos se refieren en particular a esta región costera, lo cual refleja la escasez de información sobre composición, diversidad, distribución y abundancia de la ictiofauna de los sistemas lagunares de Chiapas y la plataforma continental adyacente. Por lo tanto, el presente estudio tiene por objetivos para cada laguna: 1) determinar la composición de la ictiofauna, 2) analizar la estructura de la comunidad de peces y su relación con algunas variables ambientales, 3) el análisis ecológico de las especies dominantes y 4) definir los conjuntos de peces de estos sistemas.
ÁREA DE ESTUDIO
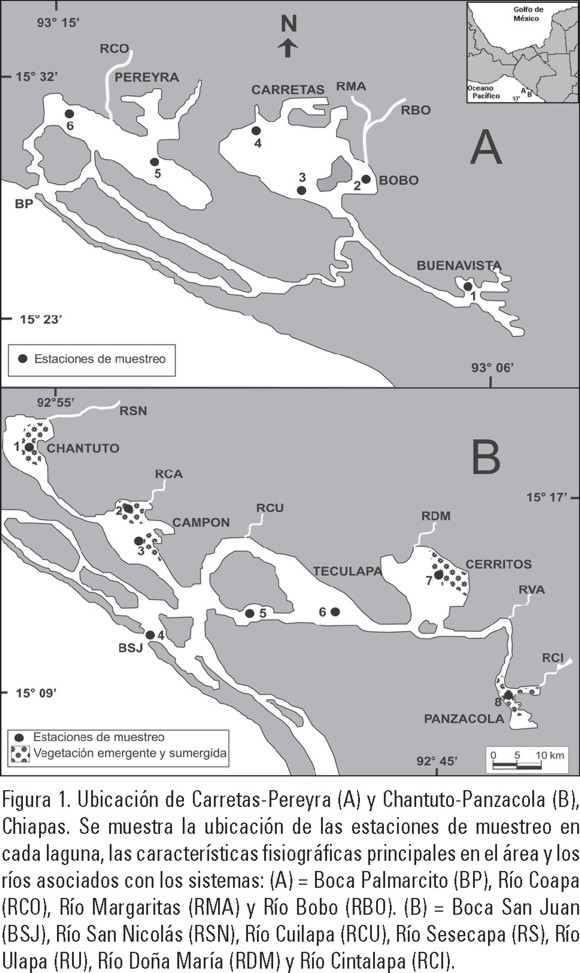
La región de estudio se ubica en el Golfo de Tehuantepec, Pacífico mexicano, en la costa sur de Chiapas. El sistema lagunar-estuarino Carretas-Pereyra se localiza entre los 15° 23' y 15° 32' N y 93° 06' y 93° 15' W. Este sistema tiene una extensión de 36.96 km2 y está conformado por cuatro lagunas principales: Pereyra, Carretas, Bobo y Buenavista. Se conecta con el mar a través de la Boca Palmarcito y recibe la descarga de varios ríos denominados: Coapa (RCO), Margaritas (RMA) y Bobo (RBO) (Fig. 1A). El sistema lagunar-estuarino Chantuto-Panzacola se localiza entre los 15° 09' y 15° 17' N y 92° 45' y 92° 55' W. El sistema tiene una extensión de 180 km2 y está conformado por cinco lagunas principales: Chantuto, Campón, Teculapa, Cerritos y Panzacola. Se conecta con el mar a través de la Boca San Juan (BSJ) y recibe la descarga de varios ríos de pequeño caudal denominados: San Nicolás (RSN), Cacaluta (RCA), Cuilapa (RCU), Doña María (RDM) y Cintalapa (RCI) (Fig. 1B). El clima de la región es tropical Am (f) w, cálido húmedo, lluvioso en verano y seco en invierno. Se reconocen dos épocas climáticas en la región: lluvias de mayo a noviembre y secas de diciembre a abril. Existen diferentes ambientes como pantanos de manglar salobre y de baja salinidad distribuidos alrededor de estos ecosistemas, vegetación emergente y sumergida (i.e. Eichornea crassipes Martius, Nymphaea ampla Salisbury de Candolle, Pistia stratiodes Linnaeus, Salvinia sp. Seguiré, Cyperus sp. Linnaeus, Thypha dominguensis Steudel, Scirpus validus Vahl, en Chantuto-Panzacola (estaciones 1, 2, 3, 7, 8) y áreas de alta sedimentación. Amplios detalles de esta síntesis se encuentran en los trabajos de García (1988), INE-SEMARNAT (1999), Varona-Cordero & Gutiérrez Mendieta (2003), Díaz-Ruiz et al., (2004).
MATERIALES Y MÉTODOS
Actividades de Campo. En Carretas-Pereyra las recolecciones de peces se efectuaron en seis estaciones de muestreo durante los meses de febrero, abril, junio y noviembre de 1998 (Fig. 1A). En Chantuto-Panzacola las recolectas de peces se efectuaron en ocho estaciones de muestreo en los meses de marzo, mayo, julio y noviembre de 1997 (Fig. 1B). Las capturas en ambas lagunas fueron diurnas en profundidades promedio de 0.86 y 1.80 m, en cada estación se realizó un lance utilizando un chinchorro playero de 60 m de largo, caída de 2.0 m, luz de malla de 1.9 cm en el copo y 1.5 cm en las alas. Las muestras fueron fijadas en formaldehído al 10 % neutralizado con borato de sodio. En cada estación se registró la temperatura con un termómetro de cubeta (precisión 0.1 °C), la salinidad y el oxígeno disuelto con un medidor de calidad de agua YSI-3800 calibrado de acuerdo a las técnicas de APHA (1989), la transparencia y profundidad de la columna de agua con un disco de Secchi y una sondaleza, respectivamente.
Actividades de Laboratorio. La determinación taxonómica se realizó empleando literatura específica del Pacífico y Golfo de Tehuantepec, principalmente los trabajos de Chirichigno et al. (1982), Fischer et al. (1995), Amezcua-Linares (1996) y Castro Aguirre et al. (1999). El orden sistemático se basó en el criterio de Nelson (1994). Se analizaron los siguientes parámetros ecológicos de la comunidad: diversidad H' (Shannon & Wiener, 1963), riqueza de especies D (Margalef, 1969) y equitatividad J' (Pielou, 1966). Fue estimada la biomasa (g peso húmedo/m2), la densidad (ind/m2) y el peso promedio (g/ind) este último, como una proporción del peso total y el número total de individuos; además, se determinó la dominancia de las especies a través de la frecuencia de aparición (Yáñez-Arancibia et al., 1985).
Análisis Estadísticos. Los parámetros fisicoquímicos como los parámetros ecológicos de la comunidad se compararon entre meses de estudio, previamente fue evaluada la homocedasticidad entre las muestras utilizando una prueba de Levene (1960). En los casos necesarios se efectuaron transformaciones a logaritmos naturales. Los datos con varianza homogénea entre grupos se evaluaron mediante análisis de varianza (ANOVA) con un nivel de significancia p< 0.05 (Daniel, 1997); de resultar diferencias significativas se procedió a determinar entre que meses, parámetro ambiental o parámetro ecológico, utilizando la prueba de Tukey (Montgomery, 1984).
Se aplicó análisis discriminante múltiple por pasos (forward) para identificar el subconjunto de variables que maximizaran las diferencias significativas (p< 0.05) entre los meses de estudio (Tatsuoka, 1970; Ludwing & Reynolds, 1988; Zar, 1999), con respecto a los factores ambientales como con la variación de los parámetros ecológicos de la comunidad de peces. Los análisis estadísticos se realizaron con el paquete STATISTICA versión 6.0 para Windows. Con la información obtenida sobre la presencia/ ausencia de las especies se efectuó análisis de agrupamiento (cluster) para definir conjuntos ictiofaunísticos; se utilizó el coeficiente de asociación de Jaccard aplicando el paquete de computación ANACOM (De la Cruz-Agüero, 1994).
RESULTADOS
Parámetros Fisicoquímicos. Carretas-Pereyra: las variaciones espacio-temporales de los parámetros físico-químicos en esta laguna se resumen en la Tabla 1. La salinidad promedio más alta del sistema se registró en las estaciones 5 y 6 con valores de 17.3 ups y 18.2 ups, respectivamente; mientras que en la estación 1 siempre se determinaron valores de 0.0. En escala temporal el valor promedio más alto se registró en junio con 32 ups, y el más bajo en noviembre con 1.3 ups, ambos meses de la temporada lluviosa. El ANOVA indico diferencias entre los meses analizados, la prueba de Tukey señaló que fueron entre febrero-abril (p= 0.001), febrero-junio (p= 0.0002), abril-noviembre (p= 0.005) y junio-noviembre (p= 0.0004). Este sistema es somero con valores promedio de profundidad de 0.71 m (febrero) a 1.03 m (noviembre), está influenciado principalmente por la descarga de agua dulce de los ríos locales. La temperatura del agua presentó los valores promedio más altos en la estación 5 con 32.6 °C, y los más bajos en la estación 2 con promedio de 30.8 °C. En los meses de estudio la temperatura promedio fue mayor en junio con 32.5°C y menor en febrero con 29.7°C. El ANOVA y la prueba de Tukey indicaron diferencias entre febrero-abril (p= 0.0002), febrero-junio (p= 0.0004) y febrero-noviembre (p= 0.0007). El oxígeno disuelto promedio más alto se registró en la estación 5 con 7.0 mg/l, y el más bajo en la estación 3 con 3.9 mg/l. El valor promedio anual más alto, fue registrado en noviembre con 8.5 mg/l y él más bajo en junio con 2.4 mg/l. El ANOVA y la prueba de Tukey señalaron diferencias entre febrero-noviembre (p= 0.015), abril-junio (p= 0.024) y junio-noviembre (p= 0.0003). La transparencia de la columna de agua varió en el sistema durante los meses de estudio, de 21 a 100%. El ANOVA no indico diferencias entre los meses analizados.

Chantuto-Panzacola: las variaciones espacio-temporales de los parámetros físicos y químicos se resumen en la Tabla 2. La salinidad promedio más alta del sistema se registró en las estaciones 4 y 5 con valores de 31.8 ups y 31.5 ups, respectivamente; mientras que la más baja se presentó en la estación 8 con promedio de 6.8 ups. La salinidad promedio del agua presentó un intervalo de 26.5 ups en marzo a 10.6 ups en noviembre. El ANOVA indicó diferencias entre los meses analizados, la prueba de Tukey señaló que fueron entre marzo-noviembre (p= 0.027) y mayo-noviembre (p= 0.030). Este sistema está influenciado principalmente por la entrada de agua salada del Golfo de Tehuantepec y por el aporte de agua dulce de ríos adyacentes, las profundidades promedio registradas fueron entre 1.30 m (mayo) a 2.18 m (marzo). La temperatura del agua presentó los valores promedio más altos en las estaciones 1 y 6 con 32.2 °C y 31.8 °C, respectivamente; mientras que los más bajos en las estaciones 3 y 5 con promedio de 30.2 °C. En los meses de estudio la temperatura promedio fue mayor en mayo con 32.7°C y la mínima en marzo con 30.0 °C. El ANOVA indicó diferencias entre los meses analizados y la prueba de Tukey señaló que se dieron entre marzo-mayo (p= 0.003) y mayo-julio (p= 0.015). El oxígeno disuelto tuvo su valor promedio más alto en la estación 4 con 4.4 mg/l, y el más bajo en la estación 8 con 2.6 mg/l. En el año el valor promedio más alto fue registrado en marzo con 4.0 mg/l y él más bajo en julio con 2.4 mg/l. El ANOVA indicó diferencias entre los meses analizados, la prueba de Tukey indicó que sólo fue entre marzo-julio (p= 0.016). La transparencia de la columna de agua presentó valores altos en el sistema durante los meses de estudio, de 76 a 99%. El ANOVA no indicó diferencias entre los meses analizados.

Composición Ictiofaunística. En el sistema Carretas-Pereyra, fueron recolectados 3,081 peces, con un peso total de 8,801 g. Se identificó un total de 19 especies, 16 géneros y 13 familias; éstas variaron de 15 (78.9%) en los meses de junio y noviembre a 6 (31.6%) en el mes de abril. En Chantuto-Panzacola, se recolectaron 1,456 individuos con un peso total de 8,708.5g; se identificaron 31 especies, 25 géneros y 19 familias. Éstas variaron de 26 (81.3%) en el mes de marzo a 12 (37.5%) en el mes de julio. La lista sistemática de los peces de Carretas-Pereyra y Chantuto-Panzacola se integra en el Apéndice 1.
Diversidad. Carretas-Pereyra: se observó que entre localidades de muestreo los valores más altos de diversidad H' y riqueza D, se presentaron en febrero en la estación 5 con H' = 1.88 y D = 2.73. La equitatividad tuvo el valor más alto en abril en la estación 3 con J' = 0.98. En las estaciones 1 y 2 no se capturaron especies en algunos meses de muestreo, por lo que fueron registrados valores cero (Fig. 2). Comparando H' y D entre los meses de muestreo, se observó que los valores más altos se presentan en noviembre (lluvias) con H' = 1.82 y D = 2.06, respectivamente y los más bajos en abril (secas) con H' = 1.26 y D = 1.03. El índice J' presentó un comportamiento inverso a los índices H' y D con el valor más alto (J' = 0.70) en el mes de abril (Fig. 3A). El ANOVA señalo diferencias entre los meses analizados para H', la prueba de Tukey, mostró que se dieron entre junio-noviembre (p= 0.034), mientras que para D y J' no las hubo.


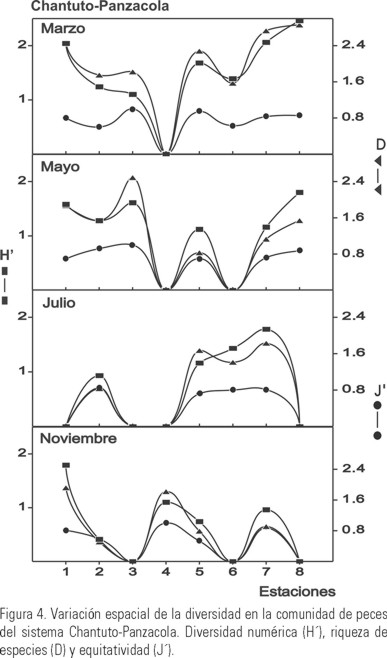
Chantuto-Panzacola: los valores más altos de diversidad H' y riqueza D, se presentaron en la estación 8 con H' = 2.46 y D= 2.86 durante el mes de marzo. La equitatividad J' tuvo el máximo valor en las estaciones 3 (mayo) y 4 (noviembre) con J' = 1.0. En las estaciones 1, 3, 4, 6 y 8 no se capturaron especies en algunos meses de muestreo, por lo que fueron registrados valores cero (Fig. 4). Comparando H' y D entre los meses de muestreo, se observó un comportamiento similar con los valores más altos en el mes de marzo (secas), H' = 2.67 y D = 3.89, y los mínimos en julio (lluvias) con H' = 2.0 y D = 2.24. El índice J' presentó un comportamiento inverso a los índices H' y D, con el valor más alto en el mes de julio (J' = 0.84), y el más bajo en mayo (J' = 0.73) (Fig. 3B). De acuerdo con el ANOVA, no hubo diferencias significativas para H' y J' ; mientras que si las hubo para D, la prueba de Tukey, mostró que se dieron entre marzo-julio (p= 0.037) y marzo-noviembre (p = 0.042).
Abundancia. Carretas-Pereyra: el comportamiento de biomasa, densidad y peso promedio se muestra en la figura 5. Los valores más altos de biomasa y densidad se registraron febrero en la estación 3 con 2.08 g/m2 y 1.46 ind/m2 , respectivamente. El peso promedio de los peces presentó su máximo valor en la estación 4 con 8.08 g/ind en abril. En las estaciones 1 y 2 se registraron valores cero, debido a que no se capturaron individuos en algunos meses de muestreo. Comparando estos parámetros entre los meses de muestreo, se observa que los valores más altos de biomasa se obtuvieron en junio (lluvias) con 0.89 g/m2, la densidad en febrero (secas) con 0.39 ind/m2 y el peso promedio en abril con 4.99 g/ind. Los valores más bajos se presentaron en abril con 0.40 g/m2, densidad con 0.08 ind/m2 y peso promedio en febrero con 2.0 g/ind (Fig. 6A). El ANOVA no indicó diferencias entre los meses analizados para los parámetros antes descritos (p > 0.05).

Chantuto-Panzacola: la figura 7 muestra el comportamiento de los parámetros de abundancia del sistema. Los valores más altos de biomasa y densidad se registraron en la estación 8 con 7.63 g/m2 y 0.96 ind/m2 (marzo). El peso promedio de los peces presentó su valor máximo en la estación 3 con 20.4 g/ind en marzo. Sin embargo, durante noviembre se observa un valor máximo de 88.7 g/ind en la estación 8, debido a la captura de un individuo en ese mes. En las estaciones 1, 3, 4, y 8 se registraron valores cero, debido a que no se capturaron individuos en algunos meses de muestreo. Comparando estos tres parámetros entre los meses de muestreo, se observa que los valores más altos se registraron en marzo (secas) con 1.88 g/m2, 0.25 ind/m2 y 7.55 g/ind, respectivamente. Los valores más bajos se presentaron en noviembre (lluvias) con 0.16 g/m2, 0.04 ind/m2 y 3.85 g/ind (Fig. 6B). El ANOVA, no indicó diferencias entre los meses analizados para los parámetros antes descritos (p > 0.05).

Análisis Discriminante. Carretas-Pereyra: el análisis múltiple mostró que la salinidad (Lambda de Wilks 0.1710; p= 0.000005), el oxígeno (Lambda de Wilks 0.4657; p= 0.0080) y la temperatura (Lambda de Wilks 0.4671; p= 0.0082) fueron significativas en el modelo. La correlación canónica para las variables incluidas fue r = 0.972. La matriz de clasificación de las observaciones para las variables canónicas incluidas indicó que el 100% fueron correctamente clasificadas. La figura 8A muestra la distribución de observaciones correspondientes en función del espacio discriminante entre la primera y segunda función, siendo su variación acumulada de 87% y 12%, respectivamente. De acuerdo con los valores de los coeficientes estandarizados para las variables canónicas, el peso individual de ellas para la primera función canónica fueron: salinidad (-1.093), oxígeno disuelto (0.808) y temperatura (-0.037). Para la segunda función fueron: temperatura (0.904), oxígeno (0.345) y salinidad (-0.0938).
Chantuto-Panzacola: el análisis múltiple mostró que la biomasa (Lambda de Wilks 0.4915; p= 0.0004), la salinidad (Lambda de Wilks 0.5428; p= 0.0013), la temperatura del agua (Lambda de Wilks 0.5762; p= 0.0028) y la transparencia (Lambda de Wilks 0.7145; p= 0.0357) fueron significativas en el modelo. La correlación canónica para las variables incluidas fue r = 0.813. La matriz de clasificación de las observaciones para las variables canónicas incluidas indicó que el 81.3% fueron correctamente clasificadas.
La figura 8B muestra la distribución de observaciones correspondientes entre la primera y segunda función, siendo su variación acumulada de 69% y 29%, respectivamente. De acuerdo con los valores de los coeficientes estandarizados, el peso individual de ellas para la primera función canónica fueron: biomasa (1.106), temperatura (-0.728), salinidad (-0.718), y la transparencia (-0.707). Para la segunda función fueron: salinidad (0.777), temperatura (0.519), biomasa (0.299) y la transparencia (0.279).
Especies Dominantes. Carretas-Pereyra: en este sistema lagunar el análisis de abundancia numérica, peso y frecuencia mostró que las especies dominantes de la comunidad fueron: Gobionellus microdon (Gilbert, 1891), Atherinella guatemalensis (Günther, 1864), Lile gracilis (Castro Aguirre & Vivero, 1990), Cichlasoma macracanthum (Günther, 1864) y Cathorops fuerthi (Steindachner, 1875), las cuales representaron el 72% de la abundancia numérica, el 81% de la captura total en peso y con las frecuencias más altas del sistema (Tabla 3).

Chantuto-Panzacola: en esta laguna el análisis de abundancia y frecuencia mostró que las especies dominantes de la comunidad fueron: Gobionellus microdon, Gobiomorus maculatus (Günther, 1859), Cichlasoma macracanthum, Lile gracilis, Cichlasoma trimaculatum (Günther, 1867), Centropomus robalito Jordan & Gilbert 1882, Achirus mazatlanus (Steindachner, 1869), Cathorops fuerthi y Caranx hippos (Linnaeus, 1766), las cuales representan el 71 % de la abundancia numérica, el 76.4 % de la captura total en peso y con las frecuencias más altas del sistema (Tabla 4).

Conjuntos Ictiofaunísticos. Carretas-Pereyra: en este sistema lagunar-estuarino se aprecia la formación de tres conjuntos de peces a niveles bajos de similitud (Fig. 9). En los grupos I y III se incluyen especies principalmente del componente marino con frecuencias intermedias a muy bajas y en la mayoría de los casos con distribución restringida y presencia sólo en alguno de los meses de muestreo, como: Achirus mazatlanus, Anchoa lucida (Jordan & Gilbert, 1882), Anchovia macrolepidota (Kner & Steindachner, 1865), Diapterus aureolus (Jordan & Gilbert, 1882). En el conjunto II se agrupan las especies más frecuentes y abundantes, donde quedan incluidas las especies dominantes (Tabla 3). Este conjunto agrupa a 11 especies y se divide en dos subgrupos, uno con 4 especies principalmente del componente estuarino como Gobiomorus maculatus, Cathorops fuerthi, Gobionellus microdon y Lile gracilis. Otro grupo está formado con 7 especies en su mayoría del componente dulceacuícola que se distribuyen preferentemente en áreas de manglar al final de la época de lluvias cuando la salinidad ha disminuido (1.3 ups) como Cichlasoma macracanthum, Astyanax fasciatus (Cuvier, 1819), Poecilia sphenops (Valenciennes, 1846), Cichlasoma trimaculatum y Atherinella guatemalensis. El registro de especies en el año, mostró que en junio y noviembre se capturaron 15 especies respectivamente, mientras que en febrero y abril fueron 13 y 6 especies, encontrándose variación en la abundancia de las especies dominantes en estos meses.

Chantuto-Panzacola: el dendrograma muestra la formación de cuatro conjuntos de peces a niveles bajos de similitud (Fig. 10). El conjunto I agrupa 14 especies, desde Gobionellus microdon hasta Gobiosoma etheostoma (Jordan & Starks, 1895). Dentro de este grupo, se observan dos subgrupos, uno formado por 9 especies, donde quedan incluidas 7 de las especies dominantes definidas para el sistema (Tabla 4), las cuales son componentes tanto de origen marino (i.e. Achirus mazatlanus, Centropomus robalito, Anchoa lucida) como dulceacuícola (i.e. Cichlasoma macracanthum, Cichlasoma trimaculatum, Atherinella guatemalensis) que presentan amplia distribución y altas frecuencias en escala temporal. Un segundo subgrupo de 5 especies, agrupa igualmente componentes de ambos orígenes con frecuencias intermedias a bajas. Los conjuntos de especies II, III y IV y sus correspondientes subgrupos incluyen 18 especies desde Caranx hippos hasta Oligoplites saurus (Bloch & Schneider, 1801), con frecuencias intermedias a muy bajas y en la mayoría de los casos con distribución espacial restringida y presencia solo en algunos de los meses de estudio. El registro de especies en el año mostró que en marzo y mayo se capturaron 26 y 20 especies, respectivamente; mientras que en julio y noviembre fueron 12 y 14 especies, encontrándose variación en la abundancia de las especies dominantes en estos meses.

DISCUSIÓN
Variación espacio-temporal de Diversidad. El análisis de la diversidad numérica (H') y la riqueza de especies (D) para los sistemas lagunares Carretas-Pereyra y Chantuto-Panzacola, mostró que las variaciones espaciales y temporales son pequeñas, no obstante, están relacionadas con las condiciones hidrológicas, los ambientes presentes en el sistema y con las condiciones ambientales prevalecientes en cada época del año.
En el sistema Carretas-Pereyra se observó que los valores más altos de H' y D fueron registrados durante los meses de junio y noviembre (lluvias). Durante estos meses, se observó un gran número de especies usando áreas de manglar. Las variaciones de estos parámetros muestran una relación con la salinidad y el oxígeno disuelto, registrándose la mayor diversidad cuando la salinidad (1.3 ups) y el oxígeno disuelto (2.4 mg/l) promedios son bajos, aumentando hacia abril (secas), cuando los valores promedio de estos parámetros son de 13 ups y 6.3 mg/l. Durante junio y noviembre (lluvias) se capturó el mayor número de especies que residen todo el año en el sistema o lo dejan por breves periodos de tiempo como Cathorops fuerthi, Eugerres lineatus (Humboldt, 1833), Gobiomorus maculatus, Gobionellus microdon, Lile gracilis y Mugil hospes (Jordan & Cuvier, 1895) del compo nente lagunar-estuarino y Atherinella guatemalensis, Astyanax fasciatus, Cichlasoma macracanthum, C. octofasciatum y C. trimaculatum del componente dulceacuícola. Mientras que en febrero y abril (secas) se capturaron mayor número de especies marinas que entran al manglar como juveniles y adultos, i.e.: Achirus mazatlanus, Anchovia macrolepidota, Centropomus robalito, Diapterus aureolus y Dormitator latifrons (Richardson, 1844). Estas especies usan este sistema para realizar todo o parte de sus ciclos de vida en áreas asociadas al manglar, adaptándose a la dinámica ambiental durante los meses de lluvias y secas, lo cual se refleja en los valores espacio-temporales de diversidad y riqueza de especies a través del año. De manera general, se considera que las variaciones de estos parámetros (H' y D) están relacionadas con las variaciones de los factores fisicoquímicos, el área de vegetación circundante (manglares) y superficie estuarica, las cuales a su vez dependen de la profundidad, tamaño de la boca y de la intensidad de las lluvias (Deegan et al., 1986; Monaco et al., 1992; Vega-Cendejas et al., 1994). De acuerdo con lo anterior, el análisis discriminante mostró que las variables con mayor importancia en el comportamiento de los parámetros ecológicos de la comunidad fueron la salinidad, el oxígeno disuelto y en menor medida la temperatura. Diversos estudios sobre estructura de la comunidad de peces en ecosistemas de manglar, reportan de manera significativa mayor riqueza y abundancia de peces que en otros hábitats (Thayer et al., 1987; Blabler et al., 1992; Robertson & Duke, 1990; Morton, 1990; Lara-Domínguez & Yáñez-Arancibia, 1999).
En Chantuto-Panzacola se observó que los valores más altos de H' y D fueron registrados en áreas de vegetación sumergida (estaciones 3 y 8). En los meses de estudio las variaciones de H' y D, muestran relación con la temperatura y salinidad, registrándose la mayor diversidad en marzo (secas) cuando la temperatura (30.0 °C) y salinidad (26.5 ups) promedios son altos, disminuyendo hacia julio (lluvias) cuando los valores promedio de estos parámetros son de 30.4 °C y 16.1 ups. En marzo se capturó un mayor número de especies marinas como Achirus mazatlanus, Anchoa lucida, Caranx hippos, Centropomus robalito, Diapterus peruvianus (Cuvier & Valenciennes, 1830), Himantura pacifica (Beebe & Tee-Van, 1941), Lutjanus argenti-ventris (Peters, 1869), Oligoplites saurus y Trinectes fonsecensis (Günther, 1862) con mayor abundancia que en otros meses. Este comportamiento, sugiere que este ecosistema es utilizado por los peces marinos optimizando las condiciones ambientales predominantes, como el gradiente de salinidad, de temperatura, la descarga fluvial y la presencia de vegetación sumergida, lo cual se refleja en los valores espacio-temporales de los parámetros comunitarios de las especies. De acuerdo con lo anterior, el análisis discriminante mostró que las variables ambientales con mayor peso en la variación de los parámetros ecológicos de la comunidad de peces, fueron la salinidad y la temperatura del sistema lagunar. En particular la variación de estos parámetros favorece la entrada de mayor número de especies marinas como se observó en marzo y mayo. Un comportamiento similar ha sido observado por Deegan et al. (1986); Yáñez-Arancibia et al. (1988, 1993); Hook (1991); Humphries et al. (1992); Aguirre-León et al. (1998); Aguirre-León & Díaz-Ruiz (2000) y Díaz-Ruiz et al. (2003), quienes encontraron que la diversidad numérica y riqueza de especies se incrementa con la mayor variedad de hábitats en lagunas costeras tropicales.
Variación espacio-temporal de Abundancia. El comportamiento de la abundancia de los peces en la laguna de Carretas-Pereyra, mostró que los valores de biomasa y densidad son máximos en junio (lluvias), cuando la salinidad y la turbidez son altas y se presenta mayor descarga fluvial y alta productividad primaria en esta época del año (Varona-Cordero & Gutiérrez, 2003). Se observó una disminución de la abundancia hacia abril (secas) cuando los valores de salinidad, oxígeno y temperatura, son intermedios. Este patrón estacional de las lluvias determina las condiciones ambientales del sistema y se refleja en los cambios en la composición y abundancia de la ictiofauna. El comportamiento de la biomasa y densidad se debe a la presencia de peces de tallas juveniles y preadultas durante junio, sugiriendo que utilizan la laguna como área de protección y alimentación. Mientras que durante abril el peso promedio se incrementa debido a numerosas especies grandes estuarinas o marinas que utilizan la laguna para alimentarse y/o protegerse, tales como Achirus mazatlanus, Centropomus robalito, Dormitator latifrons, Eugerres lineatus y Lile gracilis. Resultados similares han sido observados en otras costas tropicales, señalando que la estacionalidad de los parámetros ambientales y los cambios ontogenéticos de las especies están en sincronía con los patrones de utilización temporal y espacial del ecosistema (Robertson & Duke, 1987; Hook, 1991; Yáñez-Arancibia et al., 1993; Aguirre-León et al., 1998; Díaz-Ruiz et al., 2000).
En el sistema lagunar Chantuto-Panzacola la variación de la abundancia mostró que los mayores valores se registraron en áreas caracterizadas por la presencia de vegetación sumergida (estaciones 1, 2, 3, 7 y 8). La biomasa y densidad presentaron su valor más alto durante el mes de marzo y el menor en noviembre, lo cual está relacionado con las variaciones de salinidad y temperatura, por la descarga de los ríos e intercambio de agua con el mar. El comportamiento de la biomasa y densidad en el sistema se debe a la presencia de peces de tallas grandes observados durante marzo y mayo, sugiriendo que un mayor número de peces se presentan como preadultos y adultos utilizando las zonas de vegetación sumergida como áreas de maduración y alimentación en estos meses, cuando los valores de salinidad y temperatura promedios son elevados. Por su parte, individuos juveniles utilizan la zona como área de crianza y protección durante noviembre, cuando la temperatura y salinidad promedios tienen los valores más bajos (30.6 °C y 10.6 ups). Estudios en otros ecosistemas lagunares costeros tropicales, han discutido la importancia de los hábitats con vegetación sumergida, su variación hidrológica y la relación con los cambios de biomasa de los peces costeros (Orth et al., 1984; Rozas & Odum, 1988; Lubbers et al., 1990; Sogard & Able, 1991; Yáñez-Arancibia et al., 1993; Díaz-Ruiz et al., 2003).
Especies Dominantes. En los sistemas lagunares Carretas-Pereyra y Chantuto-Panzacola se consideraron cinco y nueve especies dominantes respectivamente, muchas de estas especies son de importancia comercial como Achirus mazatlanus (lenguado), Atherinella guatemalensis (sardina), Caranx hippos (jurel), Cathorops fuerthi (bagre), Centropomus robalito (robalo), Cichlasoma macracanthum (mojarra), Gobiomorus maculatus (guavina), Lile gracilis (sardina) y Mugil cephalus (lisa); y están relacionadas con las diferentes estrategias biológicas para utilizar los hábitats del sistema con fines alimenticios, reproductivos, crianza o de protección, lo que favorece su permanencia en el ecosistema (Yáñez-Arancibia et al., 1985; Aguirre-León et al., 1998; Díaz-Ruiz et al., 2003) como también, con las variables ambientales (i.e. temperatura, salinidad, transparencia) de cada sistema a lo largo del tiempo con diferentes ambientes y hábitats como manglares y pastos sumergidos, las cuales son variables que tienen su principal influencia durante la distribución y la abundancia de las especies dominantes en la comunidad de peces (Deegan et al., 1986; Cendejas et al., 1994; Lara-Domínguez & Yáñez-Arancibia, 1999).
La utilización de diferentes hábitats por las especies optimiza los recursos del sistema de manera programada, reflejando el comportamiento general de la comunidad. Por ejemplo en Carretas-Pereyra, principalmente caracterizada por hábitat de manglar, Gobionellus microdon y Lile gracilis se alimentan como preadultos y adultos durante la época de secas (febrero) cuando la productividad es alta en este sistema; mientras que Cichlasoma macracanthum y Atherinella guatemalensis, usan las áreas de manglar durante las diferentes etapas de sus ciclos de vida. Similarmente, al comparar las comunidades de peces en Chantuto-Panzacola se observó que, los juveniles de los reproductores marinos como Centropomus robalito y Achirus mazatlanus migran al hábitat de pastos sumergidos para alimentarse y protegerse en la época de lluvias (noviembre). Los reproductores estuarinos como Cathorops fuerthi y Lile gracilis utilizan las zonas de vegetación sumergida como áreas de alimentación y maduración durante la época de secas (marzo-mayo) (Díaz-Ruiz et al., 2004). De esta forma, se observa que la mayor parte de las especies dominantes analizadas son más abundantes en los ambientes de manglar y vegetación sumergida a fines de la época de lluvias y durante toda la época de secas. Los sistemas de manglar/vegetación sumergida ubicados a lo largo del litoral de las lagunas Carretas-Pereyra y Chantuto-Panzacola constituyen áreas de crianza, alimentación, maduración y protección caracterizadas por la presencia de aguas tranquilas, alto contenido de materia orgánica y altas densidades de invertebrados (Barba-Macias, 1999; Varona-Cordero & Gutiérrez, 2003; Díaz-Ruiz et al., 2004).
Estudios realizados en el Golfo de México han caracterizado y cuantificado las comunidades de peces, estableciendo la importancia ecológica de las áreas de manglar y pastos sumergidos como hábitats críticos que proporcionan refugio y alimentación a las especies de importancia ecológica y/o económica (Yáñez-Arancibia et al., 1985, 1988; Thayer et al., 1987; Aguirre-León & Díaz-Ruiz 2000; Díaz-Ruiz et al., 2000). Con este enfoque, los resultados obtenidos en este estudio muestran similares comportamientos sobre el uso de los diferentes hábitats por los peces en alguna etapa de sus ciclos de vida. Sin embargo, son necesarias más investigaciones sobre el ciclo de vida de las especies de peces antes de formular generalizaciones acerca del uso de los sistemas de manglar y vegetación sumergida en esta región del Pacífico mexicano.
Conjuntos Ictiofaunísticos. El análisis de similitud realizado en los sistemas costeros Carretas-Pereyra y Chantuto-Panzacola, mostraron que la composición, frecuencia y distribución de las especies en las asociaciones de poblaciones de peces, están relacionadas con las variaciones ambientales y biológicas de cada hábitat dentro del sistema a lo largo del tiempo (Blaber et al., 1992; Yáñez-Arancibia et al., 1988, 1993). Se sugiere además, que las variaciones de los conjuntos de peces, se deben a la diferente capacidad eurihalina y euritérmica que les permiten utilizar diferentes hábitats específicos. Esto es común en estuarios de zonas tropicales, donde las especies han adaptado estrategias de utilización del sistema durante sus ciclos de vida (Lara-Domínguez & Yáñez-Arancibia, 1999; Díaz-Ruiz et al., 2003).
En este estudio se observaron de manera general, cuatro grupos que caracterizan a los conjuntos de peces presentes en estos sistemas: El primer grupo está caracterizado por especies marinas que penetran al sistema lagunar presentando altas abundancias y distribuciones asociadas a las áreas de mayor salinidad y características marinas durante sus ciclos de vida, muchas de las cuales son dominantes (i.e. Achirus mazatlanus, Anchoa lucida, Anchovia macrolepidota, Centropomus robalito y Dormitator latifrons). Otro grupo comprende especies del componente estuarino (i.e. Eugerres lineatus, Cathorops fuerthi, Gobiomorus maculatus, Gobionellus microdon, Lile gracilis, Mugil hospes). Estas especies utilizan como áreas de crianza y maduración las zonas de mayor influencia marina, vegetación sumergida y manglar en el interior del sistema lagunar. El tercer grupo se caracteriza por ser especies del componente dulceacuícola, que utilizan áreas de vegetación sumergida y emergente donde realizan parte de sus ciclos de vida (i.e. Astyanax fasciatus, Cichlasoma macracanthum, Cichlasoma octofasciatum, Cichlasoma trimaculatum) cuando la salinidad del sistema disminuye (junio-noviembre). Se sugiere que las variaciones estacionales de estas especies están en función de migraciones relacionadas a estrategias de alimentación y protección en el sistema. El cuarto grupo está caracterizado por especies que no presentan un patrón claro de utilización del sistema, con frecuencias muy bajas y distribución restringida, sugiriendo que estas especies utilizan el estuario como áreas de protección principalmente.
Estos grupos de poblaciones de peces observados en este estudio, coinciden con los observados en diversos trabajos realizados en sistemas costeros del Golfo de México (Monaco et al., 1992; Yáñez-Arancibia et al., 1985, 1993; Aguirre-León et al., 1998; Díaz-Ruiz et al., 2003) estableciendo que estas asociaciones de poblaciones están altamente correlacionados con las características ambientales y la dinámica de los hábitats que prevalecen en el sistema, sugiriendo la existencia de patrones de migración y/o colonización de los hábitats costeros y numerosas interacciones entre los peces de la plataforma continental y los ecosistemas de aguas protegidas.
El análisis de resultados muestra que deben continuarse los estudios de los sistemas lagunares Carretas-Pereyra y Chantuto-Panzacola, abordando de manera integral el ecosistema y sus recursos, ya que varias especies de peces son un recurso económico actual y otras representan un recurso potencial. La información analizada en este estudio se considera de gran importancia como punto de partida para estudios futuros orientados a la evaluación ecológica y biológica de las especies de importancia ecológica y/o económica de estos sistemas, lo cual permitirá apoyar la toma de decisiones y plantear alternativas de manejo y aprovechamiento de los recursos pesqueros en los sistemas lagunares de Chiapas.
AGRADECIMIENTOS
Al Departamento de Hidrobiología de la Universidad Autónoma Metropolitana Iztapalapa y al Consejo Nacional de Ciencia y Tecnología (CONACYT, Convenio No. 400 200-5-4284 PT), el apoyo institucional y económico para realizar este estudio. Los autores agradecen a Raúl Ortega Bernal y Oswaldo Pérez-Solís su colaboración en las campañas de campo y laboratorio. A Samuel Marañón-Herrera por su asesoría en el análisis estadístico de datos.
REFERENCIAS
AGUIRRE-LEÓN, A. & S. DÍAZ-RUIZ. 2000. Estructura poblacional, madurez, gonádica y alimentación de Eugerres plumieri (Gerreidae) en el sistema fluviodeltaico Pom-Atasta, México. Ciencias Marinas 26 (2): 253-273 [ Links ]
AGUIRRE-LEÓN, A., S. DÍAZ-RUIZ & A. BERNAL-BECERRA. 1998. Ecología de Peces en Sistemas Fluvio-Deltaicos: Estudio para el Sistema Pom-Atasta en Campeche. Serie Académicos 28. Ciencias Biológicas y de la Salud. Universidad Autónoma Metropolitana-Xochimilco. México. 63 p. [ Links ]
AMEZCUA-LINARES, F. 1996. Peces Demersales de la Plataforma Continental del Pacífico Central de México. Universidad Nacional Autónoma de México y Comisión Nacional para el Uso y Conservación de la Biodiversidad. México. 184 p. [ Links ]
BARBA-MACIAS, E. 1999. Ecología del macrobentos. In: Contreras, F. (Coord.), Estudio biogeoquímico de nutrientes, productividad primaria fitoplactónica y algunos consumidores en dos lagunas costeras tropicales del Estado de Chiapas (Carretas-Pereyra y Chantuto-Panzacola). Informe Final-Proyecto de Investigación, CBS-UAMI. 250 p. [ Links ]
BIANCHI, G. 1991. Demersal assemblages of the continental shelf and slope edge between the Gulf of Tehuantepec (México) and the Gulf of Papagayo (Costa Rica). Marine Ecology 73: 121-140. [ Links ]
BLABER, S.J.M., D.T. BREWER, J.P. SALINI, J.D. KERR & C. CONACHER. 1992. Species composition and biomasses of fishes in tropical seagrasses at Groote Eylandt, northern Australia. Estuaries and Coastal Shelf Science 35: 605-620 [ Links ]
CASTRO-AGUIRRE, J.L. 1982. Los peces de las Lagunas Oriental y Occidental, Oaxaca, México y sus relaciones con la temperatura y salinidad. II Análisis Multifactorial. Anales Escuela Nacional de Ciencias Biológicas 26: 85-100. [ Links ]
CASTRO-AGUIRRE, J.L., H. ESPINOSA PÉREZ & J.J. SCHMITTER-SOTO. 1999. Ictiofauna Estuarino-Lagunar y Vicaria de México. Serie Biotecnológicas. Limusa. México. 705 p. [ Links ]
CHÁVEZ, E. A. 1979. Análisis de la comunidad de una laguna costera en la costa sur occidental de México. Anales Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 6 (2): 15-44. [ Links ]
CHIRICHIGNO, N., W. FISCHER & C. E. NAVEN. 1982. Catálogo de especies marinas de interés económico actual o potencial para América Latina. Parte 2. Pacífico Central y Suroriental. Roma, FAO/ PNUD, SIC/ 82/ 2: 1- 588. [ Links ]
DANIEL, W. 1997. Bioestadística: Base para el Análisis de las Ciencias de la Salud. Uthea. México. 878 p. [ Links ]
DEEGAN, L., J.W. DAY, JR., J.G. GOSSELINK, A. YÁÑEZ-ARANCIBIA, G. SOBERÓN-CHÁVEZ & P. SÁNCHEZ-GIL. 1986. Relationships among physical characteristics, vegetation, distribution and fisheries yields in Gulf of Mexico. In: Wolf, A.D. (Ed.) Estuarine Variability. Academic Press, Inc., pp 83-100 [ Links ]
DE LA CRUZ-AGÜERO, G., 1994. ANACOM: Sistema para el Análisis de Comunidades en Computadoras Personales. Versión 3.0. México. 99 p. [ Links ]
DÍAZ-RUIZ, S., A. AGUIRRE-LEÓN & O. PÉREZ-SOLÍS. 2000. Distribución y abundancia de Syngnathus louisianae y Syngnathus scovelli (Syngnathidae) en la Laguna de Tamiahua, Golfo de México. Ciencias Marinas 26 (1): 125-143 [ Links ]
DÍAZ-RUIZ, S., M. A. PÉREZ-HERNÁNDEZ & A. AGUIRRE-LEÓN. 2003. Characterization of fish assemblages in a tropical coastal lagoon in the north west Gulf of Mexico. Ciencias Marinas 29 (4B): 631-644 [ Links ]
DÍAZ-RUIZ, S., E. CANO-QUIROGA, A. AGUIRRE-LEÓN & R. ORTEGA-BERNAL. 2004. Diversidad, abundancia y conjuntos Ictiofaunísticos del sistema lagunar-estuarino Chantuto-Panzacola, Chiapas, México. Revista Biología Tropical 52 (1): 187-199 [ Links ]
FISCHER, W., F. KRUPP, W. SCHNEIDER, C. SOMMER, K. E. CARPETER & V. H. NIEM. 1995. Guía FAO para la Identificación de Especies para los Fines de la Pesca. Pacífico Centro-Oriental. Volúmenes II y III. Vertebrados. Partes 1 y 2. FAO, Roma. 647-1813 p. [ Links ]
GARCÍA, E. 1988. Modificaciones al sistema de clasificación climática de Köeppen para adaptarlo a las condiciones de la República Mexicana. Instituto de Geografía. Universidad Nacional Autónoma de México. 346 p. [ Links ]
HOOK, J. 1991. Seasonal variation in relative abundance and species diversity of fishes in South Bay. Marine Science 32: 127-141. [ Links ]
HUMPHRIES, P., I.C. POTTER & N.R. LONERAGAN. 1992. The fish community in the shallows of a temperate Australian estuary: relationships with the aquatic macrophyte Ruppia megacarpa and environmental variables. Estuarine and Coastal Shelf Science 34: 325-346. [ Links ]
INE SEMARNAP. 1999. Programa de Manejo Reserva de la Biosfera La Encrucijada. Instituto Nacional de Ecología. México. 183 p. [ Links ]
LARA-DOMÍNGUEZ, A.L. & A. YÁÑEZ-ARANCIBIA. 1999. Productividad secundaria, utilización del hábitat y estructura trófica. In: Yáñez-Arancibia, A. & A. L. Lara-Domínguez (Eds.) Ecosistemas de Manglar en América Tropical. Instituo de Ecología, A.C. México UICN/HORMA, Costa Rica, NOAA/NMFS Silver Spring MD USA, pp 153-166 [ Links ]
LEVENE, H. 1960. Robust test for equality on variance. In: I. Olkin, S. G. Ghurye, W. Hoeffding, W. G. Madow & H. B. Mann (Eds.). Contributions to Probability and Statistics. Stanford University Press. California, pp. 278-292. [ Links ]
LUBBERS, L., W.R. BOYNTON & W. M. KEMP. 1990. Variations in structure of estuarine fish communities in relation to abundance of submerged vascular plants. Marine Ecology 65: 1-14. [ Links ]
LUDWING, J. A. & J. F. REYNOLDS. 1988. Statistical Ecology. A Primer on Methods and Computing. Wiley, Nueva York. 337 p. [ Links ]
MARGALEF, R. 1969. Perspectives in Ecological Theory. The University of Chicago Press, Chicago. 111 p. [ Links ]
MONACO, E.M., A.T. LOWERY & R. EMMETT. 1992. Assemblages of U.S. west coast estuaries based on the distribution of fishes. Journal of Biogeography 19: 251-267 [ Links ]
MONTGOMERY, D. 1984. Design and Analysis of Experimental. Williams, Nueva York. 538 p. [ Links ]
MORTON, R.M. 1990. Community structure, density and standing crop of fishes in a subtropical Australian mangrove area. Marine Biology 105: 385-394 [ Links ]
NELSON, I.S. 1994. Fishes of the World. Wiley, Nueva York. 600 p. [ Links ]
ORTH, R. J., K. L. HECK, JR. & J. VAN MONTFRANS. 1984. Faunal communities in seagrass bets: a review of the influence of plant structure and prey characteristics on predator-prey relationships. Estuaries 7 (4A): 339-350. [ Links ]
PIELOU, E.C. 1966. The measurement of diversity in different types of biological collections. Journal Theory Biology 13: 131-144 [ Links ]
RAMÍREZ HERNÁNDEZ, E., G. CARRILLO & D. LLUCH. 1964. Investigaciones ictiológicas de las costas de Chiapas. Lista de peces colectados en las capturas camaroneras (agosto-septiembre, 1959, abril-mayo-junio 1960). Secretaría de Industria y Comercio, Dirección General de Pesca, México. Publicaciones del Instituto Nacional de Investigaciones Biológicas y Pesqueras 5: 1-17. [ Links ]
ROBERTSON, A. I. & N. C. DUKE. 1987. Mangroves as a nursery sites: comparisons of the abundance and species composition of fish and crustaceans in mangroves and other nearshore habitats in tropical Australia. Marine Biology 96: 193-205 [ Links ]
ROBERTSON, A. I. & N. C. DUKE. 1990. Mangroves fish-community in tropical Qeensland, Australia: spatial and temporal patterns in densities, biomass and community structure. Marine Biology 104: 369-376 [ Links ]
ROZAS, L.P. & W. E. ODUM. 1988. Occupation of submerged aquatic vegetation by fishes: testing the roles of food and refuge. Oecologica 77: 101-106 [ Links ]
SECRETARIA DE PESCA. 1994. Anuarios Estadísticos de Pesca 1978-1994. México. 173 p. [ Links ]
SHANNON, E.C. & W. WIENER. 1963. The Mathematical Theory of Communication. University Illinois. Urbana, 119 p. [ Links ]
SOGARD, S.M. & K.W. ABLE. 1991. A comparison of eelgrass, sea lettuce macroalgae, and marsh creeks as habitats for epibenthic fishes and decapods. Estuarine and Coastal Shelf Science 33: 501-519. [ Links ]
TATSOUKA, M. M. 1970. Discriminant Analysis. The Study of Group Differences. IPAT, Champaign, III, 57 p. [ Links ]
THAYER, G.W., R.D. COLBY & F. W. HETTER, JR. 1987. Utilization of the red mangrove prop root habitat by fishes in south Florida. Marine Ecology Progresses Series 35: 25-38 [ Links ]
VARONA-CORDERO, F. & F. J. GUTIÉRREZ MENDIETA. 2003. Estudio multivariado de la fluctuación espacio-temporal de la comunidad fitoplanctónica en dos lagunas costeras del estado de Chiapas. Revista Hidrobiológica 13 (3): 177-194 [ Links ]
VEGA-CENDEJAS, M. E., U. ORDÓÑEZ & M. HERNÁNDEZ. 1994. Day-night variation of fish population in mangrove of Celestun lagoon, Mexico. International Journal Ecology and Environmental Sciences 20: 99-108 [ Links ]
YÁÑEZ-ARANCIBIA, A., L. LARA-DOMÍNGUEZ, A. AGUIRRE-LEÓN, S. DÍAZ-RUIZ, F. AMEZCUA, D. FLORES & P. CHAVANCE. 1985. Ecología de las poblaciones de peces dominantes en estuarios tropicales: Factores ambientales que regulan las estrategias biológicas y la producción. In: A. Yáñez-Arancibia (Ed.). Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. Universidad Nacional Autónoma de México. México, pp. 311-365 [ Links ]
YÁÑEZ-ARANCIBIA, A., L. LARA-DOMÍNGUEZ, J. L. ROJAS-GALAVIZ, P. SÁNCHEZ-GIL, J. W. DAY, JR & C. J. MADDEN. 1988. Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogeneity (southern Gulf of México). Journal Fish Biology 33: 191-200 [ Links ]
YÁÑEZ-ARANCIBIA, A., A.L. LARA DOMÍNGUEZ & J.W. DAY JR. 1993. Interactions between mangrove and seagrass habitats mediated by estuarine nekton assemblages: coupling of primary and secondary production. Hydrobiologia 264: 1-12. [ Links ]
ZAR, J. H. 1999. Biostatistical Analysis. Prentice-Hall, Inc. New Jersey, 663 p. [ Links ]














