Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.16 no.2 Ciudad de México ago. 2006
Dinámica de las bacterias anaeróbicas en las fases terminales de la mineralización de la materia orgánica en el sedimento de los ecosistemas Carretas-Pereyra y Chantuto-Panzacola
Dynamics of anaerobic bacteria in the final steps of organic matter mineralization in the Carretas-Pereyra and Chantuto-Panzacola ecosystems
María del Rocío Torres Alvarado,1 Francisco Fernández P.,2 Irene de los Ángeles Barriga Sosa1 y Florina Ramírez Vives2
1 Departamento. de Hidrobiología. Universidad Autónoma Metropolitana-Iztapalapa. Apdo. Post. 55-535. México 09340, D.F.
2 Departamento de Biotecnología. Universidad Autónoma Metropolitana-Iztapalapa. Apdo. Post. 55-535. México 09340, D.F.
Recibido: 8 de marzo de 2005
Aceptado: 7 de diciembre de 2005
RESUMEN
La mineralización de la materia orgánica en los ecosistemas costeros, caracterizados por un aporte constante de sulfatos, se efectúa principalmente en la fase sedimentaria, siendo las bacterias anaeróbicas sulfatorreductoras los principales microorganismos implicados en las últimas fases de degradación. Sin embargo, las bacterias metanogénicas en estos ambientes también son importantes. Los estudios de las poblaciones bacterianas relacionadas con las fases terminales de la degradación anaeróbica de la materia orgánica, se han efectuado básicamente, en ecosistemas de zonas templadas. Con base en lo anterior, el objetivo del presente trabajo fue evaluar la dinámica espacial y temporal de las poblaciones bacterianas sulfatorreductoras y metanogénicas en el sedimento de dos ecosistemas estuarino-lagunares localizados en el Estado de Chiapas. Las muestras de sedimento se colectaron en diferentes meses y la cuantificación de las bacterias sulfatorreductoras y metanogénicas, a partir de diferentes sustratos, se efectuó con la técnica del Número Más Probable. Asimismo, se analizaron diversas variables físicas y químicas en el sedimento y agua intersticial. Los resultados obtenidos indicaron que ambos grupos bacterianos fueron abundantes en el sedimento de las lagunas estudiadas, cuantificándose densidades superiores a las determinadas en sedimentos costeros y lacustres de zonas templadas. Las variaciones temporales y espaciales de la abundancia de estas poblaciones bacterianas se relacionó con el pH, la salinidad y el contenido de sulfatos.
Palabras clave: Bacterias sulfatorreductoras, bacterias metanogénicas, sedimentos costeros, zona tropical.
ABSTRACT
The coastal sediments are important sites for the organic matter mineralization. In this ecosystems, where there is a constant input of sulfates, the sulfate reducing bacteria are the most important microorganisms implicated in the last anaerobic steps of mineralization; however the methanogenic bacteria are also important. There are several studies about the function of this anaerobic bacterial communities, mostly them in temperate regions. The aim of this study was investigate the seasonal and, spatial dynamics of sulfate reducing and, methanogenic bacteria in two coastal lagoons sediments located in Chiapas State. Sediment samples was collected at different months. The sulfate reducing and, methanogenic bacteria were evaluated with Most Probable Number technique using different substrates. Several physical and, chemical parameters was too measured. The sulfate reducing and, methanogenic bacteria were abundant in both coastal lagoons sediments. The bacterial density in the coastal lagoons studied was highest than the reported it in coastal and, freshwater sediments located in temperate regions. Seasonal and, spatial variations of the anaerobic bacterial populations were related with salinity, sulfate concentration and pH.
Key words: Sulfate reducing bacteria, methanogenic bacteria, coastal sediments, tropical zone.
INTRODUCCIÓN
En las lagunas costeras el sedimento representa un componente clave para su funcionamiento, característicamente es altamente reductor, con cantidades elevadas de materia orgánica. Las altas tasas de sedimentación de material orgánico propician que la actividad de mineralización se efectúe principalmente bajo condiciones anaeróbicas, participando en ésta diferentes grupos de microorganismos.
El proceso de la degradación anaeróbica de la materia orgánica involucra la hidrólisis de los compuestos de peso molecular elevado (polisacáridos, lípidos, proteínas) para formar compuestos de bajo peso molecular (ácidos orgánicos y alcoholes), que posteriormente son fermentados hasta ácidos grasos volátiles (propionato, acetato) y gases (H2, CO2), los cuales son los sustratos para las fases terminales de la descomposición de la materia orgánica, es decir, la sulfatorreducción y la metanogénesis (Gibson, 1990).
En los ecosistemas con un alto contenido de sulfatos (océanos y zonas costeras), la sulfatorreducción es el metabolismo dominante. Las bacterias sulfatorreductoras son las responsables de degradar más del 53% de la materia orgánica presente en dichos ambientes; sin embargo, en condiciones de bajo contenido de sulfatos su importancia disminuye, destacando la función de las bacterias metanogénicas (Mountfort et al., 1980; Jørgensen, 1982; Oremland et al., 1982; Senior et al., 1982; Fukui et al., 1997; Purdy et al., 2002). A pesar de que la metanogénesis no es el proceso dominante en la fase terminal de la mineralización anaeróbica en sedimentos costeros y marinos, se ha reportado la presencia de un número elevado de bacterias metanogénicas en éstos (Ramamurthy et al., 1990).
La dominancia de la sulfatorreducción obedece al hecho de que las bacterias sulfatorreductoras pueden utilizar con mayor eficiencia que las metanogénicas el acetato o el hidrógeno disponibles cuando hay sulfatos en el medio. Con dichas condiciones, las bacterias metanogénicas frecuentemente optan por utilizar sustratos no sujetos a competencia como el metanol y las metilaminas (Winfrey & Ward, 1983; Oren, 1988).
La importancia de los diferentes sustratos para la sulfatorreducción y la metanogénesis depende tanto de las características del medio ambiente como de los géneros de microorganismos presentes, por lo que el conocimiento sobre la disponibilidad de sustratos para los procesos mencionados es un punto clave relacionado con la abundancia, distribución y actividad de las bacterias (Nedwell & Abram, 1978; Sørensen et al., 1979).
Los estudios acerca de la abundancia y actividad de las bacterias sulfatorreductoras y metanogénicas se han llevado a cabo principalmente en zonas costeras de latitudes templadas, donde la temperatura es el factor clave que induce los cambios en los ecosistemas. La mayoría de los trabajos han sido efectuados en sedimentos estuarinos asociados a marismas (Spartina alterniflora Loisel) (Jones & Paynter, 1980; Franklin et al., 1988); siendo escasos los trabajos en lagunas costeras caracterizadas por la presencia de pastos marinos (Ruppia sp y Zoostera noltii Hornemann) (Schaub & Gemerden, 1996). Estas investigaciones se han centrado en la cuantificación sólo de alguna de las poblaciones bacterianas, ya sea sulfatorreductoras o metanogénicas, con dos o tres sustratos y muy pocos estudios han incluido la cuantificación de los dos grupos microbianos. Algunos de éstos han demostrado que el acetato, propionato e hidrógeno son los principales sustratos para la sulfatorreducción (Sørensen et al., 1981; Banat & Nedwell, 1983; Gibson, 1990), mientras que el acetato e hidrógeno son importantes para la metanogénesis (Balba & Nedwell, 1982; King, 1984).
Existen pocas investigaciones relacionadas con los procesos de sulfatorreducción y metanogénesis en latitudes tropicales, donde la precipitación es uno de los principales factores ambientales que contribuye a los cambios hidrológicos en los ecosistemas. Algunas de éstas se han efectuado en sedimentos de lagunas costeras asociadas a manglares (Mohanraju & Natarajan, 1992; Mohanraju et al., 1997), donde se establece que las bacterias metanogénicas que utilizan metanol y metilaminas son el principal componente microbiano en los sedimentos.
Aunado a la carencia de información global sobre la degradación anaeróbica en regiones tropicales, en el caso particular de los ambientes costeros mexicanos (tanto del Golfo como del Pacífico) los trabajos son todavía más escasos y particularmente en Chiapas, inexistentes.
El objetivo del presente trabajo fue, con base en lo anterior, analizar la distribución y abundancia de las poblaciones bacterianas sulfatorreductoras y metanogénicas, a partir de diferentes sustratos, en el sedimento de los sistemas Carretas-Pereyra y Chantuto-Panzacola para conocer la dinámica de dichas poblaciones y las variables ambientales que influyen en ésta; contribuyendo al mismo tiempo, al conocimiento de los procesos de sulfatorreducción y metanogénesis en los ecosistemas costeros de México. Cabe hacer mención, que el análisis de las comunidades biológicas de los ecosistemas Carretas-Pereyra y Chantuto-Panzacola es un componente esencial considerado en el Programa de Manejo para la protección y conservación de la Reserva de la Biosfera "La Encrucijada".
MATERIALES Y MÉTODO
Área de estudio. Los sistemas lagunares de Carretas-Pereyra y Chantuto-Panzacola se localizan en la Reserva de la Biósfera "La Encrucijada" en la costa de Chiapas. El clima de la región es cálido-húmedo con abundantes lluvias en verano. La temporada de lluvias comienza a finales del mes de mayo y se extiende hasta principios de noviembre, con una precipitación máxima de 3,000 mm, mientras que la temporada de secas abarca desde finales del mes de noviembre hasta principios del mes de mayo (INE-SEMARNAP, 1999).
El sistema Carretas-Pereyra se encuentra localizado entre los 15° 23' y 15° 32' de latitud norte y los 93° 06' y 93° 15' de longitud oeste, con una extensión de 3,696 Ha. Está conformado por las lagunas de Pereyra, Carretas, Bobo y Buenavista, y un cordón estuarino conocido como el Palmarcito (Fig. 1A). En este complejo lagunar desembocan los ríos Ceniceros, Margaritas y Bobo. Este sistema presenta una tendencia natural a la eutroficación, debido a los aportes significativos de nutrientes que recibe.
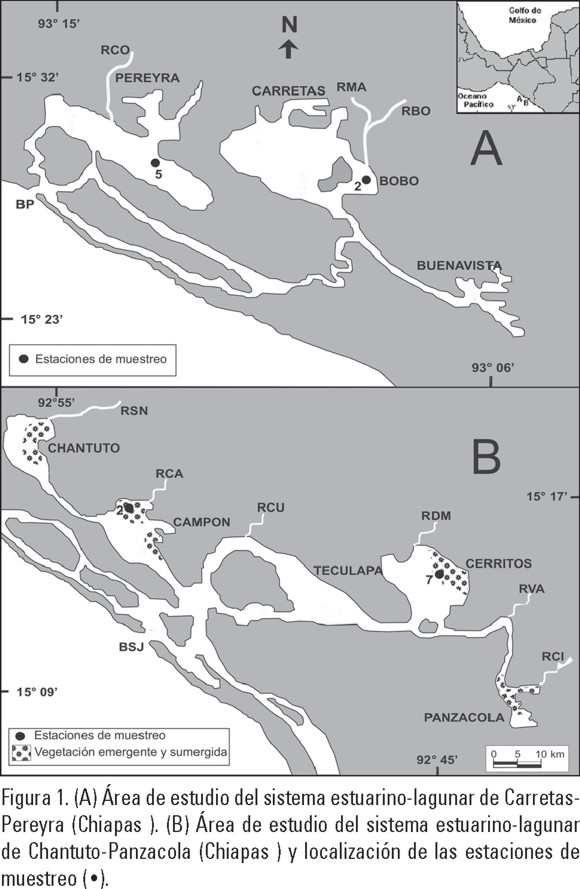
El sistema Chantuto-Panzacola se ubica entre los 15° 09' y 15° 17' de latitud norte y los 92° 45' y 92° 55' de longitud oeste, con una extensión de 18,000 Ha. Está formado por cinco lagunas principales: Chantuto, Campón, Teculapa, Cerritos y Panzacola, una boca de comunicación con el mar (San Juan) y un estuario paralelo a la barrera arenosa (El Huetate). En este ecosistema desembocan los ríos Cacaluta, Cintalapa y Vado Ancho (Fig. 1B).
Ambos ecosistemas se encuentran rodeados por extensas comunidades de manglares, Rhizophora mangle L., Laguncularia racemosa Gaetner y Avicennia germinans (L.) L, reportándose además la presencia de Rhizophora harrisonii Leechm a partir de este sistema y hacia el sur (Rico-Gray, 1981).
Procedimiento de Campo. Se colectaron muestras del sedimento bentónico en las lagunas de Cerritos (15° 09' 54.4" L. N., 92° 45' 34" L. 0.) y Campón (15° 12' 30.0" L. N., 92° 51' 24.2" L. O.) (Sistema Chantuto-Panzacola); así como en las lagunas de Pereyra (15º 31' 26.1" L. N, 93º 13' 06.4" L. O.) y Bobo (15º 29'22.0" L. N., 93º 08' 44.6" L. O.) (Sistema Carretas-Pereyra) (Figs. 1A y 1B) durante los meses asociados a las temporadas de sequía (junio 2002 y febrero 2003) y lluvias (octubre y noviembre, 2002).
En cada estación se colectaron muestras de sedimento con un nucleador constituido por un tubo de acrílico de 4.5 cm de diámetro y 45 cm de longitud, el cual se introdujo hasta una profundidad de 20 cm dentro del sedimento. En dos profundidades del sedimento (6 y 12 cm) se cuantificó in situ la temperatura con un termómetro (intervalo de -10 a 60ºC), el potencial de óxido-reducción (Eh) y la concentración del ión hidrógeno (pH) con electrodos Instrulab, registrándose las lecturas en un Ioanalizador marca Orion Research modelo 399A. Para el potencial redox se utilizó un electrodo de platino y un electrodo de referencia de calomel saturado, con un potencial de referencia de +198 mV adicionado al valor medido. Durante el trabajo de campo ambos electrodos se estandarizaron rutinariamente con solución ZoBell (3 mM de ferrocianuro de potasio y 0.1 M de cloruro de potasio) (Langmuir, 1971). Posteriormente las muestras se transportaron al laboratorio a baja temperatura (4ºC), para efectuar los análisis bacteriológicos y de las variables fisicoquímicas. Las muestras para los análisis bacteriológicos se trabajaron inmediatamente, mientras que las determinaciones de las variables fisicoquímicas se efectuaron en un plazo no mayor de 15 días, permaneciendo las muestras congeladas hasta su procesamiento.
Preparación de las muestras. Bajo una atmósfera de nitrógeno, los núcleos de cada estación se fraccionaron en dos estratos de sedimento, 0-6 cm y 6-12 cm de profundidad. Cada uno de los estratos se homogenizó en una bolsa de plástico con agitación constante. Inmediatamente se tomo un mililitro, con una jeringa estéril, del sedimento homogenizado para efectuar las diluciones en serie necesarias para la cuantificación de las poblaciones bacterianas sulfatorreductoras y metanogénicas.
El sedimento restante se congelo, separando además una submuestra que se fijó con acetato de zinc al 20% para evitar la pérdida de sulfatos (Alongi et al., 1999) y realizar el análisis de los parámetros fisicoquímicos.
Análisis bacteriológico. La cuantificación de las bacterias sulfatorreductoras y metanogénicas se efectuó mediante la técnica del Número Más Probable (NMP), realizando diluciones en serie de cada muestra (10-1 a 10-10) y con cuatro tubos por dilución. El análisis de las bacterias sulfatorreductoras abarcó la cuantificación de los grupos nutricionales que emplean lactato, acetato, H2-CO2 y propionato, utilizándose el medio de Ravot et al. (1995). Para la microbiota metanogénica se llevaron a cabo cuantificaciones de los grupos nutricionales que utilizan acetato, H2-CO2 y metanol. Se empleó el medio básico de Balch et al. (1979).
Los medios se redujeron mediante ebullición bajo una atmósfera de N2 para desplazar el oxígeno y se distribuyeron en tubos de cultivo con tapón de neopreno y rosca (Hungate, 1969), se purgaron durante 30 segundos con una mezcla N2/CO2 (80/20%) y se esterilizaron en el autoclave durante 20 minutos. Subsecuentemente, la salinidad y el pH del medio se ajustaron con soluciones de NaCl (330 g/L) y bicarbonato (10%), respectivamente, hasta obtener la salinidad y el pH determinados en el sedimento durante los muestreos (Tabla 1). Posteriormente se agregó NaS-9 H2O al 2.5% para disminuir el Eh del medio de cultivo. En el caso de los tubos para el cultivo de las bacterias sulfatorreductoras, se adicionó 0.1 ml de Na2SO4 (1 M). Finalmente, se agregaron los sustratos a partir de soluciones concentradas 1 M, para obtener una concentración final de 20 mM. Todas las soluciones fueron previamente reducidas y esterilizadas.
Los tubos para el análisis de las bacterias sulfatorreductoras se incubaron a 32ºC durante 14 días, contándose como positivos los que presentaron formación de ácido sulfhídrico, detectado colorimétricamente con un espectrofotómetro Spectronic 20D+ siguiendo la técnica de Cord-Ruwisch (1985).
Los tubos para el análisis de las bacterias metanogénicas se incubaron a 32 ºC durante un mes, al término del cual se evaluaron como positivos los que presentaron producción de metano, detectado con un cromatógrafo de gases GOW-MAC equipado con un detector de conductividad y una columna empacada Carbosphere 80/100. Las temperaturas de operación fueron de 140°C, 190°C y 170°C para la columna, detector e inyector, respectivamente.
Análisis de los parámetros fisicoquímicos. Las muestras de sedimento homogenizado, así como las conservadas con acetato de zinc al 20%, se centrifugaron a 3,600 r. p. m. a baja temperatura (4°C) durante 20 minutos, para separar el agua intersticial del sedimento (Howes, 1985). En el agua intersticial de las muestras no conservadas, previa filtración a través de membranas Millipore® de 0.45 μm, la salinidad se determinó por medio de un refractómetro marca American Optical y los carbohidratos disueltos totales se analizaron mediante técnicas colorimétricas (Dubois et al., 1956; Strickland & Parsons, 1972). En las muestras fijadas con acetato de zinc se cuantificó el contenido de sulfatos (Howarth, 1978). En el sedimento húmedo se llevó a cabo la evaluación del contenido de sólidos totales (ST) y sólidos volátiles (SV) siguiendo las recomendaciones de APHA et al. (1989). En el sedimento seco se analizo el carbono orgánico, de acuerdo con el método de Gaudette et al. (1974).
Análisis estadístico. Los datos de las abundancias poblacionales y de los parámetros fisicoquímicos fueron transformados (Log x+1) para obtener una distribución normal (Salgado-Ugarte, 1992; Zar, 1997). Los datos de los diferentes meses se agruparon en dos épocas climáticas (secas y lluvias) y se efectuó un análisis de varianza (ANOVA) de una vía para determinar diferencias significativas entre las dos épocas (P< 0.05) para cada uno de los distintos grupos nutricionales bacterianos cuantificados, así como de las variables ambientales. Para el análisis a nivel espacial, los datos de los distintos grupos nutricionales bacterianos analizados y de las variables ambientales se agruparon en dos profundidades (0-6 cm y de 6-12 cm) para determinar diferencias significativas (P< 0.05) mediante una prueba de varianza (ANOVA) de una vía. A partir de los datos de las medias de las abundancias se efectuó un análisis Pareto para determinar la importancia de utilización de sustratos. Para analizar la influencia de los parámetros fisicoquímicos sobre las densidades de las poblaciones bacterianas se efectuó un análisis de correlación de Pearson. Las variables cuyo nivel de significancia (P) fue inferior o igual a 0.05 se correlacionaron. Todas las pruebas estadísticas se llevaron a cabo con el programa STATISTICA para Windows, versión 1999.
RESULTADOS
Comportamiento de las variables fisicoquímicas. A partir de los resultados obtenidos en la Tabla 1 se observó que la temperatura del sedimento de las lagunas no presentó variaciones significativas entre la temporada de secas y de lluvias.
Por el contrario, se determinaron fluctuaciones significativas de la salinidad del agua intersticial (P= 0.00), la cual disminuyó durante la temporada de lluvias al incrementarse los aportes fluviales y la precipitación; la situación contraria se presentó en los meses asociados a secas. Los valores de salinidad se relacionaron directamente con los sulfatos (P= 0.000; r= 0.82) y el pH (P= 0.000; r= 0.70), e inversamente con el Eh (P= 0.002; r= -0.56). La influencia de los aportes dulceacuícolas también se relacionó en las variaciones estacionales del contenido de sulfatos en el agua intersticial (P= 0.00), evaluándose una mayor concentración de éstos en los meses de secas, disminuyendo en los meses de lluvias, al diluirse con la entrada de agua dulce. Se determino una correlación positiva de la concentración de sulfatos con el pH (P= 0.001; r= 0.63) y negativa con el Eh (P= 0.035; r= -0.41)
Se registraron variaciones del pH entre las épocas climáticas (P= 0.00), con características ácidas en los meses de lluvias, mientras que en secas las condiciones fueron neutras y alcalinas. En los meses asociados a las lluvias se cuantificaron potenciales de óxido-reducción menos reductores en comparación con los registrados en secas, las diferencias fueron significativas (P= 0.00).
El contenido de sólidos suspendidos totales (ST) y volátiles (SV) aumentó en la temporada de secas y disminuyó en los meses de lluvias, en el caso de los ST los cambios fueron significativos (P= 0.049). Se determino una correlación negativa entre los ST y el contenido de carbohidratos (P= 0.019; r= -0.45).
Las diferencias en los contenidos de carbono y de carbohidratos (fracciones orgánicas) no fueron significativas entre las épocas analizadas, aunque la concentración de carbono orgánico en el sedimento fue más alta en los meses con lluvias. Los carbohidratos, al contrario del carbono orgánico, tuvieron una mayor concentración en la época de secas.
En lo que respecta al comportamiento espacial, no se observaron cambios significativos en la mayoría de las variables fisicoquímicas, con excepción del Eh, el cual fue más reductor al aumentar la profundidad del sedimento (P= 0.00).
Distribución de las bacterias sulfatorreductoras (BSR). Los resultados obtenidos en los sedimentos de las lagunas estudiadas, indicaron que en la temporada de secas fueron más abundantes las poblaciones bacterianas sulfatorreductoras (BSR) de los cuatro grupos nutricionales analizados (P= 0.00) (Fig. 2).

De los diferentes grupos de las BSR cuantificados, a partir del análisis Pareto, se obtuvo el siguiente orden decreciente de utilización por sustrato en la temporada de secas: acetato (26.6%) > propionato (25.2%) > lactato (24.4%) > hidrógeno (23.8%). En la época de lluvias la utilización del sustrato tuvo el siguiente orden: hidrógeno (27.2%) > lactato (25.6%) > acetato (24%) > propionato (23.3%).
Se determinaron correlaciones significativas entre las BSR que utilizan lactato con la salinidad (P= 0.024; r= 0.44) y el contenido de sulfatos (P= 0.001; r= 0.55); entre el grupo fisiológico que emplea acetato con los sulfatos (P= 0.001; r= 0.56), el pH (P= 0.000; r= 0.60), Eh (P= 0.001, r= -0.58) y la cantidad de sólidos volátiles (P= 0.039; r= -0.37); así como de las BSR que utilizan propionato con la salinidad (P= 0.019; r= 0.46), contenido de sulfatos (P= 0.000; r= 0.67) y Eh (P= 0.011; r= -0.44).
La distribución vertical de las BSR, al igual que la de las variables fisicoquímicas, no presentó diferencias significativas entre los estratos de 0-6 cm y de los 6-12 cm de profundidad (Fig. 3). En los seis primeros centímetros del sedimento la abundancia por utilización de sustrato fue: hidrógeno (25.7%) > lactato (25.2%) > propionato (24.6%) > acetato (24.5%). Entre los 6-12 cm se determinó el siguiente orden decreciente: acetato (26.5%) > hidrógeno (24.7%) > lactato (24.5%) > propionato (24.2%).

Distribución de las bacterias metanogénicas (BM). La cuantificación de las bacterias metanogénicas (BM) indico que las poblaciones de los tres grupos nutricionales fueron más abundantes en los meses asociados a las lluvias, siendo significativas las variaciones entre las épocas climáticas para todos los grupos (P= 0.00) (Fig. 3).
La abundancia de las BM en la época de lluvias, por preferencia de sustrato en orden decreciente, fue: hidrógeno > (34.3%) > metanol (33.9%) > acetato (31.8%). En la temporada de secas la densidad metanogénica por sustrato fue: metanol (35.5%) > hidrógeno (32.8%) > acetato (31.7%).
Se determinaron correlaciones entre las BM acetoclásticas con la salinidad (P= 0.000; r= -0.81), el contenido de sulfatos (P= 0.000; r= -0.86), pH (P= 0.000; r= -0.59) y Eh (P = 0.000; r= 0.66). Se observaron también correlaciones entre las BM hidrogenofílicas con la salinidad (P= 0.000; r= -0.85), sulfatos (P= 0.000; r= -0.87), pH (P= 0.000; r= -0.66), Eh (P= 0.000; r= 0.69) y el contenido de carbohidratos (P= 0.05; r= 0.35). Las BM que emplean metanol se relacionaron negativamente también con la salinidad (P= 0.000; r= -0.75), el contenido de sulfatos (P= 0.000; r= -0.88) y el pH (P= 0.000; r= -0.69); y positivamente con el Eh (0.000; r= 0.61).
Como en el caso de las BSR, la distribución vertical de las BM, no presentó diferencias significativas entre los estratos de 0-6 cm y de los 6-12 cm de profundidad (Fig. 3). En los seis primeros centímetros de profundidad la densidad por preferencia de sustrato fue: hidrógeno (34.7%) > metanol (33.7%) > acetato (31.61%); mientras que entre los 6-12 cm el orden decreciente fue: metanol (35.3%) > hidrógeno (32.9%) > acetato (31.9%).
DISCUSIÓN
Los valores de temperatura cuantificados en las lagunas de Cerritos, Campón, Bobo y Pereyra, fueron semejantes al intervalo reportado como óptimo para el crecimiento de las BSR y de las BM mesofílicas, es decir, entre 30 y 35°C en sedimentos acuáticos y de manglares (Zeikus & Winfrey, 1976; Mohanraju et al., 1997).
Los valores de pH cuantificados también fueron adecuados para el desarrollo de las poblaciones microbianas. Gunnarsson y Rönnow (1982) cuantificaron las poblaciones metanogénicas en sedimentos costeros con pH de 7.1-7.5 y Mohanraju et al. (1997) reportan dichas bacterias en pH de 6.6 - 7.2.
Respecto a las condiciones de óxido-reducción, los valores de Eh evaluados en los sedimentos lagunares fueron más negativos en comparación con los de los sedimentos de marismas con Spartina alterniflora (-150 a -175 mV), sedimentos limosos de color negro con presencia de bacterias sulfatorreductoras (-100 a -200 mV) y sedimentos costeros aledaños a cultivos de mejillón (-100 a -200 mV) (Teal & Kanwisher, 1962; Howes et al., 1981; Gunnarsson & Rönnow, 1982). Los intervalos del Eh fueron adecuados para el desarrollo de las BSR y BM, la presencia de bacterias sulfatorreductoras se ha reportado en Eh de -120 hasta -450 mV, mientras que las metanogénicas abundan en Eh inferiores a -220 mV (Cappenberg, 1974; Conrad & Schutz, 1988).
Las BSR y BM son abundantes en ambientes con altos contenidos de carbono orgánico como los cuantificados en el presente estudio, 6.13-217.95 g/l y 49.51-284.09 g/l en Chantuto-Panzacola y Carretas-Pereyra, respectivamente.
Particularmente en las lagunas Pereyra y Campón, el estrato de los 6-12 cm de profundidad se caracterizó por tener abundantes restos de madera, los cuales son el resultado de la depositación de troncos de árboles que fueron arrastrados por los ríos durante la tormenta tropical "Javier" que se registró en la zona en el mes de agosto de 1998. Como resultado de la acumulación de madera, el contenido de carbono orgánico en el estrato de los 6-12 cm de profundidad es alto y el pH en estos sedimentos es ácido. Estas condiciones no se presentaron en las lagunas de Cerritos y Bobo.
Dinámica estacional de las poblaciones microbianas anaeróbicas. En la temporada de secas disminuyo el aporte fluvial, causando un aumento en el contenido de sólidos y la presencia de condiciones de óxido-reducción más negativas. La disminución del aporte fluvial y el aumento de temperatura provocaron un incremento de la salinidad y altos contenidos de sulfatos. Con estas condiciones las BSR en los sedimentos de los sistemas estuarino-lagunares Chantuto-Panzacola y Carretas-Pereyra fueron más abundantes para los cuatro sustratos analizados, es decir, acetato, propionato, lactato e hidrógeno.
El acetato se libera como un producto de la fermentación de los carbohidratos, o bien, a partir de la oxidación incompleta del lactato por medio de algunas especies de BSR (Laanbroek & Pfennig, 1981). Las BSR acetoclásticas en este estudio representaron del 24 al 26.6% de la abundancia total. En ambientes con un alto contenido de sulfatos, el acetato es un sustrato importante para la sulfatorreducción, contribuyendo entre el 35.5 al 100% de la misma (Ward & Olson, 1980; Winfrey & Ward, 1983; Parkes et al., 1989; Alphenaar et al., 1993).
El propionato es un producto común de diversas fermentaciones y, al parecer, al incrementarse la concentración de sulfatos aumenta su utilización como sustrato para la sulfatorreducción. En pruebas de actividad cinética utilizando sedimentos marinos y molibdato como inhibidor de la sulfatorreducción, se presentó una acumulación de propionato y butirato en los mismos, corroborando así que este ácido graso es un sustrato importante para la sulfatorreducción en medios marinos y estuarinos (Banat & Nedwell, 1983; Dicker & Smith., 1985). En los sedimentos de Campón, Cerritos, Pereyra y Bobo las BSR que emplean propionato fueron entre el 23.3 y el 25.2% del total. En zonas con aportes constantes de sulfatos dicho sustrato representa del 6 al 12.5% de la sulfatorreducción (Parkes et al., 1989). Las BSR utilizadoras de propionato generalmente pertenecen al género Desulfobulbus (Laanbroek & Pfennig, 1981; Vance & Brink, 1994).
El lactato es el resultado de la actividad microbiana fermentadora y también un producto de excreción de los invertebrados bentónicos, éste puede ser oxidado completamente hasta CO2, o de forma incompleta dando como resultado la formación de acetato. El lactato en sedimentos de medios marinos que muestran un enriquecimiento con materia orgánica propicia un desarrollo rápido de las BSR, principalmente de las especies del género Desulfovibrio (Parkes et al., 1989). En sedimentos estuarinos anóxicos de la Bahía Kingoodie las BSR que utilizan lactato fueron dominantes (71%), seguidas por las que emplean propionato (17%) y acetato (12%) (Gibson et al., 1987). En las lagunas estudiadas, las utilizadoras del lactato, con respecto a la abundancia total, fueron del 24.4 al 25.6%.
El hidrógeno es el principal producto de la fermentación de muchas especies bacterianas, hongos y protozoarios. Asimismo, puede ser generado por las bacterias sintróficas. La abundancia de las BSR hidrogenofílicas estuvo entre el 23.8 y el 27.2% del total. El hidrógeno es utilizado por algunas especies sulfatorreductoras de los géneros Desulfobacter y Desulfovibrio, entre otros (Gibson, 1990).
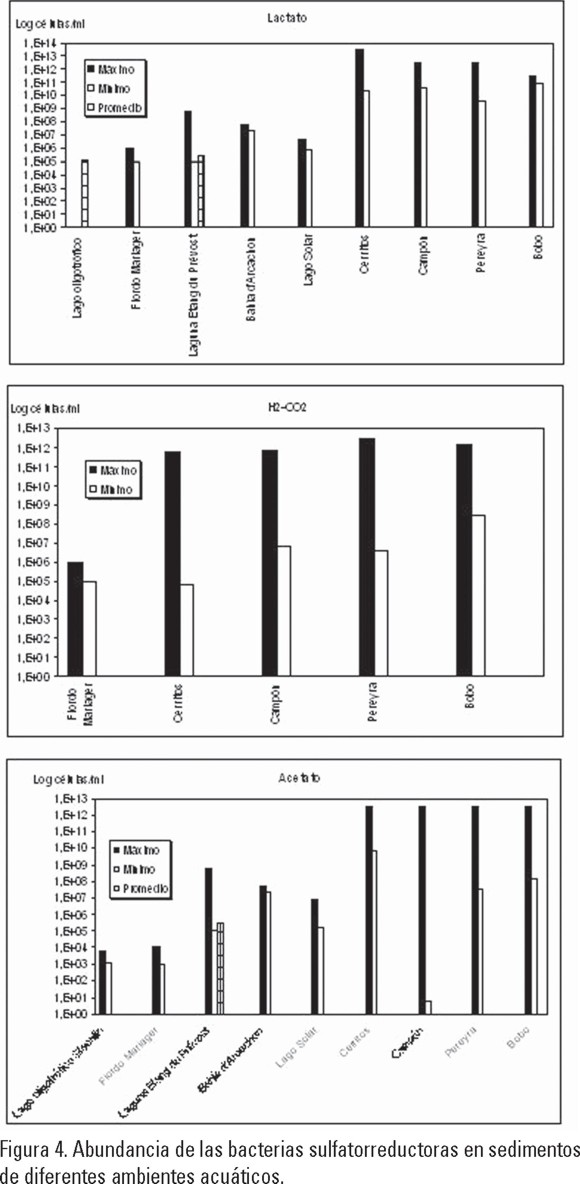
Las características fisicoquímicas de las lagunas de Campón, Cerritos, Pereyra y Bobo favorecieron que la densidad de las BSR de los cuatro grupos nutricionales cuantificados (101-1013 células/cm3) fuera superior a las abundancias reportadas en otros ambientes tanto dulceacuícolas como marinos de latitudes templadas (103-107 células/cm3), entre ellos lagos oligotróficos, fiordos, bahías y lagunas costeras (Schaub & Gemerden, 1996; Teske et al., 1996; Sass et al., 1997) (Fig. 4).
En los meses asociados a la temporada de lluvias, el aumento de la precipitación y del flujo de los ríos a las lagunas ocasionó una disminución de la salinidad y del contenido de sulfatos. Al mismo tiempo, se registró un cambio electroquímico en los sedimentos con valores de Eh menos reductores. A pesar de la presencia de Eh menos reductores, el intervalo de esta variable fue adecuado para el desarrollo de las BM. Con base en los resultados de las correlaciones efectuadas, la salinidad y la concentración de sulfatos son las principales variables ambientales que explican entre el 75 y el 88% de la abundancia y distribución de las BM. Los tres grupos nutricionales analizados de dichas bacterias tuvieron una correlación negativa con las variables mencionadas; por lo cual, al contrario de lo que ocurre con las sulfatorreductoras, las BM fueron más abundantes durante los meses asociados a las lluvias cuando se registró una menor salinidad y concentración de sulfatos.
En lo que respecta a la utilización de sustratos, las BM hidrogenofílicas contribuyen entre el 32.8 y el 34.3% de la densidad total. El H2-CO2 puede ser utilizado como sustrato por especies de los géneros Methanobacterium, Methanobrevibacter, Methanothermus, Methanococcus, Methanomicrobium, Methan ogenium, Methanospirillum, Methanosarcina y Methanoplanus (Olliver et al., 1986; Vogels et al., 1988). Es un precursor importante para la metanogénesis principalmente en sedimentos dulceacuícolas y en aguas residuales (Abram & Nedwell, 1978), contribuyendo aproximadamente del 36 al 98% del metano producido en sedimentos lacustres, mientras que en digestores anaeróbicos de aguas de desecho representa del 14 al 30% (Sandbeck & Ward, 1981). Teóricamente, el H2-CO2 es el sustrato del 33% de la metanogénesis total cuando los carbohidratos o formas similares de materia orgánica son degradados (Conrad, 1999).
El acetato genera dos terceras partes del metano, conociéndose seis géneros capaces de utilizarlo: Methanosarcina, Methanococcoides, Methanohalobium, Methanohalophilus, Methanolobus y Methanothrix (Holt et al., 1994). Este ácido graso puede contribuir al 73-90% del metano producido en digestores anaeróbicos de aguas de desecho y al 70% en sedimentos lacustres (Sandbeck & Ward, 1981). En este estudio las BM acetoclásticas representaron aproximadamente el 32% de la abundancia total.
El metanol se origina del rompimiento de compuestos metilados como la pectina y las ligninas. En los sedimentos donde el sulfato no es limitante, éste es el principal sustrato para las bacterias metanogénicas (Mathrani & Boone, 1985). La abundancia de las BM que emplean metanol representó del 33.9 al 35.5 % del total. Lovley y Klug (1983) determinaron que la formación de metano a partir de metanol representa del 2.8-4.0% de la producción total y ayuda a las bacterias metanogénicas a mantener sus poblaciones cuando hay suministro de sulfatos al medio. Se conocen once especies de bacterias metanogénicas capaces de utilizarlo, pertenecientes a los géneros Methanococcus, Methanosarcina, Methanohalophilus, Methanococcoides y Methanolobus (Vogels et al., 1988).
La densidad de las BM cuantificadas en los sedimentos de Campón, Cerritos, Bobo y Pereyra correspondiente a los tres grupos nutricionales analizados (102-1013 células/g ST), fue superior a la reportada para otros ecosistemas, incluyendo sedimentos lacustres donde este tipo de poblaciones microbianas son abundantes (103-106 células/g ST) (Fig. 5) (Cappenberg, 1974; Jones & Paynter, 1980; Phelps & Zeikus, 1985; Franklin et al., 1988).

En las lagunas estudiadas, el acetato y el hidrógeno son sustratos importantes para las BM y las BSR como lo demuestran las densidades cuantificadas de los grupos nutricionales acetoclásticos e hidrogenofílicos. El consumo de H2, con la reducción del CO2 a través de la sulfatorreducción y la metanogénesis, contribuye a eliminar el hidrógeno del medio, siendo un proceso importante porque permite que continúen las reacciones de fermentación en equilibrio (Conrad et al., 1985) e impide la inhibición de la metanogénesis a partir de acetato (Lovley & Ferry, 1985).
Distribución espacial. Con base en los resultados de la cuantificación de las poblaciones bacterianas obtenidos en función de la profundidad, así como del análisis ANOVA, los procesos de metanogénesis y sulfatorreducción aparentemente pueden coexistir a lo largo de la columna sedimentaria (Fig. 3), no observándose una clara separación espacial entre ambas comunidades microbianas como se ha establecido anteriormente en ecosistemas costeros y dulceacuícolas de latitudes templadas (Gunnarsson & Rönnow, 1982).
De manera general, en estudios previos se ha reportado que la máxima actividad sulfatorreductora se localiza en los primeros centímetros del sedimento (entre los 0 y 2 cm), con una tendencia general hacia una disminución de la misma conforme aumenta la profundidad. En estos primeros centímetros del se dimento donde se alcanzan a difundir los sulfatos, las BSR metabolizan los principales productos resultantes de la fermentación y dominan sobre las BM (Winfrey & Ward, 1983; Howarth & Merkel, 1984). Fukui y Takii (1996) en un lago hipereutrófico cuantificaron la mayor abundancia de las bacterias sulfatorreductoras en los primeros centímetros del sedimento, dominando las que utilizan lactato, seguidas por las que emplean propionato y acetato.
A consecuencia de la actividad sulfatorreductora, la mayor parte de los sulfatos se reducen en los primeros centímetros del sedimento, hecho que da como resultado que al aumentar la profundidad de la columna sedimentaria se limite el crecimiento de las BSR, incrementándose la abundancia de las BM justo por debajo de la zona de sulfatorreducción (Howarth & Merkel, 1984; Gibson et al., 1987). Asimismo, se ha observado que la abundancia de las BM hidrogenofílicas se relaciona con la presencia de materia orgánica fácilmente degradable (Zepp Falz et al., 1999).
Para concluir, la densidad de las bacterias sulfatorreductoras y metanogénicas cuantificada en este estudio fue superior a la reportada en otros ecosistemas acuáticos de latitudes templadas y tropicales. El desarrollo de estas poblaciones bacterianas en todos los meses analizados se relaciono por las características químicas del sedimento de las lagunas costeras estudiadas, es decir, temperaturas cálidas cercanas al óptimo mesofílico, un pH ácido-neutro y Eh reductores.
En los sistemas estuarino-lagunares de Chantuto-Panzacola y Carretas-Pereyra, las BSR fueron los microorganismos más abundantes implicados en la degradación anaeróbica de la materia orgánica en la temporada de secas; durante ésta el desarrollo de las BSR se vio favorecido por las temperaturas cálidas (25.7-29.8°C), salinidades básicamente polihalinas (10-30 ups), un contenido de sulfatos de 3.5-14.3 mM, pH con tendencia a la neutralidad (6.8-7.2) y potenciales de óxido-reducción más negativos (-111 a -490). Estas condiciones fueron el resultado de una disminución de la precipitación y del aporte de agua dulce procedente de los ríos.
Por el contrario, las BM fueron abundantes en la temporada de lluvias. La presencia y distribución de las BM durante dicha temporada se relacionó principalmente con las características oligohalinas de las lagunas (0-12 ups), un bajo contenido de sulfatos, entre 2.1-7.9 mM, y pH ácidos (6.5-6.9), determinados por el incremento de los aportes fluviales y la precipitación en los sistemas lagunares.
Aunado a lo anterior, las comunidades microbianas sulfatorreductoras y metanogénicas coexisten a lo largo de los 12 cm de profundidad en los sedimentos analizados. Sin embargo, sería necesario efectuar un análisis molecular (como FISH) para confirmarlo.
AGRADECIMIENTOS
Este trabajo es el resultado del proyecto de investigación "Determinación de la diversidad y actividad bacteriana sulfatorreductora y metanogénica en los sedimentos de los ecosistemas estuarino-lagunares del Estado de Chiapas" desarrollado en el Doctorado en Ciencias Biológicas de la Universidad Autónoma Metropolitana, unidades Iztapalapa y Xochimilco. El trabajo fue patrocinado por el Laboratorio de Ecosistemas Costeros de la UAM-Iztapalapa a través del proyecto "Diagnóstico Ecológico de los Humedales Costeros del Estado de Chiapas" aprobado por la División de Ciencias Biológicas y de la Salud (2002-2004). Se agradece al Dr. Francisco Gutiérrez Mendieta y al M. en B. Francisco Varona Cordero por su apoyo en el proceso estadístico de los resultados.
REFERENCIAS
ABRAM, J. W. & D. B. NEDWELL. 1978. Hydrogen as a substrate for methanogenesis and sulphate reduction in anaerobic saltmarsh sediment. Archives of Microbiology 117: 93-97. [ Links ]
ALONGI, D. M., F. TIRENDI, P. DIXON, L. A. TROTT & G. J. BRUNSKILL. 1999. Mineralization of organic matter in intertidal sediments of a tropical semi-closed delta. Estuarine Coastal and Shelf Science 48: 451-467. [ Links ]
ALPHENAAR, P. A., A. VISSER & G. LETTINGA. 1993. The effect of liquid upward velocity and hydraulic retention time on granulation in UASB reactors treating wastewater with a high sulphate content. Bioresearch Technology 43: 249-258. [ Links ]
APHA, AWWA & WPCF. (EDS). 1989. Standard Methods for the Examination of Water and Wastewater. Washington, D. C. United States: American Public Health Association, American Water Works Association and Water Pollution Control Federation (APHA, AWWA and WPCF). 989 p. [ Links ]
BALBA, M. T. & D. B. NEDWELL. 1982. Microbial metabolism of acetate, propionate and butyrate in anoxic sediment from Colne Point saltmarsh, Essex, U. K. Journal of General Microbiology 128: 1415-1422. [ Links ]
BALCH, W. E., G. E. FOX, L. J. MAGRUM, C. R. WOESE & R. S. WOLFE. 1979. Methanogens: reevaluation of a unique biological group. Microbiological Reviews 43: 260-296. [ Links ]
BANAT, I. M. & D. B. NEDWELL. 1983. Mechanisms of turnover of C2-C4 fatty acids in high-sulphate and low-sulphate anaerobic sediments. FEMS Microbiology Letters 17: 107-110. [ Links ]
CAPPENBERG, T. E. 1974. Interrelations between sulfate-reducing and methane-producing bacteria in bottom deposits of a freshwater lake. II. Inhibition experiments. Antonie Van Leeuwenhoek. Journal of Microbiological Series 40: 297-306. [ Links ]
CONRAD, R. 1999. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments. FEMS Microbiology Ecology 28: 193-202. [ Links ]
CONRAD, R., T. J. PHELPS & J. G. ZEIKUS. 1985. Gas metabolism evidence in support of the juxtaposition of hydrogen-producing and methanogenic bacteria in sewage sludge and lake sediments. Applied and Environmental Microbiology 50: 595-601. [ Links ]
CONRAD, R. & H. SCHÜTZ. 1988. Methods of studying methanogenic bacteria and methanogenic activities in aquatic emvironments. In: B. Austin (Ed.). Methods in Aquatic Bacteriology. John Wiley and Sons. Great Britain. pp. 301-346. [ Links ]
CORD-RUWISCH, R. 1985. A quick method for the determination of dissolved and precipitated sulfides in cultures of sulfate-reducing bacteria. Journal of Microbiological Methods 1: 2-10. [ Links ]
DICKER, H. J. & D. W. SMITH. 1985. Effects of organic amendments of sulfate reduction activity, H2 consumption, and H2 production in salt marsh sediments. Microbial Ecology 11: 299-315. [ Links ]
DUBOIS, M., K. A. GILLES, J. K. HAMILTON, P. A. REBERS & F. SMITH. 1956. Colorimetric method for determination of sugars and related substances. Analytical Chemistry 28: 350-356. [ Links ]
FRANKLIN, M. J., J. W. WILLIAM & W. B. WHITMAN. 1988. Populations of methanogenic bacteria in a Georgia salt marsh. Applied and Environmental Microbiology 54: 1151-1157. [ Links ]
FUKUI, M & S. TAKII. 1996. Microdistribution of sulfate-reducing bacteria in sediments of a hypertrophic lake and their response to the addition of organic matter. Ecological Research 11: 257-267 [ Links ]
FUKUI, M., J. SUH, Y. YONEZAWA & Y. URUSHIGAWA. 1997. Major substrates for microbial sulfate reduction in the sediments of Ise Bay, Japan. Ecology Research 12: 201-209. [ Links ]
GAUDETTE, H., W. FLIGH, L. TONER & D. FOLGER. 1974. An inexpensive tritation method for the determination of organic carbon in recent sediments. Journal of Sediment and Petrology 44: 249-253. [ Links ]
GIBSON, G. R. 1990. Physiology and ecology of the sulphate-reducing bacteria. Journal of Applied Bacteriology 69: 769-797. [ Links ]
GIBSON, G. R., R. J. PARKES & R. A. HERBERT. 1987. Evaluation of viable counting procedures for the enumeration of sulfate-reducing bacteria in estuarine sediments. Journal of Microbiology Methods 7: 201-210. [ Links ]
GUNNARSSON, L. A. H. & P. H. RÖNNOW. 1982. Interrelationships between sulfate reducing and methane producing bacteria in coastal sediments with intense sulfide production. Marine Biology 69: 121-128. [ Links ]
HOLT, J. G., N. KRIEG R., P. SNEATH H. A., J. STANLEY T. & W. STANLEY T. 1994. The methanogens. Bergey's Manual of Determinative Bacteriology. William & Wilkins. Baltimore, U.S.A. 719-735 [ Links ]
HOWARTH, R. W. 1978. A rapid and precise method for determining sulfate in seawater, estuarine waters, and sediment pore waters. Limnology and Oceanography 23: 1066-1069. [ Links ]
HOWARTH, R. W. & S. MERKEL. 1984. Pyrite formation and the measurement of sulfate reduction in salt marsh sediments. Limnology and Oceanography 29: 598-608. [ Links ]
HOWES, B. L. 1985. Effects of sampling technique on measurements of porewater constituents in salt marsh sediments. Limnology and Oceanography 30: 221-227. [ Links ]
HOWES, B. L., R. W. HOWARTH, J. M. TEAL & I. VALIELA. 1981. Oxidation-reduction potentials in a salt marsh. Spacial patterns and interactions with primary production. Limnology and Oceanography 26: 350-360. [ Links ]
HUNGATE, R. E. 1969. A roll tube method for cultivation of strict anaerobes. In: Norris, J. R. & D. W. Ribbons (Eds). Methods in Microbiology. Academic Press., pp. 117-132. [ Links ]
INE-SEMARNAP (ED) 1999. Programa de Manejo Reserva de la Biósfera La Encrucijada. México: Instituto Nacional de Ecología-Secretaría del Medio Ambiente, Recursos Naturales y Pesca [ Links ]
JONES, W. J. & M. J. B. PAYNTER. 1980. Populations of methane-producing bacteria and in vitro methanogenesis in salt marsh and estuarine sediments. Applied and Environmental Microbiology 39: 864-871. [ Links ]
JØRGENSEN, B. B. 1982. Mineralization of organic matter in the sea-bed-the role of sulphate-reduction. Nature. 296: 643-645 [ Links ]
KING, G. M. 1984. Utilization of hydrogen, acetate, and "noncompetitive" substrates by mtehanogenic bacteria in marine sediments. Geomicrobiology Journal 3: 275-306. [ Links ]
LAANBROEK, H. J. & N. PFENNIG. 1981. Oxidation of short chain fatty acids by sulfate-reducing bacteria in freshwater and in marine sediments. Archives of Microbiology 128: 330-335. [ Links ]
LANGMUIR, D. 1971. Eh-pH determination. In: Conver, R. E. (Ed). Proceedings Sediments and Petrology. Wiley-Interscience, p. 653. [ Links ]
LOVLEY, D. R. & M. J. KLUG. 1983. Methanogenesis from methanol and methylamines and acetogenesis from hydrogen and carbon dioxide in the sediments of an eutrophic lake. Applied and Environmental Microbiology 45: 1310-1315. [ Links ]
LOVLEY, D. R. & J. G. FERRY. 1985. Production and consumption of H2 during growth of Methanosarcina spp. on acetate. Applied and Environmental Microbiology 49: 247-249. [ Links ]
MATHRANI, I. M. & D. R. BOONE. 1985. Isolation and characterization of a moderately halophilic methanogen from a solar saltern. Applied and Environmental Microbiology 50: 140-143. [ Links ]
MOHANRAJU, R. & R. NATARAJAN. 1992. Methanogenic bacteria in mangrove sediments. Hydrobiologia 247: 187-193. [ Links ]
MOHANRAJU, R., B. S. RAJAGOPAL & L. DANIELS. 1997. Isolation and characterization of a methanogenic bacterium from mangrove sediments. Journal of Marine Biotechnology 5: 147-152. [ Links ]
MOUNTFORT, D. O., R. A. ASHER, E. L. MAYS & J. M. TIEDJE. 1980. Carbon and electron flow in mud and sandflat intertidal sediments at Delaware Inlet, Nelson, New Zealand. Applied and Environmental Microbiology 39: 686-694. [ Links ]
NEDWELL, D. B. & J. W. ABRAM. 1978. Bacterial sulfate reducing in relation to sulfur geochemistry in two contrasting areas of salt marsh sediment. Estuarine and Coastal Marine Science 6: 341-351. [ Links ]
OLLIVER, B. M., R. A. MAH, J. L. GARCIA & D. R. BOONE. 1986. Isolation and characterization of Methanogenium bourgense sp. nov. International Systematic Bacteriology 36: 297-301. [ Links ]
OREMLAND, R. S., L. M. MARSH & S. POLCIN. 1982. Methane production and simultaneous sulphate reduction in anoxic, salt marsh sediments. Nature 296: 143-145. [ Links ]
OREN, A. 1988. Anaerobic degradation of organic compounds at high salt concentrations. Antonie van Leeuwenhoek 54: 267-277. [ Links ]
PARKES, R. J., G. R. GIBSON, I. MUELLER-HARVEY, W. J. BUCKINGHAM & R. A. HEREBERT. 1989. Determination of the substrates for sulphate-reducing bacteria within marine and estuarine sediments with different rates of sulphate reduction. Journal of General Microbiology 135: 175-187. [ Links ]
PHELPS, T. J. & J. G. ZEIKUS. 1985. Effect of fall turnover on terminal carbon metabolism in Lake Mendota sediments. Applied and Environmental Microbiology 50: 1285-1291. [ Links ]
PURDY, K. J., M. A. MUNSON, D. B. NEDWELL & T. M. EMBLEY. 2002. Comparison of the molecular diversity of the methanogenic community at the brackish and marine ends of UK estuary. FEMS Microbiology Ecology 39: 17-21. [ Links ]
RAMAMURTHY, T., R. MOHANRAJU & R. NATARAJAN. 1990. Distribution and ecology of methanogenic bacteria in mangrove sediments of Pichavaram, east coast of India. Indian Journal of Marine Science 19: 269-273. [ Links ]
RAVOT, G., B. OLLIVIER, M. MARGOT, M. L. FARDEAU, K. C. PATEL, G. PRENSIER, A. EGAN & J. L. GARCÍA. 1995. Thermotoga elfii sp. Nov., a novel thermophilic bacterium from an African oil producing well. International Journal of Systematic Bacteriology 45: 308-314. [ Links ]
RICO-GRAY, V. 1981. Rhizophora harrisonnii (Rhizophoraceae), un nuevo registro de las costas de México. Boletín de la Sociedad Botánica de México 41: 163-165. [ Links ]
SALGADO-UGARTE, I. H. 1992. Introducción al análisis exploratorio de datos biológicos. Fundamentos y aplicaciones. Marc Ediciones, UNAM. México. 243 p. [ Links ]
SANDBECK, K. A. & D. M. WARD. 1981. Fate of immediate methane precursors in low-sulfate, hot-spring algal-bacterial mats. Applied and Environmental Microbiology 41: 775-782. [ Links ]
SASS, H., H. CYPIONKA & H.-D. BABENZIEN. 1997. Vertical distribution of sulfate-reducing bacteria at the oxic-anoxic interface in sediments of the oligotrophic Lake Stechlin. FEMS Microbiology Ecology 22: 245-255. [ Links ]
SCHAUB, B. E. M. & H. V. GEMERDEN. 1996. Sulfur bacteria in sediments of two coastal ecosystems: the Bassin d'Arcachon and the Etang du Prévost, France. Hydrobiologia 329: 199-210. [ Links ]
SENIOR, E., E. B. LINDSTROM, I. M. B. & D. B. NEDWELL. 1982. Sulfate reduction and methanogenesis in the sediment of a saltmarsh on the east coast of the United Kingdom. Applied and Environmental Microbiology 43: 987-996. [ Links ]
SØRENSEN, J., B. B. JØRGENSEN & N. B. REVSBECH. 1979. A comparasion of oxygen, nitrate and sulfate respiration in coastal marine sediments. Microbial Ecology 5: 105-115. [ Links ]
SØRENSEN, J., D. CHRISTENSEN & B. B. JØRGENSEN. 1981. Volatile fatty acids and hydrogen as substrates for sulfate-reducing bacteria in anaerobic marine sediment. Applied and Environmental Microbiology 42: 5-11. [ Links ]
STRICKLAND, J. D. H. & T. R. PARSONS. 1972. A Practical Handbook of Seawater Analysis. Fisheries Research Board of Canada. Ottawa, Canada. 310 [ Links ]
TEAL, J. M. & J. KANWISHER. 1962. Gas exchange in a Georgia salt marsh. Limnology and Oceanography 6: 388-399. [ Links ]
TESKE, A., C. WAWER, G. MUYZER & N. B. RAMSING. 1996. Distribution of sulfate-reducing bacteria in a stratified fjord (Mariager Fjord, Denmark) as evaluated by most-probable-number counts and denaturing gradient gel electrophoresis of PCR-amplified ribosomal DNA fragments. Applied and Environmental Microbiology 62: 1405-1415. [ Links ]
VANCE, I. D. & E. BRINK. 1994. Propionate-driven sulphate reduction by oil-field bacteria in a pressurised porous rock bioreactor. Applied and Environmental Microbiology 40: 920-925. [ Links ]
VOGELS, G. D., J. T. KELTJENS & C. V. D. DRIFT. 1988. Biochemistry of methane production. In: Zehnder, A. J. B. (Ed). Biology of Anaerobic Microorganisms. John Wiley and Sons, pp. 707-770. [ Links ]
WARD, D. M. & G. J. OLSON. 1980. Terminal processes in the anaerobic degradation of an algal-bacterial mat in a high-sulfate hot in spring. Applied and Environmental Microbiology 40: 67-74. [ Links ]
WINFREY, M. R. & D. M. WARD. 1983. Substrates for sulfate reduction and methane production in intertidal sediments. Applied and Environmental Microbiology: 193-199. [ Links ]
ZAR, J. H. 1997. Biostatistical Analysis. Prentice Hall. Englewood Clifs. New Jersey. 718 p. [ Links ]
ZEIKUS, J. G. & M. R. WINFREY. 1976. Temperature limitation of methanogenesis in aquatic sediments. Applied and Environmental Microbiology 31: 99-107. [ Links ]














