Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.16 no.1 Ciudad de México abr. 2006
Artículos
Características histológicas de los estadios de atresia de folículos ováricos en dos especies de teleósteos vivíparos: llyodon whitei (Meek, 1904) y Goodea atripinnis (Jordan, 1880) (Goodeidae)
Histological features of atretic stages of the ovarian follicles of two viviparous teleost species: llyodon whitei (Meek, 1904) and Goodea atripinnis (Jordan, 1880) (Goodeidae)
Mari Carmen Uribe Aranzábal, Gabino De la Rosa Cruz, Adriana García Alarcón, Sandra Milena Guerrero-Estévez y Marcela Aguilar Morales
Laboratorio de Biología de la Reproducción Animal. Facultad de Ciencias, Universidad Nacional Autónoma de México. Cd. Universitaria. Coyoacán 04510 México, D.F. mcua@hp.fciencias.unam.mx
Recibido: 15 de febrero de 2005
Aceptado: 24 de octubre de 2005
RESUMEN
La atresia, proceso de degeneración y reabsorción de folículos ováricos, es un aspecto esencial de la fisiología ovárica e influye en los índices de fertilidad, reduciendo el número de folículos que maduran. En los teleósteos vivíparos, la atresia adquiere características específicas debido al doble papel reproductor del ovario, como sitio de desarrollo folicular y de gestación. Se analizaron las características histológicas de los folículos atrésicos en dos especies de teleósteos vivíparos de la familia Goodeidae, Ilyodon whitei y Goodea atripinnis. Los ovarios se procesaron para la obtención de preparaciones histológicas. Estas especies muestran diferente número promedio de embriones en el ovario, 30 en I. whitei, y 55 en G. atripinnis. Todos los ovarios no gestantes y gestantes de I. whitei y G. atripinnis presentaron folículos atrésicos, En ambas especies, la atresia ocurre en folículos previtelogénicos y vitelogénicos. Los ovocitos en vitelogénesis avanzada solamente están presentes antes de la fecundación. Todos los ovocitos vitelogénicos que no fueron fecundados, se observaron atrésicos. Durante la gestación avanzada, en ambas especies, no se observaron ovocitos en vitelogénesis avanzada, y los vitelogénicos tempranos mostraron atresia.
Palabras clave: Atresia folicular, ciclo ovárico, teleósteos vivíparos, Goodeidae.
ABSTRACT
Atresia, the process of degeneration and removal of ovarian follicles from the ovary is an essential aspect of the ovarian physiology. It plays an important role in fecundity, reducing the number of maturing oocytes. In viviparous teleosts, atresia shows special characteristics because of the dual reproductive role of the ovary, as the place for follicular development and gestation. The histological features of atretic follicles in two species of viviparous teleosts, Ilyodon whitei and Goodea atripinnis, were observed. The ovaries were processed histologically. These species have a different average number of embryos, 30 in I. whitei, and 55 in G. atripinnis. All the ovaries observed during non gestation and gestation stages of I. whitei and G. atripinnis contained atretic follicles. Follicles may become atretic at previtellogenic and vitellogenic stages. In both species, late vitellogenic oocytes are seen only around the time of fertilization. All of the non-fertilized vitellogenic oocytes become atretic. In both species, late vitellogenic oocytes were not seen during late gestation, and most of the early vitellogenic oocytes observed were atretic.
Key words: Follicular atresia, ovarian cycle, viviparous teleosts, Goodeidae.
INTRODUCCIÓN
En teleósteos, durante el proceso de desarrollo folicular se forman cíclicamente los folículos, desde primarios, hasta su fase de maduración y ovulación. Sin embargo, no todos los folículos ováricos que inician su desarrollo alcanzan su madurez, algunos de ellos inician un proceso de degeneración y reabsorción, formando folículos atrésicos.
En teleósteos ovíparos se ha identificado el proceso de atresia en diversas especies, entre las cuales están: Acanthobrama terraesanctae (Yaron, 1971); Amphipnous cuchia (Rastogi, 1969); Apeltes quadracus (Wallace & Selman, 1979); Astyanax bimaculatus lacustris (Miranda et al., 1999), Carassius auratus (Yamamoto & Yamazaki, 1961; Khoo, 1975; Nagahama, 1983); Eucalia inconstans (Braekevelt & MacMillan, 1968); Gadus morhua (Kjesbu et al., 1991); Gasterosteus aculeatus (Wallace & Selman, 1979); Gobius giuris (Rajalakshmi, 1966); Leporinus reinhardti (Miranda et al., 1999); Macrodon ancylodon (Vizziano & Berois, 1990); Oncorhynchus mykiss (Tyler et al., 1990; Bromage et al., 1992); Parophrys vetulus (Johnson et al., 1988); Tilapia nilotica (Yaron, 1971).
Son muy escasas las referencias relacionadas con estudios sobre atresia en teleósteos vivíparos. Turner (1938), analiza la atresia en Cymatogaster aggregatus, especie de la familia Embiotocidae. Constantz (1989) menciona la atresia en Poeciliopsis sp., Lambert (1970) en Poecilia reticulata, y Uribe et al. (2004) en Poeciliopsis gracilis, especies de la familia Poeciliidae. En cuanto a la familia Goodeidae, a la cual pertenecen las especies seleccionadas para el presente trabajo, Turner (1933) menciona la atresia en Goodea bilineata, y Mendoza (1940) en Skiffia (=Neotoca) bilineata (Meyer et al. 1985).
La carencia de oviductos en los teleósteos implica que el ovario en las especies vivíparas, además de ser el sitio donde ocurre el desarrollo folicular, es también el sitio de gestación (Turner, 1933; Mendoza, 1940; Wourms, 1981; Uribe et al., 2004). Los goodeidos presentan gestación intraovárica de tipo intraluminal (desarrollo de los embriones en el lumen ovárico) (Turner, 1933; Mendoza, 1940; Wourms, 1981). El número de crías que se desarrollan simultáneamente en el ovario de las especies de goodeidos puede variar, Meyer et al. (1985), mencionan el desarrollo de 25-30 crías en Ilyodon whitei y 50-60 crías en Goodea atripinnis. Los goodeidos son modelos muy adecuados para el análisis de los cambios cíclicos del ovario de especies vivíparas durante el ciclo reproductor, tanto durante la maduración de los folículos, como en la gestación. Con base en lo anterior, el objetivo de este trabajo es describir las características histológicas de los estadios de los folículos atrésicos en ovarios no gestantes y en gestación temprana y avanzada de dos especies de goodeidos, I. whitei y G. atripinnis.
MATERIAL Y MÉTODOS
Se recolectaron 18 hembras adultas de Ilyodon whitei y Goodea atripinnis, 9 de cada especie (3 no gestantes, 3 en gestación temprana y 3 en gestación avanzada). I. whitei se recolectó en el río Amacuzac, Morelos, México, y G. atripinnis, en la laguna de Cuitzeo, Michoacán, México. Se disecaron los ovarios y se aplicó el procedimiento histológico (Aguilar et al., 1996) de la siguiente forma: los ovarios obtenidos se fijaron en Bouin, se deshidrataron en alcoholes graduales, se incluyeron en parafina con índice de fusión de 56-58°C, se cortaron en secciones longitudinales en microtomo de rotación, con un grosor de 7µm. Se aplicaron las técnicas de tinción con hematoxilina-eosina (H-E) (panorama histológico general, núcleos, límites celulares, basofilia, acidofilia); tricrómica de Masson (fibras colágenas, vasos sanguíneos, fibras musculares); PAS (fibras colágenas, eritrocitos, membranas basales, zona pelúcida); azul alciano (vitelo, epitelios, sangre) y doble impregnación argéntica de Río Hortega (cromatina, fibras reticulares, fibras colágenas). Las preparaciones histológicas obtenidas se analizaron en un microscopio óptico, se seleccionaron los campos y tomaron fotomicrografías en un fotomicroscopio Zeiss III, con película de color 100 ASA.
RESULTADOS
Todos los ovarios no gestantes y gestantes de Ilyodon whitei y Goodea atripinnis presentaron folículos atrésicos, identificados por sus cambios histológicos, en los cuales se distinguieron cuatro estadios de atresia, tanto en folículos previtelogénicos como vitelogénicos que, de acuerdo con la clasificación que sugiere Lambert (1970), fueron las siguientes:
Estadio α, estadio temprano de atresia, que se caracterizó por cambios en la zona pelúcida, la cual presentó rupturas y ondulaciones, más prolongadas en la medida que avanzó el proceso de atresia (Figs. 1 A-E). El ovoplasma mostró ligeras alteraciones siendo evidentes signos de vacuolización e irregularidad en la intensidad en su afinidad acidófila y basófila a los colorantes (Figs. 1 C, 2 A, B). En algunos folículos atrésicos se observó proliferación de las células foliculares, formando dos o más capas alrededor del ovocito (Figs. 1 C, E, 2 A).
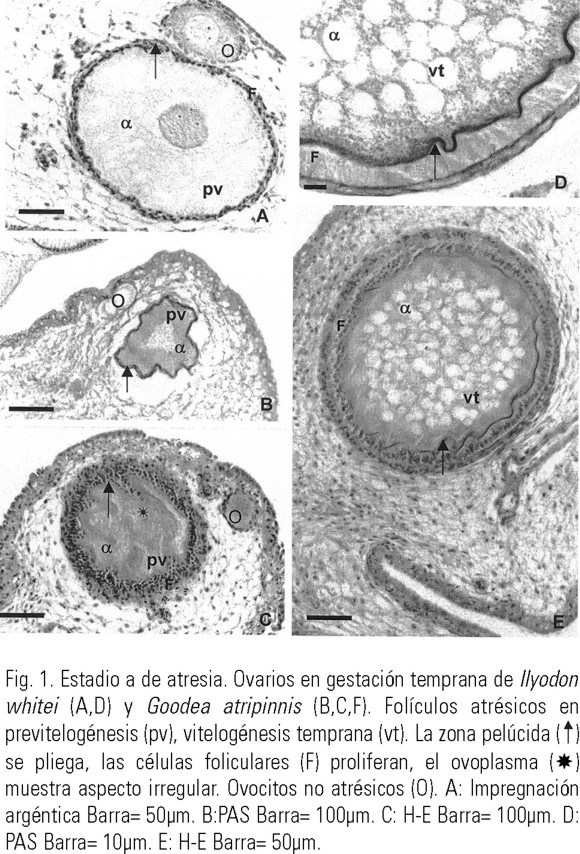

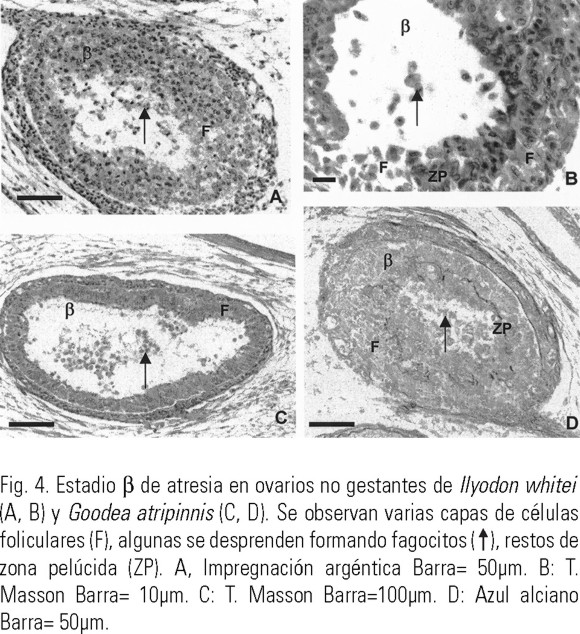
Estadio β, el ovoplasma disminuyó progresivamente (Fig. 3 A). Con frecuencia, el folículo perdió su forma esférica u ovoide y se tornó irregular, formando plegamientos en su periferia (Figs. 3 A, B). Continuó la proliferación de células foliculares (Figs. 3 C, D, 4 A-D) observada también en el estadio anterior. Algunas células foliculares se separaron de la capa folicular, formando fagocitos, desplazándose hacia los restos del ovocito (Figs. 3 C, 4 A, B). De la zona pelúcida sólo quedaron fragmentos, generalmente muy plegados (Fig. 4 B, D).

Estadio γ, las células periféricas de los folículos atrésicos, así como las que formaron fagocitos, se observaron en todo el espacio central, previamente ocupado por el ovocito (Fig. 5 A, B). La zona pelúcida se observó con mayor grado de fragmentación y disolución (Fig. 5 A, B). La teca vascularizada, se observó subyacente entre plegamientos de las capas de células foliculares (Fig. 5 A).

Estadio δ, las células de los folículos atrésicos se observaron más pequeñas y con gránulos PAS positivos (Fig. 5 C, D). El folículo atrésico disminuyó de tamaño y mostró su límite muy irregular (Figs. 5 C, D).
En ovarios no gestantes se observaron todas los estadios de atresia, en folículos previtelogénicos, vitelogénicos tempranos durante el depósito de las plaquetas vitelinas, y vitelogénicos avanzados durante la homogeneización del vitelo, con la confluencia de las plaquetas vitelinas.
En ambas especies, los ovarios en gestación temprana, con embriones en etapas de gastrulación y neurulación, mostraron todos los folículos vitelogénicos avanzados no fecundados en atresia (Figs. 6 A). Durante la gestación avanzada disminuyó el número de folículos ováricos, todos los folículos en vitelogénesis temprana se observaron atrésicos, y no se observaron folículos en vitelogénesis avanzada (Fig. 6 B).

DISCUSION
El análisis histológico de los folículos atrésicos de Ilyodon whitei y Goodea atripinnis mostraron cambios histológicos que indicaron su proceso de degeneración, coincidiendo con lo descrito por Lambert (1970), quien estudiando a Poecilia reticulata, los clasificó en cuatro estadios, también utilizados por Saidapur (1978), Nagahama (1983), Johnson et al. (1988) y Tyler & Sumpter (1996). Estos autores sintetizan los cambios observados en cada estadio: estadio α) alteraciones en el ovoplasma, proliferación de células foliculares y rupturas en la zona pelúcida; estadio β) reducción del ovoplasma por difusión y su fagocitosis por las células foliculares; estadio γ) las células foliculares y la teca vascularizada ocupan el espacio del ovocito; estadio δ) disminución progresiva del volumen del folículo atrésico. Johnson et al. (1988), resumen los cambios morfológicos descritos en dos fases fisiológicas: degeneración y reabsorción del ovocito durante los estadios α, y β, y regresión de las células foliculares y disminución progresiva del tamaño del folículo atrésico durante los estadios γ y δ.
El cambio más temprano observado en los folículos en atresia de Ilyodon whitei y Goodea atripinnis fue la ruptura y el plegamiento de la zona pelúcida, lo que indica, de acuerdo con lo descrito por Rajalakshmi (1966), en Gobius giuris y Vizziano & Berois (1990), en Macrodon ancylodon, alteración en el paso de metabolitos hacia el ovocito, desde los vasos capilares, a través de las células foliculares. Esta alteración se refleja, en las características morfológicas y fisiológicas del ovoplasma. Rajalakshmi (1966) observó la licuefacción del vitelo, como uno de los signos tempranos de atresia.
Las células foliculares que rodean al ovocito tienen un papel muy activo durante la atresia, ya que son las responsables de la digestión y remoción del ovocito. Esta característica se manifiesta en la proliferación de las células foliculares y en la formación de fagocitos que se desprenden de la capa folicular. La actividad de las células foliculares en la remoción del ovocito ocurre tanto por la actividad de los fagocitos, como por la secreción de enzimas producidas por las células foliculares que digieren el vitelo y lo eliminan por difusión, a través de las células foliculares hacia los vasos sanguíneos de la teca. Braekevelt & McMillan (1968) y Vizziano & Berois (1990), clasifican a los folículos atrésicos en hipertróficos, cuando las células foliculares proliferan y forman fagocitos, y no hipertróficos, cuando la eliminación del ovocito es por difusión, ambos tipos de folículos atrésicos fueron observados en Ilyodon whitei y Goodea atripinnis.
Durante el estadio δ, estadio final de la atresia, tanto en Ilyodon whitei como en Goodea atripinnis se describió la formación de grupos de células foliculares que contienen gránulos PAS positivos. Esta fase de atresia ha sido descrita por autores como Braekevelt & McMillan (1968), en Eucalia inconsistans; Rastogi (1969), en Amphipnous cuchia; Lambert (1970), en Poecilia reticulata; Vizziano & Berois (1990), en Macrodon ancylodon; y Miranda et al. (1999), en Astyanax bimaculatus, quienes han identificado el contenido de estos gránulos como lipofucsina, residuo del proceso de digestión del vitelo.
Saidapur (1978), Norris (1997) y Blazer (2002) mencionan que, mediante la atresia, la remoción de los ovocitos que no alcanzaron su desarrollo permite recuperar parte de la energía, y los componentes invertidos durante la maduración folicular.
Durante la gestación temprana de ambas especies, Ilyodon whitei y Goodea atripinnis, se observó que todos los folículos vitelogénicos avanzados no fecundados mostraron atresia, observación que coincide con Turner (1933, 1938) quien también observó atresia en todos los ovocitos maduros no fecundados en Goodea bilineata y Cymatogaster aggregatus.
Diversos factores externos también pueden influir en el incremento de la atresia, como la cantidad y calidad del alimento (Bromage et al., 1992), la presencia de contaminantes como residuos del petróleo, compuestos órganoclorados, hidrocarburos aromáticos (AH) o bifenil policlorinados (PCB) (Johnson et al., 1988; Blazer, 2002), o factores que provoquen estrés en las hembras por alteraciones del hábitat (Tyler & Sumpter, 1996). Estos resultados sugieren que la atresia también pueda corresponder a una manifestación al decremento en los niveles de estradiol observados en el plasma ante los niveles de contaminación. Observaciones similares en otros vertebrados, como el reptil Alligator mississippiensis (Guillette & Uribe, 2001), han mostrado que diversos contaminantes, como el DDT y sus metabolitos, muestran afinidad por los receptores de los estrógenos, produciendo un efecto sinérgico, que se expresa en el aumento de la esteroidogénesis, debido a la afinidad de los receptores de estrógenos por los contaminantes y bloqueando el proceso hormonal normal, por lo que es importante establecer una correlación entre los contaminantes y el proceso de atresia.
La atresia de ovocitos previtelogénicos observada en Ilyodon whitei, y Goodea atripinnis reduce el número de ovocitos que iniciarán la vitelogénesis, lo que coincide con lo mencionado por Turner (1938) para Cymatogaster aggregatus, y Bromage et al. (1992) para Oncorhynchus mykiss, quienes indican que la atresia de folículos previtelogénicos es un factor que interviene tempranamente en el índice de fertilidad en el ciclo reproductor anual. Es también un aspecto esencial el papel de la atresia en la regulación del número de ovocitos que llegan a la maduración y ovulación, por lo tanto, su incidencia en la regulación del número de crías que se desarrollen. En este sentido, el proceso de atresia se relaciona con el índice de fertilidad de la especie (fertilidad absoluta: número de ovocitos ovulados; y fertilidad relativa: número de ovocitos ovulados en relación con el peso de la hembra) (Guraya, 1976; Bromage et al., 1992). La relación entre el índice de fertilidad de una especie y el proceso de atresia está regido, inicialmente, por factores de la fisiología del ovario, en los cuales Hsueh et al. (1994) y Patiño & Redding (2000) mencionan la ocurrencia del proceso de apoptosis, lo que sugiere un control hormonal establecido internamente, regulado genéticamente, y no dependiente de cambios ambientales.
De acuerdo con Meyer et al. (1985), en Ilyodon whitei se observó un número promedio de 30 embriones y en Goodea atripinnis de 55 embriones. Esta diferencia coincidió con el número de folículos atrésicos en vitelogénesis avanzada observados en ovarios en gestación temprana de ambas especies, escasos ovocitos atrésicos (2-5) en I. whitei y mayor número de ovocitos atrésicos (9-13) en G. atripinnis. Estos datos indican que la proliferación de folículos y su maduración es mayor en G. atripinnis en relación con I. whitei, y, aunque el número de crías que se desarrollan en G. atripinnis es mayor que en I. whitei, esta diferencia se reduce debido al mayor número de folículos en atresia en G. atripinnis. Estos resultados sugieren evaluar la ocurrencia de la atresia al definir el índice de fertilidad de una especie, coincidiendo con Vizziano & Berois (1990), quienes afirman que tomar en cuenta los folículos en desarrollo, sin considerar el número de folículos atrésicos, podría llevar a sobreestimar el cálculo de la fertilidad y, por lo tanto el potencial reproductor de una especie. En particular, en las especies vivíparas, es importante definir la relación entre ovocitos maduros, ovocitos atrésicos, y la capacidad del ovario para contener un número máximo de embriones en gestación, así como la incidencia de atresia durante la gestación.
Con base en lo anterior, consideramos que la atresia es un proceso esencial de la fisiología ovárica que influye en el índice de fertilidad. En teleósteos vivíparos adquiere características específicas, debido al doble papel reproductor del ovario, el desarrollo folicular y la gestación. En particular, en los goodeidos debido a que, durante la gestación intraluminal, se suspende la maduración de los folículos vitelogénicos, y los que hubieran permanecido después de la fecundación inician el proceso de atresia.
REFERENCIAS
AGUILAR, M.M., B. COUTIÑO & R. SALINAS. 1996. Manual general de técnicas histológicas y citoquímicas. Las Prensas de Ciencias. Facultad de Ciencias, UNAM. México. [ Links ]
BLAZER, V.S. 2002. Histopathological assessment of gonadal tissue in wild fishes. Fish Physiology and Biochemistry 26: 85-101. [ Links ]
BRAEKEVELT, C.R. & D.B. MACMILLAN. 1968. Cyclic changes in the ovary of the brook stikleback Eucalia inconsistans (Kirtland). Journal of Morphology 123: 373-396. [ Links ]
BROMAGE, N.R., J. JONES, C. RANDALL, M. THRUSH, B. DAVIS, J. SPRINGATE, J. DUSTON & G. BARKER, 1992. Broodstock management, fecundity, egg quality and the timing of egg production in the rainbow trout (Oncorhynchus mykiss). Aquaculture 100: 141-166. [ Links ]
CONSTANTZ, J. 1989. Reproductive biology of the Poeciliid fishes. In: Meffe, G.K. & F.F. Snelson (Eds). Ecology and evolution of live bearing fishes (Poeciliidae). Prentice Hall. New Jersey, pp.33-50. [ Links ]
GUILLETTE L.J. & M.C. URIBE. 2001. Alteraciones en el sistema reproductor de Alligator mississippiensis por contaminantes ambientales. Boletín de la Sociedad Herpetológica Mexicana. Vol 9(1): 1-11. [ Links ]
GURAYA, S.S. 1976. Recent advances in the morphology, histochemistry, and biochemistry of steroid-synthesizing cellular sites in the nonmammalian vertebrate ovary. International Review of Cytology 4: 365-409. [ Links ]
HSUEH, A.J.W, H. BILLIG & A. TSAFRIRI. 1994. Ovarian follicle atresia: a hormonally controlled apoptotic process. Endocrine Reviews. The Endocrine Society. 707-724. [ Links ]
JOHNSON, L.L., E. CASILLAS, T.K. COLLIER, B.B. MCCAIN & U. VARANASI. 1988. Contaminants effects on ovarian development in English sole (Parophrys vetulus) from Puget Sound, Washington. Canadian Journal of Fish Aquaculture Science. 45: 2133-2146. [ Links ]
KHOO, K.H. 1975. The corpus luteum of goldfish (Carassius auratus) and its functions. Canadian Journal of Zoology 53: 1306-1323. [ Links ]
KJESBU, O.S., J. KLUNGSOIR, H. KRYVI, P.R. WITTHAMES & M. GREER WALKER. 1991. Fecundity, atresia, and egg size, of captive Atlantic cod (Gadus morhua) in relation to proximate body composition. Canadian Journal of Fish Aquaculture Science. 48: 2333-2343. [ Links ]
LAMBERT, J.G.D. 1970. The ovary of the guppy Poecilia reticulata. The atretic follicle, a corpus atreticum or a corpus luteum praeovulationis. Z. Zellforsch 107: 54-67. [ Links ]
MENDOZA, G. 1940. The reproductive cycle of the viviparous teleost Neotoca bilineata, a member of the Goodeidae. IV. The germinal tissue. Biological Bulletin 84: 87-97. [ Links ]
MEYER, M.K, L. WISCHNATH & W. FOERSTER. 1985. Lebendgebärende Zierfische. Arten der Welt. Herausgeber: Hans A. Baensch. Mergus, pp. 67-125. [ Links ]
MIRANDA, A.C.L., N. BAZZOLI, E. RIZZO & Y. SATO. 1999. Ovarian follicular atresia in two teleost species: a histological and ultrastructural study. Tissue Cell 31: 480-488. [ Links ]
NAGAHAMA, Y. 1983. The functional morphology of teleost gonads. In: Hoar, W.S., D.J. Randall & E.M. Donaldson (Eds). Fish Physiology. Academic Press. Vol. IX. pp. 223-275. [ Links ]
NORRIS, D.O. 1997. Reproduction in bony fishes. Vertebrate Endocrinology. Third edition. Academic Press, New York, pp. 425-426. [ Links ]
PATIÑO, R. & J.M. REDDING. 2000. Reproductive System. Microscopic functional anatomy; reproductive systems. In: Ostander, G.K. (editor). Handbook of experimental animals. The laboratory fish. Chapter 28. Academic Press. London, U.K., pp. 489-500. [ Links ]
RAJALAKSHMI, M. 1966. Atresia of oocytes and ruptured follicles in Gobius giuris (Hamilton-Buchanan). General and Comparative Endocrinology 6: 378-385. [ Links ]
RASTOGI, R.K. 1969. The occurrence and significance of ovular atresia in the freshwater mudeel, Amphipnous cuchia (Ham). Acta Anatomica 73: 148-160. [ Links ]
SAIDAPUR, S.K. 1978. Follicular atresia in the ovaries of non mammalian vertebrates. International Review of Cytology 54: 225-244. [ Links ]
TURNER, C.L. 1933. Viviparity superimposed upon ovoviviparity in the Goodeidae. A family of Cyprinodont teleost fishes of the Mexican plateau. Journal of Morphology 55: 207-251. [ Links ]
TURNER, C.L. 1938.Histological and cytological changes in the ovary of Cymatogaster aggregatus during gestation. Journal of Morphology 62: 351-373. [ Links ]
TYLER, C.R. & SUMPTER J.P. 1996. Oocyte growth and development in teleosts. Reviews in Fish Biology and Fisheries 6: 287-318. [ Links ]
TYLER, C.R., J.P. SUMPTER & P.R. WITTHAMES. 1990. The dynamics of oocyte growth during vitellogenesis in the rainbow trout (Oncorhynchus mykiss). Biology of Reproduction 43: 202-209. [ Links ]
URIBE, M.C., G. DE LA ROSA-CRUZ, S.M. GUERRERO-ESTÉVEZ, A. GARCÍA-ALARCÓN & M.E. AGUILAR-MORALES. 2004. Estructura del ovario de teleósteos vivíparos. Gestación intraovárica: intraluminal en Ilyodon whitei (Goodeidae), e intrafolicular en Poeciliopsis gracilis (Poeciliidae). En: Lozano Vilano, M.L. & A.J. Contreras Balderas (Eds). Homenaje al Doctor Andrés Reséndez Medina. Dirección de Publicaciones. Universidad Autónoma de Nuevo León. México, pp. 31-45. [ Links ]
VIZZIANO, D. & N. BEROIS.1990. Histología del ovario de Macrodon ancylodon (Bloch y Schneider, 1801) (Teleostei: Scianediae). Ovogénesis. Folículos post-ovulatorios. Atresia. Revista Brasileña de Biología 50(2): 523-536. [ Links ]
WALLACE, R.A. & K. SELMAN. 1979. Physiological aspects of oogenesis in two species of sticklebacks, Gasterosteus aculeatus (L.) and Apeltes quadracus (Mitchill). Journal of Fish Biology 14: 551-564. [ Links ]
WOURMS JP. 1981. Viviparity: The maternal-fetal relationship in fishes. American Zoologist 21: 473-515. [ Links ]
YAMAMOTO, K. & F. YAMAZAKY. 1961. Rhythm of development in the oocyte of the goldfish Carassius auratus. Bulletin of the Faculty of Fish Hokkaido University XII. 2: 93-100. [ Links ]
YARON, Z. 1971. Observations on the granulosa cells of Acanthobrama terrae-sanctae and Tilapia nilotica (Teleostei). General and Comparative Endocrinology 17: 247-252. [ Links ]














