Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.16 no.1 Ciudad de México Abr. 2006
Artículos
Fisiología energética de Cherax quadricarinatus (von Martens) alimentado con dos dietas, expuesto a un regimen constante y fluctuante de temperatura
Physiological energetics of Cherax quadricarinatus (von Martens) feed with two diets and exposed to constant and fluctuating temperatures
Fernando Díaz1, Gisela Escalante2, Ana Denisse Re y Elizabeth Sierra
1 Laboratorio de Ecofisiología. Departamento de Biotecnología Marina. Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE). Km 107 Carretera Tijuana-Ensenada, Ensenada Baja California, México.
2 Departamento de Acuicultura. Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE). Km. 107 Carretera Tijuana-Ensenada, Ensenada Baja California, México.
Recibido: 6 de diciembre de 2004
Aceptado: 30 de julio de 2005
RESUMEN
El balance energético de juveniles de quelas rojas Cherax quadricarinatus alimentados con dos dietas (Rangen con 35% de proteína y Purina con 32%) se determino al exponer a los organismos a dos regímenes de temperatura uno constante 28 ºC y otro fluctuante 25-33 ºC. La mayor cantidad de energía ingerida contenida en el alimento consumido se obtuvo en los organismos alimentados con la dieta Rangen y aclimatados al régimen fluctuante de temperatura. El consumo de oxígeno de rutina de los acociles de quelas rojas alimentados con ambas dietas y expuestos al régimen fluctuante de temperatura fue de 3.5 a 7.1% menor que los aclimatados al régimen constante de temperatura. En los acociles mantenidos en el régimen fluctuante de temperatura el incremento de calor aparente causado por la ingestión del alimento tuvo el valor mas bajo. La mayor cantidad de energía derivada al campo de crecimiento (1949 joules g-1 día-1 p.s.) se obtuvo en los juveniles del acocil de quelas rojas alimentados con la dieta Rangen y expuestos al régimen fluctuante de temperatura. Los resultados de este trabajo permiten recomendar que para optimizar el cultivo del acocil de quelas rojas C. quadricarinatus en condiciones controladas, se use una dieta con los componentes nutrimentales como la Rangen y que los organismos se mantengan en un régimen fluctuante de temperatura ya que la exposición de los acociles al régimen cíclico de temperatura, permite que se maximice la energía que canalizaran al campo de crecimiento.
Palabras clave: Fisiología energética, Cherax quadricarinatus, temperatura constante y fluctuante.
ABSTRACT
The energy budget of the redclaw juveniles Cherax quadricarinatus feed with two diets (Rangen with 35% protein and Purina with 32%) was determined. The organisms were exposed to two regimens of temperature, constant 28 ºC and fluctuating 25-33 ºC. The highest energy from the food consumed by the organisms was obtained from the fluctuating regime of temperature and the Rangen diet. The oxygen consumption routine of the redclaw juveniles fed with both diets and exposed to the fluctuating temperature regime was 3.5 to 7.1% less than the organisms acclimated to the constant temperature regime. In the crayfish maintained with the fluctuating temperature regime the apparently heat increase (AHI) caused by the food ingestion was the lowest value. The high quantity of potential energy derived to the scope for growth (1949 Joules g-1 day-1 d.w.) was obtained in the juveniles of redclaw fed with the Rangen diet and the fluctuating regime. With the results obtained in this study we recommended in order to optimize the redclaw crayfish culture (Cherax quadricarinatus) in controlled conditions, to use a similar diet, which has the nutrients as Rangen. Also the organisms to be maintained in a fluctuating temperature regime because the exposition to this cycle allows maximizing the energy, which the crayfish will canalize for the scope of growth.
Key words: Physiological energetics, Cherax quadricarinatus, constant and fluctuating temperatures.
INTRODUCCIÓN
El acocil de quelas rojas Cherax quadricarinatus (von Martens) es una especie omnívora de origen australiano, que posee características favorables para su cultivo a escala comercial entre las que destacan: Una alta tasa de crecimiento, fácil manejo, múltiples desoves al año y un comportamiento no agresivo (Meade & Watts, 1995; Lawrence & Jones, 2002). Esta especie fue introducida en México en los años 90s y actualmente se cultiva en la región norte, utilizando alimentos balanceados formulados para otras especies como bagre, langostino y camarón (Villarreal, 2000).
En su ambiente natural C. quadricarinatus habita en ríos y corrientes del norte de Australia, esta es una zona subtropical que experimenta fluctuaciones estaciónales de temperatura como de salinidad (Reik, 1972). El acocil de quelas rojas es un organismos que tolera un amplio intervalo de temperatura (23-27 ºC) (King, 1994). Estos organismos viven en ambientes donde las condiciones térmicas varían cíclicamente lo cual afecta directamente las tasas fisiológicas y bioquímicas modificando la homeostasis de los organismos, por lo que la determinación de sus requerimientos energéticos puede no ser adecuada si los animales en experimentación se someten únicamente a temperaturas constantes (Dame & Vernberg, 1978, 1982; Cox, 1978: Tian et al., 2004).
El estudio de la fisiología energética es una herramienta útil para conocer el uso catabólico o biosintético que hacen de la energía alimentaría los animales acuáticos, para compensar las variaciones ambientales que les permiten mantener su homeostasis (Warren & Davis, 1967; Calow, 1977 Jobling, 1994; Rosas et al., 2003).
La bioenergética se define como la cuantificación del intercambio y transformación de la materia y energía entre los organismos y su ambiente (Lucas, 1996). Cuando el balance energético es determinado condiciones de cultivo, ayuda a entender como los factores ambientales y nutrimentales modulan en los crustáceos los mecanismos fisiológicos relacionados con las transformaciones de energía a biomasa a través de la ecuación C = P + R + F + U + ICA + M. En donde C es la energía ingerida a través del alimento consumido, P es la fracción de la energía que corresponde al campo de crecimiento en los organismos juveniles o producción de gametos en los adultos, R es la proporción de energía que se canaliza a metabolismo respiratorio, F es la energía ingerida que se pierde como heces, U es la parte de la energía que se excreta como productos nitrogenados, ICA es el costo energético asociado con la digestión y utilización del alimento y M es la energía que se utiliza en el proceso de la ecdisis.
En varias especies de acociles Jones & Mamot (1983), Sanguanruang (1988), Villarreal (1991; 1998), Barón-Sevilla et al. (1994) Gutiérrez-Yurrita & Montés (1999 y 2001) realizaron estudios del balance energético para conocer la distribución de la energía y su eficiencia metabólica en organismos mantenidos en temperaturas constantes.
En la acuicultura de los organismos acuáticos es deseable entender las interacciones entre los factores ambientales y nutrimentales, la determinación de la fisiología energética, permite la optimización de las raciones que proporcionan los niveles adecuados de energía a las especies de importancia comercial, al cubrir los procesos básicos del organismo y por lo tanto se facilita la incorporación de proteína para la síntesis de tejido (Villarreal, 1991). Por lo tanto el objetivo del presente trabajo fue evaluar el efecto de dos regímenes térmicos y dos dietas con diferente contenido de proteínas sobre la fisiología energética de un organismo heterotrófico como el acocil de quelas rojas Cherax quadricarinatus.
MATERIALES Y MÉTODOS
Los juveniles de C. quadricarinatus (n=2000) con un intervalo de peso húmedo de 1.25 a 3.39 gramos se obtuvieron en la granja de producción "El Jicarero" ubicada en Cuernavaca, Morelos, México y fueron transportados al laboratorio en cajas de polietileno. Los organismos se mantuvieron durante 15 días en cuatro estanques ovalados de 2000 l con agua dulce recirculada conectados a un filtro biológico de 20000 l y provistos con aireación constante. Se mantuvo una densidad de 500 juveniles por estanque a la temperatura de 28 ± 1 0C registrada en el lugar de cultivo, que se mantuvo mediante calentadores sumergibles de 1000 watts conectados a dispositivos reguladores. En los estanques se colocaron refugios de PVC para evitar el canibalismo, durante este periodo a los acociles se les proporcionó diariamente el alimento comercial para camarón Rangen con (35% de proteína), en una ración diaria al 10% de su peso húmedo corporal durante 4 horas, posteriormente se retiró el alimento remanente.
Se seleccionaron al azar 160 juveniles que no difirieron en un intervalo de peso húmedo entre 1 y 2 g que se distribuyeron individualmente en 160 cubetas de plástico de tres litros en cuyas paredes se pegaron mallas de 200 µm, fueron colocadas en ocho estanques circulares de 500 l con aireación y flujo constante de agua. Durante 21 días los organismos se aclimataron a una temperatura fija de 28±1 0C, que correspondió a la temperatura preferida determinada para esta especie por Díaz et al. (2004) que se mantuvo mediante calentadores sumergibles de 1000 watts conectados a dispositivos reguladores.
Otro grupo de acociles (n=160) se aclimataron durante 21 días a un régimen de temperatura fluctuante simétrico de 25-33 0C de acuerdo a lo reportado por Medley et al. (1994) y King (1994) en este intervalo se obtiene la mayor sobrevivencia y el mayor crecimiento para esta especie, los organismos se introdujeron en ocho estanques circulares de 500 l en donde se colocaron de manera individual en cubetas de tres litros. Para mantener el régimen de temperatura fluctuante en los estanques, se elaboró un programa en un controlador de tiempo Chontrol serie XT, al que se conectaron los calentadores sumergibles de 1000 W; el ciclo inició con la temperatura de 25 0C la que se mantuvo durante 7 horas, posteriormente la temperatura se elevó gradualmente durante 5 horas hasta 33 0C, en esta temperatura los organismos permanecieron 7 horas, para a continuación iniciar un descenso gradual de la temperatura en 5 horas, hasta 25 0C iniciando así un nuevo ciclo (Fig. 1). La tasa de ascenso y descenso de la temperatura del agua de los estanques fue de 1.5 0C por hora.
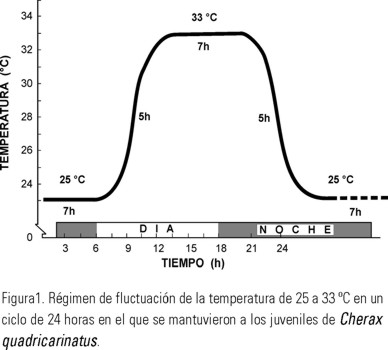
Las características fisicoquímicas del agua de los estanques para los organismos mantenidos tanto en el régimen constante como en el fluctuante fue 8.11 ± 0.29 mg O2 l-1, el pH tuvo un intervalo de 7.8 a 8.1, la dureza fue de 328 ± 26 mg de CaCO3 l-1.
El balance energético de los juveniles de C. quadricarinatus se evaluó en organismos aclimatados a dos regímenes de temperatura y alimentados durante 30 días con dos dietas Bagrina de Purina con un contenido proteínico del 32% y Camaronina de Rangen con 35% de proteína (Tabla I), mediante la siguiente ecuación modificada de Klekowski & Duncan (1975):

C = P + R + F + U + ICA + M
Para determinar el alimento consumido (C) a los organismos se les proporciono diariamente el alimento durante 2 horas en una ración equivalente al 10% de su peso húmedo corporal. El alimento remanente fue retirado de cada cubeta por medio de un sifón y recolectado con una malla de 60 µm colocada en el extremo distal del mismo, posteriormente se colocó en una estufa a 60 ºC para obtener el peso seco. El alimento consumido por los acociles se determinó mediante el método gravimétrico por la diferencia entre el alimento suministrado y el remanente. Se realizaron por triplicado pruebas de solubilidad de ambas dietas, se coloco 1 g de alimento en las cubetas sin organismos durante dos horas. Los datos obtenidos del alimento consumido por los acociles fueron corregidos por el factor de dilución de ambas dietas.
Las heces (F) fueron recolectadas diariamente de cada una de las cubetas 8 horas después de haber recogido el alimento remanente y al día siguiente antes de dar el alimento a los organismos para evitar su reprocesamiento digestivo, para ello se utilizó la misma técnica empleada en la recolección del alimento remanente.
Las mudas (M) se recolectaron de las cubetas para los organismos provenientes de cada condición experimental, se etiquetaron y se colocaron en una estufa a 60 ºC durante 24 horas para obtener el peso seco.
Para medir el consumo de oxígeno de rutina (R) los acociles provenientes de cada condición experimental, se colocaron individualmente 12 horas antes de realizar las mediciones en 20 matraces de 1 l conectados a un sistema respirométrico semiabierto como el descrito por Díaz et al. (1989). Para evitar variaciones en el consumo de oxígeno debidas al estatus nutricional, los acociles fueron mantenidos sin alimentar 48 h antes de las mediciones. Se realizaron cuatro repeticiones para cada condición experimental. Se tomaron muestras iniciales de agua de 3 ml de cada uno de los matraces por medio del desplazamiento de agua al inflar un globo en el interior de cada matraz, a través de un sistema de mangueras (para evitar variaciones en el contenido de oxígeno disuelto), que se conectaron a una cámara cerrada herméticamente provista de un sensor polarográfico; la concentración inicial del gas se midió con un oxímetro digital (YSI 52 ± 0.01 mg l-1), posteriormente los matraces permanecieron cerrados durante dos horas ya que de acuerdo a Stern et al. (1984) es el tiempo adecuado para que el oxígeno disuelto no disminuya por debajo del 30% y no cause estrés en los organismos, al término de las cuales se tomaron nuevamente muestras de agua de cada matraz para medir la concentración final de oxígeno disuelto. La diferencia entre la concentración inicial y final del gas fue el consumo de oxígeno de los organismos y se expresó en mg O2 consumido h-1 g-1 de p. s.
El incremento de calor aparente (ICA), se midió como la diferencia entre el consumo de oxígeno de organismos recién alimentados y mantenidos sin alimentación durante 48 horas del mismo modo que la descrita anteriormente. En el régimen fluctuante las mediciones de oxígeno se realizaron cuando los organismos se encontraban en las temperaturas de 25 ºC y 33 ºC.
Al finalizar los experimentos de respirometría los organismos se pesaron para obtener su peso húmedo, se sacrificaron, se etiquetaron y se colocaron en una estufa a 60 ºC durante 6 días, posteriormente se pesaron para obtener su peso seco. El consumo de oxígeno de rutina y el incremento de calor aparente se transformaron a unidades de energía mediante el uso del equivalente oxicalórico de 3.53 cal mg-1 de O2 consumido (Elliot & Davison, 1975).
Para medir la excreción de amonio (U) de los acociles mantenidos en ambos regímenes de temperatura, se tomaron muestras iniciales y finales de 10 ml de agua de cada uno de los matraces en el sistema respirométrico de la misma forma que se describió para el consumo de oxígeno. La determinación del contenido de amonio de las muestras se realizó por el método de azul de indofenol descrito por Rodier (1979), en donde la intensidad de este compuesto leído a una longitud de onda de 640 nm en un espectrofotómetro ELIPTICA 2000 fue directamente proporcional a la concentración de amonio, que se expresó en mg NH4+ h-1 g-1 p.s. La excreción de amonio se transformó con el equivalente nitrocalórico de 5.73 cal mg-1 de NH4+ excretado (Clifford & Brick, 1979).
Durante esta fase experimental se mantuvieron 2 matraces control sin organismos, para medir el consumo de oxígeno y producción de amonio de los microorganismos presentes en el sistema respirométrico y hacer las correcciones pertinentes.
El contenido energético del alimento suministrado, las heces y las mudas de los organismos provenientes de todas las condiciones experimentales, se determinaron en una bomba calorimétrica semimicro (PARR 1425), calibrada previamente con ácido benzoico, cada análisis se llevo a cabo por triplicado.
El campo de crecimiento (P) en los acociles alimentados con las dos dietas y expuestos a los dos regímenes de temperatura, se calculó como la diferencia entre la energía contenida en el alimento ingerido y la suma de la energía utilizada en el consumo de oxígeno, producción de heces, excreción de amonio, incremento de calor aparente y mudas.
P = C - (R + F + U + ICA + M)
El alimento consumido, la producción de heces, el consumo de oxígeno de rutina, el incremento de calor aparente, la excreción de amonio y las mudas, se transformaron a Joules con el factor de conversión de 1 caloría = 4.1840 Joules (Gnaiger, 1983) y se expresaron en J g-1 dia-1 p.s.
Se utilizó el análisis de varianza de dos vías previa determinación de la normalidad y homoscedasticidad de los datos (Sigma Stat), para determinar el efecto de los dos regímenes de temperatura y las dietas proporcionadas a los juveniles de quelas rojas sobre los diferentes parámetros que conforman la ecuación del balance energético (Zar, 1999).
RESULTADOS
La energía contenida en el alimento ingerido por los juveniles de Cherax quadricarinatus alimentados con la dieta Rangen y mantenidos en el régimen fluctuante fue de 2295.8 J g-1 día-1 p.s. y fue 158 a 202 % mayor que los mantenidos en las otras condiciones experimentales (Tabla 2). El análisis de varianza indico que la temperatura y las dietas tuvieron un efecto significativo (P < 0.05) sobre la cantidad de energía incorporada a través del alimento consumido por los acociles, así como la interacción temperatura y dietas tuvieron un efecto significativo.
La energía derivada por los juveniles de quelas rojas al metabolismo de rutina fue significativamente menor en los organismos expuestos al régimen fluctuante y alimentados con ambas dietas con un intervalo de 155.3 a 155.6 J g-1 día-1 p.s. (Tabla 2). El análisis de varianza indico que hubo un efecto significativo (P < 0.05) de la temperatura sobre el metabolismo de rutina, las dietas y la interacción entre temperatura y dietas no ejercieron un efecto significativo (P > 0.05).
El porcentaje de energía perdida a través de las heces por los juveniles expuestos a ambos regímenes térmicos y alimentados con las dos dietas tuvo un intervalo de 36.1 a 69.7 J g-1 día-1 p.s. (Tabla 2), lo que represento del 2.5 a 4.9% de la energía incorporada con el alimento (Fig. 2). El análisis de varianza indico que la temperatura ejerció un efecto significativo (P < 0.05) sobre la producción de heces, las dietas y la interacción entre temperatura y dietas no tuvieron un efecto significativo (P > 0.05).
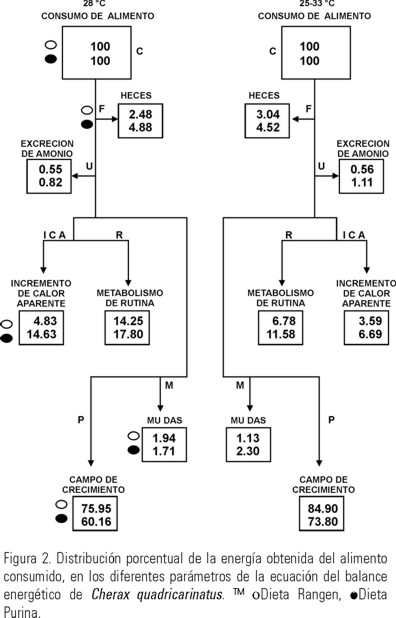
La energía derivada a la excreción de amonio por los juveniles de C. quadricarinatus se incremento en los organismos expuestos al régimen fluctuante de temperatura y alimentados con ambas dietas y tuvo un intervalo de 13 a 15 J g-1 día-1 p.s (Tabla 2). El análisis de varianza indico que la temperatura y las dietas ejercieron un efecto significativo (P < 0.05) sobre la tasa de excreción nitrogenada pero la interacción entre temperatura y dietas no tuvo un efecto significativo (P > 0.05).
El incremento de calor aparente de los organismos mantenidos en el régimen constante y alimentados con la dieta Purina tuvo un incremento significativo del 54% con respecto a los acociles expuestos a las otras condiciones experimentales (Tabla 2 y Figura 2). El análisis de varianza indico que la temperatura y las dietas ejercieron un efecto significativo (P < 0.05) sobre el incremento de calor aparente, así como la interacción temperatura y dietas tuvieron un efecto significativo.
Los acociles expuestos a las diferentes condiciones experimentales destinaron al proceso de la muda un intervalo de 19.7 a 30.9 J g-1 día-1 p.s. (Tabla 2), lo que significo del 1.1 al 2.3% de la energía consumida en el alimento ingerido (Fig. 2). El análisis de varianza indico que la temperatura, las dietas y la interacción entre ellas no tuvieron un efecto significativo (P > 0.05) sobre la perdida de energía a través del proceso de la muda.
La energía que los juveniles de quelas rojas destinaron al campo de crecimiento representó el 85% de la energía consumida en el alimento ingerido, cuando se expusieron al régimen fluctuante y se alimentaron con la dieta Rangen y fue mayor que la canalizada por los organismos mantenidos en las otras condiciones experimentales (Fig. 2). El análisis de varianza indico que la temperatura y dietas tuvieron un efecto significativo (P < 0.05) sobre el campo de crecimiento, así como la interacción entre temperatura y dietas ejercieron un efecto significativo.
DISCUSION
La temperatura es un factor directriz que controla procesos como la actividad, el consumo de alimento y el crecimiento en los poiquilotermos (Winberg, 1956; Fry, 1971). El mayor valor de la energía incorporada a través del alimento consumido se obtuvo en los juveniles de Cherax quadricarinatus que fueron expuestos al régimen fluctuante de temperatura y a los que se les proporciono la dieta Rangen, esta dieta tuvo un contenido de proteína del 35% y del 8% de lípidos (Tabla 1). Esto concuerda con lo mencionado por Anson & Rouse (1994); Meade & Watts (1995) quienes evaluaron el incremento en peso y supervivencia de juveniles de C. quadricarinatus alimentados con alimentos formulados y obtuvieron que dietas con 35% de proteína y con 5 a 10% de lípidos son adecuadas para la producción comercial de C. quadricarinatus. Se ha evidenciado que los alimentos balanceados de buena calidad utilizados para alimentar al acocil de que las rojas, pueden dar un pobre resultado, si el manejo de los mismos es inadecuado teniendo en consideración que la cantidad, frecuencia método y horario de alimentación modifica su tasa de ingestión. Debido a esto la alimentación de los organismos mantenidos en el régimen fluctuante de temperatura se realizo durante la fase caliente del ciclo entre los 26 a 28 0C, lo que facilito que una gran cantidad de energía fuera ingerida a través del alimento consumido. Este incremento en la tasa de ingestión de los juveniles de quelas rojas mantenidos en el régimen fluctuante de temperatura es comparable a los descritos por Spigarelli et al. (1982) en Salmo trutta (Linnaeus), Diana (1984) en Micropterus salmoides (Lacepede), Soderback et al. (1987) en Astacus astacus (Linnaeus), Seals et al. (1997) en Procambarus acutus acutus (Girard) y Sierra et al. (1999) en Ictalurus punctatus (Rafinesque) expuestos a regímenes fluctuantes. Nuestros resultados concuerdan con la hipótesis propuesta por Brett (1971), ya que los juveniles de C. quadricarinatus fueron alimentados durante el periodo caliente del ciclo, incrementándose la capacidad para consumir y digerir mas alimento, debido a que los procesos de digestión ocurren más rápido a temperaturas altas que en las frías del ciclo. Hokanson et al., (1977) y Biette & Geen, (1980) mencionan que la exposición de los organismos a este tipo de régimen corresponde a las fluctuaciones normales que experimentan los organismos en su hábitat natural, estimulando algunas funciones fisiológicas como la alimentación como lo obtenido en los organismos alimentados con la dieta Rangen.
La reducción del consumo de oxígeno de rutina de C. quadricarinatus expuestos al régimen fluctuante sugiere que los juveniles utilizaron una compensación metabólica tanto para temperaturas templadas como para calidas a las que fueron expuestos, debido a que los organismos incrementaron su tolerancia térmica de acuerdo al numero de ciclos térmicos a los cuales son expuestos (Cox, 1978). La disminución de la tasa metabólica en el régimen fluctuante puede ser una respuesta importante que permite el aumento en el crecimiento del acocil de quelas rojas, sin embargo este mecanismo de porque se incrementa el crecimiento en los crustáceos expuestos a este régimen térmico no esta muy claro. Resultados similares han sido reportados para diferentes especies de ectotermos como Panopeus herbstii (Milne-Edwards), Uca pugilator (Bosc), Micropterus salmoides, Ictalurus punctatus y Fenneropenaeus chinensis (Osbeck) (Dame & Vernberg 1978; Diana 1983; Sierra et al., 1999; Tian et al., 2004).
La energía pérdida vía heces en los juveniles de C. quadricarinatus expuestos a ambos regímenes térmicos y alimentados con ambas dietas no excedió el 4.9% del total de la energía incorporada con el alimento ingerido. Villareal (1991, 1998) obtuvo que la producción de heces en Cherax tenuimanus (Smith) tuvo un intervalo de 7 a 17% y estuvo inversamente relacionada con el tamaño de los organismos y con la cantidad de alimento ingerido. En postlarvas y juveniles de Macrobrachium rosenbergii (De Man) alimentados con dos dietas comerciales Díaz-Herrera et al. (1992) reportaron una perdida en heces del 8.6 a 26.6%. Para Procambarus clarkii (Girard) alimentado con dietas balanceadas y con diferentes alimentos naturales, Sanguanruang, (1988); Barón Sevilla et al. (1994); Gutierrez-Yurrita & Montes, (2001) obtuvieron una relación directa entre el contenido de proteína en la dieta y la producción de heces con un intervalo de 2.5 a 36.6%. En Procambarus acutus acutus, Sanguanruang (1988) reporto una producción de heces del 10 al 37.8% alimentado con diferentes dietas. Sierra Uribe et al. (1997) mencionan para machos y hembras de Procambarus clarkii ablacionados unilateralmente una pérdida en heces del 6.5 al 10.7% de la energía extraída del alimento consumido. La diferencia entre la pérdida de energía vía heces en los juveniles de Cherax quadricarinatus con respecto a los obtenidos por los otros autores en otras especies de crustáceos puede ser atribuida al tamaño uniforme de los organismos utilizados, al tipo y calidad de los alimentos proporcionados así como a las condiciones controladas en las que se mantuvieron los organismos.
En juveniles y adultos de Procambarus clarkii alimentados con diferentes dietas se ha reportado que la excreción nitrogenada represento del 0.0004 al 15% de la energía extraída del alimento consumido (Barón Sevilla et al., 1994; Sierra Uribe et al., 1997; Gutiérrez-Yurrita & Montes, 2001). En Macrobrachium rosenbergii Díaz et al. (1992) reportaron valores de la energía perdida en productos nitrogenados del 0.15 al 0.43%. Villarreal (1991) en Cherax tenuimanus obtuvo un intervalo de excreción de amonio de 0.48 a 0.72 joules g-1 h-1 p.s. En los juveniles de los acociles de quelas rojas se obtuvo un intervalo de la excreción nitrogenada de 0.55 a 1.11% de la energía ingerida en el alimento consumido, la baja producción de amonio de los juveniles de C. quadricarinatus expuestos a el régimen constante y fluctuante de temperatura sugiere que solamente una pequeña porción del contenido de proteínas fue utilizado para cubrir su demanda energética. Por lo tanto la mayoría del nitrógeno proveniente de la desaminación de los aminoácidos de las dietas fue incorporado en la síntesis de tejido por lo juveniles de quelas rojas. Y concuerda con lo mencionado por Villarreal (1991, 1998) que en general los acociles tienen bajas tasas de excreción de desechos nitrogenados, por lo que se considera que este parámetro tiene poca importancia cuando se construyen presupuestos energéticos para las diferentes especies de acociles.
El incremento de la tasa metabólica como consecuencia de la ingestión del alimento ha sido investigado por diferentes autores (Warren & Davis, 1967; Nelson et al., 1985; Tandler & Beamish, 1979; Jobling, 1983; Beamish & Trippel, 1990). En los juveniles de Cherax quadricarinatus el ICA para los organismos alimentados con la dieta Purina fue de 3.6 a 14.6% para los organismos mantenidos en el régimen constante como en el fluctuante. La magnitud de este incremento puede ser influenciado por la tasa de digestión, la temperatura ambiental y la actividad del organismo (Du Preez, 1992). Dado que se ha establecido que el ICA esta relacionado con el metabolismo y desaminación de las proteínas, los resultados de este trabajo son similares con los obtenidos por Nelson et al. (1977) en Macrobrachium rosenbergii que reportaron que la tasa metabólica se incrementó de 7.1 a 39.4 % cuando estos organismos fueron alimentados con diferentes dietas y para Crangon franciscorum (Stimpson) Nelson et al. (1985) obtuvieron valores de ICA de 14 a 45 %. Díaz Herrera et al. (1992) obtuvieron que el ICA fue 4 al 7% para postlarvas y juveniles de M. rosenbergii alimentados con la dieta Purina que para los alimentados con Bovilac; Barón Sevilla et al. (1994) mencionan que el ICA para Procambarus clarkii tuvo un intervalo de 1.56 a 2.95% cuando los organismos fueron alimentados con dietas con un contenido proteína de 20 a 35 %. De acuerdo con estos resultados y al hecho que la dieta Rangen tuvo un 35% de proteína, esto explica que se obtuvieran los valores más bajos del ICA tanto en los organismos expuestos al régimen constante (70.4) como al fluctuante (85.2) alimentados con esta dieta . Ya que esta dieta esta formulada para crustáceos lo que favoreció que en los procesos digestivos de los acociles se utilizara una menor cantidad de energía.
Los juveniles de quelas rojas expuestos a ambos regímenes de temperatura tuvieron una perdida energética en las exuvias del 1.1 al 2.3% de la energía ingerida con el alimento. Klein-Breteler (1975) y Logan & Epifanio (1978) mencionan que la perdida energética durante el proceso de la muda en los juveniles de Carcinus maenas (Linnaeus) y Homarus americanus (Milne-Edwards) fue del 10% de la energía ingerida. Sanguanruang (1988) reporto que en Procambarus clarki la energía invertida en las exuvias fue del 1.5 al 4.3% y en P. acutus acutus tuvo un intervalo de 2 al 4.7%. Durante el desarrollo larval de Rhithropanopeus harrisii (Gould) Levine & Sulkin (1979) obtuvieron que estos organismos perdieron en exuvias del 1.3 a 10%. Kurmaly, Yule & Jones (1989) reportaron para diferentes estadios de desarrollo de Penaeus monodon (Fabricius) una perdida en exuvias del 1.4 al 3.8% de la energía ingerida con el alimento consumido. Las perdidas energéticas que los juveniles de quelas rojas destinaron al proceso de exuviación estuvieron dentro del intervalo reportado para varias especies de crustáceos.
En los acociles de quelas rojas C. quadricarinatus el valor más alto del campo del crecimiento (84.9%) fue obtenido en los organismos alimentados con la dieta Rangen y aclimatados al régimen fluctuante. Al respecto Woodland (1967) informó que Cherax destructor puede destinar aproximadamente el 50% de la energía ingerida hacia el crecimiento. Villarreal (1991; 1998) menciono que Cherax tenuimanus canalizo 57.5% de la energía consumida para el crecimiento. Díaz Herrera et al. (1992), obtuvieron un campo de crecimiento para postlarvas y juveniles de Macrobrachium rosenbergii de 68.01 y de 86.67 % alimentados con dos dietas con diferente contenido de proteínas. En Procambarus clarkii Barón Sevilla et al. (1994) y Gutiérrez-Yurrita & Montes (2001) obtuvieron un campo de crecimiento de 75.4 a 85.0% para organismos alimentados con dietas con diferentes porcentajes de proteína.
Webster et al. (1994) evaluaron dietas con niveles de proteína entre 25 y 55 % para alimentar a juveniles de Cherax quadricarinatus y encontraron que la dieta con 33% de proteína fue adecuada, ya que con esta dieta los acociles tuvieron un óptimo crecimiento. Meade & Watts (1995) probaron varias dietas y la dieta formulada para acociles con 30% de proteína resultó ser la mas adecuada. En el presente trabajo el mayor campo de crecimiento se obtuvo cuando se alimentó a C. quadricarinatus con la dieta Rangen (35% de proteína), lo cual coincide con los resultados de Webster et al. (1994) y Meade & Watts (1995) por lo tanto para alimentar a los acociles de quelas rojas en condiciones de cultivo controladas se puede recomendar una dieta con un contenido de proteína entre 30 y 35 % y que tenga las características proximales semejantes a los de la dieta Rangen. Ya que los organismos aprovecharan de manera óptima los componentes nutrimentales de esta dieta y además fue la que causo menores pérdidas metabólicas, por lo que los acociles canalizaron la mayoría de la energía hacia el campo de crecimiento.
Biette & Geen (1980) encontraron que al exponer al salmón Oncorhynchus nerka (Walbaum) a temperaturas cíclicas se produjo un incremento en el crecimiento que cuando se aclimataron a temperaturas constantes. Hokanson et al. (1977) también han determinado que los organismos aclimatados a temperaturas cíclicas incrementan su crecimiento con respecto a los mantenidos en temperaturas constantes. Varios estudios indican que las temperaturas fluctuantes siempre que estén dentro de los límites de tolerancia, incrementan el crecimiento de los ectotermos acuáticos (Miao & Tu, 1996; Sierra et al., 1999; Baras et al., 2000). El mayor campo de crecimiento obtenido en los juveniles de C. quadricarinatus mantenidos en el régimen fluctuante se debió a que los organismos mantenidos en esas condiciones son más eficientes en extraer una mayor cantidad de energía del alimento consumido, debido a que en su ambiente natural los organismos experimentan cambios cíclicos de temperatura lo cual no afecta el metabolismo de los animales ya que estos cambios de temperatura favorecen el funcionamiento de algunos procesos biológicos como el crecimiento.
Para optimizar el cultivo de la langosta de quelas rojas en México en condiciones controladas, se recomienda utilizar una dieta con los componentes nutricionales similares a la dieta Rangen y mantenerlos en un régimen de temperatura fluctuante de 25 a 33 0C ya que se incrementara la energía destinada al campo de crecimiento.
AGRADECIMIENTOS
A José M. Domínguez y Francisco Javier Ponce del Departamento de Dibujo del CICESE.
REFERENCIAS
ANSON, K.J & D.B. ROUSE. 1994. Effects of salinity on hatching and post-hatch survival of the Australian red claw crayfish Cherax quadricarinatus. Journal of the World Aquaculture Society 25: 277-280. [ Links ]
BARAS, E., C. PRINGNON., G. GOHOUNGO & F. MELARD. 2000. Phenotypic sex differentiation of blue tilapia under constant and fluctuating thermal regimes and its adaptative implications. Journal of Fish Biology 57: 210-223. [ Links ]
BARÓN SEVILLA, B., F. DÍAZ HERRERA & L.F. BUCKLE RAMÍREZ. 1994. Energy budget for red swamp crawfish Procambarus clarkii (Crustacea.Cambaridae). Rivista Italiana Acquacoltura 29: 103-107. [ Links ]
BEAMISH, F.W.H & E.A. TRIPPEL 1990. Heat increment: a static or dynamic dimension in bioenergetic models?.Transactions of the American Fisheries Society 119: 649-661. [ Links ]
BIETTE, J.R & G.H. GEEN. 1980. Growth of underyearling sockeye salmon Oncorhynchus nerka under constant and cyclic temperatures in relation to live zooplankton ratio size. Canadian Journal of Fisheries and Aquatic Science 37: 203-210. [ Links ]
BRETT, J.R. 1971. Energy responses of salmon to temperature. A study some thermal relations in the physiology and freshwater ecology of sockeye salmon. American Zoology 11: 99-113. [ Links ]
CALOW, P. 1977. Conversion efficiencies in heterotrophic organisms. Biological Reviews 52: 385-409. [ Links ]
CLIFFORD, H.C. & R.W. BRICK. 1979. A physiological approach to the study of growth and bioenergetics in the freshwater shrimp Macrobrachium rosenbergii. Proceedings of the World Mariculture Society 10: 710-719. [ Links ]
COX, D.K. 1978. Acclimation states of juvenile striped bass held in constant and fluctuating temperature regimes. In: Thorpe, H. J. y J. W. Gibbons. (Eds.). Energy and environmental stress in aquatic organisms. Technical Information Center. Department of Energy Publisher, Georgia. pp. 703-715. [ Links ]
DAME, R.F. & F.J. VERNBERG. 1978. The influence of constant and cyclic acclimation temperatures on the metabolic rates of Panopeus herbstii and Uca pugilator. Biological Bulletin 154: 188-197. [ Links ]
DAME, R.F. & F.J. VERNBERG. 1982. Energetics of a population of the mud crab Panopeus herbstii in the North inlet estuary South Caroline. Journal of Experimental Marine Biology and Ecology 63: 183-193. [ Links ]
DIANA, S.J. 1983. Oxygen consumption by largemouth bass under constant and fluctuating thermal regimes. Canadian Journal of Zoology 61: 1892-1895. [ Links ]
DIANA, S.J. 1984. The growth of largemouth bass Micropterus salmoides (Lacepede) under constant and fluctuating temperatures. Journal of Fish Biology 24: 165-172. [ Links ]
DÍAZ, F., S. ESPINA., C. ROSAS., A. SÁNCHEZ., C. VANEGAS & E. DÍAZ-IGLESIAS. 1989. Ritmo respiratorio y amplitud metabólica del camarón café Penaeus aztecus con ablación de los pedúnculos oculares. Revista de Investigaciones Marinas X: 27-39. [ Links ]
DÍAZ HERRERA, F., G. JUÁREZ CASTRO., M.E. PERÉZ CRUZ & L.F. BUCKLE RAMÍREZ. 1992. Energy budget for postlarvae and juveniles of the Malaysian prawn Macrobrachium rosenbergii De Man. Ciencias Marinas 18: 19-32. [ Links ]
DÍAZ, F., A. D. RE., E. SIERRA & G. AMADOR. 2004. Behavioural thermoregulation and critical thermal limits applied to the culture of redclaw Cherax quadricarinatus (von Martens). Freshwater Crayfish 14: 1-9. [ Links ]
DU PREEZ, H.H., CHEN, H.Y & C.S. HSIEH. 1992. Apparent specific dynamic action of food in the grass shrimp Penaeus monodon Fabricius. Comparative Biochemistry and Physiology 103A: 173-178. [ Links ]
ELLIOT, J.M. & W. DAVISON. 1975. Energy equivalents of oxygen consumption in animal energetics. Oecologia 19: 195-201. [ Links ]
FRY, F.E.J. 1971. The effects of environmental factors on the physiology of fish.. In: Hoar, W.S & D.J. Randall (eds.). Fish Physiology Vol VI: Environmental relations and behaviour. Academic Press, New York. 1-98 p. [ Links ]
GNAIGER, E. 1983. Calculations of energetic and biochemical equivalents for respiratory oxygen consumption. In: Gnaiger, E & H. Forstner (Eds.). Polarographic oxygen sensor. Springer, Berlin. 337-345 p. [ Links ]
GUTIERREZ-YURRITA, P.J. & C. MONTES. 1999. Bioenergetics and phenology of the reproduction of the red swamp crayfish Procambarus clarkii in Doñana National Park, SW Spain. Freshwater Crayfish 12: 561-574. [ Links ]
GUTIERREZ-YURRITA, P.J. & C. MONTES. 2001. Bioenergetics of the red swamp crayfish Procambarus clarkii. Comparative Biochemistry and Physiology 130A: 29-38. [ Links ]
HOKANSON, K.E.F. 1997. Temperature requirements of some percids and adaptation to the seasonal temperature cycle. Journal of Fisheries Research Board and Canada 34: 1524-1550. [ Links ]
JOBLING, M. 1983. Towards an explanation of specific dynamic action (SDA). Journal of Fish Biology 23: 549-555. [ Links ]
JOBLING, M. 1994. Fish bioenergetics. Chapman and Hall, London. 309 p. [ Links ]
JONES, P.D & W.T. MAMOT. 1983. The bioenergetics of Orconectes virilis in two pothole lakes. Freshwater Crayfish 5: 192-209. [ Links ]
KING, C.R. 1994. Growth and survival of red claw crayfish hatchlings (Cherax quadricarinatus von Martens) in relation to temperature with comments on relative suitability of Cherax quadricarinatus and Cherax destructor for culture in Queensland. Aquaculture 122: 75-80. [ Links ]
KLEIN BRETELER, W.C.M. 1975. Food consumption, growth and energy metabolism of juvenile shore crabs, Carcinus maenas. Netherlands Journal of the Sea Research 9: 255-272. [ Links ]
KLEKOWSKI, R.Z. & A. DUNCAN. 1975. Physiological approach to ecological energetics. In: Grodzinski, Z.R & A. Duncan. (Eds.). Methods for ecological bioenergetics. IBP. Blackwell Scientific Publications, Oxford. pp. 15-64. [ Links ]
KURMALY, K., A.B. YULE & D.A. JONES. 1989. An energy budget for the larvae of Penaeus monodon. Aquaculture 81: 13-25. [ Links ]
LAWRENCE, C.S & C. JONES.2002 Cherax. In Holdich, M. D. (Ed.). Biology of freshwater crayfish. Blackwell. Science, London, pp. 635-669. [ Links ]
LEVINE, D.M & S.D. SULKIN. 1979. Partitioning and utilization of energy during the larval development of the xanthid crab Rhitropanopeus harrisii (Gould). Journal of Experimental Marine Biology and Ecology 40: 247-257. [ Links ]
LOGAN, D.T & C.E. EPIFANIO. 1978. A laboratory energy balance for the larvae and juveniles of the American lobster Homarus americanus. Marine Biology 47: 381-389. [ Links ]
LUCAS, A. 1996. Bioenergetics of aquatic animals. Taylor & Francis, London. 169 p. [ Links ]
MEADE, M.E & S.A. WATTS. 1995. Weight gain and survival of juvenile Australian crayfish Cherax quadricarinatus fed formulated feeds. Journal of the World Aquaculture Society 26: 469-474. [ Links ]
MEDLEY, P.B., NELSON, R.G. & L.U. HATCH. 1994. Economic feasibility and risk analysis of Australian red claw crayfish Cherax quadricarinatus aquaculture in the southeastern United States. Journal of the World Aquaculture Society 25: 135-146. [ Links ]
MIAO, S & S. TU. 1996. Modeling effects of thermal amplitude on growing Chinese shrimp Penaeus chinensis (Osbeck). Ecological Modeling 88: 187-197. [ Links ]
NELSON, S.G., H.W. LI & A.W. KNIGHT. 1977. Calorie, carbon and nitrogen metabolism of juvenile Macrobrachium rosenbergii with regard to trophic position. Comparative Biochemistry and Physiology 58A: 319-327. [ Links ]
NELSON, S.G., M.A. SIMMONS & A.W. KNIGTH 1985. Calorigenic effect of diet on the grass shrimp Crangon franciscorum. Comparative Biochemistry and Physiology 82A: 373-376. [ Links ]
REIK, E.F. 1972. The phylogeny of the Parastacidae (Crustacea:Astacidae) and description of a new genus of Australian freshwater crayfishes. Australian Journal of Zoology 20: 369-389. [ Links ]
REYNOLDS, W.W & M.E. CASTERLIN. 1979. Behavioral thermoregulation and the "final preferendum" paradigma. American Zoology 19: 211-224. [ Links ]
ROSAS, C., A. SANCHEZ., M.E. CHIMAL & R. BRITO. 2003. Manual de métodos para la evaluación del balance energético en crustáceos. Centro de Formación de la Cooperación Española en Cartagena de Indias Colombia. 43 p. [ Links ]
SANGUANRUANG, M. 1988. Bioenergetics of the red swamp crawfish (Procambarus clarkii) and white river crawfish (Procambarus acutus acutus) in cultivated non-cultivated and wooded ponds in south Louisiana. Ph. D. Thesis Louisiana State University. Baton Rouge. Louisiana, USA. [ Links ]
SEALS, C., A.G. EVERSOLE., J.R. TOMASSO & B.R. PETROSKY. 1997. Effects of temperature on feeding activity of the white river crayfish Procambarus acutus acutus. Journal of the World Aquaculture Society 28: 133-141. [ Links ]
SIERRA, U.E., DÍAZ, H.F & BUCKLE, R.L.F. 1997. Effect of unilateral eyestalk ablation on the physiological energetics of Procambarus clarkii (Decapoda,Cambaridae). Rivista Italiana Acquacoltura 32: 106-113. [ Links ]
SIERRA, E., F. DÍAZ & S. ESPINA. 1999. Energy budget of Ictalurus puntatus exposed to constant and fluctuating temperatures. Rivista Italiana Acquacoltura 34: 71-81. [ Links ]
SODERBACK, B., M. APPEBERG., T. ODELSTROM & U. LINDQVST. 1987. Food consumption and growth of the crayfish Astacus astacus L. in laboratory experiments. Freshwater Crayfish 7: 145-153. [ Links ]
SPIGARELLI, S.A., M.M. THOMES & W. PREJCHAL. 1982. Feeding, growth and fat deposition by brown trout in constant and fluctuating temperatures, Transactions of the American Fisheries Society 111: 199-209. [ Links ]
STERN, S., A. BORUT & D. COHEN. 1984. The effect of salinity and ion composition on oxygen consumption and nitrogen excretion of Macrobrachium rosenbergii (De Man). Comparative Biochemistry and Physiology 79A: 271-274. [ Links ]
RODIER, J. 1979. Análisis de las aguas: aguas naturales, aguas residuales, agua de mar. Omega, Barcelona. 138-140 p. [ Links ]
TANDLER, A & F.W.H. BEAMISH. 1979. Mechanical and biochemical components of apparent specific dynamic action in largemouth bass Micropterus salmoides Lacepede. Journal of Fish Biology 14: 343-350. [ Links ]
TIAN, X., S. DONG., F. WANG & L. WU. 2004. The effects of temperature changes on the oxygen consumption of the juvenile Chinese shrimp Fenneropenaeus chinenis. Journal of the Experimental Marine Biology and Ecology 310: 58-72. [ Links ]
VILLARREAL, H. 1991. A partial energy budget for the Australian crayfish Cherax tenuimanus. Journal of the World Aquaculture Society 22: 252-259. [ Links ]
VILLARREAL, H. 1998. Evaluación del potencial de cultivo de la langosta de agua dulce Cherax tenuimanus en función de su eficiencia bioenergética. Avances en Nutricion Acuicola III: 65-80. [ Links ]
VILLARREAL, H. 2000. El cultivo de la langosta de agua dulce. Una oportunidad para diversificación acuícola. In: Bonilla, Z & I. Burciaga (Eds.). Memorias III Simposium Internacional de Acuicultura. Culiacan, Sinaloa. México. pp. 110-135. [ Links ]
WARREN, C.E & G.E. DAVIS. 1967. A laboratory study on the feeding, bioenergetics and growth of fishes. In: Gerking, S. D (Ed.). The Biological basis of fish production. Blackwell Scientific Publ. pp.279-352. [ Links ]
WEBSTER, C.D., L.S. GOODGAME-TIU., J.H. TIDWELL & D.B. ROUSE. 1994. Evaluation of practical feed formulations with different protein levels for juvenile redclaw crayfish (Cherax quadricarinatus). Transactions of the Kentucky Academy of Sciences 55: 108-112. [ Links ]
WINBERG, G.G. 1956. The rate of metabolism and food requirements of fishes. Belorussian University. Minsk. In Russian, (Engl. Transl. Fisheries Research Board of Canada Translation Series, 194). [ Links ]
WOODLAND, D.J. 1967. Population study of a freshwater crayfish, Cherax destructor Clark with a particular reference to the ecoenergetics of a population. Ph. D. Thesis University of New England. 221 p. [ Links ]
ZAR, J. 1999. Biostatistical analysis. Prentice Hall. New Jersey. 663 pp. [ Links ]














