Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.14 no.2 Ciudad de México 2004
Artículo
Ordenación de comunidades de fitoplancton en el lago de Chapala, Jalisco-Michoacán, México
Ordination of phytoplankton communities in the Chapala Lake, Jalisco-Michoacan, Mexico
Ma. del Refugio Mora-Navarro, J. Antonio Vázquez-García y Yalma Luisa Vargas-Rodríguez
Instituto de Botánica, Departamento de Botánica y Zoología, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, Km. 15.5 carr. Guadalajara-Nogales, Las Agujas, Nextipac. Apartado postal 1-139. Zapopan 45110, Jalisco, México. E. mail: jvazquez@cucba.udg.mx
Recibido: 1 de octubre de 2003
Aceptado: 2 de junio de 2004
Resumen
Se investigó cuales variables fisicoquímicas explican mejor los ejes de composición florística de las comunidades de fitoplancton en el lago de Chapala. Con base en datos de presencia-ausencia, se ordenaron 96 muestras de fitoplancton, con 116 especies. El gradiente primario de la composición de comunidades, generado mediante la ordenación de Bray-Curtis regresión de varianza, fue explicado por la concentración de sulfatos (r=0.751) y en relación inversa por la alcalinidad total (r=−0.635). El gradiente secundario de la estructura de comunidades, el cual es independiente del primario, fue explicado por la dureza debida al calcio (r=−0.617) y por la dureza total (r=−0.602). Las restantes variables medidas (16) no mostraron relación con los principales ejes de la ordenación de las comunidades. Los datos sugieren para la mayoría de las comunidades de fitoplancton una preferencia de hábitat hacia altas concentraciones de sulfatos y baja alcalinidad total, mientras que para ciertas especies una especialización hacia alta alcalinidad y bajas concentraciones de sulfatos. Se reconocen dos grupos de comunidades, los cuales además de estar separados por diferencias en concentración de sulfatos y alcalinidad total muestran una relación con el último periodo de colecta. La disminución del azufre, disponible como sulfatos y el incremento de alcalinidad de 1996-1998, debida a la disminución del nivel del lago, asociados al fenómeno de El Niño (1996-1998), explican también la disminución de la riqueza de especies observada en dicho periodo. En conclusión, los sulfatos y la alcalinidad fueron más importantes para la composición y riqueza de las comunidades de fitoplancton en el lago de Chapala.
Palabras clave: Bray-Curtis, Composición, Diversidad, Ordenación sociológica, Variables fisicoquímicas.
Abstract
We investigated what environmental variables explained major axes of compositional variation in phytoplankton communities at the Chapala lake. We used presence-absence data for the ordination analysis, which included 96 phytoplankton samples and 116 species. The primary gradient of the phytoplankton community structure, obtained from Bray-Curtis variance-regression, was explained by sulfates (r=0.751) and inversely by total alkalinity (r=−0.635). The secondary compositional gradient of phytoplankton communities, which was independent from the primary one, was explained by hardness of water due to Calcium (r=−0.617) and by total hardness (r=−0.602). The remainder of environmental variables (16) showed no relationship to any of the ordination axis. These data suggest habitat preference for most communities of phytoplankton toward higher sulfate concentration and toward low total alkalinity levels. Only few species showed specialization toward low sulfate concentration and toward high total alkalinity. Two groups of community were shown, which are separated from each other on differences on sulfates and total alkalinity levels. In addition these data showed a relationship to the last sampling period. A decrease in sulfur, in the form of sulfate, and an increase of total alkalinity from 1996 to 1998, due in part to a decrease of the lake level, associated to the El Niño effect, explained also a decline in species diversity through this period. In conclusion, alkalinity and sulfates seem to be major environmental factors explaining relevant compositional gradients as well as species richness of the phytoplankton communities at the Chapala Lake.
Key words: Bray-Curtis, Composition, Diversity, Sociological ordination, Chemical and physical variables.
Introducción
El conocimiento de las algas, en particular su ecología en aguas continentales ha sido muy limitado. Esto es en parte debido a la visión antropocéntrica dominante, que asigna mayor importancia a aspectos utilitarios relacionados con el desarrollo económico que al conocimiento y conservación de la biodiversidad; así como a la preferencia por estudiar organismos conspicuos (plantas vasculares, vertebrados etc.). No obstante, durante la segunda mitad del siglo pasado se ha manifestado un interés creciente por el estudio del fitoplancton, dada la importancia que tiene como primer eslabón en la cadena trófica, productor de oxígeno, depurador de sustancias contaminantes y como bioindicador, entre otras propiedades (Palmer 1962; Prescot 1973; Wetzel 1981; Margalef 1983; Reynolds 1986; Streble y Krauter 1987; González-González 1992).
Los estudios limnológicos en México son numerosos y abordan aspectos diversos de florística, taxonomía y ecología (Ortega 1987; Ortega y Godínez 1994; Tavera-Sierra et al. 1994; Parra y Bicudo 1996; Tavera-Sierra 1996; Valadez-Cruz et al. 1996; Banderas-Tarabay 1997; Ibarra-Vazquez y Novelo 1997; Alcocer et al. 1998; Novelo-Maldonado 1998). Otros estudios refieren a la formación de florecimientos algales y a su toxicidad, principalmente la originada por algas azul-verde (cianobacterias) (Mennes y Stanier 1968; Compére 1974; Lacoste et al. 1987; Anand 1988; Carmichael 1994; Watanabe y Komárek 1994; Komárková-Legnerová y Tavera-Sierra 1996; Guzmán-Arroyo et al. 2000).
Las investigaciones biológicas del lago de Chapala, aún las de carácter general son todavía escasas (Lind y Dávalos-Lind 1991; Guzmán-Arroyo y Merino-Nambo 1992; Lind et al. 1992; Guzmán-Arroyo 1995; Phlips et al. 1995), más escasas son las que contemplan particularidades de su fitoplancton (Márquez-Núñez y Reyes-González 1995; Mora-Navarro y Castro-Cruz 1999; Mora-Navarro et al. 2000) y ninguna ha aplicado un enfoque multivariado para examinar la organización de comunidades de algas con base en datos de presencia ausencia de sus especies, con relación en los gradientes fisicoquímicos. Esta información ayudaría a guiar la toma de decisiones de manejo y de conservación de fitoplancton del lago de Chapala.
En este trabajo se pretende generar hipótesis sobre las variables fisicoquímicas que podrían explicar la composición y organización de las comunidades de fitoplancton en el lago de Chapala.
Materiales y métodos
Área de estudio: El lago de Chapala se ubica en la parte centro-oriente del estado de Jalisco, en el occidente de México, entre los 20° 7'-20° 21' N y los 102° 40' 45"-103° 25' 30" W, y a una altitud de 1,524 m s.n.m (Estrada et al. 1983) (Fig. 1). El lago comprende una superficie de 5,127.43 km2, con una profundidad máxima de siete metros y una profundidad media de cuatro metros. El río Lerma es su influente y el río Santiago su efluente. El lago ha tenido variaciones en sus niveles, con sequías en 1950, 1980 y 1985. El 90% de su superficie corresponde al estado de Jalisco y el 10% restante al estado de Michoacán (Estrada et al. 1983; García-Velasco 2001). El lago de Chapala (el más grande de la República Mexicana), constituye la principal fuente de abasto de agua para la zona metropolitana de Guadalajara, influye favorablemente en los regímenes de temperatura y precipitación regional y es una fuente importante de trabajo para los lugareños de la rivera, beneficiados principalmente por la pesca y el turismo.
Materiales y métodos: En el lago de Chapala se ubicaron un total de 16 estaciones aproximadamente equidistantes (Fig. 1). En cada estación se obtuvieron seis muestras en total: tres durante 1996 (septiembre, octubre y diciembre: 1-48), dos durante 1997 (febrero y junio: 49-80), y una muestra durante 1998 (marzo: 81-96); el total de muestras fueron 96. Con un punto de corte de dos desviaciones estándar ninguna de las muestras fue separada como discordante. El criterio utilizado para la selección de los períodos de colecta fue: a) septiembre de 1996, período en el cual se inicia la entrada más importante de agua pluvial por el río Lerma, la cual acarrea cargas contaminantes elevadas y sedimentos acumulados durante la estación estival en la cuenca hidrológica; b) octubre de 1996, aquí se presenta el caudal máximo de entrada de agua de lluvia, hasta 30 m3/s; c) diciembre de 1996, se disminuyen significativamente los caudales de entrada al lago de Chapala y se presentan crecimientos masivos de cianobacterias y clorofíceas, con impacto al uso del agua; d) febrero de 1997, período en el cual las entradas de caudal al lago son muy limitadas y la hidrodinámica del lago depende de condiciones meteorológicas únicamente; e) junio de 1997, período final de la época estival, el lago presenta niveles mínimos de agua con respecto al ciclo anual dadas las extracciones realizadas para agricultura y para uso urbano y f) marzo de 1998, período complementario al de febrero de 1997, de condición similar a este último.
Mediante ordenación sociológica es posible realizar un análisis multivariado que permita reflejar las relaciones entre grupos de muestras con base en su similitud en composición y en características fisicoquímicas. Es decir, las "diferencias de especies entre dos muestras reflejan sus diferencias ambientales, pero de una manera altamente integrada, la cual incluye diferencias en interacciones bióticas y en eventos históricos" (Beals 1984). Para la colecta de fitoplancton superficial (1 a 45 cm de profundidad) se utilizó una red de plancton estándar con 45 centímetros de diámetro de boca, un m de longitud y luz de malla de 50 µm. Se realizaron arrastres circulares durante tres minutos a una velocidad de un nudo, en una embarcación de propela con motor fuera de borda. Las muestras colectadas se vaciaron en frascos de 100 ml, se fijaron con formalina al 4 % final y acetato de cobre de acuerdo con Schwöerbel (1975), James y Hicks (1978) y King (1980).
La identificación de las especies se realizó con ayuda de claves taxonómicas de fitoplancton (Smith 1950; Prescot 1973 y 1978; James y Hicks 1978; Ortega 1984; Bourrelly 1972 y 1985; Krammer y Lange-Bertalot 1986, 1988 y 1991; Parra y Bicudo 1996) (Tabla 1). Las colecciones fueron depositadas en el laboratorio de Ficología, en el Instituto de Botánica de la Universidad de Guadalajara (IBUG).
Se determinaron in situ algunas variables fisicoquímicas (FQ I): temperatura del agua, pH y oxígeno disuelto con un equipo Hidrolab (Khalsico), transparencia con disco de Secchi. Se tomaron muestras de agua con una botella Van Dorn de 3 l. Para la determinación de otras variables fisicoquímicas se usaron métodos espectrofotométricos (FQ II): alcalinidad total, alcalinidad a la fenolftaleína, cloruros, color, dureza cálcica, dureza magnésica, dureza total, fósforo en ortofosfatos, fósforo total, sólidos totales, sólidos suspendidos, sólidos disueltos totales y sulfatos. Además, la turbiedad (UTN) fue determinada con disco de Secchi, mientras que la demanda química de oxígeno y la conductividad eléctrica se determinaron con un equipo Hidrolab (Khalsico). Los parámetros se midieron en superficie y fondo (Schwöerbel 1975; Streble y Krauter 1987; García-Velasco 2001) (Tabla 2).
Análisis de datos: La matriz principal consistió en datos de presencia ausencia de especies, los cuales tienden a mostrar una relación más monotónica con la distancia ambiental que los datos de abundancia (Beals 1984). La matriz principal consistió de 116 especies y 96 muestras (seis muestras en cada una de las 16 estaciones) (Tabla 1). La matriz secundaria consistió de datos de 20 variables ambientales de cada una de las 96 muestras, correspondientes a las mismas épocas y estaciones.
Mediante análisis multivariado, los datos de composición de fitoplancton y de los factores fisicoquímicos se ordenaron sociológicamente (Beals 1984) y se relacionaron mediante regresiones lineales con las variables ambientales medidas. Se usó la técnica de Bray-Curtis regresión de varianza (BC-rv), por ser eficaz para la detección de gradientes ecológicos de alta heterogeneidad y de variada dinámica (Beals 1984; Ludwig y Reynolds 1988; McCune y Beals 1993; McCune y Mefford 1999; McCune y Grace 2002).
La medida de similitud utilizada fue la distancia Sørensen, la cual se considera una medida robusta de distancia ecológica (Faith et al. 1987).
S = 1-(2w/a+b)
Donde S es la distancia Sørensen, a es el número de especies en el sitio A; b es el número de especies en el sitio B; y w es el número de especies compartidas entre los sitios A y B.
Resultados: El fitoplancton encontrado en las 16 estaciones incluyó 116 especies en 56 géneros y 28 familias. Los géneros con más especies incluyeron Euglena (8); Pediastrum (7); Closterium (6) y Nitzschia (6). El 31% de las especies se reportan en Ortega y Godínez (1994) con algún índice de saprobiedad; 13 se reportan como oligosaprobias; 16 como beta-mesosaprobias; cinco como alfa mesosaprobias y dos como polisaprobias. Un análisis florístico detallado se presenta en otro trabajo (Mora-Navarro et al., en prep.). La riqueza de fitoplancton en el lago disminuyó de septiembre de 1996 a marzo de 1998 (r=−0.525, p<0.001, gl=94) (Tabla 1, Fig. 2).

Ordenación:La ordenación de BC-rv de 96 muestras extrajo un total de varianza acumulada para los tres ejes de 60%. No se reconocieron muestras discordantes (Fig. 3).

Para el eje uno los extremos asignados fueron la muestra 92 y la muestra 12. Este eje extrajo el 38 % de la varianza en la matriz de distancia original. Intrínsecamente, sobre este eje la ordenación mostró una marcada discontinuidad, la cual permitió distinguir dos grupos. Extrínsecamente la variación en este eje fue explicada por la concentración de sulfatos (r=0.751) e inversamente por la alcalinidad total (r=−0.635) (Fig. 4).

El primer grupo se integró por las muestras 80 a 96, las cuales, con excepción de la muestra 80 (colectada en Junio de 1997) corresponden a colectas realizadas en marzo de 1998. Este grupo incluye especies encontradas en un nivel más bajo de sulfato (28 mg/l en promedio) y de más alcalinidad (405 mg/l de CaCO3, en promedio) que el resto de las muestras. Las especies encontradas en el nivel más bajo de sulfato y de más alta alcalinidad incluyen: Trachelomona hispida Ehrenberg, 1833, Chlorella vulgaris Beijerinck, 1890 y Aphanocapsa grevillei (Berk.) Rabenhorst, 1865 (Fig. 3).
El segundo grupo se integró por las muestras 1 a 79, un grupo grande y heterogéneo integrado por muestras obtenidas en los cuatro períodos restantes. Este grupo incluye especies encontradas en un nivel relativamente alto de sulfatos (89 mg/l en promedio) y de relativa baja alcalinidad (323 mg/l de CaCO3, en promedio). Las especies encontradas en los niveles más altos de sulfatos y más bajos de alcalinidad total incluyen: Phormidium fragile (Menenghinii) Gomont, 1892, Strombomonas costata Deflander, 1930, Pediastrum duplex var. reticulatum Lagerheim, Öfvers, 1882 y Phacus pleuronectes (O. F. Müller) Dujardin 1925.
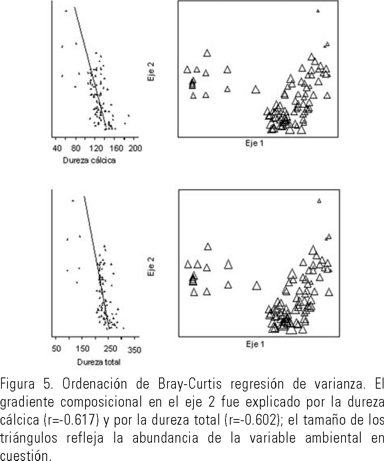
Para el eje dos, los extremos asignados fueron la muestra 59 y la muestra 16. Este eje extrajo el 13% de la varianza en la matriz de distancia original. Intrínsecamente, solamente el grupo dos mostró importante variación sobre este eje. En particular sólo hubo una marcada discontinuidad entre el sitio 16 y el resto del grupo dos. Extrínsecamente la variación de este eje fue explicada por la dureza total (r=−0.602), y por la dureza debida al calcio (r=−0.617) ambas relacionadas entre sí (Fig. 5). Las especies representativas en lugares de baja dureza total (99 mg/l CaCO3, en promedio) incluyeron: Diploneis puella Cleve, 1894, Epithemia sp., 1838, Eudorina elegans Ehrenberg, 1832, Strombomonas costata y Pediastrum duplex var. reticulatum; mientras que las especies representativas en lugares de alta dureza total (288 mg/l de CaCO3, en promedio,) fueron Synedra ulna (Nitzsch) Ehrenberg, 1862, Synedra acus Kützing, 1844, Synedra parasitica (W. Smith.) Hust, 1930, Nitzschia dissipata (Kützing) Grunow, 1862 y Anabaena spiroides (Klebahn) Forschungsber, 1895 (Fig. 3).
Para el eje tres, los extremos asignados fueron la muestra 85 y la muestra 64. Este eje extrajo el 9% de la varianza en la matriz de distancia original. Intrínsecamente, para el eje tres la variación observada para cada grupo fue mínima. Extrínsecamente, la variación del eje tres no fue explicada por ninguna de las variables medidas.
Discusión
Los análisis de ordenación (BC-rv) de fitoplancton en el lago de Chapala correspondientes a los años 1996, 1997 y 1998, sugieren que la concentración de sulfatos y la alcalinidad total explican la mayor parte de variación en la estructura de estas comunidades. Sobre el eje uno, los dos grupos de comunidades además de ser explicados por los sulfatos y por la alcalinidad muestran una correspondencia temporal con los períodos de colecta (Fig. 2).
La disminución observada en la riqueza de especies al disminuir la concentración de sulfatos puede deberse a que la deficiencia de este compuesto reduce el crecimiento y la fotosíntesis de las algas (Giordano et al. 2000) (Fig. 3). Ya que el azufre, considerado como un macro nutrimento es además importante por sus funciones estructurales y enzimáticas, ya que es un componente principal de aminoácidos como cistina y metionina y por tanto de proteínas, así como un componente de la coenzima A, la cual interviene en el inicio del ciclo de Krebs (Raven et al. 1999).
Las concentraciones de sulfatos en el lago, podrían tener su origen en las descargas de aguas domésticas y agrícolas de la zona (Guzmán-Arroyo 1997; Arriaga et al. 2002). Los iones sulfatos contribuyen a la salinidad del lago, estos tienden a formar sales con los metales pesados disueltos en el agua, así, un incremento de los sulfatos presentes en el medio hídrico puede indicar la existencia de un vertido cercano (Guzmán-Arroyo 1997; García-Velasco 2001). Otro posible origen de los sulfatos es a través de la oxidación de los sulfuros de las capas anóxicas del lago que se mezclan con el agua rica en oxígeno durante el intercambio vertical de agua del otoño (Guzmán-Arroyo 1997), el cual se efectúa por las descargas acuíferas del río Lerma, que son más intensas durante ese período (García-Velasco 2001). Como respuesta a esta producción de sulfatos, el fitoplancton se incrementa ya que obtiene la cantidad de sulfato necesaria para su crecimiento y reproducción (Cole 1975; Abalde 1995; Raven et al. 1999) (Fig. 2). Las muestras con altas concentraciones de sulfatos se caracterizaron por una flora eutrófica que incluyó especies como Cyclotella meneghiniana Kützing, 1844 y Synedra ulna, las cuales se relacionan con episodios de contaminación del agua (Ofarrell 1994) y Gomphonema parvulum Kützing, 1849 que se relaciona con episodios de mayor descarga de metales, después de la estación lluviosa (Monteiro et al. 1995). Adicionalmente, Anabaena aff spiroides, Microcystis aeruginosa (Kützing) Kützing, 1846, Nitzschia dissipata, Nitzschia amphibia Grunow, 1862 (diatomea saprofítica asociada a la contaminación orgánica), y Pediastrum duplex var. reticulatum se observaron en este grupo de muestras (Brown y Olive 1995; Monteiro et al. 1995; Stoyneva 2003).
El aumento de nutrimientos como el nitrógeno y sulfatos en el lago, permiten cambios en la distribución y abundancia del fitoplancton. Estos cambios a su vez modifican las interacciones entre especies, las cuales compiten por recursos y promueven florecimientos de una o pocas especies (Huszar et al. 1998). Además, la dominancia de las especies varía de acuerdo a su capacidad para explotar la misma fuente de nutrimentos, como es el caso de Pediastrum duplex y Anabaena aff. spiroides (Berman y Chava 1999). Estos atributos de la comunidad de fitoplancton están relacionados con su nivel trófico. Con el incremento del nivel trófico, la biomasa de fitoplancton muestra marcadas fluctuaciones estacionales, relacionadas a su vez con variables físicas (Reynolds 1998). Se sugiere en este trabajo, que estas variaciones pueden ser estacionales y cíclicas, y estar correlacionadas con variables como sulfatos, dureza y salinidad.
De este estudio, los datos muestran como en el último año (marzo 1998), el nivel de alcalinidad total rebasó los 375 mg/l de CaCO3, mayor al nivel registrado en los otros cinco períodos de colecta. Esto corresponde con el más bajo nivel de riqueza de especies observado (11 especies en promedio) (Tabla 1, Fig. 2). Aunque el global de los datos actuales sugieren una declinación de la riqueza de especies, estos distan de ser representativos y requieren más repeticiones en los mismos períodos y a largo plazo a fin de poder demostrar dicha hipótesis (Fig. 2). La disminución de la riqueza también corresponde con una notoria disminución del nivel del lago durante el semestre de enero a junio de 1998, atribuida principalmente, al fenómeno de El Niño (Tereshchenko et al. 2002), debido a que durante este periodo (1996-1998), la temperatura del aire y la evaporación se incrementaron causando la disminución del nivel del lago observada durante enero a junio de 1998. Esto es, las temperaturas del verano y otoño de 1998 fueron 1.5°C mayores que en 1996. La temperatura superficial del lago en el invierno 1997/1998 fue en promedio 1°C menor que en 1996 (Tereshchenko et al. 2002). De manera similar, otros lagos como el de Coatetelco, Morelos, mostró una tendencia de disminución de fitoplancton a través del tiempo conforme el lago se reducía en profundidad y volumen y sus valores de diversidad fueron los más bajos en el mes de febrero (Peña-Mendoza et al. 2002).
Se sugiere que aunque algunas especies de algas pueden estar adaptadas en su metabolismo a ambientes salinos, o bien pueden tener la capacidad de tolerar pequeños cambios de salinidad (Raven et al. 1999), otras especies sin embargo pueden ser incapaces de tolerar considerables niveles de salinidad (Raven et al. 1999). Un exceso de sales en el lago puede crear un diferencial osmótico de tal magnitud que podría al menos limitar el éxito relativo de ciertas especies poco tolerantes a la salinidad (Raven et al. 1999). El considerable cambio en salinidad, debido en parte a la disminución del nivel del lago y éste último relacionada con el fenómeno de El Niño, pudo haber resultado en una comunidad más pobre, como la observada, caracterizada por especies tolerantes a altas concentraciones de salinidad tales como Trachelomona hispida, Chlorella vulgaris y Aphanocapsa grevillei (Tereshchenko et al. 2002), especies que contribuyeron al reconocimiento de un grupo distinto del resto. También es consistente con el hecho de que los niveles de mayor salinidad, al igual que las temperaturas altas, reducen la saturación de gases, incluyendo CO2, indispensable para el desarrollo óptimo del fitoplancton. Pérdidas de CO2 modifican las condiciones de pH, lo cual selecciona las especies con mayor eficiencia en sus mecanismos de captura de carbono. La concentración de CO2 y la competencia por el carbono inorgánico disuelto juegan un papel importante en la determinación de la composición de fitoplancton y en la capacidad de las especies en usar bicarbonatos como fuentes de carbón (Huszar et al. 1998).
De esta manera, las variaciones en salinidad afectan la disponibilidad de carbono (ya sea como gas disuelto o como carbonatos) lo cual, se convierte en uno de los factores limitantes en el crecimiento de fitoplancton y de la acumulación de biomasa. Este factor, puede además estar influenciado por la contaminación ambiental, movimientos del agua y la morfología e hidrología del cuerpo de agua, los cuales en su conjunto determinan la estructura trófica de la comunidad (Huszar et al. 1998). Estos mecanismos selectivamente determinan la presencia o ausencia de las especies en un ambiente dado (Reynolds 1998; Naselli-Flores y Barone 2000).
La dureza debida al calcio y la dureza total, mostraron en el eje dos de la ordenación un efecto menor que el mostrado por concentración de sulfatos o que el nivel de alcalinidad sobre el eje uno, y explicaron parte de la varianza en composición no explicada por los últimos. La dureza total representa la cantidad de calcio y magnesio que contiene el agua y está ligada al pH, ya que, aguas de dureza baja (blandas) suelen ser al mismo tiempo ácidas (pH bajo) y aguas de dureza elevada (duras) son por lo general alcalinas (pH alto). La dureza puede ser temporal o permanente. Por lo tanto, se espera que el efecto que tienen estas variables sobre el fitoplancton sea el mismo que el mencionado para la alcalinidad total. Además esta concentración de sales puede servir como fuente de suministro importante de los elementos esenciales como Ca y Mg (Raven et al. 1999). Una especie comúnmente observada en lugares de mayor dureza total fue Synedra ulna, especie codominante durante estados tempranos de desarrollo de la comunidad (Monteiro et al. 1995; Alam et al. 2001; De Fabricius et al. 2003).
El hecho de que la varianza extraída por el eje tres, aunque mínima (9.1%), no fue explicada por las variables medidas, sugiere que deben medirse otras variables ambientales esperando que alguna(s) de ella(s) pueda(n) explicarla.
Con relación a la permanencia del fitoplancton en el cuerpo de agua, los resultados sugieren que los niveles bajos de sulfatos y los niveles altos de alcalinidad podrían ser desfavorables para la mayor parte de fitoplancton, principalmente a través de disminuir su riqueza (aumentando su densidad), de cambiar su composición y de limitar el desarrollo de especies poco tolerantes a la alta salinidad, modificando la dinámica y la productividad, lo cual eventualmente repercute sobre la actividad pesquera en el cuerpo de agua (García-Velasco 2001).
En conclusión, se hipotetiza: a) que las concentraciones de sulfatos y de alcalinidad total son los factores más importantes que determinan el gradiente principal de composición del fitoplancton en el lago de Chapala y b) que la dureza cálcica y la dureza total explican el gradiente secundario de composición de dicho fitoplancton. Más variables fisicoquímicas deben ser incluidas en futuros análisis, en vista de que ninguna de las variables medidas explicó el gradiente terciario de composición. Un enfoque comparativo con estudios como el presente en lagos tropicales similares podría permitirnos demostrar tales hipótesis.
Agradecimientos
El presente trabajo fue financiado en parte por el proyecto "Ordenamiento ecológico territorial de la vegetación, flora vascular, ficoflora y micobiota de Jalisco" (Universidad de Guadalajara, SIMORELOS-CONACyT 96-06-002 y SEMARNAP). La autora principal agradece el apoyo recibido por el programa PROMEP de la Universidad de Guadalajara. A los doctores Eduardo Ríos Jara y David Siqueiros Beltrones, así como a revisores anónimos de Hidrobiológica por sus constructivas sugerencias al manuscrito. Al personal del Instituto de Limnología, del Departamento de Ecología de la Universidad de Guadalajara, en especial al Dr. Manuel Guzmán Arroyo por haber coordinado los muestreos en campo. A Kandis Elliot y al Dr. Manuel Guzmán Arroyo por la elaboración de los mapas. Al personal del Departamento de Ciencias Ambientales, de la Universidad de Guadalajara, en particular al Dr. Javier García Velasco, por los análisis de aguas para la determinación de las variables fisicoquímicas. Al Dr. Arturo Curiel Ballesteros, del Departamento de Ciencias Ambientales, coordinador del Estudio Integral del lago de Chapala (1996-1998), por invitarnos a colaborar en dicho proyecto.
Referencias
ABALDE, J., 1995. Microalgas: cultivo y aplicación. Monografía 26. Universidad de Coruña. La Coruña, España. 210 p. [ Links ]
ALAM, M. G. M., N. JAHAN, L. THALIB, B. WEI & T. MAEKAWA, 2001. Effects of environmental factors on the seasonal change of phytoplankton populations in a closed freshwater pond. Environmental International 25(5): 363-371. [ Links ]
ALCOCER, J., A. LUGO, M. R. SÁNCHEZ & E. ESCOBAR, 1998. Isabela Crater-Lake: a Mexican insular saline lake. Hydrobiologia 381: 1-7. [ Links ]
ANAND, N., 1988. Culture studies and taxonomy of blue-green algae: certain identification problems. Algological Studies 50-53: 141-147. [ Links ]
ARRIAGA, L., V. AGUILAR, C. AGUILAR, J. M. ESPINOZA & L. GÓMEZ, 2002. Evaluación de la biodiversidad y estado de conservación de la cuenca Lerma-Chapala. Resúmenes II Congreso Nacional de la Asociación Mexicana de Limnología. 23 al 25 de octubre, México D. F. 115 p. [ Links ]
BANDERAS-TARABAY, A. G., 1997. Phycoflora of the tropical high-mountain lake El Sol, central Mexico, and some biogeographical relationships. Hydrobiologia 354: 17-40. [ Links ]
BEALS, E. W., 1984. Bray Curtis ordination: An effective strategy for analysis of multivariate ecological data. Advances in Ecological Research 14: 1-55. [ Links ]
BERMAN, T. & S. CHAVA, 1999. Algal growth on organic compounds as nitrogen sources. Journal of Plankton Research 21(8): 1423-1437. [ Links ]
BOURRELLY, P., 1972. Les algues d'éau douce. Initiation à la systématique. T 1: Les algues vertes. Éditions N. Boubée et Cie. Paris. 572 p. [ Links ]
BOURRELLY, P., 1985. Les algues d'éau douce. Initiation à la systématique. T 3: Les algues bleues et rogues; les eugléniens, peridiniens et cryptomonadines. Éditions N. Boubée & Cie. Paris. 606 p. [ Links ]
BROWN, B. J. & J. H. OLIVE, 1995. Diatom communities in the Cuyahoga river (USA): changes in species composition between 1974 and 1992 following renovations in waste-water management. Ohio Journal of Science 95(3): 254-260. [ Links ]
CARMICHAEL, W. W., 1994. The toxins of Cyanobacteria. Scientific American 270(1): 78-86. [ Links ]
COLE, G. A., 1975. Textbook of Limnology. The C. V. Mosby Company. Saint Louis Missouri. 283 p. [ Links ]
COMPÉRE, P., 1974. Algues de la Région du lac Tchad. Cyanophycés. Hydrobiologia 8(3-4): 165-198. [ Links ]
DE FABRICIUS, A. L. M., N. MAIDANA, N. GOMEZ & S. SABATER, 2003. Distribution patterns of benthic diatoms in a Pampean river exposed to seasonal floods: the Cuarto River (Argentina). Biodiversity and Conservation 12(12): 2443-2454. [ Links ]
ESTRADA-FAUDON, E., E. FLORES-TRITSCHLER & J. R. MICHEL, 1983. Lago de Chapala, investigación actualizada. Instituto de Geografía y Estadística-Instituto de Astronomía y Meteorología, Universidad de Guadalajara. Guadalajara, México. 67 p. [ Links ]
FAITH, D. P., P. R. MINCHIN & L. BELBIN, 1987. Compositional dissimilarity as a robust measure of ecological distance. Vegetatio 69: 57-68. [ Links ]
GARCÍA-VELASCO, J., 2001. Estudio de los contaminantes en el proceso de sedimentación en el lago de Chapala, México. Tesis de Doctorado. Universidad de Valencia, España. 120 p. [ Links ]
GIORDANO, M., V. PEZZONI & R. HELL., 2000. Strategies for the allocation of resources under sulfur limitation in the green alga Dunaliella salina. Plant Physiology 124(2): 857-864. [ Links ]
GONZÁLEZ-GONZÁLEZ, J., 1992. Flora ficológica de México: Concepciones y estrategias para la integración de una flora ficológica nacional. Revista Ciencias (número especial) 6: 13-33. [ Links ]
GUZMÁN-ARROYO, M. (ED.), 1995. La pesca en el lago de Chapala: hacia su ordenamiento y explotación racional. Comisión Nacional del Agua-Universidad de Guadalajara, Guadalajara, México. 302 p. [ Links ]
GUZMÁN-ARROYO, M., 1997. Las aguas superficiales. Diagnóstico. Programa de Ordenamiento Ecológico y Territorial del Estado de Jalisco, Marco Físico. Instituto de Limnología, Universidad de Guadalajara, Guadalajara, México. 125 p. [ Links ]
GUZMÁN-ARROYO, M. & E. MERINO-NAMBO, 1992. El lago de Chapala, información básica. Instituto de Limnología, Universidad de Guadalajara. Chapala, México. 13 p. [ Links ]
GUZMÁN-ARROYO, M., M.R. MORA-NAVARRO, E.S. ROBLES-JARERO & J.G MICHEL-PARRA 2000. El alga Anabaena spp. en el lago de Chapala. Un problema de calidad del agua. pp. 145-155. In: A. Valdéz-Zepeda, M. Guzmán-Arroyo S. Peniche-Campos (eds.). Chapala en Crisis. Universidad de Guadalajara, Guadalajara, Jalisco. [ Links ]
HUSZAR, V. L. M, L. H. S. SILVA, P. DOMINGOS, M. MARINHO & S. MELO, 1998. Phytoplankton species composition is more sensitive than oecd criteria to the trophic status of three brazilian tropical lakes. Hydrobiologia 369/370: 59-71. [ Links ]
IBARRA-VÁZQUEZ, C. & E. NOVELO, 1997. Diatomeas de Texcala, Puebla. Boletín de la Sociedad Botánica de México 61: 49-57. [ Links ]
JAMES, A. & P. M. HICKS, 1978. A selected bibliography of plant collection and herbarium curation. Taxon 27 (1): 63-99. [ Links ]
KING, J. M., 1980. Ecology and distribution of algae: Techniques. Phycological Seminar - Workshop. U.S.A. - México. 22 p. [ Links ]
KOMÁRKOVA-LEGNEROVÁ, J. & R. TAVERA-SIERRA, 1996. Cyanoprokaryota (Cyanobacteria) in the phytoplankton of lake Catemaco (Veracruz, Mexico). Algological Studies 83: 403-422. [ Links ]
KRAMMER, K. & H. LANGE-BERTALOT, 1986. Bacillariophyceae. 1. Naviculaceae. In: Pascher, A. B. Von H., H. Von Ettl, J, Garloff, H. Heyning, y D. Mollenhauer (eds.). SüBwasser flora von Mitteleuropa. Band 2/1. Gustav Fischer Verlag, Stuttgart, New York. 876 p. [ Links ]
KRAMMER, K. & H. LANGE-BERTALOT, 1988. Bacillariophyceae. 2. Bacillariaceae, Epithemiaceae, Surirellaceae. In: Pascher, A. B. Von H., H. Von Ettl, J, Garloff, H. Heyning, y D. Mollenhauer (eds.). SüBwasser flora von Mitteleuropa. Band 2/2 Gustav Fischer Verlag, Stuttgart, New York. 576 p. [ Links ]
KRAMMER, K. & H. LANGE-BERTALOT, 1991. Bacillariophyceae. 3. Centrales, Fragillariaceae, Eunotiaceae. In: Pascher, A. (op. cit.), SüBwasser flora von Mitteleuropa.Band 2/3 Gustav Fischer Verlag, Stuttgart, New York. 578 p. [ Links ]
LACOSTE, E. N., M. S. VIGNA, S. MAC CARTHY & N. I. MAIDANA, 1987. Algas de aguas continentales de Argentina VII. Entre ríos II. Darwiniana 28(1-4): 105-145. [ Links ]
LIND, O. T. & L. DÁVALOS-LIND, 1991. Association of turbidity and organic carbon with bacterial abundance and cell size in a large, turbid, tropical lake. Limnology and Oceanography 36: 1200-1208. [ Links ]
LIND, O. T., R. DOYLE, D. S. VODOPICH, B. G. TROTTER, J. G. LIMÓN & L. DÁVALOS-LIND, 1992. Clay turbidity: regulation of phytoplankton production in a large, nutrient-rich tropical lake. Limnology and Oceanography 37: 549-565. [ Links ]
LUDWIG, J. A. & J. F. REYNOLDS, 1988. Statistical ecology. John Wiley & Sons, Inc. New York, U.S.A. 337 p. [ Links ]
MARGALEF, R., 1983. Limnología. Editorial Omega, Barcelona. 1010 p. [ Links ]
MCCUNE, B. & E. BEALS, 1993. History of the development of the Bray-Curtis ordination pp. 67-79. In: Fralish, R.P. McIntosh, O. L. Louckes (eds.) John T. Curtis: Fifty years of Wisconsin plant ecology. Wisconsin Academy of Sciences Art and Letters, Madison Wisconsin. [ Links ]
MCCUNE, B. & J. B. GRACE, 2002. Analysis of ecological communities. MjM Software Design, Gleneden Beach, Oregon. 300 p. [ Links ]
MCCUNE, B. & M. J. MEFFORD, 1999. PC-ORD. Multivariate analysis of ecological data. Versión 4. MjM Software Design, Glenden Beach, Oregon, USA. 300 p. [ Links ]
MENNES, A. M. & R. Y. STANIER, 1968. Selective Isolation of blue-green algae from water and soil. Journal Genetic Microbiolology 51: 203-209. [ Links ]
MONTEIRO, M. T., R. OLIVEIRA & C. VALE, 1995. Metal stress on the plankton communities of Sado river (Portugal). Water Research 29(2): 695-701. [ Links ]
MORA-NAVARRO, M. R. & T. CASTRO-CRUZ, 1999. El fitoplancton del lago de Chapala. DeVinci 1(1): 39-42. [ Links ]
MORA-NAVARRO, M. R., M. GUZMÁN-ARROYO, & E. G. ROBLES-JARERO, 2000. El alga Anabaena sp. en el lago de Chapala. Estudios sobre Plancton en México y el Caribe. Reunión del X Aniversario de la Sociedad Mexicana de Planctología, A. C., Mayo 2-4, Chapala, Jalisco. Universidad de Guadalajara, Guadalajara, México. 155 p. [ Links ]
NASELLI-FLORES, L. & R. BARONE, 2000. Phytoplankton dynamics and structure: a comparative analysis in natural and man-made water bodies of different trophic state. Hydrobiologia 438: 65-74. [ Links ]
NOVELO-MALDONADO, E., 1998. Flora ficológica del Valle de Tehuacán, Puebla. Tesis de Doctorado. Facultad de Ciencias, UNAM, México. D. F. 599 p. [ Links ]
NÚÑEZ-MÁRQUEZ, I. G. & M. E. REYES-GONZÁLEZ, 1995. Contribución al conocimiento del fitoplancton del lago de Chapala, Jalisco, México. Durante el período de febrero a mayo de 1989, 1990 y 1991. Tesis de Licenciatura (Biología). Universidad de Guadalajara, Guadalajara, México. 69 p. [ Links ]
OFARRELL, I., 1994. Comparative analysis of the phytoplankton of 15 low-land fluvial systems of the River Plate Basin (Argentina). Hydrobiologia 289(1-3): 109-117. [ Links ]
ORTEGA, M. M., 1984. Catálogo de algas continentales recientes de México. Universidad Nacional Autónoma de México, México, D. F. 566 p. [ Links ]
ORTEGA, M. M., 1987. Doce años de ficología en México (1971-1983). In: Contribuciones en Hidrobiología. Universidad Nacional Autónoma de México. México, D. F. pp. 15-18. [ Links ]
ORTEGA, M. M. & L. GODÍNEZ, 1994. Ficología de México. Algas continentales. Ed. AGT México, D.F. 221 p. [ Links ]
PALMER, M., 1962. Algas de abastecimiento de agua. Departamento de Sanidad, Educación y Bienestar de Estados Unidos. Servicio de Sanidad Pública. Ed. Interamericana, S. A. 91 p. [ Links ]
PARRA, O. O. & C. E. M. BICUDO, 1996. Algas de aguas continentates: Introducción a la biología y sistemática. Ed. Universidad de Concepción, Chile. 268 p. [ Links ]
PEÑA-MENDOZA, B., J. L. GÓMEZ-MÁRQUEZ, I. H. SALGADO-UGARTE & J. L. ARREDONDO-FIGUEROA, 2002. Variación temporal del fitoplancton en el lago Coatetelco, Morelos. Resúmenes II Congreso Nacional de la Asociación Mexicana de Limnología, 23 al 25 de octubre de 2002, México, D. F. 115 p. [ Links ]
PHLIPS, E. J., F. J. ALDRIDGE, C. L. SCHELSKE & T. L. CRISMAN, 1995. Relationships between light availability, chlorophyll a, and tripton in a large, shallow subtropical lake. Limnology and Oceanography 40: 416-421. [ Links ]
PRESCOT, G. W., 1973. Algae of the western Great Lakes area. W. M. Brown Company Publishers. Dubuque, Iowa. 977 p. [ Links ]
PRESCOT, G. W., 1978. How to know the freshwater algae. 3rd ed. W. M. Brown Company Publishers. Dubuque, Iowa. 293 p. [ Links ]
RAVEN, P., R. F. EVERT & S. E. EICHHORN, 1999. Biology of plants. Company Worth Publishers, New York. 944 p. [ Links ]
REYNOLDS, C. S., 1986. The ecology of freshwater phytoplankton. Cambridge University Press, Cambridge. 384 p. [ Links ]
REYNOLDS, C. S., 1998. What factors influence the species composition of phytoplankton in lakes of different trophic status? Hydrobiologia 369/370: 11-26. [ Links ]
SCHWÖERBEL, J., 1975. Métodos de hidrobiología (biología de agua dulce). Hermann Blume Ediciones, Madrid. 237 p. [ Links ]
SMITH, G. M., 1950. The fresh-water algae of the United States. Mc-Graw-Hill Book Company, New York-Toronto-London. 637 p. [ Links ]
STOYNEVA, M. P., 2003. Steady-state phytoplankton assemblages in shallow Bulgarian wetlands. Hydrobiologia 502(1-3): 169-176. [ Links ]
STREBLE, H. & D. KRAUTER, 1987. Atlas de los microorganismos de agua dulce. La vida en una gota de agua. Editorial Omega, Barcelona. 366 p. [ Links ]
TAVERA-SIERRA, R., 1996. Phytoplankton of the tropical lake Catemaco. Ph. D. Thesis. Faculty of Biological Sciences, University of South Bohemia. Ceské Budejovice, Czech Republic. 108 p. [ Links ]
TAVERA-SIERRA, R., J. ELSTER & P. MARVAN, 1994. Diatoms from Papaloapan basin communities, Mexico. Algological Studies 74: 35-65. [ Links ]
TERESHCHENKO, I., A. FILONOV, A. GALLEGOS, C. MONZÓN & R. RODRÍGUEZ, 2002. El Niño 1996-98 and the hydrometeorological variability of Chapala, a shallow tropical lake in México. Journal of Hydrology 264: 133-146. [ Links ]
VALADEZ-CRUZ, F., J. CARMONA-JIMÉNEZ & E. A. CANTORAL-URIZA, 1996. Algas de ambientes lóticos en el estado de Morelos, México. Anales del Instituto de Biología de la Universidad Autónoma de México, Serie Botánica 67(2): 227-282. [ Links ]
WATANABE, M. & J. KOMÁREK, 1994. Several cyanoprocaryotes from Sagarmatha National Park, Nepal Himalayas. Bulletin of the Natural Science Museum, Tokyo (Ser. B). 20(1): 1-31. [ Links ]
WETZEL, R. G., 1981. Limnología. Editorial Omega, Barcelona. 679 p. [ Links ]














