Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.14 no.2 Ciudad de México 2004
Artículo
Eficiencia de captura del camarón dulceacuícola Palaemonetes argentinus (Nobili 1901) sobre larvas de mosquito Culex pipiens s.l. (Linnaeus 1758)
Capture efficiency of the freshwater prawn Palaemonetes argentinus (Nobili 1901) on the Culex pipiens s.l. (Linnaeus 1758) mosquitoes larvae
Federico Giri1 y Pablo Collins1,2
1 Instituto Nacional de Limnología (INALI - CONICET), José Maciá 1933, C.P. 3016 Santo Tomé, Santa Fe, Argentina. Email fegiri@infovia.com.ar
2 Escuela Superior de Sanidad, Facultad de Bioquímica y Ciencias Biológicas, Universidad Nacional del Litoral, Pje. El Pozo s/n, 3000 Santa Fe, Argentina. Email pcollins@arnet.com.ar
Recibido: 28 de julio de 2003
Aceptado: 13 de mayo de 2004
Resumen
La depredación consiste en eventos encadenados divididos en tres etapas: búsqueda, captura e ingestión. Se filmó al camarón Palaemonetes argentinus depredando larvas de mosquito (Culex pipiens s.l.) en acuarios, reconociendo un incremento en la actividad natatoria de los camarones luego de percibir el movimiento de las larvas por mecanorreceptores. La búsqueda de presas insumió en camarones pequeños 13,9 ± 9,39 segundos, en camarones grandes 26,6 ± 23,47 segundos y en los acuarios con ejemplares de ambas tallas (mixtos) 17,9 ± 16,32 segundos. La efectividad de los ataques fue mayor en ejemplares pequeños (73 %) que en grandes (44 %), quizás por una relativa mayor capacidad natatoria. La captura de presas la realizan con los segundos pereiópodos y rápidamente son llevadas hacia los apéndices bucales. Estas larvas son preferentemente comidas por la región cefálica (79,33 %) neutralizando el posible escape. El tiempo empleado en el manipuleo depende del número de larvas depredadas. En general, se puede decir que el tiempo empleado en consumir una larva de mosquito es mayor en los ejemplares pequeños (91,0 ± 90,30 segundos) que en los camarones grandes (25,0 ± 27,9 segundos).
Palabras clave: decápodos, depredación, Palaemonetes argentinus, Culex pipiens.
Abstract
The predation consists of a chain of events divided in three phases: encounter, capture and ingestion. We filmed the prawn Palaemonetes argentinus depredate on mosquitoes larvae (Culex pipiens s.l.) in aquaria, watching an increment in the swimming activity of prawns then to recognize the movement of the larvae by mechanoreceptors. The encounters of prey demand in the aquaria with small prawns 13.9 ± 9.39 seconds, in the aquarium with big prawns 26.6 ± 23.47 seconds, and in the pools with mixed prawns 17.9 ± 16.32 seconds. The attacks were more efficiently in small prawn (73%) that in big prawn (44%), maybe because the small prawns are better swimmers than big ones. The capture of prey was made with the second pereiopods and rapidly will be carried to its cephalic appendices. These larvae are preferment eaten by the cephalic region (79.33 %) and in this manner the prawns neutralized its possible escapes. The time utilized into manipulation depends of the larvae number depredated. In general, the time to eat the mosquitoes larvae is longer in the small prawns (91.0 ± 90.3 seconds) that the big prawns (25.0 ± 27.9 seconds).
Key words: decapods, depredation, Palaemonetes argentinus, Culex pipiens.
Introducción
Todas las actividades desarrolladas por las poblaciones animales les ocasionan costos y beneficios, el balance positivo de éstas permite que las especies perduren en un ambiente (Pianka 1982). En este sentido la obtención de alimento está directamente relacionada con la incorporación de energía a expensas de su consumo por la búsqueda de las presas, uno de los aspectos analizados con gran interés es la dependencia del tipo de presa y el manipuleo de la presa (Posey & Anson 1991; Hsueh et al., 1992; Juanes 1992; Gordon & Corkum 1994; MacIsaac 1994; Gibson et al.1995; L'Abée-Lund et al. 1996; Pavey & Fielder 1996; Fleeger et al. 1999; RayCulp et al. 1999) determinando en algunos casos que el comportamiento críptico o el rápido crecimiento de las presas son características importantes en las relaciones entre los eslabones tróficos. De acuerdo con estos conceptos, la relación entre depredador-presa está determinada por características morfológicas, fisiológicas y/o etológicas favorables o desfavorables desde donde se considere dicha relación. Las presas intentan evitar ser comidas y los depredadores hacer efectiva la obtención de alimento mediante ajustes o cambios en las características antes mencionadas. Sin embargo la eficacia de cada intento no ha sido aún analizada detalladamente.
El proceso de depredación consiste, en eventos encadenados, pudiéndose dividir en tres etapas: búsqueda, captura e ingestión (Gibson et al. 1995).
En el presente trabajo se analiza el proceso de depredación en el camarón dulceacuícola Palaemonetes argentinus (Nobili 1901) sobre larvas del mosquito Culex pipiens s.l. (Linnaeus 1758).
Estas dos especies son miembros abundantes de ambientes dulceacuícolas, tanto lóticos como lénticos (Boschi 1981; Angrisano & Trémouilles 1995). El depredador en este caso, P. argentinus, es omnívoro alimentándose de componentes planctónicos y bentónicos (Collins 1999); mientras que las larvas de C. pipens s.l. son activas nadadoras y se alimentan de microorganismos y de materia orgánica (Riviere 1985; Floore 2000).
Material y método
Se recolectaron ejemplares adultos del camarón P. argentinus en el Río Salado a la margen de la ciudad de Santo Tomé (Santa Fe, Argentina) mediante copo de arrastre de 50 x 30 cm de diámetro y 1 mm de luz de malla e inmediatamente se trasladaron al Instituto Nacional de Limnología. En el laboratorio, los camarones capturados se colocaron en acuarios de 70 L. En los acuarios se colocó agua extraída del ambiente mezclada con agua de perforación (83 mg/l de Ca CO3, pH 8,1, conductividad 410 µohms/cm y concentración de oxígeno 5,5 mg/l) en proporciones de 1/1. La columna de agua fue de 30 cm. Las condiciones de temperatura y luz coincidieron con las encontradas en el ambiente durante la experimentación (25 ºC, 14:10 luz:oscuridad).
Se seleccionaron camarones de acuerdo a tres intervalos de longitud de cefalotórax, incluyendo el rostro (LC). Un primer grupo con camarones de LC menor a 15 mm, un segundo grupo de LC mayor a 15 mm y un tercer grupo con LC mayores y menores a 15 mm (grupo mixto). Cada grupo estaba constituido por 30 individuos, los cuales se colocaron en 6 acuarios (dos acuarios para cada grupo con 15 individuos cada uno). Luego se los dejó aclimatar durante 3 días alimentados ad libitum con músculo fresco de camarón.
Larvas del mosquito C. pipens s.l. fueron cultivadas en estanques de fibrocemento contando con suficientes larvas en estadio 3 para la realización de las observaciones.
Se interrumpió la alimentación de P. argentinus durante 24 h. Luego, en cada acuario se colocaron larvas de C. pipiens s.l. El ofrecimiento de larvas de mosquito se realizó a intervalos de 24 h, siempre por la mañana (09:00 h), durante tres días. La cantidad de presas colocadas fue superior a la capacidad de depredación en laboratorio de P. argentinus (18 larvas/camarón en 24 h) a fin de evitar competencia intraespecífica por el alimento (Giri 2001).
Las etapas del proceso de depredación utilizadas por Gibson et al. (1995), fueron ajustadas a las características observadas en P. argentinus de la siguiente manera: tiempo de búsqueda (TB), luego de ofrecidas las presas, los camarones las asedian y empiezan a nadar en el hiponeuston (donde se encuentran las larvas de mosquito) hasta la captura efectiva de la presa; tiempo de captura (TC) desde que la presa es sostenida por el depredador con el segundo pereiópodo hasta que es sujetada por las piezas bucales; y tiempo de ingestión (TI) desde la sujeción de la presa hasta que ésta es ingerida completamente. Todos los datos se indican como promedio y desviación estándar.
Además se observó la efectividad en los ataques (porcentaje de larvas capturadas sobre el total de ataques realizados) y la frecuencia de la forma de consumo de las larvas de mosquito por el camarón (por región cefálica o región posterior del abdomen).
Todos los procesos de depredación fueron filmados con una videocámara SONY video Hi8 XR modelo CCD-TRV87, filmándose por 10 minutos a cada acuario durante tres días.
Los videos fueron analizados y los tiempos de cada una de las etapas definidas anteriormente fueron cronometrados con un cronómetro CASIO G-SHOCK FOX FIRE.
Los datos de tiempo requeridos en cada grupo de talla y en cada evento de las diferentes etapas se probaron mediante el test no paramétrico de Kruskal-Wallis (Zar 1996).
Resultados
En todos los acuarios con ejemplares de P. argentinus, chicos, grandes y mixtos, hubo depredación de larvas de C. pipens s.l.
El tiempo total de todo el proceso en los grupos observados representó un valor medio de 36,2 ± 28,58 segundos. También se pudo observar, principalmente en los ejemplares grandes, que los camarones podían tener más de una presa a la vez, disminuyendo o aumentando el tiempo de alguna de las etapas definidas.
En las condiciones experimentales establecidas, el tiempo promedio de búsqueda de presas realizada por P. argentinus fue menor en los acuarios con camarones pequeños (13,89 ± 9,39 segundos), mayor en los acuarios con camarones grandes (26,56 ± 23,47 segundos) e intermedio en los acuarios con ejemplares de ambas tallas (mixtos) (17,86 ± 16,32 segundos) (Figura 1). No existiendo diferencias estadísticamente significativas entre los grupos de distinta talla (Kruskal-Wallis α= 0,05; n= 3; df= 2 p =0,5407).

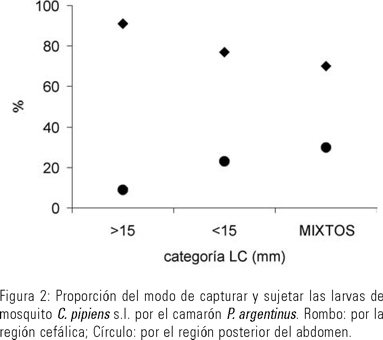
Los individuos de menor tamaño fueron más efectivos (73 % de efectividad en los ataques) que los ejemplares grandes (44 % de efectividad). Mientras que la efectividad en los acuarios con ejemplares de ambas tallas fue semejante al grupo de mayor LC (47 % de efectividad). En la captura de presas, P. argentinus utilizó las quelas del segundo par de pereiópodos llevando rápidamente las larvas hacia los apéndices bucales. De esta manera la captura de las larvas de C. pipiens s.l. por los camarones - y su traspaso a los apéndices bucales - fue realizada principalmente por la región cefálica y en menor proporción por la región posterior del abdomen, existiendo diferencias estadísticamente significativas en la forma de captura (Kruskal-Wallis α= 0,05; n= 2; df= 1 p =0,0495) (Figura 2).
Los ejemplares pequeños de P. argentinus emplearon más tiempo en la ingestión que los camarones de talla mayor, mientras que en los acuarios con ambas tallas el TI fue intermedio observándose que no habría interferencia entre las categorías de tallas en esta etapa (Figura 3).

A pesar de esas diferencias las amplitudes en los desvíos determinaron que las diferencias entre el grupo mixto y los grupos grandes y chicos no son estadísticamente significativas (Kruskal-Wallis α= 0,05; n= 3; df= 2 p =0,6786). Sin embargo el TI entre los camarones grandes y chicos mostró diferencias significativas (Kruskal-Wallis α= 0,05; n= 22; df= 21 p =0,0360).
Discusión
En las experiencias desarrolladas se observaron las tres etapas descriptas apreciándose diferencias en la actividad de los camarones en cada una de ellas. P. argentinus aumentó la actividad natatoria ante la presencia de las presas, asentándose luego sobre el sustrato. Durante la primera fase perciben el movimiento de las larvas posiblemente por medio de mecanorreceptores. Esto ya se ha visto en algunas especies de decápodos que detectan las vibraciones para ubicar a sus presas (Popper et al. 2001). Posteriormente habría aceptación por quimiorreceptores (Hindley 1975). El reconocimiento visual no se consideraría importante y eficiente debido a que el hábitat natural de P. argentinus no es favorable a este sentido por el alto contenido de material en suspensión existente.
El tiempo de búsqueda de presas, a pesar de no presentar diferencias estadísticamente significativas, indicó que los camarones pequeños encontraban las larvas de mosquito más rápidamente y de manera más activa. El alto desvío de los valores de TB podría deberse al momento en el ciclo de muda en que se encontraban los camarones pertenecientes a esta clase etaria. Esto hace referencia a que algunos ejemplares podrían encontrarse en premuda, momento de disminución y cesación de los procesos tróficos. En los acuarios donde se encontraban camarones de distintas tallas, el tiempo de búsqueda fue intermedio entre los pequeños y grandes, no evidenciando efectos de interferencia competitiva entre las tallas o de comportamiento agonístico, coincidiendo con lo mencionado para este camarón (Williner & Collins 2000). Las diferencias encontradas en el tiempo de búsqueda en los distintos grupos de talla se deberían al tamaño corporal y a los hábitos más pelágicos de los camarones pequeños justificando el cambio ontogenético de la alimentación en esta especie (Collins 1999) y de la velocidad de captura a pesar de que todos los ejemplares sean considerados adultos. Los hábitos depredadores de la mayoría de los palaemónidos están relacionados a los cambios de tamaño corporal (Inyang 1978; Guerao 1994; 1995; Guerao & Ribera 1996) observándolo también en P. argentinus (Collins 1999). Por otra parte Sedgwick (1979) observó en juveniles del camarón peneido Penaeus merguiensis una utilización más eficiente del alimento que los individuos de mayor tamaño, aspecto que también se aprecia en el camarón P. argentinus.
La eficacia en la captura de larvas de C. pipiens s.l. por los camarones posiblemente se deba a dos aspectos, la mayor capacidad natatoria de los camarones pequeños y a una mayor selección de los ejemplares grandes sobre las presas, buscando aquellas que representen un menor gasto energético para el camarón, no alimentándose de las presas más activas o de difícil captura.
El tiempo de manipuleo fue prácticamente imperceptible. Esta etapa de la depredación dependería principalmente del tipo de presa que consume P. argentinus, considerándose el tamaño, la presencia de estructuras duras o de protección y la capacidad de movimiento de las presas, como se ha observado en otros decápodos (Juanes 1992) siendo un factor determinante en la manipulación. Las larvas de C. pipiens s.l. son activas nadadoras ante un ataque, de manera que los camarones fueron más efectivos al consumirlas sujetándolas por la región cefálica. De esta manera se presume que ejercerían un mejor control provocando la muerte de la larva más rápidamente.
Los camarones pequeños tuvieron un tiempo de ingestión mas prolongado quizás por el aumento en la relación de tamaño entre la presa y el depredador. Estas diferencias debidas al tamaño, se producirán por la mayor capacidad de manipulación en los ejemplares grandes.
Por último cabe considerar que se propone la realización de trabajos con otros tipos de presas a fin de contrastar y analizar resultados y de esta manera poder definir la eficiencia de captura en el proceso de depredación de los crustáceos en general y en particular de P. argentinus.
Agradecimientos
A María Carla Giri por la facilitación del equipo de grabación y a Verónica Williner por la ayuda prestada durante las experiencias.
Referencias
ANGRISANO, E. B. Y E. R. TRÉMOUILLES, 1995. Insecta Díptera. En: Ecosistemas de aguas continentales: Metodologías para su estudio. Tomo III. Ed. Lopretto, E.C. y Tell, G. Ediciones Sur. 1243-1265 pp. [ Links ]
BOSCHI, E. E., 1981. Decapoda: Natantia. Serie Fauna de Agua Dulce de la República Argentina. Vol. XXVI., 61 pp. [ Links ]
COLLINS, P. A., 1999. Feeding of Palaemonetes argentinus (Nobili) (Decapoda: Palaemonidae) in flood valley of river Parana, Argentina. Journal of Crustacean Biology 19(3): 485-492. [ Links ]
FLEEGER, J. W., K. R. CARMAN, S. WEBB, N. HILBUN Y M. C. PACE, 1999. Consumption of microalgae by the grass shrimp Palaemonetes pugio. Journal of Crustacean Biology 19(2):324-336. [ Links ]
FLOORE, T., 2000. Mosquito information. American Mosquito Control Association. En http://www.mosquito.org/ [ Links ]
GIBSON, R. N., M. C. YIN Y L. ROBB, 1995. The behavioral basis of predator-prey size relationships between shrimp (Crangon crangon) and juvenile plaice (Pleuronectes platessa). Journal of the Marine Biological Association of the United Kingdom 75:337-349. [ Links ]
GIRI, F., 2001. Evaluación de Palaemonetes argentinus (Decapoda: Natantia) como controlador biológico de larvas de mosquito (Diptera: Culicidae). Facultad de Humanidades y Ciencias, Universidad Nacional del Litoral. Tesis de Licenciatura en Biodiversidad, 41 pp. [ Links ]
GORDON, M. W. Y L. D. CORKUM, 1994. Predation of zebra mussels by crayfish. Canadian Journal of Zoology 72: 1867-1871. [ Links ]
GUERAO, G., 1994. Feeding habits of the prawns Processa edulis and Palaemon adspersus (Crustacea, Decapoda, Caridea) in the Alfacts Bay, Ebro delta (NW Mediterranean). Miscellania Zoologica 17: 115-122. [ Links ]
GUERAO, G., 1995. Locomotor activity patterns and feeding habits in the prawn Palaemon xiphias (Crustacea: Decapoda: Palaemonidae) in Alfacts Bay, Elbro delta (Northwest Mediterranean). Marine Biology 122:115-119. [ Links ]
GUERAO, G. Y C. RIBERA. 1996. Locomotor activity patterns and feeding habits in the prawn Palaemon serratus (Pennant, 1777) (Decapoda, Palaemonidae) in the Alfacts Bay, Elbro delta, Spain. Crustaceana 69(1):101-112. [ Links ]
HINDLEY, J. P. R. 1975. The detection, location and recognition of food by juvenile banana prawns, Penaeus marguiensis. Marine Behavioural Physiology 3:193-210. [ Links ]
HSUEH, P. W., J. B. MCCLINTOCK Y T. S. HOPKINS. 1992. Comparative study of the diets of the blue crabs Callinectes similis and C. sapidus from a mud-bottom habitat in mobile bay, Alabama. Journal of Crustacean Biology 12(4):615-619. [ Links ]
INYANG, N. M. 1978. Notes on the food of the Baltic Palaemonid shrimp Palaemon adspersus var. fabricii (Rathke). Meeresforschungesellschaft 26 (1-2): 42-46. [ Links ]
JUANES, F. 1992. Why do decapod crustaceans prefer small-sized molluscan prey. Marine Ecology Progress Series. 87: 239-249. [ Links ]
L'ABEE-LUND, J. H., P. AASS Y H. SAEGROV. 1996. Prey orientation in piscivorous brown trout. Journal of Fish Biology 48: 871-877. [ Links ]
MACISAAC, H. J. 1994. Size-selective predation on zebra mussels (Dreissena polymorpha) by crayfish (Orconectes propinquus). Journal of the North American Benthological Society 13 (2):206-216. [ Links ]
PAVEY, C. R. Y D. R. FIELDER. 1996. The influence of size differential on agonistic behaviour in the freshwater crayfish, Cherax cuspidatus (Decapoda: Parastacidae). Journal of Zoology 238: 445-457. [ Links ]
PIANKA, E. R. 1982. Ecología evolutiva. Ed. Omega, S. A., Barcelona, 365 pp. [ Links ]
POPPER, A. N., M. SALOMON Y H. W. KENNETH. 2001. Acoustic detection and communication by decapod crustaceans. Journal of Comparative Physiology 178(2):83-89. [ Links ]
POSEY, M. H. Y H. H. ANSON. 1991. Complex predator-prey interactions within an estuarine benthic community. Ecology 72(6):2155-2169. [ Links ]
RAY-CULP, M., M. DAVIS Y A. W. STONER. 1999. Predation by xanthid crab post-settlement gastropods: the role of prey size, prey density, and habitat complexity. Journal of Experimental Marine Biology and Ecology 240(2):303-321. [ Links ]
RIVIÈRE, F. 1985. Effects of two predators on community composition and biological control of Aedes aegypti and Aedes polynesiensis. Ecology of mosquitoes: proceedings of a workshop. In L. P. Lounibos, J. R. Rey & J. H. Frank (Eds.). Florida Medical Entomology Laboratory, Vero Beach, Fla. pp. 121-135. [ Links ]
SEDGWICK, R. W. 1979. Effect of ration size and feeding frequency on the growth and food conversion of juvenile Panaeus merguiensis. Aquaculture 16:279-298. [ Links ]
WILLINER, V. Y P. COLLINS. 2000. ¿Existe jerarquización en las poblaciones de Palaemónidos del valle aluvial del Río Paraná?. Natura Neotropicalis 31(1 & 2): 53-60. [ Links ]
ZAR, J. H. 1996. Bioestatistical Analysis. Prentice Hall, New York, 662 pp. [ Links ]














