Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.13 no.3 Ciudad de México oct. 2003
Artículo
Efecto de la temperatura y tipo de alimento en el cultivo de Moina micrura (Kurz, 1874) (Anomopoda: Moinidae) en condiciones de laboratorio
Effect of temperature and type of food on the growth of Moina micrura (Kurz, 1874) (Anomopoda: Moinidae), in laboratory conditions.
Jesús Rodríguez-Estrada, Rafael Villaseñor-Córdova y Fernando Martínez-Jerónimo
Laboratorio de Hidrobiología Experimental, Escuela Nacional de Ciencias Biológicas, I. P. N., Apdo. Postal: CON-252, México D. F. 06401. MÉXICO. E-mail: fjeroni@ipn.mx
Recibido: 30 de julio de 2002.
Aceptado: 5 de julio de 2003.
Resumen
Moina micrura fue cultivada a 20 y 25ºC, empleando como alimento las microalgas clorofíceas Ankistrodesmus falcatus y Scenedesmus incrassatulus, en concentración de 300,000 cél ml-1, evaluándose los efectos sobre la sobrevivencia y la reproducción a lo largo de su ciclo vital. De los parámetros evaluados, la temperatura fue el único factor que produjo diferencias estadísticamente significativas y únicamente el valor promedio de neonatos por camada fue afectado significativamente por el tipo de alimento (P<0.05). En general se observó que los organismos desarrollados a 25ºC tuvieron una sobrevivencia menor, aunque la progenie total por hembra fue mayor. El tiempo de la primera reproducción osciló entre 3.6 y 6.6 días, siendo menor a 25ºC. La longevidad promedio fue mayor en los organismos alimentados con A. falcatus a 20°C (14.90 días). El promedio del tiempo entre camadas fluctuó de 33.3 a 42.2 horas, registrándose el menor valor a 25°C. La progenie total promedio por hembra osciló en todos los tratamientos entre 57.9 (25°C) y 41.1 (20°C), para los organismos alimentados con A. falcatus. El mejor desarrollo de M. micrura se obtuvo en los cultivos a 25°C, empleando como alimento a Ankistrodesmus falcatus. De acuerdo a las respuestas reproductivas evaluadas, se confirma el uso potencial de esta especie para el cultivo masivo, así como para la obtención de organismos de prueba para bioensayos.
Palabras Clave: Cladocera, zooplancton, Moina micrura, Ankistrodesmus falcatus, Scenedesmus incrassatulus.
Abstract
Moina micrura was grown at 20 and 25°C, fed with the green microalgae Ankistrodesmus falcatus and Scenedesmus incrassatulus, at a food concentration of 300,000 cell ml-1. Survival, longevity and reproduction during a full life-cycle test were registered. Temperature was the only factor that produced significant effects in all the assessed responses. Food type produced significant differences in the average clutch size. Organisms grown at 25°C had the lowest survival and the largest total progeny per female. Time to first reproduction ranged from 3.6 to 6.6 days, with the lowest values at 25°C. The highest average longevity was observed for organisms fed with A. falcatus at 20°C (14.49 days). Average inter-clutch time ranged from 33.3 to 42.2 h, with the lowest value recorded at 25°C. The mean total progeny per female ranged from 41.1 to 57.9, for the organisms grown at 20 and 25°C respectively, and both fed with A. falcatus. The best results, regarding reproductive responses and longevity, were obtained for M. micrura fed with A. falcatus at 25°C. This cladoceran has a great potential for mass culture, and also may be used as a test organism in bioassays.
Key words: Cladocera, zooplankton, Moina micrura, Ankistrodesmus falcatus, Scenedesmus incrassatulus.
Introducción
Los cladóceros son microcrustáceos de ciclo de vida corto, cuya duración puede fluctuar dependiendo de la temperatura entre los 13 a 15 días en Moina micrura Kurz, 1874 (Murugan, 1975), a más de 60 días en Daphnia magna Straus (Martínez-Jerónimo et al., 1994). Forman parte del zooplancton dulceacuícola, jugando un papel muy importante como alimento para un gran número de organismos, como larvas de peces y crustáceos y también influyen sobre el crecimiento de las poblaciones de protozoarios heterótrofos flagelados, bacterias, así como en el desarrollo poblacional de microalgas clorofíceas como Ankistrodesmus falcatus, Chlorella vulgaris y Chlamydomonas sp., interactuando incluso con algunos rotíferos como Polyarthra y Keratella (Pace & Vaqué, 1994; Arnold, 1971).
Los cladóceros (actualmente Ctenopoda y Anomopoda) habitan en charcas temporales, ríos, lagos o estanques. Son organismos que se reproducen asexualmente por partenogénesis, en condiciones favorables y generalmente de manera sexual cuando las condiciones ambientales son inadecuadas (temperatura baja, fotoperiodo corto, falta de alimento, sobrepoblación, acumulación de metabolitos, etc.) (Gilbert, 1983). Los embriones producidos por partenogénesis tienen desarrollo directo (el desarrollo del huevo transcurre en la cámara incubatriz, sin fases larvarias), y de la madre emergen los juveniles, que no presentan diferencias morfológicas con el adulto, de no ser por la talla.
Estos organismos son filtradores no selectivos que pueden consumir materia orgánica, aunque es importante el tamaño de la partícula ingerida para su disponibilidad y asimilación (Arnold, 1971; Egloff & Palmer, 1971). M. micrura es un cladócero cosmopolita que habita en lagos de regiones tropicales y subtropicales (Murugan, 1975; Bonou & Saint-Jean, 1998), aunque principalmente ocurre en charcas temporales de regiones áridas y semiáridas del mundo (Goulden, 1968); de igual forma se puede distribuir en ambientes estuarinos, ya que tolera valores de salinidad de 3 a 4 g l-1 (Saint-Jean & Bonou, 1994).
Moina micrura y otros cladóceros han sido utilizados a escala comercial y experimental como alimento vivo en el cultivo de larvas de peces tropicales y postlarvas del langostino malayo Macrobrachium rosenbergii (Alam et al., 1993; Jana & Chakrabarti, 1993), aunque generalmente obtenidos a partir de colectas, o producidos masivamente en sistemas semi-controlados mediante procedimientos que no siempre garantizan su adecuada disponibilidad en cantidad ni en tiempo (Bonou & Saint-Jean, 1998).
Los estudios existentes sobre la biología de Moina en condiciones de laboratorio son escasos (Benider et al., 2002), por lo que es importante determinar algunas de sus características poblacionales y de historia de vida, a fin de desarrollar metodologías de propagación controlada y masiva, que permitan utilizar de manera más confiable a este recurso como fuente de alimento vivo, en estudios de hidrobiología experimental y como organismo de prueba en toxicología acuática.
Materiales y métodos
Para el presente trabajo se utilizó una cepa de Moina micrura procedente del cepario de Cladóceros del Laboratorio de Hidrobiología Experimental, Escuela Nacional de Ciencias Biológicas, I. P. N., que fue aislada a partir de colectas realizadas en lago artificial de la segunda sección del Bosque de Chapultepec, en la Ciudad de México.
Para su propagación experimental se aplicaron cuatro tratamientos que surgieron de la combinación de dos temperaturas (20 y 25ºC) y dos alimentos, consistentes en las especies de microalgas clorofíceas Ankistrodesmus falcatus y Scenedesmus incrassatulus (Cepario del Laboratorio de Hidrobiología Experimental, E. N. C. B.- I. P. N.), las cuales fueron suministradas en concentración de 300,000 cél ml-1; en lo sucesivo cada tratamiento será denominado por la letra inicial del alimento utilizado, seguido del valor de la temperatura aplicada (A20, A25, S20 y S25).
El alimento se obtuvo de un cultivo aséptico por lotes en medio Bold Basal (Stein, 1973), cosechado justo en la fase de crecimiento exponencial. La cantidad de alimento suministrada era determinada mediante lecturas en cámara de Neubauer y el remanente mantenido en refrigeración por un periodo máximo de una semana, al término de la cuál se desechaba para utilizarse un nuevo cultivo.
Para los ensayos se emplearon neonatos de hembras partenogenéticas (menores de 24 horas de edad) obtenidos en la segunda camada de reproductores de edad conocida. Cada una de las 15 réplicas para cada experimento, consistió de un individuo colocado aisladamente en un vaso de precipitado de 50 ml con volumen de prueba de 30 ml. Como medio de cultivo se utilizó agua semidura reconstituida, preparada con agua destilada y de acuerdo a la formulación de Weber (1991). Diariamente y hasta la muerte de todos los individuos de prueba, se registró y separó la progenie liberada por cada hembra, llevándose simultáneamente un registro de la sobrevivencia de los reproductores. El medio de cultivo y el alimento eran renovados totalmente cada 48 hrs. La temperatura era controlada con un termostato en una cámara húmeda. Las pruebas se realizaron con iluminación de lámparas fluorescentes "luz de día", a una intensidad de 3000 luxes y fotoperiodo controlado de 16:8 (luz:oscuridad).
Con la información registrada se calcularon los siguientes parámetros poblacionales: longevidad, sobrevivencia, número de camadas por hembra y tiempo entre camadas. Mediante un análisis de Tabla de Vida (Krebs,1985), se determinaron la tasa reproductiva neta de crecimiento poblacional (Ro, de acuerdo a la ecuación de Euler, cit. en Amarasinghe et al., 1997), la tasa intrínseca de incremento poblacional (r) y el tiempo generacional (G):
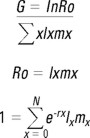
Los datos obtenidos fueron comparados mediante un Análisis de Varianza Bifactorial (ANOVA), a fin de determinar efectos estadísticamente significativos para los factores evaluados (temperatura y alimento).
Resultados
La figura 1 muestra las curvas de sobrevivencia obtenidas en los cuatro experimentos realizados; en ésta gráfica se puede observar que no ocurrió mortalidad en ninguno de los tratamientos durante los primeros 6 días. La menor longevidad se registró para los individuos en el tratamiento S25 (12 días), en tanto que el mayor valor de longevidad fue para S20 (18 días, ver Fig. 1). El promedio de los valores para la longevidad y los correspondientes intervalos de confianza se presentan en la tabla 1.

La temperatura tuvo un efecto altamente significativo sobre la longevidad (P<0.001), aunque ninguna de las dos especies de algas empleadas como alimento produjo diferencias significativas; el ANOVA bifactorial aplicado también demostró que no hubo interacción significativa entre temperatura y alimento (P=0.169).
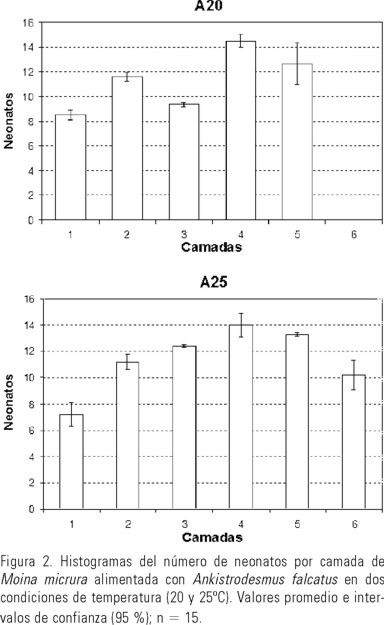
La figura 2 muestra el número promedio de neonatos producidos en camadas consecutivas de M. micrura alimentada con A. falcatus. La figura 3 representa lo mismo para los organismos que consumieron S. incrassatulus; en ambos casos se observa que las primeras y últimas camadas fueron comparativamente menores (con excepción de S25), y que en la cuarta camada se alcanza la mayor fecundidad en todos los tratamientos. El ANOVA bifactorial aplicado a estos datos permitió determinar que sólo el alimento suministrado tuvo un efecto significativo, no habiendo interacción entre este factor y la temperatura (P>0.05). Adicionalmente se observó que en los ensayos a 25ºC se produce una camada más que en los experimentos realizados a 20ºC, independientemente del alga usada como alimento.

La temperatura tuvo un efecto altamente significativo sobre la progenie total acumulada que produce una hembra durante todo su ciclo vital (P<0.001), con el mayor registro en A25 (57.9 crías en promedio), en tanto que el menor se obtuvo en A20 (promedio de 41.1 neonatos). La interacción entre la temperatura y el alimento no fue estadísticamente significativa (P=0.11). Los valores promedio y los intervalos de confianza se muestran en la tabla 1.
Con respecto al número de camadas, el análisis de varianza bifactorial demostró que la temperatura produce un efecto significativo sobre este parámetro (P< 0.001).
La edad de primera reproducción fue menor en los tratamientos realizados a 25ºC; los valores oscilaron entre 3.6 (S25) y 6.6 días (A20).
El promedio del tiempo entre camadas se incluye en la tabla 1, el cual fluctuó entre 26.22 y 43.61 horas; los resultados del ANOVA bifactorial revelaron efectos altamente significativos debidos a la temperatura (P<0.001).
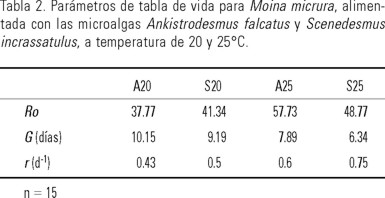
En la tabla 2 se resumen los resultados de Ro, G y r obtenidos del análisis de Tabla de Vida, en la que se observa que la mayor cantidad de progenie promedio producida por hembra promedio durante toda su vida (Ro) se obtuvo en el tratamiento A25.
En la figura 4 se presenta el número acumulado de neonatos producidos por hembra en reproducciones consecutivas durante su ciclo vital, observándose que a 25ºC se registra el mayor número de neonatos.

A manera de sinopsis biológica de esta especie, la Tabla 1 presenta un resumen de los principales respuestas reproductivas registradas en todos los ensayos aplicados, con los correspondientes intervalos de confianza, así como los valores mínimo y máximo registrados.
Discusión
Aún cuando los alimentos fueron suministrados con base en la misma cantidad en número de células por mililitro, dadas las diferencias en forma y dimensiones que presentan ambas algas, era de esperarse que hubieran diferencias en las cantidades aplicadas, en términos de biomasa. Sin embargo, estas probables diferencias no se manifestaron en efectos distintos en los tratamientos aplicados, puesto que el alimento sólo produjo respuestas estadísticamente significativas en el número de neonatos por camada. Esta situación puede explicarse en términos de que las cantidades disponibles de alimento estuvieran, en ambos casos, por encima de las concentraciones umbrales y de las cantidades críticas; además, dado que la permanencia en suspensión de ambas especies es bastante elevada, sólo una pequeña fracción se sedimentaría con el paso del tiempo, situación que además se minimizó mediante la agitación manual que periódicamente se aplicó a los recipientes de prueba. Ovie y Egborge (2002) suministraron a M. micrura concentraciones superiores a 500,000 cél. ml-1 de Scenedesmus acuminatus y observaron que había una inhibición del crecimiento a densidades celulares superiores a 1.5 X106. No obstante, nuestros resultados no pueden compararse con los obtenidos por Ovie y Egborge (2002), pues ellos desarrollaron un cultivo masivo en el que evaluaron respuestas distintas a las aquí presentadas. Lo observado en el presente estudio permite concluir que fue mas importante el efecto de la temperatura que la especie de microalga empleada, al parecer porque dicho factor afecta el desarrollo y metabolismo de los individuos, lo que concuerda con lo reportado por Gilbert, (1983), Hardy y Duncan, (1994) y Amarasinghe et al. (1997), y refuerza el carácter de filtrador no selectivo que generalmente se reconoce para los cladóceros.
La longevidad de M. micrura fue una de las respuestas que más se afectó negativamente por la temperatura. Murugan (1975) registró a 28ºC una longevidad de hasta 13 días para M. micrura alimentada con seuston. Por otro lado, Jana y Pal (1985) registraron una longevidad de 19 días para M. micrura alimentada con residuos de la extracción de aceite de semillas de Madhuca indica (Sapotaceae), y 9 días cuando se alimentó con cascarilla de arroz, en ambos casos a temperatura ambiental de 29 a 32ºC. Los valores obtenidos en el presente estudio permiten concluir que M. micrura fue mas longeva a 20ºC, y aunque a mayor temperatura la longevidad promedio fue significativamente menor con la dieta de S. incrassatulus, éste valor fue semejante a los registrados por otros autores.
Para M. macrocopa se han registrado hasta 27 organismos por camada y una progenie total de 159 neonatos, alimentando a este organismo con diferentes microalgas cloroficeas a 26ºC (Martínez-Jerónimo & Gutiérrez-Valdivia, 1991). Los resultados aquí obtenidos muestran una menor progenie total y promedio por camada para M. micrura, lo que indica seguramente una distinta cualidad genética de ambas especies.
Los valores de tasa intrínseca de crecimiento poblacional (r) registrados en el presente trabajo oscilaron entre 0.75 (S25) y 0.43 d-1 (A20), que son en general superiores a los encontrados para M. micrura por Amarasinghe et al. (1997) de 0.57 d-1 a 27ºC, y de 0.35 d-1 a 22.5ºC. Jana y Pal (1985), reportaron para esta misma especie valores de r de 0.24 a 0.31 d-1 a temperatura ambiental de 29 a 32ºC, que asimismo son menores a los determinados en el presente estudio.
De los experimentos aquí realizados se concluye que los dos tipos de microalgas suministradas como alimento de M. micrura, tuvieron una buena aceptación y aprovechamiento, registrándose la mejor respuesta reproductiva con Ankistrodesmus falcatus a una temperatura de 25°C.
De acuerdo a los parámetros reproductivos determinados y considerando la longevidad y sobrevivencia de esta especie, se puede también concluir que Moina micrura es una especie con potencial para ser producida en cultivos masivos como alimento para acuacultura. En este sentido también debe considerarse que esta especie es de menor tamaño que otros cladóceros comúnmente utilizados con tal propósito, por lo que sería útil para consumidores de talla pequeña (larvas y juveniles de peces y crustáceos), además de que su tolerancia a la salinidad amplía su intervalo de consumo hacia especies de aguas salobres.
Un detalle adicional es que debido a sus características reproductivas y de ciclo de vida, así como su facilidad de manejo y resistencia a la manipulación, M. micrura podría ser utilizada en estudios de hidrobiología experimental y como organismo de prueba en ensayos toxicológicos.
Agradecimientos
A la Coordinación General de Posgrado e Investigación (CGPI) del Instituto Politécnico Nacional, que aportó recursos económicos para la realización de este trabajo. También a la COFAA-IPN y al sistema EDI-IPN. Agradecemos por último a los revisores anónimos que con sus acertadas sugerencias contribuyeron de manera efectiva al mejoramiento del manuscrito.
Referencias
ALAM, M. J., K. J. ANG & S. H. CHEAN. 1993. Use of Moina micrura (Kurz) as an Artemia substitute in the reproduction of Macrobrachium rosenbergii (de Man) post-larvae. Aquaculture 109: 337-349. [ Links ]
AMARASINGHE, B. P., M. BOERSMA & J. VIJVERBERG. 1997. The effect of temperature, and food quantity and quality on the growth and development rates in laboratory-cultured copepods and cladocerans from a Sri Lankan reservoir. Hydrobiologia 350: 131-144. [ Links ]
ARNOLD, D. E. 1971. Ingestion, assimilation, survival and reproduction by Daphnia pulex fed seven species of blue-green algae. Limnology & Oceanography 16: 906-920. [ Links ]
BENIDER, A., A. TIFNOUTI & R. POURRIOT. 2002. Growth of Moina macro-copa (Straus 1820) (Crustacea, Cladocera): influence of trophic conditions, population density and temperature. Hydrobiologia 468: 1-11. [ Links ]
BONOU, C. A. & L. SAINT-JEAN. 1998. The regulation mechanisms and yield of brackish water populations of Moina micrura reared in tanks. Aquaculture 160: 69-79 [ Links ]
EGLOFF, A. D. & S. D. PALMER. 1971. Size relations of the filtering area of two Daphnia species. Limnology & Oceanography 16: 901-905. [ Links ]
GILBERT, J. J. 1983. Sexual dimorphism in zooplankton (Copepoda, Cladocera, and Rotifera). Annual Review of Ecology and Systematics 14: 1-33. [ Links ]
GOULDEN, C. E. 1968. The systematics and evolution of the Moinidae. Transactions of the American Philosophical Society 58: 1-101. [ Links ]
HARDY, R. E. & A. DUNCAN. 1994. Food concentration and temperature effects on life cycle characteristics of tropical cladocera (Daphnia gesseneri Herbst, Diaphanosoma sarsi Richards, Moina reticulata Daday) development time. Acta Amazonica 24: 119-134. [ Links ]
JANA, B. B. & G. P. PAL. 1985. The life history parameters of Moina micrura (Kurz) grown in different culturing media. Water Research 19: 863-867. [ Links ]
JANA, B. B. & R. CHAKRABARTI. 1993. The effect of protocols for juvenile carp (Cyprinus carpio) culture on life history responses of a zooplankton food source, Moina micrura (Kurz). Aquaculture 110: 285-300. [ Links ]
KREBS, C. J. 1985. Ecology. The experimental analysis of distribution and abundance. Harper & Row, Publishers, New York. pp: 174-206. [ Links ]
MARTÍNEZ-JERÓNIMO, F. & A. GUTIERREZ-VALDIVIA. 1991. Fecundity, reproduction, and growth of Moina macrocopa fed different algae. Hydrobiologia 222: 49-55. [ Links ]
MARTÍNEZ-JERÓNIMO F., R. VILLASEÑOR, G. RIOS & F. ESPINOSA. 1994. Effect of food type and concentration on the survival, longevity, and reproduction of Daphnia magna. Hydrobiologia 287: 207-214. [ Links ]
MURUGAN, N. 1975. Egg production, development and growth in Moina micrura Kurz (1874) (Cladocera: Moinidae). Freshwater Biology 5: 245-250. [ Links ]
OVIE, S. I. & A. B. M. Egborge. 2002. The effect of different algal densities of Scenedesmus acuminatus on the population growth of Moina micrura Kurz (Crustacea: Anomopoda, Moinidae). Hydrobiologia 477: 41-45. [ Links ]
PACE, L. M. & D. VAQUÉ. 1994. The importance in determining mortality rates of protozoans and rotifers in lakes. Limnology & Oceanography 35: 985-996. [ Links ]
SAINT-JEAN, L. & C. A. BONOU. 1994. Growth, production, and demography of Moina micrura fishponds (Layo, Ivory Coast). Hydrobiologia 272: 125-146 [ Links ]
STEIN, J. R. 1973. Handbook of phycological methods. Culture methods and growth measurements. Cambridge University Press, London. pp: 7-24. [ Links ]
WEBER, C. I. 1991. Methods for measuring the acute toxicity of effluents and receiving water to freshwater and marine organisms. EPA/600/4-90/027. Cincinnati, Ohio USA. 197 pp. [ Links ]














