Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.13 no.3 Ciudad de México oct. 2003
Artículo
Variaciones de la comunidad de copépodos plánticos en el gradiente estuarino-costero de Celestún, Yucatán, México
Variations of the planktonic copepod community in the estuarine-coastal gradient of Celestun, Yucatan, Mexico
Uriel Ordóñez-López y Margarita Ornelas-Roa
CINVESTAV-IPN, U. Mérida. Lab. Plancton. Km 6, antigua carretera a Progreso, A. P. 73 "Cordemex", C.P. 97310, Mérida Yuc. C.E.: uriel@mda.cinvestav.mx
Recibido: 30 de julio de 2002.
Aceptado: 30 de septiembre de 2003.
Resumen
Se efectuaron recolectas mensuales (julio de 1994 a junio de 1995) de zooplancton para determinar las variaciones de la abundancia de los copépodos pláncticos a través del gradiente estuarino-costero en Celestún, Yucatán. Se identificaron 17 especies de copépodos con Acartia tonsa (51.8 %), A. lilljeborgii (12.2 %) y Pseudodiaptomus cokeri (30.8 %) como las especies más abundantes, mientras que Labidocera fue el género más diverso. La variación en la abundancia de las especies se relacionó principalmente con los gradientes de temperatura, salinidad y biomasa zooplánctica . La mayor riqueza de especies se encontró en la boca del estero lo cual se debió a un mayor intercambio y mezcla de las faunas estuarina y marina. Las principales características de la comunidad de copépodos son similares a las encontradas en otras lagunas costeras de la región.
Palabras clave: Distribución, copépodos, estuario Celestún, Yucatán, México.
Abstract
Zooplankton samples were collected monthly (from July 1994 to June 1995) to determine variations in abundance of planktonic copepods along the estuarine-coastal gradient in Celestun, Yucatan, México. From 17 copepod species, Acartia tonsa (51.8 %), A. lilljeborgii (12.2 %) and Pseudodiaptomus cokeri (30.8 %) were the most abundant species. Labidocera was the most diverse genus. Variation in species abundance was related mainly with gradients in salinity, temperature and biomass. The highest species richness was recorded in the mouth of the estuary due to a bigger exchange and mixture between the estuarine and marine fauna. The main features of the copepod community at Celestun are similar to those found in other regional coastal lagoons.
Key words: Distribution, copepods, Celestun estuary, Yucatan, Mexico.
Introducción
Los copépodos son el grupo más numeroso del zooplancton en los sistemas costeros tropicales representando del 50 al 95% de la biomasa (Gómez-Aguirre, 1987; Suárez-Morales, 1994a). Algunas especies típicamente costeras o estuarinas como las de los géneros de Acartia y Labidocera llegan a conformar grandes concentraciones de individuos (Omori & Hamner, 1982). No obstante la relevancia de estos microcrustáceos pláncticos en la dinámica del zooplancton en estas zonas, los estudios en las aguas costeras y estuarios de la Península de Yucatán son escasos. Los trabajos a la fecha realizados señalan la alta riqueza de especies existente y la necesidad de elaborar listados y claves de identificación de copépodos para la región (Álvarez-Cadena et al., 1998; Escamilla-Sánchez & Suárez-Morales, 1999; Suárez-Morales, 1995 y 1996). Así también es importante que se genere la información relativa a la afinidad ecológica y biogeográfica de las especies del área. El presente trabajo relaciona las características del medio hidrológico (salinidad, temperatura y pH) con la riqueza y abundancia de especies de los copépodos y su variación en tiempo y espacio en el estero de Celestún, durante un ciclo anual.
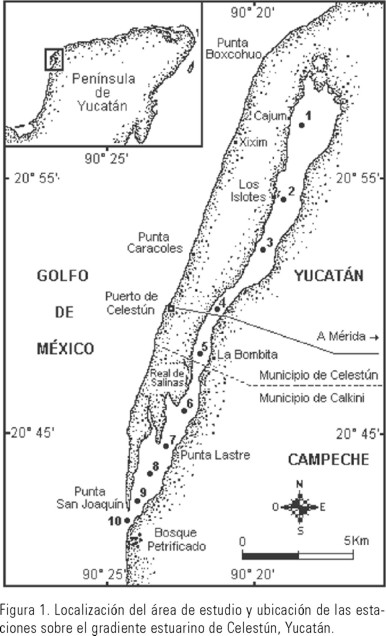
El sistema costero de Celestún, localizado al noroeste de la Península de Yucatán (Fig. 1), presenta un clima del tipo cálido semi-seco de marzo a junio, intensas lluvias de julio a octubre y fuertes vientos del norte y lluvias de menor intensidad el resto del año. Celestún se caracteriza por presentar un gradiente salino y de temperatura originado por los aportes de agua dulce provenientes del manto freático (manantiales) y su mezcla con aguas marinas. El sistema, en cuyas partes someras existen praderas de macrófitas sumergidas, posee una barra arenosa de 22.4 Km que corre paralela a lo largo de la laguna.
Materiales y métodos
El zooplancton se recolectó mensualmente durante un ciclo anual (julio 1994 / junio 1995) en 10 estaciones distribuidas a lo largo del gradiente estuarino (Fig.1). Los arrastres se efectuaron cerca de la superficie con una red cónica de 30 cm de diámetro (con medidor de flujo para estimaciones de volumen filtrado, malla de 333 µm), con una duración de cinco minutos en la fase de luna nueva y marea alta. Las muestras fueron fijadas en una solución de formol con agua de mar al 4%, neutralizada con borato de sodio. Los parámetros hidrológicos como temperatura, salinidad y oxígeno disuelto fueron medidos in situ con un multisensor de campo YSI 85/50FT (±0.1); para el análisis de las clorofilas se tomaron muestras de agua y llevadas al laboratorio; éstas fueron determinadas por el método espectrofotométrico descrito por Parsons et al. (1984).
La biomasa zooplánctica se determinó por peso húmedo (mg/m3) y la abundancia de los copépodos se calculó con base en el promedio de tres alícuotas de 1 ml de cada muestra, obtenidas con una pipeta de Stempel. La densidad se estandarizó a organismos por m3. La identificación de las especies se efectuó con las claves de Campos y Suárez-Morales (1994), Suárez-Morales (1996) y Suárez-Morales et al. (1996). A los datos de salinidad y temperatura se les aplicó una técnica de clasificación aglomerativa a fin de identificar grupos de estaciones y/o meses, y sometidas al análisis de varianza (ANOVA) de una vía (P<0.05, Zar, 1988) para conocer si existen diferencias respecto a una misma variable. Finalmente se efectuó un análisis de correlación a través del coeficiente de Pearson con el fin de conocer las posibles relaciones entre la abundancia de las especies y los principales parámetros registrados. Los datos fueron transformados a logaritmo de base diez para su análisis (Zar, 1988).
Resultados
El análisis de agrupación de las estaciones y/o meses basados en los promedios de los principales variables del medio permitió identificar un gradiente hidrológico horizontal (zonas) y temporal (periodos) dentro del sistema. Espacialmente, las zonas fueron: interna (est. 1-4), media (est. 5-7) y externa (est. 8-10), temporalmente fueron: nortes (nov.-feb.) secas (mar.-jun.) y lluvias (jul.-oct.). Cada uno de estos grupos fue significativamente distinto (P<0.05) con respecto a los otros en términos de las variables abióticas y bióticas del medio (Tabla 1). En este sentido la salinidad y la temperatura superficial mostraron un gradiente positivo desde la zona interna hacia la boca, con un promedio anual y desviación estándar de 19.5 ±1.6 ups y 26.1 ±0.7°C respectivamente, mientras que el pH y la transparencia medida en centímetros presentaron sus mayores valores en la zona interna (8.4 y 85.7 respectivamente). Durante el periodo de lluvias se registró la mayor temperatura (28.3°C) y la menor durante los meses con vientos del norte (24.8°C); mientras que en secas se registró la mayor salinidad y pH (25.2 ups y 8.4) y bajos valores en lluvias (15.3 ups y 8.0). La mayor transparencia ocurrió en el periodo de vientos del norte (75.2) y la menor en lluvias (73.1).
La clorofila a, el peso húmedo y la abundancia de los copépodos pláncticos, aumentaron progresivamente de la zona interna hacia la externa; estas dos últimas variables registraron dos momentos de mayor concentración: el primero durante el periodo de secas y el segundo en lluvias, mientras que la clorofila registró su mayor concentración en secas. Los promedios anuales observados de biomasa fueron de 1224.7 ±246 mg/m3, mientras que la abundancia de copépodos fue de 2305 ± 380.7 org/m3 y de 2.81 ± 0.2 mg/L para la clorofila.
Se determinaron 17 especies de copépodos pláncticos y de varios Harpacticoida no identificados asociados con el meiobentos (Tabla 2). La mayor riqueza de copépodos se presentó hacia la zona media de la laguna durante el periodo de lluvias. Las especies más abundantes en orden decreciente fueron: Acartia tonsa Dana (51.8%), Pseudodiaptomus cokeri González et Bowman (30.8 %), Acartia lilljeborgii Giesbrecht (12.2%) y Calanopia americana Dahl (1.8%) representando en conjunto más del 96% de la fauna copepodológica. A. tonsa, P. cokeri, C. americana, Labidocera aestiva Wheeler, Labidocera scotti Giesbrecht y Temora turbinata Dana registraron sus mayores abundancias en las aguas más profundas del estuario con una salinidad y temperatura promedio de 29.1 ups y 26.7°C respectivamente. A su vez A. lilljeborgii presentó su mayor concentración en aguas de mayor turbidez (62.4 cm) con una salinidad de 19.6 ups y temperatura de 26.6°C; características de la zona media. Por su parte Subeucalanus crassus Giesbrecht, Pontella mimocerami Fleminger, Labidocera mirabilis Fleminger y Temora stylifera Dana se registraron preferentemente en la zona externa del estuario y Subeucalanus mucronatus Giesbrecht, Labidocera wilsoni Fleminger et Engchow, Thermocyclops inversus Kiefer y Macrocyclops albidus Jurine en la zona media. Asimismo, A. lilljeborgii, P. mimocerami, L. aestiva, L. mirabilis y L. scotti mostraron sus mayores concentraciones durante secas. C. americana, P. cokeri y M. albidus en lluvias y sólo A. tonsa en nortes (Tabla 2). Finalmente las especies dulceacuícolas sólo ocurrieron durante el periodo de lluvias y cerca de un manantial con salinidad de 4 ups. Los Harpacticoida y Tortanus setacaudatus Williams fueron abundantes en aguas someras y de baja salinidad y durante el periodo de secas.
Las especies A. lilljeborgii, A. tonsa, C. americana, P. cokeri, L. aestiva y L. scotti presentaron una correlación altamente significativa (P< 0.01) con la temperatura, salinidad y biomasa zooplánctica. Asimismo, fueron notables las correlaciones negativas de A. lilljeborgii, A. tonsa, L. aestiva y L. scotti con el pH (Tabla 3).
Discusión
Las diferencias hidrológicas observadas en el estero revelan una variación espacial y temporal que según Herrera-Silveira et al. (1999) son el resultado de la asociación entre la intensidad y frecuencia de varios factores como la fuerza y dirección de los vientos, tiempo de residencia del agua, flujos de marea y aportes dulceacuícolas subterráneos (manantiales). La concentración promedio de la biomasa se encontró entre el intervalo reportado por Ordóñez-López, (1998) para Ría Lagartos en donde se observan dos momentos de máxima concentración a principios del periodo de secas y otro al final de lluvias.
La abundancia de los copépodos pláncticos estuvo relacionada con los gradientes de los factores medidos y con los cambios temporales del medio hidrológico; cambios que también han sido señalados en otros sistemas costeros del norte de la península (Ordóñez-López, 1998; Escamilla-Sánchez & Suárez-Morales, 2001). Aún cuando la riqueza de especies puede ser considerada baja en comparación con la fauna copepodológica asociada a sistemas lagunares arrecifales de la península (Alvarez-Cadena et al, 1998), el número de especies registradas es comparable con otras lagunas y bahías de la región (Tabla 4). La mayor riqueza en la zona media y externa del estero sugiere un importante intercambio y mezcla de las faunas estuarina y marina. Al respecto, Suárez-Morales (1994a) reporta que es común que en las lagunas costeras con fuerte influencia marina, la riqueza de zooplancteres sea mayor particularmente en la boca, conformando una comunidad mixta. La dominancia en abundancia de A. lilljeborgii y A. tonsa sobre las demás especies en Celestún, también han sido reportada para un cuerpo de agua cercano al estuario en cuestión (Escamilla-Sánchez & Suárez-Morales, 1999).
La gran cantidad de copépodos con afinidad costera-oceánica en el estero, sugiere que la principal fuente de organismos es la zona costera, sin embargo, las variaciones en sus abundancias están estrechamente relacionadas con los flujos de marea y los cambios estacionales que modifican los gradientes de salinidad, temperatura y biomasa zooplánctica. Estos factores también han sido señalados como responsables en la variación de la abundancia de los copépodos y larvas de peces en otros sistemas costeros de la península (Suárez-Morales, 1994b; Ordóñez-López, 1995, 1998). En este sentido el gradiente horizontal de salinidad se mantiene durante todo el año y podría ser un factor que controle la distribución espacial de las especies más abundantes. Así las mayores concentraciones de A. tonsa, A. lilljeborgii y P. cokeri se presentaron en salinidades mayores de 17 ups (Fig. 2 y 3); lo cual es debido a su condición estuarina-costera (Ríos-Jara, 1998; Suárez-Morales, 1990; Bradford-Grieve et al., 1999). Lo anterior quedó corroborado al obtener altos coeficientes de correlación de las especies con la variable mencionada.
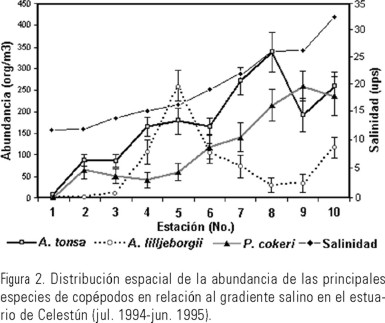
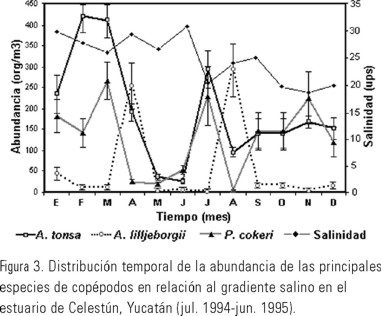
De manera similar, las mayores abundancias de C. americana, L. aestiva, L. scotti, L. mirabilis, T. turbinata, T. stylifera, S.crassus y P. mimocerami en la zona de mayor influencia marina se debe a que son habitantes con afinidad costera-oceánica (Bradford-Grieve et al., 1999; Suárez-Morales, 1990, 1995, 1996). Por otra parte los ciclopoides M. albidus y T. inversus suelen encontrase en ambientes cársticos y tolerar concentraciones de salinidad cercanos a 5 ups (Reid, 1989; Suárez-Morales et al., 1996). Su presencia a la mitad del estero podría deberse a que fueron transportadas desde los cuerpos de agua continental cercanos. Ambas especies han sido reportadas en cenotes próximos a Celestún (Suárez-Morales et al., 1996).
La mayor presencia de T. setacaudatus en el interior del estero es posible se deba a que suele ser residente de aguas costeras de baja salinidad (Reid, 1990), condición que también ha sido registrada en otro cuerpo de agua cercano a Celestún (Escamilla-Sánchez & Suárez-Morales, 1999).
La abundancia de las especies de copépodos también se incremento con la temperatura y la biomasa. Al respecto se han demostrado las relaciones entre la temperatura, la tasa de alimentación y la calidad del alimento natural (dinoflagelados y cloromonádidos) en la producción de huevos. Según Ambler, (1986) y Venccione (1991) A. tonsa produce una mayor descendencia ante una mejor calidad del alimento disponible y durante las máximas temperaturas del medio (27.0°C). En este sentido, las especies dominantes registraron sus máximas abundancias en sitios con una temperatura mayor a 26.7°C, lo cual se reflejó en los altos valores de correlación.
Otro factor importante que influye en la abundancia de los copépodos es la disponibilidad del alimento. En este sentido, las diferencias en las épocas de abundancia de las especies más abundantes evita condiciones de competencia por el alimento. Este parece ser el caso de lo que sucede en Celestún, en donde las mayores concentraciones temporales de A. tonsa (marzo y julio) y A. lilljeborgii (abril a agosto) ocurrieron casi de manera simultanea, pero en diferente zona del estero (Fig. 2 y 3). Al respecto Miller (1983) señaló la alternancia temporal y espacial entre especies de copépodos afines en estuarios de latitudes más altas (p. ej. el copépodo Acartia clausi Giesbrecht frecuentemente sustituye a A. tonsa). De manera semejante Suárez-Morales (1990) ha mencionado que en aguas cálidas costeras es probable que A. lilljeborgii reemplace a A. tonsa, que es muy común y dominante a los largo de las lagunas costeras del norte Golfo de México. Por otro lado la similar temporalidad en la abundancia de P. cokeri (marzo y septiembre) con las dos especies de Acartia, presuponen diferencias en el modo alimentario, mientras A. tonsa y A. lilljeborgii son especies heterotróficas, P. cokeri tiene una tendencia a ser herbívora (Ríos-Jara, 1998). Es de esperarse que la disponibilidad y variedad del alimento permitan sostener una mayor riqueza de especies (Begon et al., 1999), que aunado con el intercambio de faunas que ocurre en la boca del estero explique la elevada riqueza en esta zona.
Un aspecto adicional es la escasa información con relación a la tolerancia de las especies más abundantes a los cambios del pH. No obstante, en este trabajo se observó que las poblaciones de copépodos dominantes presentaron una menor abundancia en aguas con un pH alto (8.4), en contraste con lo que ocurre con las especies dulceacuícolas aquí registradas que suelen estar presentes en ambientes cársticos (Suárez-Morales et al., 1996).
Finalmente, diversos trabajos han discutido largamente la relación de los zooplanctéres y el ambiente estuarino, sin embargo es evidente que la abundancia de las poblaciones cambian (Day et al., 1989; Miller, 1983). En este sentido, el gradiente halino, la temperatura y la biomasa no fueron los únicos factores que determinaron los patrones de distribución de los copépodos pláncticos, es probable que factores biológicos como el flujo de estadios tempranos (naupliares o copepoditos), la competencia y la depredación tengan un papel importante en la variación de la abundancia de los organismos para las poblaciones de copépodos del estero.
Agradecimientos
Los autores nos permitimos agradecer al laboratorio de química del CINVESTAV-Mérida, por los análisis de la clorofila, al Dr. Eduardo Suárez Morales por la identificación de algunas especies, así también a los Drs. José N. Álvarez Cadena y Luis R. Capurro Filograsso por sus comentarios al escrito, al QBB. Benigno Escamilla Sánchez por sus observaciones y a dos revisores anónimos por sus acertadas sugerencias al escrito, así como a la CONABIO por el apoyo recibido a través del proyecto B020.
Referencias
ÁLVAREZ-CADENA, J., E. SUÁREZ-MORALES & R. GASCA. 1998. Copepod assemblages from a reef-related environment in the Mexican Caribbean Sea. Crustaceana 71: 411-433. [ Links ]
AMBLER, J. W. 1986. Effect of food quantity and quality on eggs production of Acartia tonsa Dana from East Lagoon, Galveston, Texas. Estuarine Coastal and Shelf Science 23: 183-196. [ Links ]
BEGON, M., J.L. HARPER & C. R. TOWSEND. 1999. Ecology: Individuals, Populations and Communities. 3rd Edition. Blackwell Science Limited, Oxford. 1148 p. [ Links ]
BRADFORD-GRIEVE, J.M., E. L. MARHASEVA, C. E. ROCHA & B. ABIANY. 1999. Copepoda. In: BOLTOVSKOY, D. (ed.). South Atlantic Zooplankton V. 2. Backhuys Publishers, Leiden. The Netherlands, pp. 869-1098. [ Links ]
CAMPOS, A. H. & E. SUÁREZ-MORALES. 1994. Copépodos Pelágicos del Golfo de México y Mar Caribe. 1. Biología y Sistemática. CIQRO, México. 353 p. [ Links ]
DAY, J.W., C. S. HALL, W. M. KEMP & A. YÁÑEZ-ARANCIBIA. 1989. Estuary Ecology. John Wiley & Sons, New York: 558 p. [ Links ]
ESCAMILLA-SÁNCHEZ, J. & E. SUÁREZ-MORALES. 1999. Lista preliminar de copépodos (Crustacea) de la laguna de Chelem y aguas marinas adyacentes, Yucatán, México. Invierno de 1998/99. Revista de la División de Estudios de Posgrado e Investigación. Instituto Tecnológico de Mérida 37: 32-38. [ Links ]
ESCAMILLA-SÁNCHEZ, J. & E. SUÁREZ-MORALES. 2001. Distribución del zooplancton durante flujos de marea opuestos en el complejo lagunar de Chelem, Yucatán México. Revista de Biología Tropical 49(1): 47-51. [ Links ]
GÓMEZ-AGUIRRE, S. 1987. Plancton de lagunas costeras de México. In: GÓMEZ-AGUIRRE, S. y V. ARENAS-FUENTES (ed.). Contribuciones en Hidrobiología. UNAM, México, pp. 207-221. [ Links ]
HERRERA-SILVEIRA, J., J. RAMÍREZ-RAMÍREZ & A. SALDIVAR. 1999. Overview and characterization of the hydrology and primary producer communities of selected costal lagoons of Yucatan, Mexico. Aquatic Ecosystem Health and Management 1: 353-372. [ Links ]
MILLER, C. B. 1983. The zooplankton of estuaries. In: BOSTWICK (ed.). Estuaries and Enclosed Seas. Ecosystems of the Word 26. Elsevier Scientific Publishing Co., New York, pp. 103-149. [ Links ]
OMORI, M. & W. H. HAMNER. 1982. Patchy distribution of zooplankton: behavior, population assessment and sampling problems. Marine Biology 72: 193-200. [ Links ]
ORDÓÑEZ-LÓPEZ, U. 1995. Análisis del Ictioplancton del Ecosistema Costero de Celestún, Yucatán. Informe Final a CONABIO (Proyecto B020). Dpto. Recursos del Mar, CINVESTAV-IPN, U. Mérida: 85 p. [ Links ]
ORDÓÑEZ-LÓPEZ, U. 1998. Análisis del Ictioplancton de la Reserva Faunística de Ría Lagartos, Yucatán. Informe Final a CONABIO (Proyecto L148), Dpto. Recursos del Mar, CINVESTAV-IPN, U. Mérida: 90 p. [ Links ]
PARSONS, T. R., MAITA, Y. & C. M. LALLI. 1984. A Manual of Chemical and Biology Methods for Seawater Analysis. Pergamon Press. England. 173 p. [ Links ]
REID, J. W. 1989. The distribution of species of the genus Thermocyclops (Copepoda Cyclopoida) in the Western Hemisphere, with description of T. parvus, new species. Hydrobiologia 175: 149-174. [ Links ]
REID, J. W. 1990. Continental and Coast free-living Copepoda (Crustacea) of Mexico, Central America and the Caribbean Region. In: NAVARRO, D. y J. ROBINSON (eds.) Diversidad Biológica en la Reserva de la Biosfera de Sian Ka'an Quintana Roo, México. Vol. 1. Centro de Investigaciones de Quintana Roo. Chetumal, pp. 175-213. [ Links ]
RÍOS-JARA, E. 1998. Seasonal abundance of the demersal copepod Pseudodiaptomus cokeri (Calanoidea: Pseudodiaptomidae) in a Caribbean estuarine environment. Revista de Biología Tropical 46 (3): 661-672. [ Links ]
SUÁREZ-MORALES, E. 1990. Copépodos planctónicos (Crustacea) de la Bahía de la Ascensión, Reserva de la Biosfera de Sian Ka'an, México. In: NAVARRO, D. y J. ROBINSON (Eds.) Diversidad Biológica en la Reserva de la Biosfera de Sian Ka'an Quintana Roo, México. Vol. 1. Centro de Investigaciones de Quintana Roo. Chetumal, pp. 216-238. [ Links ]
SUÁREZ-MORALES, E. 1994a. Comunidades zooplanctónicas de las lagunas costeras. In: DE LA LANZA-ESPINO, G. y C. CÁCERES-MARTÍNEZ (Eds.). Lagunas Costeras y el Litoral Mexicano. Universidad Autónoma de Baja California Sur, pp. 247-268. [ Links ]
SUÁREZ-MORALES, E. 1994b. Copépodos pláncticos de la bahía de Chetumal, México (1990-1991). Caribbean Journal of Science 30(3-4): 181-188. [ Links ]
SUÁREZ-MORALES, E. 1995. Clave ilustrada para la identificación de los copépodos pláncticos de la Bahía de Chetumal, México. Avances Científicos 12: 16-24. [ Links ]
SUÁREZ-MORALES, E. 1996. Clave de identificación ilustrada de los copépodos pláncticos (Crustacea) de la Bahía de la Ascensión, Chetumal, Q. Roo. Avances Científicos 17: 25-39. [ Links ]
SUÁREZ-MORALES, E. & R. GASCA. 2000. The planktonic copepod community at Mahahual Reef, Western Caribbean. Bulletin Marine of Science 66(1): 255-267. [ Links ]
SUÁREZ-MORALES, E., REID, W. J., ILIFE, M. T. & F. FIERS. 1996. Catálogo de los Copépodos (Crustacea) Continentales de la Península de Yucatán, México. CONABIO y ECOSUR, México. 296 p. [ Links ]
VENCCIONE, M. 1991. Long-term trends in the abundance of the copepod Acartia tonsa in the Calcasieu Estuary. Contribution in Marine Science 32: 89-101. [ Links ]
ZAR, J. H. 1988. Biostatistical Analysis. 2nd Edition. Pentice Hall. Englewood Clifs, N. Jersey. 718 p. [ Links ]














