Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.13 no.1 Ciudad de México abr. 2003
Artículo
La Tribu Callithamnieae (Ceramiaceae, Rhodophyta) en la costa del Atlántico de México
The Tribe Callithamnieae (Ceramiaceae, Rhodophyta) in the Atlantic Coast of Mexico
1Luz Elena Mateo-Cid, 1A. Catalina Mendoza-González y 2Richard B. Searles
1Departamento de Botánica, Escuela Nacional de Ciencias Biológicas, IPN. Carpio y Plan de Ayala Col. Sto. Tomás México, D.F. 11340.
2Department of Biology, Duke University, Durham, NC 27708-0338, USA.
Recibido: 13 de julio de 2002.
Aceptado: 11 de diciembre de 2002.
Resumen
Se realizó una revisión bibliográfica y de ejemplares de herbario de los géneros y especies de la Tribu Callithamnieae (Ceramiaceae, Rhodophyta) que han sido registradas para la costa del Atlántico de México, así como material biológico recolectado en 20 localidades entre 1983 a 2000. Los resultados obtenidos indican que la Tribu Callithamnieae se encuentra representada por tres géneros y cinco especies. El género Aglaothamnion Feldmann-Mazoyer tiene tres especies, de las cuales A. cordatum (Børgesen) Feldmann-Mazoyer presenta la distribución más amplia desde Isla Cozumel, Quintana Roo hasta Tampico, Tamaulipas. Ejemplares de A. boergesenii (Aponte et Ballantine) L' Hardy-Halos et Rueness y A. herveyi (M. Howe) Aponte, Ballantine et Norris se ubicaron solo en la región del Caribe. Callithamnion Lyngbye y Seirospora Harvey son uniespecificos y la distribución de ambos se restringe a Quintana Roo y Veracruz. Los integrantes de esta Tribu fácilmente pasan desapercibidos por su carácter filamentoso, hábito epífito y tamaño pequeño. Cada especie se acompaña con datos sobre su morfología, citología, estado reproductivo, distribución, esquemas, claves dicotómicas para su determinación y ejemplares representativos.
Palabras Clave: Ceramiaceae, Callithamnieae, taxonomía, Atlántico, México.
Abstract
Bibliographic revision of species from the Tribe Callithamnieae (Ceramiaceae, Rhodophyta) previously recorded from the Atlantic Mexico's shores was realized. We also checked herbarium's specimens housed at different herbaria. In addition, some samples of Callithamnieae were carried out in twenty localities at the Atlantic coast of Mexico from 1983 to 2000. Analysis of this information showed us that this tribe contains three genera and five species. The best-represented genus of this Tribe was Aglaothamnion Feldmann-Mazoyer with three species. A. cordatum (Børgesen) Feldmann-Mazoyer is recorded from Cozumel island, Quintana Roo to Tampico, Tamaulipas, while A. boergesenii (Aponte et Ballantine) L' Hardy-Halos et Rueness and A. herveyi (M. Howe) Aponte, Ballantine et Norris only were found in the Caribbean Sea. The distribution of Callithamnion Lyngbye and Seirospora Harvey, with one species each, is restricted to Quintana Roo and Veracruz. The taxa of this Tribe are not easily noticed because of their epiphytic habit, filamentous forms and small size. Morphological descriptions, drawings, distributional range, reproductive stage, substrate, tidal level, wave exposure, keys for determinations and specimens examinated are included.
Key words: Ceramiaceae, Callithamnieae, taxonomy, Atlantic, Mexico.
Introducción
La familia Ceramiaceae es una de las familias de algas rojas más diversa, que incluye más de 100 géneros y 200 especies. Está constituida por 12 tribus cuyos integrantes son plantas que van desde talos pequeños, filamentosos y delicados, tales como Callithamnion Harvey y Antithamnion Nâgeli, hasta formas robustas muy ramificadas como Ptilota C. Agardh y Microcladia Greville (Hommersand, 1963). Las especies de esta familia se distribuyen en mares tropicales y templados (Bold y Wynne, 1976).
La forma de crecimiento de los talos es por célula apical; la familia se caracteriza por su construcción uniaxial y un ciclo de vida diplohaplóntico con alternancia de generaciones isomórficas, reproducción sexual tipo oogámica; los gametófitos comúnmente son dioicos. Los gametos femeninos o carpogonios se soportan en ramas carpogoniales de cuatro células, la célula auxiliar se forma después de la fertilización; espermacios (gametos masculinos) inmóviles, desarrollándose sobre los pleuridios terminales.
Las plantas diploides (esporofitos) producen esporangios los que en la mayoría de los géneros poseen cuatro tetrasporas inmóviles, en algunos casos se producen monosporas (Bold y Wynne, 1976).
La segregación de las Tribus en la familia Ceramiaceae se basa en el carácter uni o multinucleado de las células (Aponte y Ballantine, 1995), en la organización y disposición de los pleuridios, ya sea en verticilos opuestos o alternos, ramas carpogoniales rectas o curvadas y la presencia o ausencia de filamentos vegetativos que rodean al gonimoblasto (Hommersand, 1963).
La Tribu Callithamnieae incluye a Callithamnion Lyngbye (1819), Seirospora Harvey (1846), Carpothamnion Kützing (1849) y Aglaothamnion Feldmann-Mazoyer (1941). De estos géneros, Seirospora y Aglaothamnion poseen células vegetativas uninucleadas, mientras que las células de Callithamnion y Carpothamnion son multinucleadas. Tradicionalmente el criterio básico para separar a Seirospora de Aglaothamnion fue la estructura compacta o difusa del gonimoblasto así como la producción de esporas en cadenas, llamadas seirosporas (Dixon, 1971).
De acuerdo a Dixon y Price (1981) dos de las características taxonómicas más importantes para delimitar a Callithamnion y Aglaothamnion son el tipo de ramificación y el arreglo de las laterales. Otros trabajos (Price, 1978, Aponte et al., 1997), han mostrado que diferentes estados reproductivos pueden estar correlacionados con los diferentes tipos de ramificación. Maggs y Hommersand (1993) también registraron amplias variaciones morfológicas en especies de Aglaothamnion de las Islas Británicas.
Actualmente se reconocen como géneros independientes a Callithamnion y Aglaothamnion, sobre la base de células vegetativas uninucleadas o multinucleadas (Aponte y Ballantine, 1995; Aponte et al. 1997).
Las investigaciones que se han llevado a cabo sobre las especies de Callithamnieae en la costa del Atlántico de México son escasas, en su mayor parte han sido enfocadas a estudios florísticos, siendo de mayor aporte los realizados por Huerta-Múzquiz y Garza Barrientos (1964), Mendoza-González y Mateo-Cid (1986), Huerta-Múzquiz et al. (1987), Mateo-Cid y Mendoza-González (1991), Mendoza-González y Mateo-Cid (1992), Dreckmann et al. (1996), Collado-Vides et al. (1998) y Díaz-Martín y Quang Young (2001).
Debido a los cambios nomenclaturales recientes y a la confusión que ha existido para delimitar a los géneros Aglaothamnion y Callithamnion en México, el objetivo de este trabajo es reexaminar el material mexicano de estos géneros que se encuentran depositados en herbarios nacionales y elaborar un estudio sobre la Tribu Callithamnieae con descripciones, ilustraciones y distribución de los géneros y especies registradas en la costa del Atlántico de México.
Material y métodos
Se obtuvieron muestras ficológicas en 20 localidades de la zona intermareal y submareal de las costas de Quintana Roo (en 1983, 1986, 1993, 1997 y 2000), Veracruz,(en 1986) y Yucatán, (en 1987). Los sitios de recolecta se eligieron de acuerdo a la accesibilidad y a la ocurrencia de las especies previamente citadas en la literatura. Los especimenes se recolectaron con ayuda de espátulas, se colocaron en frascos de vidrio, fueron etiquetados y preservados en una solución de formaldehído al 5% en agua de mar. Con el objeto de corroborar, corregir las determinaciones taxonómicas y obtener registros geográficos de los ejemplares depositados en los herbarios, se revisaron los ejemplares depositados en los herbarios de la Escuela Nacional de Ciencias Biológicas (ENCB); Herbario de la Universidad Autónoma Metropolitana Iztapalapa (UAMIZ) y el herbario de la Escuela Nacional de Estudios Profesionales Iztacala (IZTA).
El material biológico recolectado se tiñó con hematoxilina de Harris para evidenciar los núcleos de las células y determinar el carácter uni o multinucleado de los especímenes, y se elaboraron preparaciones semipermanentes con el fin de observar la organización de los talos filamentosos y estructuras de reproducción útiles para la determinación de las especies. En el caso del material herborizado, este se hidrató previamente en agua con formol por 24 a 72 horas y posteriormente se tiñó con hematoxilina de Harris, de acuerdo a la técnica propuesta por Maggs y L' Hardy-Halos (1993). En la determinación del material se utilizaron las obras de Taylor (1960), Schneider y Searles (1991), Aponte y Ballantine (1995) y Aponte et al. (1997). La actualización nomenclatural se basó en Aponte et al. (1997) y Wynne (1998).
En el presente estudio se incluyen descripciones genéricas y claves dicotómicas para la separación de géneros y especies. Cada especie se presenta con un prolegómeno taxonómico, descripciones morfoanatómicas basadas en los ejemplares recolectados, así como datos referentes a su hábitat, material examinado, localidad, colectores, estado reproductivo, referencias sobre binomios, basionimos y sinonimias, comentarios taxonómicos, esquemas realizados en cámara clara y ejemplares representativos.
Resultados

Callithamnieae se encuentra representada por tres géneros en la costa del Atlántico de México: Aglaothamnion con tres especies y la distribución más amplia, desde Isla Cozumel, Quintana Roo hasta Tampico, Tamaulipas; Callithamnion y Seirospora sólo tienen una especie y la distribución de ambos está restringida a Quintana Roo y Veracruz.
AGLAOTHAMNION Feldmann-Mazoyer
Talos erectos que nacen desde un sistema de filamentos postrados, todas las células vegetativas uninucleadas, filamentos uniseriados, una rama lateral determinada por célula axial, dispuestas en secuencia radial o en espiral, raramente alterna dística; las laterales ramificadas de modo alterno a subdicotómico; ápices del talo produciendo en algunas ocasiones pelos largos. Tetraesporangios tetrahédricamente divididos, sésiles, uno por célula y dispuestos en forma adaxial. Paquetes espermatangiales con 1 a 3 células fértiles que crecen de modo adaxial sobre las ramillas laterales. Procarpos laterales creciendo sobre las células de los ejes indeterminados no modificados; gonimoblastos proyectados hacia ambos lados de los ejes, cada uno con proyecciones cortas o largas.

Aglaothamnion boergesenii (Aponte et Ballantine) L. Hardy-Halos et Rueness.
Callithamnion boergesenii Aponte et Ballantine 1990: 192, Aglaothamnion boergesenii (Aponte et Ballantine) L' Hardy-Halos et Rueness in Aponte et al. 1997: 84
Talos filamentosos arborescentes, de color rojo-vino a verde rojizo, de 3.0-3.5 cm de alto de aspecto flácido (Fig. 1), fijos al sustrato por rizoides pluricelulares (Fig. 2), ramificación primaria y secundaria radialmente alterna. Ejes principales evidentes sin corticación en las porciones basales las células miden 113-151 m de diámetro y 68-151 m de longitud, alargándose hacia las porciones medias, en donde las células son 55-70 m de diámetro y 200-210 m de longitud. La ramificación terciaria dicotómica, las células de 6-8 m de diámetro y 20-29 m de longitud, adelgazándose hacia los ápices, los cuales son algo curvados y agudos; con células de 2.0 m de diámetro y 20-29 m de longitud. Células vegetativas uninucleadas, (Fig. 3), con plastos numerosos de forma irregular (Fig. 4). Tetrasporangios subesféricos de 36-41 m de diámetro y 50-62 mm de longitud, tetrahédricamente divididos, sésiles y solitarios, produciéndose adaxialmente sobre las penúltimas y últimas ramillas (Figs. 4 y 5).


De acuerdo con Aponte y Ballantine (1995), los gonimoblastos son irregularmente lobados; mientras que los espermacios forman agregados hemisféricos pulvinados formándose de 1-4 ramas espermatangiales por célula.
Distribución y material examinado
Tabasco: Laguna de Mecoacán (Orozco-Vega y Dreckmann, 1995:194).
Quintana Roo: Isla Cozumel (Mateo-Cid y Mendoza-González, 1991:73 como Callithmanion uruguayense W. Taylor); Playa Caletilla, Isla Cozumel, 16-X-1983, L. Huerta, C. Mendoza, L. E. Mateo y A. Cisneros (ENCB 8248); Arrecife Santa Rosa, Isla Cozumel, 20-III-1994, R. B. Searles y R. Robles, RBS-94-09, 12 m de profundidad.
Hábitat: Epífito de Gracilaria aff. pacifica Abbott, sobre rocas, intermareal expuesto y epífito de Halimeda opuntia (Linnaeus) J. V. Lamouroux, 12 m de profundidad.
Comentarios: De acuerdo con Aponte y Ballantine (1990), A. boergesenii se distribuye principalmente en el Caribe; ellos indican que la mayoría de los registros previos en la región del Caribe, de Børgesen (1909, 1917), Almodóvar (1964), Oliveira (1969), Díaz-Piferrer (1970) y Chapman, (1963) referidos a Callithamnion byssoides, corresponden a Aglaothamnion boergesenii. A. boergesenii se diferencia de A. cordatum por el tamaño de los talos, el tipo de ramificación y la forma de los gonimoblastos que en A. boergesenii se dividen en 2 o 3 lóbulos alargados cuando son maduros, mientras que en A. cordatum estos son cordados tendiendo a ser irregularmente triangulares cuando maduran.
Aglaothamnion cordatum (Børgesen) Feldmann-Mazoyer
Callithamnion cordatum Børgesen 1909: 30, Aglaothamnion neglectum Feldmann-Mazoyer 1941: 459-464, Aglaothamnion cordatum (Børgesen) Feldmann-Mazoyer 1941:459
Talos filamentosos, de aspecto plumoso de color rojo-vino a verde rojizo (Fig. 6), fijos al hospedero por una base de filamentos reptantes que se adhieren por rizoides pluricelulares o por hápteras (Figs. 7,8), ramificación primaria alterna, la secundaria muy abundante, dicotómica en un solo plano. Ejes principales no corticados o sólo con unos pocos filamentos rizoidales; todas las células uninucleadas y con numerosos plastos alargados. Células de las porciones basales de 98-172 m de diámetro y 155-288 m de longitud, ápices de las ramillas redondeadas, las células de 7-27 m de diámetro.

Los talos que forman los tetrasporangios miden 0.5-0.8 cm de alto; tetrasporangios tetrahédricamente divididos, sésiles y solitarios, de forma casi esférica desarrollándose en el lado interno de las ramillas (Figs. 9, 10) de 48-68 m de diámetro.

Gametofitos femeninos de 1-1.5 cm de alto; los gonimoblastos se disponen de dos en dos sobre las células de las ramas superiores y están formados por dos o tres gonimoblastos irregularmente triangulares o cordados (Figs. 11, 12, 13 ), cuando maduros miden de 162-350 m de diámetro y 311-470 m de alto.

Los talos masculinos de 1.5-1.8 cm de alto; los espermatocistos se desarrollan unilateralmente en las ramas superiores y en las ramillas de último orden, generalmente sobre el lado interno de las ramas (Figs. 14, 15, 16), se dividen de 1-3 veces formando densos agregados y miden 3.0-3.8 m de diámetro.

Distribución y material examinado
Tampico: Ciudad Madero (Garza Barrientos et al. 1984: 119), San Fernando (Martínez-Lozano y Villareal-Rivera 1991: 10), escollera de Altamira, 4-VIII-1984, S. Vázquez-Martínez (ENCB 5298, Martínez-Lozano et al. 1992: 32).
Veracruz: Tuxpan 04-V-1963 L. Huerta y G. Barrientos (ENCB, 107), VI 1984 L. Huerta y L. Mateo (ENCB, 5610), 09-II-1986 E. Rojas-R. (ENCB 9483), 27-VI-1986 E. Rojas-R. (ENCB, 9484), 27-VI-1986 E. Rojas-R. (ENCB, 9485), 20-X-1986 E. Rojas-R. (ENCB, 9486), Huerta-Múzquiz y Garza-Barrientos 1964:16, Mendoza-González y Mateo-Cid 1986:437.
Campeche: Campeche (Huerta-Múzquiz et al. 1987: 48, como Aglaothamnion neglectum).
Yucatán: Progreso (Huerta-Múzquiz et al. 1987:48, como Aglaothamnion neglectum).
Quintana Roo: Isla Mujeres 01-III-1985 C. Mendoza y L. E. Mateo (ENCB, 8254), extremo Norte de Isla Mujeres 13-IX-1985 L. E. Mateo y C. Mendoza (ENCB, 561), Mendoza-González y Mateo-Cid 1992: 50, como Callithamnion neglectum, Aguilar-Rosas, et al. 1992: 82, como Callithamnion cordatum, Puerto Morelos (Dreckmann et al. 1996:11; Collado-Vides et al., 1998:138), Isla Cozumel en el Muelle 19-III-1994 L. E. Mateo Cid, C. Mendoza y L. Huerta (ENCB 16005), Bahía de la Ascensión (Aguilar-Rosas, 1990: 28).
Aglaothamnion cordatum presenta la distribución más amplia en la costa del Atlántico de México desde la Isla Cozumel, Quintana Roo a Tampico, Tamaulipas. Se cita por primera vez para la Isla Cozumel.
Hábitat: Sobre rocas y epífito de Grateloupia filicina (J. V. Lamouroux) C. Agardh y Sebdenia flabellata (J. Agardh) P. G. Parkinson, en el intermareal expuesto.
Comentarios: Feldmann-Mazoyer (1941) delimitó a Aglaothamnion neglectum de A. cordatum basándose en los gonimoblastos de forma lobada y el arreglo en zig-zag de las ramas carpogoniales; sin embargo, Dixon y Price (1981) observaron que estas características eran variables, con poco valor taxonómico. Athanasiadis (1987) indicó que A. neglectum es coespecífico con A. cordatum.
Aglaothamnion herveyi (M. Howe) Aponte, Ballantine et J. Norris
Callithamnion herveyi M. Howe 1918: 528. Aglaothamnion herveyi (M. Howe) Aponte, Ballantine et J. Norris 1997: 232.
Talos de aspecto plumoso, esponjosos, cubiertos por sedimento, de color verde iridiscente o café-rojizo, de 2.0-2.8 cm de alto (Fig. 18). Células de los ejes principales de 200-220 m de diámetro cerca de la base; ejes no distinguibles en las plantas maduras. Los ejes están corticados densamente, aproximadamente en 60% de la longitud total por filamentos rizoidales que se originan de la base de las ramas laterales (Fig. 17). Filamentos rizoidales descendentes, de 45-50' m diámetro, que sólo cortican las porciones inferiores de las ramas laterales. Células vegetativas uninucleadas, plastos alargados numerosos (Fig. 20). Células de las ramas laterales de 52-55 m de diámetro y 95-165 m de longitud; ramillas cortas ramificadas de manera alterna, densamente dispuestas; los ápices redondeados, células de las partes medias de 23-27 m de diámetro y 33-59 m longitud, las ramillas curvadas hacia adentro lo cual le da al talo un aspecto corimboso. La ramificación de primer, segundo y tercer orden, alterna; la de último orden espiralada, tricotómica o dística muy densa. Tetraesporangios sésiles, tetrahédricamente divididos (Fig. 19), de 42-45 m de diámetro y solitarios. Los gonimoblastos son esféricos y los espermacios forman paquetes espermatangiales pedicelados, dispuestos uno por célula, las ramas espermatangiales se ramifican varias veces (Aponte y Ballantine, 1995).

Distribución y material examinado
Quintana Roo: Playa del Carmen, 30-X-1984, C. Mendoza-González y L. E. Mateo-Cid (ENCB 10702). Cabe mencionar que esta especie fue citada previamente como Callithamnion herveyi por Senties et al. (1999) sobre tortugas migratorias en playas del caribe mexicano.
Hábitat: Epífita de Spyridia filamentosa (Wulfen) Harvey in Hooker en el intermareal expuesto.
Comentarios: Aparentemente A. herveyi tiene una distribución restringida, ya que sólo ha sido registrada para Bermuda (Howe, 1918), Puerto Rico (Almodóvar, 1964), Colombia (Schnetter y Bula-Meyer 1979) y las Islas Vírgenes (Aponte et al. 1994). Esta situación quizá se deba a la apariencia poco evidente de los talos de A. herveyi y a que estos siempre están cubiertos por arena. Aponte et al. (1997) mencionan que probablemente A. herveyi está más ampliamente distribuido en el Caribe. Esta especie se separa claramente de A. boergesenii y A. cordatum por la presencia de una densa corticación en los ejes principales y el tipo de ramificación tricotómica y dística de las porciones superiores (Tabla 1).
El género Aglaothamnion fue creado por Feldmann-Mazoyer basándose en una especie previamente referida al género Callithamnion y designando como especie tipo a Aglaothamnion furcellariae (J. Agardh) Feldmann-Mazoyer. Este género fue separado de Callithamnion basándose en varios criterios, entre ellos el carácter uninucleado de todas las células vegetativas, la rama carpogonial en zig-zag y gonimoblastos de forma lobada. Aglaothamnion fue aceptado por algunos ficólogos (Kylin 1956; Dawson 1962; Abbott y Hollenberg 1976), mientras que otros ( Dixon y Price 1981 y Taylor 1960) incluyeron a Aglaothamnion en Callithamnion. L' Hardy-Halos y Rueness (1990) reconocen al género Aglaothamnion sobre la base del carácter uninucleado de las células y mencionan la confusión que existía entre el estatus taxonómico de Callithamnion y Aglaothamnion.
Aponte et al. (1997) aclaran la confusión taxonómica existente entre los géneros Aglaothamnion y Callithamnion, aceptando como diferencia taxonómica el carácter uni o multinucleado de las células. Ellos concluyen que Callithamnion byssoides, C. pseudobyssoides, Aglaothamnion westbrookiae Ruennes et L' Hardy-Halos y Callithamnion halliae Collins correspondían al género Aglaothamnion, por lo que propusieron una nueva combinación: Aglaothamnion halliae (Collins) Aponte, Ballantine et J. Norris.
Por lo que respecta a las citas de A. halliae registradas en los trabajos de Huerta et al. (1987), Dreckmann et al. (1996), Mateo-Cid y Mendoza-González (1991) y Collado-Vides et al. (1998), no fue posible ubicar a los especimenes en los que se basó la descripción, por lo que Aglaothamnion halliae es considerado un registro dudoso para la flora ficológica de México. Además, Aponte et al. (1997) indican que la distribución de A. halliae se presenta principalmente en las aguas templadas y subtropicales del Atlántico oeste, ocurriendo desde Nova Scotia hasta Florida y Texas así como en Noruega. Así mismo, mencionan que los registros de A. halliae en el Caribe están basados en otras especies o géneros de la familia Ceramiaceae como podrían ser: Pleonosporium Nâgeli o Callithamnion.
En el caso de Aglaothamnion uruguayense (W. Taylor) Aponte, Ballantine et Norris, se reexaminó el material depositado en el herbario ENCB , el cual corresponde a A. boergesenii. Como ocurre con A. halliae, A. uruguayense tiene una distribución restringida a la costa oeste del Atlántico (Aponte y Ballantine, 1995).
En la tabla 1 se indican los caracteres distintivos entre las tres especies de Aglaothamnion citadas en este estudio.
CALLITHAMNION Lyngbye
Talos formando agregados de filamentos uniseriados, los cuales presentan ramificación alterna; ejes principales corticados por filamentos o no. Todas las células vegetativas multinucleadas; plastos parietales, alargados o discoides. Talos gametangiales dioicos. Paquetes espermatangiales producidos en las ramillas superiores y en posición adaxial. Ramas carpogoniales desarrolladas desde células especiales dispuestas lateralmente en las partes superiores de los ejes indeterminados. Los carpoesporofitos son desnudos y comúnmente lobados, también se forman varios gonimolobos proyectados. Tetrasporangios tetraédricos, sésiles y en posición similar a la de los espermacios, naciendo en los sitios superiores (adaxiales) de las ramas laterales determinadas.
Callithamnion corymbosum (J. E. Smith) Lyngbye
Conferva corymbosa J. E. Smith in Smith y Sowerby 1811: 2352, Ceramium versicolor C. Agardh 1824: 140, Callithamnion corymbosum (J. E. Smith) Lyngbye 1819: 125
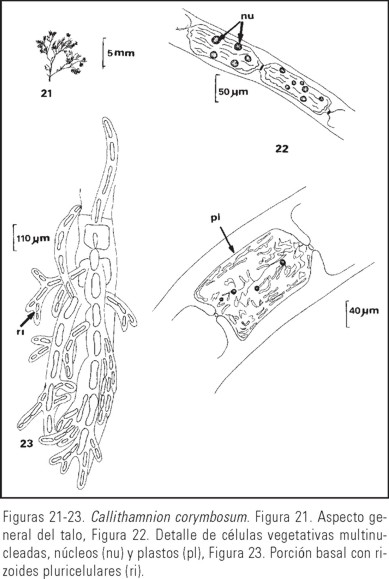
Talo filamentoso de color café rojizo, de aspecto plumoso, flácido (Fig. 21), fijo al sustrato por rizoides pluricelulares (Fig. 23); eje principal evidente, ramificación dicotómica muy densa arriba, células de los ejes principales de 160-175 m diámetro y 98-115 m longitud, comúnmente sin corticación o con unos pocos filamentos corticantes. Células axiales rectas o un poco curvadas, células de las porciones medias de 52-92 m diámetro y 110-128 m longitud y células apicales de 8-14 m diámetro y 27-51 m longitud, adelgazándose hacia los ápices y muchas de ellas con pelos en su mayoría deciduos (Fig. 25). Células vegetativas multinucleadas con plastos numerosos y alargados (Fig. 22). Talos gametangiales dioicos; gametofitos femeninos de 0.5-0.8 cm de alto, gonimoblastos generalmente divididos en dos gonimolobos (Fig. 24, 26), carposporangios de 12-18 m de diámetro. Gametófitos masculinos de 0.7-0.9 cm de alto, espermatocisto ramificados varias veces, formando agregados adaxiales en las ramillas de último orden (Fig. 27), espermacios de 1.5-2.5 m diámetro. Talos tetrasporangiales de 1.0-1.2 cm de alto, tetrasporangios esféricos, de 48-57 m diámetro (Figs. 28, 29), sésiles solitarios o raramente en pares sobre cada célula de las ramillas terminales.


Distribución y material examinado
Veracruz: Isla Lobos, V-1967, E. Hidalgo (ENCB 1198); Tuxpan, 14-V-1963, L. Huerta-Múzquiz y M. A. Garza-Barrientos (ENCB 105).
Quintana Roo: Puerto Morelos, 20-III-1994, L. E. Mateo-Cid y A. C. Mendoza-González (ENCB 16004); Isla Cozumel Arrecife Yucab, 20-III-1994, R. B. Searles y R. Robles (ENCB 12979); Isla Mujeres, Díaz-Martín y Quan-Young (2001:393).
Hábitat: Sobre rocas y epífita de Grateloupia filicina, Acanthophora spicifera (Vahl) Børgesen, nivel intermareal expuesto, epífita de Udotea occidentalis A. Gepp y E. Gepp en el submareal a 19.5 m de profundidad.
Comentarios: Dixon y Price (1981) indican que el tipo de ramificación y el crecimiento de C. corymbosum es muy variable y que el tipo de ramificación que predomina en sus ejemplares es subdicotómica. Por otro lado, comentan que el número de pelos terminales es variable y en ocasiones ausente.
Los especímenes localizados en este estudio difieren en el tipo de ramificación registrado por Dixon y Price (1981), pero coinciden en general con las características atribuidas a C. corymbosum, en especial el carácter multinucleado de las células. Por otro lado, Taylor (1960) indica que el tipo de ramificación que él encontró en C. corymbosum va de irregularmente pinado a dicotómico en las porciones superiores. Considerando que Dixon y Price (1981) mencionan que este taxon es extremadamente variable en su tipo de ramificación, los ejemplares examinados en este estudio se asignan a C. corymbosum.
SEIROSPORA Harvey
Talos filamentosos, delicados, ramificados de forma alterna abajo y subdicotómicamente en las porciones superiores, ejes principales corticados o no, células vegetativas uninucleadas con numerosos plastos redondeados, ápices de las ramillas redondeados sin pelos. Talos gametangiales dioicos, los carpogonios con tres o cuatro células como rama carpogonial, gonimoblastos difusos o compactos sin divisiones. Espermatocistos 1-3 veces ramificados, erectos, hemisféricos o pulvinados, de 1-3 ramas espermatangiales por célula, dispuestos adaxialmente en las ramas terminales. Tetrasporangios esféricos, subesféricos, ovoides o elipsoidales, sésiles o pedicelados, solitarios o en pares. Producción de esporas en series (seirosporas) en paquetes radiales sobre las ramas terminales.
Seirospora occidentalis Børgesen
Seirospora occidentalis Børgesen 1909:12.
Talos erectos, filamentosos de aspecto plumoso y color verde rojizo, de 6.0-8.0 m de alto, fijos al hospedero por un cojín de rizoides pluricelulares (Fig. 31), eje principal evidente sin corticación, células cercanas a la base de 140-265 m de diámetro y 118-160 m de longitud, ramificación alterna; células vegetativas uninucleadas y con numerosos plastos alargados (Fig. 32), células de las porciones medias de 112-128 m de diámetro y 172-200 m de longitud, en las porciones superiores la ramificación subdicotómica y en espiral, ápices redondeados y sólo algunos con pelos; células de las ramas terminales de 9-18 m de diámetro y 25-90 m de longitud. Seirosporas sésiles, formando cadenas simples o una vez ramificadas, de 32-37 m diámetro (Fig. 30, 33, 34). Los talos gametangiales han sido descritos por Børgesen (1917) y Aponte y Ballantine (1995); estos autores indican que los gonimoblastos son difusos; mientras que los gametófitos masculinos forman de 1-3 ramas espermatangiales por célula, con 2-4 células de largo, no ramificadas y erectas sin formar agregados.


Distribución y material examinado
Quintana Roo: Isla Cozumel, Arrecife Palancar, 1-IX-1993, R. B. Searles y R. Robles (ENCB 12980), Arrecife Santa Rosa, 22-III-1994 y V-1995, R. B. Searles y R. Robles (preparación semipermanente Colección Anexa Herbario ENCB). Isla Mujeres, Díaz-Martin y Quang Young (2001).
Hábitat: Epífita de Halimeda discoidea Decaisne a 27 m de profundidad, epífita de Champia parvula (C. Agardh) Harvey, 24 m de profundidad.
Comentarios: Tres especies de Seirospora han sido registradas para el Caribe y el Atlántico Oeste (Bermuda): S. viridis Aponte y Ballantine, S. purpurea M. Howe y S. occidentalis; la última fácilmente distinguible por sus talos ecorticados, mientras que las dos primeras están fuertemente corticadas, además de que son más altas y robustas (Aponte y Ballantine, 1995).
Los especimenes revisados en este estudio coinciden en general con las descripciones previamente citadas en otros estudios (Taylor, 1960, Aponte y Ballantine, 1995), excepto en la longitud del talo, ya que nuestros ejemplares son más pequeños.
Discusión
Los géneros Aglaothamnion y Callithamnion representan un buen ejemplo de la confusión taxonómica en las algas rojas y que por muchos años no ha permitido establecer con exactitud el número de especies y distribución de estos géneros en la costa del Atlántico de México. Esta situación se debe a varias razones, entre ellas a la ausencia en el conocimiento de la influencia del ambiente sobre el fenotipo extremadamente plástico de estos organismos lo que produce una amplia variación morfológica de los talos (Dixon y Price, 1981). También la falta de información sobre sus límites de distribución en diferentes áreas geográficas, y a la mala interpretación y confusión en la aplicación de nombres en diferentes tiempos, por diferentes ficólogos y en diferentes países. Esta situación ha cambiado sustancialmente a partir de los estudios de L' Hardy-Halos y Rueness (1990), Aponte y Ballantine (1990, 1995), Aponte y Norris (1994) y Aponte et al. (1997), quienes han dado bases sólidas para la separación de estos géneros.
Recientemente, Ortega et al. (2001) indicaron la necesidad de que el material mexicano asignado a Aglaothamnion fuera reexaminado. Ellos mencionan a cinco especies de Aglaothamnion, aunque como ya se mencionó, A. halliae es un registro dudoso y A. uruguayense es considerado un nombre mal aplicado.
La característica más importante y útil para delimitar a estos géneros es el número de núcleos por célula, ya sea uni o multinucleadas, ya que es un carácter constante en las especies estudiadas en este trabajo. Por ello, se recomienda realizar técnicas de tinción específicas para evidenciar núcleos, y así partir de bases sólidas en la delimitación de estos géneros. Como caracteres secundarios se utilizan el tipo de ramificación, la longitud de los talos y la presencia o ausencia de corticación. En la tabla 1 se indican los caracteres distintivos de cada na de las especies registradas en este estudio.
El número escaso de referencias de Aglaothamnion y Callithamnion en México puede deberse al tamaño y hábito poco evidente de estos organismos, que en su mayoría son epífitos y pasan desapercibidos. Así mismo, hay que considerar la falta de determinaciones confiables de estos géneros. Por tal motivo, es necesario llevar a cabo estudios específicos sobre estos taxa, para ampliar nuestro conocimiento de ellos.
Agradecimientos
Al Instituto Politécnico Nacional, por proporcionar el apoyo económico así como las instalaciones y el equipo para desarrollar este estudio. El segundo autor agradece a la Comisión de Operación y Fomento de Actividades Académicas del IPN (COFAA) por la beca otorgada. Rosalba Robles colaboró en la recolecta del material y Luz Elena Tejeda Hernández capturó la Información.
Referencias
ABBOTT, I. A. y G. A. HOLLENBERG, 1976. Marine algae of California. Stanford University Press, Stanford. 827 p. [ Links ]
AGARDH, C. A., 1824. Systema Algarum. Lund. xxxviii + 312 p. [ Links ]
AGUILAR-ROSAS, L. E., M. A. AGUILAR-ROSAS, A. GÓMEZ-PEDROSO-CEDILLO y J. A. HERNÁNDEZ-PRIETO, 1992. Adiciones a la flora marina del Caribe Mexicano. Acta Botánica Mexicana 19: 77-84. [ Links ]
AGUILAR-ROSAS, M. A, 1990. Algas marinas bentónicas de la Reserva de la Biosfera de Sian Ka' an, Quintana Roo, México pp. 13-34. En: D. NAVARRO y J. G. ROBINSON (Eds.). Diversidad Biológica en la Reserva de la Biosfera de Sian Ka'an, Quintana Roo, México. Centro de Investigaciones de Quintana Roo (CIQRO), México. [ Links ]
ALMODÓVAR, L. R., 1964. The marine algae of Guánica, Puerto Rico. Revue Algologique 7: 129-150. [ Links ]
APONTE, N. E. y D. L. BALLANTINE, 1990. The life history in culture of Callithamnion boergesenii sp. nov. (Ceramiaceae, Rhodophyta) from the Caribbean. Phycologia 29: 191-199. [ Links ]
APONTE, N. E. y BALLANTINE, D. L., 1995. Aglaothamnion flexibile sp. nov. and Seirospora viridis sp. nov. (Ceramiaceae, Rhodophyta) from Puerto Rico. Phycologia 34: 102-12. [ Links ]
APONTE, N. E. y J. N. NORRIS, 1994. Culture studies on the morphology and life history of Aglaothamnion herveyi (Howe) comb. nov., with notes on A. felipponei (Howe) comb. nov. (Ceramiaceae, Rhodophyta). Phycologia 33: 231-238. [ Links ]
APONTE, N. E., BALLANTINE, D. L. y J. N. NORRIS, 1997. Aglaothamnion halliae comb. nov. and A. collinsii sp. nov. (Ceramiales; Rhodophyta): Resolution of nomenclatural and taxonomic confusion. Journal of Phycology 33: 81-87. [ Links ]
ATHANASIADIS, A., 1987. A survey of the seaweeds of the Aegean Sea with taxonomic studies on species of the tribe Antithamnieae (Rhodophyta). Univ. Gothenburg, Department of Marine Botany. VII + 174 p. [ Links ]
BOLD, H. C. y M. J. WYNNE, 1976. Introduction to the algae. Structure and reproduction. Prentice Hall Inc. New Jersey 706 p. [ Links ]
BØRGESEN, F., 1909. Some new or little know west Indian Florideae. Botanisk Tidsskrift 30: 1-19. [ Links ]
BØRGESEN, F., 1917. The marine algae of the Danish West Indies. III. Rhodophyceae. C. Dansk Botanisk Arkiu 3: 145-240. [ Links ]
CHAPMAN, V. J., 1963. The marine algae of Jamaica, Part 2. Phaeophyceae and Rhodophyceae. Bulletin of the Institute of Jamaica. 12: 3-201. [ Links ]
COLLADO-VIDES, L., I. ORTEGÓN-AZNAR, A. SENTIES G., L. COMBA-BARRERA y J. GONZÁLEZ-GONZÁLEZ. 1998. Macroalgae of Puerto Morelos Reef System, Mexican Caribbean. Hidrobiológica 8: 133-143. [ Links ]
DAWSON, E. Y., 1962. Marine red algae of Pacific México Part 7. Ceramiales: Ceramiaceae, Delesseriaceae. Allan Hancock Pacific Expeditions 26: 1-206. [ Links ]
DÍAZ-MARTÍN, M. A. y L. I. QUAN-YOUNG. 2001. Ampliación de ámbito de 32 macroalgas de Isla Mujeres Quintana Roo, Quintana Roo, México. Revista de Biología Tropical 49: 391-398. [ Links ]
DÍAZ-PIFERRER, M., 1970. Adiciones a la flora marina de Venezuela. Caribbean Journal of Science 10: 159-198. [ Links ]
DIXON, P. S., 1971. Cell enlargament in relation to the development of thallus form in Florideophyceae. British Phycological Journal 6: 195-205. [ Links ]
DIXON, P. S. y J. H. PRICE, 1981. The genus Callithamnion (Rhodophyta, Ceramiaceae) in the British Isles. Bulletin British Museum Natural History (Botany) 9: 99-141. [ Links ]
DRECKMANN, K. M., I. STOUT y A. SENTIES-GRANADOS, 1996. Lista actualizada de las algas marinas bentónicas de Puerto Morelos, Quintana Roo, Caribe Mexicano. Polibotánica 3: 1-17. [ Links ]
FELDMANN-MAZOYER, G., 1941 ["1940"]. Researches sur les Cêramiacées de la Méditerranée. Imprimerie Minerva, Alger. 510 p. + errata (4), 4 pls. [ Links ]
GARZA-BARRIENTOS, M. A., S. MARTÍNEZ-LOZANO y M. A. ESCALANTE, 1984. Contribución al conocimiento de las algas marinas bentónicas de Ciudad Madero, Tamaulipas, México. Phycologia Latino-Americana 2:103-125. [ Links ]
HARVEY, W. H., 1846. Phycologia Britannica, pls 1-72 (with text). Reeve y Benham, London. [ Links ]
HOMMERSAND, M. H., 1963. The morphology and classification of some Ceramiaceae and Rhodomelaceae. University of California Publications in Botany, 35: 165-366. [ Links ]
HOWE, M. A., 1918. Algae. In: Flora of Bermuda (Ed. by N. L. BRITTON), pp. 489-540. Charles Scribner's Sons, New York. XI + 585 p. [ Links ]
HUERTA-MÚZQUIZ, L. y M. A. GARZA-BARRIENTOS, 1964. Algas marinas de la Barra de Tuxpan y de los arrecifes Blanquilla y Lobos. Anales de la Escuela Nacional de Ciencias Biológicas 1 : 9-22, 1 fig., 1 cuadro. [ Links ]
HUERTA-MÚZQUIZ, L., A. C. MENDOZA GONZÁLEZ y L. E. MATEO CID, 1987. Avances sobre un estudio de las algas marinas de la Península de Yucatán. Phytologia 62: 23-53. [ Links ]
KÜTZING, F. T.,1849. Species Algarum Vi + 922 p. Lipsiae. [ Links ]
KYLIN, H., 1956. Die Gattungen der Rhodophyceen. C.W.K. Gleerups Förlag, Lund, 673 p. [ Links ]
L' HARDY-HALOS M. TH. y J. RUENESS, 1990. Comparative morphology and crossability of related species of Aglaothamnion (Rhodophyta). Phycologia 29: 351-366. [ Links ]
LYNGBYE, H. C., 1819. Tentamen Hydroplytologiae danicae. Copenhagen. 248 p. 70 pls. [ Links ]
MAGGS, C. A. y M. H. HOMMERSAND, 1993. Seaweeds of the British Isles. Vol. 1. Rhodophyta. Part 3A. Ceramiales. Natural History Museum, London: Her Majesty's Stationery Office. 444 p. [ Links ]
MAGGS, C. A. y M. TH. L' HARDY-HALOS, 1993. Nuclear staining in algal herbarium material; a reappraisal of the holotype of Callithamnion decompositum J. Agardh (Rhodophyta). Taxon 42: 521-530. [ Links ]
MARTÍNEZ-LOZANO, S. y L. VILLARREAL, 1991. Algas marinas bénticas de Soto la Marina, Tamaulipas, México. Publicaciones Biológicas de la Facultad de Ciencias Biológicas Univ. Autónoma de Nuevo León (México) 5(2): 13-22. [ Links ]
MARTÍNEZ-LOZANO, S., J. M. LÓPEZ-BAUTISTA y S. VÁZQUEZ-MARTÍNEZ, 1992. Flora ficológica marina de Altamira, Tamaulipas. Publicaciones Biológicas Facultad de Ciencias Biológicas. Univ. Autónoma de Nuevo León (México) 6: 30-37. [ Links ]
MATEO-CID, L. E. y A. C. MENDOZA-GONZÁLEZ, 1991. Algas marinas bénticas de la Isla Cozumel, Quintana Roo, México. Acta Botánica Mexicana 16: 57-88. [ Links ]
MENDOZA-GONZÁLEZ, A. C. y L. E. MATEO-CID, 1986. Algas marinas poco comunes de las costas mexicanas (III). Phytologia 60: 437-442. [ Links ]
MENDOZA-GONZÁLEZ, A. C. y L. E. MATEO CID, 1992. Algas marinas bentónicas de Isla Mujeres, Quintana Roo, México. Acta Botánica Mexicana 19: 37-61. [ Links ]
OLIVEIRA, E. C., 1969. Algas marinhas do sul do Estado do Espiritu Santo (Brasil). I - Ceramiales. Boletim de Facultad de de Filosofia, Ciências e Letras. Universidade de São Paulo 343 Bot. 26:1-277. [ Links ]
OROZCO-VEGA, H. y K. M. DRECKMANN, 1995. Macroalgas [Microalgas] estuarinas del litoral mexicano del Golfo de México. Cryptogamie Algologie 16: 189-198. [ Links ]
ORTEGA, M. M., J. L. GODÍNEZ y G. GARDUÑO-SOLÓRZANO, 2001. Catálogo de algas bénticas de las costas mexicanas del Golfo de México y Mar Caribe. Cuadernos del Instituto de Biología, Universidad Nacional Autónoma de México, 34:1-594. [ Links ]
PRICE, J. H., 1978. Ecological determination of adult form in Callithamnion. Its taxonomic implications. In: D.E.G. IRVINE and J. H. PRICE (Eds.). Modern Approaches to the Taxonomy of Red and Brown algae. pp. 263-300. London, New York, San Francisco. [ Links ]
SCHNEIDER, C. W. y R. B. SEARLES, 1991. Seaweeds of the Southeastern United States, Cape Hatteras to Cape Cañaveral. Duke University Press, Durham, North Carolina, 553 p. [ Links ]
SCHNETTER, R. y G. BULA-MEYER, 1979. Rodofíceas nuevas para la costa Atlántica de Colombia. Anales del Instituto de Investigaciones Marinas de Punta Betin 11: 71-85. [ Links ]
SENTIES GRANADOS, A., J. ESPINOSA-AVALOS y J. C. ZURITA. 1999. Epizoic algae of nesting sea turtles Caretta caretta (L.) and Chelonia mydas (L.) from the mexican Caribbean. Bulletin of Marine Science 64(1): 185-188. [ Links ]
SMITH, J. E. y J. SOWERBY, 1970-1814. English Botany. 36 vols. With indices. London. [ Links ]
TAYLOR, W. R., 1960. Marine algae of the Eastern tropical and subtropical coasts of the Americas. University of Michigan Press, Ann Arbor. 870 p. [ Links ]
WYNNE, M. J., 1998. A checklist of benthic marine algae of the tropical and subtropical western Atlantic. First revision. Nova Hedwigia 116:1-155. [ Links ]














