Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.10 no.2 Ciudad de México dic. 2000
Artículos
Dieta natural y tasa de forrajeo del camarón carideo Hippolyte zostericola Smith sobre epífitas de Thalassia testudinum Banks et Solander ex König
Everardo Barba Macías1, Alberto J. Sánchez Martínez2, Andrea Raz-Guzmán3 y Margarita E. Gallegos4
1 PEMEX, PEP-OAC. Activo de Producción Luna, Región Sur.
2 Lab. Hidrobiología, Div. Académica de Ciencias Biológicas, UJAT. Villahermosa, Tabasco, 08600, México. E-mail: sanchez@cicea.ujat.mx.
3 INIRENA, U. Michoacana de San Nicolás de Hidalgo. Priv. Juan Escutia 100, Col. Chapultepec Norte, 58260, Morelia, Michoacán, México.
4 Lab. Ecosistemas Costeros, Dpto. Hidrobiología, UAM-I, 09340, México, D. F.
Recibido: 6 de diciembre de 1999
Aceptado: 18 de abril de 2000
Resumen
La dieta del carideo Hippolyte zostericola se determinó mediante el análisis del contenido estomacal de especímenes recolectados en parches de vegetación acuática sumergida dominados por el pasto Thalassia testodinum. Las dietas experimentales suministradas fueron pasto con epífitas y se realizaron en condiciones de iluminación y obscuridad (12:12) en intervalos de 3 horas a lo largo de 24 horas. En ambos casos más del 55% de los componentes alimentarios estuvieron constituidos por algas filamentosas y diatomeas. La dieta tuvo una variación temporal en composición, ya que se observó que en la época de lluvias se detectó una preferencia significativa (p<0.001) por el consumo de algas filamentosas y materia orgánica no identificada. En condiciones experimentales la tasa de forrajeo fue mayor a las 15:00 en obscuridad con un valor promedio de 1.16 ± 0.36 mg epífitas pslc/individuo/hora, el promedio de consumo de epífitas en condiciones de obscuridad fue 1.9 veces mayor que en iluminación. La tasa promedio de forrajeo en obscuridad fue de 0.64 ± 0.29 mg epífitas plsc/individuo/hora, mientras que en iluminación fue de 0.33 ± 0.26 mg epífitas plsc/individuo/hora. En cuanto al número de excretas éste fue 1.7 veces mayor en obscuridad, con un valor promedio de 89.03 ± 67.71 excretas. Con respecto al tiempo, el número de excretas presentó un comportamiento similar al del forrajeo con valores máximos en obscuridad a las 15:00 y 18:00 horas. H. zostericola es un eslabón que transfiere energía vía biomasa entre los productos primario y niveles tróficos superiores, ya que es depredado por la mayoría de los carnívoros debido a que es un componente faunístico numéricamente dominante asociado con la vegetación acuática sumergida.
Palabras clave: Dieta, tasa de forrajeo, Hippolyte zostericola, epífitas, Thalassia testudinum.
Abstract
Diet of caridean shrimp Hippolyte zostericola was studied analizing stomach contents of specimens collected in Thalassia testudinum meadows. Experimental diets included seagrass leaves with epiphytes as food and were conducted in light and dark conditions (12:12) in 3 hours periods along 24 hours. In both cases, more than 55% of dietary components were plant material constituted by filamentous algae and diatoms. The composition of the natural diet had a seasonal variation, whereas in the rainy season the caridean shrimp prefered filamentous algae and unidentifiable organic matter. In experimental conditions, the grazing rate was higher during the 15:00 hours in dark conditions with an average value of 1.16 ± 0.36 mg of epiphytes afdw/individual/hour. The grazing rate in dark was 1.9 times higher than in light condition. The average grazing rate in darkness was 0.64 ± 0.29 mg of epiphytes afdw/individual/hour, while in light condition it was 0.33 ± 0.26 mg of epiphytes afdw/individual/hour. Fecal pellets was 1.7 times larger in darkness with 89.03 ± 67.71 fecal pellets. The number of fecal pellets with respect to time had a similar behavior to the grazing rate, with maximum values in dark condition at 15:00 and 18:00 hours. H. zostericola is a link between primacy producers and higher trophic levels. This caridean is a numerically important component of seagrass habitats and represents an available food item for fish and other higher invertebrates via biomasa.
Key words: Diet, grazing rate, Hippolyte zostericola, epiphytes, Thalassia testudinum.
Introducción
En los parches de pastos marinos las epífitas contribuyen a la producción primaria con marcadas variaciones espaciales y temporales en su biomasa y productividad (Klumpp et al., 1992; Mazella et al., 1992). El crecimiento de esta agrupación está influido por los mismos factores ambientales que intervienen en sus hospederos los pastos marinos (Mazella y Russo, 1989). La tasa de crecimiento y producción de los pastos marinos y la tasa de forrajeo (Alcoverro et al., 1997) modifican la estructura y la abundancia de la asociación de epífitas ya que son el recurso alimentario más frecuente y de mayor valor nutricional para los herbívoros asociados con este tipo de hábitat (Kitting et al., 1984). Además los organismos forrajeros se consideran facilitadores de la salud de los pastos (Klumpp et al., 1992) al permitir el crecimiento y la supervivencia de estos, mediante la regulación de la composición, abundancia y crecimiento de las algas epífitas que compiten con los pastos marinos por varios factores como luz y nutrientes entre otros (van Montfrans et al., 1984; Mazzella y Russo, 1989).
El forrajeo enlaza a los productores primarios y niveles tróficos superiores en la cadena alimenticia (Orth, 1992). Entre los principales forrajeros de epífitas de pastos marinos están los invertebrados epifaunales como anfípodos, isópodos, gasterópodos y camarones carideos, los cuales en su conjunto son denominados como mesoherbívoros. Estos regulan las poblaciones de epífitas y se destacan por su densidad y sus altas tasas de consumo de epífitas (Brawley, 1992).
En los pastos marinos distribuidos en los sistemas estuarinos tropicales y templados, los carideos son los decápodos numéricamente dominantes en los estos sistemas del suroccidente del Golfo de México, donde Hippolyte zostericola Smith es el carideo dominante en densidad (Barba, 1995; Sánchez et al., 1996; Barba, 1999). Por tal razón, este estudio se enfocó a determinar el estatus trófico de esta especie mediante la determinación de la dieta y a descubrir si existe variación de la misma en cuanto a las épocas climáticas y al fotoperiodo (iluminación vs oscuridad). Además, se cuantificó la tasa de forrajeo para evaluar el impacto de H. zostericola sobre la agrupación de epífitas de las hojas de Thalassia testudinum Banks et Solander ex König.
Materiales y métodos
Área de estudio
La Laguna de Términos es una laguna costera tropical localizada en el suroccidente del Golfo de México. Esta laguna tiene comunicación permanentemente con el ambiente marino a través de dos canales naturales que son las bocas de El Carmen y Puerto Real, y recibe los aportes de los ríos Palizada, Chumpán y Candelaria durante todo el año (Fig. 1). Las épocas climáticas en ésta laguna son sequía (febrero a mayo) y lluvias (junio a enero). La laguna presenta una heterogeneidad espacial y temporal alta con relación al gradiente de salinidad y a la presencia y arreglo espacial de hábitats de acuerdo con Sánchez y Raz-Guzman (1997). Los organismos fueron recolectados en el subsistema norcentral-noreste (NC-NE) de la laguna, en El Cayo (18°39'7 N, 91°42'W), que es un bajo con un área de 542 900 m2 aproximadamente con una profundidad promedio a 1 m y cubierta permanentemente por Thalassia testudinum (Sánchez, 1997), en donde en estudios anteriores se ha registrado abundancia y diversidad máxima de camarones carideos (Escobar, 1984; Escobar y Soto, 1987; Barba, 1995). Alvarez et al., 1996; Negreiros-Franzoso et al., 1996).

Área de experimentación
Los experimentos fueron llevados a cabo en el laboratorio de la Estación de El Carmen del Instituto de Ciencias del Mar y Limnología de la UNAM en Ciudad del Carmen, Campeche. El agua utilizada para los experimentos fue bombeada del Estero Pargo, el cual tiene una longitud de 5.3 km. con una profundidad promedio de 2m (Sánchez, 1997) y se comunica al subsistema NC-NE de la laguna. El agua usada en los experimentos fue tratada previamente con filtros mecánicos, químicos y de luz ultravioleta (UV).
Recolecta y mantenimiento de organismos
Los especímenes de H. zostericola se capturaron con una red de arrastre tipo Renfro (Renfro, 1962) con una abertura de boca de 2m y una luz malla de 1 mm en un área de 50 m2, y se transportaron en contenedores con agua aireada al laboratorio en donde los organismos adultos fueron identificados de acuerdo con los criterios taxonómicos propuestos por Chace (1972). Los individuos mayores a 3 mm de longitud de cefalotórax fueron escogidos para los experimentos. Los organismos fueron aclimatados en acuarios de 0.06 m2 de área y volumen de 0.12 m3, con agua circundante, aireación constante y pasto artificial de polietileno como substrato 24 horas antes de cada experimento. La temperatura (20 ± 2 °C), la salinidad (26 ± 2 ups) y el fotoperiodo controlado en laboratorio (iluminación 12hrs:12hrs obscuridad) fueron constantes.
Por su parte las hojas de T. testudinum con epífitas usadas en los experimentos fueron colocadas en estanques con agua circulante y aireación constante.
Tiempo de ayuno
Los carideos fueron puestos en ayuno 24 hrs antes del inicio de los experimentos, donde un total de 90 organismos se colocaron en un acuario de 40 lts con aireación, temperatura y salinidad constante y como substrato se colocó pasto artificial de polietileno sin materia orgánica adherida. Lotes de 30 carideos fueron extraídos a las 12, 24 y 36 horas, para determinar el tiempo de ayuno, el cual fue definido como el tiempo mínimo donde los estómagos se encontraron vacíos. Lo anterior se corroboró con el porcentaje de volumen mediante examen de los contenidos estomacales. El tiempo de ayuno se definió a las 24 horas, ya que en este tiempo el 100% de los estómagos se encontraron vacíos. Este criterio se usó para evitar sesgos en el análisis de la dieta experimental y en los cálculos de la tasa de forrajeo.
Dieta natural
Mediante el análisis de los contenidos estomacales de H. zostericola se determinaron los hábitos alimentarios, para lo cual se recolectaron especímenes en las dos épocas climáticas (sequía y lluvias). Al azar se seleccionaron 50 organismos para cada época climática, se preservaron en formalina y después en alcohol para su posterior análisis. Los contenidos estomacales se examinaron con un microscopio compuesto a un aumento de 100X dividido en cuatro campos para cuantificar el porcentaje por componente alimenticio. Los grupos alimentarios se dividieron en: (1) algas coralinas incrustantes, (2) algas filamentosas, (3) diatomeas, (4) materia orgánica no identificada y (5) materia animal.
Dieta experimental
En ocho acuarios de 0.06 m2 de área y volumen de 0.15 m3 con agua salobre (30±2 ups) fueron colocados 20 carideos en ayuno por acuario con trozos de pasto altamente epifitizado (>80%) (Nicotri, 1977), como su alimento por 24 horas para su posterior análisis de los contenidos estomacales con el mismo método mencionado en la dieta natural. Los trozos de pasto fueron cortados y lavados alternadamente durante 3 minutos con agua dulce corriente y agua salobre para provocar un choque osmótico y retirar la micro y meiofauna sin provocar daño o desprendimiento de epífitas (Holmlund et al., 1990). Los trozos de hoja se obtuvieron siempre de la zona apical ya que se asume que presentaban una composición similar de epífitas (Mazella y Alberte, 1986; Alcoverro et al., 1997).
La comparación de los hábitos alimentarios entre épocas para la dieta natural (para este análisis se excluyó el componente animal) y entre ambas dietas se efectuó mediante un análisis de varianza (ANDEVA) modelo I de dos factores con interacciones (Sokal y Rohlf, 1995), y fue analizado con STATISTICA (1985). Comparaciones múltiples de los promedios fueron realizadas con la prueba de Tükey (Méndez, 1976). En la primera comparación se incluyó la variación de los cinco grupos alimentarios en la sección anterior y la variación temporal (sequía y lluvias). Mientras que en la comparación entre dietas, el ANDEVA se aplicó con la variación de solamente cuatro grupos de epífitas (FIL, DIAT, COR y MONI), los grupos alimentarios y el tipo de dieta (natural y experimental). La exclusión del material animal se realizó con la finalidad de comparar sólo el componente vegetal de las dietas por lo que en la fase experimental previa se eliminaron los epizoides de las hojas del pasto mediante choque osmótico (Holmlund et al., 1990).
Tasa de forrajeo
En 80 acuarios cilíndricos de 50 ml con agua salobre (30 ± 2 ups) fue colocado un carideo en ayuno con su respectivo alimento, que consistió en un pedazo de pasto (3 cm de largo), altamente epifitizado (>80%) y previamente limpio de micro y meiofauna (ver dieta experimental). El tiempo de forrajeo se midió cada tres horas durante un ciclo de 24 horas para incluir las condiciones de iluminación y de obscuridad. En cada fotoperiodo de tiempo se realizaron 10 réplicas.
La tasa de forrajeo individual se cuantificó como la diferencia entre el peso seco libre de cenizas inicial y final (mg pslc) de epífitas y con el número de heces fecales mayores a 1mm analizado mediante una ANDEVA modelo I de dos factores con interacciones Sokal y Rolhf, 1995): tasa de forrajeo y fotoperiodo (iluminación y obscuridad). Las comparaciones múltiples de los promedios fueron realizadas con la prueba de Tükey (Méndez, 1976). Los organismos se utilizaron solamente una vez para evitar cualquier efecto generado por alimentación y manipulación.
Resultados
Dieta natural y experimental
La dieta natural de H. zostericola estuvo constituida por más del 60% por materia vegetal, ya que los porcentajes de los grupos preferidos fueron las algas filamentosas (FIL) con 31.6%, las diatomeas (DIAT) con el 22.2%, el material orgánico no identificado (MONI) con el 24.6%, el material animal (MAN) con 13.1% y por último las algas coralinas incrustantes (COR) con 8.2% (Tabla 1). La dieta natural presentó diferencias significativas entre los diferentes grupos alimentarios (F4, 395=357.25; p<0.001) ya que los porcentajes de los grupos de FIL y DIAT resultaron significativamente mayores a MONI, MAN y COR (Tabla 2). Los grupos alimentarios tuvieron diferencias significativas entre las épocas climáticas (F9,30=1105.99; p<0.001), donde FIL y MONI aumentaron con respecto a sequía (Tabla 1).

La dieta de H. zostericola en condiciones experimentales tuvo una preferencia similar al de la dieta natural por material vegetal con los valores más altos para FIL y DIAT. La dieta experimental presentó diferencias significativas entre los grupos alimentarios (F6,636=1105.99; p<0.001), mientras que no hubo diferencias significativas con respecto a la dieta natural (F1,6=0.112; p>0.05) (Tabla 2).
Tasa de forrajeo
La tasa de forrajeo no presentó diferencias significativas con respecto al factor fotoperiodo (F7,2= 1.377, p> 0.05) así como en el efecto combinado de tiempo y periodo (F3,6=0.393, p>0.05). Sin embargo, en la fase de obscuridad se observaron valores altos de la tasa de forrajeo en comparación con el fotoperiodo de iluminación (Fig. 2).

La tasa de forrajeo máxima en obscuridad fue a las 15:00 horas con un valor dde 1.16 ± 0.36 mg pslc/individuo/hora y después a las 21:00 con un valor de 0.58 ± 0.36 mg pslc/individuo/hora, y el valor mínimo fue de 0.38 ± 0.10 mg pslc/individuo/hora a las 18:00 horas. Con respecto al periodo de iluminación el valor máximo fue a las 09:00 horas con un valor de 0.56 ± 0.18 mg pslc/individuo/hora, mientras que el valor mínimo fue a las 06:00 con 0.18 ± 0.04 (Fig. 2).
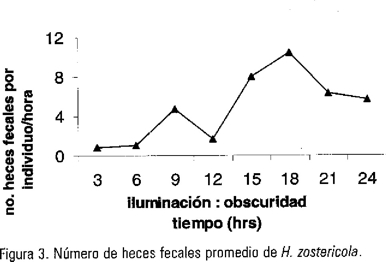
El número de excretas no varió significativamente en tiempo (fotoperiodo) (F3,6=1.211, p> 0.05). Sin embargo el número de excretas promedio fue mayor para la obscuridad con un valor de 7.61 ± 2.1 excretas/individuo/hora, con un intervalo de 10.39 ± 2.6 excretas/individuo/hora a las 18:00 horas y un valor mínimo de 5.67 ± 1.65 excretas/individuo/hora a las 24:00 hrs. Con respecto al periodo de iluminación el valor promedio fue de 2.09 ± 1.80 excretas/individuo/hora y un intervalo de 4.74 ± 1.8 excretas/individuo/hora para las 09:00 hrs y de 0.87 ± 0.41 excretas/individuo/hora para las 3:00 hrs (Fig.3).
Discusión
Los resultados de este estudio corroboraron que el camarón carideo H. zostericola es un forrajero activo de epífitas del pasto marino T. testudinum, ya que estas contribuyeron con más del 55% de su alimento tanto en condiciones naturales como experimentales. Este organismo mostró una preferencia por material vegetal donde los componentes alimentarios dominantes fueron las algas filamentosas (35%) y las diatomeas (20%). No obstante esta preferencia, se consideró una especie omnívora ya que en condiciones naturales se encontró que un 11% de su dieta estuvo constituida por material animal, lo cual puede estar relacionado con la abundancia de los alimentos (Kitting, 1984; Kitting et al., 1984).
No hubo diferencias significativas en los alimentos consumidos en la dieta natural entre épocas climáticas, lo cual sugiere que éstos se encuentran disponibles para su consumo. Las algas filamentosas y diatomeas son materiales sucesionales tempranos, y son más palatables al contener un valor nutricional mayor y una complejidad estructural menor. Así mismas, estas asociaciones son comunes en las hojas de pastos marinos y macroalgas en los ambientes tropicales y subtropicales (Jerkanoff y Nielsen, 1996).
En este estudio se encontraron estómagos de H. zostericola llenos a toda hora, lo cual revela que la actividad de alimentación es continua, y lo anterior se relacionó con la movilidad del organismo. Esto ocurre en otros organismos como los cangrejos ermitaños, en contraste con las jaibas del género Callinectes, tanto en condiciones de laboratorio como en el ambiente natural, presentan un patrón de alimentación relacionado con su ciclo circadiano (Cannicci et al., 1996).
La preferencia por material vegetal epifítico se ha observado en otros carideos, como Palaemonetes pugio que es uno de los carideos más estudiados y es un invertebrado dominante en ambientes estuarinos templados y subtropicales (Kitting et al, 1984; Kitting, 1984; Kitting et al., 1984). Esta especie es omnívora que se alimenta de epífitas de Halodule wrightii, así como de Spartina, Ruppia, Ulva y Enteromorpha y de invertebrados como poliquetos. Este carideo puede asimilar el detrito del pasto y su alto contenido en fibra, así como el alto contenido en proteínas que ofrece la macroalga Ulva. En estudios de isotopía de dC13 en invertebrados asociados a VAS, se encontró que los valores isotópicos de los invertebrados son cercanos al material vegetal como el de las epífitas, lo cual indica que éstas son consumidas por estos organismos (Dugan, 1983; Kitting et al., 1984; Kitting, 1984; Minello y Zimmerman, 1991; Raz-Guzmán, 1995). No obstante, existen diferencias con relación a las dietas de varios mesoherbívoros reportadas en literatura. Esto se atribuye a la variación en la abundancia de los alimentos preferidos, las condiciones estacionales, a la edad del forrajeador, y a los diferentes métodos de investigación de la dieta.
Los forrajeros de epífitas de pastos exhiben una variedad de formas y tamaños, los taxa que representan tienen diferente morfología funcional de sus partes bucales y exhiben una variedad de conductas de alimentación. La selectividad varía de acuerdo con la disponibilidad, abundancia, palatabilidad y valor del alimento. Estos organismos ocupan un intervalo específico del nicho de alimentación en las praderas de pastos al constituir un eslabón importante en esta trama trófica (Kitting, 1984; Kitting et al., 1984; Klumpp et al., 1989; Brawley, 1992). El forrajeo sólo ocurre en las partes distales de las hojas, en las cuales se encuentra una biomasa alta de epífitas y es más frecuente en hojas viejas que en jóvenes (Mazzella y Alberte, 1986). Sin embargo, el alimento no es un recurso limitante para los mesoherbívoros y aún durante periodos de abundancia de los forrajeros, la biomasa de éstos es baja con relación a la de las plantas donde esta puede ser de 1:160 (Nicotri, 1980; Arrontes, 1990).
La tasa de forrajeo del carideo H. zostericola sobre las epífitas de T. testudinum se observó de manera continua desde las primeras horas, lo cual se atribuye al periodo de ayuno, sin embargo los valores máximos de consumo fueron obtenidos en el periodo de obscuridad (Fig. 2). La tasa de forrajeo obtenida para H. zostericola fue 3.4 veces mayor que la tasa de forrajeo para P. pugio y 1.4 veces menor que la del anfípodo Cymadusa compta (Jerkanoff et al., 1996). Estos mesoherbívoros son cohabitantes de las praderas de pastos marinos del Atlántico tropical y las diferencias en la tasa de forrajeo son atribuibles a la demanda energética y fisiológica requerida para cada especie relacionada con la tasa de asimilación, de respiración y el nicho. La conducta de actividad de los mesoherbívoros es preferentemente nocturna al evitar la depredación visual (Orth, 1992).
Por otro lado, el número de excretas se relacionó directamente con la tasa de forrajeo, donde en el periodo de obscuridad se obtuvieron los valores más altos de forrajeo y el número de excretas. Lo anterior sugiere que tanto la tasa de forrajeo y la de excreción es continua (Fig. 2 y 3). La tasa de forrajeo presentó tres máximos con un intervalo promedio de 6 horas, mientras que para el número de excretas los valores máximos fueron a las 15, 18 y 21 horas lo cual sugiere que el tiempo de residencia del alimento se encuentra en el intervalo de 3 a 6 horas. Sin embargo, el incremento en la tasa de alimentación no necesariamente implica que ocurra una asimilación del mismo. Viejo y Arrontes (1992) observaron que para los anfípodos, se reduce la eficiencia digestiva como una consecuencia del poco tiempo de residencia intestinal. Peduzzi (1987) sugiere que los gasterópodos forrajean sobre Posidonia oceanica y remueven el 40% de la producción primaria de las epífitas. Las eficiencias de asimilación de los forrajeros tienen una tendencia similar, siendo las más altas para las epífitas con una complejidad morfológica menor (<70%) que para las macroepífitas (<20%).
Los forrajeros pueden tener un impacto significativo en la abundancia de las epífitas de pastos, pero la naturaleza de este impacto puede variar con el tiempo y el espacio y la densidad de herbívoros y epífitas (Jerkanoff y Nielsen, 1996). Las actividades de forrajeo reducen la mortalidad de los pastos, al mantener las hojas limpias de epífitas y de sedimento fino. Los mesoherbívoros tienen un papel central como controladores del crecimiento algal perifítico y como un vehículo de transferencia de energía de las epífitas a niveles de altos consumidores (Mazzarella et al., 1992; Llansó et al., 1998).
El carideo H. zostericola resultó ser una especie omnívora que forrajea sobre material vegetal, principalmente epífitas filamentosas y diatomeas. Es un componente dominante en cuanto a su abundancia en los substratos con VAS en la Laguna de Términos y en los principales sistemas estuarinos del Golfo de México mexicano, siendo un eslabón intermedio entre los productores primarios al proporcionar biomasa que es disponible para un gran número de peces juveniles residentes y transitorios que son consumidores de los ambientes de pastos marinos.
Agradecimientos
Los autores agradecemos la valiosa ayuda técnica en campo al técnico A. Reda así como a todo el personal de la estación "El Carmen" del Instituto de Ciencias del Mar y Limnología, UNAM.
Bibliografía
Alcoverro, T., C. M. Duarte y J. Romero, 1997. The influence of herbivores on Posidonia oceanica epiphytes. Aquatic Botany 56: 93-104. [ Links ]
Álvarez, F., A. J. Sánchez y L. A. Soto, 1996. Comparison of two nets as samplers of estuarine macrofauna in a tropical seagrass meadow. Revista de Investigaciones Marinas 17: 17-27. [ Links ]
Arrontes J., 1990. Diet food preference and digestive efficiency in intertidal isopods inhabiting macroalgae. Journal of Experimental Marine Biology and Ecology 139: 231-249. [ Links ]
Barba, M. E., 1995. Patrones de distribución de los carideos (CRUSTACEA: DECAPODA) de Laguna Madre, Tamaulipas y Laguna de Términos, Campeche en el suroccidente del Golfo de México. Tesis de Maestría en Biología de Sistemas y Recursos Acuáticos. Facultad de Ciencias, UNAM, México, 50 p. [ Links ]
Barba, M E., 1999. Variación de la densidad y la biomasa de peces juveniles y decápodos epibentónicos de la región central de Laguna Madre, Tamaulipas. Hidrobiológica 9(2): 101-114. [ Links ]
Brawley, S. H., 1992. Mesoherbivores pp. 235-363. En: D. M. John, S. J. Hawkins, J. H. Price, (Comps.). Plant-animal interactions in the marine benthos. Clarendon Press, Oxford. [ Links ]
Cannicci, S., F. Daddouh-Guebas, D. Anyona y M. Vannini, 1996. Natural diet and feeding habitats of Thalamita crenata (Decapoa: Portunidae). Journal of Crustacean Biology 16(4): 678-683. [ Links ]
Chace, F. A. Jr., 1972. The shrimps of the Smithsonian-Bredin Caribbean Expeditions with a summary of the West Indian shallow-water species (Crustacea: Decapoda: Natantia) Smithsonian Contributions to Zoology 98: i-x, 1-179. [ Links ]
Dugan, P. J., 1983. Seasonal and geographic distribution of seven decapod crustaceasn in Apalache Bay, Florida. Contributions to Marine Science 26: 65-79. [ Links ]
Escobar, B. E. G., 1984. Comunidades de macroinvertebrados bentónicos en la laguna de Términos, Campeche: composición y estructura. Tesis de Mestría. UACPyP-CCH. Universidad Nacional Autónoma de México. 191 p. [ Links ]
Escobar, B. E. G. y L. A. Soto, 1988. Trophic structure and energy flow in a tropical coastal macroinvertebrate comunity. Join Oceanographic Assembly. Abstracts. 32. [ Links ]
Holmlund, M. B., C. Peterson y M. E. Hay, 1990. Does algal morphology affect amphipod susceptibility to fish predation?. Journal of Experimental Marine Biology and Ecology 139: 65-83. [ Links ]
Jerkanoff, P., A. Brearley y J. Nielsen, 1996. Factors affecting grazerepiphyte interactions in temperate seagrass meadows. Oceanography and Marine Biology: an Annual Review 34: 109-162. [ Links ]
Jerkanoff, P. y J. Nielsen, 1996. The relative importance of amphipod and gastropod grazers in Posidonia sinuosa meadows. Aquatic Botany 56: 183-202. [ Links ]
Kitting, C. L., 1984. Selectivity by dense populations of small invertebrates foraging among seagrass blade surfaces. Estuaries 7A: 276-299. [ Links ]
Kitting, C. L., B. Fry y M. D. Morgan, 1984. Detection of inconspicuous epyphitic algae supporting food webs in seagrass meadows. Oecologia 62: 145-149. [ Links ]
Klumpp, D. W., R. K. Howard y D. A. Pollard, 1989. Trophodynamics of nutritional ecology of seagrass communities. pp. 394-457. En: A. W. D. Larkum, A. J. McComb y S. A. Shepherd (Comps.). Biology of seagrasses: a treatise on the biology of seagrasses with special reference to the Australian region. The Netherlands, Elsevier. [ Links ]
Klumpp, D. W., J. T. Salita-Espinosa y M. D. Fortes, 1992. The role of epiphytic periphyton and macroinvertebrate grazers in the trophic flux of a tropical seagrass community. Aquatic Botany 43: 327-349. [ Links ]
Llansó, R. J., S. S. Bell y F. E. Vose, 1998. Food habits of red drum and spotted seatrout in a restored mangrove impoundment. Estuaries 21(2): 294-306. [ Links ]
Mazzella, L. y R. S. Alberte, 1986. Light adaptation and the role of autrophic epiphytes in primary production of the temperate seagrass Zostera marina L. Journal of Experimental Marine Biology and Ecology 100: 165-180. [ Links ]
Mazella, L. y G. F. Russo, 1989. Grazing effect of two Gibbula species (Mollusca, Archaeogastropoda) on the epiphytic community of Posidonia oceanica leaves. Aquatic Botany 35: 357-373. [ Links ]
Mazzella, L., M. C. Buia, M. C. Gambi, M. Lorenti, G. F. Russo, M. B. Scipione y V. Zupo, 1992. Plant animal trophic relationships in the Posidonia oceanica ecosystem of the Mediterranean Sea. pp. 165-187. En: D. M. John, S. J. Hawkins, J. H. Price (Comps.). Plant-animal interactions in the marine benthos. Clarendon Press, Oxford. [ Links ]
Méndez, I., 1976. Comparación de medias de población. IIMAS-UNAM Comunicaciones Técnicas. Serie Azul: Monografías 3: (17) 39. [ Links ]
Minello, T. J. y R. J. Zimmerman, 1991. The role of estuarine habitats in regulatory growth and survival of juvenile penaeid shrimp. pp. 1-16. En: P. F. Deloach, W. J. Dougherty y M. A. Davidson (Comps.). Frontiers of shrimp research developments in aquaculture and fisheries Science. Elsevier Science Publishers. Amsterdam. [ Links ]
Morgan, M. D. y C. L. Kitting, 1984. Productivity and utilization of the seagrass Halodule wrightii and its attached epiphytes. Limnology and Oceanography 29: 1066-1076. [ Links ]
Negreiros-Fransozo, M. L., E. Barba, A. J. Sánchez, A. Fransozo y A. Raz-Guzmán, 1996. The species of Hippolyte Leach (Crustacea, Caridea, Hippolytidae) from Terminos Lagoon, southwestern Gulf of Mexico. Revista Brasileira de Zoología 13(3): 539-551. [ Links ]
Nicotri, M. E., 1977. Grazing effects of four marine intertidal herbivores on the microflora. Ecology 58: 1020-1032. [ Links ]
Nicotri, M. E., 1980. Factors involved in herbivore food preferences. Journal of Experimental Marine Biology and Ecology 42: 13-26. [ Links ]
Orth, R. J., 1992. A perspective on plant-animal interactions in seagrasses: physical and biological determinant influencing plant and animal abbundance. pp. 147-164. En: D. M. John, S. J. Hawkins y J. H. Price (Comps.). Plant-Animal Interactions in the Marine Benthos. Systematics Association Special Volume 46. Clarendon Press, Oxford. [ Links ]
Peduzzi, P., 1987. Dietary preferences and carbon absorption by two grazing gasteropods, Gibbula umbilicaris (Linne) and Jujubinus striatus (Linne). P. S. Z. N. I.: Marine Ecology 8359-370. [ Links ]
Raz-Guzmán, A., 1995. Caracterización trópica de los componentes dominantes de las comunidades bentónicas en Laguna de Términos, Campeche y en la plataforma continental adyacente. Tesis Doctoral. UACPyP-CCH. UNAM, México, 85 p. [ Links ]
Renfro, W. C., 1962. Small beam net for sampling postlarval shrimp. Galveston Biological Lab. June 30, 1962. U. S. Fisheries and Wildlife Services Circulation 161: 86-67. [ Links ]
Sánchez, A. J., 1997. Habitat preference of Penaeus duorarum Burkenroad (Crustacea: Decapoda) in a tropical coastal lagoon, southwest Gulf of Mexico. Journal of Experimental Marine Biology and Ecology 217(1): 107-117. [ Links ]
Sánchez, A. J., A. Raz-Guzmán y E. Barba, 1996. Habitat value of seagrasses for decapods in tropical coastal lagoons of the southwestern Gulf of Mexico: An overview. pp. 233-240. En: J. Kuo, R. C. Phillips, D. I. Walker y H. Kirkman (Comps.). Seagrass Biology: Proceedings of an International Workshop. Rottnest Island, Western Australia, 25-29 January 1996. [ Links ]
Sánchez, A. J. y A. Raz-Guzman, 1997. Distributional patterns of brachyuran crabs in the four greatest lagoon systems in the south-western Gulf of Mexico. Journal of Crustacean Biology 17(4): 173-184. [ Links ]
Sokak, R. R. y F. J. Rolhf, 1995. Biometry: The principles and practice of statistics in biological research. Third Edition, W. H. Freeman and Company, New York, 850 p. [ Links ]
Statistica, 1993. Statistica for Windows. Release 4.5 B. StatSoft Inc. [ Links ]
Van Montfrans, J., R. L. Wetzel y R. J. Orth, 1984. Epiphyte-grazer relationships in seagrass meadows: Consequences for seagrass growth and survival. Estuaries 7: 289-309. [ Links ]
Viejo, R. M. y J. Arrontes, 1992. Interactions between mesograzers inhabiting Fucus vesiculosus in northern Spain. Journal of Experimental Marine Biology and Ecology 162: 97-111. [ Links ]














