Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Hidrobiológica
versão impressa ISSN 0188-8897
Hidrobiológica vol.10 no.2 Ciudad de México Dez. 2000
Artículos
Obtención de una fracción con actividad gonadotrópica de la hipófisis de la tilapia Oreochromis niloticus (Osteichytes: Cichlidae)
Benjamín Ortíz López, Carmen Ramírez Estudillo y Rodolfo Cardenas Reygadas
Laboratorio de Histología, Unidad de Morfología y Función. ENEP Iztacala UNAM. Av. de los Barrios s/n, Los Reyes Iztacala, Tlalnepantla, Edo. de México. C. P. 54090. Fax: (525) 623-1155. E-mail: rodolf@servidor.unam.mx.
Recibido: 4 de abril de 2000
Aceptado: 14 de septiembre de 2000.
Resumen
Se aisló la hormona gonadotrópica a partir de hipófisis de la tilapia, por medio de cromatografía en Sephadex G-100. Se comprobó esto al observarse una banda por medio de electroforesis en geles de poliacrilamida. Una fracción presentó un patrón de movilidad electroforética similar al de la hormona folículo estimulante de mamíferos y su peso fue calculado en 32 000 Da. Posteriormente se comprobó que la molécula contenida en dicha fracción poseía actividad biológica por medio de un bioensayo con carpas machos y hembras, que presentaron un mayor desarrollo gonadal en comparación con gónadas de peces tratados con hormona luteinizante de mamífero, gonadolac y del grupo control.
Palabras clave: Hormonas gonadotropicas, Oreochromis, ovogénesis, espermatogénesis, ovario, testículo.
Abstract
Gonadothropic was isolated from pituitary of tilapia through out Sephadex G-100 chromatography and posterior comprobation by electrophoretic poliacrilamide gel. One fraction had similar electrophoretic mobility to follicle-stimulating hormone, and its molecular weight was calculated as 32 000 Da. Biological activity of the molecule on that fraction was tested through a bioassay with juvenile male and female carps, which gonadal development was more advanced compared with the gonadal development of the fish that were treated with luteinizing hormone of mammals, gonadolac and control group.
Key words:Gonadotrophic hormones, Oreochromis, oogenesis, spermatogenesis, ovary, testis.
Introducción
Las hormonas folículo estimulante (FSH) y luteinizante (LH) de mamífero fueron aisladas tempranamente en la historia de la endocrinología. Sin embargo, las hormonas equivalentes en peces han resultado más difíciles de aislar y caracterizar, y no fue sino hasta 1988 que quedó plenamente demostrada la presencia de dos tipos distintos de gonadotropinas en teleósteos (Suzuki et al. 1988a, Kawauchi et al, 1989, Naito et al. 1991), denominadas respectivamente GtH-I y GtH-II. Entre los métodos de aislamiento y purificación que se han desarrollado para estas hormonas están: cromatografía en columna (Sinha 1969), cromatografía de intercambio iónico (Donaldson y Yamazaki1968), cromatografía por afinidad (Idler y Ng 1979) y cromatografía líquida de alta resolución (Chang et al. 1990), además de combinaciones de estos métodos (Mañanós et al. 1997).
El objetivo del presente trabajo fue la obtención de una fracción con actividad gonadotrópica a partir de la hipófisis de tilapia.
Materiales y métodos
Las hipófisis fueron colectadas en el puerto de Alvarado, Veracruz, México, durante un año. La especie donadora fue la mojarra prieta Oreochromis niloticus, debido a que fue la única especie a la que se tuvo acceso gratuito y masivo. Durante la recolección de las glándulas no se tomó en cuenta el sexo, ni el estado de madurez de los organismos, considerando que debido a la selección que de ellos se realizaba por medio de las técnicas de captura, todos los organismos colectados estaban en etapas juvenil o adulta.
Las hipófisis frescas fueron fijadas inmediatamente en acetona a 4°C, y se mantuvieron bajo estas condiciones hasta su procesamiento y durante el mismo.
Las hipófisis fueron pesadas y posteriormente maceradas en acetona por medio de un homogenizador Tekmar mod. SDTV, en una proporción de 1 gramo de tejido húmedo por 3 ml de acetona.
El macerado se lavó con 20 volúmenes de una mezcla acetona-éter y se secó por 24 horas. Una vez seco se registró su peso.
Posteriormente, se agregó etanol al 40% con 6% de acetato de amonio, pH 6.0, en proporción 10 ml de etanol / 1 gramo de tejido. Esta mezcla se mantuvo en agitación por 24 horas. Después la mezcla fue centrifugada a 2500g durante 5 minutos y el sobrenadante recuperado.
A esta solución se le agregaron 3 volúmenes de etanol al 96% por goteo, con agitación constante y se dejó reposar por 24 horas. La solución fue centrifugada a 3000g durante 30 minutos con recuperación de la pastilla, la cual se lavó con tres volúmenes de éter y se centrifugó nuevamente a 2500g durante 30 minutos.
La pastilla fue suspendida en una solución de acetato de amonio 50mM a pH 5.5 y dialisada contra la misma solución durante 24 horas.
El contenido fue centrifugado nuevamente a 2500g por 30 minutos y se recuperó el sobrenadante, mismo que fue eluído en una columna de Sephadex G-100 de 60 cm y 1 cm de diámetro con 60 ml de acetato de amonio 0.1 M, a pH 8.5 a una velocidad de flujo de 1 ml/ 6 minutos colectandose 30 fracciones de 2 ml cada una (Sinha, 1969).
La cuantificación de proteínas se realizó de acuerdo al método de Lowry (1951), utilizando como patrón albúmina sérica de bovino.
Las fracciones que contenían proteínas fueron sujetas a electroforesis en geles de poliacrilamida al 10% a pH 7.1 y 8 mA en presencia de dodecyl-sulfato de sodio (SDS-page), y reducción con 1% de β-mercaptoetanol. Se utilizaron como patrones de referencia FSH de porcino (Sigma Chem. F-8001), LH de equino (Sigma Chem. L-2019) y BSA (Sigma Chem A-4378).
El bioensayo se basó en el método reportado por (Sundararaj y Goswami 1965, Sundararj y Donaldson 1972) con ligeras modificaciones. Se utilizaron 74 carpas juveniles con un peso entre 30-50 g. Se seleccionaron diez organismos al azar para formar el grupo con el objeto de establecer las condiciones iniciales de maduración gonadal. Los ejemplares fueron sacrificados justo al iniciar el experimento, se les disecaron las gónadas, se procesaron con la técnica histológica de rutina y se tiñeron con hematoxilina y eosina (H-E) (Luna 1968).
Otros ocho peces fueron testigo y no recibieron tratamiento alguno.
Los peces de otro grupo (n = ocho) fueron inyectados con 0.2 ml de acetato de amonio 0.1 M pH 8.5 que se utilizó como vehículo para disolver la hormona aislada, formando el grupo control.
Otros seis grupos de peces con ocho organismos cada lote, fueron sujetos a uno de los siguientes tratamientos: Extraco hipofisiario de mamífero (gonadolac, Laboratorio Gortie S. A.) a dosis de 10, ó 50 mg/kg (grupo gonadolac), LH de mamífero a dosis de 10. ó 50 mg/kg (grupo LH), y la fracción con actividad gonadotropica obtenida a partir de tilapia (O-GtH) a dosis de 10, ó 50 mg/kg (grupo O-GtH).
Antes de iniciar el experimento los peces fueron sometidos a una semana de aclimatación, durante la cual, así como durante el experimento, las condiciones fueron controladas a una temperatura de 20°C y un fotoperíodo de 12 horas luz, 12 horas de oscuridad. Las carpas fueron alimentadas ad libitum con alimento comercial balanceado y mantenidas con aireación constante. Durante 40 días los organismos de los grupos testigo, gonadolac, LH y O-GtH fueron inyectados intraperitonealmente (ip) en 20 ocasiones con intervalos de 48 horas entre cada inyección, por medio de una jeringa insulínica del # 26, durante los meses de marzo, abril y mayo. En todas las ocasiones las soluciones fueron preparadas justo antes de ser administradas.
Todos los organismos fueron sacrificados un día después de la última inyección. Los organismos fueron pesados, decapitados y las gónadas disecadas, pesadas y se tomaron muestras de las regiones anterior, media y posterior para ser sometidas a procesamiento histológico de rutina, con tinción de hematoxilina y eosina (Luna 1968).
Los cortes fueron revisados en un microscopio óptico para identificar los tipos celulares presentes y determinar en base a estos, el grado de desarrollo gonadal.
Resultados
De 30 g de hipófisis en peso húmedo de Oreochromis se obtuvo 1.742 g en peso seco. Después del aislamiento en sephadex se registraron 25.2 mg de proteína.
Tres picos de proteína se detectaron a lo largo de las diferentes fracciones, y fueron denominados alternativamente A, B y C, respectivamente (Fig. 1).

El pico B comprendió de las fracciones 17 y 18 y la concentración total de proteínas de estas fracciones fue de 544 μg/ml. Su migración electroforética fue similar a la FSH y la LH y su peso molecular fué calculado en 32 000 Da, por esta razón se decidió utilizar el pico B para el bioensayo.
Los resultados del bioensayo mostraron que el tratamiento más efectivo fue con 50 mg/kg de peso corporal de la proteína incluida en el pico B, puesto que en los cortes tanto de ovario como testículo de los peces sometidos a este tratamiento se observó la presencia de células en etapas más avanzadas de la gametogénesis respecto a los otros tratamientos (Figs. 2, 3, 4, Tabla I).
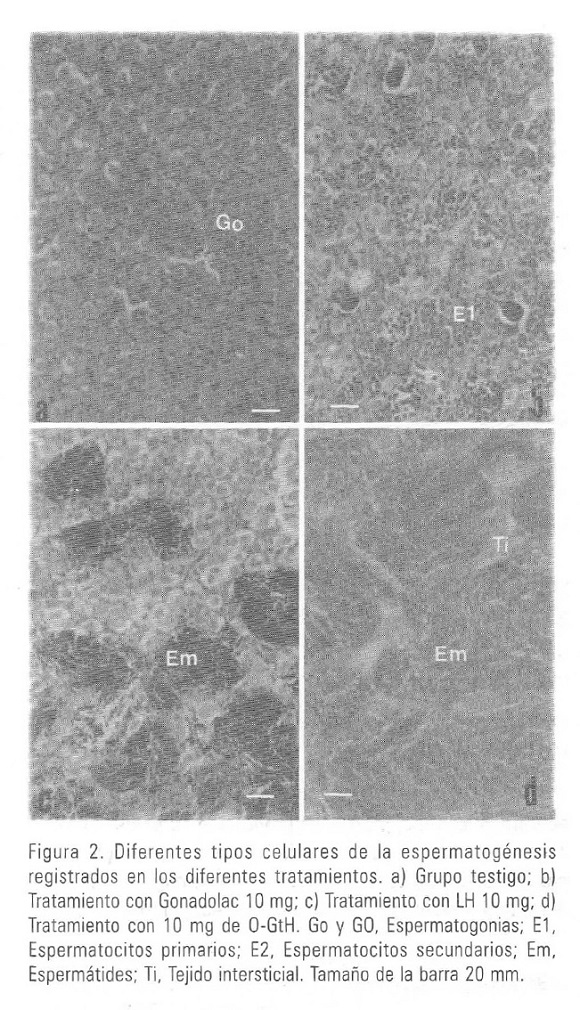

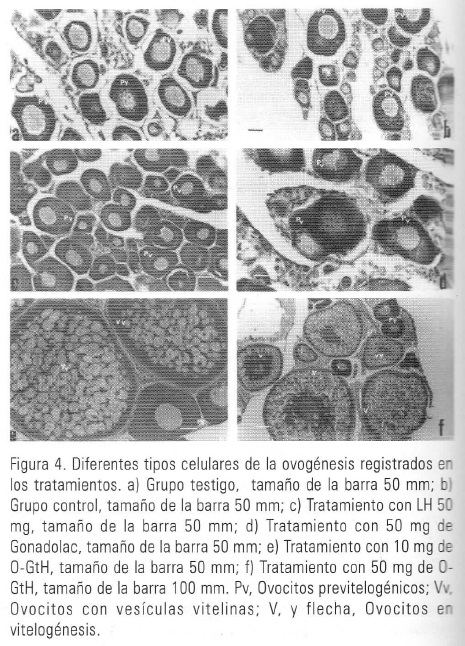
Los cortes histológicos evidenciaron que en los organismos de ambos sexos pertenecientes a los grupos testigo (Fig. 2a) y control (Figs. 3a, 4a, 4b.) no se presentaron etapas de maduración gonadal, encontrándose sólo espermatogonias, en el caso de los machos y ovocitos en etapas previtelogénicas en el caso de las hembras.
Un caso similar fue para el grupo de condiciones iniciales de madurez gonádica, aunque en este lote de organismos sólo se contó con la presencia de machos debido a que la selección de los organismos fue realizada al azar como se indicó en la metodología.
Las hembras tratadas con extracto hipofisiario de mamífero para ambas dosis (10, y 50 mg/kg) no presentaron avance en la ovogénesis , pues en los cortes de ovario ovocitos previtelogénicos fueron encontrados (Fig. 4d, Tabla I).
Para los machos que constituían este grupo, un estado de avance en la espermatogénesis fue detectado al presentarse una proporción de espermatocitos primarios a una concentración de 10 mg/kg (Fig. 2b, Tabla I), proporción que se ve incrementada en los machos que fueron tratados con 50 mg/kg (Fig. 3b, Tabla I).
Los peces inyectados con LH de mamífero a dosis de 10 mg/kg, en el caso de los machos mostraron la presencia de espermatogonias, espermatocitos primarios y espermatocitos secundarios (Fig. 2c, Tabla I), mientras que las hembras no manifestaron diferencias con respecto a los grupos descritos anteriores.
Con la inyección de LH de mamífero a dosis de 50 mg/kg, los machos presentaron menos espermatogonias, y una mayor proporción de espermatocitos primarios y secundarios e incluso algunas espermátides (Fig. 3c, Tabla I). Para las hembras sometidas a esta dosis, tampoco se registraron variaciones en el tipo celular, con respecto a los grupos anteriores (Fig. 4c, Tabla I).
Los peces tratados con la fracción que presentó actividad gonadotrópica, registraron mayores fases de maduración de las gónadas. En el caso de machos, no se registraron espermatogonias en los cortes y una mayor abundancia de espermátides se observó, siendo ello más evidente en los machos inyectados con dosis de 50 mg/kg (Fig. 4e, Tabla I), y de algunos ovocitos en etapas de vitelogénesis para dosis de 50 mg/kg fueron evidentes (Fig. 4f, Tabla I).
Discusión
La cantidad de gonadotropina presente en la fracción activa en este trabajo, a un costo relativamente bajo, fue equiparable a la obtenida por otros autores con procesos de purificación similares (Burzawa-Gerard 1971, Donaldson y Yamazaki 1972).
Otras técnicas con mayores recursos tecnológicos como la cromatografía líquida de alta resolución, permiten obtener mejores rendimientos (Suzuki et al. 1988a, Chang et al. 1990, Naito et al. 1991, Mañanós et al. 1997) aunque implican una gran inversión en equipo.
Para el género Oreochromis se ha reportado la presencia de un sólo tipo de hormona gonadotrópica correspondiente a la denomina GtH-II o maduracional (Naito et al. 1991). En el presente trabajo se aisló sólo un tipo de gonadotropina y su peso molecular es similar al reportado para otras gonadotropinas de teleósteos (Donaldson y Yamazaki 1972, Jollés et al. 1977, Idler y Ng 1979, Mañanós et al. 1997), y aunque entre los vertebrados las gonadotropinas de teleósteos y mamíferos son las que menor grado de homología presentan, esta relación continúa siendo importante (Kawauchi et al. 1989), y el obtener una migración electroforética y por lo tanto un peso molecular similar al de la FSH y la LH, constituyen elementos para considerar que el material aislado corresponde a esta clase de hormona.
El tratamiento más efectivo fue con 50 mg/kg de peso corporal de la hormona de Oreochromis, seguido del grupo tratado con 10 mg7kg de peso corporal de la misma hormona, al presentar etapas más avanzadas de la gametogénesis en ambos tipos de gónadas, comparados con los otros grupos. Ambos tratamientos promovieron mayor diferenciación de la gametogénesis tanto en machos como hembras, con un mayor número de espermátides en las cortes de testículo en ambos grupos y ovocitos en etapa de vesículas vitelinas en ambos tratamientos, e incluso inicio de vitelogénesis cuando se aplicó a las hembras en dosis de 50 mg/kg. El segundo mejor tratamiento aunque distante en resultados cualitativos con respecto al de la hormona purificada, fue el de 50 mg/kg de peso corporal de LH, seguido nuevamente, en cuanto a efectividad se refiere, a la aplicación de la misma sustancia en concentraciones de 10 mg/kg de peso corporal, lo cual concuerda con datos reportados por diversos autores (Sundararaj y Anand 1971, Kawauchi et al. 1989), en el sentido de que, de las hormonas de mamífero, la LH resulta más efectiva en la estimulación de la gametogénesis. Sin embargo, la estimulación de la gametogénesis sólo se observó en machos que sí presentaron fases más avanzadas de la espermatogénesis con respecto de los grupos de condición inicial, control y testigo.
Esta adaptación metodológica puede constituirse como una valiosa herramienta con aplicación directa a la investigación en las diversas especies de peces tropicales, o con fines de acuacultura.
Literatura citada
Burzawa-Gerard, E., 1971. Purification d'une hormone gonadotrope hypophysaire de poisson téléostéen, le carpe (Cyprinus carpio L.) Biochimie 53: 545-552. [ Links ]
Cárdenas L. M., 1998. Purificación de hormona folículo estimulante de origen equino para inducir el estro en vacas. Tesis de Licenciatura en Biología. ENEP Iztacala, Universidad Nacional Autónoma de México, México. 50 p. [ Links ]
Chang, Y. S., C. J. Huang, F. L. Huang y T. B. Lo, 1990. Purification, characterization, and molecular cloning of gonadotropin subunits of silver carp Hypophthalmycthys molitrix. General Comparative Endocrinology 78: 23-33. [ Links ]
Donaldson, M. E. y F. Yamazaki, 1968. The effects of partially purified salmon pituitary gonadotropin on spermatogenesis, vitellogenesis and ovulation in hipophysectomized goldfish, Carassius auratus. General Comparative Endocrinology 11: 292-299. [ Links ]
Donaldson, M. E. y F. Yamazaki, 1972. Preparation of gonadotropin from salmon Oncorhynchus tshawytscha pituitary glands. General Comparative Endocrinology 18: 469-481. [ Links ]
Idler, R. D. y T. B. Ng, 1979. Studies on two types of gonadotropins from both salmon and carp pituitaries. General Comparative Endocrinology 38: 421-440. [ Links ]
Jollés, J., E. M. Burzawa y Y. A. Fontaine, 1977. The evolution of gonadotropins: some molecular data concerning a non-mammalian pituitary gonadotropin, the hormone from a teleost fish Cyprinus carpio L. Biochimie 59: 893-898. [ Links ]
Kawauchi, H., K. Suzuki, H. Itoh, P. Swanson, N. Naito, Y. Nagahama, M. Nozaki, Y. Nakai y S. Itoh, 1989. The duality of teleost gonadotropins. Fish Physiology Biochemistry 7: 29-38. [ Links ]
Lowry, O. H., N. J. Roserough, A. L. Far y R. J. Rondall, 1951. Protein measurement with the phenol reagent. Journal of Biological Chemistry 193: 265-275. [ Links ]
Luna, L. G., 1968. Manual histologic staining methods of the Armed Forces. Institute of Pathology. Mc. Graw Hill, Nueva York. 258 p. [ Links ]
Mañanós, E. L., P. Swanson, J. Stubblrfield y Y. Zohar, 1997. Purification of gonadotropin II from a teleost fish, the hybrid striped bass, and development of a specific enzyme-linked inmunosorbent assay. General Comparative Endocrinilogy 108: 209-222. [ Links ]
Naito, N., S. Hyodo, N. Okumoto, A. Urano y Y. Nakay, 1991. Diferential production and regulation of gonadotropins GtH I y GtH II in the pituitary gland of rainbow trout Oncorhynchus mykiss, during ovarian development. Cell Tissue Research 266: 457-467. [ Links ]
Sinha, V. R. P., 1969. Chromatography of fish pituitary extracts on Sephadex G-100. Journal Chromatography 44: 624-628. [ Links ]
Sundararaj, B. I. y S. V. Goswami, 1965. Seminal vesicle response of intact, castrate and hypophysectomized cat fish, Heteropneustes fossilis. (Bloch). To testosterone propionate, prolactin and growth hormone. General Comparative Endocrinology 5: 464-474. [ Links ]
Sundararaj, B. I. y T. C. Anand, 1971. Effects salmon pituitary gonadotropin, Ovine luteizing hormone, and testosterone on the testes and seminal vesicles of hypophysectomized Catfish Heteropneustes fossilis (Bloch). General Comparative Enocrinology 17: 73-82. [ Links ]
Sundararaj, B. I. y E. M. Donaldson, 1972. Effects of partially purified salmon pituitary gonadotropin on ovarian maintenance, ovulation, and vitellogenesis in the hypophysectomized catfish Heteropneustes fossilis (Bioch). General Comparative Endocrinology 18: 102-114. [ Links ]
Suzuki, K., Y. Nagahama y H. Kawauchi, 1988a. Isolation and characterization of two distinct gonadotropins from chum salmon pituitary glands. General Comparative Endocrinology 71: 292-301. [ Links ]
Suzuki, K. y H. Kawauchi, 1988b. Isolation and characterization of subunits from two distinct salmon gonadotropins. General Comparative Endocrinology 71: 302-306. [ Links ]














