Introducción
Los lagos urbanos son a menudo ecosistemas creados por el hombre y, en varios casos, son el resultado de las actividades de excavación para proporcionar materiales de construcción para el desarrollo residencial, el sistema de caminos y los pasillos (Naselli-Flores, 2008). Estos ecosistemas son una de las características del paisaje que contribuyen significativamente al aumento de la calidad de vida en los centros urbanos, al brindar actividades recreativas y educativas e incluso a mitigar el clima urbano (Martínez-Arroyo & Jáuregui, 2000). Son ecosistemas de tamaño relativamente pequeño que generalmente están dentro de parques y cumplen una función de recreación, lo que ha provocado que el proceso de eutrofización en estos ecosistemas se vea incrementado notablemente como resultado de gran incorporación de nutrientes y materia orgánica disuelta y particulada (Birch & McCaskie, 1999), lo que trae como consecuencia que alberguen diversos hábitat, pero en su manejo se presentan muchos problemas por su condición ambiental (Almanza-Marroquín et al., 2016).
Como regla general, los ecosistemas acuáticos menores de 10 hectáreas (pequeños) y poco profundos tienen una menor capacidad de recuperación en comparación con los grandes y profundos cuerpos de agua. Por lo tanto, los lagos urbanos son más sensibles a la contaminación del agua y los procesos de eutrofización. Además, como ecosistemas creados por el hombre, son llenados con aguas residuales tratadas, o bien con agua potable, propiciando condiciones ecológicas especiales que permiten el desarrollo de algunas especies no deseables (Elías-Fernández et al., 2006; Jurczak et al., 2019; López-Mendoza et al., 2015; Schueler & Simpson, 2001).
Las condiciones ecológicas de los lagos urbanos permiten el desarrollo de algunas especies de plantas y animales, y dentro de este último se encuentra el zooplancton, el cual juega un papel importante en el ecosistema acuático al realizar varias funciones vitales dentro de estos sistemas, las cuales incluyen: transferir energía de productores a consumidores primarios y secundarios, remover el fitoplancton de la columna de agua y actuar como bioindicadores de las condiciones del medio acuático; por lo que la composición y abundancia no es constante en el tiempo, sino que varía en respuesta a los cambios ambientales y las caraterísticas bióticas del ecosistema (Dodson et al., 2000; Sree & Shameem, 2017; Yang et al., 2017).
Por lo tanto, es importante generar conocimiento ecológico del zooplancton en estos ecosistemas urbanos, por lo que este trabajo tiene el propósito de analizar la composición y abundancia del zooplancton de dos lagos urbanos de importancia ecoturistica que se localizan en Cuernavaca, Morelos, México: Jardín Borda (JB) y Parque Alameda de la Solidaridad (PAS) y su relación con algunas variables físicas y químicas del agua para una mejor planeación y un manejo eficiente de este recurso acuático.
Materiales y métodos
Los lagos urbanos Jardín Borda (JB) y Parque Alameda Solidaridad (PAS) se ubican dentro del municipio de Cuernavaca (18° 49' 07´´ LN; 99° 10´ 03´´ LO) a 1510 m.s.n.m. (Garcia-Rodríguez et al., 2015). El lago JB posee una extensión de 0.4 hectáreas y 1.30 m de profundidad, y es llenado con agua potable proveniente del municipio. El lago PAS tiene una superficie de 0.14 hectáreas y 1.20 m de profundidad, y se le suministra agua tratada de la planta de tratamiento de aguas municipales que se encuentra dentro del parque.
Para realizar este estudio, se recolectaron muestras mensuales de noviembre de 2014 a mayo de 2015, y debido al tamaño pequeño de estos ecosistemas se estableció una sola estación de monitoreo para la toma de muestras biológicas y del agua, siguiendo el criterio de Thornton (1990).
En cada lago se midió la transparencia (cm) por medio del disco de Secchi, temperatura del aire y del agua (ºC), pH, sólidos disueltos totales (STD ppm) y conductividad eléctrica (µS/cm) con un multiparamétrico marca HANNA Combo. La determinación del oxígeno disuelto (O2 mg/l), bióxido de carbono (CO2 (mg/l), dureza total (DT mg CaCO3/l) y alcalinidad total (Alc mg CaCO3/l) se determinaron mediante técnicas colorimétricas (Rice et al., 2012). Mediante una prueba t-student o ANOVA de una vía (previa comprobación de los supuestos de normalidad y homocedasticidad para su aplicación, o de lo contrario, una prueba de U de Mann-Whitney o Kruskal-Wallis) (Daniel, 1991), se determinó si hubo diferencias significativas (p < 0.05) entre las variables fisicoquímicas analizadas.
Las muestras del zooplancton se obtuvieron en la zona pelágica con la ayuda de una red cónica de luz de malla de 60 μm hasta filtrar aproximadamente 60 litros. Las muestras se preservaron con solución de formol al 4% para su posterior análisis en el laboratorio.
La identificación taxonómica se realizó con la ayuda de literatura especializada (Elías-Gutiérrez & Valdez-Moreno, 2008; Elías-Gutiérrez et al., 2008; Pennak, 1978; Smirnov, 1974; Thorp & Covich, 2010). Para la estimación de la abundancia del zooplancton se colocó 1 ml de muestra en una cámara Sedgwick-Rafter, los conteos se efectuaron tomando tres transectos al azar con apoyo de un microscopio óptico Olimpus CX 31; los organismos se reportaron en organismos por litro y el conteo se realizó por triplicado. Para jerarquizar la dominancia de las especies se construyó un diagrama de Olmstead-Tuckey (Sokal & Rohlf, 1981). Para determinar la diversidad de especies dentro de los sistemas acuáticos, se utilizó el índice de Shannon-Weiner (Moreno, 2001). Para relacionar el comportamiento físico y químico del agua con las especies se realizó un análisis de redundancia (RDA), el cual busca para dos grupos de variables las combinaciones lineales en un grupo que maximicen la varianza explicada del otro por dicha combinacion lineal (Carmona, 1988). El análisis se llevó a cabo utilizando los programas Statgraphic Centurion versión16 (2015) y Past versión 4.08 (Hammer et al., 2001).
Resultados
Los resultados obtenidos de los parametros físicos y químicos se muentran en la Tabla 1. La transparencia para el lago JB registró el valor máximo en marzo (26 cm) y el mínimo en abril (10 cm), con un promedio de 20 cm ± 5.7 cm. Para el lago PAS los valores fluctuaron entre los 10 cm y 80 cm, en marzo y febrero respectivamente (promedio 38 ± 20.84). Se registraron diferencias estadísticamente significativas (p < 0.05) de manera temporal. Los valores mayores de temperatura en este estudio fueron registrados en marzo para el lago JB y en abril para el lago PAS, con 25.9 °C en ambos casos, mientras que la temperatura mínima se obtuvo en enero para ambos lagos con 18.2 °C (JB) y 20.4 °C (PAS) (promedios de 22.8 ± 2.70 y 23.7 ± 2.10, respectivamente). No se detectaron diferencias estadísticamente significativas (p > 0.05) entre los lagos.
Tabla 1 Registro de los parámetros físicos y químicos de las condiciones del agua durante el periodo de estudio para ambos lagos.
| Nov | Dic | Ene | Feb | Mar | Abr | May | Media | Desv | ||
| Transparencia (cm) | JB | 15 | 23 | 20 | 25 | 26 | 10 | 20 | 20 | 5.70 |
| PAS | 34 | 36 | 40 | 80 | 10 | 33 | 35 | 38 | 20.84 | |
| Temperatura (°C) | JB | 22.9 | 22.5 | 18.2 | 20.6 | 25.9 | 25.1 | 24.5 | 22.8 | 2.70 |
| PAS | 23.8 | 22.1 | 20.4 | 22.6 | 25.4 | 25.9 | 25.7 | 23.7 | 2.10 | |
| Oxígeno disuelto (mg/l) | JB | 4.6 | 7.8 | 8.6 | 5.1 | 2.2 | 8.4 | 3.8 | 5.8 | 2.50 |
| PAS | 6.6 | 8.6 | 11 | 10.1 | 9 | 12 | 9.8 | 9.6 | 1.75 | |
| pH | JB | 9.4 | 9.8 | 8.9 | 9.3 | 9.6 | 9.5 | 9.4 | 9.4 | 0.28 |
| PAS | 9.5 | 9.8 | 9.5 | 9.2 | 8.8 | 9.2 | 9.6 | 9.4 | 0.33 | |
| Conductividad eléctrica (μS/cm) | JB | 135 | 148 | 142 | 150 | 157 | 84 | 154 | 139 | 25.17 |
| PAS | 393 | 374 | 339 | 373 | 347 | 360 | 347 | 362 | 19.19 | |
| Sólidos totales disueltos (mg/l) | JB | 72 | 74 | 71 | 78 | 75 | 43 | 76 | 70 | 12.08 |
| PAS | 175 | 185 | 172 | 182 | 173 | 179 | 174 | 177 | 4.95 | |
| Dureza total (mg CaCO3/l) | JB | 27 | 28 | 44 | 90 | 82 | 104 | 138 | 73 | 41.91 |
| PAS | 29 | 30 | 32 | 66 | 38 | 176 | 150 | 74 | 62.27 | |
| Alcalinidad total (mg CaCO3/l) | JB | 18 | 19 | 17 | 15 | 18 | 18 | 19 | 18 | 1.38 |
| PAS | 32 | 78 | 35 | 11 | 31 | 22 | 49 | 37 | 21.57 |
Fuente: Elaboración propia.
Las concentraciones de oxígeno disuelto (O2) oscilaron entre 2.2 mg/l y 8.6 mg/l (promedio de 5.8 ± 2.5) para JB y de 6.6 mg/l a 12 mg/l (promedio 9.6 ± 1.8) en PAS. Existen diferencias estadísticamente significativas de manera mensual (p < 0.05). Cabe mencionar que el CO2 durante todo el periodo de estudio no se detectó en las muestras. El valor promedio de pH registrado en ambos lagos fue de 9.4 ± 0.28, lo que corresponde a aguas alcalinas, obervando diferencias estadísticas significativas entre lo lagos (p < 0.05). Los valores registrados de conductividad eléctrica fueron de 84 µS/cm en abril a 157 µS/cm en marzo (promedio 139 µS/cm ± 25.2 µS/cm) para JB y para el lago PAS fue de 339 µS/cm (enero) a 393 µS/cm (noviembre) (promedio 362 µS/cm ±19.19 µS/cm). Se registraron diferencias estadísticamente significativas entre ambos sistemas (p < 0.05).
Los resultados de los STD fueron menores en JB, con un intervalo de 43 mg/l en abril a 78 mg/l en febrero (promedio 70 ± 12.08), a diferencia del lago PAS en donde los valores fueron más altos, con un mínimo de 172 mg/l en enero y un máximo de 185 mg/l (promedio 177 ± 4.95) en diciembre. Se registraron diferencias estadísticamente significativas (p < 0.05). La DT en el lago JB exhibió un intervalo de 27 mg CaCO3/l (noviembre) a 138 mg CaCO3/l (mayo) (promedio 73 mg ± 41 mg CaCO3/l), mientras que los resultados en PAS fueron de 29 mg CaCO3/l (noviembre) a 176 (abril) mg CaCO3/l (promedio de 74 mg CaCO3/l ± 62.3 mg CaCO3/l). No se registraron diferencias estadísticamente significativas (p > 0.05) entre ambos sistemas. La alcalinidad total registró valores bajos en el lago JB entre 15 mg CaCO3/l a 19 mg CaCO3/l (promedio 18 ± 1.4), a diferencia del lago PAS en donde se observó mayor fluctuación, con un valor mínimo de 11 mg CaCO3/l (febrero) y máximo de 78 mg CaCO3/l (diciembre) (promedio 37 ± 21.6). Se registraron diferencias estadísticamente significativas (p < 0.05) entre ambos sistemas acuáticos.
Durante el periodo de estudio se registraron 17 taxa: 13 rotíferos, que representaron el 76.47% de la riqueza, dos cladóceros y dos copépodos (11.76% cada uno). Se determinaron siete especies comunes para ambos lagos, seis rotíferos (Brachionus calyciflorus, Brachionus havanaensis, Keratella americana, Polyarthra dolichoptera, Trichocerca sp y Filinia longiseta) y un cladócero (Moina cf. micrura). Los rotiferos Asplanchna girordi, Proales sp. y Horaella sp., el cladocero Diaphanasoma cf. brachyurus y el copépodo Mastigodiaptomus albuquerquensis fueron especies exclusivas del lago JB, mientras que los rotíferos Asplanchna sieboldi, Brachionus quadridentatus, Cephallodela sp. Hexarthra intermedia y el copépodo Thermocyclops tenuis fueron registradas únicamente en el lago PAS. Entre los rotíferos predominaron las especies de los géneros Asplanchna y Brachionus con dos y tres taxa respectivamente (Tabla 2).
Tabla 2 Especies del zooplancton presentes en el lago del Jardín Borda y del Parque Alameda.
| CLASE | ORDEN | FAMILIA | ESPECIE | JB | PAS |
| Eurototaria | Ploimida | Asplanchnidae | Asplanchna girodi De Guerne, 1888 | 1 | 0 |
| Asplancha sieboldi Leydig, 1854 | 0 | 1 | |||
| Brachionidae | Brachionus calyciflorus Pallas 1766 | 1 | 1 | ||
| Brachionus havanaensis Rousselet, 1911 | 1 | 1 | |||
| Brachionus quadridentatus Hermann, 1783 | 0 | 1 | |||
| Keratella americana Carin, 1943 | 1 | 1 | |||
| Synchaetidae | Polyarthra dolichoptera Ideson, 1925 | 1 | 1 | ||
| Trichocercidae | Trichocerca sp Lamarck, 1801 | 1 | 1 | ||
| Notommatidae | Cephallodela sp. Bory de St. Vincent, 1826 | 0 | 1 | ||
| Proalidae | Proales sp Gosse, 1886 | 1 | 0 | ||
| Flosculariaceae | Hexarthridae | Hexarthra intermedia (Wiszniewski, 1929) | 0 | 1 | |
| Filinidae | Filinia longiseta (Erenberg, 834) | 1 | 1 | ||
| Trochosphaeridae | Horaella sp. Donner, 1949 | 1 | 0 | ||
| Branchiopoda | Diplostraca | Moinidae | Moina cf. micrura Kurz, 1874 | 1 | 1 |
| Sididae | Diaphanosoma cf. brachyurum (Lièvin, 1848) | 1 | 0 | ||
| Maxillopoda | Calanoida | Diaptomidae | Mastigodiaptomus albuquerquensis (Herrick, 1895) | 1 | 0 |
| Cyclopoida | Cyclopoidae | Thermocyclops tenuis (Marsh, 1909) | 0 | 1 |
Nota. 1 = Presencia; 0 = Ausencia.
Fuente: Elaboración propia.
Respecto a la abundancia del zooplancton en ambos lagos, se registraron valores mayores en abril, mientras que los mínimos fueron observados en marzo para JB y en diciembre para PAS (Figura 1).

Fuente: Elaboración propia.
Figura 1 Comparación de la abundancia del zooplancton en ambos lagos urbanos.
Con base en el diagrama de Olmstead-Tuckey, para el lago JB se reportan como especies dominantes a M. albuquerquensis, D. cf. Brachyurum, M. cf. micrura y K. americana, mientras que para PAS las especies dominantes fueron M. cf. micrura, K. americana, Trichocerca sp, y B. havanaensis, especies registradas casi durante todo el estudio. Las especies constantes no se registraron para el lago JB, en tanto que para el lago PAS fueron F. longiseta y P. dolichoptera. En el lago JB se registró a B. havanaensis como especie ocasional y para PAS a T. tenuis. Asimismo, para el lago JB se observaron cinco especies consideradas como raras (Horaella sp, A. girodi, F. longiseta, Proales sp y B. calyciflorus), así como para el lago PAS (H. intermedia, A. sieboldi, B. quadridentatus, Cephalodella sp y B. calyciflorus).
El comportamiento del índice de diversidad mostró una tendencia a incrementar hacia el final del estudio, con registro de temperaturas mayores de 22 °C. En los dos lagos urbanos se observó un patrón con bajos valores de diversidad específica, principalmente en PAS durante el período seco, con valores entre 0.1 y 1.4 (Figura 3).

Fuente: Elaboración propia.
Figura 3 Variación del índice de diversidad para los lagos urbanos de Cuernavaca, Morelos.
De los resultados obtenidos con el análisis de redundancia (RDA) en el lago JB, se alcanzó un 5.086% de varianza explicada con los dos primeros componentes. En el eje 1, que incluye el 4.98% de la varianza, se presentan los meses correspondientes a la temporada de estiaje frío (diciembre, enero y febrero) y se relacionan con la conductividad y los sólidos disueltos. El eje 2 representó el 0.09% de la varianza, en el cual se incluyen los meses del fin de la temporada de estiaje frío (marzo) e inicio del periodo cálido (abril y mayo) y relacionó de manera directa al zooplancton con el pH y la alcalinidad, y de manera inversa con la transparencia, la temperatura del agua y el oxígeno disuelto (Figura 4). Si se considera el tercer eje, la varianza explicada es del 97.57%. En este análisis, el R2 fue de -0.42%.
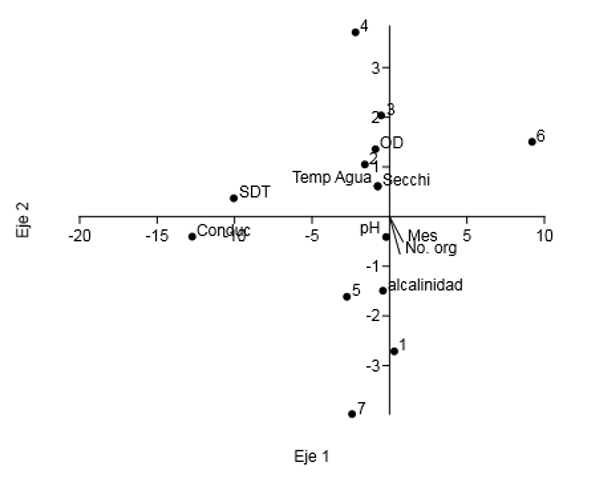
Fuente: Elaboración propia.
Figura 4 Análisis de redundancia del conjunto de características físicoquímicas y la abundancia del zooplancton del lago del Jardín Borda (JB).
Para el lago PAS, los resultados del RDA indican que con los dos primeros componentes se obtiene el 59.37% de la varianza explicada. El eje 1 incluye el 45.9% de la varianza, en el cual se presentan los meses de la temporada de estiaje frío (noviembre, diciembre y febrero), y se relaciona con las variables como alcalinidad y conductividad, la cual tiene poca influencia con el zooplancton. El eje 2 exhibió el 13.6% de la varianza, representado por los meses de la temporada de estiaje cálido (marzo y abril), así como con el mes de mayo (inicio de lluvias) y en el que se presenta mayor influencia entre el zooplancton con la temperatura del agua, oxígeno disuelto, transparencia y pH, similar al comportamiento del lago Borda (Figura 5). Sin embargo, el valor de R2 fue de 0.593%.
Discusión
Un aspecto fundamental de los sistemas acuáticos son las características físicas y químicas del agua que generalmente ayudan a la interpretación de la capacidad productiva de los recursos acuáticos y su comportamiento en el tiempo y el espacio que inciden en las condiciones bióticas (Díaz-Vargas et al., 2005). El nivel de la profundidad y el volumen de agua de los lagos urbanos depende, entre otros aspectos, de la época de lluvias, la tasa de evaporación durante la temporada de estiaje, la sustracción de agua por medio de pipas para el riego de las áreas verdes dentro del parque durante la época de estiaje y el abastecimiento de agua tratada aportada por las plantas de tratamiento, como es mencionado por Gómez-Márquez et al. (2013a) para el lago urbano de la Alameda Oriente.
Generalmente, carecen de regulación (contaminación difusa), como ha sido reportado para otros lagos urbanos por Elías-Fernández et al. (2006) y López-Mendoza et al. (2015), lo que resulta en el deterioro del valor ecológico de estos entornos; transformándolos en un riesgo potencial para la salud humana, y pueden llegar a convertirse en un riesgo por la presencia de floraciones tóxicas, así como por altas concentraciones de bacterias (Cisterna-Osorio & Pérez-Bustamante, 2019; Verma et al., 2011), requiriendo costosos planes de gestión y restauración.
La temperatura constituye un factor clave para determinar las tasas reproductivas del zooplancton, en particular de los rotíferos, estableciendo que el intervalo de temperaturas entre 15 ºC a 20 ºC es óptimo para la reproducción de este grupo (Gómez-Márquez et al., 2013b; Havens & Beaver, 2011), lo que coincide con la temperatura promedio registrada en ambos ecosistemas del presente estudio, así como también lo citan Almanza-Marroquín et al. (2016).
La concentración del oxígeno disuelto es uno de los indicadores más importantes de la calidad del agua, la cual refleja en general la salud de los sistemas acuáticos, y este no debería bajar del 80% de saturación (superior al 5.0 mg/l) para poder mantener un cierto nivel de diversidad zooplanctónica (Amado et al., 2016). En el presente estudio en ambos lagos se obtuvieron promedios de O2 de 5.8 mg/l (JB) a 9.6 mg/l (PAS), lo que coincide con lo expuesto anteriormente, y apoyado por Gómez-Márquez et al. (2013b).
En las aguas naturales y residuales el valor del pH está en el intervalo de 6.0 a 9.0 unidades, y estos valores son los adecuados para la actividad biológica de los ecosistemas (Arredondo & Ponce, 1998; Muñoz et al., 2018). Aunque el zooplancton existe bajo un amplio intervalo de condiciones ambientales, muchas especies son limitadas por el pH, O2 y otras variables físicas y químicas, las cuales permiten su distribución y abundancia (Ahmad et al., 2012; Mustapha, 2009). Durante el período de estudio ambos ecosistemas registraron agua alcalina (9.4), valores que son elevados a los valores óptimos para los organismos, aunque Mustapha (2009) menciona que el pH alcalino, acompañado de alta producción primaria, favorece el crecimiento y abundancia de los organismos en los reservorios. Con respecto a la conductividad eléctrica (CE), este es un factor importante que afecta la distribución del zooplancton. En el lago JB se registraron valores menores de CE, a diferencia del lago PAS, el cual presentó valores altos, rebasando los límites permisibles establecidos por el Diario Oficial de la Federación (DOF, 1989) para agua de uso agrícola. Sin embargo, se considera que son valores adecuados para la vida acuática.
Los valores de la dureza del agua indican que ambos lagos presentan aguas blandas a moderadamente duras, si se considera como límite para denominar a un agua como dura valores superiores a 120 mg/l de CaCO3 (Arredondo & Ponce, 1998; Julián-Soto, 2010); y con respecto a los valores de alcalinidad obtenidos, estos se encuentran dentro de los límites establecidos por la normatividad (DOF, 1989). Ambos ecosistemas acuáticos reciben aportes significativos tanto de nutrientes como de materia orgánica, originados por el arrastre de terrígenos durante la temporada de lluvias, por lo que es considerable su baja riqueza específica algal (Garcia-Rodríguez et al., 2015), pero no así su abundancia, la cual se encuentra dentro de los valores reportados por Almanza-Marroquín et al. (2016). Estos autores mencionan que los cambios estacionales de estos parámetros influyen en la variabilidad de las características limnológicas en cada lago durante el verano con el aumento en la temperatura promedio del agua, posiblemente la clorofila-a y la concentración de nutrientes, generando un efecto estacional en la dinámica de nutrientes y en su estado trófico, en gran medida por las características meteorológicas típicas de las estaciones en las zonas templadas y cálidas.
La comunidad zooplanctónica del presente estudio estuvo constituida por 17 taxa. De acuerdo con Pennak (1957), la composición taxonómica es característica de embalses someros, ya que recopiló información sobre la composición de zooplancton en 42 lagos someros en todo el mundo y registró que estos ecosistemas están constituidos de una a tres especies de copépodos, de dos a cuatro especies de cladóceros y entre tres y siete especies de rotíferos, similar al presente estudio. Esto también ha sido reportado para otros ecosistemas acuáticos eutróficos tropicales por Mustapha (2009), Granados-Ramírez & Álvarez-del-Ángel (2003), Gómez-Márquez et al. (2013b), Yang et al. (2017) y Razak & Sharip (2019).
En estos ecosistemas no es común encontrar más de una especie de copépodos y cladóceros, y si esto llega a suceder, una de ellas es más abundante que la otra (Pennak, 1957), lo cual se observó en el presente estudio, en donde el lago JB solo registró un género de copépodo y dos géneros de cladóceros, cada uno con una especie, en tanto que en el lago PAS se determinó un género para los copépodos y otro para los cladóceros. Similares resultados han sido reportados por Gómez-Márquez et al. (2013b).
De los nueve géneros de rotíferos reconocidos en el presente estudio, solo Brachionus se observó con dos especies en el JB y tres en el PAS. B. calyciflorus y B. havanaensis se observaron en ambos lagos, mientras que B. quadridentatus fue exclusivo de JB. De acuerdo con Sládecek (1983), la familia Brachionidae puede considerarse como altamente tolerante a ciertas concentraciones de contaminantes, así como a diversos factores ecológicos, además de ser un indicador de aguas α-mesosapróbicas y polisapróbicas (por la cantidad de materia orgánica donde viven los organismos). Granados-Ramírez et al. (2014) han registrado a B. calyciflorus en ambientes con altas concentraciones de fitoplancton, en materia orgánica e inclusive en ambientes hipertróficos. Gómez-Márquez et al. (2013b) mencionan que los rotíferos B. calyciflorus y B. quadridentatus son especies cosmopolitas que habitan en sistemas con aguas alcalinas, y Gannon & Stemberger (1978) consideran a B. quadridentatus como indicador de sistemas eutróficos.
Los rotíferos son considerados los organismos más importantes en los ambientes dulceacuícolas debido a su pequeño tamaño, así como por rasgos del ciclo de vida, los mecanismos de alimentación y el metabolismo, dándoles ventajas competitivas sobre los otros grupos principales de zooplancton, como cladóceros y copépodos, según lo citan Sampaio et al. (2002). Azma & Anis (2016) y Yang et al. (2017) mencionan que la dominancia numérica de los rotíferos en ambientes eutróficos ha sido ampliamente documentada; coincidentemente, en el presente estudio la composición zooplanctónica en los dos lagos mostró una mayor diversidad para los rotíferos, acompañados en menor grado por los cladóceros y copépodos, lo cual coincide con Mustapha (2009) y Gómez-Márquez et al. (2013b).
Umi et al. (2018) mencionan que la abundancia de los géneros Brachionus, Keratella y Trichocerca se relaciona con la condición eutrófica, la cual está asociada con la turbidez o la transparencia, los sólidos disueltos totales, la clorofila-a y la concentración de nutrimentos.
Fernando et al. (1990) describen al género Asplanchna como uno de los rotíferos más comunes en los ambientes acuáticos, ya que presenta amplia distribución y es un depredador del zooplancton en los sistemas lenticos templados y tropicales. Esparcia et al. (2001) clasifica a A. girodi como una especie epimetalimnética (por encima de la capa del metalimnion), con una tendencia hacia temperaturas más elevadas, superiores a los 13 °C. Granados-Ramírez & Álvarez-del-Ángel (2003) han registrado a Asplanchna en dos cuerpos de agua del estado de Morelos. Urabe (1989) y Pennak (1978) definen a A. sieboldi como organismo que se caracteriza por presentarse en aguas alcalinas con pH superiores a 7.0, con cierta concentración de materia orgánica. Por su parte, Sládecek (1983) comenta que esta especie es indicadora de sistemas oligosapróbicos a β-mesosapróbicos. Esta especie se registró en los meses de agosto con un pH de 8.3 y en febrero con un pH de 9.2 en el lago PAS, lo cual concuerda con lo registrado por Urabe (1989) y Pennak (1978). Con respecto a Filinia longiseta, Granados-Ramírez & Álvarez-del-Ángel (2003) mencionan que es una especie termófila, epilimnética (que se ubica en el epilimnio) y de ambientes estratificados, que ocurre en zonas subtropicales y tropicales (24 °C -28 °C), por lo que es considerada una especie euritérmica, ampliamente distribuida en ambientes temporales y permanentes.
Dentro de los cladóceros, las especies del género Diaphanosoma son consideradas como especies de aguas eutróficas y cálidas (Han et al., 2011). Yousuf & Qadri (1981) reportan que D. brachyurum es una especie de verano y prefiere el agua cálida con temperaturas mayores a 20 °C, pH mayor a 8.0 y con bajas o libres cantidades de CO2, condiciones que son reportadas en el lago JB, en donde se registró esta especie.
En el lago PAS solo se observó una especie de cladócero (M. cf. Micrura), la cual fue abundante, posiblemente, debido a que es una especie altamente tolerante, cosmopolita, con gran plasticidad morfológica y ecológica, registrada en todo el mundo, con la excepción de las regiones de clima frío (Goulden, 1968). Margalef (1983) ha reportado a M. cf. micrura en aguas poco mineralizadas, y esta es considerada como un organismo termófilo con una variación de la temperatura en aguas tropicales que va de los 22.0 °C hasta los 33.0 °C, además de que ha sido registrada en distintos lugares, desde una charca temporal, hasta ambientes como presas y lagos de mediano y gran tamaño de la República Mexicana (Elías-Gutiérrez 1995; Elías-Gutiérrez & Suárez-Morales 2003).
Los copépodos de agua continentales son un grupo con características ecológicas muy interesantes, y ello contrasta con el escaso conocimiento que aún se tiene sobre el grupo, principalmente en zonas tropicales. La especie M. albuquerquensis presenta una distribución muy amplia en México (Suárez-Morales, 2000), y en el presente estudio esta únicamente fue registrada en el lago JB. En muchos cuerpos de aguas tropicales, el género Thermocyclops representa el componente más importante de la biomasa del zooplancton (Margalef, 1983) y es considerado como factor de gran relevancia en el proceso de transmisión del nemátodo parásito Dracunculus medinensis al hombre (Suárez-Morales, 2000). Thermocyclops tenuis está ampliamente distribuido en México (Suárez-Morales & Reid, 1998), y en este estudio solo se registró en el lago PAS.
Aunque la densidad del zooplancton no presentó variaciones temporales significativas, se observó un aumento importante de la densidad a partir de la temporada de estiaje cálido para el lago JB; en cambio, en el lago PAS únicamente se observó un incremento en febrero durante el estiaje frío, debido posiblemente al restablecimiento de las condiciones bióticas y abióticas del lago, posterior a la limpieza y recambio de agua realizada por la administración del parque.
La riqueza específica obtenida en este estudio se considera baja (menos de 20 especies), similar a la reportada por Granados-Ramírez & Álvarez-del-Ángel (2003) y Gómez-Márquez et al. (2013b). Es posible que la baja diversidad en estos cuerpos de agua fuera causada por las actividades humanas y la falta de macrofitas, porque son el hábitat de algunas especies perifíticas o porque sirven de refugio contra la actividad depredadora, como ha sido reportada para otros cuerpos de agua por Gómez-Márquez et al. (2013a, 2013b) y Balderas (2016).
Por lo tanto, la estructura de la comunidad zooplactónica en este estudio, conformada por rotíferos, copépodos y cladóceros, es similar a la reportada en otros ambientes (Sampaio et al., 2002; Mustapha, 2009; Gómez-Márquez et al., 2013a, 2013 b; Yag et al., 2017; Jurczak et al., 2019), la cual no está completa porque el presente estudio solo abarca la época de secas e inicio de lluvias, faltando la época de lluvias completa, así como la época fría. Una de las ventajas de tener representada la mayoría de las especies de los grupos del zooplancton es porque la estructura de especies de este grupo, así como su biomasa y densidad, provee de información acerca de la importancia relativa de la cascada trófica y su impacto sobre la calidad del agua, como lo mencionan Almanza-Marroquín et al. (2016), Jurczak et al. (2019) y Razak & Sharip (2019). Esto se debe a que la estructura de la comunidad del zooplancton está principalmente determinada por las condiciones físicas y químicas y es modificada por las interacciones biológicas (Ejsmont-Karabin, 2012), así como por la comunidad de peces, la cual depreda al zooplancton. Además, dentro del zooplancton, los rotíferos fueron el grupo con más riqueza de especies, comparada con los copépodos y los cladóceros, por lo que estos han sido utilizados como bioindicadores de la calidad del agua (Ejsmont-Karabin, 2012; Sládecek, 1983; Sree & Shameem, 2017; Razak & Sharip, 2019).
Para poder tener una evaluación y propuestas adecuadas para el manejo y conservación de los lagos, es necesario realizar una caracterización más adecuada de la calidad del agua que incluya los parámetros físicos, químicos, nutrimentos y clorofila-a, con la finalidad de conocer el estado trófico de estos lagos; ya que la calidad del agua está siendo deteriorada por efectos antropogénicos, los cuales afectan la estructura de la comunidad, su composición y su abundancia, debido a su sensibilidad a los cambios ambientales, porque esta comunidad es importante para las redes alimenticias y para que además se pueda utilizar como bioindicadora de la calidad del agua, como se ha señalado anteriormente, considerando que los cambios a largo plazo deben ser monitoreados para una mejor caracterización de los sistemas acuáticos urbanos.
Por último, el manejo y la conservación de estos lagos urbanos deben ser definidos por las autoridades administrativas, con base en la información recopilada en los estudios que se realicen, debido a que su actual estado de eutrofización y posible contaminación podría ser un riesgo para la salud de los habitantes cercanos a estos lagos, quienes realizan actividades recreativas por su contacto directo con ellos o para el abastecimiento de agua, ante eventuales casos de emergencia durante la época de sequía.
Conclusiones
La dinámica de los factores físicos y químicos que se registraron en ambos lagos, determinaron la composición, abundancia y distribución espacial y temporal de la comunidad zooplanctónica, las cuales están fuertemente relacionadas con el estado trófico y el grado de interacciones biológicas que ocurren en estos ecosistemas, además del efecto causado por las actividades humanas.
Conflictos de interés
Los autores declaran que no tienen conflicto de intereses.











 nova página do texto(beta)
nova página do texto(beta)





