Introducción
Las infecciones originadas por Helicobacter pylori (H. pylori) son consideradas un problema de Salud Pública debido a su alto índice de morbilidad, ya que afectan a un 50% de la población mundial (Chey et al., 2017). Se considera que el estado socioeconómicamente bajo es el principal factor de riesgo de esta infección, lo cual implica una carencia de medidas de higiene en la población afectada (Bandy-Nacif et al., 1999). El agente causal es una bacteria gram-negativa, microaerofílica, móvil, con forma espiral y única especie del género Helicobacter que posee múltiples flagelos unipolares envainados que le confieren movilidad y movimientos rápidos, originando alteraciones gástricas y duodenales en el huésped (Graham, 2014; Kusters et al., 2006), las cuales con el tiempo pueden llegar a ser causantes de cáncer gástrico (Moreira & garrido, 2013).
La infección por H. pylori es típicamente adquirida en la infancia temprana y es transmitida de persona a persona por medio de aerosoles, vía oral-oral o vía oral-fecal. La mayoría de los individuos infectados son asintomáticos y solo 5%-15% desarrollan complicaciones. La bacteria coloniza la mucosa no secretora de ácido del estómago y la parte alta del tracto intestinal, incluyendo el duodeno. Sobrevive en condiciones ácidas del estómago por la generación de amonio proveniente de la urea, el cual neutraliza la acides gástrica alrededor de H. pylori (Satoh et al., 2012).
La infección crónica es principalmente conocida como factor de riesgo para ulceras gástricas o duodenales y cáncer, por lo que ha sido catalogada como carcinógeno clase I por la Agencia Internacional de Estudio de Cáncer (Romi et al, 2011).
La respuesta inmunológica innata ante la presencia de H. pylori es localizada y comienza desde la infiltración de neutrófilos, células dendríticas y macrófagos que reconocen a la bacteria por medio de los receptores tipo toll (TLR), para posteriormente dar paso a la presentación del antígeno a los linfocitos T (Mayer, 2000; Segal, 2005; Zhuang et al, 2011).
Varios estudios reportan en personas infectadas que la respuesta inmunológica contra H. pylori es prevalentemente de tipo celular (Th1), con una alta participación de linfocitos TCD4+ y con alta producción de interferón gama (IFN-ɣ) secretado por las células localizadas en el sitio de daño (Romi et al, 2011). También se ha señalado niveles elevados de factor de necrosis tumoral-α (TNF-α), IL-1, IL-6, IL-7, IL-8, IL-10 e IL-18 (Moyat & Velin, 2014), donde algunas citocinas actúan como quimioatrayentes locales e inducen la infiltración de granulocitos, como los neutrófilos (Mahdi, 2013).
Por otra parte, también se ha reportado la presencia de la respuesta Th17 in vitro en respuesta a la secreción de peptidil prolil cis-trans-isomerasa de H. pylori (Amedei et al., 2014). Al tratarse de epitelio de mucosa donde se lleva a cabo la infección, también se tiene la presencia de inmunoglobulinas como IgA, IgG e IgM, las cuales confieren protección al individuo contra la invasión bacteriana (Moyat & Velin, 2014).
Algunos estudios han descrito la función de las células Treg en gastritis originada por H. pylori, donde se les ha relacionado con inmunotolerancia, lo cual puede contribuir a la persistencia crónica de la bacteria y eventualmente al desarrollo de la patología gástrica (Romi et al., 2011; Sun et al., 2017). También existen otros mecanismos de evasión como la expresión de antígenos de Lewis en la superficie de H. pylori para poder camuflar a la bacteria entre los antígenos de la mucosa gástrica (Cava & Cobas, 2003).
El objetivo de este estudio fue detectar la seropositividad a Helicobacter pylori en una población rural del estado de Morelos, México. Para poder evaluar la proporción de poblaciones leucocitarias (monocitos, granulocitos y linfocitos), y subpoblaciones linfocitarias como células de memoria (CD3+CD45RO+, CD4+CD45RO+ y CD8+CD45RO+) y células efectoras (CD4+CD62L- y CD8+CD28-) en sangre periférica de adultos asintomáticos, con la finalidad de poder comprender mejor el comportamiento de la respuesta inmune ante este patógeno en una parte de la población mexicana, ya que en nuestro país no existen estudios similares al respecto.
Materiales y Métodos
Participantes y muestras de sangre
Se obtuvieron muestras de sangre periférica (5 ml) de 79 participantes adultos que no presentaban sintomatología, usuarios del centro de salud de Tlayacapan, Morelos, quienes fueron invitados para realizarse la detección de anticuerpos-anti-H. pylori por medio de la prueba de ELISA y evaluar si a nivel de sangre periférica había cambios en los leucocitos y subpoblaciones linfocitarias por la presencia de la seropositividad. Los criterios de exclusión para todos los participantes fueron que presentaran algún tipo de enfermedad crónica o proceso infeccioso y que hubieran consumido algún tipo de antibiótico o antiparasitario previo al estudio.
Determinación de la presencia de anticuerpos anti-H. pylori por medio de ELISA directa
Para la detección de anticuerpos anti-IgA-H-pylori en el plasma, se tomó 1 ml de las muestras de sangre de todos los participantes y se centrifugó a 1500 rpm durante 5 min para obtener el plasma. Posteriormente, para determinar las concentraciones de anticuerpos anti-IgA-H. pylori, se utilizó un kit comercial para la realización de la prueba de ELISA directa (enzyme-linked immuno-sorbent assay, IgA Chemistry, DRG Instuments GmbH, Germany).
Para diferenciar a los participantes seropositivos de los seronegativos, se graficaron las medias de los valores del control negativo y de los tres estándares. Con estos valores se realizó una curva estándar (absorbancia contra concentración), y los valores de absorbancia obtenidos de cada participante fueron interpolados en esta curva. Se realizó la regresión lineal de la curva. El punto de corte fue de 15 DU/ml. Una muestra se consideró positiva si tenía un valor por arriba de 20 DU/ml, dudoso si su valor osciló entre 15 DU/ml y 20 DU/ml, y negativo si el valor fue menor a 15 DU/ml.
Tinción de células de sangre periférica
La sangre (5 ml) fue colectada en tubos (Becton Dickinson Vacutainer Systems, Franklin Lakes, NJ) con anticoagulante EDTA y procesada el mismo día de su obtención. Los fluorocromos que se emplearon fueron: fluoresceína (FITC), ficoeritrina (PE), proteína piridina cloridina (PerCP) y afidil colina (APC). La combinación de anticuerpos conjugados utilizados fue: FITC-anti-CD45/PE-anti-CD14; FITC-anti-CD45RA/PE-anti-CD45RO/PerCP-anti-CD3/APC-anti-CD4; FITC-anti-CD45RA/PE-anti-CD45RO/PerCP-anti-CD3/APC-anti-CD8; FITC-anti-CD4/PE-anti-CD62/PerCP-anti-CD3 y FITC-anti-CD8/PE-anti-CD28/PerCP-anti-CD3 (Becton Dickinson, San José CA). Cada combinación de anticuerpos (20 µl) fue incubada con 100 µl de sangre completa por 20 min en obscuridad a temperatura ambiente. Posteriormente a la incubación, la solución de lisis fue añadida a cada tubo para la eliminación de eritrocitos, y las células fueron lavadas con PBS. Las células fueron fijadas usando paraformaldehido al 1% (Nájera-Medina et al., 2017).
Análisis por citometría de flujo
Los datos fueron obtenidos y analizados usando el software FACSDiva y el citómetro de flujo modelo FACSCanto II (Becton Dickinson Imumunocytometry Systems; San Jose, CA), calibrado con perlas CaliBRATE. En cada evento se analizaron 10 000 células. La región para el análisis de las proporciones de leucocitos y las diferentes subpoblaciones de linfocitos se realizó en base a forward-scatter, FL-3-scatter o FL-4-scatter para obtener la subpoblación deseada, y se realizaron gráficas de puntos de dos fluorescencias, como se muestra en la Figura 1 (Nájera-Medina et al., 2017).
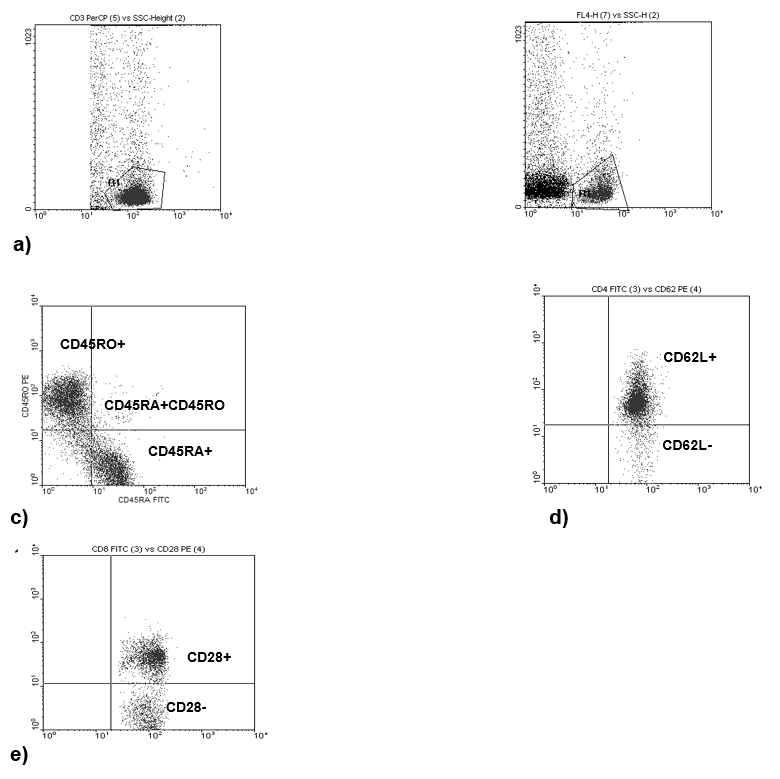
Fuente: Elaboración propia.
Figura 1 Gráficas y Regiones de puntos. a) y b) Regiones en FL-3-SSC y FL-4 para las subpoblaciones CD3+, CD4+ o CD8+; c) Dot Plot FL-1-FL-2 para definir células vírgenes y de memoria (CD45RA+ y CD45RO+); d) Dot Plot FL-1, FL-2 para definir células ayudadoras (CD4+CD62L-); e) Dot Plot FL-1-FL-2 para definir células citotóxicas (CD8+CD28-).
Análisis estadístico
Para el análisis de las subpoblaciones se determinaron por grupo de estudio la media o los porcentajes, así como el error estándar de cada población celular. Para hacer el análisis de varianza entre los grupos de estudio se utilizó el programa JMP y las diferencias estadísticas se definieron con la prueba t de student, la significancia estadística fue establecida cuando p ≤ 0.05.
Resultados
Se trabajó con 79 participantes con una media de 42 ± 13.7 años, de los cuales el 65.8% (n = 52) fueron del sexo femenino y el 34.2% (n = 27) masculino. El 57% fueron positivos a IgA-anti-H. pylori y el 43% negativos. El grupo seropositivo estuvo conformado por 45 individuos, de los cuales 25 fueron mujeres y 20 hombres; el grupo seronegativo estuvo conformado por 34 personas (27 mujeres y 7 hombres) (Tabla 1). Cabe mencionar que los resultados obtenidos de las muestras analizadas son de sangre periférica, por lo que la respuesta inmunológica a evaluar fue sistémica no local, además de que los individuos no presentaban ningún signo o sintomatología de la enfermedad, solo eran usuarios del centro de salud antes mencionado, desconociendo el tiempo de evolución de la enfermedad. Por otra parte, tampoco se les hizo la detección de la presencia de la bacteria, debido a los recursos con los que se contaban para el presente trabajo.
Tabla 1 Características de los grupos de estudio.
| Grupo | Sexo | Presencia de anticuerpos anti-H. pylori |
| Individuos (n = 34) | Femenino (n = 27) Masculino (n = 7) | Seronegativos |
| Individuos (n = 45) | Femenino (n = 25) Masculino (n = 20) | Seropositivos |
n = número de muestra.
Fuente: Elaboración propia.
Subpoblaciones linfocitarias
En el análisis de los distintos tipos de leucocitos por citometría de flujo no se encontraron diferencias estadísticamente significativas en individuos seropositivos a H. pylori en comparación con los individuos seronegativos, ni por sexo (no se muestran esos resultados). Sin embargo, en los granulocitos se observó una tendencia a disminuir su porcentaje en los individuos seropositivos respecto a los individuos seronegativos (74.3% ± 1.6% vs. 78.2% ± 1.8%, p < 0.09) (Tabla 2); no obstante, en ambos grupos se encontraban por arriba de la normalidad (51%-68%), de acuerdo con estudios previos en sujetos con normo peso.
Células efectoras
Con respecto a las células efectoras, se encontró que los individuos seropositivos mostraron una disminución en el total de las células ayudadoras (CD4+CD62L-) con relación a los individuos seronegativos sin ser estadísticamente significativa (51.5% ± 3.3% vs. 58.8% ± 4.0%, p < 0.18). En lo que respecta a las células citotóxicas (CD8+CD28-), tampoco se encontró ningún cambio estadísticamente significativo entre los dos grupos de estudio (68.5% ± 2.3% vs. 66.3% ± 2.7%, p < 0.54, respectivamente) (Tabla 3).
Tabla 3 Porcentajes de poblaciones de células ayudadoras (CD4+CD62L-) y citotóxicas (CD8+CD28-) en sangre periférica de individuos seronegativos y seropositivos.
| Tipo celular | Individuos seronegativos n = 33 |
Individuos seropositivos n = 42 |
| CD4+ | 70.1 ± 2.6 | 71.2 ± 2.3 |
| CD4+CD62L- | 58.8 ± 4 | 51.5 ± 3.5 |
| CD8+ | 21.1 ± 2.3 | 22.8 ± 2 |
| CD8+CD28- | 66.3 ± 2.7 | 68.3 ± 2.3 |
Nota. Datos expresados como media ± error estándar; n = número de participantes.
Fuente: Elaboración propia.
Células de memoria
El análisis de los linfocitos CD3+, CD4+ y CD8+ vírgenes (CD45RA+) y de memoria (CD45RO+) no presentaron diferencias estadísticas entre los dos grupos de estudio. Con relación a las células CD8+ dobles positivos (CD45RA+CD45RO+), se encontraron diferencias estadísticamente significativas, los individuos seropositivos las mostraban disminuidas con relación a los individuos seronegativos (15.5±4.8% vs. 31.5±6.6%, p ≤ 0.05) (Tabla 4).
Tabla 4 Porcentajes en sangre periférica de células vírgenes (CD45RA+) y de memoria (CD45RO+) en individuos seronegativos y seropositivos a H. pylori.
| Tipo celular | Individuos seronegativos n = 14 |
Individuos seropositivos n = 24 |
P |
| CD3+ | 12.0 ± 1.8 | 12.9 ± 1.4 | 0.68 |
| CD3+CD45RA+ | 25.0 ± 3.9 | 27.4 ± 2.5 | 0.56 |
| CD3+CD45RO+ | 49.3 ± 5.2 | 45.8 ± 3.9 | 0.60 |
| CD3+CD45RA+CD45RO+ | 21.5 ± 4.7 | 20.9± 3.4 | 0.93 |
| CD4+ | 5.3 ± 1.6 | 6.3 ± 1.1 | 0.61 |
| CD4+CD45RA+ | 11.8 ± 3.1 | 10.7 ± 2.3 | 0.76 |
| CD4+CD45RO+ | 63.1 ± 8 | 66.8 ± 5.8 | 0.70 |
| CD4+CD45RA+CD45RO+ | 26.5 ± 6.7 | 13.6 ± 4.5 | 0.09 |
| CD8+ | 5.0 ± 0.9 | 4.6 ± 0.7 | 0.79 |
| CD8+CD45RA+ | 10.4 ± 3.8 | 9.9 ± 2.7 | 0.90 |
| CD8+CD45RO+ | 60.7 ± 8.6 | 64.9 ± 6.2 | 0.69 |
| CD8+CD45RA+CD45RO+ | 31.5 ± 6.6 | 15.5 ± 4.8* | 0.05 |
Nota. Datos expresados como media ± error estándar; *Diferencia estadística entre los grupos de estudio; *Diferencia estadística
p ≤ 0.05; n = número de participantes.
Fuente: Elaboración propia
Discusión
Este estudio estuvo encaminado a evaluar los cambios que se presentan en las poblaciones de leucocitos y células funcionales, como son las células efectoras y de memoria, en individuos mexicanos con seropositividad a H. pylori. Hasta el momento, en población mexicana de una localidad específica, no habían existido estudios similares que evalúen dichos cambios en circulación periférica, con el objetivo de entender más los procesos inmunológicos desarrollados en individuos seropositivos, pudiendo así contribuir en estudios a futuro acerca de este tema.
En estos resultados se observó que el 57% de los participantes fueron seropositivos a H. pylori, sin manifestar ninguna sintomatología. En el análisis de las células de la inmunidad innata, no se encontraron diferencias estadísticamente significativas entre los seronegativos y seropositivos. Algunos autores han señalado que la infección de la mucosa gástrica se acompaña por una exacerbada infiltración de leucocitos en el sitio de daño (específicamente neutrófilos) (Stubljar, 2015). En el presente trabajo, la detección de las células inmunes se realizó en sangre periférica sin encontrar cambios en individuos seropositivos. Sin embargo, sí se detectaron tendencias a aumentar en los linfocitos totales, probablemente esto responde a que se ha observado que existe una proliferación de linfocitos T CD4+, principalmente, y linfocitos TCD8+ desde las 42 a 72 horas post infección hasta las 4 semanas. Por su parte, se observó que la tendencia de los granulocitos es disminuir con relación a los individuos seronegativos, quizá por la infiltración de polimorfonucleares que se lleva a cabo para contribuir con la liberación de gránulos en la eliminación del patógeno (Sánchez-Zauco et al., 2010).
Satoh et al. (2012) encontraron en una población de adultos infectados por Helicobacter pylori una disminución de linfocitos CD8+ y de la relación CD4+/CD8+ en comparación a individuos no infectados, así como un aumento de la polarización del porcentaje de las células Th2 (respuesta humoral), lo cual interpretaron como una posibilidad de desencadenar enfermedad autoinmune como gastritis.
En el presente estudio tampoco se encontraron cambios respecto a las células con funciones efectoras (CD4+CD62L- y CD8+CD28-) entre ambos grupos de estudio a nivel periférico. Pero se ha señalado que la disminución de células efectoras a nivel periférico se relaciona con la migración de estas células hacia los sitios de inflamación, para la producción de citocinas y orientar hacia un tipo de respuesta, ya sea celular (Th1) o humoral (Th2) (Nakagome et al., 2005). En las infecciones crónicas de H. pylori se ha observado que la respuesta inmune adaptativa predominante además de la respuesta Th1 es la respuesta Th17 (Ihan & Gubina, 2014; Ito et al., 2020). La respuesta Th1 se relaciona con la producción de niveles elevados de citocinas como factor de necrosis tumoral-α (TNF-α), IL-6, IL-7, IL-8, IL-10 e IL-18 (Moyat & Velin, 2014).
Hay que mencionar que el lipopolisacárido (LPS) de H. Pylori tiene un efecto antiinflamatorio que selectivamente regula a las interleucinas 12 y 18 inhibiendo a otras citocinas, favoreciendo la supresión de las células T, lo cual promueve el inicio y progreso del cáncer gástrico (Ito et al., 2020).
Por otra parte, también se ha reportado la infiltración en mucosas de células T γδ+, estas células son células TCD3+ poco convencionales que estimulan y modulan la infección, provocando inflamación local crónica productora de lesiones y cáncer, además de que H. pylori tiene la capacidad de inducir la respuesta T reguladora, propiciando un ambiente de inmunotolerancia, idóneo para el desarrollo de la infección. Un ejemplo de esto es la presencia de CCR2, las cuales modulan la respuesta del huésped a la de la bacteria (Romi et al., 2011; Sun et al., 2017). Asimismo, se ha visto el involucramiento de la respuesta Th2 en la producción de anticuerpos contra diferentes patógenos bacterianos del tipo IgG, sin embargo, estos no confieren ninguna protección para futuras infecciones (Larussa et al., 2015; Vinagre et al., 2018). Probablemente esta inmunotolerancia se relaciona con los pocos cambios encontrados en la presente investigación, en personas que, aunque fueron seropositivas, no presentan sintomatología.
Respecto a las células de memoria (CD45RO+) y vírgenes (CD45RA+), tampoco se encontraron diferencias estadísticamente significativas entre los grupos de estudio, lo cual coincide con un estudio realizado por Kayhan et al. (2008), donde tampoco se observan diferencias estadísticas en CD4+ ni CD8+ y sus subpoblaciones. Probablemente esto se debe a que la respuesta inmunológica para este patógeno es local y las células migran justamente al sitio de infección. Sin embargo, en personas con sobrepeso y obesidad, se han encontrado células de memoria aumentadas y se han relacionado con el proceso inflamatorio crónico de baja intensidad (Rodríguez et al., 2018). En la presente investigación solo se encontró una tendencia a aumentar tanto las células CD4+ como CD8+ de memoria (CD45RA+CD45RO+). Las células de memoria son relevantes tanto para la inmunidad innata como para la adaptativa, debido a que estas células tienen la facultad de fortalecer la respuesta inmunológica, al tener la capacidad de activar y reclutar las células de la inmunidad innata (macrófagos, células dendríticas y NK) y adaptativa (linfocitos T y B), que en conjunto potencializan la eliminación de agentes infecciosos como bacterias y virus (Booth et al., 2010; McKinstry et al., 2010).
Los linfocitos CD8+ dobles positivos (CD45RA+CD45RO+) se encontraron con cambios estadísticamente significativos (p ≤ 0.05) y las CD4+ con una tendencia a disminuir en los individuos H. pylori seropositivos, en comparación con los seronegativos. Las células dobles positivas son células que se encuentran en proceso de diferenciación para la formación de células de memoria, pero en este caso las encontramos disminuidas en nuestros participantes, lo cual se podría relacionar con la evasión de la bacteria a la respuesta inmunológica, para no desarrollar una memoria inmunológica a largo plazo.
Es conocido que H. pylori desarrolla una serie de mecanismos para evadir la respuesta inmunológica tanto innata como adaptativa y permitir la tolerancia en el huésped (Cava & Cobas, 2003; Larussa et al., 2015). Se ha observado que H. Pylori puede evadir el reconocimiento de los receptores tipo Toll, pertenecientes a la inmunidad innata, como los lipopolisacáridos que no son reconocidos por los receptores Toll tipo 4 de macrófagos y célula epiteliales, debido que se remueve un grupo fosfato de la posición 1´ y 4´ del lípido A del lipopolisacárido de la bacteria, pudiendo así escapar de la respuesta inmunológica. También se ha descrito la evasión al reconocimiento de los receptores tipo Toll 5 y Toll 9, además de otra clase de receptores como los RLR (receptores tipo RIG) , NLR (receptores tipo NOD) y CLR, (receptores de lectina tipo C) entre otros mecanismos que incluyen a la inmunidad adaptativa (Karkhah et al., 2019). Probablemente, es como se podría interpretar el haber encontrado pocas diferencias significativas en las poblaciones leucocitarias y algunas subpoblaciones linfocitarias, entre individuos seropositivos y seronegativos.
Conclusiones
En el presente trabajo se buscaron cambios en poblaciones de leucocitos y subpoblaciones linfocitarias a nivel periférico entre individuos seropositivos y seronegativos a H. pylori, debido a que en México no existen estudios similares, ni con poblaciones tan específicas, pudiendo de esta manera contribuir a la investigación básica en este tema. Sin embargo, no se encontraron diferencias significativas en células efectoras y de memoria, solo en dobles positivas de linfocitos T CD8+ (CD45RA+CD45RO+). Esto se podría relacionar a la inmunotolerancia que pueden desarrollar las personas ante H. pylori. Asimismo, los individuos asintomáticos seropositivos a H. pylori probablemente desarrollen una respuesta inmunológica local más que sistémica, por lo que se considera importante realizar más estudios al respecto para poder comprender mejor la respuesta inmunológica que puede desarrollar esta bacteria en sus diferentes estados, que en casos graves puede ser causante de cáncer.
Conflictos de interés
No existe conflicto de intereses entre los autores del manuscrito.





![Agro-morphological characterization of 20 cowpea cultivars (Vigna unguiculata [L.] Walp.) in Yucatan, Mexico](/img/en/next.gif)





 text new page (beta)
text new page (beta)



