Introducción
Los ácaros depredadores de la familia Phytoseiidae son enemigos naturales comunes de ácaros fitófagos y de insectos de las familias Aleyrodidae y Thripidae (Mcmurtry et al., 2013), y por ello tienen enorme potencial como agentes de control biológico de plagas en varios cultivos agrícolas de invernadero y campo. Los géneros más utilizados incluyen a Neoseiulus y Amblyseius, seguidos de varias especies de Galendromus, Phytoseiulus, Typhlodromus, Typhlodromalus y Euseius (Reddy, 2016).
En los últimos años aumentó el uso de acaricidas organosintéticos para el manejo de ácaros fitófagos. Estos productos de nueva generación no actúan en el sistema nervioso, como los acaricidas convencionales, por lo que se consideran seguros para organismos benéficos (Van Leeuwen et al., 2014). Entre estos productos se encuentran los acaricidas que actúan sobre la síntesis de lípidos, a través de la inhibición de la Acetil CoA-Carboxilasa (ACCI), como spirodiclofen, spiromesifen y spirotetramat, que se derivan de los ácidos tetrónicos y tetrámicos (Marcic, 2012). Tres grupos de acaricidas que actúan a nivel de respiración mitocondrial, conocidos como acaricidas METI (Mitocondrial Electron Transport Inhibitors), inhiben el transporte de electrones en la mitocondria. El primero lo hace en el complejo I (METI I), e incluye a fenazaquin, fenpiroximato, flufenerim, piridabeno, pyrimidifen, tebufenpirad y tolfenpyrad; el segundo grupo actúa sobre el complejo II (METI II), e incluye cyenopyrafen y cyflumetofen; y el tercer grupo actúa en el complejo III (METI III), e incluye acequinocyl, bifenazate y flucrypyrim (Marcic, 2012).
Aunque algunos autores consideran que los acaricidas ACCI y METI son de menor impacto ambiental (Van Leeuwen et al., 2014), otros indican que estos acaricidas pueden tener efectos letales y subletales en ácaros depredadores (Maroufpoor et al., 2016; Sarbaz et al., 2017). Los efectos letales de estos acaricidas se han descrito en detalle (Cloyd, 2012; Marcic, 2012). Incluso, en condiciones de campo se han observado efectos negativos prolongados sobre la supervivencia de ácaros depredadores (Marcic, 2012).
Por otro lado, el efecto de dosis subletales de acaricidas químicos ha sido poco estudiado con resultados diversos. Los efectos subletales más abordados son la longevidad, fecundidad, periodos de oviposición y reproducción (Hamedi et al., 2010). Maroufpoor et al. (2016) y Sarbaz et al. (2017) encontraron que los acaricidas ACCI spiromesifen y spirodiclofen disminuyen la fecundidad y periodos de oviposición en N. californicus. En contraste, Sato et al. (2011) y Alinejad et al. (2016) encontraron que estos productos no tienen efectos en N. californicus.
Debido a la necesidad de una visión amplia sobre los efectos letales y subletales de los acaricidas organosisntéticos de nueva generación sobre ácaros depredadores, se realizó el presente estudio en dos etapas: 1) evaluación en laboratorio de los efectos tóxicos letales de acaricidas en los ácaros depredadores A. swirskii y N. californicus, y 2) integración de un metaanálisis de estudios publicados sobre efectos subletales de acaricidas ACCI y METI en la supervivencia, fecundidad y periodo de oviposición en ácaros depredadores de la familia Phytoseiidae.
Materiales y Métodos
Ácaros depredadores y acaricidas para pruebas de laboratorio
Los ácaros depredadores A. swirskii y N. californicus se compraron en la empresa Koppert Biological Systems (Querétaro, México). Para los bioensayos se usaron adultos sin sexar.
Las formulaciones comerciales de los acaricidas se adquirieron de distribuidoras regionales de agroquímicos. Para los experimentos de dosis-respuesta, se usaron cuatro concentraciones de cada acaricida. El testigo consistió en la aplicación de agua destilada. Los detalles de los acaricidas químicos se presentan en la Tabla 1.
Tabla 1 Acaricidas e intervalos de concentración utilizados en los bioensayos.
| Ingrediente Activo (I.A.) | Nombre comercial | Concentraciones de I.A. utilizadas (mg L-1) |
Empresa |
| Spirodiclofen | Envidor® 240 SC | 288, 144, 14.4 y 1.4 | Bayer de México S. A. de C. V. |
| Spiromesifen | Oberon® 240 SC | 1920, 960, 96 y 0.96 | Bayer de México S. A. de C. V. |
| Bifenazate | Acramite® 50 WS | 2000, 1000, 100 y 10 | Arysta Lifescience México, S. A. de C. V. |
| Fenpiroximato | Sumatrus® 5% SC | 254, 127, 12.7 y 1.27 | Agroquímicos Versa, S. A. de C. V. |
| Acequinocyl | Kanamite® 15 SC | 310, 155, 15 y 0.15 | Arysta Lifescience México, S. A. de C. V. |
SC: suspensión concentrada; WS: polvo humectable.
Fuente: Elaboración propia.
Bioensayo de mortalidad en laboratorio y análisis de datos
La toxicidad de los acaricidas en los ácaros depredadores (A. swirskii y N. californicus) se evaluó según lo descrito por Abraham et al. (2013). Las mezclas de 5 ml de cada concentración, descritas en la Tabla 1, se vertieron en viales de cristal de 20 ml, se agitaron para una cobertura uniforme sobre las paredes de los viales y se desechó el exceso. Los viales se secaron 3 h a temperatura ambiente; posteriormente, se colocaron 10 ácaros adultos en un vial con tapa; cada vial fue considerado una de cuatro repeticiones por concentración. La mortalidad de los ácaros se midió a las 24 h de exposición.
Los resultados de mortalidad se corrigieron con la fórmula de Abbott (1925). La determinación de los valores CL50 y CL90, y sus límites de confianza al 95%, se realizaron con el método de Log-Probit en el paquete estadístico SAS versión 9.11. En la toxicidad de cada acaricida se consideró diferencia significativa si los límites de confianza al 95% no se traslaparon.
Recopilación de datos para el metaanálisis
Se realizó la búsqueda de artículos científicos en Google Scholar y en las bases de datos Science Direct, Springer Journal, Taylor & Francis y Wiley Online Library; para lo cual, se utilizaron combinaciones de las siguientes palabras clave: Phytoseiidae, Amblyseius, Galendromus, Neoseiulus, Phytoseiulus, phytoseius, efectos letales y subletales, spiromesifen, spirodiclofen, spirotetramat, fenpiroximato, fenazaquin, pyridaben, bifenazate y acequinocyl. Los términos para la búsqueda se usaron en español y en inglés. Los datos se incluyeron si los estudios cumplían con tres criterios: 1) los estudios se realizaron después del año 2000 hasta 2018; 2) los estudios evaluaron la toxicidad de los acaricidas en ácaros depredadores de la familia Phytoseiidae en condiciones de laboratorio; 3) los estudios se basaron en datos informados sobre la supervivencia de adultos, la fecundidad y periodo de oviposición de los ácaros depredadores.
Los datos de un mismo estudio que informaron sobre varios acaricidas, varias especies de ácaros depredadores, diferentes tipos de aplicación, dosis subletales de 10, 20 y 30 se consideraron casos diferentes e independientes. Las variables de análisis fueron supervivencia de adultos, fecundidad y periodo de oviposición.
Cálculo de tamaños de efectos y metaanálisis de datos publicados
Los efectos de los acaricidas sobre la supervivencia, fecundidad y periodo de oviposición de ácaros depredadores se evaluaron utilizando una relación del efecto de los tratados con cada acaricida, en comparación con la del grupo testigo, no expuestos a los acaricidas. Valores negativos en la relación de respuesta indicaron un efecto negativo o una reducción en la supervivencia de adultos, la fecundidad o el periodo de oviposición. Para calcular el tamaño del efecto para cada variable, se obtuvo la media, la desviación estándar y el tamaño de muestra para el grupo testigo y el grupo experimental. Cuando se presentaban valores de error estándar, estos se transformaron en desviación estándar con la ecuación: SD = SE √ n, donde SD es la desviación estándar, SE es el error estándar y n es el tamaño de la muestra.
Se realizó otro análisis del efecto de acaricidas, de acuerdo con el modo de acción y los géneros de Phytoseiidae, con base en la supervivencia, fecundidad y periodo de oviposición. El tamaño del efecto se calculó mediante Hedges: d = [(XO-XY) / s] J, donde XO = respuesta media al grupo de control, XY = respuesta media al grupo experimental, s = SD combinada y J = factor de corrección del sesgo debido al pequeño tamaño de muestreo (Gurevitch & Hedges, 2001). Se utilizó el programa estadístico Meta Win 2.1 para modelos de efectos fijos (Rosenberg et al., 2002). Los intervalos de confianza se generaron a un nivel de confianza del 95% (bootstrap con corrección de sesgo) para todos los tamaños de efectos, desde 999 interacciones. Los efectos se consideran significativos cuando el 95% de los intervalos de confianza no se superponen con 0. Para evaluar si los grupos categóricos (supervivencia de adultos, fecundidad y periodo de oviposición) fueron homogéneos con respecto al tamaño del efecto, se calculó la heterogeneidad dentro de cada grupo (QW) y entre los grupos (QB) y se evaluó con X2.
El riesgo de sesgo en el conjunto de datos se evaluó mediante el número de seguridad (nfs), con el método de Rosenberg (Rosenberg, 2005). Los nfs indican el número de estudios no significativos, no publicados o faltantes que deberían agregarse al metaanálisis para cambiar los resultados de significativos a no significativos. Los resultados se consideran robustos cuando la nfs es mayor que 5n + 10, donde n es el número de estudios (Rosenberg, 2005).
Resultados y Discusión
Efectos letales de acaricidas en pruebas de laboratorio
El efecto tóxico de los acaricidas, evaluado a través de los valores de CL50 y CL90, siguió un patrón similar en ambas especies de ácaros depredadores, A. swirskii y N. californicus. El acaricida más tóxico (valores más bajos de CL50 y CL90) fue spirodiclofen, le siguieron fenpiroximato y acequinocyl. Los acaricidas menos tóxicos fueron bifenazate y spiromesifen (Tabla 2 y 3).
Tabla 2 Concentraciones letales estimadas (CL50 y CL90) de seis acaricidas sobre A. swirskii.
| Acaricidas | CL50 (mg L-1) (95% CI) | CL90 (mg L-1) (95% CI) | Ecuación de regresión | p > X2 |
| Spirodiclofen | 3.87 (3.18-4.64) | 53.50 (43.16-68.35) | Y = 1.1240 X-0.6616 | < 0.0001 |
| Fenpiroximato | 41.49 (36.32-47.49) | 365.7 (299.7-458.8) | Y = 1.3558 X-2.1937 | < 0.0001 |
| Acequinocyl | 44.28 (38.10-50.94) | 373.7 (306.0-472.7) | Y = 1.3836 X-2.2778 | < 0.0001 |
| Bifenazate | 188.6 (163.9-216.1) | 1779 (1468-2208) | Y = 1.3149 X-2.9921 | < 0.0001 |
| Spiromesifen | 558.2 (505.3-614.3) | 2107 (1858-2431) | Y = 2.2213 X-6.1016 | < 0.0001 |
Fuente: Elaboración propia.
Tabla 3 Concentraciones letales estimadas (CL50 y CL90) de seis acaricidas sobre N. californicus.
| Acaricidas | CL50 (mg L-1) (95% CI) | CL90 (mg L-1) (95% CI) | Ecuación de regresión | p > X2 |
| Spirodiclofen | 6.85 (5.56-8.36) | 133.04 (104.6-173.5) | Y = 0.9950 X-0.8318 | < 0.0001 |
| Fenpiroximato | 10.25 (8.34-12.48) | 80.5 (42.7-233.7) | Y = 1.0289 X-1.0402 | < 0.0001 |
| Acequinocyl | 29.76 (25.19-35.14) | 614.7 (561.4-857.1) | Y = 0.9746 X-1.4364 | < 0.0001 |
| Bifenazate | 67.22 (53.47-83.58) | 2672 (1975-3765) | Y = 0.8013 X-1.4644 | < 0.0001 |
| Spiromesifen | 141.8 (120.5-166.0) | 2268 (1788-2976) | Y = 1.0644 X-2.2903 | < 0.0001 |
Fuente: Elaboración propia.
Los acaricidas spirodiclofen, fenpiroximato y acequinocyl, considerados en el presente estudio como los más tóxicos, se han reportado con alta toxicidad en varias especies de ácaros depredadores (Ghasemzadeh & Quereshi, 2018; Puchalska & Piotrowska, 2016) y ácaros fitófagos de importancia económica, como Tetranychus kanzawai, Tetranychus merganser y Tetranychus urticae (Askari et al., 2013; Kumari et al., 2017; Ullah et al., 2011; Ullah & Gotoh, 2013). Estos productos se usan de forma rutinaria en campo, y se han encontrado poblaciones de ácaros fitófagos resistentes en diversas regiones agrícolas (Van Leeuwen et al., 2010).
Al tomar como referencia los valores de CL90 calculados en el presente estudio y las dosis recomendadas por los fabricantes (PLM México, 2019) para el control de ácaros fitófagos en campo (spirodiclofen, 180 mg L-1-340 mg L-1; acequinocyl, 150 mg L-1-300 mg L-1; fenpiroximato, 37.5 mg L-1-75 mg L-1; spiromesifen, 125 mg L-1-250 mg L-1; y bifenazate, 250 mg L-1-500 mg L-1), el acaricida spirodiclofen sería más tóxico a los ácaros depredadores A. swirskii y N. californicus que a los ácaros fitófagos; asimismo, el fenpiroximato, bifenazate y spiromesifen también serían más tóxicos a los ácaros depredadores pero en menor magnitud. En contraste, acequinocyl tendría toxicidad similar en ácaros depredadores y ácaros fitófagos.
Efectos subletales de acaricidas a través de metaanálisis
De los 64 artículos encontrados, solo 14 cumplieron con los criterios de selección para realizar los análisis. Incluso un mismo artículo proporcionó diferentes estudios (supervivencia de adultos, fecundidad y oviposición) con resultados específicos. De esta forma, se sintetizaron 14 estudios de supervivencia en adultos, 32 estudios de fecundidad y 19 estudios de periodo de oviposición.
En general, los acaricidas mostraron efectos negativos significativos sobre las variables supervivencia, fecundidad y oviposición en los ácaros depredadores de la familia Phytoseiidae (Figura 1). Para la supervivencia en adultos, el tamaño de efecto de la exposición a los acaricidas resultó de -0.6065 (sesgo% CI = -1.0635 a -0.3704), un efecto negativo significativo en comparación con el testigo. Para la fecundidad y oviposición, la exposición a los acaricidas produjo tamaños de efecto de -1.5507 (sesgo, CI = -2.1494 a -1.0683) y -1.4607 (sesgo CI = -2.4020 a -0.7223), respectivamente; esto representa un efecto negativo significativo en relación con los testigos (Figura 1; Tabla 4).

n: Tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
El tamaño medio del efecto E++ = -1.2605 y el IC del sesgo del 95% = -1.6085 a -0.9612.
Figura 1 Tamaño del efecto (media e intervalo de confianza [IC] 95%) de los acaricidas estudiados por metaanálisis en la supervivencia de adultos, fecundidad y oviposición. El número de muestras se muestra para cada análisis. Las medias con intervalos de confianza que no se superponen con cero se consideraron significativas.
Tabla 4 Estadísticas de heterogeneidad para cada modelo en el análisis de frecuencia de supervivencia de adultos, fecundidad y oviposición.
| Supervivencia | Fecundidad | Oviposición | |||||||
| df | QB | P | df | QB | P | df | QB | P | |
| Modelo completo | 13 | 257.446 | < 0.0000 | 31 | 838.632 | < 0.0000 | 18 | 871.660 | < 0.0000 |
| Modos de acción | 2 | 162.676 | < 0.0000 | 2 | 229.521 | < 0.0000 | 2 | 62.994 | < 0.0000 |
| Géneros de Ácaros | 3 | 155.623 | < 0.0000 | 3 | 192.992 | < 0.0000 | 2 | 201.118 | < 0.0000 |
df: grados de libertad; QB: variación en el tamaño del efecto explicado por el modelo.
Fuente: Elaboración propia.
El análisis de supervivencia se integró en dos secciones, los efectos por grupos de acaricidas de acuerdo con el modo de acción y el efecto de los acaricidas sobre los géneros de Phytoseiidae. Los tres grupos de acaricidas analizados tienen efectos negativos significativos. El grupo METI I fue el que presentó mayor efecto sobre la supervivencia (Figura 2).

tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -0.6065 y el IC del sesgo del 95% = -1.0526 a -0.3692.
Figura 2 Tamaño del efecto (media e intervalo de confianza [IC] del 95%), de los acaricidas en la supervivencia de adultos para la categoría considerada para el grupo acaricida, según su modo de acción. Los tamaños del efecto fueron significativos si los IC del 95% no se superponen con cero. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
En el análisis de los efectos por géneros de Phytoseiidae se observó que los acaricidas tuvieron efectos negativos significativos en todos los géneros; en particular, Neoseiulus presentó el mayor tamaño del efecto (Figura 3).

n: tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -0.6065 y el IC del sesgo del 95% = -0.9971 a -0.3728.
Figura 3 Tamaño del efecto (media e intervalo de confianza [IC] del 95%) de los acaricidas en la supervivencia de ácaros adultos para la categoría considerada para el grupo apropiado (géneros de depredadores). Los tamaños del efecto se consideraron significativos si los IC del 95% no se superponen con cero. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
El análisis de la variable fecundidad se integró en dos secciones, la de los efectos por grupos de acaricidas de acuerdo con el modo de acción y el efecto de los acaricidas en los géneros de Phytoseiidae. Los tres grupos de acaricidas analizados tuvieron efectos negativos significativos, y el grupo METI I presentó mayor efecto sobre la variable fecundidad (Figura 4).

n: tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -1.5507 y el IC del sesgo del 95% = -2.1341 a -1.1079.
Figura 4 Tamaño del efecto (media e intervalo de confianza [IC] del 95%) de los acaricidas en la fecundidad para la categoría considerada para el grupo apropiado de acaricida, según su modo de acción. Los tamaños del efecto se consideraron significativos si los IC del 95% no se superponen con cero. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
El análisis de los efectos por géneros de Phytoseiidae mostró disminución significativa en la fecundidad y fue ligeramente mayor en el género Phytoseius (Figura 5).

n: tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -1.5507 y el IC del sesgo del 95% = -2.1821 a -1.0863.
Figura 5 Tamaño del efecto (media e intervalo de confianza [IC] del 95%) de los acaricidas en la fecundidad para la categoría considerada para el grupo apropiado (géneros de ácaros depredadores). Los tamaños del efecto se consideraron significativos si los IC del 95% no se superponen con cero. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
El análisis del periodo de oviposición se integró en dos secciones, los efectos por grupos de acaricidas de acuerdo con el modo de acción y el efecto de los acaricidas en los géneros de Phytoseiidae. De los tres grupos de acaricidas analizados, METI I y METI III tuvieron efectos negativos significativos (Figura 6).

n: tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -1.4607 y el IC del sesgo del 95% = -2.3706 a -0.8062.
Figura 6 Tamaño del efecto (media e intervalo de confianza [IC] del 95%) de los acaricidas en la oviposición para la categoría considerada para el grupo apropiado (modos de acción). Los tamaños del efecto se consideraron significativos si los IC del 95% no se superponen con 0. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
El análisis de los efectos por géneros de Phytoseiidae mostró que todos los incluidos en la evaluación recibieron efectos negativos significativos; en particular, Phytoseius mostró tamaño mayor del efecto sobre la variable oviposición (Figura 7).
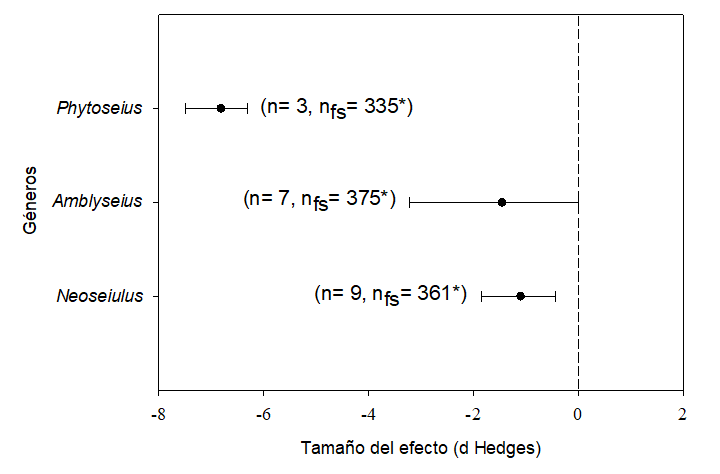
n: tamaño de la muestra; nfs: número de seguridad; *: indica la robustez estadística de nfs.
Se muestra el tamaño del efecto medio E++ = -1.4607 y el IC del sesgo del 95% = -2.5192 a -0.7989.
Figura 7 Tamaño del efecto (media e intervalo de confianza [IC] del 95%) de los acaricidas en la oviposición para la categoría considerada para el grupo apropiado (géneros). Los tamaños del efecto se consideraron significativos si los IC del 95% no se superponen con 0. Los tamaños del efecto dentro de los análisis se consideraron diferentes entre sí, si su IC del 95% no se superponía.
El metaanálisis de estudios publicados sobre los efectos de acaricidas en ácaros depredadores de la familia Phytoseiidae generó información relevante. En algunos casos, los estudios publicados en este tema muestran resultados contrapuestos, donde ciertos acaricidas en unos estudios no muestran efectos y en otros estudios se observan efectos negativos. En estudios separados, Hamedi et al. (2010) y Sarbaz et al. (2017) encontraron efectos negativos significativos en la supervivencia de adultos, fecundidad y periodo de oviposición en los ácaros de los géneros Phytoseiulus, Amblyseius, Phytoseius y Neoseiulus por efecto del spiromesifen, spirodiclofen, bifenazate, acequinocyl y fenpiroximato. Por el contrario, Alinejad et al. (2016), Bergeron & Schmidt-Jeffris (2020) y Lima et al. (2016) mencionaron que estos mismos acaricidas no tuvieron efectos negativos en la supervivencia de adultos, fecundidad y periodo de oviposición en los ácaros depredadores pertenecientes a los géneros Galendromus, Amblyseius y Neoseiulus.
En general, en el metaanálisis se observaron efectos negativos significativos de los acaricidas en las variables supervivencia de adultos, fecundidad y periodo de oviposición. La supervivencia es un indicador que suele asociarse al efecto directo de los plaguicidas en un periodo de tiempo corto (24 h a 96 h) (Cloyd, 2012). Según Lima et al. (2013, 2016), Park et al. (2011) y Maroufpoor et al. (2016), los acaricidas de los grupos incluidos en el presente metaanálisis disminuyen la supervivencia en ácaros depredadores, principalmente en la aplicación por contacto.
La fecundidad es un parámetro del crecimiento poblacional de ácaros que se relaciona con el número de huevos puestos por hembras (Lima et al., 2016). Se ha observado que la fecundidad disminuye de modo sustancial a medida que aumenta la exposición a concentraciones de los acaricidas ACCI, METI I y METI III (Park et al., 2011). Según López et al. (2015) y Sato et al. (2011), las hembras de ácaros depredadores tratadas con acaricidas de nueva generación ovipositan menor número de huevos. El efecto negativo en la fecundidad se relaciona con una disminución en el contenido de lípidos en hembras tratadas, lo cual sugiere que estos compuestos interfieren en la inhibición de síntesis de lípidos necesarios para ovipositar (Van Leeuwen et al., 2014).
El metaanálisis también mostró que el periodo de oviposición disminuye significativamente por efecto de los acaricidas ACCI, METI I y ETI III. El periodo de oviposición es otra variable para medir el crecimiento de la población de ácaros, esta variable indica los días a los cuales ovipositan las hembras. Alinejad et al. (2014) y Ghadim et al. (2017) observaron que la oviposición disminuye por el efecto de los acaricidas. Hamedi et al. (2010), Maroufpoor et al. (2016) y Sarbaz et al. (2017) encontraron que las hembras tratadas con acaricidas ACCI disminuyeron los días a la oviposición, por una disminución en el contenido de lípidos en hembras tratadas, lo cual sugiere que los lípidos interfieren en la biosíntesis de los huevos (Van Leeuwen et al., 2014). Lo anterior tendría implicaciones importantes en el ciclo biológico de los ácaros depredadores.
Los efectos negativos de los acaricidas sobre los ácaros depredadores encontrados en el metaanálisis deben tomarse con reserva, ya que los datos utilizados se basan en trabajos realizados en condiciones de laboratorio y se sabe que las evaluaciones de los acaricidas en condiciones controladas pueden sobreestimar los efectos reales en campo. No obstante, los resultados del metaanálisis son contundentes y sugieren que el uso de acaricidas de nueva generación debe tomarse con precaución, debido a los efectos en organismos no objetivo.
Conclusiones
El acaricida spirodiclofen fue altamente tóxico por contacto a los ácaros depredadores A. swirskii y N. californicus bajo condiciones de laboratorio. Al considerar las dosis comerciales de campo, spirodiclofen tendría mayor toxicidad a los ácaros depredadores que a los ácaros fitófagos.
De acuerdo al metaanálisis, los acaricidas inhibidores de la Acetil-CoA-Carboxilasa (ACCI) e inhibidores del transporte de electrones mitocondrial en los complejos METI I y METI III tienen efectos negativos significativos en los géneros Phytoseiulus, Amblyseius, Galendromus y Neoseiulus. Con tales efectos, estos acaricidas podrían reducir la densidad poblacional de los ácaros depredadores en campo.
Conflictos de intereses
Los autores declaran no tener conflictos de interés.











 nova página do texto(beta)
nova página do texto(beta)


